БИОФИЗИКА, 2019, том 64, № 5, с. 841-853
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.323.432: 577.322.9
СТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА Z-ФОРМЫ ДНК
© 2019 г. Т.М. Заварыкина, М.В. Аткарская, Г.П. Жижина
Институт биохимической физики им. Н.М. Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
E-mail: tpalievskaya@yandex.ru
Поступила в редакцию 06.12.2018 г.
После доработки 11.06.2019 г.
Принята к публикации 08.07.2019 г.
Рассмотрены этапы изучения левоспиральной Z-формы ДНК от ее открытия в 1979 году до настоя-
щего времени. Указаны повторяющиеся последовательности нуклеотидов, способные к В-Z-пере-
ходу, и факторы, инициирующие этот переход и стабилизирующие Z-ДНК, в том числе негистоно-
вые белки, взаимодействующие с Z-сайтами. Важнейшим результатом этих исследований является
доказательство наличия этой формы в ДНК эукариот и ее роли в регуляции транскрипции генов.
Приведены свидетельства участия Z-ДНК в индукции ряда патологий человека.
Ключевые слова: Z-форма ДНК, не-В-формы ДНК, Z-ДНК-связывающие белки, регуляция
транскрипции, нестабильность генома, метилирование ДНК.
DOI: 10.1134/S0006302919050028
Изучение полиморфизма спирали ДНК явля-
химические и структурные свойства, которые
ется актуальной темой современной биофизики и
обеспечивают ДНК-белковые взаимодействия,
молекулярной биологии. Обнаружены многочис-
лежащие в основе различных процессов регу-
ленные не-В-формы спирали ДНК, которые часто
ляции.
наблюдаются в функционально важных областях
Z-ДНК - левоспиральная форма ДНК - была
различных геномов, что указывает на биологиче-
открыта в 1979 году при изучении структуры мо-
скую значимость этих структур. К основным нека-
нокристалла фрагмента ДНК [8], и за прошедшие
ноническим (не-В-) формам ДНК относятся кру-
четыре десятилетия знания о свойствах и функ-
сиформы, шпильки, триплексы (Н-ДНК), квад-
циях этой формы ДНК значительно прогрессиро-
руплексы (G-ДНК) и левоспиральная Z-ДНК
вали. История открытий вкратце дана в таблице,
(рис. 1) [1,2]. Не-В-формы ДНК образуются в спе-
составленной на основе обзора А. Rich, ученого,
цифических, как правило, повторяющихся после-
внесшего наибольший вклад в развитие этой на-
довательностях оснований. Эти повторы распре-
учной проблемы [9], и дополненная более позд-
делены по геному неслучайно, часто совпадая с
ними данными.
сайтами хромосомных поломок, присущих гене-
тическим заболеваниям [3,4]. В настоящее время
получены данные о том, что они вызывают мута-
СТРУКТУРА Z-ДНК
ции типа делеций, вставок и транслокаций в клет-
Левоспиральную Z-форму ДНК образуют в
ках прокариот и эукариот, которые могут быть
основном последовательности чередующихся пу-
связаны у последних с канцерогенезом [5,6]. Гене-
риновых и пиримидиновых нуклеотидов [10].
тический анализ связи таких повторов, принима-
Z-ДНК - двойная левая спираль, имеющая суще-
ющих не-В-формы спирали, и нестабильности ге-
ственные структурные отличия от правоспираль-
нома позволяет предположить, что они вызывают
ного В-дуплекса. Z-ДНК имеет виток высотой
изменения, сопровождающиеся быстрой эволю-
44,6 Å, на который приходится 12 уотсон-криков-
цией в некоторых классах генов, особенно имею-
ских пар нуклеотидов, причем конформации dG
щих регуляторные функции [4,7]. Кроме того, не-
и dC существенно различаются. Нуклеотид dC
В-формы ДНК играют важную роль в индукции
имеет стандартную конформацию, т.е. С2-эндо-
нестабильности генома, которая, в свою очередь,
является одним из факторов злокачественной
конформацию сахара и анти-конформацию ци-
трансформации клеток [1]. Это связано с тем, что
тозина, а dG - С3-эндо-конформацию сахара и
для функционирования регуляторных областей
син-конформацию гуанина. Вследствие этого
ДНК решающее значение имеет не только нуклео-
фосфодиэфирный остов спирали Z-ДНК имеет
тидная последовательность, но также их физико-
зигзагообразную форму (рис. 2) [11,12]. Канони-
841
842
ЗАВАРЫКИНА и др.
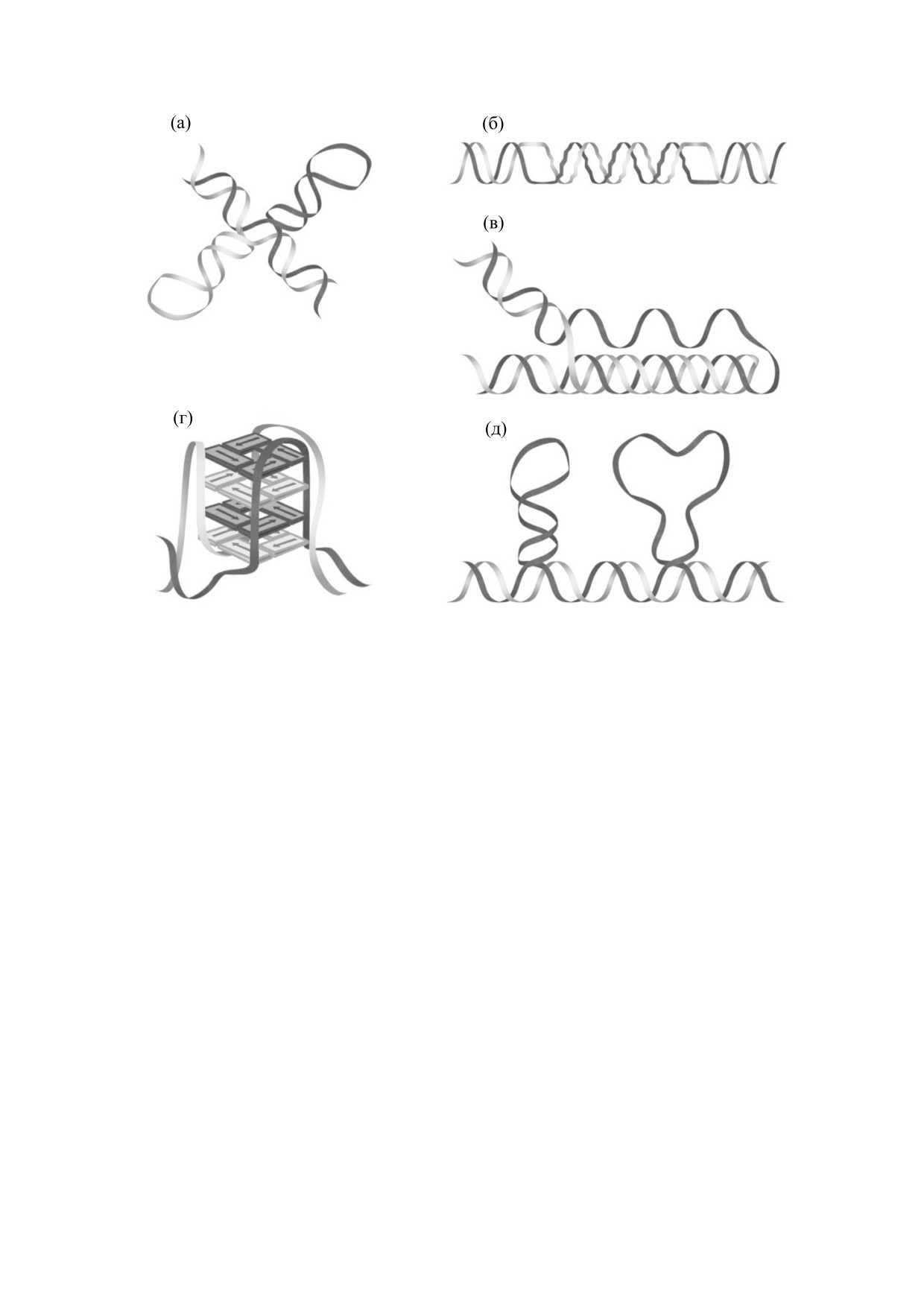
Рис. 1. Неканонические формы спирали ДНК: (а) - крусиформа, (б) - Z-ДНК, (в) - Н-ДНК (тройная спираль), (г) -
G-ДНК (квадруплекс), (д) - шпильки и петли ДНК [2].
ческая правая В-спираль имеет виток высотой
ровании Z-ДНК. Предполагается, что эта форма
33,8 Å, состоящий из 10 пар нуклеотидов, причем
ДНК стабилизируется за счет эффекта Хоффмай-
конформация сахара соответствует С2-эндо-, а ан-
стера, или специфического ионного эффекта
ти-конформация всех оснований одинакова. Z-
[24]. Некоторые полиамины [25-27], малые мо-
лекулы
[28-30] и многоядерные комплексы
ДНК является более высокоэнергетической кон-
[31,32] также могут стабилизировать Z-форму
формацией, чем В-ДНК [13], следовательно, она
ДНК. Интеркаляция бромистого этидия стиму-
термодинамически менее выгодна для клетки.
лирует обратный переход из Z- в В-конформацию
Легкость В-Z-перехода убывает в ряду: m5CG >
[33,34]. Пограничные участки между Z-сайтами и
CG > GGGC = TG = CA > TA, а у поли(dA-dT) пе-
В-ДНК, так называемые j-сайты, имеют нару-
реход B-Z не обнаружен [11]. B-Z-переход спира-
шенные водородные связи нескольких нуклеоти-
ли ДНК облегчается повышением концентрации
дов и легко разрезаются эндонуклеазой S1, Р1 и
соли NaCl, иодированием, бромированием осно-
ДНКазой. Еще в начале работ по исследованию
ваний и метилированием цитозина по положе-
биологической функции Z-ДНК было выявлено
нию 5 [14-19], а также негативной суперспирали-
наличие антител к ней [35,36], а также Z-форма
зацией [20,21] и связыванием со специфически-
двунитевой РНК и антитела к этой молекуле
ми Z-ДНК-связывающимися белками [22]. Ионы
[37,38].
металлов стимулируют переход B-Z ДНК in vitro.
Переход B-Z имеет сложную природу и проте-
К ним относятся щелочные катионы при высоких
кает медленно [39,40]. Было предложено не-
концентрациях солей (Na+ при концентрации 2,3
сколько различных моделей, описывающих этот
М и Cs+ при концентрации 4,7 М) и ряд двухва-
переход. Модель S. Harvey [41] предполагала, что
лентных катионов - Mg, Ca, Ba, Ni, Zn, Cu, Co,
это - кооперативный процесс, происходящий за
Mn [23]. Относительно недавние исследования
счет ротации оснований без разрыва водородных
показали, что анионы также могут влиять на В-Z-
связей и раскручивания спирали. Альтернатив-
переход, поэтому элетростатическая модель не
ная ей модель, предложенная A.H. Wang с соавто-
может полностью объяснить роль солей в форми-
рами [42], утверждала, что для осуществления
БИОФИЗИКА том 64
№ 5
2019
СТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА Z-ФОРМЫ ДНК
843
История открытия и изучения Z-ДНК (по обзору [25], дополненная)
Pohl & Jovin, 1972
Впервые обнаружено изменение спектра кругового дихроизма поли(dG-dC) при
повышении концентрации раствора NaCl
Wang et al., 1979
Обнаружена левоспиральная Z-форма ДНК при изучении структуры
монокристалла фрагмента ДНК
Nordheim et al., 1981
Связывание антител к Z-ДНК с транскрипционно-активными участками
политенных хромосом дрозофилы
Nordheim & Rich, 1983
Стабилизация Z-ДНК негативным супер-скручиванием плазмид и вируса SV-40.
Левоспиральная Z-ДНК in vivo - в ядрах protozoa
Rich et al., 1984; Davis et al.,
Взаимодействие белков и Z-ДНК. Левоспиральная Z-форма двутяжевой РНК и ее
1986
структура
Liu &Wang, 1987
Отрицательное супескручивание ДНК при транскрипции позади движущейся
РНК-полимеразы
Hardin et al., 1988
Цитоплазматическая Z-РНК. Антитела к Z-РНК
Wittig et al., 1989
Регулирование уровня Z-ДНК торсионным напряжением в активных ядрах клеток
Wittig et al., 1991
Корреляция образования Z-ДНК с уровнем синтеза РНК
Wittig et al., 1992
Корреляция образования Z-ДНК вблизи промотора гена с-myc с транскрипцией гена
Herbert et al., 1995,1997
Специфичная прочная связь с Z-ДНК белка ADAR1. Выделен связывающийся с
Z-ДНК домен белка ADAR1 (Zα)
Kim et al., 1999
Изучена структура кристалла Z-ДНК, связанной с Zα доменом ADAR1.
Обнаружено взаимодействие этого домена и Z-РНК
Oh et al., 2002
Действие белков, связывающихся с Z-ДНК, как потенциальных эффекторов
экспрессии гена
Brandt & Jacobs, 2003
Z-ДНК связывающиеся белки E3L вируса vaccinia, белок zuotin дрожжей и
филаментные белки ядра
Suram et al., 2002; Hegde
Повышенное содержание Z-ДНК в мозге при болезни Альцгеймера
et al., 2004
Lim & Feng, 2005
Сформирована обобщающая модель процесса перехода из B- в Z-форму ДНК
Ha et al., 2005
Изучена структура ДНК в месте перехода В- в Z-форму. Выявлено наличие в этом
месте разрыва в паре оснований А-Т и выпячивания их из цепи ДНК
Bacolla & Wells, 2009
Участие Z-формы в индукции мутагенеза
Ray et al., 2011
Z-ДНК-формирующая последовательность в гене белка ADAM-12 регулирует его
экспрессию
Bae et al., 2011
Z-связывающиеся белки стабилизируют Z-ДНК
Bae et al., 2013
Z-ДНК стабилизируется за счет эффекта Хоффмайстера
Ray et al., 2013
Синтез Z-связывающегося белка АDАМ-12 повышается при раке молочной
железы, печени, желудка, мозга и др. локализаций
Shin et al., 2016
Корреляция образования Z-ДНК с активной транскрипцией (метод ChIP-Seq)
Kouzine et al., 2017
Полногеномное исследование, показавшее, что формирование Z-ДНК иницииру-
ется негативной суперспирализацией, возникающей происходящей рядом тран-
скрипцией
Chaktabotty & Wales, 2017
Термодинамическая модель, предполагающая два механизма протекания
перехода из B- в Z-форму ДНК
Lee et al., 2018
На примере белка ZBP1 предложена альтернативная термодинамическая модель
B-Z-перехода, предполагающая его индукцию этим белком
Van der Vorst, 2018
Белки семейства АDАМ связаны с болезнью Альцгеймера, артритом,
атеросклерозом и диабетом
Hetbert, 2019
Связь Z-ДНК и Z-связывающегося белка АDАR1 с патогенезом синдрома
Айкарди-Гутьереса и макулодистрофии
БИОФИЗИКА том 64
№ 5
2019
844
ЗАВАРЫКИНА и др.
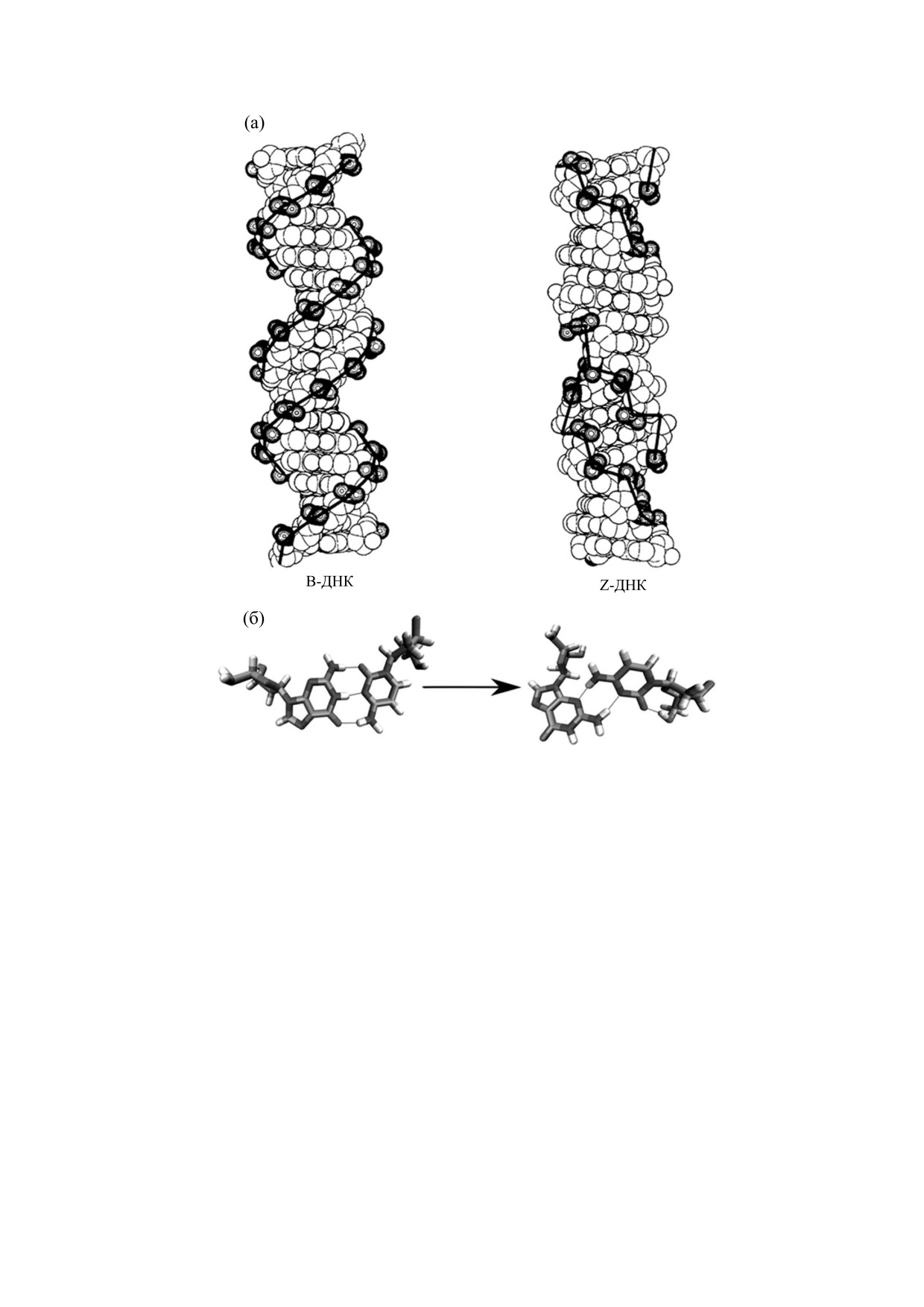
Рис. 2. Структура Z-формы ДНК (а) и конформационное состояние нуклеотидной пары Г-Ц, определяющее
зигзагообразную форму фосфодиэфирного остова спирали Z-ДНК (б) [46].
B-Z-перехода необходим разрыв связей между
ется последними исследованиями структуры
спаренными основаниями ДНК перед поворотом
кристаллической ДНК [46]. Кроме того, суще-
оснований. Однако обе эти модели не объясняли
ствует достаточное количество альтернативных
раскручивание спирали при B-Z-переходе. Мо-
моделей B-Z-перехода [47]. Недавние исследова-
дель, предложенная W. Saenger и U. Heinemann,
ния D. Chakraborty и D.J. Wales позволили им
пыталась объяснить это за счет образования
предложить новую модель этого процесса [12],
А-ДНК в процессе B-Z-перехода [43]. В 2005 году
которая предполагает два различных механизма
была предложена обобщающая модель, которая
для B-Z-перехода. При первом варианте проис-
также ставила своей целью объяснить раскручи-
ходит образование растянутых ДНК-структур,
вание спирали во время B-Z-перехода [44]. Кро-
тогда как для второго характерен непосредствен-
ме этих моделей, существует zipper-модель (от
ный переход из B- в Z-форму. Расчеты на основе
англ. «застежка-молния») [45], которая основы-
радиуса вращения спирали показали, что в пер-
вается на термодинамических расчетах и предпо-
вом случае раскручивание спирали сопровожда-
лагает, что В-Z-переход происходит за счет рас-
ется разрывом практически всех уотсон-криков-
пространения специфической
«переходной»
ских связей между основаниями. Затем нити
структуры ДНК, которая находится между В- и Z-
ДНК закручиваются вновь, формируя Z-форму
формами (B-Z junction). Эта теория подтвержда-
ДНК. Во втором случае радиус вращения спирали
БИОФИЗИКА том 64
№ 5
2019
СТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА Z-ФОРМЫ ДНК
845
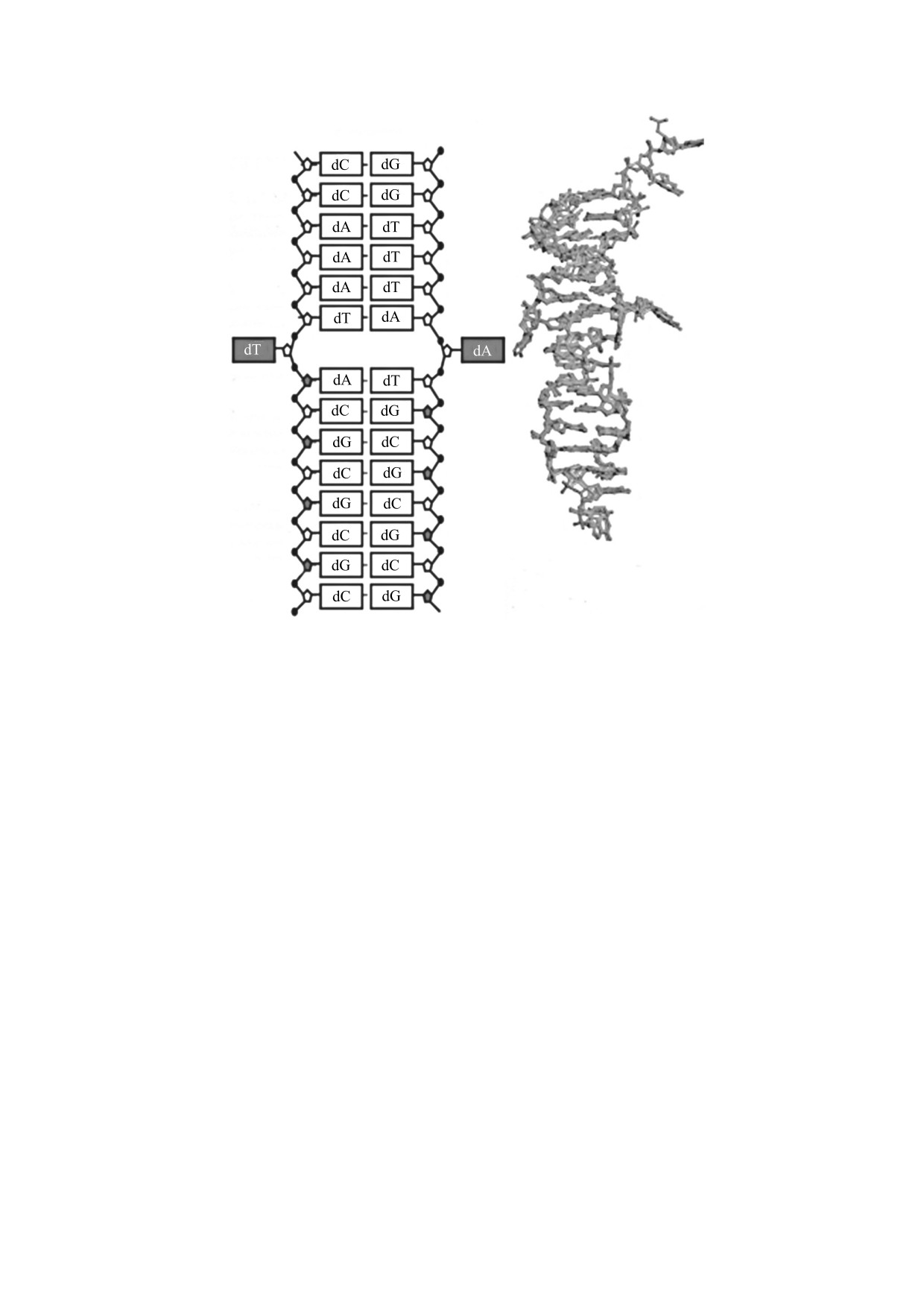
Рис. 3. Структура перехода между В- и Z-формами ДНК (на примере олигонуклеотида BZ78) [48].
меньше, промежуточные продукты вращения бо-
наблюдалось выпячивание основания аденина в
лее компактны по сравнению с первым механиз-
месте соединения В- и Z-ДНК [49].
мом и сохраняют часть спаренных уотсон-кри-
Последние исследования подтвердили полу-
ковских оснований. Также эти два пути отлича-
ченную ранее структуру перехода между В- и
ются процессом принятия гуанином син-
Z-ДНК (выпячивание аденина и тимина), кото-
конформации. В случае первого механизма цен-
рая отличается как от В-, так и от Z-ДНК, и вы-
тральные гуанины переходят в син-конформацию
явили, что она не зависит от последовательности
раньше, чем гуанины на конце цепи, тогда как
оснований. Также в этой работе было показано,
при втором механизме B-Z-перехода наблюдает-
что формирование такой структуры необходимо
ся обратная ситуация - первыми меняют кон-
для образования Z-ДНК. Авторы полагают, что
формацию концевые гуанины, а затем уже цен-
Z-формирующие последовательности не могут
тральные. Кроме того, цитозины при первом
принимать Z-форму, если данный переход не
механизме B-Z-перехода также меняют конфор-
сформирован. [48].
мацию с анти- на син-, тогда как для второго ме-
ханизма это не характерно, большинство цитози-
Экспериментально Z-ДНК идентифицируют с
нов остается в анти-конформации.
помощью ультрафиолетовых спектров кругового
дихроизма, Рамановских спектров [50-52], ин-
Структура цепи ДНК в месте соединения В- и
фракрасных спектров [53], специфических анти-
Z-форм также активно исследуется. Анализ кри-
тел [54-56], методом связывания с нитроцеллю-
сталлической структуры места перехода B- в
лозными фильтрами [57], с помощью модифика-
Z-ДНК показал наличие разрыва в паре основа-
ции перманганатом в сочетании с рестриктазами,
ний А-Т и выпячивания их из цепи ДНК (рис. 3)
специфичными к однонитевой ДНК j-сайтов как
[46,48]. Подобные структурные особенности бы-
отдельно, так и в сочетании с высокопроизводи-
ли подтверждены в экспериментах на растворах
тельным секвенированием (ssDNA-seq) [58], мо-
ДНК с использованием 2-аминопурина, флуо-
дификацией пиримидинов в j-cайтах тетраокси-
ресцентного аналога аденина, в которых также
дом осмия или диэтилпирокарбонатом, специ-
БИОФИЗИКА том 64
№ 5
2019
846
ЗАВАРЫКИНА и др.
фичным к пуринам Z-ДНК, а также комбинацией
[18], что в случае локализации их в промоторах
этих методов [10,59,60]. На основе иммуногенно-
ингибирует транскрипцию генов [16].
сти Z-ДНК был разработан метод иммунофер-
Известно, что Z-форма ДНК участвует в регу-
ментного анализа на твердой фазе [61]. Недавние
ляции транскрипции и функции РНК-полимера-
исследования позволили разработать и использо-
зы. Роль Z-ДНК в регуляции транскрипции генов
вать для работы с Z-ДНК метод FRET-анализа,
неоднозначна и зависит от ее положения. Боль-
основанный на использовании флуоресцентной
шинство Z-формирующих последовательностей,
спектроскопии с модифицированными основа-
таких как (GC)n и (GT)n, расположены в геноме
ниями [39,40], в качестве пробы для флуорес-
неслучайно, в основном располагаясь в области
центного анализа особенно распространен 2-ами-
промоторов генов [66]. Z-образующие участки
нопурин, флуоресцентный аналог аденина [49].
ДНК, расположенные вблизи промоторов или
Также для исследования Z-ДНК используют про-
энхансеров генов, участвуют в регуляции их тран-
бы на основе модифицированного Z-связываю-
скрипции, служа эффекторами, тогда как распо-
щего белка ADAR1 [62].
ложенные внутри промоторов ингибируют тран-
скрипцию [67,68]. Последний вариант, видимо,
встречается реже, так как недавнее исследование
Z-ДНК КАК АКТИВНЫЙ
с использованием иммунопреципитации хрома-
ЭЛЕМЕНТ ГЕНОМА
тина с модифицированным Z-связывающим бел-
ком ADAR1 и последующим высокопроизводи-
Z-конформация ДНК обнаружена как в мо-
тельным секвенированием (метод ChIP-Seq)
дельных опытах in vitro на суперспирализованных
показало прямую корреляцию между формирова-
плазмидах, так и in vivo у бактериофагов, бакте-
нием Z-ДНК и активной транскрипцией [62].
рий, в ядрах простейших, хромосомах дрозофи-
Кроме того, выяснено, что РНК-полимераза
лы, клетках дрожжей, млекопитающих и челове-
не проходит через Z-участки матрицы ДНК, по-
ка. Z-формирующие последовательности ДНК
этому расположенные в интронах Z-сайты служат
вызывают высокий уровень нестабильности ге-
для разделения соседних генов. Напротив, про-
нома как в бактериях, так и в клетках млекопита-
хождение РНК-полимеразы через В-спираль
ющих, индуцируя двунитевые разрывы ДНК и
матрицы сопровождается суперскручиванием
образование больших делеций [5].
пройденных сайтов и переходом их в Z-форму
В геноме эукариот насчитывают 20-30 тысяч
[69]. Так, например, транскрипция гена с-myc че-
генов. Один ген содержит в среднем три Z-сайта
ловека ассоциирована с образованием трех дис-
размером 12-15 пар СG или АТ нуклеотидов, ло-
кретных участков Z-ДНК [70]. При функциони-
кализованных у 5'-конца гена. Распространен-
ровании оперона E. coli повышается количество
ность Z-формирующих последовательностей в
не-В-форм ДНК, что предполагает их регулятор-
геноме человека составляет в среднем
1 на
ную функцию у этих бактерий [71]. Увеличение
3000 пар нуклеотидов, или около 1% ДНК [63].
уровня экспрессии генов, возможно, достигается
Компьютерное моделирование позволило пред-
за счет снятия торсионного стресса в процессе
сказать 716462 мотива Z-формирующих последо-
транскрипции, что продемонстрировано биоин-
вательностей для генома мышей. При этом было
форматической валидацией наложения располо-
экспериментально выяснено, что в ряде геном-
жения Z-формирующих последовательностей и
ных сайтов последовательности, характерные для
CpG-островков в сайтах начала транскрипции
различных не-В-форм ДНК, перекрываются бо-
[72]. В недавней работе [58] показано, что форми-
лее чем на 50% своей длины с другими не-В-фор-
рование не-В-форм ДНК, включая Z-ДНК, ини-
мами ДНК, для Z-ДНК такое явление наблюда-
циируется негативной суперспирализацией выше
лось для 3% последовательностей [58]. Образова-
сайта начала транскрипции, которая возникает
ние Z-конформации ДНК в клетке
-
вследствие происходящего рядом процесса тран-
динамичный процесс, который генерируется от-
скрипции гена. Известно, что Z-ДНК-формиру-
рицательной суперспирализацией при раскручи-
ющий участок белка ADAM-12 функционирует
вании В-спирали ДНК с нуклеосом, а также дви-
как супрессор транскрипции [68], что говорит о
жением РНК-полимеразы при транскрипции ге-
важном функциональном значении связывания
нов. Экспериментально было показано, что
специфических белков с Z-ДНК, которое также
переход В-Z в кольцевых молекулах ДНК или за-
выражается в регуляции экспрессии генов.
мкнутых участках индуцируется и стабилизирует-
ся за счет негативной суперспирализации [14,64].
БЕЛКИ, СВЯЗЫВАЮЩИЕСЯ С Z-ДНК
Этот переход в клетке осуществляется с помощью
топоизомеразы II, а обратный переход - с помо-
В настоящее время известно, что с Z-ДНК
щью топоизомеразы I или гиразы в бактериях
(Z-РНК) связываются как структурные фибрил-
[65]. Метилирование цитозина в (СpG)n-после-
лярные белки, входящие в состав матрикса, так и
довательностях также облегчает В-Z-переход
ферменты, регулирующие молекулярные процес-
БИОФИЗИКА том 64
№ 5
2019
СТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА Z-ФОРМЫ ДНК
847
сы клетки: белки ADAR1, DLM-I, PKZ, вирусный
белок E3L и ряд других. Эти специфические бел-
ки, связывающиеся с Z-сайтами при помощи
входящих в их состав одного или нескольких Zα-
доменов, осуществляют стабилизацию Z-ДНК в
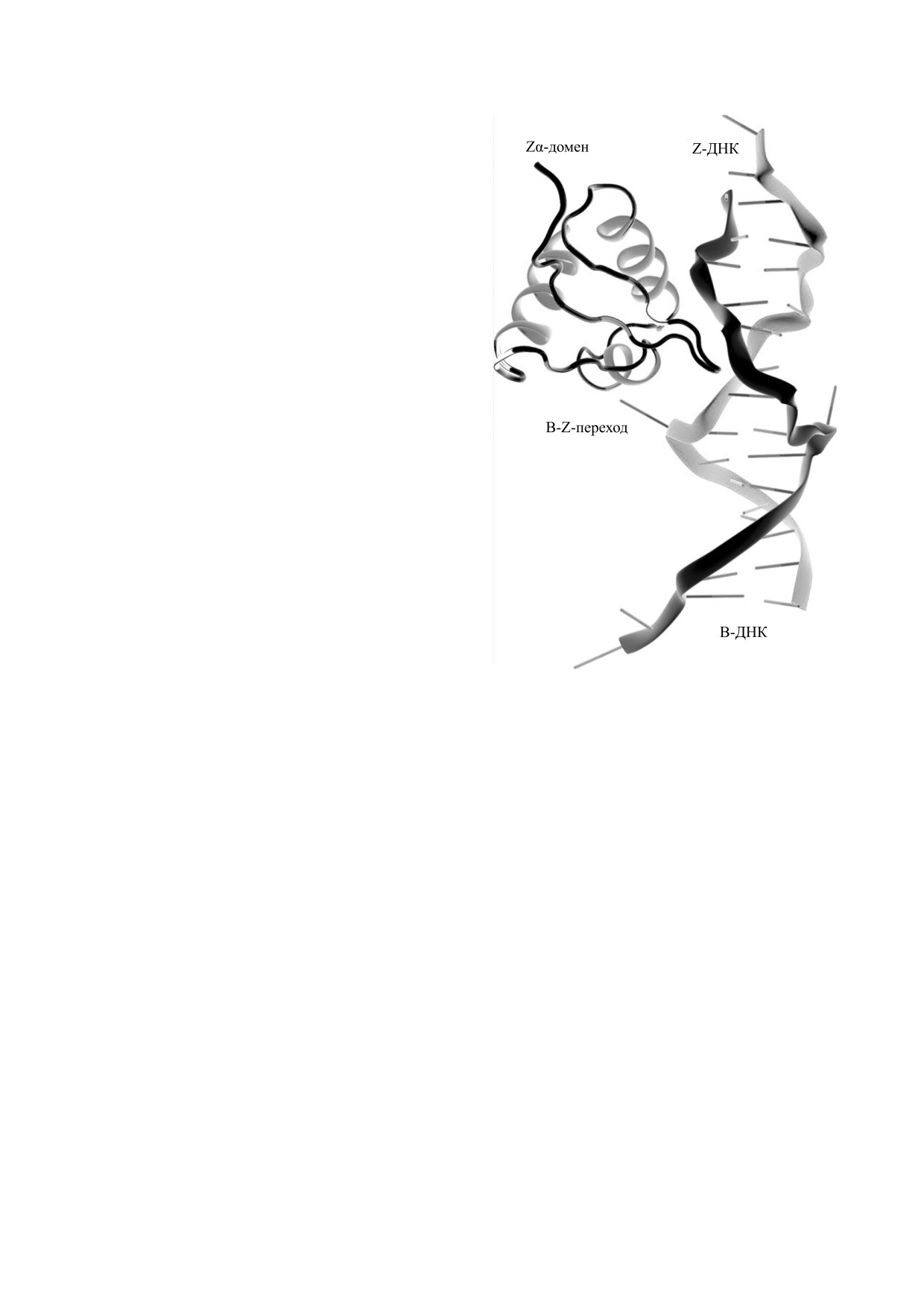
клетке (рис. 4, [73]). Предполагается, что Zα-до-
мены данных белков не индуцируют конформа-
ционный переход из В-формы в Z-ДНК, а присо-
единяются уже после формирования Z-структуры
и стабилизируют ее [22]. Однако последняя пред-
ложенная термодинамическая модель, рассчи-
танная для белка ZBP1, предлагает альтернатив-
ную гипотезу и говорит об индукции B-Z-перехо-
да непосредственно этим белком [74].
Zα-домен принадлежит к Zα-семейству (база
данных Pfam: PF02295), которое характеризуется
следующей специфической вторичной структу-
рой: α1-β1-α2-α3-β2-β3, где α - α-спираль, β -
β-лист. Zα-семейство белков принадлежит к су-
персемейству ДНК-связывающих белков wHTH
(winged helix-turn-helix, или winged helix DNA
binding domain superfamily) типа «спираль-пово-
рот-спираль», в котором за узнавание ДНК отве-
чает спираль α3, а так называемые «β-крылья» (β-
wings) представлены β2-β3-листами и связываю-
щей их петлей [75]. Заряженные основания α3-
спирали распознают Z-ДНК за счет электроста-
тического взаимодействия и водородных связей.
Связывание с Z-ДНК осуществляется в основном
за счет взаимодействия тирозина α3-спирали с
гуанином Z-ДНК. Кроме того, гидрофобные ос-
нования «β-крыльев» (например, триптофан и
пролин) также участвуют в связывании с Z-ДНК
Рис. 4. Взаимодействие Zα-домена Z-ДНК связыва-
[76]. Однако основой взаимодействия между Zα-
ющегося белка с Z-ДНК на примере белка ADAR1
[73].
доменом белка и Z-ДНК все же является конфор-
мационная специфичность. Кроме того, Zβ-до-
мен белка человека ZBP1 связывается с Z-ДНК,
DLM-1 (DAI, ZBP1) - белок, открытый недав-
используя другой набор взаимодействующих ос-
но в лимфатических тканях человека и связываю-
нований, что подтверждает большое разнообра-
щийся с Z-сайтами ДНК. Этот белок инициирует
зие семейства ДНК-связывающих белков wHTH
врожденный иммунный ответ путем связывания
[73].
чужеродных нуклеиновых кислот в цитозоле. Для
полной активации ответа (синтеза иммуноглобу-
Биологическая роль Z-ДНК была выяснена
лина) требуются два Z-ДНК-связывающихся до-
благодаря открытию белка ADAR1, взаимодей-
мена и один домен, связывающийся с В-ДНК
ствующего с Z-сайтами ДНК и РНК
[77].
[63,80-82]. В некоторых случаях, например при
ADAR1 - аденин-дезаминаза РНК, которая свя-
инфицировании вирусом гриппа А, распознава-
зывается с Z-сайтами двутяжевой mРНК и редак-
ние вирусной РНК происходит при помощи вто-
тирует ее, превращая аденин в инозин, цитозин в
рого Zα-домена, что в дальнейшем приводит к
урацил и меняя кодоны аминокислот в синтези-
некрозу или апоптозу зараженной клетки [83,84].
рованной РНК. Таким образом, ADAR1 увеличи-
вает количество белков, кодируемых геном. Свя-
PKZ - РНК-зависимая протеинкиназа, аналог
зывание этого белка с Z-ДНК позволяет исполь-
прoтеинкиназы PKR. Белок PKZ обнаружен в
зовать интроны для прямого процессинга
клетках некоторых рыб, а PKR - в клетках других
экзонов и редактировать синтезированную РНК
позвоночных. Оба белка играют ключевую роль в
до ее сплайсинга [78,79]. Ген человека ADAR1
антивирусной защите при обнаружении вирус-
имеет N-концевой Zα-домен, взаимодействую-
ной двунитевой РНК в цитоплазме клеток. Одна-
щий с Z-ДНК и влияющий на активность экс-
ко киназа PKZ, в отличие от PKR, вместо домена,
прессии гена.
связывающегося с РНК, содержит два домена,
БИОФИЗИКА том 64
№ 5
2019
848
ЗАВАРЫКИНА и др.
связывающихся с Z-сайтами ДНК [85]. Вирус
скрипции не происходит. Количество белка по-
герпеса карпов кодирует белок ORF112, который
вышается при прогрессировании болезни (при
имеет собственный Zα-домен и служит ингиби-
раке молочной железы, мочевого пузыря), с по-
тором PKZ [86].
вышенной экспрессией белка ADAM-12 связыва-
ют начало процесса метастазирования [94].
Нуклеолин - ключевой ядерный белок деля-
щихся клеток, тесно связанный с ядерным мат-
Zα-мотив типа «спираль-поворот-спираль»
риксом и контролирующий транскрипцию рРНК
был обнаружен у 182 других белков (SMART Do-
и синтез рибосом. Нуклеолин эффективно связы-
main SM00550), которые являются ортологами
вается с РНК, однотяжевыми участками ДНК и
белков ADAR1, ZBP1, PKZ, E3L и ORF112 у дру-
АТ-богатыми сайтами ДНК, содержащими не-
гих видов организмов [73].
спаренные основания (потенциальными Z-сай-
Таким образом, функциональная роль белков,
тами) [87].
связывающихся с Z-ДНК, состоит в том, что они
E3L - белок вируса Vaccinia virus из семейства
могут служить потенциальными эффекторами
поксвирусов (вирусы оспы), N-концевой домен
транскрипции генов. Предполагают, что образо-
которого сходен по строению с семейством Z-аль-
вание Z-ДНК в области промотора индуцируется
фа Z-ДНК-связывающих белков позвоночных.
и стабилизируется связавшимся с ней белком.
N-концевой домен этого белка способен связы-
Это предположение подтверждено опытами в од-
ваться с Z-ДНК, причем степень летальности ви-
ногибридной системе дрожжей. Показано, что
русов зависит от активности этой связи [88-90].
образование Z-ДНК возможно при транскрип-
Зуотин - белок, взаимодействующий с Z-ДНК
ции репортерного гена и что сегмент Z-формы в
в клетках дрожжей Saccaromyces cerevicia [91].
области промотора может играть роль cis-элемен-
та регуляции активности гена. Подобные резуль-
К числу регуляторных белков человека можно
таты были получены также в системе ремодели-
отнести семейство белков ADAM, обладающих
рования хроматина человека [95].
свойствами дезинтеграз и металлопротеаз, и за-
крепленных на мембране клеток [68,92]. Белки
Кроме того, Z-ДНК взаимодействует со струк-
ADAM являются трансмембранными, состоящи-
турными белками, например, с цитоплазматиче-
ми из четырех доменов, причем первый домен ло-
скими промежуточными филаментами (сIF),
кализован внутри клетки. Они удаляют эктодоме-
устойчиво ассоциированными с ядерным мат-
ны связанных с мембраной рецепторов, факторов
риксом. Эти белки играют роль цитоскелета и ре-
роста и цитокинов. Эти белки играют роль моле-
гулятора активности генома. Еще 50 лет назад бы-
кулярных включателей сигнального пути тиро-
ло показано, что в ядре клетки существует сеть
зин-киназного рецептора EGFR, играющего
нехроматиновых фибриллярных и глобулярных
большую роль в ответе клеток на сигналы факто-
белковых структур. Термин «ядерный матрикс»
ров роста и цитокинов, активируясь через цито-
был предложен в 1974 году [96]. В клетках эукари-
плазматический домен G-белком (GPCR) [93].
от он представляет собой каркасные белковые
структуры, служащие для поддержания опреде-
Обнаружено, что ген ADAM-12 (a disintegrin
ленного положения хромосом и петель хромати-
and metalloprotease domain-containing protein 12)
на. Структура ядерного матрикса динамично из-
содержит в первом экзоне консервативный отри-
меняется в процессе функционирования ядра
цательный регуляторный элемент (NRE), дей-
клетки. Z-форма ДНК участвует в прикреплении
ствующий как репрессор транскрипции. Этот
петель ДНК к ядерному матриксу в интерфазных
элемент содержит повтор последовательности
клетках или к скаффолду хромосом в митотиче-
динуклеотида, способного принимать Z-конфор-
ских клетках, а также для осуществления процес-
мацию in vitro и in vivo [92]. Белки ADAM не свя-
сов репликации, транскрипции, репарации и ре-
зываются с Z-ДНК, но их гены содержат Z-уча-
комбинации ДНК.
сток, действующий как негативный регулятор-
ный элемент, снижающий экспрессию белка, а
Петли хроматина состоят из доменов длиной
при взаимодействии с ядерными белками усили-
20-70 тысяч пар нуклеотидов, а участки ДНК,
вает транскрипцию. Многочисленное семейство
фиксирующие концы петель ДНК на матриксе
белков ADAM человека связано с процессами
(«якоря»), довольно длинны (500-1000 пар нук-
оплодотворения, ангиогенеза, нейрогенеза, раз-
леотидов) и постоянны. В основном это повторы
вития сердца. Кроме того, белок ADAM-12 обла-
чередующихся пурин-пиримидиновых нуклеоти-
дает важной функцией в опухолевых клетках,
дов (100-150 пар), обогащенные АТ-парами, или
экспрессируясь в клетках различных видов рака.
GC-повторы, способные принимать Н- или
Его Z-ДНК-формирующий участок функциони-
Z-форму. Эти сайты ДНК называют матрикс-ас-
рует как супрессор транскрипции, обеспечивая
социированными участками (МАRs). Участки
сниженный уровень этого белка в большинстве
связывания петель ДНК с ядерным матриксом
нормальных клеток. В опухолевах клетках функ-
содержат сайты инициации репликации, промо-
ция этого участка снижена, и супрессии тран-
торы, энхансеры и белковые факторы транскрип-
БИОФИЗИКА том 64
№ 5
2019
СТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА Z-ФОРМЫ ДНК
849
ции, регулирующие активность экспрессии генов
Предполагают, что связывание Z-ДНК с бел-
[97]. Существуют также динамичные контакты
ком ADAR1 играет роль в ответе клеток эукариот
Z-ДНК с ядерным матриксом за счет фосфоли-
на патогены, поскольку этот белок, содержащий
пидов [98].
Z-связывающийся домен, связан с синтезом ин-
терферона [107,108]. Нарушение (мутация) в функ-
ционировании этого белка связано с активацией
СВЯЗЬ Z-САЙТОВ ДНК
Alu-повторов (ретротранспозонов) и приводит к
С ЗАБОЛЕВАНИЯМИ ЧЕЛОВЕКА
развитию синдрома Айкарди-Гутьереса (наслед-
ственного заболевания с тяжелыми неврологиче-
В настоящее время существуют свидетельства
скими нарушениями). Узнавание Z-формы ДНК
индукции не-В-формами ДНК нестабильности
белком ADAR активирует белок DICER1, оба они
генома
[4,99], которая является характерным
служат для предотвращения распространения ре-
признаком ряда заболеваний человека, в частно-
тротранспозонов в геноме человека. Потеря функ-
сти онкологических, аутоиммунных и неврологи-
ции белка DICER1 приводит накоплению Alu-по-
ческих. Установлена структурная роль Z-сайтов
второв и развитию макулодистрофии (возрастной
ДНК, состоящая в индукции мутагенеза в форме
дегенерации сетчатки) [73].
разрывов, больших делеций, рекомбинации,
транслокации и амплификации фрагментов ге-
Исследования влияния курения на ткани лег-
нома клетки [100]. Не-В-формы ДНК ассоцииро-
ких показали появление митохондриальной ДНК
ваны с «горячими точками» генома, которые под-
в бронхоальвеолярной жидкости как раннее про-
вергаются указанным выше повреждениям [101].
явление повреждающего действия сигаретного
дыма с одновременным уменьшением количества
Считают, что Z-форма ДНК вызывает разры-
митохондриальной ДНК в клетках легочной тка-
вы двойной спирали in vivo, поскольку они лока-
ни. Выявлено, что длительный оксидативный
лизованы главным образом вблизи сайтов, гипер-
стресс низкого уровня повреждает митохондри-
чувствительных к действию ДНКазы I или топо-
альную ДНК, которая выходит в цитоплазму, свя-
изомеразы II [34,69,102]. ДНКаза I расщепляет
зывается там с белком ZBP1 и запускает воспали-
однотяжевые участки ДНК на В-Z-границе, а то-
тельную реакцию [109].
поизомераза II предпочитает разрезать Z-ДНК
образующие последовательности нуклеотидов. В
Нестабильность генома, одной из причин воз-
результате соседних разрывов ДНК образуются
никновения которой является наличие не-В-
делеции [63].
форм ДНК, служит предпосылкой злокачествен-
ной трансформации клеток, а также является од-
Повышенное содержание левоспиральной
ной из характерных особенностей опухолевых
Z-формы обнаружено в ДНК гиппокампа мозга
клеток [110]. Опухолевые клетки отличаются от
человека при болезни Альцгеймера [103-105].
нормальных также ускоренным ростом, утратой
Считают, что Z-ДНК может участвовать в отри-
дифференцировки, нарушением программиро-
цательной регуляции ряда генов системы антиок-
ванной клеточной гибели (апоптоза), снижением
сидантной защиты при этой болезни. Белки
антипролиферативных сигналов и опорой на эк-
ADAM, гены которых содержат в регуляторных
зогенные факторы роста, исключением реплика-
сайтах Z-ДНК-кодирующие последовательно-
тивного старен/*/ия за счет активности теломе-
сти, также связаны с патологическими процесса-
раз. Все эти признаки сопутствуют нарушению
ми - болезнью Альцгеймера, артритом, атеро-
нормального регулирования экспрессии генов
склерозом и диабетом [106].
[111]. При изучении участков MARs (способных
Также предполагается, что Z-связывающие
образовывать Z- или Н-формы ДНК) в клетках
белки модифицируют считываемую генетиче-
лейкемии СЕМ еще в 1998 году впервые было по-
скую информацию в относительно короткие пе-
казано существенное увеличение их количества
риоды времени, хотя этo происходит не настоль-
по сравнению с нормальными клетками [112].
ко быстро, как при посттрансляционной моди-
Участие Z-формы ДНК в развитии онкологиче-
фикации. Это больше напоминает механизм
ских заболеваний также подтверждается данны-
«обратной связи», когда альтернативные тран-
ми о повышенном синтезе Z-связывающегося
скрипты одного гена изменяют ответ мишени,
белка ADAM-12 при раке молочной железы, пе-
приводя к противоположным результатам. Изме-
чени, желудка, мозга и других локализациях [94].
нение процессинга таким образом позволяет
Кроме того, было показано, что C8-гуаниновые
быстро реагировать на экзогенный стресс. Дан-
аддукты различных канцерогенных соединений
ный способ регуляции экспрессии генов вероят-
индуцируют образование Z-формы ДНК [113].
нее всего имеет индивидуальные различия, свя-
зан с различиями в риске развития ряда патоло-
Одной из особенностей опухолевых клеток
гий и имеет особое значение в генах с длинными
млекопитающих in vitro является дисбаланс мети-
участками Z-ДНК, особенно при наличии ассо-
лирования геномной ДНК, который вносит зна-
циированных с заболеваниями мутаций [73].
чительный вклад в создание генетической и фе-
БИОФИЗИКА том 64
№ 5
2019
850
ЗАВАРЫКИНА и др.
нотипической нестабильности и в процессы воз-
концентрации NaCl в интервале 0,5-4,5 М, дей-
никновения и развития опухоли. Изменение
ствия бромистого этидия, нуклеазы SI, Hin PI или
метилирования цитозина по 5-положению (5mC)
тетраоксида осмия - пиридинового реагента по-
проявляется на ранних стадиях злокачественной
казал, что локальные денатурированные участки
трансформации клеток млекопитающих и усили-
ДНК обладают свойствами j-сайтов с нарушен-
вается с развитием опухолей [112,114]. Гиперме-
ными водородными связями, образующимися на
тилирование CрG-островков, многие из которых
границе Z-В участков двойной спирали ДНК.
локализованы в промоторах генов, является ран-
ДНК опухолей оказалась более радиочувстви-
ним специфическим событием в процессе воз-
тельной, чем в норме по количеству двунитевых
никновения опухоли. Гиперметилирование про-
разрывов ДНК при воздействии ионизирующей
моторных районов генов-супрессоров опухолево-
радиации как на растворы ДНК, так и на заморо-
го роста играет важную роль в развитии и
женные клетки [122]. Это может быть объяснимо
прогрессии рака [115,116]. Метилирование CG-
структурными особенностями Z-сайтов, в кото-
последовательностей может вызывать их В-Z-пе-
рых гуанин, не экранированный молекулой саха-
реход и стабилизировать Z-форму, что приводит
ра, пространственно более доступен свободным
к инактивации прилежащего гена вследствие сте-
радикалам или другим повреждающим агентам
рических препятствий связывания транскрипци-
[123]. Можно предположить, что повышенный
онных факторов. Этот феномен MAGI (methyla-
уровень локальных денатурированных участков
tion-associated gene inactivation) обнаружен для
(Z-cайтов) в ДНК опухолевых клеток обусловлен
промоторного региона гена-супрессора опухоле-
активацией процессов репликации и тран-
скрипции.
вого роста p16INK4A при плоскоклеточном раке
легкого [117], для гена ретинобластомы, через бе-
В наших исследованиях in vivo выявлено изме-
лок которого в клетке реализуются антипролифе-
нение количества Z-сайтов в ДНК при действии
ративные сигналы, а также для генов онко-су-
различных агентов: пероксида водорода, произ-
прессоров ТР53 и PTEN при лимфоме [118]. Обна-
водных
2,5-дифенил-оксазола, антиоксиданта
ружено, что метилирование цитозина
(5mC)
фенозана и ионизирующего излучения [124-126].
снижает свободную энергию Z-цепи и тем самым
Это говорит о лабильности данной структуры и
может инициировать B-Z-переход, увеличивая
участии Z-формы ДНК в неспецифическом отве-
количество ДНК в Z-форме [16].
те клетки на действие факторов различной при-
роды.
Данные собственных исследований в области
изучения Z-формы ДНК (именовавшейся в ран-
них работах участками локальной денатурации),
ЗАКЛЮЧЕНИЕ
которые проводились, начиная с 1985 года, следу-
Вторичная структура ДНК и ее неканониче-
ющие. При сравнительном изучении состояния
ские формы, а также связанные с ними белки иг-
вторичной структуры ДНК опухолевых и нор-
рают важную роль в функционировании генома
мальных тканей по скорости расплетания спира-
клеток. Роль левоспиральной Z-ДНК при этом
ли формальдегидом было обнаружено увеличе-
неоднозначна: она функционирует как регулятор
ние количества локальных денатурированных
транскрипции генов, может вызывать деструк-
участков преимущественно в GC-обогащенных
тивные эффекты, нестабильность генома, кото-
участках ДНК и повышенное метилирование ци-
рая, в свою очередь, повышает вероятность раз-
тозина в ДНК зрелых солидных и асцитных опу-
вития различных заболеваний человека, особен-
холей животных [119]. Количество локальных де-
но злокачественных. Z-ДНК может представлять
натурированных участков коррелировало с со-
собой новый класс молекулярных мишеней для
держанием
5-mC. Повышенный уровень
контроля транскрипции. Кроме того, изучение
локальных денатурированных участков был обна-
Z-ДНК, как и других не-В-форм ДНК, важно для
понимания механизма развития и терапии ряда
ружен также в ДНК лимфоцитов крови человека
заболеваний человека.
при остром и хроническом лейкозе [120,121], что
подтверждает участие Z-формы ДНК в развитии
онкологических заболеваний. Динамика увели-
СПИСОК ЛИТЕРАТУРЫ
чения количества локальных денатурированных
1. R. D. Wells, J. Biol. Chem. 284 (14), 8997 (2009).
участков была симбатна росту (весу солидных или
2. G. Wang and K. M. Vasquez, Genes 8 (1), 17 (2017).
клеточности асцитных) опухолей мышей. Анализ
спектров кругового дихроизма растворов опухо-
3. R. D. Wells, Trends Biochem. Sci. 32 (6), 271 (2007).
левой ДНК, S-образных кривых связывания ее с
4. J. Zhao, A. Bacolla, G. Wang, et al., Cell. Mol. Life Sci.
нитроцеллюлозными фильтрами при повышении
67 (1), 43 (2010).
БИОФИЗИКА том 64
№ 5
2019
СТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА Z-ФОРМЫ ДНК
851
5. G. Wang, L. A. Christensen, K. M. Vasquez, et al.,
33. F. M. Pohl, T. M. Jovin, W. Baehr, and I. J. Holbrook,
Proc. Natl. Acad. Sci. USA 103 (8), 2677 (2006).
Proc. Natl. Acad. Sci. USA 69 (12), 3805 (1972).
6. A. Bacolla, J. A. Tainer, K. M. Vasquez, et al., Nucleic
34. A. Rich, A. Nordheim, and A. H,-J. Wang, Annu. Rev.
Acids Res. 44 (12), 5673 (2016).
Biochem. 53, 791 (1984)
7. H. Hamada, M. G. Petrino, and T. Kakunaga, Proc.
35. A. Nordheim, M. L. Pardue, E. M. Lafer, et al., Nature
Natl. Acad. Sci. USA 79 (21), 6465 (1982).
294, 417 (1981).
8. A. H. Wang, G. J. Quigley, F. J. Kolpak, et al., Nature
36. C. Vaz de Andrade, S. M. Freitas, M. M. Ventura, et al.,
282, 680 (1979).
Biochim. Biophys. Acta 1726 (3), (2005).
9. A. Rich and S. Zhang, Nature, Reviews: Genetics 4 (7),
37. C. C. Hardin, D. A. Zarling, S. K. Wolk, et al., Bio-
566 (2003).
chemistry 27, 4169 (1988).
10. M. G. McLean, V. W. Lee, and R. D. Wells, J. Biol.
38. P. W. Davis, K. Hall, P. Cruz, et al., Nucl. Acids Res.
Chem. 263 (15), 7378 (1988).
14, 1279 (1986).
11. В. Зенгер, Принципы структурной организации нук-
39. B. Dumat, A. F. Larsen, and L. M. Wihelmsson, Nucl.
леиновых кислот (Мир, М., 1987).
Acids Res. 44, e101 (2016).
40.
M. Lee, S. H. Kim, and S.-C. Hong, Proc. Natl. Acad.
12. D. Chakraborty and D. J. Wales, Phys. Chem. Chem.
Sci. USA 107, 4985 (2010).
Phys. 19, 878 (2017).
41.
S. Harvey, Nucl. Acids Res. 11, 4867 (1983).
13. L. J. Peck and J. C. Wang, Proc. Natl. Acad. Sci. USA
80 (20), 6206 (1983).
42.
A. H. Wang, G. J. Quigley, F. J. Kolpak, et al., Nature
282 (5740), 680 (1979).
14. J. Klysik, S. M. Stirdivant, J. E. Larson, et al., Nature
290, 672 (1981).
43.
W. Saenger and U. Heinemann, FEBS Lett. 257, 223
(1989).
15. F. M. Pohl and T. M. Jovin, J. Mol. Biol. 67, 375 (1972).
44. W. Lim and Y. P. Feng, Biophys. J. 88, 1593 (2005).
16. N. A. Temiz, D. E. Donohue, A. Bacolla, et al., PLoS
One 7 (4), e35558 (2012).
45.
P. S. Ho, Proc. Natl. Acad. Sci. USA 91, 9549 (1994).
17. А. К. Щелкина, Л. Е. Минченкова, В. И. Иванов
46.
S. C. Ha, K. Lowenhaupt, A. Rich, et al., Nature 437,
и др., Молекуляр. биология 22 (6), 1562 (1988).
1183 (2005).
47.
M. A. Fuertes, V. Cepeda, C. Alonso, and J. M. Pérez,
18. В. И. Иванов и Э. Е. Минят, Биополимеры и клет-
Chem. Rev. 106, 2045 (2006).
ка 4 (4), 171 (1988).
48.
D. Kim, J. Hur, J. Hoon, et al., Nucl. Acids Res. 46
19. В. И. Иванов, А. Т. Карапетян, Э. Е. Минят и Я.
(19), 10504 (2018).
Садь, Молекуляр. биология 27 (5), 1150 (1993).
49.
D. Kim, S. Reddy, D. Y. Kim, et al., Nucl. Acids Res.
20. F. Azorin, A. Nordheim, and A. Rich, EMBO J. 2, 649
37, 4353 (2009).
(1983).
50.
C. M. A. Gangemi A. D'Urso, G. A. Tomaselli, et al.,
21. A. Nordheim and A. Rich, Proc. Natl. Acad. Sci. USA
J. Inorg. Biochem. 173, 141 (2017).
80, 1821 (1983).
51.
T. J. Tharnann, R. C. Lord, A. H. Wang, and A. Rich,
22. S. Bae, D. Kim, K. K. Kim, et al., J. Am. Chem. Soc.
Nucl. Acids Res. 9, 5443 (1981).
133, 668 (2011).
52.
A. Rich, A. Nordheim, and A. H.-J. Wang, Annu. Rev.
23. M. Gueron, J. Demaret, and M. Filoche, J. Biophys.
Biochem. 53, 797 (1984).
78, 1070 (2000).
53.
M. Kyriakidou, J. Anastassopoulou, A. Tsakiris, et al.,
24. S. Bae, H. Son, Y. G. Kim, and S. Hohng, Phys. Chem.
In Vivo 31 (6), 1131 (2017).
Chem. Phys. 15 (38), 15829 (2013).
54.
54. A. Rich and S. Zhang, Nature, Reviews: Genetics 4
25. T. J. Thomas and T. Thomas, Biochem. J. 298, 485
(7), 566 (2003).
(1994).
55.
Б. П. Уланов, А .А. Вехер, Т. И. Маторина и др.,
26. B. Hiraks, P. Malgorzata, G. Burt, and J. Laurence,
Молекулярная генетика, микробиология и виру-
Anticancer Res. 16, 39 (1996).
сология 2, 29 (1989).
27. H. Ohishi, M. Odoko, K. Grzeskowiak, et al., Bio-
56.
E. M. Lafer, A. Möller, A. Nordheim, et al., Proc. Natl.
chem. Biophys. Res. Commun. 366, 275 (2008).
Acad. Sci. USA 78, 3546 (1981)
28. M. L. Howell, G. P. Schroth, and P. S. Ho, Biochem-
57.
U. Kuhnlein, S. S. Tsang, and J. Edwards, Nature 287,
istry 35, 15373 (1996).
363 (1980).
29. T. Schwartz, J. Behlke, K. Lowenhaupt, et al., Nat.
58.
F. Kouzine, D. Wojtowicz, L. Baranello, et al., Cell
Struct. Mol. Biol. 8, 761 (2001).
Syst. 4 (3), 344 (2017).
30. D. Bancroft, L. D. Williams, A. Rich, and M. Egli,
59.
E. Palecek, P. Boublikova, and P. Karlovsky, Gen.
Biochemistry 33, 1073 (1994).
Physiol. Biophys. 6 (6), 593 (1987).
31. B. Spingler, Inorg. Chem. 44, 831 (2005).
60.
Б. П. Уланов, Т. И. Маторина, А. И. Богуш и
32. B. Spingler and C. Da Pieve, Dalton Trans. 5 (9), 1637
Ю. М. Румянцев, Молекулярная генетика, микро-
(2005).
биология и вирусология 4, 26 (2002).
БИОФИЗИКА том 64
№ 5
2019
852
ЗАВАРЫКИНА и др.
61. В. И. Киселев и А. М. Поверенный, Молекуляр.
90. T. A. Brandt and B. L. Jacobs, J. Virol. 75, 850 (2003).
биология 21 (6), 1551 (1987).
91. S. Zhang, C. Lockshin, A. Herbert, et al., EMBO J. 11
62. S. I. Shin, S. Ham, J. Park, et al., DNA Research 23
(10), 3787 (1992).
(5), 477 (2016).
92. B. K. Ray, S. Dhar, A. Shakya, and A. Ray. Proc. Natl.
63. K. Kim, B. Khayrutdinov, C-K. Lee, et al., Proc. Natl.
Acad. Sci. USA.108 (1), 103 (2011).
Acad. Sci. USA 108 (17), 6921 (2011).
93. A. J. Groot and M. A. Vooijs, Adv. Exp. Med. Biol. 727,
64. A. Nordheim and A. Rich, Proc. Natl. Acad. Sci. USA
15 (2012).
80 (7), 1921 (1983).
94. B. K. Ray, S. Dhar, C. Henry, et al., Cancer Res. 73 (2),
65. A. Herbert and A. Rich, Genetica 106 (1-2), 37 (1999).
736 (2013).
66. G. P. Schroth, P. J. Chou, and P. S. Ho, J. Biol. Chem.
95. H. Liu and K. Zhao, Methods Enzymol. 377, 412
267 (17), 11846 (1992).
(2004).
67. A. Nordheim and A. Rich, Nature 303, 674 (1983).
96. R. Berezney and D. S. Coffey, Biochem. Biophys. Res.
68. B. K. Ray, S. Dhar, A. Shakya, and A. Ray, Proc. Natl.
Commun. 60 (4), 1410 (1974).
Acad. Sci. USA 108 (1), 103 (2011).
97. H. H. Heng, S. Goetze, C. J. Ye, et al., J. Cell Sci. 117,
69. L. Liu and J. C. Wang, Proc. Natl. Acad. Sci. USA 84,
999 (2004).
7024 (1987).
98. P. Krishna, B. P. Kennedy, D. M. Waisman, et al.,
70. S. Wolfl, B. Wittig, and A. Rich, Biochim. Biophys.
Proc. Natl. Acad. Sci. USA 87 (4), 1292 (1990).
Acta 126, 294 (1995).
99. G. Wang, K. M. Vasquez, Mutat. Res. 598 (1-2), 103
71. X. Du, D. Wojtowicz, A. A. Bowers, et al., Nucleic Ac-
(2006).
ids Res. 41 (12), 5965 (2013).
100.A. Bacolla and R. D. Wells, Mol. Carcinog. 48 (4), 273
72. P. Khuu, M. Sandor, J. DeYoung, and P. S. Ho, Proc.
(2009).
Natl. Acad. Sci. USA 104, 16528 (2007).
101. N. C. Popescu, Cancer Lett. 192, 1 (2003).
73. A. Herbert, Commun. Biol. 2, 7 (2019).
102.E. Kas and U. K. Laemmli, EMBO J. 11, 4973 (1992).
74. A. R. Lee, N. H Kim, Y. J. Seo, et al., Molecules 23
(11), (2018).
103.M. Hegde, S. Anitha, K. S. Latha, et al., J. Mol. Neu-
rosci. 22 (1-2), 19 (2004).
75. M. Schade, C. J. Turner, K. Lowenhaupt, et al., EMBO
J. 18 (2), 470 (1999).
104.P. Vasudevaraju, Bharathi, R. M. Garruto, et al., Brain
76. T. Schwartz, M. Rould, K. Lowenhaupt, et al., Science
Res. Rev. 58, 136 (2008).
284, 1841 (1999).
105.A. Suram, J. K. S. Rao, K. S. Latha, and M. A. Viswa-
77. A. Wittig, T. Dorbic, and A. Rich, J. Cell Biol. 108, 755
mitra, NeuroMol. Med. 2, 289 (2002).
(1989).
106.E. P. C. van der Vorst, C. Weber, and M. M. P. C. Don-
78. A. Herbert, K. Lowenhaupt, J. Spitzner, and A. Rich,
ners. Thromb. Haemost. 118 (7), 1167 (2018).
Proc. Natl. Acad. Sci. USA 92, 7590 (1995).
107. S. K. Ng, R. Weissbach, G. E. Ronson, and A. D. Sca-
79. A. Herbert, J. Alfken, Y. G. Kim, et al., Proc. Natl.
dden, Nucl. Acids Res. 41 (21), 9786 (2013).
Acad. Sci. USA 94, 8421 (1997).
108.G. I. Rice, P. R. Kasher, G. M. Forte, et al., Nat.
80. T. Schwartz, J. Behlke, K. Lowenhaupt, et al., Nat.
Ge et. 44 (11), 1243 (2012).
Struct. Biol. 8 (9), 761 (2001).
109.B. Szczesny, M. Marcatti, A. Ahmad, et al., Sci. Rep.
81. S. Rothenburg, T. Schwartz, F. Koch-Nolte, and F.
8 (1), 914 (2018).
Haag, Nucl. Acids Res. 30 (4), 993 (2002).
110. Е. Н. Имянитов и К. П. Хансон, Молекулярная он-
82. A. Takaoka, Z. Wang, M.K. Choi, et al., Nature 448
кология: клинические аспекты (СПбМАПО, СПб.,
(7152), 501 (2007).
2007).
83. R. J. Thapa, J. P. Ingram, K. B. Ragan, et al., Cell Host
111. B. Vogelstein and K. W. Riinzler, Nature Medicine 10
Microbe. 20 (5), 674 (2016).
(8), 789 (2004).
84. S .Kesavardhana, T. Kuriakose, C. S. Guy, et al., J.
112. S. B. Baylin, Proc. Am. Thorac. Soc. 9 (2), 64 (1998).
Exp. Med. 214 (8):2217 (2017).
113. V. Vongsutilers and P. M. Gannett, Org. Biomol.
85. M. de Rosa, S. Zacarias, and A. Athanasiadis, Nucl.
Chem. 16 (13), 2198 (2018).
Acids Res. 41 (21), 9924 (2013).
114. K. D. Robertson and P. A. Jones, Carcinogenesis 21
86. K. Kuś, K. Rakus, M. Boutier, et al., J. Biol. Chem. 290
(3), 461 (2000).
(52), 30713 (2015).
115. P. A. Jones, Nat. Rev. Genet. 13, 484 (2012).
87. S. Rothenburg, F. Koch-Nolte, A. Rich, and F. Haag,
Proc. Natl. Acad. Sci. USA 98, 8985 (2001).
116. S. Sharma, T. K. Kelly, and P. A. Jones, Carcinogene-
sis 31, 27 (2009).
88. Y-G. Kim, M. Muralinath, T. Brandt, et al., Proc.
Natl. Acad. Sci. USA 100 (12), 6974 (2003).
117. S. B. Baylin, J. G. Herman, J. R. Graff, et al., Adv.
Cancer Res. 72, 141 (1998).
89. Y-G. Kim, K. Lowenhaupt, D. B. Oh, et al., Proc.
Natl. Acad. Sci. USA 101 (6), 1514 (2004).
118. D. Hanahan and R.A. Weinberg, Cell 100, 57 (2000).
БИОФИЗИКА том 64
№ 5
2019
СТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА Z-ФОРМЫ ДНК
853
119. Г. П. Жижина, К. Е. Круглякова, И. Н. Тодоров и
123.G. Wang and K. M. Vasquez, Front. Biosci. 12, 4424
Н. М. Эмануэль, Успехи соврем. биологии 101 (1),
(2007).
3 (1986).
124.Г. П. Жижина и Т. М. Палиевская, Радиац. биол.
120.Г. П. Жижина, С. И. Скалацкая, Е. Ф. Бунина
Радиоэкология 43 (2), 147 (2003).
и др., Гематология и трансфузиология 28 (2), 9
125.Г. П. Жижина, Т. М. Заварыкина, Е. Б. Бурлакова
(1983).
и др., Радиац. биол. Радиоэкология 45 (1), 56
121. Г. П. Жижина, А. Б. Медина, А. С. Наваррете и
(2005).
Г. П. Троицкая, Биохимия 57 (11), 1627 (1992).
126.Г. П. Жижина, Т. М. Заварыкина, Е. М. Миль и
122.Г. П. Жижина, Е. Ф. Бунина, С. И. Скалацкая и
Е. Б. Бурлакова, Радиац. биол. Радиоэкология 47
В. А. Шарпатый, ДАН СССР 281 (6), 1466 (1985).
(4), 414 (2007).
The Structural and Functional Properties of Z-DNA
T.M. Zavarykina, M.V. Atkarskaya, and G.P. Zhizhina
Emanuel Institute of Chemical Physics, Russian Academy of Sciences, ul. Коsygina 4, Moscow, 119334 Russia
This review covers the stages of studying left-helical Z-DNA forms, from its opening in 1979 until the present
time. It is shown the repetitive nucleotide sequences capable to B-Z transition, and factors that initiate the
transition and stabilizing Z-DNA, including the non-histone proteins, which interact with the Z-sites. The
most important result of this research is to prove the presence of this form in eukaryotic DNA and its role in
the regulation of gene transcription. Also the assumption of Z-DNA participation in the induction of a num-
ber of human pathologies is expressed.
Keywords: DNA, Z-form, non-B-forms, Z-DNA-binding protein, regulation of transcription, genome instability
БИОФИЗИКА том 64
№ 5
2019