БИОФИЗИКА, 2019, том 64, № 5, с. 861-865
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ВЛИЯНИЕ СЕРДЕЧНОГО МИОЗИНСВЯЗЫВАЮЩЕГО БЕЛКА С
НА КАЛЬЦИЕВУЮ РЕГУЛЯЦИЮ АКТИН-МИОЗИНОВОГО
ВЗАИМОДЕЙСТВИЯ ЗАВИСИТ
ОТ ИЗОФОРМ ЛЕГКИХ ЦЕПЕЙ МИОЗИНА
© 2019 г. С.Р. Набиев, Г.В. Копылова, Д.В. Щепкин
Институт иммунологии и физиологии УрО РАН, 620049, Екатеринбург, ул. Первомайская, 106
E-mail: g_rodionova@mail.ru
Поступила в редакцию 21.06.2019 г.
После доработки 21.06.2019 г.
Принята к публикации 08.07.2019 г.
Кроме тропонина и тропомиозина, в регуляции актин-миозинового взаимодействия в миокарде
участвует белок cMyBP-C (сердечный миозинсвязывающий белок С), который влияет на функцию
миозина и активацию тонких нитей. В медленных скелетных мышцах экспрессируется та же самая
β-изоформа тяжелых цепей миозина, что и в миокарде, но миозин медленных скелетных мышц и
сердечный миозин отличаются изоформами легких цепей. Мы исследовали влияние cMyBP-C на
кальциевую регуляцию взаимодействия миозина медленной скелетной мышцы (m. soleus) с
актином, используя in vitro подвижную систему и оптическую ловушку. Обнаружено, что в
физиологической концентрации cMyBP-C увеличивал кальциевую чувствительность скорости
скольжения регулируемых тонких нитей по миозину из m. soleus и, в отличие от сердечного миозина,
увеличивал скорость тонких нитей. В оптической ловушке cMyBP-C не влиял на шаг миозина, но
уменьшал продолжительность одиночного актин-миозинового взаимодействия, что объясняет
увеличение скорости нитей в in vitro подвижной системе. Таким образом, cMyBP-C по-разному
проявляет свои регуляторные свойства в зависимости от изоформного состава легких цепей
миозина.
Ключевые слова: миозин, актин-миозиновое взаимодействие, сердечный миозинсвязывающий белок С,
оптическая ловушка, in vitro подвижная система.
DOI: 10.1134/S0006302919050041
C7-C10) связывает стержневую часть молекулы
Сокращение поперечнополосатых мышц яв-
миозина [9]; N-конец (домены C1 и C2) - суб-
ляется результатом взаимодействия толстых мио-
фрагмент 2 миозина [10-12], а домен C0 - регуля-
зиновых нитей с тонкими нитями, состоящими
торную легкую цепь миозина [10,13]. N-концевые
из актина и регуляторных белков тропонина и
домены (C0-C2) и линкерные участки между ни-
тропомиозина. Кроме тропонина и тропомиози-
ми связывают актин [14-17]. Показано, что домен
на, в регуляции актин-миозинового взаимодей-
C1 может взаимодействовать с тропомиозином
ствия в миокарде принимает участие сердечный
[18]. Взаимодействие N-концевых доменов
миозинсвязывающий белок С (cMyBP-C) [1-7].
cMyBP-C с белками тонкой нити модулирует ее
Этот белок располагается в С-зоне в области пе-
активацию [19-22], тем самым cMyBP-C влияет
рекрытия толстых и тонких нитей саркомера кар-
на сократимость миокарда, особенно при фофо-
диомиоцита [8]. cMyBP-C имеет стержнеобраз-
рилировании, вызванном β-адренергической
ную форму, его длина - 48 нМ, молекулярная
стимуляцией [23-26].
масса - около 140-150 кДа. Молекула cMyBP-C
В экспериментах на мышечных волокнах об-
состоит из восьми иммуноглобулиновых и трех
наружено, что cMyBP-C увеличивает кальциевую
фибронектиновых доменов от С0 на N-конце до
чувствительность зависимости
«рСа
- сила»
С10 на С-конце. cMyBP-C взаимодействует с
[27,28]. С помощью in vitro подвижной системы
миозином в нескольких местах: C-конец (домены
(ИПС) показано, что добавление как полнораз-
мерного cMyBP-C, так и его N-концевых доме-
Сокращения: cMyBP-C - сердечный миозинсвязывающий
белок С, ИПС - in vitro подвижная система, ELC -
нов увеличивает кальциевую чувствительность
«существенная» легкая цепь.
скорости скольжения тонких нитей по миозину
861
862
НАБИЕВ и др.
[29-31], а также уменьшает максимальную ско-
25 мМ имидазола, 4 мМ MgCl2, 1 мМ ЭГТА,
рость скольжения нитей как по скелетному мио-
10 мМ ДТТ, pH 7,5), содержащем 80 мМ KCI, и
зину и его протеолитическим субфрагментам
диализовали против этого же буфера.
[29,30], так и по сердечному миозину [31].
Чистоту полученных белков и изоформный
В медленных скелетных мышцах экспрессиру-
состав тяжелых и легких цепей миозина проверя-
ется та же самая β-изоформа тяжелых цепей мио-
ли с помощью вертикального денатурирующего
зина, что и в миокарде. Миозин из медленных
гель-электрофореза [31].
скелетных мышц содержит изоформы «суще-
Эксперименты в оптической ловушке и в in vitro
ственной» (ELC) легкой цепи, характерные для
подвижной системе проводили, как описано ранее
медленных скелетных мышц. В связи с тем, что
[31,36,38]. С помощью оптической ловушки из-
cMyBP-C взаимодействует с регуляторной легкой
мерили шаг миозина и продолжительность ак-
цепью, а легкие цепи принимают участие в сило-
тин-миозинового взаимодействия. В in vitro по-
генерации миозина, можно предположить, что
движной системе (ИПС) исследовали влияние
эффект cMyBP-C на взаимодействие с тонкой
cMyBP-C на кальциевую зависимость скорости
нитью сердечного миозина и миозина из медлен-
скольжения тонких нитей. cMyBP-C добавляли в
ных скелетных мышц будет различен. Мы иссле-
проточную ячейку вместе с миозином. Концен-
довали влияние cMyBP-C на кальциевую регуля-
трации миозина и cMyBP-C, загружаемых в про-
цию взаимодействия миозина медленной скелет-
точную камеру в экспериментах в ИПС, состав-
ной мышцы (m. soleus) с актином, используя
ляли соответственно 300 мкг/мл (0,65 мкМ) и
in vitro подвижную систему и оптическую ло-
20 мкг/мл (0,13 мкМ), а в оптической ловушке -
вушку.
5 мгк/мл (0,011 мкМ) и 0,33 мкг/мл (0,002 мкМ),
что соответствует их отношению в мышце.
МАТЕРИАЛЫ И МЕТОДЫ
Кальциевую зависимость скорости скольже-
ния тонких нитей аппроксимировали уравнени-
Получение белков. Миозин выделяли из m. so-
ем Хилла: V = Vmax(1 + 10h(pCa-pCa50))-1, где V и
leus кроликов по методу, описанному в работе
[32]. Миозин содержал преимущественно мед-
Vmax - соответственно скорость и максимальная
ленную изоформу I тяжелых цепей миозина и
скорость скольжения тонких нитей при насыща-
изоформы легких цепей, соответствующие мед-
ющей концентрации кальция; pCa50 (кальциевая
ленному скелетному миозину. Актин получали из
чувствительность) - значение, при котором до-
m. psoas кролика по стандартной методике [33].
стигается полумаксимальная скорость скольже-
Мономерный G-актин полимеризовали, увели-
ния филаментов; h - коэффициент кооператив-
чивая концентрации KCl до 100 мМ, АТФ - до
ности Хилла.
2 мМ и MgCl2 - до 4 мМ. Тропонин и тропомио-
зин экстрагировали из левого желудочка сердца
быка [34,35]. Регулируемые тонкие нити, содер-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
жащие F-актин, тропомиозин и тропонин, ре-
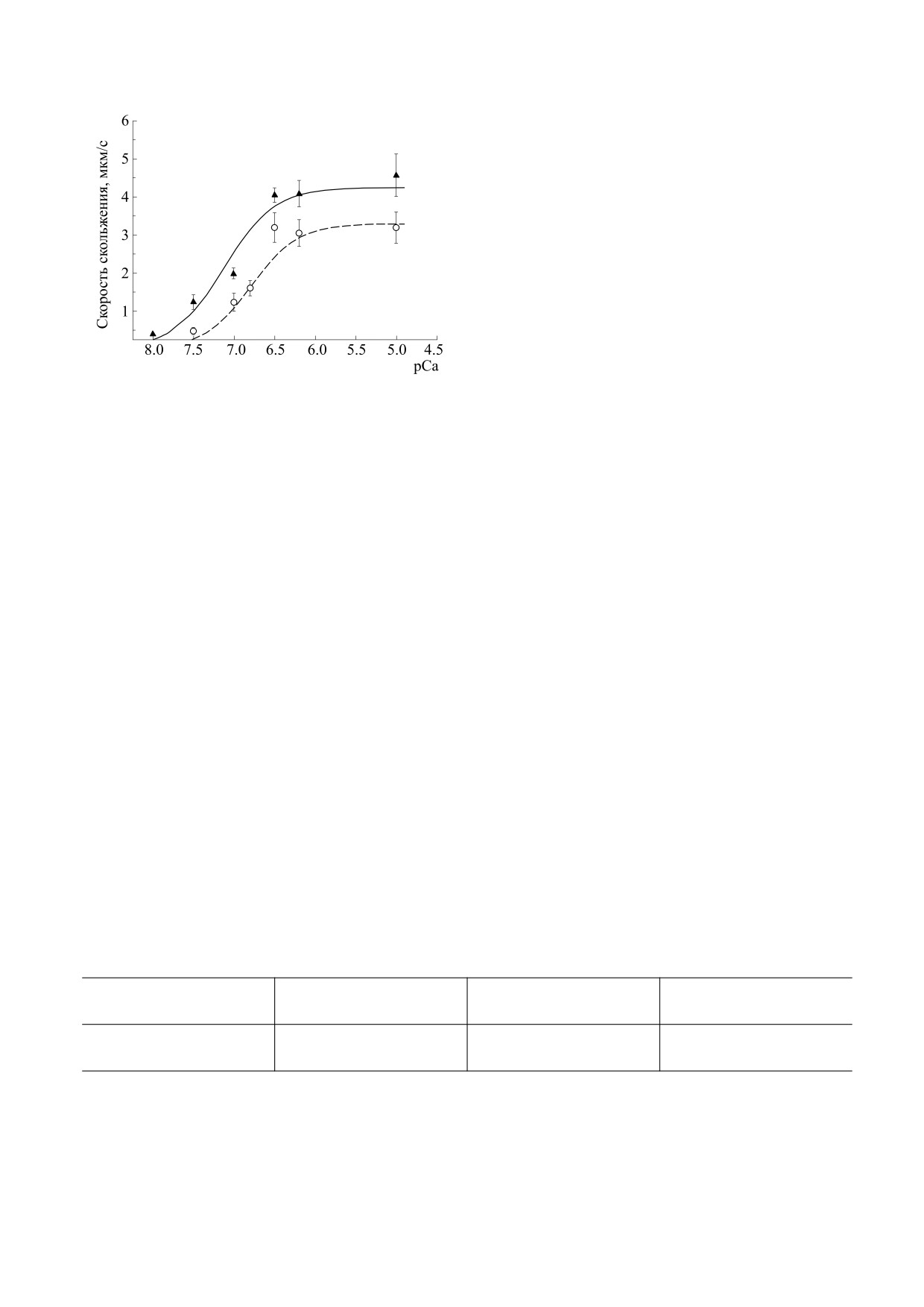
Влияние cMyBP-C на кальциевую регуляцию
конструировали прямо в проточной ячейке [36].
взаимодействия миозина из m. soleus с актином. Для
cMyBP-C выделяли из куриных сердец по ме-
исследования влияния cMyBP-C на кальциевую
тоду, описанному в работе [37], с небольшими
регуляцию взаимодействия миозина из медлен-
модификациями [31]. После экстракции cMyBP-
ной мышцы с актином мы проанализировали
C осаждали сульфатом аммония до финального
кальциевую зависимость скорости скольжения
насыщения 55% и растворяли в буфере, содер-
тонких нитей в ИПС (рис. 1). Обнаружено, что
жавшем 70 мМ KC1, 10 мМ MES, 2 мМ NaN3,
влияние cMyBP-C на зависимость «рСа - ско-
0,1 мМ ЭДТА, 3 мМ 2-меркаптоэтанола, pH 6,45,
рость» миозина из m. soleus и сердечного миозина
затем диализовали против этого же буфера. После
[31] существенно различается. cMyBP-C не влиял
диализа cMyBP-C очищали с помощью жидкост-
на коэффициент кооперативности Хилла зависи-
ной хроматографии на пятимиллилитровой ко-
мости «рСа - скорость» миозина из медленной
лонке HiTrap Q HP (AKTA basic 10 FPLC, Amersh-
мышцы, увеличивал ее кальциевую чувствитель-
am Biosciences, США) с линейным градиентом
ность и скорость скольжения тонких нитей при
от 70 до 300 мМ NaC1 в буфере следующего со-
всех концентрациях кальция (рис. 1; табл. 1). Ра-
става: 10 мМ MES, 2 мМ NaN3, 0,1 мМ ЭДТА,
нее для сердечного миозина было показано, что
cMyBP-C уменьшает максимальную скорость
3 мМ 2-меркаптоэтанола, pH 6,45. cMyBP-C, ко-
скольжения тонких нитей и коэффициент коопе-
торый сходил с колонки в области 90-130 мМ по
ративности Хилла, но увеличивает кальциевую
NaCl, концентрировали добавлением сульфата
чувствительность скорости [31].
аммония с последующим центрифугированием
при
15000 g в течение
15 мин. Осажденный
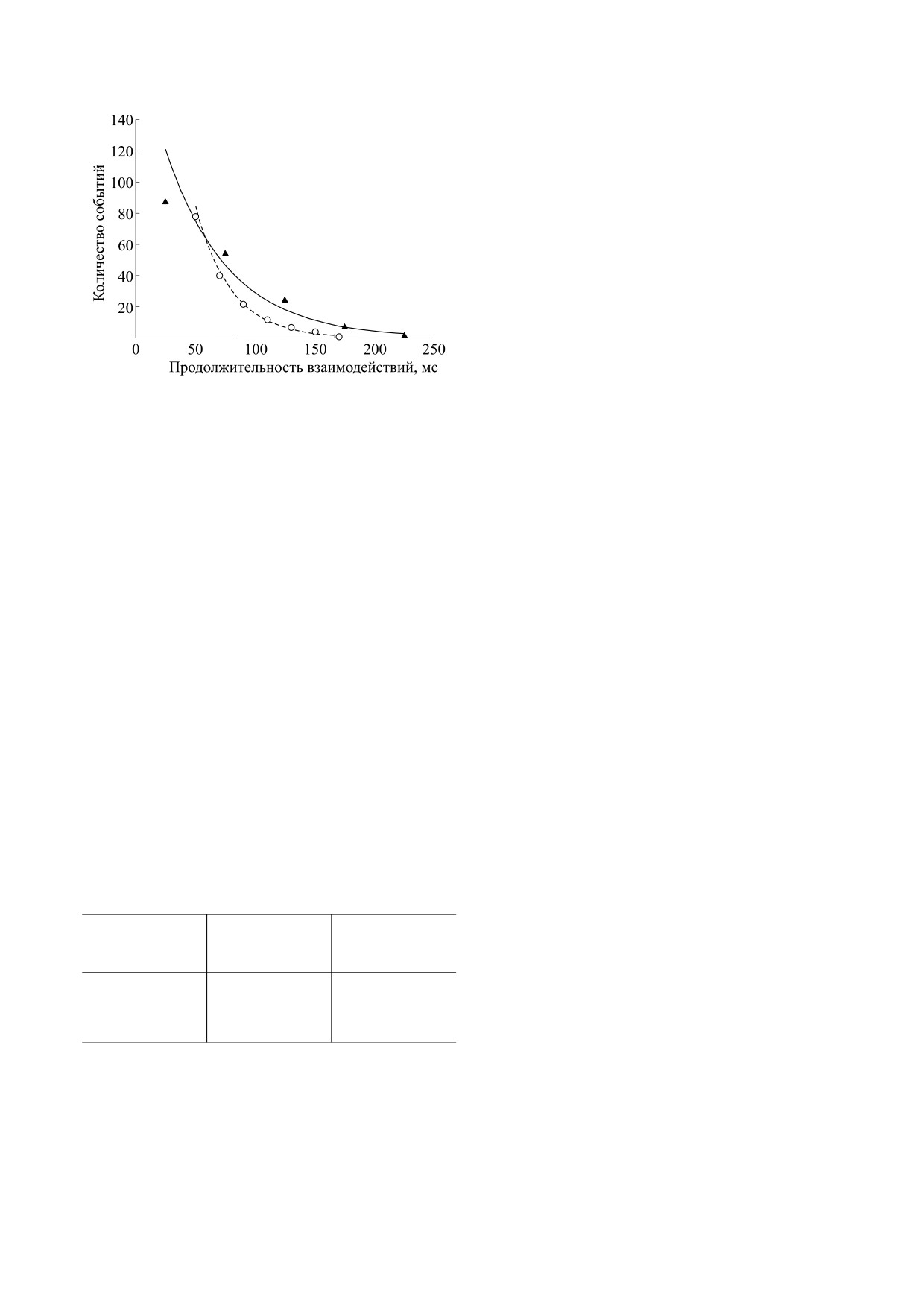
Влияние cMyBP-C на характеристики одиноч-
cMyBP-C растворяли буфером АВ (25 мМ KCl,
ного взаимодействия миозина с актином. С помо-
БИОФИЗИКА том 64
№ 5
2019
ВЛИЯНИЕ СЕРДЕЧНОГО МИОЗИНСВЯЗЫВАЮЩЕГО БЕЛКА С
863
собен связываться с регуляторной легкой цепью
сердечного миозина [13], при этом фрагмент C1-
C2 взаимодействует с субфрагментом 2 миозина
[10-12]. Это может менять ориентацию головок
миозина [13], влияя на их взаимодействие с акти-
ном, которое зависит от изоформ легких цепей
миозина. Известно, например, что предсердная
изоформа ELC - aELC, в отличие от желудочко-
вой vELC, не взаимодействует с актином и что
экспрессия aELC в миокарде желудочков крыс
приводит к изменению сократительных характе-
ристик миокарда [40,41]. На изолированных мы-
шечных белках показано, что кинетика взаимо-
действия головки миозина с актином различается
для изоформ миозина, содержащих aELC и vELC
[38, 42]. Поэтому важно исследовать влияние изо-
форм легких цепей на взаимодействие cMyBP-C с
Рис. 1. Влияние cMyBP-C на кальциевую зависи-
мость скорости скольжения тонких филаментов по
миозином. Для изучения этого влияния мы ис-
миозину, выделенному из медленной скелетной
пользовали медленный скелетный миозин и
мышцы (m. soleus), без cMyBP-C (треугольники) и в
сравнили полученные данные с результатами ис-
присутствии cMyBP-C при соотношении cMyBP-C :
следований на сердечном миозине. Медленный
миозин, равном 1 : 5 (кружки). Скорость представле-
скелетный миозин содержит в своем составе ту же
на как среднее значение ± стандартное отклонение
по трем экспериментам. Линия регрессии соответ-
β-цепь, кодируемую геном MYH7, что и сердеч-
ствует уравнению Хилла, значения параметров урав-
ный миозин. В составе медленного скелетного
нения Хилла представлены в табл. 1.
миозина кролика имеются легкие цепи LC1sa,
LC1sb и sLC2 [43,44]. LC1sb и sLC2 экспрессиру-
ются также в миокарде [44,45]. Медленный ске-
щью оптической ловушки были измерены вели-
летный миозин представляет собой смесь двух ти-
чина шага миозина и продолжительность его вза-
пов миозинов, содержащих в своем составе либо
имодействия с F-актином. Обнаружено, что
LC1sa, либо LC1sb. Показано, что волокна с пре-
cMyBP-C не влияет на размер шага миозина, но
имущественным содержанием LC1sa генерирова-
уменьшает продолжительность его взаимодей-
ли большие силы и обладали меньшей скоростью
ствия с актином в 1,7 раза (рис. 2; табл. 2), что мо-
ненагруженного укорочения, чем волокна с
жет объяснять увеличение скорости скольжения
LC1sb [44].
нитей по миозину из медленной мышцы, так как
Наши результаты показали, что из-за наличия
скорость скольжения нитей в ИПС обратно про-
специфической изоформы LC1sa, регуляторный
порциональна продолжительности актин-миози-
эффект cMyBP-C отличается для медленного ске-
нового взаимодействия [39].
летного и сердечного миозина, и cMyBP-C сокра-
Взаимодействие cMyBP-C с миозином, а
щает время одиночного взаимодействия миозна
из m. soleus с актином. Результаты, полученные в
именно с его регуляторной легкой цепью, может
объяснить различие его эффектов на характери-
ИПС, можно объяснить тем, что cMyBP-C умень-
шает время присоединенного к актину состоя-
стики кальциевой регуляции взаимодействия
ния, благодаря чему увеличивается скорость
сердечного миозина и миозина из m. soleus с акти-
скольжения тонких нитей.
ном. C помощью ядерного магнитного резонанса
и дифференциальной сканирующей калоримет-
Таким образом, cMyBP-C оказывает суще-
рии было показано, что домен C0 в cMyBP-C спо-
ственное влияние на кальциевую регуляцию вза-
Таблица 1. Влияние cMyBP-C на характеристики зависимости «рСа - скорость»
Концентрация
pCa50
h
Vmax, мкм/с
cMyBP-C, мкМ
0
3.2 ± 0.2
6.80 ± 0.01
1.49 ± 0.08
0.13
4.2 ± 0.2*
7.13 ± 0.08*
1.39 ± 0.07
Примечание. V и Vmax - скорость и максимальная скорость скольжения тонких филаментов при насыщающей концентрации
кальция соответственно; pCa50 (кальциевая чувствительность) - значение, при котором достигается полумаксимальная ско-
рость скольжения филаментов; h - коэффициент кооперативности Хилла. Символом * обозначены отличия параметров урав-
нения Хилла зависимости «рСа - скорость», полученной в присутствии cMyBP-C, от значений зависимости «рСа - ско-
рость» без cMyBP-C (р < 0,05).
БИОФИЗИКА том 64
№ 5
2019
864
НАБИЕВ и др.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена при финансовой поддержке
Российского фонда фундаментальных исследова-
ний (грант № 18-04-20085) и Программы AAAA-
A18-118020590135-3.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Все применимые международные, националь-
ные и институциональные принципы ухода и ис-
пользования животных при выполнении работы
были соблюдены.
СПИСОК ЛИТЕРАТУРЫ
1. G. Offer, C. Moos, and R. Starr, J. Mol. Biol. 74, 653
(1973).
Рис. 2. Распределение продолжительности одиноч-
ных взаимодействий миозина с актином без cMyBP-
2. P. A.Hofmann, H. C. Hartzell, and R. L. Moss, J. Gen.
C (треугольники) и в присутствии cMyBP-C при соот-
Physiol. 97, 1141 (1991).
ношении cMyBP-C : миозин, равном 1 : 5 (кружки).
3. S. P. Harris, C. R. Bartley, T. A. Hacker, et al., Circ.
Res. 90, 594, (2002).
4. F. S. Korte, K. S. McDonald, S. P. Harris, and
имодействия миозина из медленной скелетной
R. L. Moss, Circ. Res. 93, 752, (2003)
мышцы с актином, а также на продолжитель-
5. O. Cazorla, S. Szilagyi, N. Vignier, et al., Cardiovasc.
ность актин-миозинового взаимодействия. Эф-
Res. 69, 370 (2006).
фекты cMyBP-C на кальциевую регуляцию взаи-
6. T. J. Herron, E. Rostkova, G. Kunst, et al., Circ. Res.
модействия сердечного миозина и миозина из
98, 1290 (2006).
медленной скелетной мышцы с актином различа-
7.
7. W. Saber, K. J. Begin, D. M. Warshaw, P and. Van-
ются, что может объясняться отличием изоформ-
Buren, J. Mol. Cell. Cardiol. 44, 1053 (2008).
ного состава легких цепей этих миозинов, т.е. ре-
8. P. Bennett, R. Craig, R. Starr, and G. Offer, J. Mus-
гуляторные свойства cMyBP-C зависят от изо-
cle Res. Cell. Motil. 7, 550 (1986).
форм миозина.
9. E. Flashman, C. Redwood, J. Moolman-Smook,
and H.Watkins, Circ. Res. 94, 1279 (2004).
10. R. Starr and G. Offer, Biochem. J. 171, 813 (1978).
11. M. Gruen and M. Gautel, J. Mol. Biol. 286, 933
БЛАГОДАРНОСТИ
(1999).
12. M. S. Bhuiyan, P. McLendon, J. James, et al.,
Авторы благодарят С.Ю. Бершицкого за кон-
Pflugers Arch. 468, 1685 (2016).
структивные предложения при работе над тек-
13. J. Ratti, E. Rostkova, M. Gautel, and M. Pfuhl, J.
стом рукописи.
Biol. Chem. 286, 12650 (2011).
Работа выполнена с использованием оборудо-
14. J. M. Squire, P. K. Luther, and C. Knupp, J. Mol.
Biol. 331, 713 (2003).
вания ЦКП ИИФ УрО РАН.
15. C. Moos, C. M. Mason, J. M. Besterman, et al., J. Mol.
Biol. 124, 571 (1978).
Таблица 2. Влияние cMyBP-C на характеристики оди-
16. A. Orlova, V. E. Galkin, C. M. Jeffries, et al., J. Mol.
ночного актин-миозинового взаимодействия
Biol. 412, 379 (2011).
17. A. Weith, S. Sadayappan, J. Gulick, et al., J. Mol.
Концентрация
Cell. Cardiol. 2012 Jan;52(1):219-27.
d, нм
t, мс
cMyBP-C, мкМ
18. S. P. Harris, B. Belknap, R. E. Van Sciver, et al., Proc.
Natl. Acad. Sci. USA 113, 1558 (2016).
0
10 ± 4 (279)
52.6 ± 7.0
19. J. Y. Mun, M. J. Previs, H. Y. Yu, et al., Proc. Natl.
Acad. Sci. USA 111, 2170 (2014).
0.13
9 ± 3 (233)
29.8 ± 5.4*
20. T. Kampourakis, Z. Yan, M. Gautel, et al., Proc. Natl.
Acad. Sci. USA 111, 18763 (2014).
Примечание. d - Размер шага, представлен как среднее ± SD;
21. M. J. Previs, J. Y. Mun, A. J. Michalek, et al., Proc.
t - продолжительность взаимодействия, представлена как
Natl. Acad. Sci. USA 113, 3239 (2016).
среднее ± SEM. В скобках указано количество проанализи-
22. C. Risi, B. Belknap, E. Forgacs-Lonart, et al., Struc-
рованных взаимодействий. Символом * обозначено стати-
ture 26, 1604 (2018).
стически значимое отличие продолжительности взаимодей-
ствия с cMyBP-C от миозина без cMyBP-C. Достоверность
23. S.Sadayappan, J. Gulick, H. Osinska, et al., Circ. Res.
оценивали по t-тесту Стьюдента на уровне р < 0,05.
109, 141 (2011).
БИОФИЗИКА том 64
№ 5
2019
ВЛИЯНИЕ СЕРДЕЧНОГО МИОЗИНСВЯЗЫВАЮЩЕГО БЕЛКА С
865
24. C. W.Tong, X. Wu, Y. Liu, et al., Circ. Heart Fail. 8,
34. J. D. Potter, Methods Enzymol. 85, 241 (1982).
595 (2015).
35. L. B. Smillie, Methods Enzymol. 85, 234 (1982).
25. K. S.Gresham, R. Mamidi, J. Li, et al., J. Appl. Physi-
36. A. M. Matyushenko, D. V. Shchepkin, G. V. Kopy-
ol. 122, 520 (2017).
lova, et al., Biochemistry 56, 250 (2017).
26. R. Mamidi, K. S. Gresham, J. Li, and J. E. Stelzer, Sci.
37. H. C. Hartzell, J. Biol. Chem. 259, 15587 (1984).
Adv. 3, e1602445 (2017).
38. G. Kopylova, S. Nabiev, L. Nikitina, et al., Biochem.
27. C. C. Witt, B. Gerull, M. J. Davies, et al., J. Biol.
Biophys. Res. Commun. 476, 648 (2016).
Chem. 276, 5353 (2017).
39. K. A. Palmiter, M. J. Tyska, D. E. Dupius, et al., J.
28. O. Cazorla, S. Szilagyi, N. Vignier, et al., Cardio-
Physiol. 519, 669 (1999).
vasc. Res. 69, 370 (2016).
40. M. C. Schaub, M. A. Hefti, R. A. Zuellig, and I. Mora-
29. M. V. Razumova, J. F. Shaffer, A. Y. Tu, et al., J. Bi-
no, Cardiovasc. Res. 37, 381 (1998).
ol. Chem. 281, 35846 (2006).
41. K. Kazmierczak, Y. Xu, M. Jones, et al., J. Mol. Biol.
30. W. Saber, K. J. Begin, D. M. Warshaw, and P. Van-
387, 706 (2009).
Buren, J. Mol. Cell. Cardiol. 44, 1053 (2006).
42. H. Yamashita, S. Sugiura, H. Fujita, et al., Cardiovasc.
31. D. V. Shchepkin, G. V. Kopylova, L. V. Nikitina, et
Res. 60, 580 (2003).
al., Biochem. Biophys. Res. Commun. 401,
159
43. O. Andruchov, O. Andruchova, Y. Wang, and S. Galler,
(2010).
J. Physiol. 571, 231 (2006).
32. S. S. Margossian and S. Lowey, Methods Enzymol. 85,
44. P. J. Reiser, S. Bicer, Arch. Biochem. Biophys. 456, 112
55 (1982).
(2006).
33. J. D. Pardee and J. A. Spudich, Methods Enzymol.
45. F. Sheikh, R. C. Lyon, and J. Chen, Gene 569, 14
85, 164 (1982).
(2015).
The Effect of Cardiac Myosin-Binding Protein C on Calcium Regulation
of the Actin-Myosin Interaction Depends on Myosin Light Chain Isoforms
S.R. Nabiev, G.V. Kopylova, and D.V. Shchepkin
Institute of Immunology and Physiology, Ural Branch of Russian Academy of Sciences,
Pervomayskaya ul. 106, Yekaterinburg, 620049 Russia
In addition to troponin and tropomyosin, cMyBP-C (cardiac myosin-binding protein C) that has an effect
on the function of myosin and thin filament activation, is involved in regulation of the actin-myosin interac-
tion in the myocardium., The β-myosin heavy chains isoform expressed in slow skeletal muscles is identical
to that in the myocardium, but myosin isoforms in slow skeletal muscles and in cardiac muscle differ in the
composition of myosin light chain isoforms. We investigated the effect of cMyBP-C on calcium regulation of
the interaction of slow skeletal muscle myosin (m. soleus) with actin, using an in vitro motility assay and an
optical trap. It was found that physiological concentration of cMyBP-C resulted in increased calcium sensi-
tivity of the sliding velocity of regulated thin filaments over myosin extracted from slow soleus muscle, and as
opposed to cardiac myosin, increased the speed of thin filaments. In the optical trap, cMyBP-C did not affect
the step size of myosin but reduced the duration of a single actin-myosin interaction, thereby explaining
the increase in the velocity of filaments in the in vitro motility assay. Thus, the regulatory properties of
cMyBP-C are exhibited in different ways depending on the composition of myosin light chain isoforms.
Keywords: myosin, actin-myosin interaction, cardiac myosin-binding protein C, optical trap, in vitro motility assay
БИОФИЗИКА том 64
№ 5
2019