БИОФИЗИКА, 2019, том 64, № 5, с. 869-882
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.61.66
АМПЕРОМЕТРИЧЕСКИЕ МУЛЬТИФЕРМЕНТНЫЕ БИОСЕНСОРЫ:
РАЗРАБОТКИ И ПРИМЕНЕНИЕ (КРАТКИЙ ОБЗОР)
© 2019 г. С.Ж. Ибадуллаева*, Н.О. Аппазов*, Ю.С. Тараховский**, Е.А. Замятина**,
М.Г. Фомкина**, Ю.А. Ким***
*Кызылординский государственный университет им. Коркыт Ата,
120008, Кызылорда, ул. Айтеке Би, 29А, Казахстан
**Институт теоретической и экспериментальной биофизики РАН,
142290, Пущино Московской области, ул. Институтская, 3
***Институт биофизики клетки РАН - обособленное подразделение ФИЦ ПНЦБИ РАН,
142290, Пущино Московской области, ул. Институтская, 3
E-mail: yuk01@rambler.ru
Поступила в редакцию 23.07.2019 г.
После доработки 23.07.2019 г.
Принята к публикации 02.08.2019 г.
В последнее десятилетие был достигнут значительный прогресс в разработке ферментных биосен-
соров, которые находят применение в фармакологии, клинической практике, в сельском хозяйстве,
в контроле качества пищевых продуктов, мониторинге возбудителей инфекционных заболеваний и
распространении факторов загрязнения окружающей среды. Функционирование амперометриче-
ских мультиферментных биосенсоров основано на природных механизмах распознавания. Для по-
вышения эффективности конструкция биосенсора должна позволять анализируемым веществам
беспрепятственно взаимодействовать с ферментами, участвующими в каталитических реакциях,
что требует знаний как о свойствах исследуемой среды, так и о свойствах самих анализируемых ве-
ществ. Для выявления, распознавания и оценки концентрации веществ в среде требуется также
учитывать факторы, способные подавлять или искажать сигнал, что может быть связано с взаимо-
действием компонентов биосенсора друг с другом и с молекулами исследуемой среды. Указанные
факторы могут меняться не только в процессе хранения или после многократного использования
биосенсора, но также в течение единичного измерения. В процессе развития измерительной техни-
ки были достигнуты значительные успехи в совершенствовании конструкции биосенсоров. В обзо-
ре рассматривается развитие наиболее интересных и перспективных тенденций в развитии амперо-
метрических мультиферментных биосенсоров, наметившихся в последние годы.
Ключевые слова: биосенсор, мультиферментные комплексы, каскадная реакция, метаболиты.
DOI: 10.1134/S0006302919050065
ферментов, которые обеспечивают прохождение
Мультиферментные биосенсоры - это разно-
мультиферментных каскадных реакций. По ряду
видность ферментных биосенсоров, в которых
показателей использование мультиферментных
система распознавания состоит из двух и более
ферментов, использующих каскады фермента-
каскадных реакций в биосенсорах обладает зна-
тивных реакций [1-6]. Их появление было вызва-
чительным преимуществом над биосенсорами,
но потребностью увеличить чувствительность,
содержащими только один фермент [7]. Мульти-
селективность и диапазон анализируемых ве-
ферментные биосенсоры находят широкое прак-
ществ. В некоторых случаях биосенсоры, осно-
тическое применение в фармакологии и клини-
ванные на одном ферменте, не могут быть приме-
ческой диагностике [5,6,8,9], анализе пищевых
нены для обнаружения анализируемого соедине-
продуктов [10-14], мониторинге окружающей
ния. Поэтому исследователи используют в
среды [15,16]. Разработаны электрохимические
биосенсорах системы, состоящие из нескольких
биосенсоры для количественной оценки концен-
трации биохимических метаболитов [7]. Ранняя
диагностика заболеваний, например, болезней
Сокращения: НАД+ - никотинамидадениндинуклеотид,
НАДН - восстановленная форма никотинамидаденинди- Паркинсона и Альцгеймера, диабета и различных
нуклеотида, Хол.Окс. - холестериноксидаза, Хол.Эст. -
типов рака, а также мониторинг реакции пациен-
холестеринэстераза, PtNP - наночастицы платины, ITO -
оксид индия и олова, ПРХ - пероксидаза хрена.
тов на терапию играют решающую роль в лечении
869
870
ИБАДУЛЛАЕВА и др.
Рис. 1. Основные принципы устройства биосенсоров. Заимствовано с изменениями из работы [26].
болезней. В пищевой промышленности анализ
ваются, после чего они подлежат анализу, визуа-
питательных веществ в продуктах имеет важное
лизации и хранению.
значение для контроля качества. Глюкан, L-лак-
тат [17], полифенол [18] и сульфиты [19] являются
АМПЕРОМЕТРИЧЕСКИЕ БИОСЕНСОРЫ
типичными целевыми аналитами для мультифер-
ментных биосенсоров в анализе пищевых про-
Биосенсоры, работа которых основана на ис-
дуктов.
пользовании электрохимических реакций, влия-
Биосенсоры, в которых используются углерод-
ющих на величину электрического тока в систе-
ме, называются амперометрическими. В послед-
ные наноматериалы, стали важными инструмен-
ние годы ведутся обширные исследования в этой
тами в распознавании биомаркеров, в которых
области. Создано большое разнообразие биосен-
электродный материал и архитектура играют ре-
соров, которые условно можно разделить как ми-
шающую роль. Благодаря превосходным механи-
ческим, электронным и оптическим свойствам
нимум на три поколения в соответствии со спосо-
бом переноса электронов, используемых в их
углеродные наноматериалы в форме листов, ча-
конструкции.
стиц или точек, трубок или проволок в последнее
время стали незаменимыми элементами биосен-
В первом поколении амперометрических био-
сорных платформ [20-25]. В представленном
сенсоров фермент иммобилизован на поверхно-
кратком обзоре обсуждаются основные принци-
сти пробразователя, который способен обнару-
пы разработки биосенсоров на основе каскадных
жить превращение субстрата в электроактивный
мультиферментных реакций и их применение на
продукт в результате чего образуется перекись во-
практике.
дорода (рис. 2). В процессе окислительно-восста-
новительной реакции электроны переносятся к
кислороду, в результате чего изменяется концен-
ПРИНЦИПЫ РАБОТЫ БИОСЕНСОРОВ
трация перекиси водорода, что можно обнару-
жить по величине электрического тока. Благода-
В основе устройства биосенсоров лежит есте-
ря этому осуществляется измерение концентра-
ственная способность антител и ферментов рас-
ции анализируемых соединений [7,31,32].
познавать различные молекулы, растворенные в
окружающей среде или в жидкостях внутри жи-
Обычно используются два основных класса
вотных и растений, включая клетки и ткани. При
ферментов - оксидазы и дегидрогеназы. У этих
создании биосенсоров используются детекторы,
ферментов в качестве кофермента используются
позволяющие преобразовывать сигнал распозна-
никотинамидадениндинуклеотид (НАД+) или
вания в физические или химические процессы,
никотинамиддинуклеотидфосфат, аденозинтри-
которые могут быть зарегистрированы специали-
фосфат, флавинадениндинуклеотид, а также его
зированными детекторами, предназначенными
восстановленная форма, которые подвергаются
для преобразования регистрируемых изменений
циклическим процессам окисления-восстанов-
в электрический ток (рис. 1).
ления, необходимым для обеспечения процессов
измерения.
При выделении тепла используются калори-
метрические детекторы в калориметрических
В биосенсорах первого поколения, основан-
биосенсорах [27], при перемещении зарядов -
ных на использовании оксидаз, наиболее распро-
электрохимические детекторы в электрохимиче-
страненным кофактором является флавинаде-
ских биосенсорах [28], при выделении квантов
ниндинуклеотид. Эти биосенсоры могут отсле-
света - электроннооптические детекторы в опти-
живать продуцирование перекиси водорода,
ческих биосенсорах [29], а при возникновении
используя потенциал на аноде +0,7 В против
механических воздействий - пьезоэлектрические
хлорсеребрянного электрода (Ag/AgCl), или по-
детекторы в пьезоэлектрических биосенсорах
требление кислорода, используя потенциал на
[30]. Полученные электрические сигналы усили-
катоде -0,7 В против Ag/AgCl. Эти биосенсоры
БИОФИЗИКА том 64
№ 5
2019
АМПЕРОМЕТРИЧЕСКИЕ МУЛЬТИФЕРМЕНТНЫЕ БИОСЕНСОРЫ
871
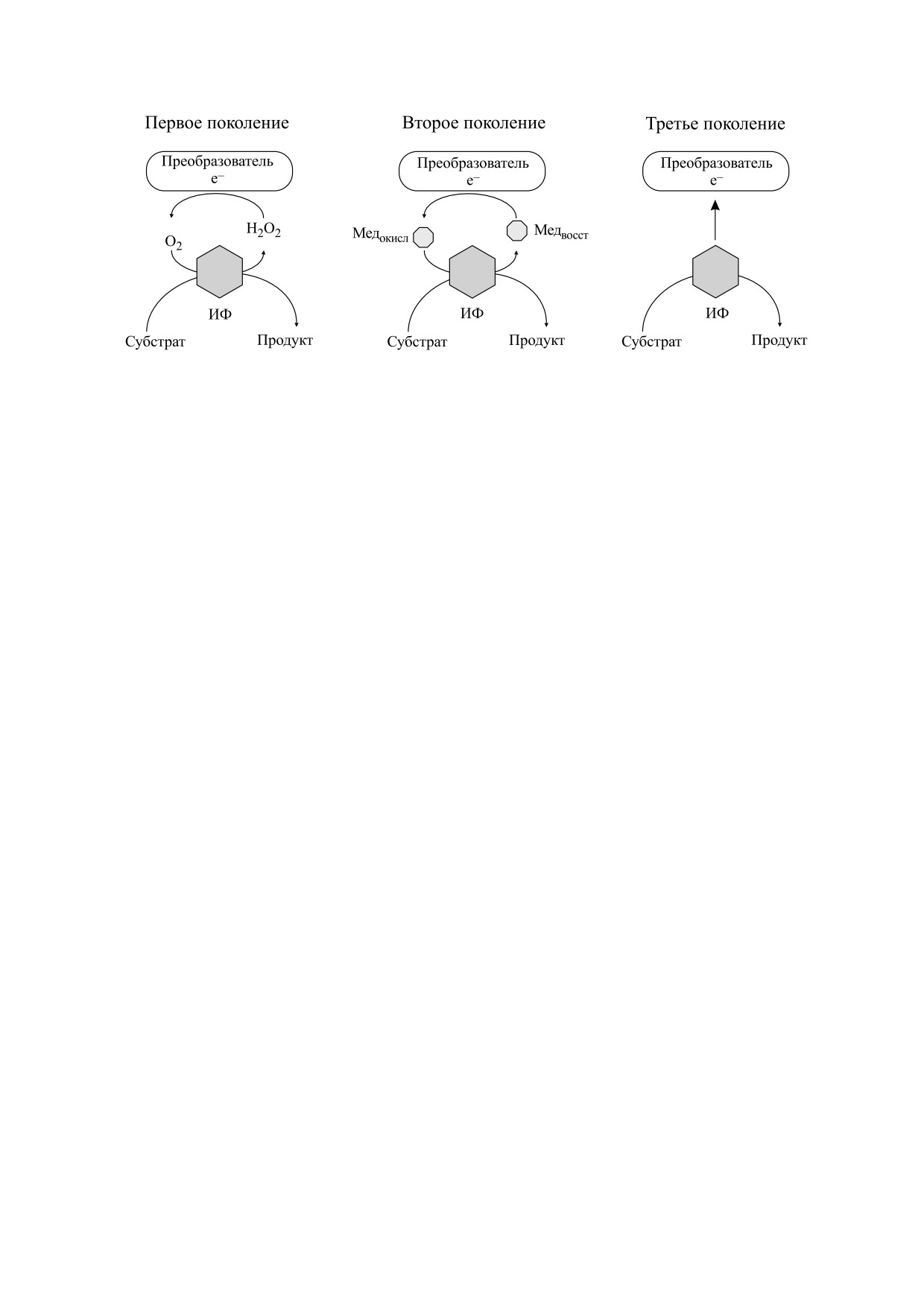
Рис. 2. Схематическое изображение трех поколений амперометрических ферментных биосенсоров, преобразующих
сигнал от иммобилизованных ферментов (ИФ) в электрический ток. В первом поколении использованы процессы
окисления-восстановления перекиси водорода, во втором поколении - медиаторов (Мед), а в третьем поколении
используется прямой перенос электронов между редокс-активными биомолекулами и электродом преобразователя.
Заимствовано с изменениями из работ [7,31,32] .
зависят от присутствия в среде кислорода в каче-
ферментом и электродом. Для электрического
стве акцептора электронов, что может приводить
проведения сигнала от места редокс-реакции на
к ошибкам измерения, если концентрация рас-
ферменте к поверхности электрода используются
творенного в среде кислорода изменяется. По-
редокс-полимеры. В настоящее время такие био-
этому они малоэффективны при измерениях в
сенсоры находятся на стадии разработки и мало
анаэробных условиях, например, при ишемии.
применяются в практической работе [32], хотя
известны многочисленные лабораторные иссле-
Биосенсоры первого поколения, основанные
дования. Например, недавно был создан биосен-
на дегидрогеназах, зависят от присутствия нико-
сор для обнаружения биомаркера заболеваний
тинамидадениндинуклеотида в восстановленной
мочевой системы - пара-гидроксифенилацетата,
форме (НАДН), который необходим для проду-
в котором фермент бактериальная редуктаза был
цирования сигнала, что становится проблематич-
заключен в электропроводящий редокс-полимер,
ным при использовании имплантируемых сенсо-
что позволило производить надежные измерения
ров. Достоинством сенсоров первого поколения
концентрации исследуемого анализируемого со-
является малое время ответа (около 1 c) и высокая
единения [35]. В другом исследовании для выяв-
чувствительность. Однако для повышения вос-
ления фосфорорганических пестицидов был со-
производимости данных эти биосенсоры часто
здан высокочувствительный амперометрический
нуждаются в предварительной обработке элек-
ацетилхолинэстеразный биосенсор на основе со-
тродов перед работой, а также могут подвергаться
пряженного полимера и металлосодержащего на-
влиянию посторонних факторов, вследствие чего
нокомпозита [36].
может быть необходима коррекция получаемых
величин. Эти недостатки могут в наибольшей ме-
ре проявляться при измерениях в сложных био-
МУЛЬТИФЕРМЕНТНЫЕ
логических средах [33].
АМПЕРОМЕТРИЧЕСКИЕ БИОСЕНСОРЫ
Биосенсоры второго поколения используют в
Биосенсоры могут содержать один или не-
качестве окислителя медиаторы, функционирую-
сколько ферментов. Биосенсоры, содержащие
щие в качестве переносчиков электронов. Это
два или более ферментов и называемые мульти-
позволяет работать с использованием низких по-
ферментными, более эффективны, чем монофер-
тенциалов, исключает влияние кислорода и ин-
ментные. Основной принцип работы мультифер-
терференцию с другими химическими агентами.
ментных электрохимических биосенсоров бази-
Среди медиаторов наиболее известны ферроциа-
руется на каскадных мультиферферментных
нид и ферроцен. Следует упомянуть также мети-
реакциях [37], содержащих пары редокс- и не ре-
леновый синий, метиловый фиолетовый, ализа-
докс-ферментов, способных превращать анали-
рин желтый, берлинскую лазурь, тионин, лазури-
зируемые вещества в определенную форму, кото-
ты А и С, толуидиновый синий [34].
рая может быть окислена следующей реакцией
В биосенсорах третьего поколения использу-
редокс-фермента [37]. В качестве не редокс-фер-
ется электрокатализ, благодаря чему происходит
мента для реакции превращения анализируемого
непосредственный перенос электронов между
соединения могут использоваться любые воз-
БИОФИЗИКА том 64
№ 5
2019
872
ИБАДУЛЛАЕВА и др.
этом случае используемая реакция диафоразы
эффективно рециркулирует НАД+/НАДН и, на-
конец, обеспечивает усиленный электрохимиче-
ский сигнал. В большинстве разработок мульти-
ферментных биосенсоров с применением кас-
кадных химических реакций используются
электрохимические методы регистрации сигнала
[38].
Первая искусственная биферментная система,
включающая ковалентно связанные с полимер-
ным носителем иммобилизованные ферменты
гексокиназу и глюкозо-6-фосфатдегидрогеназу,
была создана К. Мосбахом в 1970 г. [39]. Было по-
казано, что эффективность пространственно ор-
ганизованной ферментной системы выше по
сравнению с ферментами, находящимися в рас-
творе в свободном виде. Этими же авторами впер-
вые была предложена трехферментная система
«β-галактозидаза-гексокиназа-глюкоза-6-фос-
фатдегидрогеназа» [40] (рис. 4), которая, как
предполагали, позволит наблюдать кумулятив-
ный эффект.
Три фермента были поверхностно связаны с
укрепленной поперечно-сшитой полимерной
матрицей [41]. Было показано, что кинетическое
поведение связанной с матрицей трехфермент-
ной системы по сравнению с аналогичной систе-
мой, состоящей из трех несвязанных и находя-
щихся в растворе ферментов, было более эффек-
тивно. При этом увеличение эффективности
связанной системы становится заметнее с увели-
чением числа участвующих ферментов. В настоя-
щее время известно несколько десятков иммоби-
Рис. 3. Типы каскадных мультиферментных реакций:
лизованных мультиферментных комплексов, со-
(а) - каскадная реакция не редокс-восстановитель-
стоящих из двух, трех, четырех и более
ной и редокс-восстановительной ферментных пар;
(б) - каскадная реакция ферментной пары «оксида-
ферментов, эффективность которых намного вы-
за-пероксидаза хрена»; (в) - каскадная реакция фер-
ше, чем у свободных ферментов, за счет локаль-
ментной пары «дегидрогеназа-диафораза»). Обозна-
ного концентрирования субстратов, входящих в
чения: a - субстрат (аналит), b - ферменты конвер-
систему [42-44].
сии, c
- промежуточный реагент, d
- редокс-
ферменты, EP - электроактивный продукт. Заим-
ствовано с изменениями из работы [37].
НОВЕЙШИЕ РАЗРАБОТКИ В ОБЛАСТИ
МУЛЬТИФЕРМЕНТНЫХ
можные ферменты, такие как киназы, трансфе-
АМПЕРОМЕТРИЧЕСКИХ БИОСЕНСОРОВ
разы, инвертазы и гидролазы. Каскадные фер-
Технологии использования биосенсоров, ос-
ментативные реакции этих «редокс-не редокс»
нованных на использовании редокс-ферментов,
ферментных пар приводят к образованию пере-
являются одной из наиболее быстро развиваю-
киси водорода в качестве электроактивного про-
щихся областей аналитической химии, что связа-
дукта, способного генерировать электрохимиче-
но с их высокой селективностью, чувствительно-
ские сигналы (рис. 3).
стью, быстротой и надежностью измерения, ком-
Как и пара «оксидаза-пероксидаза», НАД+-
пактностью и сравнительно невысокой ценой [2].
зависимая дегидрогеназа, например лактакдегид-
Ниже приводятся работы по исследованиям и
рогеназа, может сочетаться с диафоразой, кото-
разработкам мультиферментных биосенсоров для
рая окисляет НАДН. В результате реакции дегид-
мониторинга некоторых клинически важных ме-
рогеназы с аналитами образуются окисленные
таболитов за последние 10 лет.
субстраты и НАДН. Диафораза повторно окисля-
Определение содержания холестерина в крови.
ет НАДН в окисленную форму НАД+ и генериру-
Высокое содержание холестерина в крови тесно
ет электрохимические сигналы на электроде. В
связано с ишемической болезнью сердца, атеро-
БИОФИЗИКА том 64
№ 5
2019
АМПЕРОМЕТРИЧЕСКИЕ МУЛЬТИФЕРМЕНТНЫЕ БИОСЕНСОРЫ
873
Рис. 4. Схематическое изображение матрикс-связанной трехферментной системы. Сокращения: β-Гал - β-галактози-
даза, ГК - гексокиназа, Г-6-ФДГ - глюкозо-6-фосфатдегидрогеназа. Заимствовано с изменениями из работы [39].
склерозом, инфарктом миокарда, тромбозом го-
изученные с помощью циклической вольтампе-
ловного мозга, нарушением липидного обмена,
рометрии, показали его высокую селективность и
гипертонией и т.д., и поэтому разработка чув-
чувствительность (29,33 мкА · мМ-1 · см-2). Био-
ствительных методов его определения имеет важ-
сенсор был протестирован на реальных образцах
ное значение в диагностических целях [45]. Ран-
маргарина, сливочного масла и рыбьего жира, по-
ние разработки электрохимического биосенсора
казав возможность использования его в качестве
для определения холестерина были основаны на
инструмента для обнаружения холестерина при
прямом переносе электронов между холестери-
контроле качества пищевых продуктов и добавок.
ноксидазой (Хол.Окс.) и поверхностью электро-
дов [46,47]. Определение холестерина осуществ-
Кроме этого, была сделана попытка разрабо-
лялось ферментами холестериноксидазой и холе-
тать трехслойную нанокомпозитную пленку на
стеринэстеразой (Хол.Эст.).
основе наночастиц платины (PtNP) и полипир-
рола для оценки общего холестерина с использо-
Позже был создан биосенсор, в котором для
ванием импедансной спектроскопии [50]. Изме-
опеделения холестерина использовались фер-
нение импеданса нанобиокомпозитных электро-
менты холестериноксидаза и холестеринэстераза,
дов использовали для измерения концентрации
ковалентно иммобилизованые на графитовом
олеата холестерина. Импедиметрический био-
электроде, функционализированном графеном
сенсор был изготовлен на основе наночастиц
[48]. При определении свободного холестерина,
платины и многослойного нанокомпозитного
электрод
«Хол.Окс.-графен/графит» показал
электрода из полипиррола. Его преимуществом
чувствительность от 50 до 350 мкМ (R = -0,9972)
была простота изготовления [50]. Наночастицы
с пределом обнаружения холестерина 5 мкМ, а
Pt, электрохимически осажденные между двумя
для общего холестерина совместная иммобилиза-
слоями полипиррола на стеклянных пластинах из
ция Хол.Эст. и Хол.Окс. на модифицированный
оксида индия и олова (ITO) (PtNP/полипир-
электрод
«(Хол.Эст./Хол.Окс.)-графен/графит»
показал линейный диапазон от 50 до 300 мкМ
рол/ITO), обладали высокой электроактивной
(R = -0,9982) с пределом обнаружения 15 мкМ.
площадью поверхности и служили благоприят-
ной микросредой для иммобилизации Хол.Эст. и
При этом глюкоза, аскорбиновая кислота и моче-
Хол.Окс., что приводило к эффективному пере-
вая кислота не вызывали каких-либо помех из-за
использования низкого рабочего потенциала.
носу электронов между ферментной системой и
электродом. Электрод
«Хол.Эст.-Хол.Окс./Pt-
Для оценки уровня общего холестерина муль-
NP/ITO» обнаруживал линейность праметров в
тиферментным биосенсором титановый электрод
диапазоне от 2,5 · 10-4 до 6,5 · 10-3 М/л, низкий
был модифицирован тремя ферментами - холе-
стеринэстеразой, холестериноксидазой и перок-
порог чувствительности (2,5 · 10-4 М/л), быстрое
сидазой хрена (ПРХ) [49]. Каскадная фермента-
время отклика (25 с) и высокую чувствительность
тивная реакция для определения холестерина со-
(196 Ω/мМ/см-2). Уникальные особенности
стоит из пар «редокс-не редокс» и «редокс-
нанобиоэлектрода
«Хол.Окс.-Хол.Эст./PtNP/
редокс»-ферментов (рис. 5).
полипиррол/ITO» заключались в дешевизне из-
Биосенсор был изготовлен путем совместной
готовления, простоте измерения, возможности
иммобилизации трех ферментов на нанопори-
многократного использования, минимализации
стых сетках золота, непосредственно выращен-
помех и очень низким значением константы Ми-
ных на титановой подложке (Ti/NPAu/Хол.Окс.-
хаэлиса. Авторы отмечают, что ограничением из-
ПРХ-ChE). Электрохимические характеристики
мерения импеданса является полулогарифмиче-
биосенсора
«Ti/NPAu/Хол.Окс.-ПРХ-ChE»,
ская зависимость градуировочной кривой и вы-
БИОФИЗИКА том 64
№ 5
2019
874
ИБАДУЛЛАЕВА и др.
Рис. 5. Схематическое представление каскадной трехферментной реакции и электрохимической сигнализации.
Заимствовано с изменениями из работы [49].
бор репрезентативной схемы из различных
как пероксидаза хрена [53] и оксидаза глюкозы
графиков Найквиста (амплитудно-фазовая ча-
[54], используются для изготовления биосен-
стотная характеристика).
соров.
Как отмечалось выше, разработки электрохи-
В исследовании [55] были синтезированы по-
мического биосенсора холестерина на прямом
крытые серебром магнитные наночастицы
переносе электронов между холестериноксида-
«Fe3O4-Ag-NPs», в которых Fe3O4NP (магнетит)
зой и поверхностью электродов ограничивало
служил ядром, а Ag-NP (наночастицы серебра) -
аналитическую эффективность датчиков. Вольт-
оболочкой [55]. Уровни холестерина определяли
амперометрия как аналитическая техника обес-
циклической вольтамперометрией с пределом
печивает большую точность, чем амперометриче-
обнаружения 5,0 мг/дл и линейным диапазоном
ские методы [46,47]. Использование пероксидазы
от 5,0 до 195 мг/дл. Было обнаружено, что помехи,
хрена позволяет произвести конвертирование
вызванные присутствием глюкозы, аскорбино-
окисленного состояния в восстановленное и об-
вой кислоты и ацетаминофена, не оказывали су-
ратно с участием гемовой группы ПРХ [45].
щественного влияния на биосенсор, что свиде-
тельствовало о его высокой селективности.
Для определения общего холестерина
[51]
Высокая чувствительность биосенсора была обу-
вольтамперометрический датчик был изготовлен
словлена большой площадью поверхности для
путем совместной иммобилизации двух фермен-
эффективной загрузки ферментов. Нанокомпо-
тов - холестериноксидазы и ПРХ - на пористом
зит «SiO2/Fe3O4-Ag-ДНК» обладал хорошей сов-
графите. Датчик был избирателен и показывал
устойчивость к помехам, таким как аскорбиновая
местимостью с ферментами, имел хорошую про-
кислота, глюкоза, молочная и мочевая кислоты,
водимость. В недавно опубликованном обзоре
обладал высокой стабильностью, чувствительно-
[56] были обсуждены различные типы, а также
перспективы дальнейшего совершенствования и
стью (16 мкА · мМ-1 · см-2) и линейным диапазо-
коммерциализации биосенсоров холестерина.
ном до 300 моль/дм3 в условиях, близких к фи-
Биосенсоры креатинина. В клиническом ана-
зиологическим (рН 6,86), что определяло его пер-
лизе креатинин, образуемый в результате рас-
спективность для использования в клинической
щепления креатина и фосфокреатина, может слу-
практике.
жить важным индикатором функционирования
Известно, что ДНК широко используется в ка-
почек [57,58]. Традиционные методы определе-
честве элементов биораспознания в биосенсорах,
ния креатинина, такие как колориметрический,
а также в качестве строительных блоков в нано-
спектрофотометрический и хроматографиче-
устройствах [52]. Модифицированные ДНК ма-
ский, имеют ряд недостатков, в частности, трудо-
териалы для иммобилизации ферментов, таких
емкость, необходимость предварительной обра-
БИОФИЗИКА том 64
№ 5
2019
АМПЕРОМЕТРИЧЕСКИЕ МУЛЬТИФЕРМЕНТНЫЕ БИОСЕНСОРЫ
875
Рис. 6. Схема каскадной трехферментной реакции, применяемой в электрохимическом биосенсоре креатинина.
Заимствовано с изменениями из работы [62].
ботки образцов, дорогостоящая аппаратура и вы-
из Pseudomonas sp., креатиназа из Pseudomonas sp.,
сокие требования к квалификации специалистов.
саркозооксидаза из Bacillus sp. - были совместно
Напротив, биосенсорные датчики просты в ис-
иммобилизованы на наночастицах «оксид желе-
пользовании, экономически эффективны и вы-
за/хитозан-графт-полианилин» (Fe3O4-NPs/
сокочувствительны [58-60].
CHIT-g-PANI). Биосенсор характеризовался от-
Для создания биосенсора креатинина три
кликом в течение 2 с при рН 7,5 и 30°С, линейной
фермента - креатинин-амидогидролаза, креа-
зависимостью от концентрации креатинина в
тин-амидиногидролаза и саркозинооксидаза -
диапазоне от 1 до 800 мкМ, чувствительностью
были иммобилизованы на платиновом электро-
3,9 мкА · мкМ-1 · см-2 с пределом обнаружения
де, покрытом пленкой из наночастиц «оксид
1 мкМ (S/N = 3) и 10%-й потери в своем первона-
цинка/хитозан/карбоксилированные карбоно-
чальном ответе после 120 использований в тече-
вые нанотрубки/полианилин» [61]. Электрод об-
ние 200 суток при хранении при 4°C.
наруживал уровень креатинина, равный
Улучшенный амперометрический биосенсор
0,5 мкМ, в течение 10 с при рН 7,5 и 30°С, харак-
для обнаружения креатинина был разработан в
теризовался рабочим диапазоном 10-650 мкМ,
работе [59] на основе иммобилизации на стекло-
чувствительностью 0,03 мкА · мкМ-1 · см-2 и
углеродном электроде наночастиц, содержащих
только 15%-й потерей величины первоначально-
креатининазу, креатиназу и саркозооксидазу. От-
го ответа в течение 120 суток при хранении при
клик биосенсора составлял 2 с при рН 6,0 в 0,1 М
4°C. Устройство было успешно использовано
натрий-фосфатном буфере и 25°С. Биосенсор об-
для определения креатинина в сыворотке крови
ладал широким линейным диапазоном
- от
человека. Этими же авторами в другой работе
0,01 мкМ до 12 мкМ с пределом обнаружения
[62] был разработан биосенсор креатинина с ис-
0,01 мкМ. Наблюдалась хорошая корреляция
пользованием карбоксилированной многостен-
(R2 = 0,99) между значениями сывороточного
ной углеродной нанотрубки (с-МУНТ) и поли-
креатинина в сыворотке здоровых людей и лю-
анилинового модифицированного электрода.
дей, страдающих почечной и мышечной дис-
Для изготовления мультиферментного модифи-
функцией, полученными стандартным фермен-
цированного электрода, нанокомпозитная
тативным колориметрическим методом и при ис-
пленка «с-МУНТ/полианилин» была электро-
пользовании биосенсора. В течение 240 суток
осаждена на поверхность платинового электро-
после регулярного использования и хранения при
да. Для определения креатинина на активиро-
4°C потеря первоначальной активности электро-
ванном электроде были ковалентно иммобили-
да составляла всего 10%.
зованы ферменты (креатининамидогидролаза,
креатинамидиногидролаза и саркозиноксидаза)
Определение содержания триглицеридов в кро-
с использованием 1-этил-3-(3-диметиламино-
ви. Триглицериды являются основными перенос-
пропил)карбодиимид/N-гидроксисукциними-
чиками жиров в крови. Помимо транспортировки
да. Для электрохимической сигнализации ис-
жира триглицериды также действуют как накоп-
пользовали прямое окисление перекиси водоро-
ленный жир в жировой ткани, которая использу-
да, которая генерировалась в результате
ется при недостаточном поступлении углеводов.
каскадной ферментативной реакции (рис. 6).
Переносчиками жиров являются липополисаха-
Биосенсор характеризовался линейным диа-
риды крови. Повышенный уровень триглицери-
пазоном ответа от 10 до 750 мкM креатинина с
дов в крови, превышающий 500 мг/дл, может уве-
пределом обнаружения 0,1 мкM, был успешно ис-
личить риск сердечно-сосудистых заболеваний
пользован для определения креатинина в образ-
[63], сосудистой деменции и диабета [64], поэто-
цах сыворотки человека. В другой работе [60] эти-
му определение триглицеридов в крови имеет
ми же авторами был разработан биосенсор, в ко-
очень важное значение в клинической диагно-
тором коммерческие ферменты - креатининаза
стике. Биосенсоры триглицеридов, выполненные
БИОФИЗИКА том 64
№ 5
2019
876
ИБАДУЛЛАЕВА и др.
Рис. 7. Амперометрический биосенсор триглицеридов. Сокращения: ГК - глицеролкиназа, ГФО - глицеролфосфа-
токсидаза. Заимствовано с изменениями из работы [79].
на основе наноматериалов, способны измерять
перометрические, импедиметрические, кондук-
уровень триглицеридов в фруктовых соках, на-
тометрические датчики, биосенсор на основе
питках, образцах сыворотки и мочи [65]. В насто-
оксида металла, оптический биосенсор, биосен-
ящее время указанные биосенсоры недостаточно
сор на основе микрогеля и биосенсор на основе
совершенны для широкого практического при-
наночастиц фермента.
менения, требуются дальнейшие исследования
Потенциометрические биосенсоры на тригли-
для повышеия их надежности и эффективности
цериды основаны на катализируемом липазой
[66,67].
гидролизе трибутирина в глицерин и свободную
Для определения триглицеридов используют
жирную кислоту (масляная кислота). Производ-
различные методы, такие как колориметриче-
ство жирных кислот вызывает изменение рН ре-
ский [68], спектрофотометрический [69], хрома-
акционного буфера, который измеряется с ис-
тографический [70], флуорометрический [71] и
пользованием потенциала разомкнутой цепи
ряд других, в том числе и измерение биосенсора-
[77]. В этих биосенсорах генерируется постоян-
ми как наиболее простой, быстрый и экономич-
ный потенциал, зависимый от концентрации
ный метод. В основе работы биосенсоров на триг-
анализируемых соединений [78].
лицериды лежит принцип генерации электриче-
В амперометрическом методе ток прямо про-
ского сигнала, пропорционального количеству
порционален концентрации анализируемого со-
анализируемого соединения [72] . Среди разных
единения (триглицеридов) [79], а биосенсор со-
классов биосенсоров, например, основанных на
держит два или три электрода, на которых H2O2
проводящих полимерах, оксидах металлов, ис-
пользующих биодатчики с инфракрасным волок-
генерируется из триглицеридов в каскадной реак-
ном, микрогелевые оптические биосенсоры, наи-
ции «липаза, глицеролкиназа и глицерол-3-фос-
более чувствительными, простыми, специфич-
фатоксидаза/дегидрогеназа». Продукт H2O2 раз-
ными и экономичными были электрохимические
лагается при высоких напряжениях, чтобы гене-
биосенсоры [73-76].
рировать электроны (рис. 7).
Электрохимические биосенсоры на триглице-
На основе совместной иммобилизации липа-
риды классифицируют в соответствии с принци-
зы, глицеролкиназы и глицерол-3-фосфатокси-
пами их измерения на потенциометрические, ам-
дазы на наночастицы «оксид никеля-хитозан»
БИОФИЗИКА том 64
№ 5
2019
АМПЕРОМЕТРИЧЕСКИЕ МУЛЬТИФЕРМЕНТНЫЕ БИОСЕНСОРЫ
877
Рис. 8. Схема измерения метилсалицилата с использованием мультиферментного амперометрического датчика.
Сокращения: ЭС - эстераза, СГ - салицилатгидролаза, Тир - тирозиназа. Заимствовано с изменениями из работ
[87,88].
[80], на хитозан и наночастицы ZnO (ZnONPs)
тивным колориметрическим методом. Электрод
[81], на химически синтезированные частицы
использовали 180 раз в течение трех месяцев с по-
«Au/нанокомпозит поли(3,4-этилендиокситио-
терей 50% от его первоначального значения при
фен)полистирен сульфонат» [82] были изготовле-
хранении в сухом месте при 4°С.
ны амперометрические биосенсоры на триглице-
Улучшенный амперометрический биосенсор
риды.
триглицерида, полученый с использованиенм нано-
Электрохимический биосенсор на триглице-
частиц коммерческой липазы из Candida rugosa, гли-
риды был разработан путем нанесения липазы,
церолкиназы из Cellulomonas, а также глицерол-3-
глицеролкиназы и глицерол-3-фосфатоксидазы
фосфатоксидазы из Aerococcus viridans, иммобилизо-
на полимерные матрицы посредством электро-
ваннх на электроде карандашного графита, показал
статических сил и далее стабилизирован посред-
оптимальный отклик в течение 2,5 с при рН 7,0 и
ством ковалентного сшивания. Он позволял
температуре 35°С. Электрод показал высокую чув-
измерить уровень триглицеридов в сыворотке
ствительность (1241 ± 20 мА · см-2 · мМ-1); низкий
крови пациентов, страдающих кожными заболе-
предел обнаружения (0,1 нМ) и хороший коэффи-
ваниями [83], был прост в изготовлении, обладал
циент корреляции (R2 = 0,99) оцениваемый стан-
стабильной адгезией ферментов, длительным
дартным ферментативным колориметрическим ме-
сроком службы электрода. К недостаткам био-
тодом. Биосенсор использовали для определения
сенсора можно было отнести неоднородность
триглицеридов в сыворотке здорового субъекта и
дисперсии проводящего полимера, химическую
лиц, страдающих гипертриглицеридемией. Потеря
нестабильность и низкую технологичность при
его первоначальной активности после продолжи-
изготовлении.
тельного использования в течение 240 суток при
Эффективный электрохимический биосенсор
хранении при 4°C составляла всего 20% [86].
на триглицериды, в котором ферменты были ко-
валентно ко-иммобилизованы на модифициро-
Детектирование метилсалицилата. Летучие ор-
ванный стеклоуглеродный электрод (MNP-
ганические соединения признаны важными мар-
CHIT/ZnO-ZnHCF/GCE), представлял значи-
керными химическими веществами для выявле-
ния болезней растений, вызываемых патогенами.
тельный интерес, связанный со способностью к
значительному усилению сигнала и высокой ста-
Метилсалицилат - одно из наиболее важных ле-
бильностью при хранении [84].
тучих органических соединений, выделяемых
растениями во время биотического стресса, тако-
В амперометрическом бионаносенсоре триг-
го как инфекция патогенными грибками.
лицеридов агрегаты наночастиц липазы из под-
желудочной железы свиньи, глицеролкиназы из
Разработка быстрого, достаточно чувствитель-
Cellulomonas sp. и глицерол-3-фосфатоксидазы из
ного и надежного, неразрушающего объект и
Aerococcus viridanss сшивали глутаральдегидом и
пригодного для работы в полевых условиях мето-
функционализировали цистеамином. Получен-
да обнаружения метилсалицилата в зараженных
ные ферментные наночастицы ковалентно иммо-
растениях очень важно для выявления инфекции
билизовали на поликристаллическом Au-элек-
на ранней стадии. Для обнаружения метилсали-
троде через тиолированную связь [85]. Биосенсор
цилата был изготовлен мультиферментный ам-
показал оптимальный ток при 1,2 В в течение 5 с,
перометрический датчик [87,88] на основе бифер-
при рН 6,5 и 35°С. Кроме того, была получена ли-
мент-модифицированного трафаретного элек-
нейная зависимость между током (мА) и концен-
трода. Так, для прямого обнаружения метил-
трацией триолеина в широком диапазоне низких
салицилата, выделяемого зараженными растени-
концентраций. Предел обнаружения триглице-
ями, был предложен датчик, основанный на трех-
ридов составлял 1,0 мкг/мл. Была получена хоро-
ферментной системе (рис. 8).
шая корреляция (R2 = 0,99) между значениями
Использование мультиферментных электро-
содержания триглицеридов в сыворотках, изме-
химических датчиков метилсалицилата имеет, по
ренными биосенсором и стандартным фермента-
сравнению с другими методами, ряд преиму-
БИОФИЗИКА том 64
№ 5
2019
878
ИБАДУЛЛАЕВА и др.
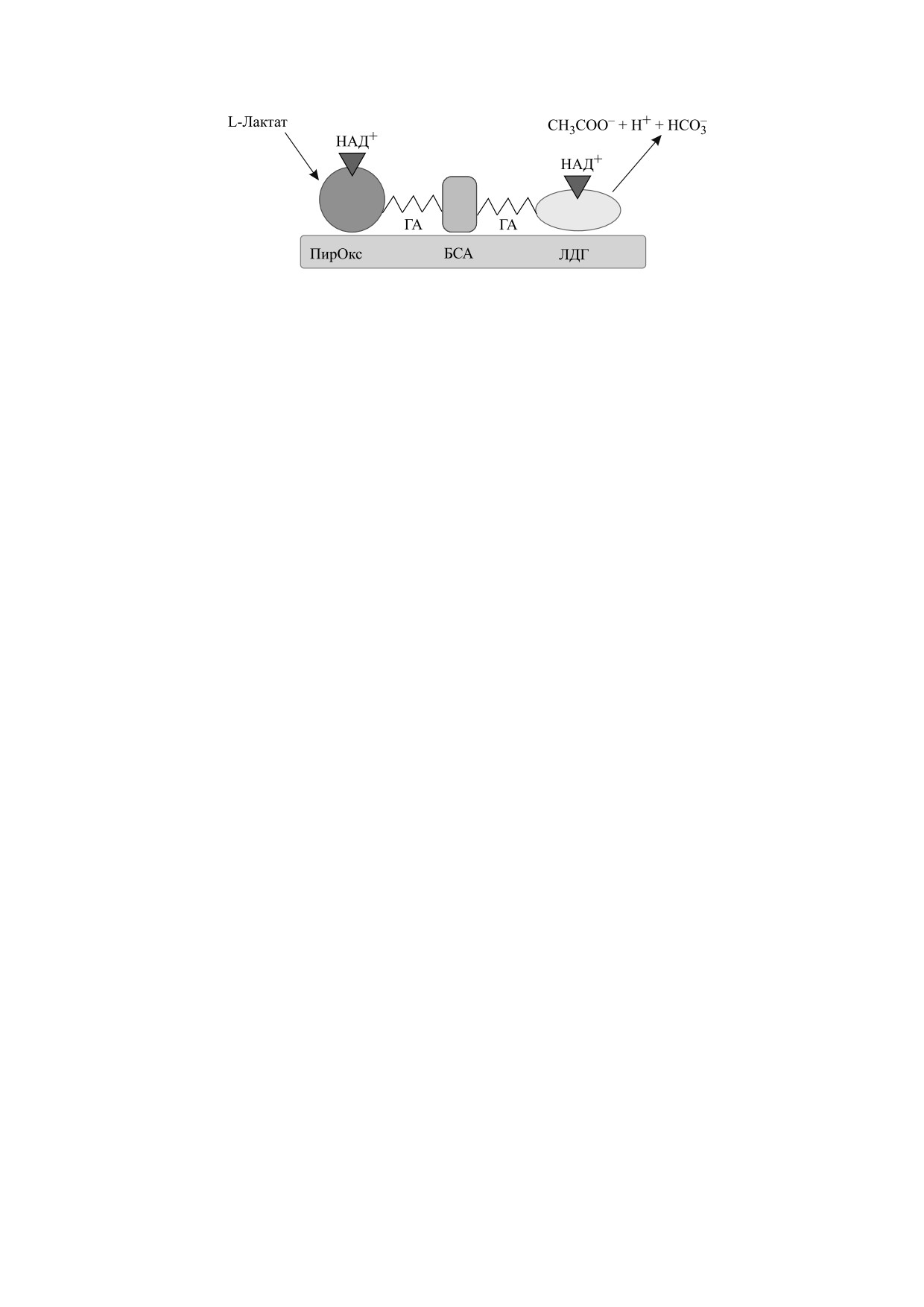
Рис. 9. Схематическое изображение l-лактат-селективного импедиметрического биосенсора на основе биоселектив-
ной мембраны. Сокращения: ГА - глутаровый альдегид, ПирОкс - пируватоксидаза, БСА - бычий сывороточный
альбумин, ЛДГ - лактатдегидрогеназа. Заимствовано с изменениями из работы [97].
ществ благодаря их надежности, чувствительно-
Была предложена оригинальная методика со-
сти и возможности количественного анализа
четания лактатдегидрогеназы и пируватоксидазы
[87,89]. В предложенной конструкции биосенсо-
для определения L-лактата, в которой биосенсор
ра метилсалицилат, высвобождаемый заражен-
готовили методом капельного покрытия лактат-
ными растениями, гидролизовался эстеразой до
дегидрогеназы, НАД+ и пируватоксидазы на по-
метанола и салициловой кислоты (I), а образо-
верхности электродов трафаретной печатью, с ис-
вавшаяся салициловая кислота была затем пре-
пользованием паров глютарового диальдегида.
вращена в катехол с помощью салицилатгидрола-
Определение L-лактата в сложных матрицах по-
зы, также иммобилизованной на трафаретном
казало применимость импедиметрического
электроде (II). Затем полученный катехол был
мультиферментного биосенсора для анализа ка-
окислен тирозиназой с образованием электроак-
чества пищевых продуктов и в клинической диа-
тивного соединения 1,2-бензохинона (III), кото-
гностике.
рое далее восстанавливался до катехина на по-
верхности трафаретного электрода, способствую-
Для одновременнного детектирования кисло-
щего генерации электрического тока (IV).
рода, глюкозы и лактата с использованием одного
Концентрация метилсалицилата была обратно
сенсора, ферменты лактатоксидаза, пероксидаза
пропорциональна величине тока на катоде. Чув-
и глюкозооксидаза были инкапсулированы в по-
ствительность биосенсора, определяемая с помо-
лиэлектролитные капсулы микронного размера
щью циклической вольтамперометрии и амперо-
[98]. Микрокапсулы готовили послойным оса-
метрии с постоянным потенциалом, составляла
ждением противоположно заряженных поли-
электролитов: полиаллиламин гидрохлорида и
112,37 и 282,82 мкА · см-2 · мМ-1, а пределы обна-
полистиролсульфоната на частицы CaCO3, в ре-
ружения - 22,95 и 0,98 мкМ соответственно.
зультате чего образовывалась оболочка «полисти-
Определение содержания сахаров и их производ-
ролсульфонат/полиаллиламина гидрохлорид».
ных. L-лактат является ключевым агентом, обра-
Ферменты находились во внутренней части кап-
зующимся в результате анаэробного метаболизма
сулы, в то время как на поверхности были при-
глюкозы в организме, и его определение очень
креплены флуоресцентные красители, удержива-
важно в клинической диагностике [90,91], в спор-
емые за счет электростатических и гидрофобных
тивной медицине [92,93], в анализе качества пи-
взаимодействий с полиэлектролитными много-
щевых продуктов [94,95]. Среди различных ана-
слойными оболочками [98].
литических методов, используемых для определе-
ния лактата, электрохимические биосенсоры
Глюконовая кислота, продукт окисления глюко-
обладают многими преимуществами, такими как
зы, широко распространена в природе и присутству-
быстрота, высокая специфичность, низкая стои-
ет в различных пищевых продуктах [99]. Для опреде-
мость и возможность миниатюризации/интегра-
ления глюконовой кислоты был разработан амперо-
ции в схемы для выполнения автоматического
метрический биосенсор, использующий мульти-
зондирования [73,96].
ферментный каскад, состоящий из глюконаткиназы
На основе лактатдегидрогеназы и пируваток-
и креатинкиназы, саркозиноксидазы и пероксидазы
сидазы был разработан простой и чувствитель-
[12]. Ферменты были иммобилизованы между слоя-
ный импендансометрический биферментный
ми хитозана на поверхности плоского нанокомпо-
биосенсор [97], продемонстрировавший высокую
зитного электрода, содержащего многостенные угле-
стабильность при работе и хранении, а также вы-
родные нанотрубки. Измерительная среда содержала
сокую селективность с пределом обнаружения 17
аденозинтрифосфат, креатинфосфат и гексациано-
и 20 мкМ для слоя лактатдегидрогеназы и слоя
феррат(II) в качестве редокс-медиатора. Отклик на
пируватоксидазы соответственно (рис. 9).
присутствие в среде глюконовой кислоты проявлял-
БИОФИЗИКА том 64
№ 5
2019
АМПЕРОМЕТРИЧЕСКИЕ МУЛЬТИФЕРМЕНТНЫЕ БИОСЕНСОРЫ
879
ся в виде изменения величины тока, измеряемого
мические биосенсоры для обнаружения кислоро-
при постоянном напряжении -50 мВ. Биосенсор об-
да и глюкозы, используя одну капсулу [98]. По-
ладал линейностью в диапазоне от 4 до 620 мкМ с
тенциально, капсулы могут находиться внутри
пределом обнаружения 2,6 мкМ, чувствительностью
клетки [111,112] и отслеживать изменения кон-
центрации метаболитов на протяжении жизнен-
45,3 нА · мкМ-1 · см-2 и временем ответа 70 с. Досто-
ных циклов клеток. Исследования показали, что
инство данной конструкции заключалось также в
миллимолярные концентрации таких веществ,
том, что используемые при создании биосенсора
как глюкоза и лактат, могут быть надежно зареги-
ферменты были доступны, дешевы, стабильны и эф-
стрированы с помощью флуоресценции. Таким
фективно функционировали в подходящих рабочих
образом, совместное инкапсулирование фермен-
условиях, что позволяло изготавливать чувствитель-
та и флуоресцентного красителя, позволяющее
ные, надежные и стабильные биосенсоры. Указан-
осуществлять оптический мониторинг биологи-
ный мультиферментный биосенсор был применен
чески важных метаболитов в одной микрокапсу-
для анализа глюконовой кислоты в различных суслах
ле, является уникальной системой для исследова-
и винах без какой-либо предварительной обработки.
ния в реальном времени микросреды в цито-
Полученнные с использованием биосенсора резуль-
плазме.
таты измерений не отличались от результатов
эталонных измерений методом жидкостной хрома-
Известны исследования мультиферментных
тографии. Биферментный биосенсор на основе пе-
биосенсорных систем для измерения концентра-
роксидазы хрена и глюкозооксидазы был сконструи-
ции фтора и фосфатов [113,114], для обнаружения
рован путем гибридизации in situ ковалентно связан-
ацетилхолина [115], аргинина [116], аспартаттран-
ной органико-неорганической биокомпозитной
саминазы и аланинтрансаминазы с использова-
пленки, которая обладала высокой стабильностью в
нием мультифермент-модифицированной по-
кислотном растворе [100]. Для обнаружения в вод-
верхности электрода [117,118], трансаминаз в сы-
ных растворах двух различных сахаридов - лактозы и
воротке крови [117], секреторной фосфолипазы
глюкозы - в трехэлектродном амперометрическом
группы 2-IIA, биомаркера бактериальной сепсис-
биосенсоре глюкозооксидаза и β-галактозидаза были
ной инфекции [119], лизина как показателя каче-
ко-иммобилизованы на графитовом рабочем элек-
ства пищевых продуктов [120], для обнаружения
троде [11]. Лактозный биосенсор показал линейный
и контроля нуклеозидов [121], а также аналогов
диапазон до 0,010 мM с пределом обнаружения и
нуклеозидов, представляющих универсальное се-
чувствительностью, равной
0,001
мM и
мейство лекарств широкого спектра действия
850 ± 81 мкА/мМ соответственно, и был испытан на
[122].
реальных образцах - фруктовых соках, обезжирен-
Современные методы иммобилизации позво-
ном молоке и сыворотке.
ляют создавать не только мультиферментные
комплексы, но и связывать их с целыми клетка-
ми, субклеточными структурами [123] и микроор-
ДРУГИЕ МУЛЬТИФЕРМЕНТНЫЕ
ганизмами [124]. Использование иммобилизо-
БИОСЕНСОРЫ
ванных клеток позволяет исключить необходи-
Перспективным направлением развития био-
мость выделения и очистки требуемых
сенсоров является использование флуоресцент-
ферментов. Живая клетка, в отличие от выделен-
ных красителей, которые обычно заключают в
ного фермента, представляет собой готовый био-
капсулы, в различные матрицы [101,102] или обо-
технологический реактор, в котором реализуются
лочки [103], спроектированые таким образом,
процессы, приводящие к образованию конечного
чтобы облегчить взаимодействие между анализи-
продукта. Они позволяют получать естественные
руемым соединением и чувствительным материа-
мультиферментные системы, осуществляющие
лом. Широко распространенный подход при из-
многостадийные химические преобразования. С
готовления датчиков такого типа состоит в ин-
использованием живых клеток создано много
капсулировании чувствительного материала в
различных биосенсоров [125,126], в которых клю-
многослойные наноструктуры, получаемые пу-
чевым вопросом является метод иммобилизации
тем последовательной адсорбции положительно
клеток [127,128].
и отрицательно заряженных полиэлектролитов,
что впервые было описано в начале 2000-х годов
[104,105], в дальнейшем получило значительное
ЗАКЛЮЧЕНИЕ
развитие и нашло разнообразное применение
В последние годы наблюдалось быстрое разви-
[106-109].
тие технологий создания мультиферментных
Так, была показана возможность совместного
биосенсоров, предназначенных для использова-
инкапсулирования ферментов с чувствительны-
ния в биомедицине, фармакологии, пищевой
ми красителями в полиэлектролитные капсулы
промышленности, сельском хозяйстве, монито-
микронного размера [98]. Многокомпонентные
ринге окружающей среды. Эти устройства отли-
структуры капсул [110] позволили изготовить хи-
чают компактность и портативность, высокая
БИОФИЗИКА том 64
№ 5
2019
880
ИБАДУЛЛАЕВА и др.
чувствительность и селективность, простота и
14.
M. S. Thakur and K. V. Ragavan, J. Food Sci. Technol.
удобство в использовании, поскольку они не тре-
50, 625 (2013).
буют проведения сложных подготовительных ра-
15.
N. Patel, S. Shahane, Shivam, et al., Recent Pat Bio-
бот для измерения.
technol. 13, 19 (2019).
16.
A. L. Campaña, S. L. Florez, M. J. Noguera, et al., Bi-
Биосенсоры на основе каскадных фермента-
osensors (Basel), 9 (1), 41 (2019).
тивных реакций обладают рядом преимуществ в
17.
D. Bagal-Kestwal, R. M. Kestwal, B.-C. Hsieh, et al.,
сравнении с моноферментными биосенсорами.
Biosens. Bioelectron. 26, 118 (2010).
Важным фактором в разработке эффективных
18.
M. Diaconu, S. C. Litescu, and G. L. Radu, Micro-
биосенсоров, основанных на каскадных реакци-
chim. Acta 172 (1-2), 177 (2011).
ях, является подбор подходящих ферментных
19.
R. Spricigo, R. Dronov, F. Lisdat, et al., Anal. Bioanal.
пар, для которых требуются относительное сход-
Chem. 393, 225 (2009).
ство условий функционирования, включая сход-
ство оптимальных значений pH, температурных
20.
J. Simon, E. Flahaut, and M. Golzio, Materials (Basel)
12 (4), 624 (2019).
профилей, концентрации метаболитов.
21.
L. F. Fernandes, G. E. Bruch, A. R. Massensini, et al.,
Современные тенденции развития указанной
Front. Neurosci. 12, 453 (2018).
техники направлены на дальнейшую минимиза-
22.
Y. Zhou, Y. Fang, R. P. Ramasamy, Sensors (Basel), 19
цию их размеров, повышение их надежности чув-
(2), 392 (2019).
ствительности, избирательности, устойчивости к
23.
M. Adeel, M. Bilal, T. Rasheed, et al., Int. J. Biol. Mac-
действию посторонних агентов и факторов, сни-
romol. 120, 1430 (2018).
жающих время службы этих устройств. Важным
24.
Á. Torrinha, C. G. Amorim, M. C. B. S. M. Montene-
аспектом является также снижение стоимости из-
gro, et al., Talanta 190, 2357 (2018).
готовления и расширение аспектов применения
25.
B. Wang, U. Akiba, and J.-I. Anzai, Molecules 22 (7),
измерительных устройств.
1048 (2017).
26.
V. Hooda, A. Gahlaut, A. Gothwal, et al., Artif. Cells
ФИНАНСИРОВАНИЕ РАБОТЫ
Nanomed. Biotechnol. 46, 626 (2018).
27.
S.-C. Park, E.-J. Cho, S.-Y. Moon, et al., In Materials
Pабота выполнена пpи финанcовой поддеpжке
of World Congress on Medical Physics and Biomedical
Комитета науки Миниcтеpcтва обpазования и на-
Engineering - 2006, Ed. by S.-I. Kim and T. Suk Suh
уки Pеcпублики Казаxcтан (пpоект AP05134201)
(Springer, New York, 2007).
28.
D. Grieshaber, R. MacKenzie, J. Vörös, et al., Sensors
(Basel) 8, 1400 (2008).
СПИСОК ЛИТЕРАТУРЫ
29.
P. Damborský, J. Švitel, J. Katrlík, Essays Biochem. 60,
1. M. Asal, Ö. Özen, M. Şahinler, et al., Sensors (Basel)
91 (2016).
18 (6), 1924 (2018).
30.
M. Pohanka, Materials (Basel), 11 (3), 448 (2018).
2. T. Monteiro and M. G. Almeida, Crit. Rev. Anal.
31.
S. K. Sharma and R. M. Leblanc, Anal. Biochem. 535,
Chem. 49, 44 (2019).
1 (2017).
3. A. Gahlaut, V. Hooda, A. Gothwal, et al., Crit. Rev.
32.
G. Rocchitta, A. Spanu, S. Babudieri, et al., Sensors
(Basel) 16 (6), 680 (2016).
Anal. Chem. 49, 32 (2019).
33.
S. V. Dzyadevych, V. N. Arkhypova, A. P. Soldatkin,
4. B. Bucur, F.-D. Munteanu, J.-L. Marty, et al., Biosen-
et al., Innovation Res. BioMed. Engineer. 29 (2-3),
sors (Basel) 18 (2), 27 (2018).
171 (2008).
5. L. El Harrad, I. Bourais, H. Mohammadi, et al., Sen-
34.
A. Chaubey and B. D. Malhotra, Biosens. Bioelectron.
sors (Basel) 18 (1), 164 (2018).
17, 441 (2002).
6. I. Palchetti, Mini-Rev. Med. Chem. 16, 1125 (2016).
35.
S. Teanphonkrang, A. Ernst, S. Janke, et al., ACS Sens.
7. H. H. Nguyen, S. H. Lee, U. J. Lee, et al., Materials
4, 1270 (2019).
(Basel) 12, 121 (2019).
36.
P. Zhang, T. Sun, S. Rong, et al., Bioelectrochemistry
8. M. Asif, A. Aziz, M. Azeem, et al., Adv. Colloid Inter-
127, 163 (2019).
face Sci. 262, 21 (2018).
37.
Y. D. Han, Y. H. Jang, and H. C. Yoon, Adv. Biochem.
9. L. Farzin, M. Shamsipur, L. Samandari, et al., Mikro-
Eng. Biotechnol. 140, 221 (2014).
chim. Acta 185, 276 (2018).
38.
D. R. Bagal-Kestwal, M. H. Pan, and B.-H. Chiang,
10. D. Baratella, E. Bonaiuto, M. Magro, et al., Amino Ac-
Biosens. Bioelectron. 121, 223 (2018).
ids 50, 1187 (2018).
39.
K. Mosbach and B. Mattiasson, Acta Chem. Scand. 24,
11. M. Portaccio and M. Lepore, J. Sensors 2017 (2), 1
2093 (1970).
(2017).
40.
B. Mattiasson and K. Mosbach, Biochim. Biophys. Ac-
12. M. Stredansky, Int. J. Electrochem. Sci. 12 (2), 1183
(2017).
ta - Enzymology 235 (1), 253 (1971).
13. R. Monošík, M. Stred'anský, and E. Šturdík, J. Clin.
41.
R. Axén, J. Porath, and S. Ernback, Nature 214, 1302
Lab. Anal. 26, 22 (2012).
(1967).
БИОФИЗИКА том 64
№ 5
2019
АМПЕРОМЕТРИЧЕСКИЕ МУЛЬТИФЕРМЕНТНЫЕ БИОСЕНСОРЫ
881
42. Z. Findrik and Đ. Vasić-Rački, Chem. Biochem. Engi-
73.
C. S. Pundir, V. Narwal, and B. Batra, Biosens. Bio-
neer. Quart. 23, 545 (2009).
electron. 86, 777 (2016).
43. S. Schoffelen and J. C. M. van Hest, Soft Matter 8 (6),
74.
I. Palchetti, S. Laschi, and M. Mascini, Methods Mol.
1736 (2012).
Biol. 504, 115 (2009).
75.
P. R. Solanki, C. Dhand, A. Kaushik, et al., Sensors
44. X. Wang, Z. Li, J. Shi, et al., ACS Catal. 4 (3), 962
and Actuators B: Chemical 141 (2), 551 (2009).
(2014).
76.
A. Yücel, H. M. Özcan, and A. Sağıroğlu, Prep. Bio-
45. A. Gahlaut, V. Hooda, V. Dhull, et al., Artif. Cells
chem. Biotechnol. 46, 78 (2016).
Nanomed. Biotechnol. 46, 472 (2018).
77.
R. R. Reddy, A. Chadha, E. Bhattacharya, Biosens.
46. J. J. Gooding, Electrochim. Acta 50 (15), 3049 (2005).
Bioelectron. 16, 313 (2001).
47. J. Wang, Electroanalysis 17 (15-16), 1341 (2005).
78.
K. Nakazato, In State of the Art in Biosensors - General
48. R. Manjunatha, G. Sh. Suresh, J. S. Melo, et al., Talan-
Aspects, Ed. by T. Rinken (InTech, 2013).
ta 99, 302 (2012).
79.
V. K. Khanna, Sensor Rev. 28 (1), 39 (2008).
49. A. Ahmadalinezhad and A. Chen, Biosens. Bioelec-
80.
J. Narang, N. Chauhan, and C. S. Pundir, Int. J. Biol.
tron. 26, 4508 (2011).
Macromol. 60, 45 (2013).
50. K. Singh, R. Chauhan, P. R. Solanki, et al., Int. J. Org.
81.
J. Narang and C. S. Pundir, Int. J. Biol. Macromol. 49,
Chem. 3 (4), 262 (2013).
707 (2011).
51. K. V. Derina, E. I. Korotkova, E. V. Dorozhko, et al.,
82.
A. Phongphut, C. Sriprachuabwong, A. Wisitsoraat,
Procedia Chemistry 10, 513 (2014).
et al., Sensors and Actuators B Chemical 178, 501
52. H. Pei, X. Zuo, D. Pan, et al., NPG Asia Materials, 5
(2013).
(6), e51 (2013).
83.
C. Y. Jeong, Y. D. Han, J. H. Yoon, et al., J. Biotechnol.
53. Y. Liu, L. M. Hu, and S. Q. Yang, Microchim. Acta 160
175, 7 (2014).
(3), 357 (2008).
84.
J. Narang, N. Chauhan, N. Malhotra, et al., Adv. Sci.
54. J. Leng, W.-M. Wang, L.-M. Lu, et al., Nanoscale Res.
Lett. 20 (7), 1331 (2014).
Lett. 9, 99 (2014).
85.
C. S. Pundir and V. Aggarwal, Anal. Biochem. 517, 56
55. R. K. Satvekar, A. P. Tiwari, S. S. Rohiwal, et al., J.
(2017).
Mater. Engineer. and Performance
24
(12),
4691
86.
V. Narwal and C. S. Pundir, Enzyme Microb. Technol.
(2015).
100, 11 (2017).
56. V. Narwal, R. Deswal, B. Batra, et al., Steroids 143, 6
87.
Y. Fang, Y. Umasankar, and R. P. Ramasamy, Biosens.
(2019).
Bioelectron. 81, 39 (2016).
57. J. T. Kastl, Semin Fetal Neonatal Med. 22, 83 (2017).
88.
Y. Fang, H. Bullock, S. A. Lee, et al., Biosens. Bioelec-
58. P. Delanaye, E. Cavalier, and H. Pottel, Nephron 136,
tron. 85, 603 (2016).
302 (2017).
89.
Y. Fang and R. P. Ramasamy, ECS Trans. 85 (13), 1359
59. P. Kumar, R. Jaiwal, and C. S. Pundir, Anal. Biochem.
(2018).
537, 41 (2017).
90. J. Bakker, A. Pinto de Lima, Crit. Care 8, 96 (2004).
60. C. S. Pundir, P. Kumar, and R. Jaiwal, Biosens. Bio-
91.
F. Valenza, G. Aletti, T. Fossali, et al., Crit. Care 9, 588
electron. 126, 707 (2019).
(2005).
61. S. Yadav, R. Devi, A. Kumar, et al., Biosens. Bioelec-
92.
T. Stellingwerff, P. J. Leblanc, M. G. Hollidge, et al.,
tron. 28, 64 (2011).
Am. J. Physiol. Endocrinol. Metab. 290, E1180 (2006).
62. S. Yadav, A. Kumar, and C. S. Pundir, Anal. Biochem.
93.
N. Nikolaus and B. Strehlitz, Microchim. Acta 160 (1-
419, 277 (2011).
2), 15 (2008).
63. M. Miller, N. J. Stone, C. Ballantyne, et al., Circula-
tion 123, 229233 (2011).
94. K. Kriz, L. Kraft, M. Krook, et al., J. Agric. Food
Chem. 50, 3419 (2002).
64. C. Raffaitin, H. Gin, J.-P. Empana, et al., Diabetes
Care 32, 169 (2009).
95.
F. K. Stekelenburg and M. L. Kant-Muermans, Int. J.
Food Microbiol. 66, 197 (2001).
65. C. S. Pundir and V. Narwal, Biosens. Bioelectron. 100,
214 (2018).
96.
K. Rathee, V. Dhull, R. Dhull, et al., Biochem. Bio-
phys. Rep. 5, 35 (2016).
66. M. Pohanka, Molecules 24 (3), 616 (2019).
67. R. Cánovas, M. Cuartero, and G. A. Crespo, Biosens.
97.
D. Chan, M. M. Barsan, Y. Korpan, et al., Electro-
Bioelectron. 130, 110 (2019).
chim. Acta 231, 209 (2017).
68. M. Sugiura, T. Oikawa, K. Hirano, et al., Clin. Chim.
98.
L. I. Kazakova, L. I. Shabarchina, S. Anastasova, et al.,
Acta 81, 125 (1977).
Anal. Bioanal. Chem. 405, 1559 (2013).
69. M. C. Mochón and J. A. Leyva, Clin. Chim. Acta 142,
99.
S. Ramachandran, P. Fontanille, A. Pandey, et al.,
281 (1984).
Food Technol. Biotechnol. 44, 185 (2006).
70. J. W. Brunnekreeft and B. Leijnse, J. Clin. Chem. Clin.
100.F. Li, Z. Wang, Y. Feng, Sci. China Ser. B - Chemistry
Biochem. 24, 4459 (1986).
52 (12), 2269 (2009).
71. A. J. Mendez, C. Cabeza, and S. L. Hsia, Anal. Bio-
101. D. A. Nivens, Y. Zhang, and S. M. Angel, Anal. Chim.
chem. 156, 386 (1986).
Acta 376 (2), 235 (1998).
72. G. Evtugyn, Biosensors (Springer, Berlin, Heidelberg,
102.S. Sas, M. Danko, V. Bizovská, et al., Appl. Clay Sci.
2014).
138, 25 (2017).
БИОФИЗИКА том 64
№ 5
2019
882
ИБАДУЛЛАЕВА и др.
103.D. Lu, L. Yang, Z. Tian, et al., RSC Adv. 2 (7), 2783
117. Y. D. Han, S. Y. Song, J. H. Lee, et al., Anal. Bioanal.
(2012).
Chem. 400, 797 (2011).
104.T. A. Duchesne, J. Brown, K. B. Guice, et al., Sensors
118. M. Jamal, O. Worsfold, T. McCormac, et al., Biosens.
and Materials 14 (6), 293 (2002).
Bioelectron. 24, 2926 (2009).
105.M. J. McShane, Diabetes Technol. Ther. 4,
533
119. N. Nurhanan Nik Mansor, T. Toh Leong, E. Safitri,
(2002).
et al., Sensors (Basel) 18, 686 (2018).
106.L. R. Bornhoeft, A. Biswas, and M. J. McShane, Bio-
120.B. Bóka, M. Korózs, M. Nánási, et al., Electroanalysis
sensors (Basel) 7, 8 (2017).
27 (3), 817 (2015).
107.P. Rivera Gil, M. Nazarenus, S. Ashraf, et al., Small 8,
121. P. Muthu and S. Lutz, ChemMedChem. 11, 660
943 (2012).
(2016).
108.A. Biswas, A. T. Nagaraja, and M. J. McShane, ACS
Appl. Mater. Interfaces 6, 21193 (2014).
122.L. P. Jordheim, D. Durantel, F. Zoulim, et al., Nat.
109.Q. Zhao, X. Rong, L. Chen, et al., Talanta 114, 110
Rev. Drug Discov. 12, 447 (2013).
(2013).
123.N. Katsanakis, A. Katsivelis, and S. Kintzios, Sensors
110.M. Delcea, A. Yashchenok, K. Videnova, et al., . Bios-
(Basel) 9, 378 (2009).
ci. 10, 465 (2010).
124.J. W. Lim, D. Ha, J. Lee, et al., Front. Bioeng. Bio-
111. S. De Koker, B. G. De Geest, C. Cuvelier, et al., Adv.
technol. 3, 61 (2015).
Funct. Mater. 17 (18), 375 (2007).
112. A. M. Pavlov, A. V. Sapelkin, X. Huang, et al., Macro-
125.N. A. Wan, J. Wan, and L. Sh. Wong, Int. J. Chem.
mol. Biosci. 11, 848 (2011).
Env. Biol. Sci. 2 (1), 52 (2014).
113. V. Rangelova, A. Pandelova, and N. Stoiyanov, Annals
126.Q. Gui, T. Lawson, S. Shan, et al., Sensors 17 (7), 1623
of the Faculty of Engineering Hunedoara 9 (2), 83
(2017).
(2011).
127. Applications of Cell Immobilisation Biotechnology, Ed. by
114. S. Ganesan, K. Saravanakumar, and L. Rajendran, Int.
V. Nedović and R. Willaert (Springer, Netherlands,
J. Comput. Math. 2014 (2), 1 (2014).
2005).
115. S. Hou, Z. Ou, Q. Chen, et al., Biosens. Bioelectron.
33, 44 (2012).
128.E. M. T. El-Mansi, C. F. A. Bryce, A. R. Allman, et al.,
116. N. Stasyuk, O. Smutok, G. Gayda, et al., Biosens. Bio-
Fermentation microbiology and biotechnology (CRC
electron. 37, 46 (2012).
Press, 2011).
Amperometric Multi-Enzyme Biosensors: Development and Application (Short Review)
S.Zh. Ibadullaeva*, N.O. Appazov*, Yu.S. Tarahovsky**, E.A. Zamyatina**,
M.G. Fomkina**, and Yu.A. Kim***
*Korkyt Ata Kyzylorda State University, Aiteke Bi 29A, Kyzylorda, 120008 Kazakhstan
**Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
***Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
In the last decade, significant progress has been made in the development of enzyme biosensors that are used
in pharmacology, clinical practice, agriculture, in food quality control, monitoring of infectious diseases and
the spread of environmental pollution factors. The functioning of amperometric multienzyme biosensors is
based on natural recognition mechanisms. To increase the efficiency, the biosensor design should allow an-
alytes to freely interact with enzymes involved in catalytic reactions, which requires knowledge of both the
properties of the medium under study and the properties of the analyte itself. In order to detect, recognize and
estimate the concentration of analytes in the medium, it is also necessary to take into account factors that can
suppress or distort the signal, which may be due to the interaction of the biosensor components with each oth-
er and with the molecules of the studied medium. These factors may change not only during storage or after
repeated use of the biosensor, but also during a single measurement. In the process of development of mea-
suring technology, significant progress has been made in improving the design of biosensors. The proposed
review considers the most interesting and promising trends in the development of amperometric multienzyme
biosensors emerging in recent years.
Keywords: biosensor, multienzyme complexes, cascade reaction, metabolites
БИОФИЗИКА том 64
№ 5
2019