БИОФИЗИКА, 2019, том 64, № 5, с. 883-892
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.322.9; 577.359
МОДИФИЦИРОВАННЫЙ ХЕМИЛЮМИНЕСЦЕНТНЫЙ МЕТОД
ОПРЕДЕЛЕНИЯ АНТИОКСИДАНТНОЙ СПОСОБНОСТИ
БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ И ТКАНЕЙ
© 2019 г. Ю.О. Теселкин, И.В. Бабенкова, А.Н. Осипов
Российский национальный исследовательский медицинский университет имени Н.И. Пирогова Минздрава РФ,
117997, Москва, ул. Островитянова, 1
E-mail: teselkin-box@mail.ru
Поступила в редакцию 15.05.2019 г.
После доработки 15.05.2019 г.
Принята к публикации 21.05.2019 г.
Представлен модифицированный метод определения антиоксидантной способности биологиче-
ских жидкостей и тканей на основе использования хемилюминесцентной модельной системы, в ко-
торой окисление люминола индуцировали 2,2'-азобис(2-амидинопропан)дигидрохлоридом. Пока-
зано, что включение в состав системы дополнительного компонента - ЭДТА - придает последней
ряд преимуществ. Заметно увеличивается (в шесть-семь раз) интенсивность хемилюминесценции
на стадии стационарного свечения, стационарность сохраняется в течение длительного времени
(более одного часа). Кроме того, не регистрируется значительного усиления интенсивности свече-
ния в присутствии биологических жидкостей или отдельных антиоксидантов (сывороточного аль-
бумина человека, аскорбиновой кислоты), наблюдаемого после окончания латентного периода хе-
милюминесценции в отсутствие ЭДТА. Поскольку величины латентных периодов, определяемые
при введении в изучаемую систему некоторых низкомолекулярных антиоксидантов (тролокса, мо-
чевой кислоты), а также биологических жидкостей человека (сыворотки крови, слезной жидкости)
существенно не отличались от полученных в системе без ЭДТА, можно полагать, что ЭДТА не ока-
зывает влияния на реакции окисления люминола. Предлагаемая система может применяться и для
оценки антиоксидантной способности различных тканей. Представленные данные обсуждаются в
плане перспектив использования предлагаемого модифицированного метода определения антиок-
сидантной способности биологического материала в клинической практике.
Ключевые слова: оксидативный стресс, антиоксиданты, антиоксидантная способность, сыворотка
крови, слезная жидкость, хемилюминесценция.
DOI: 10.1134/S0006302919050077
ских и пищевых факторов, а также осуществлять
Определение антиоксидантной способности
контроль эффективности коррекции этого состо-
(АОС) биологических жидкостей широко ис-
яния, например за счет введения в организм до-
пользуется при проведении клинических и экспе-
полнительного количества антиоксидантов с
риментальных исследований, направленных на
профилактической или лечебной целью [5-7].
изучение механизмов развития оксидативного
стресса и его роли в патогенезе заболеваний [1-
Для изучения АОС биологических жидкостей
4]. АОС биологических жидкостей - интеграль-
применяют модельные системы, основными ком-
ный показатель, зависящий не только от количе-
понентами которых являются система генерации
ства присутствующих в исследуемом объекте ан-
радикалов и молекулы-мишени, подвергающиеся
тиоксидантов, но и от синергизма между ними
свободнорадикальному окислению. Известно
[5]. Этот показатель позволяет количественно
много способов определения АОC биологических
оценивать состояние антиоксидантной системы,
жидкостей, которые отличаются друг от друга и ти-
влияние на него физиологических, экологиче-
пом радикалов-инициаторов, и молекулами-ми-
шенями [2,8,9]. Среди них большой популярно-
стью пользуются хемилюминесцентные методы,
Сокращения: АОС - антиоксидантная способность, АБАП -
2,2'-азобис(2-амидинопропан)дигидрохлорид, САЧ - сыво- основанные, как правило, на взаимодействии ан-
роточный альбумин человека, RO2• - пероксильные радика-
тиоксидантов, входящих в состав биологических
лы, образующиеся в процессе термического распада 2,2'-
азобис(2-амидинопропан)дигидрохлорида, TRAP
- Total
жидкостей, с радикалами-инициаторами, индуци-
Radical-trapping Antioxidant Parameter.
рующими окисление хемилюминесцентных кра-
883
884
ТЕСЕЛКИН и др.
сителей, например люминола [10-14]. В результате
вали при комнатной температуре в течение
этого взаимодействия происходит ингибирование
30 мин и далее центрифугировали в течение
окисления хемилюминесцентного красителя и по-
10 мин при 2000 g и 4°С. Процесс выделения сле-
является латентный период хемилюминесценции,
зы стимулировали с помощью летучих соедине-
длительность которого прямо пропорциональна
ний репчатого лука. Слезу собирали из нижнего
содержанию антиоксидантов в исследуемом образ-
конъюнктивального свода. Биологические жид-
це [3,15-17]. Хемилюминесцентные методы обла-
кости хранили при 4°С в течение эксперимента
дают высокой чувствительностью и позволяют
(5-6 ч).
проводить кинетические измерения. Один из та-
Печень аутбредных белых крыс-самцов линии
ких методов состоит в окислении люминола ради-
Wistar (n = 10) массой 200-220 г выделяли, про-
калами-инициаторами, образующимися при тер-
мывали физиологическим раствором (4°С) и го-
мическом распаде водорастворимого азо-соедине-
товили 2% гомогенаты (масса/объем) с использо-
ния
-
2,2'-азобис(2-амидинопропан)дигидро-
ванием физиологического раствора, содержаще-
хлорида (АБАП) [18]. Модельная система для
го
1 мМ ЭДТА для ингибирования металл-
определения АОС биологических жидкостей на
катализируемых свободнорадикальных процес-
основе АБАП и люминола используется в различ-
сов. Далее образцы центрифугировали в течение
ных модификациях, которые различаются соотно-
20 мин при 4000 g и 4°С. Супернатанты отбирали
шением концентраций основных компонентов,
и хранили так же, как и биологические жидкости.
значениями рН среды, временем введения анали-
Измерение АОС биологических жидкостей,
зируемой биологической жидкости [1,19,20]. Так,
супернатантов гомогенатов печени и антиокси-
биологическая жидкость добавляется в модельную
дантов (тролокса, аскорбиновой кислоты, моче-
систему либо до введения в нее АБАП (до момента
вой кислоты, САЧ) проводили на 12-канальном
инициирования окисления люминола) [15,19,21],
хемилюминометре Lum-1200 (ООО «ДиСофт»,
либо после введения АБАП, когда хемилюминес-
Россия) с оригинальным программным обеспече-
ценция модельной системы достигает стационар-
ного уровня [20,22,23]. Однако не все варианты су-
graph.ru). Были использованы две хемилюминес-
ществующего метода являются универсальными и
центные системы: одна из них, двухкомпонент-
приспособлены для определения АОС как биоло-
ная, содержала люминол и АБАП, в другую был
гических жидкостей, так и других биологических
включен дополнительный компонент - ЭДТА.
объектов, в частности тканей экспериментальных
Реакционная среда общим объемом 1500 мкл
животных. При проведении исследований мы об-
имела следующий состав: 10 мкМ люминола и
наружили, что натриевая соль ЭДТА, которая ча-
1 мМ ЭДТА (в первой системе ЭДТА не было) в
сто используется в качестве хелатора ионов двух- и
50 мМ трис-HCl-буфере, содержащем 0,14 М
трехвалентных металлов (например, при получе-
NaCl, pH 8,0. Исследуемые пробы предваритель-
нии плазмы крови, приготовлении гомогенатов
но инкубировали в измерительной ячейке хеми-
тканей), может существенным образом влиять на
люминометра в темноте в течение 5 мин для до-
кинетику хемилюминесценции системы «АБАП-
стижения температуры 37°С. Затем индуцирова-
люминол» и придает ей некоторые преимущества
ли свободнорадикальное окисление люминола
по сравнению с аналогичной системой без ЭДТА.
добавлением АБАП в конечной концентрации
Цель исследования - разработка модифициро-
1 мМ. Рабочий раствор АБАП (50 мМ) готовили
ванного метода определения АОС биологических
на бидистиллированной воде непосредственно
жидкостей и тканей на основе системы «АБАП-
перед проведением исследования и хранили на
люминол», содержащей ЭДТА.
протяжении эксперимента в бане со льдом. Био-
логические жидкости, супернатанты гомогенатов
печени, растворы антиоксидантов добавляли в
МАТЕРИАЛЫ И МЕТОДЫ
реакционную среду после выхода кинетики хеми-
В работе применяли реактивы: аскорбиновую
люминесценции модельной системы на стацио-
кислоту, мочевую кислоту, сывороточный альбу-
нарный уровень - через 10-15 мин с момента
мин человека (САЧ), тролокс
(6-гидрокси-
инициирования окисления люминола. Объем
2,5,7,8-тетраметилхроман-2-карбоновую кисло-
анализируемых образцов не превышал 50 мкл,
ту), динатриевую соль ЭДТА, АБАП, диметил-
поскольку при введении в систему на стадии ста-
сульфоксид, неорганические соли (все - произ-
ционарного свечения буфера в объеме до 50 мкл
водства Sigma-Aldrich, США), люминол (Fluka,
происходило быстрое восстановление свечения
Швейцария).
до исходного уровня. Так как в хемилюминомет-
В исследовании использовали кровь десяти
ре Lum-1200 перемешивание не предусмотрено,
практически здоровых добровольцев мужского
после внесения в пробы добавок (АБАП, антиок-
пола в возрасте 19-60 лет. Проводили взятие кро-
сидантов, биологических материалов) их быстро
ви из пальца, без антикоагулянта, натощак. Для
перемешивали с использованием вортекса Reax
получения сыворотки крови образец инкубиро-
top (Heidolph, Германия). Раствор люминола
БИОФИЗИКА том 64
№ 5
2019
МОДИФИЦИРОВАННЫЙ ХЕМИЛЮМИНЕСЦЕНТНЫЙ МЕТОД
885
Рис. 1. Типичные кинетики хемилюминесценции системы «АБАП-люминол» в отсутствие (1) и в присутствии (2)
ЭДТА. Стрелкой отмечен момент введения АБАП. На врезке - зависимость максимальной интенсивности
хемилюминесценции системы от концентрации ЭДТА.
(5 мМ) готовили на 50 мМ боратном буфере,
окисления люминола, образующихся при терми-
рН 10,0 и хранили в замороженном состоянии
ческом распаде АБАП, постоянна. Нами обнару-
при температуре -30°С не более шести месяцев.
жено (рис. 1, кривая 1), что при соотношении
Для приготовления 2 мМ раствора тролокса
концентраций АБАП
(1 мМ) и люминола
(10 мкМ), равном 100, стационарность свечения
(использовался в качестве стандартного антиок-
сиданта) навеску растворяли в 5%-м (по объему)
сохраняется в течение продолжительного време-
растворе диметилсульфоксида, приготовленном
ни (более 1 ч). Добавление в состав реакционной
на 50 мМ трис-HCl-буфере, содержащем 0,14 М
среды 1 мМ ЭДТА не нарушало стационарности
NaCl, рН 8,0. Приготовленный раствор тролокса
свечения (рис 1, кривая 2), однако его интенсив-
ность увеличивалась в шесть-семь раз по сравне-
хранили при температуре -30°С не более трех ме-
сяцев. Перед определением АОС раствор тролок-
нию с контролем (без ЭДТА). Зависимость мак-
са размораживали, разводили буферным раство-
симальной интенсивности свечения системы
ром до концентрации 25 мкМ и держали в тече-
«АБАП-люминол» от концентрации ЭДТА имеет
ние эксперимента при 5-10°С. Растворы других
куполообразный характер с максимумом в обла-
сти концентраций 0,33-1,0 мМ (рис. 1, врезка).
антиоксидантов - аскорбиновой кислоты, моче-
вой кислоты, САЧ - также готовили перед ис-
Наилучшая стационарность свечения наблюда-
пользованием на 50 мМ трис-HCl-буфере, содер-
лась в том же диапазоне концентраций (данные
жащем 0,14 М NaCl, рН 8,0.
не представлены). В последующих эксперимен-
тах концентрация ЭДТА в системе составляла
Результаты исследований были обработаны
1 мМ.
стандартными методами вариационной статисти-
ки и представлены в форме средней величины и
При изучении антиоксидантных свойств био-
стандартной ошибки средней (М ± m). Оценку
логических субстратов в качестве стандартного
достоверности различий между сравниваемыми
антиоксиданта обычно используют тролокс, ко-
показателями проводили с помощью t-критерия
торый является водорастворимым структурным
Стьюдента. Различия считали статистически зна-
аналогом витамина Е. Показано, что добавление
чимыми при p < 0,05.
тролокса в систему «АБАП-люминол» приводит
к появлению латентного периода хемилюминес-
ценции, который увеличивается прямо пропор-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ционально концентрации данного антиоксидан-
Один из подходов, используемых для опреде-
та [17,20,22]. В нашем исследовании латентный
ления АОC биологических материалов с помо-
период, возникающий при введении тролокса в
щью системы «АБАП-люминол», основан на по-
систему «АБАП-люминол» на стадии стационар-
лучении стационарного свечения [17,20,22], когда
ного свечения, не зависел от присутствия в среде
скорость продукции радикалов-инициаторов
ЭДТА и также увеличивался прямо пропорцио-
БИОФИЗИКА том 64
№ 5
2019
886
ТЕСЕЛКИН и др.
Рис. 2. Влияние тролокса на хемилюминесценцию системы «АБАП-люминол». (а) - Изменение кинетических кри-
вых хемилюминесценции при добавлении тролокса (0,5 мкМ). Верхняя кривая - система с ЭДТА; нижняя кривая -
система без ЭДТА. Стрелкой отмечен момент введения тролокса. (б) - Зависимости латентного периода хемилюми-
несценции системы с ЭДТА (1) и без ЭДТА (2) от концентрации тролокса. Уравнения прямых: (1) - y = 1228,55x + 5,62,
r2 = 0,999; (2) - y = 1177,38x + 3,17, r2 = 0,999.
нально концентрации этого ингибитора
вольцу. Для других обследованных добровольцев
(рис. 2а,б). Возникновение латентного периода
указанные зависимости имели аналогичный ха-
связывают с тем, что тролокс перехватывает обра-
рактер.
зующиеся в системе водорастворимые радикалы-
Существует предположение, что наблюдаемое
инициаторы окисления люминола, в качестве ко-
усиление свечения в системе «АБАП-люминол»
торых рассматривают пероксильные радикалы
без ЭДТА при добавлении в нее сыворотки крови
(RO2•). Это вызывает торможение окисления лю-
человека обусловлено САЧ [23]. Результаты на-
минола. В работе [24] установлено, что одна мо-
ших экспериментов свидетельствуют в пользу
лекула тролокса взаимодействует с двумя радика-
этого мнения. На рис. 4а видно, что добавление
лами RO2• (коэффициент стехиометрии
САЧ в систему без ЭДТА приводило к подъему
nтрол = 2). Как только весь антиоксидант инакти-
кинетических кривых хемилюминесценции вы-
вируется, латентный период заканчивается, и
ше стационарного уровня. В присутствии ЭДТА,
процесс окисления люминола возобновляется.
наоборот, было установлено концентрационно-
зависимое ингибирующее действие САЧ на ин-
Введение в систему «АБАП-люминол» сыво-
тенсивность свечения модельной системы
ротки крови или слезной жидкости также сопро-
(рис. 4б). При этом в обеих системах не наблюда-
вождалось появлением латентного периода
лось латентных периодов (рис. 4а,б).
(рис. 3а,б), продолжительность которого была
прямо пропорциональна количеству добавлен-
Влияние низкомолекулярных антиоксидантов -
ной биологической жидкости. При этом суще-
мочевой кислоты и аскорбиновой кислоты - на хе-
ственных различий между значениями латентных
милюминесценцию системы
«АБАП-люминол»
периодов в системах с ЭДТА и без ЭДТА не обна-
показано на рис. 5 и 6. В случае мочевой кислоты из-
ружено (рис. 3в). Величина латентного периода
менение латентных периодов хемилюминесценции
не зависела от того, в какой момент времени на
в зависимости от концентрации в изучаемых систе-
стадии стационарного свечения вводили анали-
мах было практически одинаковым. Что касается
зируемый образец (данные не приводятся). Сле-
аскорбиновой кислоты, то увеличение латентного
дует отметить, что в отсутствие ЭДТА после окон-
периода с повышением ее концентрации было ме-
чания латентного периода регистрировалось уси-
нее выраженным в системе без ЭДТА. Это связано,
ление свечения, максимальная интенсивность
по-видимому, с тем, что аскорбиновая кислота мо-
которого превышала интенсивность стационар-
жет подвергаться окислению с участием ионов ме-
ного уровня. В то же время в присутствии ЭДТА
таллов переменной валентности, которые в следо-
такого усиления хемилюминесценции либо со-
вых количествах содержатся в бидистиллированной
всем не происходило (сыворотка крови), либо
воде и химических реактивах. При введении моче-
оно было менее выраженным (слезная жидкость).
вой кислоты интенсивность хемилюминесценции,
На рис. 3 представлены данные по одному добро-
регистрируемая после окончания латентного перио-
БИОФИЗИКА том 64
№ 5
2019
МОДИФИЦИРОВАННЫЙ ХЕМИЛЮМИНЕСЦЕНТНЫЙ МЕТОД
887
да, не превышала уровень стационарного свечения в
обеих системах, тогда как добавление аскорбиновой
кислоты в систему без ЭДТА сопровождалось неко-
торым нарастанием интенсивности свечения в ана-
логичную фазу кинетической кривой.
Для определения антиоксидантного потенци-
ала различных биологических жидкостей исполь-
зуются латентные периоды хемилюминесценции,
регистрируемые при их добавлении в систему
«АБАП-люминол». При этом АОС представляют
в виде эквивалентной концентрации тролокса
(тролоксовый эквивалент) или параметра TRAP
(Total Radical-trapping Antioxidant Parameter) [18].
АОС биологических жидкостей в виде тролоксо-
вого эквивалента рассчитывается следующим об-
разом:
АОС (мкмоль/л) = Т/Ттрол ⋅Строл ⋅ k,
где Т и Ттрол - латентные периоды в присутствии
биологической жидкости и тролокса соответствен-
но, Строл - концентрация тролокса в мкмоль/л, k -
коэффициент, учитывающий разведение биологи-
ческой жидкости в модельной системе. В нашем ис-
следовании значения АОС сыворотки крови и слез-
ной жидкости добровольцев в тролоксовом эквива-
ленте, полученные в системе «АБАП-люминол» с
добавлением ЭДТА, составили 439,6 ± 9,4 мкмоль/л
и 73,1 ± 2,5 мкмоль/л соответственно. Если эти зна-
чения умножить на 2 (т.е. nтрол), то получим АОС в
виде концентрации RO2•, перехваченных 1 л сыво-
ротки крови или слезной жидкости, которую обо-
значают как TRAP.
Вопрос о том, что лучше брать для определе-
ния АОС - сыворотку или плазму крови - весьма
важен с точки зрения получения корректных ре-
зультатов анализа. В выполненном исследовании
сравнение АОС сыворотки и плазмы крови не
проводилось, поскольку была поставлена задача
сравнения АОС сыворотки крови (без антикоагу-
лянта) в системе с ЭДТА и без ЭДТА. В то же вре-
мя имеются данные, свидетельствующие о том,
что для определения АОС более предпочтитель-
ным является применение плазмы крови [5].
Предлагаемый модифицированный метод мо-
жет быть использован для определения АОС тка-
ней. Так, введение в систему с ЭДТА супернатан-
та гомогената печени крыс сопровождается появ-
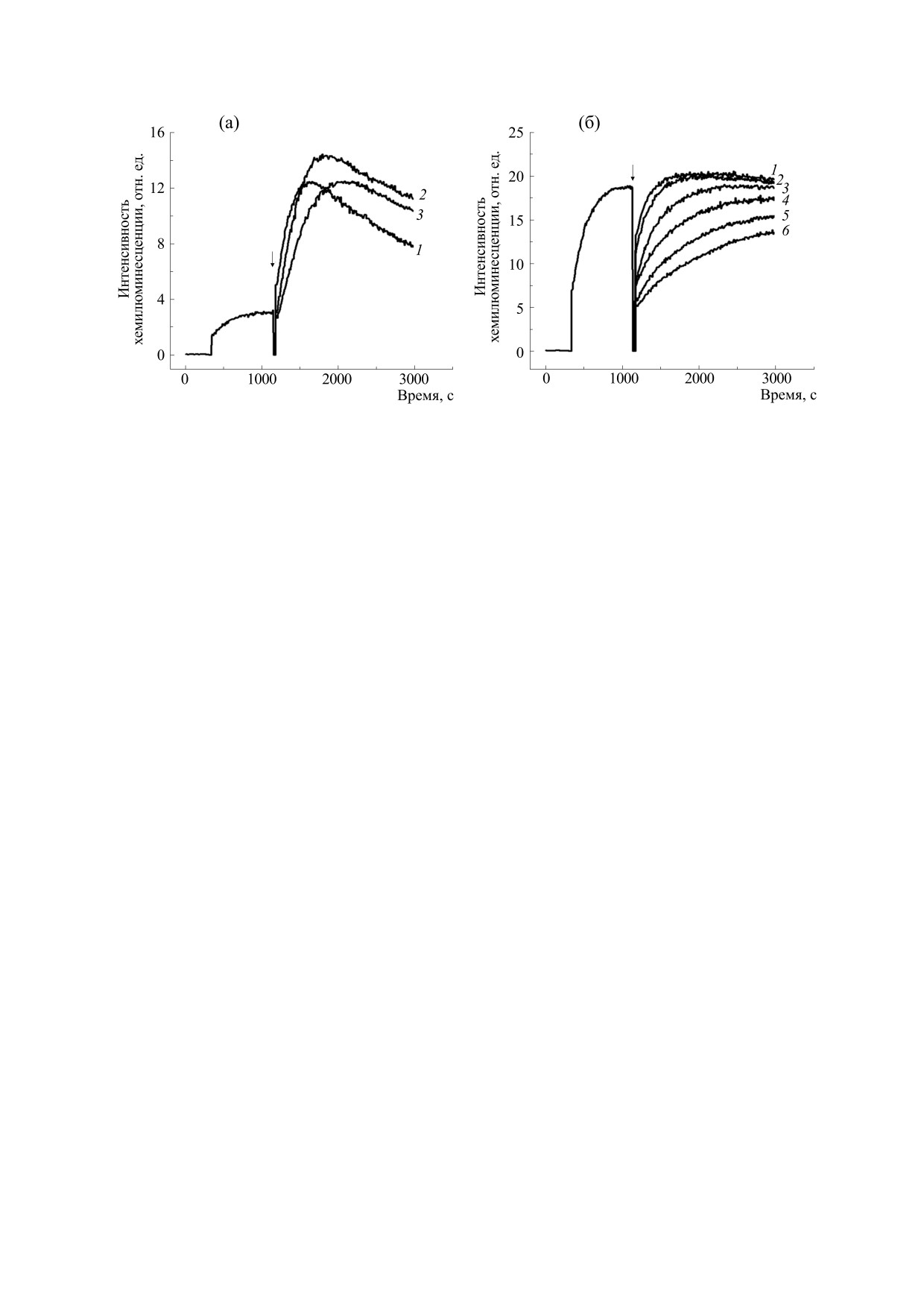
Рис. 3. Влияние биологических жидкостей человека на
лением латентного периода хемилюминесценции
хемилюминесценцию системы «АБАП-люминол». (а) -
и снижением интенсивности свечения (рис. 7).
Сыворотка крови (1, 1' - 2,5 мкл, 2, 2' - 5 мкл и 3, 3'-
Для определения АОС гомогенаты готовили та-
10 мкл); (б) - слезная жидкость (1, 1' - 10 мкл, 2, 2' -
ким образом (см. раздел «Материалы и методы»),
20 мкл). Стрелками отмечены моменты введения сыво-
ротки крови или слезной жидкости. 1, 2, 3 - система с
чтобы зависимость латентного периода хемилю-
ЭДТА; 1', 2', 3' - система без ЭДТА. (в) - Зависимости
минесценции от объема вводимого в систему су-
латентного периода хемилюминесценции системы от
пернатанта имела линейный характер (рис. 7,
объема биологической жидкости: 1 - сыворотка крови;
врезка). При расчете АОС необходимо учитывать
2 - слезная жидкость. Треугольниками показаны значе-
не только разведение гомогената в модельной си-
ния латентных периодов хемилюминесценции, полу-
ченные в системе с ЭДТА, кружками - в системе без
стеме, но и процентное содержание ткани в гомо-
ЭДТА.
генате. Значение АОС печени интактных крыс
БИОФИЗИКА том 64
№ 5
2019
888
ТЕСЕЛКИН и др.
Рис. 4. Влияние CАЧ на хемилюминесценцию системы «АБАП-люминол». (а) - Система без ЭДТА. Концентрации САЧ
(мкг/мл): 1 - 26,7; 2 - 106,7; 3 - 213,3. (б) - Система с ЭДТА. Концентрации САЧ (мкг/мл): 1 - 26,7; 2 - 53,3; 3 - 106,7; 4 -
160,0; 5 - 213,3; 6 - 266,7. Стрелками отмечен момент введения САЧ. Конечные концентрации САЧ соответствуют тем,
которые создаются при введении в модельную систему от 1 до 10 мкл сыворотки крови. В качестве среднего значения
концентрации САЧ в сыворотке крови была принята величина 40 мг/мл.
составило 4,64 ± 0,12 мкмоль/г сырой ткани, что
полученных в системе без ЭДТА. Поскольку ла-
согласуется с результатами работы [25]. В отдель-
тентные периоды хемилюминесценции в присут-
ном исследовании нами было установлено сни-
ствии тролокса в системах без ЭДТА и с добавле-
жение АОС печени крыс с экспериментальным
нием ЭДТА не различаются, близкие значения
острым гепатитом и нормализация этого показа-
должны иметь и скорости продукции RO2• на ста-
теля у крыс с гепатитом, получавших раствор
дии стационарного свечения. Численно эти ско-
лиофилизата водного извлечения из побегов ка-
рости равны скоростям убыли тролокса (1/атрол),
раганы гривастой (Caragana jubata (Pall.) Poir.)
умноженным на стехиометрический фактор 2:
[26].
ω = 2/атрол,
Следует подчеркнуть, что при определении
где атрол - значения коэффициентов а в уравне-
АОС биологического материала нет необходимо-
ниях линейной регрессии, описывающих зависи-
сти в получении зависимости латентного периода
мости латентного периода от концентрации тро-
хемилюминесценции от объема для каждого ана-
локса (рис. 2б).
лизируемого образца. Достаточно выбрать один
объем, который заведомо соответствует линей-
Зная ω и скорости расходования различных
антиоксидантов, можно рассчитать коэффициен-
ной зависимости. В данном исследовании значе-
ния АОС сыворотки крови и слезной жидкости
ты стехиометрии их взаимодействия с RO2•. Зна-
добровольцев, а также АОС печени были получе-
чения этих коэффициентов для мочевой кислоты
ны исходя из величин латентных периодов хеми-
составили 2,04 (в системе с ЭДТА) и 2,02 (в систе-
люминесценции, регистрируемых при введении в
ме без ЭДТА), для аскорбиновой кислоты - соот-
систему соответственно 4 мкл сыворотки крови,
ветственно 0,76 и 0,62. Следует отметить, что в ра-
20 мкл слезной жидкости, 15 мкл супернатанта
ботах других авторов, использовавших систему
гомогенатов печени (рис. 3в; рис. 7, врезка).
«АБАП-люминол» без ЭДТА, значения этих ко-
эффициентов для мочевой и аскорбиновой кис-
В настоящее время не ясно, чем обусловлено
лоты были соответственно равны 2,0 и 0,7 [20] и
изменение свойств системы «АБАП-люминол» в
2,05 и 0,75 [22]. Близкие значения коэффициен-
присутствии ЭДТА. Вместе с тем полученные ре-
тов стехиометрии говорят в пользу того, что при-
зультаты позволяют предположить, что ЭДТА не
сутствие ЭДТА не нарушает взаимодействия ука-
оказывает существенного влияния на реакции
занных антиоксидантов с RO2•.
окисления люминола. Действительно, величины
латентных периодов, регистрируемых при введе-
Антиоксидантная способность сыворот-
нии в систему низкомолекулярных антиоксидан-
ки/плазмы крови, определяемая с помощью систе-
тов (тролокса и мочевой кислоты), а также биоло-
мы «АБАП-люминол», зависит от содержания в
гических жидкостей человека (сыворотки крови,
ней отдельных антиоксидантов. Показано, что в
слезной жидкости) практически не отличались от
норме средние вклады отдельных антиоксидантов
БИОФИЗИКА том 64
№ 5
2019
МОДИФИЦИРОВАННЫЙ ХЕМИЛЮМИНЕСЦЕНТНЫЙ МЕТОД
889
Рис.
5. Влияние мочевой кислоты на хемилюминесценцию системы
«АБАП-люминол». (а)
- Кинетики
хемилюминесценции системы с ЭДТА (кривые 1-3) и без ЭДТА (кривые 1'-3'). Концентрации мочевой кислоты: 1, 1' -
1,33 мкМ; 2, 2' - 2 мкМ; 3, 3' -2,67 мкМ. Стрелкой отмечен момент введения мочевой кислоты. (б) - Зависимости
латентного периода хемилюминесценции системы с ЭДТА (1) и без ЭДТА (2) от концентрации мочевой кислоты.
Уравнения прямых: (1) - y = 1254,12x + 24,26, r2 = 0,999; (2) - y = 1188,11x + 8,24, r2 = 0,999.
в АОС сыворотки/плазмы крови составляют: мо-
авторов, этот вклад является еще более значитель-
чевая кислота - 43-53%, аскорбиновая кислота -
ным и может составлять основную часть ее антиок-
1-3%, витамин Е - 3%, SH-группы белков - 6-19%,
сидантного потенциала [19,23]. Что касается вкла-
неидентифицированные антиоксиданты - 34% [11,
да в АОС неучтенных (или неидентифицирован-
22]. Несколько иные вклады представлены в рабо-
ных) антиоксидантов, то его вычисляют по раз-
те [15]: мочевая кислота - 63,1%, аскорбиновая
ности между измеренным и расчетным значением
кислота - 26,3%, белки - 5,4%, неидентифициро-
TRAP. Расчетное значение TRAP (TRAPрасчет) по-
ванные антиоксиданты - 5,2%. Видно, что наи-
лучают из уравнения [20, 22]:
больший вклад в АОС сыворотки/плазмы крови
вносит мочевая кислота. По мнению некоторых
TRAPрасчет = Σ ni Ci,
Рис. 6. Влияние аскорбиновой кислоты на хемилюминесценцию системы «АБАП-люминол». (а) - Кинетики
хемилюминесценции системы с ЭДТА (кривые 1-3) и без ЭДТА (кривые 1'-3'). Концентрации аскорбиновой кислоты: 1,
1' - 0,4 мкМ; 2, 2' - 0,8 мкМ; 3, 3' - 1,6 мкМ. Стрелкой отмечен момент введения аскорбиновой кислоты. (б) - Зависимости
латентного периода хемилюминесценции системы с ЭДТА (1) и без ЭДТА (2) от концентрации аскорбиновой кислоты.
Уравнения прямых: (1) - y = 474,42x + 13,58, r2 = 0,999; (2) - y = 365,85x + 4,69, r2 = 0,999.
БИОФИЗИКА том 64
№ 5
2019
890
ТЕСЕЛКИН и др.
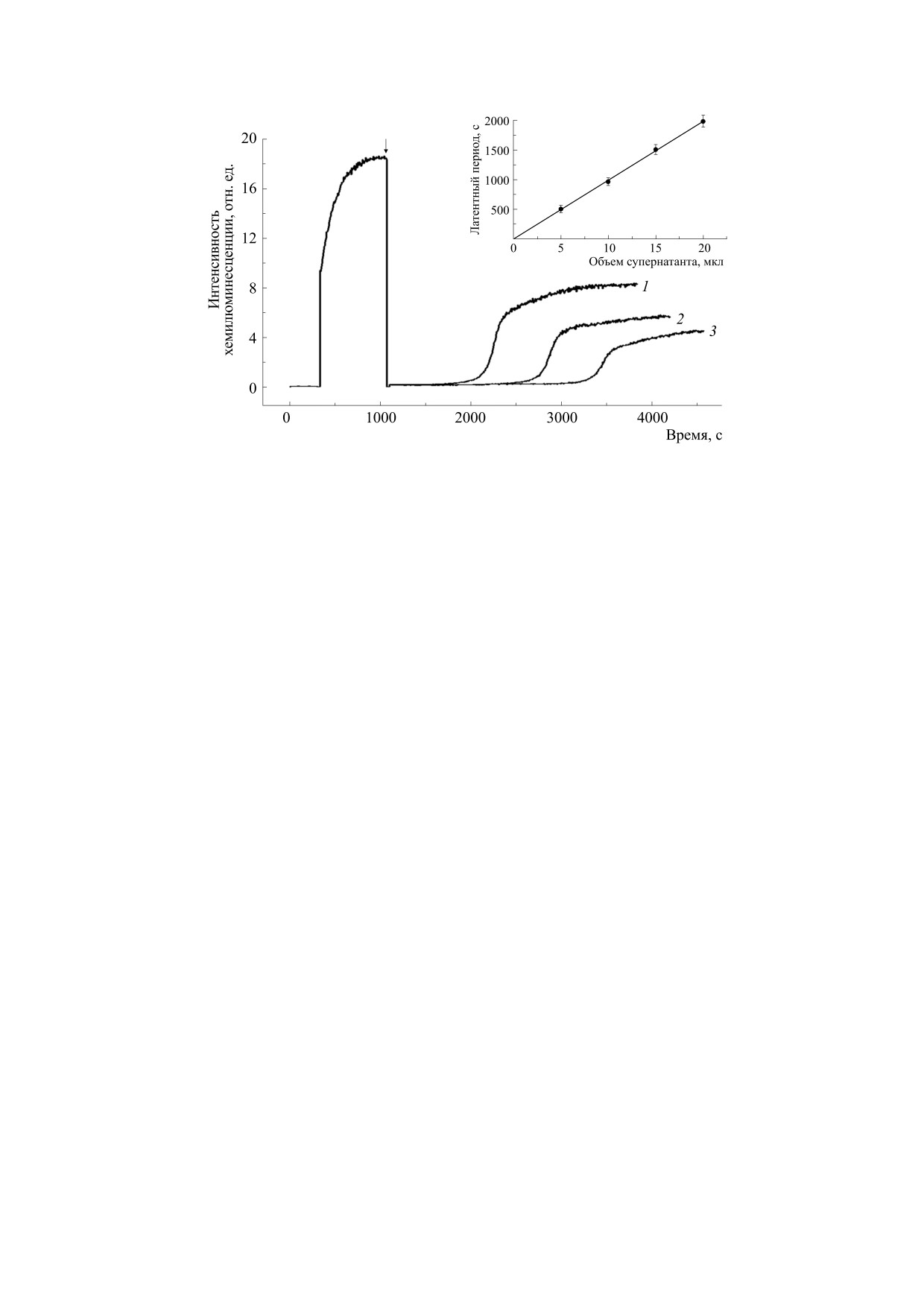
Рис. 7. Влияние разных объемов супернатанта гомогената печени крысы на хемилюминесценцию системы «АБАП-
люминол» с ЭДТА: 1, 2, 3 - 10, 15 и 20 мкл соответственно. Стрелкой отмечен момент введения супернатанта. На врезке -
зависимость латентного периода хемилюминесценции системы от объема супернатанта.
где ni - коэффициент стехиометрии взаимодей-
оценка АОС слезы была выполнена с использова-
нием других методов. Выявлено уменьшение
ствия индивидуального антиоксиданта с RO2•,
АОС слезной жидкости и плазмы крови у боль-
Ci-концентрация антиоксиданта. Нельзя ис-
ных с III стадией глаукомы в 2,2 и 1,4 раза соот-
ключить, что величина этого вклада зависит не
ветственно (p < 0,01) по сравнению со здоровыми
только от концентрации неучтенных антиокси-
лицами [30]. Полагают, что существенный вклад
дантов в сыворотке/плазме крови, но и от синер-
в АОС слезной жидкости вносят мочевая и аскор-
гизма между отдельными радикальными ингиби-
биновая кислоты [31,32]. Установлено, что на до-
торами. Развитие ряда заболеваний человека
лю этих антиоксидантов приходилось около по-
(свободнорадикальные патологии) сопровожда-
ловины измеренной АОС слезы, при этом значи-
ется нарушениями в функционировании антиок-
тельная корреляция наблюдалась между АОС
сидантной системы организма, что приводит к
слезной жидкости и содержанием в ней мочевой
изменениям в АОС сыворотки/плазмы крови [2].
кислоты [31].
С использованием системы «АБАП - люминол»
Исследование АОС тканей крыс с использова-
было установлено снижение АОС сыворот-
нием системы «АБАП - люминол» проводилось в
ки/плазмы крови при сепсисе [27], синдроме си-
работе [25]. Измеренная АОС увеличивалась в ря-
стемного воспалительного ответа [11], хрониче-
ду: сердце - головной мозг - почки - печень. Для
ском гепатите С [28], увеличение этого показате-
большинства тканей показано, что суммарный
ля зарегистрировано при преэклампсии [22] и
вклад глутатиона, мочевой кислоты, аскорбино-
BИЧ-инфекции [29]. На уровень АОС могут ока-
вой кислоты и α-токоферола составляет около
зывать влияние как внешние, так и внутренние
50% от измеренного значения TRAP. Остальные
факторы [7]. Выявлено влияние возраста и пола
50% приходятся на неучтенные антиоксиданты.
на АОС плазмы крови. У женщин с возрастом на-
Авторы полагают, что эта доля обусловлена глав-
блюдалось существенное увеличение данного по-
ным образом белками.
казателя, тогда как у мужчин после 74 лет имело
место его значительное снижение. При этом на-
Возникновение латентных периодов хемилю-
минесценции в системе «АБАП-люминол» при
блюдаемые изменения АОС происходили за счет
введении в нее биологических объектов (биоло-
неучтенных антиоксидантов [20].
гических жидкостей, супернатантов гомогенатов
В отличие от сыворотки/плазмы крови, АОС
тканей, биологически активных веществ) опреде-
слезной жидкости с применением системы
ляется взаимодействием неферментативных ан-
«АБАП-люминол» не изучена. Наши данные по-
тиоксидантов с радикалами-инициаторами окис-
казывают, что АОС слезной жидкости обследо-
ления люминола. В этом случае механизм анти-
ванных добровольцев в шесть раз меньше, чем
оксидантного действия заключается в переносе
АОС сыворотки (p < 0,05). В ряде публикаций
атома водорода (другой известный механизм -
БИОФИЗИКА том 64
№ 5
2019
МОДИФИЦИРОВАННЫЙ ХЕМИЛЮМИНЕСЦЕНТНЫЙ МЕТОД
891
перенос электрона) от антиоксиданта на RO2•.
направлены на оценку площади над кинетиче-
ской кривой хемилюминесценции, отражающей
Основные реакции, связанные с инициировани-
суммарную радикалперехватывающую актив-
ем окисления люминола и ингибированием этого
ность как низкомолекулярных антиоксидантов,
окисления, могут быть представлены следующим
так и белков, входящих в состав биологического
образом [8,18]:
образца.
R-N=N-R → 2R• + N2,
Предложенный в настоящем исследовании
модифицированный метод определения АОС
R• + O2 → RO2•,
биологических жидкостей и тканей на основе си-
стемы «АБАП-люминол-ЭДТА» имеет ряд пре-
RO2• + LН- → ROOH + L•,
имуществ по сравнению с применением анало-
гичной системы без ЭДТА. К ним относятся: вы-
RO2• + InH → ROOH + In•,
сокая интенсивность хемилюминесценции на
где R-N=N-R - молекула АБАП, R• - углерод-
стадии стационарного свечения, длительная фаза
стационарного свечения, отсутствие значитель-
центрированный радикал, LН- - молекула люми-
ного усиления свечения после завершения
нола, InH - молекула антиоксиданта, L• - ради-
латентного периода, вызванного добавлением
кал люминола, In• - радикал антиоксиданта. Если
биологических жидкостей или отдельных анти-
константа скорости взаимодействия антиокси-
оксидантов, возможность исследования биологи-
данта с RO2• значительно выше константы скоро-
ческих материалов, стабилизированных ЭДТА.
сти взаимодействия люминола (молекула-ми-
Для анализа требуются микроколичества биоло-
шень) с этим радикалом, то при добавлении анти-
гических материалов. Метод является универ-
оксиданта в систему «АБАП-люминол» будет
сальным и может использоваться в клинических
развиваться латентный период. Если упомянутые
и экспериментальных исследованиях.
константы сравнимы по величине, то латентный
период регистрироваться не будет [8], однако мо-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
жет наблюдаться снижение интенсивности хеми-
люминесценции. Такая ситуация, по-видимому,
Все применимые международные, националь-
возникает при введении САЧ в систему «АБАП-
ные и институциональные принципы ухода и ис-
люминол», содержащую ЭДТА. В наших услови-
пользования животных при выполнении работы
ях при добавлении САЧ латентный период не ре-
были соблюдены. Все процедуры, выполненные в
гистрировался. Вместе с тем имело место сниже-
исследовании с участием людей, соответствовали
ние интенсивности хемилюминесценции c повы-
этическим стандартам Хельсинкской декларации
шением концентрации белка (рис.
4б), что,
1964 г. и ее последующим изменениям. От всех
вероятно, обусловлено собственными антиокси-
участников предварительно было получено ин-
дантными свойствами САЧ, связанными с нали-
формированное добровольное согласие на уча-
чием SH-группы. Следует также отметить, что in
стие в исследовании.
vivo САЧ осуществляет транспорт многих эндо-
генных и экзогенных субстратов - неорганиче-
СПИСОК ЛИТЕРАТУРЫ
ских ионов, жирных кислот, билирубина, гормо-
нов, лекарственных веществ и др. [33], некоторые
1. H. Cízová, A. Lojek, L. Kubala, and M. Cíz, Physiol.
из которых обладают антиоксидантной активно-
Res. 53 (5), 523 (2004).
стью. За счет этих веществ САЧ может вносить
2. G. Bartosz, Free Radic. Res. 44 (7), 711 (2010).
определенный вклад в величину измеряемого ла-
3. T. Kőszegi, N. Sali, M. Raknić, et al., J. Pharmacol.
тентного периода при оценке АОС сыворотки
Toxicol. Methods 88 (Pt 2), 153 (2017).
крови. К таким веществам, по-видимому, отно-
4. D. L. Hughes, R. S. Richards, and L. A. Lexis, Lumi-
сится билирубин. Установлено, что билирубин,
nescence 33 (4), 764 (2018).
связанный с САЧ, обладает антиоксидантными
5. A. Ghiselli, M. Serafini, F. Natella, and C. Scaccini,
свойствами и оказывает влияние на ее общую
Free Radic. Biol. Med. 29 (11), 1106 (2000).
АОС [11,34].
6. И. В. Бабенкова, Ю. О. Теселкин, А. В. Асейчев и
Кинетическая кривая, регистрируемая после
Б. Х. Ягмуров, Вопр. питания 68 (3), 9 (1999).
введения в систему «АБАП-люминол-ЭДТА»
7. I. N. Popov and G. Lewin, Biophysics 58 (5), 669
биологического материала, является результатом
(2013).
совместного действия всех антиоксидантов, со-
8. R. Apak, M. Özyürek, K. Güçlü, and E. Çapanoğlu, J.
держащихся в образце. Поскольку латентный пе-
Agric. Food Chem. 64 (5), 997 (2016).
риод обусловлен действием только части антиок-
9. R. Apak, M. Özyürek, K. Güçlü, and E. Çapanoğlu, J.
сидантов (главным образом низкомолекуляр-
Agric. Food Chem. 64 (5), 1028 (2016).
ных), дальнейшие исследования в плане
10. Ю. О. Теселкин, И. В. Бабенкова, О. Б. Любицкий
повышения информативности метода могут быть
и др., Вопр. мед. химии 44 (1), 70 (1998).
БИОФИЗИКА том 64
№ 5
2019
892
ТЕСЕЛКИН и др.
11. K. Tsai, T. Hsu, C. Kong, et al., Free Radic. Biol. Med.
23. M. M. Sozarukova, A. M. Polimova, E. V. Proskurnina,
28 (6), 926 (2000).
and Yu. A. Vladimirov, Biophysics 61 (2), 284 (2016).
12. L. Saleh and C. Plieth, Nat. Protoc. 5 (10), 1627 (2010).
24. D. D. M. Wayner, G. W. Burton, K. U. Ingold, et al.,
Biochim. Biophys. Acta 924, 408 (1987).
13. L. Saleh and C. Plieth, Nat. Protoc. 5 (10), 1635 (2010).
25. P. Evelson, M. Travacio, M. Repetto, et al., Arch. Bio-
14. E. Plotnikov , E. Korotkova, O. Voronova, et al., Arch.
chem. Biophys. 388 (2), 261 (2001).
Med. Sci. 12 (5), 1071 (2016).
26. П. А. Какорин, И. В. Бабенкова, Ю. О. Теселкин и
15. I. Popov and G. Lewin, Luminescence 20, 321 (2005).
др., Биомед. химия 64 (3), 241 (2018).
16. S. R. Maxwell, T. Dietrich, and I. L. Chapple, Clin.
27. C. Pascual and K. Reinhart, Luminescence 14 (2), 83
Chim. Acta 372 (1-2), 188 (2006).
(1999).
28. D. Venturini, A. N. Simão, D. S. Barbosa, et al., Dig.
17. M. T. Dresch, S. B. Rossato, V. D. Kappel, et al., Anal.
Dis. Sci. 55 (4), 1120 (2010).
Biochem. 385 (1), 107 (2009).
29. M. Repetto, C. Reides, M. L. Gomez Carretero, et al.,
18. L. M. Magalhaes, M. A. Segundo, S. Reis, and J. L. Li-
Clin. Chim. Acta 255 (2), 107 (1996).
ma, Anal. Chim. Acta 613 (1), 1 (2008).
30. Н. В. Макашова, И. В. Бабенкова и Ю. О. Тесел-
19. E. Lissi, M. Salim-Hanna, C. Pascual, and M. D. del
кин, Вестн. офтальмологии 115 (5), 3 (1999).
Castillo, Free Radic. Biol. Med. 18 (2), 153 (1995).
31. C. K. Choy, I. F. Benzie, and P. Cho, Invest. Ophthal-
20. R. T. Aejmelaeus, P. Holm, U. Kaukinen, et al., Free
mol. Vis. Sci. 41 (11), 3293 (2000).
Radic. Biol. Med. 23 (1), 69 (1997).
32. J. Horwath-Winter, S. Kirchengast, A. Meinitzer, et al.,
21. V. N. Titov and N. N. Sazhina, Bull. Exp. Biol. Med.
Acta Ophthalmol. 87 (2), 188 (2009).
158 (2), 287 (2014).
33. S. Arques, Eur. J. Intern. Med. 52, 8 (2018).
22. J. T. Uotila, A. L. Kirkkola , M. Rorarius, et al., Free
34. P. D. MacLean, E. C. Drake, L. Ross, and C. Barclay,
Radic. Biol. Med. 16 (5), 581 (1994).
Free Radic. Biol. Med. 43 (4), 600 (2007).
Modified Chemiluminescent Method for Determination of Antioxidant Capacity
of Biological Fluids and Tissues
Yu.O. Teselkin, I.V. Babenkova, and A.N. Osipov
Pirogov Russian National Research Medical University, ul. Ostrovityanova 1, Moscow, 117997 Russia
In this study, we presented the modified method for determination of antioxidant capacity of biological fluids
and tissues based on the use of a chemiluminescent model system in which oxidation of luminol was induced
by 2,2′-azobis(2-amidinopropane)dihydrochloride. It is shown that the addition of EDTA as an extra com-
ponent gives the system a number of advantages. The intensity of chemiluminescence at the stationary stage
is increased substantially (by 6-7 times), stationarity remains unchanged for a long time (more than one
hour). Besides, it should be noted that no significant increase in the intensity of chemiluminescence occurred
in the presence of biological fluids or individual antioxidants (human serum albumin, ascorbic acid) after the
end of the latent period but it was observed in the absence of EDTA. Taking into account that the values of
latent periods, which were determined while introducing some low molecular weight antioxidants (trolox,
uric acid), as well as human biological fluids (blood serum, tear fluid) into our system, were not significantly
different from those obtained in the system without EDTA, we suppose that EDTA has no impact on luminol
oxidation reactions. The proposed system can also be used to evaluate antioxidant capacity of various tissues.
The obtained data are discussed in terms of prospects for the use of the proposed modified method for deter-
mination of antioxidant capacity of biological material in clinical practice.
Keywords: oxidative stress, antioxidants, antioxidant capacity, blood serum, tear fluid, chemiluminescence
БИОФИЗИКА том 64
№ 5
2019