БИОФИЗИКА, 2019, том 64, № 5, с. 906-909
БИОФИЗИКА КЛЕТКИ
УДК 57.085.23, 616.155.392.8
МОНОЦИТАРНО-МАКРОФАГАЛЬНАЯ ДИФФЕРЕНЦИРОВКА
ПОДАВЛЯЕТ ЭКСПРЕССИЮ ПРОАПОПТОТИЧЕСКИХ РЕЦЕПТОРОВ
К Apo2L/TRAIL И ПОВЫШАЕТ РЕЗИСТЕНТНОСТЬ
К TRAIL-ИНДУЦИРОВАННОМУ АПОПТОЗУ
© 2019 г. Я.В. Евстратова, М.И. Кобякова, В.В Новикова*, А.С. Сенотов,
В.С. Акатов, Р.С. Фадеев
Институт теоретической и экспериментальной биофизики РАН,
142290, Пущино Московской области, Институтская ул., 3
*Московский государственный университет имени М.В. Ломоносова, 119991, Москва, Ленинские горы, 1
Поступила в редакцию 10.07.2019 г.
После доработки 10.07.2019 г.
Принята к публикации 19.07.2019 г.
Проведено сравнительное исследование экспрессии про- и антиапоптотических рецепторов к ци-
токину TRAIL (TNF-related apoptosis-inducing ligand) на незрелых бластных клетках острого миело-
идного лейкоза, на клетках острого миелоидного лейкоза, дифференцированных в моноцито- и
макрофагоподобные клетки, и на нормальных моноцитах и макрофагах. Было показано, что сниже-
ние экспрессии проапоптотических рецепторов к TRAIL и приобретение устойчивости к TRAIL-
индуцированному апоптозу происходит не только при дифференцировке клеток острого миелоид-
ного лейкоза в моноцито- и макрофагоподобные клетки, но и при созревании нормальных моноци-
тов в макрофаги. Таким образом, дифференцировка как клеток острого миелоидного лейкоза, так
и нормальных миелоидных клеток в моноцитарно-макрофагальном направлении опосредует сни-
жение экспрессии проапоптотических рецепторов к TRAIL, что в свою очередь может определять
устойчивость нормальных миелоидных клеток к TRAIL-индуцированному апоптозу.
Ключевые слова: оcтpый миелоидный лейкоз, цитокин TRAIL, дифференцировка, резистентность.
DOI: 10.1134/S0006302919050107
клетки обладают повышенной чувствительно-
Цитокин Apo2L/TRAIL или TNFSF10 - белок
стью к TRAIL по сравнению с нормальными
семейства фактора некроза опухолей - является
одним из основных молекулярных эффекторов
клетками, главным образом из-за низкой экс-
противоопухолевого иммунитета. Экспрессия
прессии DcR1 и DcR2 - рецепторов ловушек, и
TRAIL показана для NK-клеток, CD8+ T-клеток
большей представленности DR4 и DR5 - проап-
и дендритных клеток. TRAIL является лигандом
оптотических TRAIL-рецепторов [5,6]. Опухо-
для рецепторов TRAIL-R1 (DR4) и TRAIL-R2
левые клетки являются бластными незрелыми
(DR5), при связывании с которыми запускается
клеточными формами, именно на них главным
апоптоз в клетке-мишени [1-3]. Кроме того, ак-
образом направлено действие противоопухоле-
тивность цитокина TRAIL регулируется рецеп-
вого иммунитета, так как вероятность злокаче-
торами-ловушками TRAIL-R3 (DcR1) и TRAIL-
ственной трансформации бластных пролифери-
R4 (DcR2). TRAIL-R3 связывает TRAIL, но не
рующих клеток несоизмеримо выше, чем диф-
способен вызывать апоптоз из-за отсутствия ци-
ференцированных высокоспециализированных
топлазматического домена смерти, однако
неделящихся клеток. Исходя из этого, возникает
TRAIL-R4 может запускать антиапоптотиче-
предположение о роли дифференцировки и/или
скую программу благодаря наличию дефектного
созревания клеток в чувствительности к TRAIL-
DD-мотива в трансмембранном домене [4]. Пер-
индуцированному апоптозу. Так как баланс про-
воначально было обнаружено, что опухолевые
и антиапоптотических рецепторов к TRAIL мо-
жет играть ключевую роль в чувствительности
Сокращения: TRAIL -цитокин семейства факторов некро- клеток к TRAIL-индуцированному апоптозу,
за опухоли (TNF-related apoptosis-inducing ligand), ATRA -
возможно, изменение экспрессии TRAIL-ре-
транс-ретиноевая кислота, PMA - форбол-12-миристат-
13-ацетат.
цепторов в процессе дифференцировки может
906
МОНОЦИТАРНО-МАКРОФАГАЛЬНАЯ ДИФФЕРЕНЦИРОВКА
907
определять чувствительность клеток к TRAIL-
man CD264 (TRAIL-R4) (Biolegend, США). Для
инду-цированному апоптозу.
определения неспецифического связывания
клетки окрашивали соответствующими кон-
Данное исследование было направлено на изу-
трольными изотипами антител. Окрашивание
чение экспрессии рецепторов к TRAIL, и, следо-
проводили при комнатной температуре в темно-
вательно, чувствительности к TRAIL-индуциро-
те, в течение 30 мин. После окрашивания клетки
ванному апоптозу клеток острого миелоидного
фиксировали 2%-м раствором параформальдеги-
лейкоза при дифференцировке в моноцитарно-
да. Анализ экспрессии проводили при помощи
макрофагальном направлении.
проточного цитометра Accuri C6 (BD Bioscience,
США).
МАТЕРИАЛЫ И МЕТОДЫ
Анализ жизнеспособности клеток. Жизнеспо-
Получение белка izTRAIL. Pекомбинантный
собность клеток после инкубации с izTRAIL оце-
белок izTRAIL человека получали по методике,
нивали по интенсивности восстановления реза-
описанной в работе [7].
зурина (Sigma, США). Для этого к клеткам после
инкубации с izTRAIL добавляли резазурин в кон-
Клеточные культуры. В качестве объекта иссле-
центрации 30 мкг/мл. Далее клетки инкубирова-
дования в работе использовали клетки острого
ли с красителем в течение 4 ч при 37°С в условиях
миелоидного лейкоза человека ТНР-1, получен-
5%-го содержания СО2 в воздухе и измеряли ин-
ные из Всероссийской коллекции клеточных
тенсивность флуоресценции при длине волны
культур (Институт цитологии РАН, Санкт-Пе-
возбуждения 532 нм и длине волны испускания
тербург). Клетки ТНР-1 (далее THP-1wt) культи-
590 нм с использованием планшетного спектро-
вировали в среде RPMI 1640/F12 (Sigma, США) с
флюориметра Infinite F200 (Tecan, Австрия). Все
добавлением 20%-й эмбриональной телячьей сы-
измерения проводили относительно контроль-
воротки (Gibco, США), 80 мкг/мл гентамицина
ных клеток, необработанных izTRAIL.
сульфата (Sigma, США), 20 мкг/мл дифлюкана
(Pfizer, США) при 37°С, в условиях 5%-го содер-
Статистический анализ. Результаты представ-
жания СО2 в воздухе. Моноцитоподобные клетки
ляли в виде среднего ± стандартная ошибка
получали с помощью обработки клеток ретиное-
(M ± SEM). Все опыты проводили не менее чем в
вой кислотой (ATRA). Для этого клетки THP-1wt
пяти повторностях (n ≥ 5). Статистическую зна-
культивировали в среде RPMI/F12 с добавлением
чимость отличий определяли c использованием
10%-й эмбриональной телячьей сыворотки в при-
критерия Уилкокcона-Манна.
сутствии 1 мкМ АTRA (Sigma, США) в течение
96 ч. Макрофагоподобные клетки THP-1PMA
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
получали с помощью обработки форбол-12-мири-
стат-13-ацетатом (PMA). Для этого клетки THP-
Снижение экспрессии рецепторов к TRAIL про-
1wt культивировали в среде DMEM/F12 с добав-
исходит на фоне дифференцировки в моноцитарно-
лением 10%-й эмбриональной телячьей сыворот-
макрофагальном направлении. Было показано от-
ки в присутствии 200 нМ PMA (Sigma, США) в те-
сутствие экспрессии антиапоптотических рецеп-
чение 96 ч. Моноциты были получены из моно-
торов (DcR1 и DcR2) к TRAIL у всех исследуемых
нуклеарной фракции периферической крови
типов клеток. Для THP-1wt наблюдался самый
человека с использованием набора MojoSort Hu-
большой процент клеток, несущих проапоптоти-
man Pan Monocyte Isolation Kit (BioLegend,
ческие рецепторы DR4 и DR5 - 65 ± 2% и 71 ± 8%
США), в соответствии с рекомендациями произ-
соответственно. После обработки клеток ATRA
водителя. Макрофаги получали из моноцитов пе-
наблюдалось снижение количества клеток, экс-
риферической крови человека. Для получения
прессирующих проапоптотические рецепторы
макрофагов моноциты высевали на культураль-
DR4 и DR5, до 15 ± 9% и 12 ± 2% соответственно.
ный пластик и инкубировали в течение семи су-
При дифференцировке клеток острого миелоид-
ток в среде DMEM/F12 с 2% фетальной бычьей
ного лейкоза в макрофагоподобные клетки с по-
сыворотки.
мощью PMA происходила полная потеря экс-
Анализ экспрессии рецепторов к TRAIL. Для
прессии проапоптотического рецептора DR4 и
проведения анализа клетки собирали с культу-
снижение количества клеток, несущих DR5 до
ральных флаконов и центрифугировали в Cell
30 ± 3%. У моноцитов периферической крови
Staining Buffer (BioLegend, США) при 300 g в тече-
экспрессия проапоптотического рецептора DR4
ние 5 мин. Окрашивание проводили с использо-
отсутствовала, количество клеток, несущих проа-
ванием моноклональных антител PE anti-human
поптотический рецептор DR5, составляло
TRAIL-R1 (CD261) (BD Bioscience, США), PE
19 ± 7%. Для макрофагов, полученных из моно-
anti-human CD262 (TRAIL-R2) (Biolegend,
цитов периферической крови, показано отсут-
США), Alexa Fluor
647 Anti-human CD263
ствие экспрессии обоих проапоптотических ре-
(TRAIL-R3) (BD Bioscience, США), PE anti-hu-
цепторов (таблица).
БИОФИЗИКА том 64
№ 5
2019
908
ЕВСТРАТОВА и др.
Таблица 1. Анализ экспрессии рецепторов к TRAIL у клеток ТНР-1wt, THP-1ATRA, THP-1PMA, моноцитов и
макрофагов
DR4, %
DR5, %
DcR1, %
DcR2, %
THP-1wt
65 ± 2
71 ± 8
-
-
THP-1ATRA
15 ± 9
12 ± 2
-
-
THP-1PMA
-
30 ± 3
-
-
Моноциты
-
19 ± 7
-
-
Макрофаги
-
-
-
-
Примечание. Представлены данные (в процентах) о доле клеток, несущих данный рецептор, от общего числа клеток.
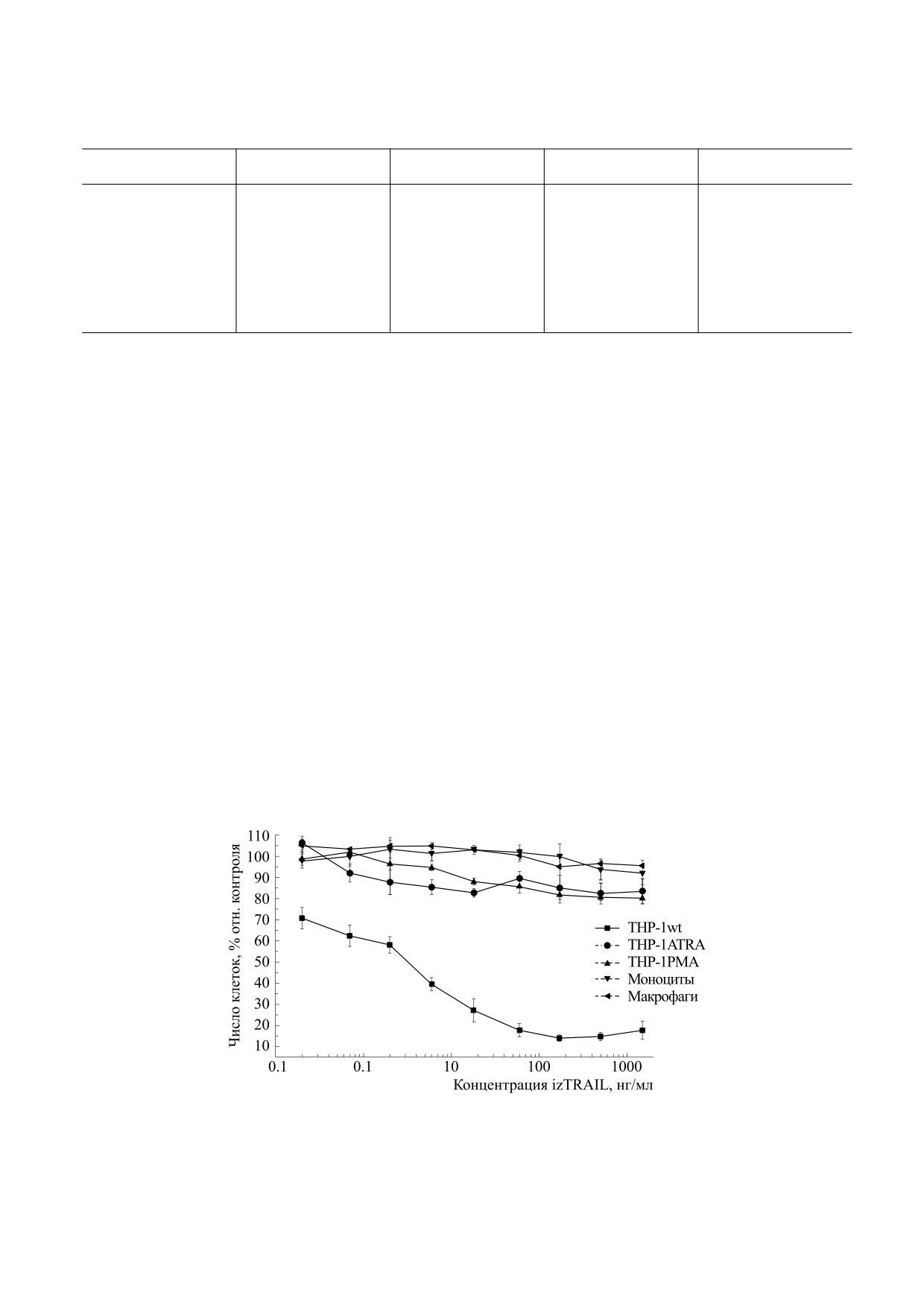
Повышение устойчивости клеток к TRAIL-ин-
правленной дифференцировке лейкозных бла-
дуцированному апоптозу происходит на фоне пони-
стов, так и при созревании нормальных моноци-
жения экспрессии проапоптотических рецепторов к
тов периферической крови в макрофаги.
TRAIL. Полученные данные по анализу экспрес-
Следовательно, модулирование экспрессии про-
сии рецепторов к TRAIL согласуются с анализом
апоптотических рецепторов к TRAIL может яв-
цитотоксического действия izTRAIL на исследуе-
ляться одним из основных механизмов чувстви-
мые типы клеток. Было показано, что 82 ± 6%
тельности бластных клеток острого миелоидного
клеток THP-1wt чувствительны к izTRAIL. Также
лейкоза и устойчивости нормальных зрелых
было показано, что только 15 ± 3% как моноцито-
миелоидных клеток (моноцитов и макрофагов) к
подобных клеток THP-1ATRA, так и макрофаго-
TRAIL-индуцированному апоптозу, как одному
подобных клеток ТНР-1PMA были чувствитель-
из основных эффекторов противоопухолевого
ны к действию izTRAIL. Моноциты перифериче-
иммунитета.
ской крови и макрофаги были резистентными к
TRAIL-индуцированному апоптозу (рисунок).
БЛАГОДАРНОСТИ
Работа выполнена при использовании при-
ЗАКЛЮЧЕНИЕ
борной базы ЦКП ИТЭБ РАН.
Таким образом, снижение экспрессии проапо-
птотических рецепторов к TRAIL и, соответ-
ФИНАНСИРОВАНИЕ РАБОТЫ
ственно, повышение устойчивости к TRAIL-ин-
дуцированному апоптозу происходит на фоне
Работа выполнена при финанcовой поддеpжке
дифференцировки миелоидных клеток в моноци-
cтипендиального гpанта Пpезидента PФ (CП-
тарно-макрофагальном направлении, как при на-
606.2019.4, CП-608.2019.4).
Цитотоксическое действие рекомбинантного белка izTRAIL на клетки ТНР-1wt, THP-1ATRA, THP-1PMA, моноциты
и макрофаги.
БИОФИЗИКА том 64
№ 5
2019
МОНОЦИТАРНО-МАКРОФАГАЛЬНАЯ ДИФФЕРЕНЦИРОВКА
909
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
3. M. J. Smyth, K. Takeda, Y. Hayakawa, et al., Immunity
18 (1), 1 (2003).
Все применимые международные, националь-
4. F. Christina, H. E. Christoph, G. Bjorn, et al., Int. J.
ные и институциональные принципы при выпол-
Biochem. Cell Biol. 39, 1462 (2007)
нении работы были соблюдены.
5. D. Lawrence, Z. Shahrokh, S. Marsters, et al., Nat.
Med. 7, 383 (2001).
СПИСОК ЛИТЕРАТУРЫ
6. A. Ashkenazi, R.C. Pai, S. Fong, et al., J. Clin. Invest.
1. Y. Hayakawa, V. Screpanti, H. Yagita, et al., J. Immu-
104, 155 (1999).
nol. 172 (1), 123 (2004).
7. P. C. Фадеев, А. В. Чеканов, Н. В. Долгиx и дp.,
2. E. M. Janssen, N. M. Droin, E. E. Lemmens, et al.,
Биол. мембpаны: жуpн. мембpанной и клеточной
Nature 434 (7029), 88 (2005).
биологии 29 (6), 433 (2012).
Monocyte-Macrophage Differentiation Suppresses the Expression of Proapoptotic
Receptors to Apo2L/TRAIL and Increases Resistance to TRAIL-Induced Apoptosis
Y.V. Evstratova*, M.I. Kobyakova* V.V. Novikova**, A.S. Senotov*, V.S. Akatov*, and R.S. Fadeev*
*Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Puschino, Moscow Region, 142290 Russia
**Lomonosov Moscow State University, Leninskie Gory 1, Moscow, 119991 Russia
In this study we compared the expression of pro- and anti-apoptotic receptors to the cytokine TRAIL (TNF-
related apoptosis-inducing ligand) on immature blast acute myeloid leukemia cells, on acute myeloid leuke-
mia cells differentiated into monocyte- and macrophage-like cells, and on normal monocytes and macro-
phages. It was shown that a decrease in the expression of proapoptotic receptors to TRAIL and acquired re-
sistance to TRAIL-induced apoptosis occur not only when acute myeloid leukemia cells differentiate into
monocyte- and macrophage-like cells, but also when normal monocytes mature into macrophages. Thus, the
differentiation of both acute myeloid leukemia cells and normal myeloid cells in the monocyte-macrophage
direction mediates a decrease in the expression of proapoptotic receptors to TRAIL, which in turn can deter-
mine the resistance of normal myeloid cells to TRAIL-induced apoptosis.
Keywords: acute myeloid leukemia, cytokine TRAIL, differentiation, resistance
БИОФИЗИКА том 64
№ 5
2019