БИОФИЗИКА, 2019, том 64, № 5, с. 933-937
БИОФИЗИКА КЛЕТКИ
УДК 577.352.4
СРАВНЕНИЕ МЕТОДОВ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ
АТФ-ЗАВИСИМОГО КАЛИЕВОГО КАНАЛА В МИТОХОНДРИЯХ
ПО ВЛИЯНИЮ НА НИХ АТФ
© 2019 г. Н.В. Хмиль* ***, А.А. Мосенцов* **, М.И. Шигаева*, Г.Д. Миронова* **
*Институт теоретической и экспериментальной биофизики РАН,
142290, Пущино Московской области, Институтская ул., 3
**Пущинский государственный естественно-научный институт,
142290, Пущино Московской области, просп. Науки, 3
***Харьковский национальный университет имени В.Н. Каразина, 61077, Харьков, пл. Свободы, 4, Украина
*E-mail: nat-niig@yandex.ru
Поступила в редакцию 04.07.2019 г.
После доработки 04.07.2019 г.
Принята к публикации 12.07.2019 г.
Проведено сравнение двух методов, используемых для изучения работы функционирования мито-
хондриального АТФ-чувствительного калиевого канала, играющего важную роль в физиологии
клетки и в особенности в кардио- и нейропротекции. Показано, что спектрофотометрический ме-
тод, наиболее часто используемый для изучения этого канала и влияния его модуляторов, имеет ряд
ограничений и дает в основном качественную оценку. Предложена модификация этого метода, бла-
годаря которой получаемые кривые изменения оптической плотности имеют линейный характер,
что позволяет количественно оценить изменение оптической плотности и, как следствие, более
точно определить влияние различных модуляторов. Определена концентрация полумаксимального
ингибирования для АТФ (IC50_АТФ), скорости калиевого транспорта, регистрируемого двумя раз-
личными методами в митохондриях печени крыс. Значение IC50_АТФ составило 23 мкМ в случае
прямого измерения 2,4-динитрофенол-индуцированного выхода калия с помощью калий-селек-
тивного микроэлектрода и 400 мкМ - при использовании спектрофотометрического метода. Полу-
ченные данные позволяют говорить о том, что регистрация 2,4-динитрофенол-индуцированного
выхода калия может быть более эффективным методом оценки АТФ-зависимого транспорта ионов
калия в митохондриях.
Ключевые слова: ДНФ-индуцированный транспорт калия, митохондрии, набухание митохондрий, ми-
тохондриальный АТФ-зависимый калиевый канал, кардиопротекция.
DOI: 10.1134/S0006302919050132
Ранее в нашей лаборатории было показано,
Изучение транспорта ионов калия, как основ-
что активация митоКАТФ-канала играет важную
ного катиона цитозоля и митохондриального
матрикса, имеет большое функциональное значе-
роль в несократительном термогенезе при выходе
ние. Особое внимание сейчас уделяется изуче-
животных из состояния зимней спячки [6], участ-
нию работы митохондриального АТФ-чувстви-
вует в защите сердца от ишемии [7-9], влияет на
тельного калиевого канала (митоКАТФ), играю-
развитие воспалительного процесса [10], защи-
щего важную роль в физиологии клетки и
щает ткани от развития гипоксии при повышен-
особенно в кардио- и нейропротекции [1,2]. Уста-
ных физических нагрузках [11]. В последнее вре-
новлено, что митоКАТФ-канал участвует в раз-
мя появилось большое количество публикаций,
витии апоптоза, в защите сердца, мозга и других
направленных на поиск активаторов этого канала
тканей от ишемии [2,4]. В последнее время дока-
[12-15].
зано, что митоКАТФ-канал участвует в коррек-
Спектрофотометрическая оценка калий- и
ции нейродегенеративных заболеваний, таких
АТФ-зависимого набухания митохондрий явля-
как болезнь Паркинсона и болезнь Альцгеймера
ется самым распространенным методом, исполь-
[3,5].
зуемым для оценки работы митохондриального
КАТФ-канала и влияния на нее модуляторов [16].
Сокращения: митоКАТФ - митохондриальный АТФ-чув-
Однако из-за нелинейного характера кривых на-
ствительный калиевый канал, ДНФ - 2,4-динитрофенол.
933
934
ХМИЛЬ и др.
бухания митохондрий, регистрируемых этим ме-
ДНФ-индуцированный выход К+ из митохон-
тодом, количественная оценка входа калия за-
дрий, отражающий работу митоКАТФ-канала в
труднена, поэтому получаемые результаты носят
обратном направлении, изучали с помощью К+-
часто лишь качественный характер [17]. Кроме
селективного валиномицинового электрода
того, этот метод требует использования гипото-
(«НикоАналит», Россия), не регистрирующего
нической среды инкубации митохондрий.
другие ионы, включая натрий, и установки «Re-
В настоящей работе показано, что метод набу-
cord4» (Россия) в ячейке объемом 1 мл при 26°C и
хания может успешно использоваться и для коли-
постоянном перемешивании [19]. Этот метод был
чественной оценки, благодаря изменению поряд-
разработан нами ранее, причем мы учитывали,
ка проведения эксперимента. Кроме того, ранее в
что митоКАТФ-канал, встроенный в бислойную
нашей лаборатории был разработан принципи-
липидную мембрану, может работать в двух на-
ально новый метод оценки АТФ-зависимого
правлениях [19]. Измерения проводили в изото-
транспорта калия в митохондриях, который оце-
нической среде, содержащей 180 мМ сахарозы,
нивался с помощью K+-селективного электрода
70 мМ маннитола, 5 мМ Na2HPO4, 10 мМ трис-
по выходу этого катиона в присутствии разобщи-
НCl (рН 7,4). Концентрация митохондриального
теля окислительного форфорилирования 2,4-ди-
белка в ячейке составляла 0,5-1,0 мг/мл. Выход
нитрофенола (ДНФ) [19]. В настоящей работе
К+ из митохондрий индуцировали добавлением в
проведено сравнение эффективности использо-
среду инкубации 50 мкМ 2,4-динитрофенола, ко-
вания упомянутых выше двух методов (набухания
торый способствовал снижению положительного
и ДНФ-индуцированного транспорта калия) для
потенциала на мембране митохондрий, создавае-
изучения работы митоKATФ-канала, а также ха-
мого вышедшим ионом, что облегчало дальней-
рактера ингибирующего влияния физиологиче-
ских концентраций АТФ на транспорт этого ка-
ший выход К+. Скорость выхода ионов калия из
тиона в митохондриях.
митохондрий выражали в нМ/мин-1·мг белка-1.
Использованные реактивы. В работе использо-
МАТЕРИАЛЫ И МЕТОДЫ
вали: сахарозу, ЭДТА, ЭГТА, трис, HEPES, ATP,
ADP, ДНФ, олигомицин, цитохром с (Sigma,
Выделение митохондрий. Митохондрии печени
США). Остальные реактивы были отечественно-
крыс выделяли из гомогената печени половозре-
го производства квалификации ос.ч. и х.ч.
лых самцов крыс линии Wistar массой 220-250 г
общепринятым методом дифференциального
центрифугирования. Среда выделения для мито-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
хондрий печени крыс содержала: 210 мМ манни-
тола, 70 мМ сахарозы, 0,1% бычьего сывороточ-
АТФ-зависимый калиевый канал является фи-
ного альбумина, 0,5 мМ ЭГТА, 30 мМ HEPES-
зиологически важным каналом, отвечающим за
KOH (pH 7,4). Концентрацию белка определяли
сохранение структуры митохондрий, а также
по методу Лоури [18], используя в качестве стан-
участвующим в адаптации организма к гипоксии.
дарта бычий сывороточный альбумин.
В связи с этим в настоящее время широко изуча-
Вход ионов калия в митохондрии определяли по
ется активность работы этого канала и возмож-
скорости набухания митохондрий в гипотониче-
ность его модуляции при помощи природных и
ской среде, содержащей
50 мМ KCl,
5 мМ
фармакологических модуляторов с целью стиму-
NaH2PO4, 0,1 мМ ЭГТА, 5 мкМ цитохрома с,
лирования процессов адаптации клетки к воздей-
10 мМ HEPES (pH 7,4). Кинетику набухания ре-
ствию различных повреждающих факторов. Ос-
гистрировали на спектрофотометре UV-2450
новным и общепринятым методом, который ис-
(Shimadzu, Япония) по изменению оптической
пользуется для изучения активности этого
плотности суспензии митохондрий при длине
канала, является метод динамической спектро-
волны 520 нм при постоянном перемешивании и
фотометрии, базирующийся на изменении свето-
термостатировании при 26°С. Набухание мито-
рассеяния суспензии митохондрий в результате
хондрий инициировали двумя способами. В пер-
их набухания в гипотонической среде [17,20,21].
вом случае применяли общепринятый метод, при
Обычно активность канала определяется измене-
котором реакцию запускали добавлением мито-
нием оптической плотности при добавлении ми-
хондрий в кювету, содержащую среду инкубации
тохондрий в кювету, содержащую среду и суб-
и субстраты дыхания (5 мМ сукцината, 2 мкМ ро-
страты дыхания. Получаемые спектры поглоще-
тенона). Во втором случае реакцию запускали до-
ния имеют нелинейный характер и используются
бавлением 5 мМ сукцината в ту же среду инкуба-
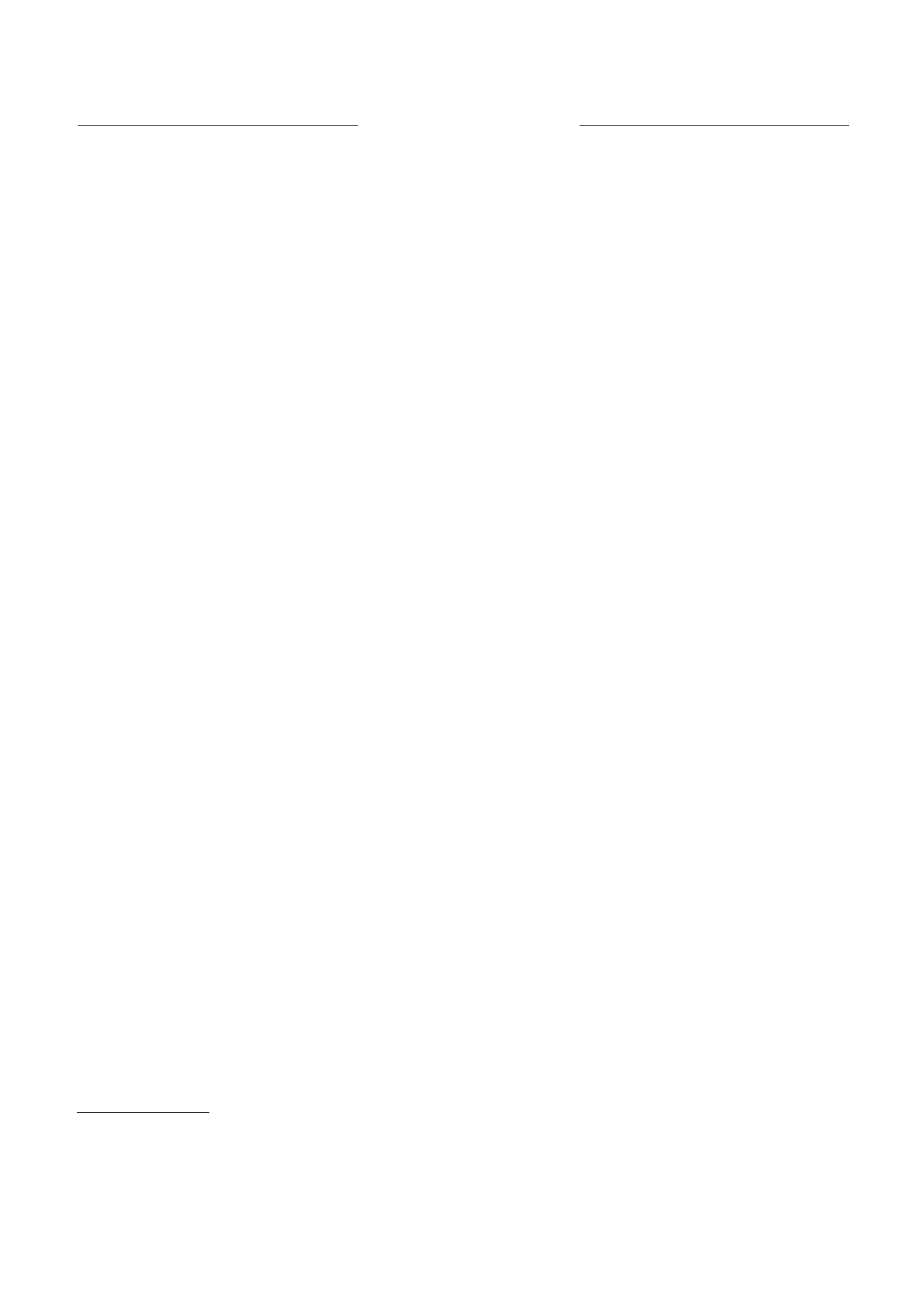
в основном для качественного анализа (рис. 1а).
ции, содержащую митохондрии. Концентрация
Это затрудняет сравнение полученных результа-
митохондриального белка в ячейке составляла
тов, особенно в случае изучения влияния различ-
0,2-0,3 мг/мл.
ных модуляторов канала, а также измерения ак-
БИОФИЗИКА том 64
№ 5
2019
СРАВНЕНИЕ МЕТОДОВ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ
935
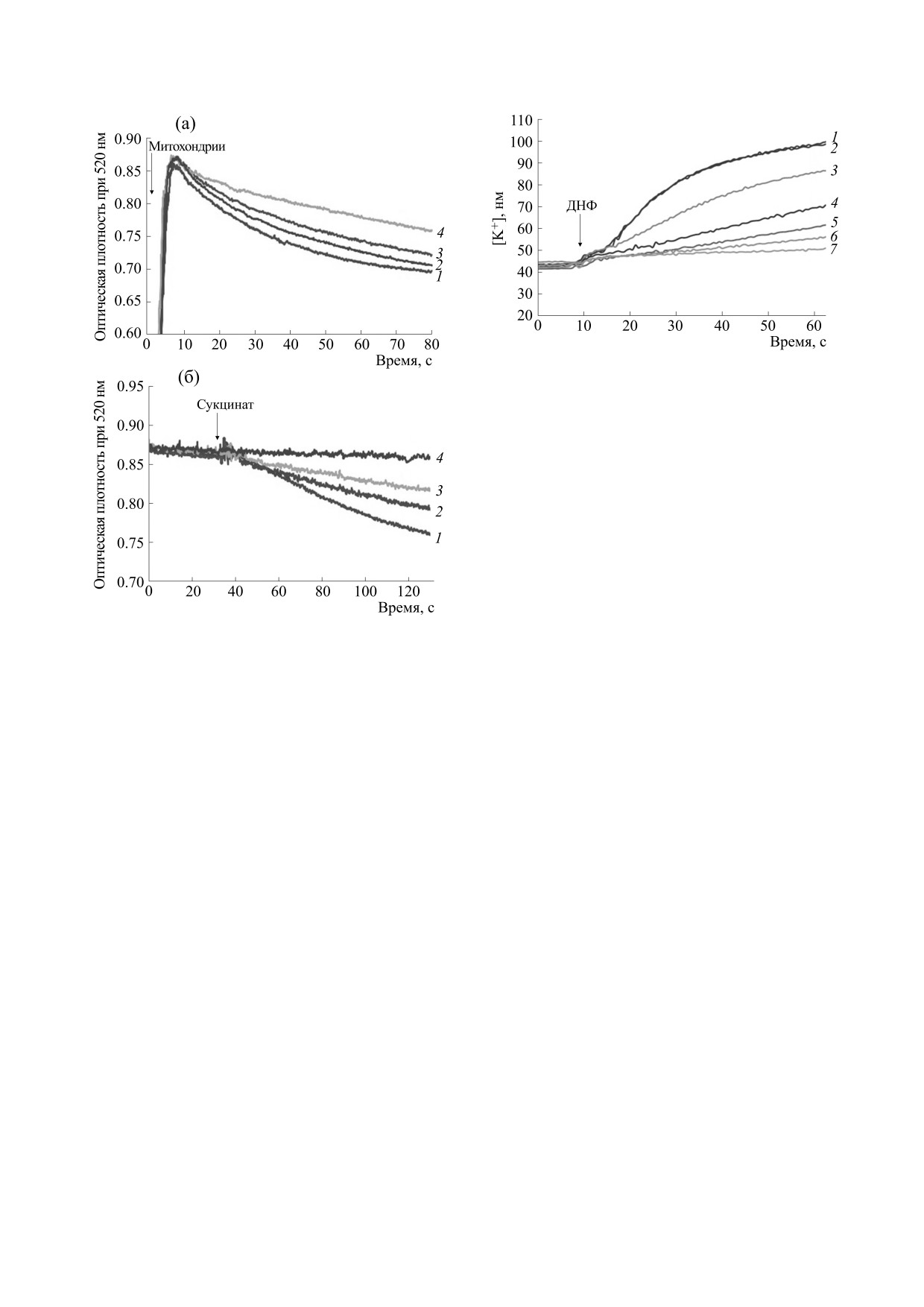
Рис. 2. Пример полученных потенциометрическим
методом типовых кривых кинетики выхода ионов
калия в среду инкубации, не содержащую калий.
Стрелкой отмечен момент добавления ДНФ
(50 мкМ). Обозначение кривых: 1 - контроль (без
добавок); 2-7 - в среде инкубации присутствует 2,5,
5,0, 50, 100, 200 и 500 мкМ АТФ соответственно.
Этот выход осуществляется по градиенту ионов
калия, так как в митохондриях находится 140 мМ
КCl, а в среде инкубации ионы калия отсутству-
ют. Ранее было установлено, что канал может ра-
ботать в обоих направлениях [22], калий начинает
выходить через митохондриальную мембрану по
своему градиенту, создавая снаружи на мембране
Рис.
1. Типичные кривые изменения оптической
положительный потенциал. Этот потенциал
плотности суспензии митохондрий печени крысы в
сбрасывается добавлением разобщителя окисли-
зависимости от времени в контроле и после добавле-
тельного фосфорилирования, что облегчает даль-
ния разных концентраций АТФ. (а) - Измерения
проводили общепринятым методом (реакция запус-
нейший выход иона из митохондрий. Калий вы-
кается добавлением митохондрий): 1 - контроль, 2 -
ходит до тех пор, пока не уравнивается градиент
0,25 мМ АТФ, 3 - 0,5 мМ АТФ, 4 - 1 мМ АТФ. (б) -
Измерения проводили модифицированным в нашей
его концентрации между митохондриями и сре-
лаборатории методом (реакция запускается добавле-
дой, что видно по добавлению тритона Х-100. В
нием субстрата): 1 - контроль, 2 - 0,5 мМ АТФ, 3 -
нашем случае мы стимулируем выход ионов ка-
1 мМ АТФ, 4 - без добавления субстрата.
лия добавлением в среду, не содержащую этот
ион, разобщителя окислительного фосфорилиро-
тивности митоКАТФ-канала при различных фи-
вания 2,4-динитрофенола (рис. 2). Однако другие
зиологических и патологических состояниях.
разобщители окислительного фосфорилирова-
Нами была предложена модификация этого
ния также стимулируют выход калия.
метода, заключающаяся в том, что изменение оп-
Используя представленные выше методы ре-
тической плотности определяется после добавле-
гистрации транспорта калия в митохондриях, мы
ния субстрата дыхания в кювету, содержащую
среду и митохондрии. В данном случае кривые
провели исследования по влиянию физиологиче-
изменения оптической плотности, особенно их
ских концентраций АТФ на этот транспорт.
начальная часть, имеют линейный характер
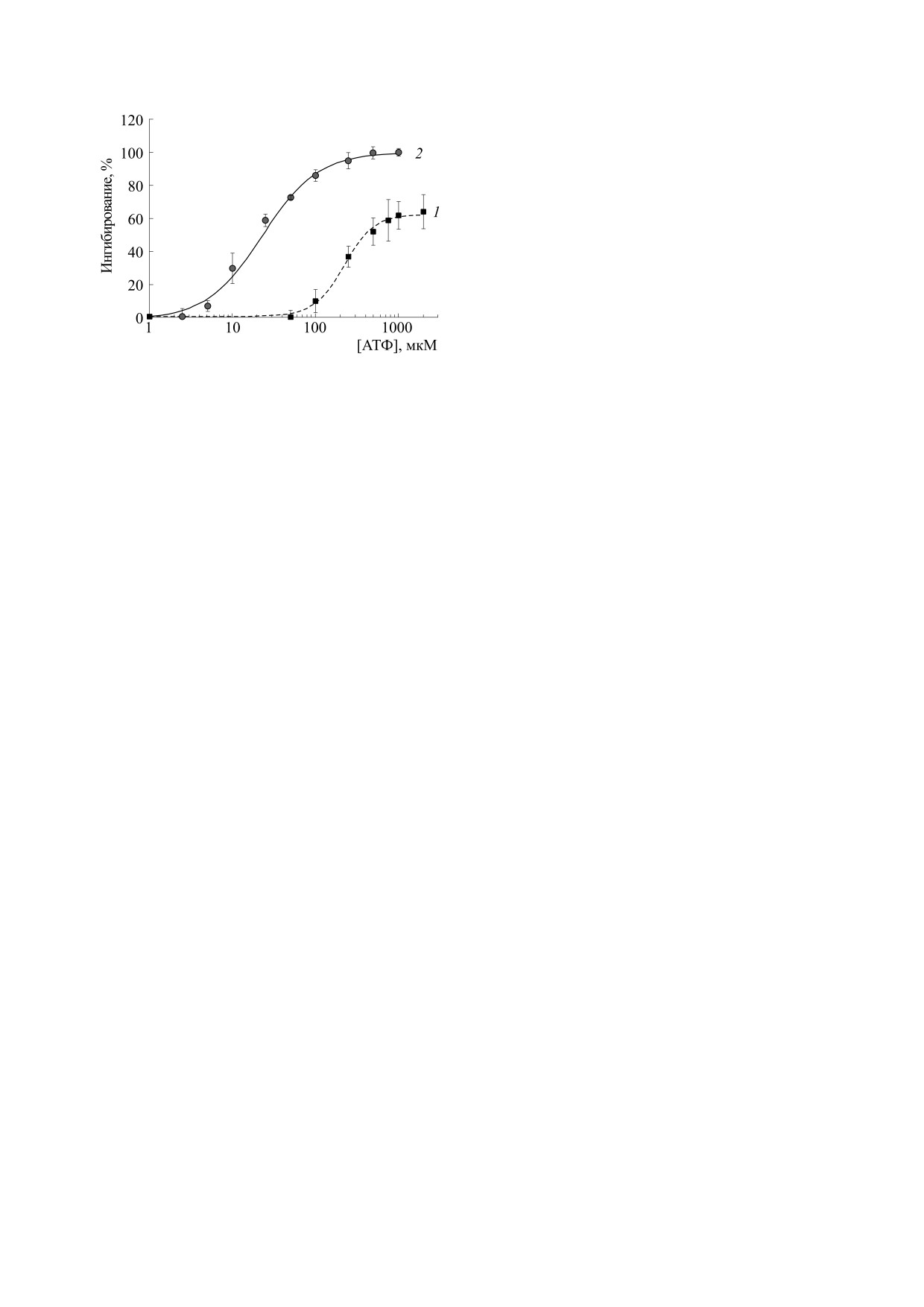
Сравнение полученных при этом данных показа-
(рис. 1б), что позволяет количественно оценить
ло, что более эффективным является метод ДНФ-
изменение оптической плотности и, как след-
индуцированного выхода калия, так как АТФ при
ствие, более точно определить влияние различ-
его использовании практически полностью инги-
ных модуляторов на работу канала.
бирует транспорт калия, в то время как спектро-
На рис. 2 представлены данные по определе-
фотометрический метод дает в среднем 50-60%
нию параметров АТФ-зависимого выхода ионов
ингибирования (рис. 3). Из этого следует, что по-
калия с помощью K+-селективного электрода.
следний метод, наряду с АТФ-зависимым транс-
БИОФИЗИКА том 64
№ 5
2019
936
ХМИЛЬ и др.
пользования животных при выполнении работы
были соблюдены.
СПИСОК ЛИТЕРАТУРЫ
1.
K. Garlid, P. Paucek, V. Yarov-Yarovoy, et al., Circ.
Res. 81 (6), 1072 (1997).
2.
L. Testai, S. Rapposelli, A. Martelli, et al., Med. Res.
Rev. 35 (3), 520 (2015).
3.
K. Peng, J. Hu, J. Xiao, et al., Biochim. Biophys. Acta.
Mol. Basis Dis. 1864 (4, Pt A), 1086 (2018).
4.
P. Duan, J. Wang, Y. Li, et al., Int. J. Mol. Med. 42 (5),
2709 (2018).
5.
Y. Son, K. Kim, and H. R. Cho, Biochem. Biophys.
Res. Commun. 500 (2), 504 (2018)
Рис. 3. Зависимость изменения оптической плотно-
сти суспензии митохондрий печени крысы (кривая 1)
6.
Г. Д. Миронова, Н. И. Федотчева, Ю. Ю. Скарга и
и скорости ДНФ-индуцированного выхода ионов ка-
М. Н. Кондрашова, в сб. Механизмы зимней спячки
лия (кривая 2) от концентрации АТФ. Представлены
(Пущино, 1987), сс. 39-47.
средние значения семи экспериментов с двумя-тремя
повторами в каждом ± стандартная ошибка.
7.
I. B. Krilova, E. V. Kachaeva, O. M. Rodionova, et al.,
Exp. Gerontol. 41 (7), 697 (2006).
8.
И. Б. Крылова, В. В. Бульон, Е. Н. Селина и др.,
портом калия, регистрирует и независимый от
Бюл. Федерального центра сердца, крови и
АТФ транспорт этого иона.
эндокринологии им. В.А. Алмазова, № 5, 44 (2012).
Кроме того, расчет показал, что концентрация
9.
Е. В. Розова, И. Н. Маньковская и Г. Д. Миронова,
полумаксимального ингибирования (IC50), как
Биохимия 80 (8), 1186 (2015).
показатель эффективности работы ингибитора, в
10.
G. D. Mironova, M. O. Khrenov, E. Y. Talanov, et al.,
нашем случае АТФ, составила ~23 мкМ АТФ для
Arch. Biochem. Biophys. 654, 70 (2018).
ДНФ-индуцированного выхода калия, в то время
11.
И. Н. Маньковская, В. И. Носарь, О. С. Горбачева
для спектрофотометрического метода она была
и др., Биофизика 59 (5), 941 (2014).
равна 400 мМ АТФ. Следует подчеркнуть, что
данные, полученные с использованием калий-се-
12.
R. Ockaili, F. Salloum, J. Hawkins, and R. Kukreja,
лективного электрода, согласуются с результата-
Am. J. Physiol. Heart Circ. Physiol. 283, 1263 (2002).
ми, полученными на встроенном в липосомы ми-
13.
Г. Д. Миронова, Е. В. Качаева, М. И. Балина и др.,
тохондриальном АТФ-чувствительном калиевом
Вестн. РАМН 2, 44 (2007).
канале [23].
14.
G. Mironova, A. Negoda, B. Marinov, et al., J. Biol.
Chem. 279 (31), 32562 (2004).
ЗАКЛЮЧЕНИЕ
15.
M. Laskowski, B. Augustynek, B. Kulawiak, et al., Bio-
Полученные данные позволяют говорить о по-
chim. Biophys. Acta. Bioenergetics 1857, 1247 (2016).
тенциальной возможности и целесообразности
16.
A. P. Wojtovich, D. M. Williams, M. K. Karcz, et al.,
более широкого применения ДНФ-индуциро-
Circ. Res. 106 (7), 1190 (2010).
ванного выхода калия для изучения как скорости
17.
C. O. Smith, K. Nehrke, and P.S. Brookes, Biochem. J.
транспорта ионов калия в митохондриях, так и
474 (12), 20674 (2017).
количества калия в них. Кроме этого, модифици-
рованный в нашей лаборатории спектрофотомет-
18.
O. Lowry, N. Rosebrough, A. Farr, and R. Randall, J.
рический метод, в котором реакция запускается
Biol. Chem. 193 (1), 265 (1951).
не добавлением митохондрий, а добавлением
19.
О. В. Баранова, Ю. Ю. Скарга, A. Е. Негода и Г.
субстрата, также может эффективно использо-
Д. Миронова, Биохимия 65 (2), 86 (2000).
ваться для изучения работы АТФ-зависимого ка-
20.
K. Garlid and A. Beavis, J. Biol. Chem. 260 (25), 13434
лиевого канала, позволяя количественно оценить
(1985).
влияние на нее активаторов и ингибиторов этого
канала.
21.
A. Beavis, R. Brannan, and K. Garlid, J. Biol. Chem.
260 (25), 13424 (1985).
22.
I. Inoue, H. Nagase, K. Kishi, and T. Higuti, Nature
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
352 (6332), 244 (1991).
Все применимые международные, националь-
23.
P. Paucek, G. Mironova, F. Mahdi, et al., J. Biol.
ные и институциональные принципы ухода и ис-
Chem. 267, 26062 (1992).
БИОФИЗИКА том 64
№ 5
2019
СРАВНЕНИЕ МЕТОДОВ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ
937
A Comparison of Impact of ATP factor on Mitochondrial Function Using Different
Methods for Measuring Activity of ATP-Sensitive Potassium Channel in Mitochondria
N.V. Khmil* ***, А.А. Mosencov* **, M.I. Shigaeva*, and G.D. Mironova* **
*Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Pushchino State University, prosp. Nauki 3, Pushchino, Moscow Region, 142290 Russia
***V.N. Karazin Kharkiv National University, pl. Svobody, 4, Kharkiv, 61077 Ukraine
We compared two methods for estimating functional activity of the mitochondrial ATP-sensitive potassium
channel that plays an important role in cell physiology and, in particular, in cardio and neuroprotection. It
has been shown that a spectrophotometric method, which is often used to study potassium channel function
and the impact of its modulators has a number of limitations and principally provides qualitative assessment.
Here, we proposed a modification of this method, whereby the absorbance curves can be linearized. This
makes it possible to obtain a reliable quantitative assessment of changes in optical density and, as a conse-
quence, to more accurately determine the impact of various modulators. The half maximal inhibitory con-
centration of ATP (IC50_ATP) for the rate of potassium transport in rat liver mitochondria was determined us-
ing two different methods. The IC50_ATP value was equal to 23 μM when a direct measurement of the 2,4-di-
nitrophenol-induced K+ efflux with a potassium-selective microelectrode was performed, and to 400 μM
using spectrophotometric method. The data obtained suggest that the measurement of the 2,4-dinitrophe-
nol-induced K+ efflux can be more efficient method for evaluating ATP-dependent potassium transport in
mitochondria.
Keywords: 2,4-dinitrophenol-induced potassium efflux, swelling, mitochondria, mitochondrial ATP-dependent
potassium channel, cardioprotection
БИОФИЗИКА том 64
№ 5
2019