БИОФИЗИКА, 2019, том 64, № 5, с. 938-944
БИОФИЗИКА КЛЕТКИ
УДК 577.23
УЛЬТРАСТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ
МИТОХОНДРИЙ ПЕЧЕНИ КРЫС ПРИ ЭКСПЕРИМЕНТАЛЬНОМ
САХАРНОМ ДИАБЕТЕ I ТИПА
© 2019 г. В.С. Старинец*, Е.В. Лебедева*, И.Б. Михеева**, Н.В. Белослудцева**,
М.В. Дубинин*, К.Н. Белослудцев* **
*Марийский государственный университет, 424000, Йошкар-Ола, площадь Ленина, 1
**Институт теоретической и экспериментальной биофизики РАН, 142290, Пущино, Институтская ул., 3
E-mail: bekonik@gmail.com
Поступила в редакцию 14.06.2019 г.
После доработки 14.06.2019 г.
Принята к публикации 08.07.2019 г.
Изучены особенности ультраструктуры и функционирования митохондрий печени крыс линии
Sprague Dawley с экспериментальным сахарным диабетом I типа. Установлено, что сахарный
диабет, вызванный введением крысам стрептозотоцина в дозе 75 мг/кг массы тела, сопровождается
нарушением структуры митохондриальных крист и уменьшением размера органелл по сравнению с
контролем. Показано, что скорости дыхания митохондрий в метаболических состояниях 2, 3 и 4
увеличиваются при развитии у крыс диабета I типа. Это может быть связано с увеличением общего
содержания жирных кислот в митохондриях печени диабетических крыс. В то же время
моделирование стрептозотоцин-индуцированного диабета у крыс не оказывало достоверного
влияния на показатели эффективности окислительного фосфорилирования (АДФ/О, дыхательный
контроль и время фосфорилирования) митохондрий печени.
Ключевые слова: сахарный диабет I типа, митохондрии, митохондриальное дыхание, окислительное
фосфорилирование.
DOI: 10.1134/S0006302919050144
как глаза, почки, печень, сердце, мозг, а также в
Сахарный диабет и вызываемые им осложне-
скелетных мышцах [2-4].
ния являются одними из самых распространен-
ных эндокринных заболеваний во всем мире.
Печень играет важную роль в поддержании го-
меостаза глюкозы в организме [5]. Косвенно или
Клинически сахарный диабет представляет собой
непосредственно она является основной мише-
гетерогенное заболевание, связанное с наруше-
нью действия инсулина [6]. В то время как высво-
нием усвоения глюкозы, которое вызвано отно-
бождение инсулина уменьшается при диабете,
сительной или абсолютной недостаточностью
выработка глюкагона возрастает, что способству-
гормона инсулина, что в конечном итоге приво-
ет увеличению скорости разложения гликогена.
дит к гипергликемии. Согласно современной
Таким образом, клетки печени первыми подвер-
классификации существуют два основных типа
гаются воздействию больших концентраций глю-
диабета. Сахарный диабет I типа - аутоиммунная
козы по сравнению с другими клетками организ-
патология, связанная с деструкцией β-клеток
ма. Высокий уровень глюкозы может являться
поджелудочной железы, результатом которой
причиной неферментативного гликозилирова-
становится абсолютная недостаточность инсули-
ния белков и липидов и в конечном итоге приво-
на в организме [1]. Сахарный диабет II типа раз-
дить к изменениям энергетического обмена. Кро-
вивается в результате нарушения механизмов вза-
ме того, изменения в синтезе АТФ также влияют
имодействия инсулина с клетками организма
на степень гликолиза, уменьшая утилизацию
(инсулинорезистентность), его патологические
глюкозы, поскольку активность глюкокиназы (и
проявления связаны с глюкозотоксичностью и
гексокиназы) зависит от внутриклеточного пула
АТФ [7].
липотоксичностью, которые приводят к возник-
новению различных осложнений в таких органах,
В клетках основная роль в поддержании энер-
гетического метаболизма принадлежит митохон-
Сокращения: ДНФ - 2,4-динитрофенол.
дриям, которые производят большую часть АТФ с
938
УЛЬТРАСТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ МИТОХОНДРИЙ
939
помощью реакций окислительного фосфорили-
3) при стрептозотоцин-индуцированном диабете
рования. Поскольку АТФ необходим для многих
I типа увеличивается содержание жирных кислот в
клеточных процессов, митохондрии играют важ-
митохондриях печени.
ную роль в регуляции метаболизма и поддержа-
нии нормального функционирования клеток в
МАТЕРИАЛЫ И МЕТОДЫ
целом [8]. При этом митохондрии являются ис-
точником активных форм кислорода, которые
Моделирование сахарного диабета I типа у
участвуют во многих патологических процессах и
крыс. В работе были использованы неполо-
часто играют существенную роль в физиологиче-
возрелые самцы крыс линии Sprague Dawley
ских механизмах гибели клеток [9].
массой 90-100 г. Крысы были случайным обра-
Общепризнано, что митохондрии принимают
зом распределены на две группы по пять особей
в каждой - контрольную и эксперименталь-
непосредственное участие в развитии сахарного
диабета [10]. Так, было установлено, что мито-
ную. Экспериментальная группа получала од-
хондриальная дисфункция напрямую связана с
нократные внутрибрюшинные инъекции вы-
общими метаболическими дефектами, вызван-
соких доз стрептозотоцина в концентрации
ными диабетом, ожирением и его метаболиче-
75 мг/кг массы тела животного, контрольная
группа - эквивалентный объем цитратного бу-
скими осложнениями [11]. Также известно, что
при сахарном диабете I и II типов происходит
фера. Через одну неделю после инъекции раз-
снижение энергетического метаболизма [12]. На
витие сахарного диабета подтверждали посред-
клеточном уровне сахарный диабет II типа харак-
ством измерения уровня глюкозы в крови жи-
теризуется нарушением митохондриальной дина-
вотных с помощью глюкометра OneTouch select
Plus (LifeScan Johnson & Johnson, США). При
мики - увеличением деления и снижением слия-
ния митохондрий [13-15]. Еще одним проявле-
этом концентрация глюкозы в крови крыс кон-
нием митохондриальной дисфункции при
трольной группы была в пределах нормы и со-
сахарном диабете является индукция окислитель-
ставляла 5-6 ммоль/л, а у животных со стреп-
ного стресса [16,17]. Тем не менее данные, пред-
тозотоцин-индуцированным диабетом
-
25 ммоль/л и выше. Через две недели после вве-
ставленные в литературе, в некоторой степени
являются разрозненными и не раскрывают пол-
дения стрептозотоцина животных забивали
ной картины изменений, происходящих на уров-
способом декапитации.
не митохондрий, выделенных из печени.
Выделение митохондрий печени крыс. Мито-
Особое место в изучении физиологических и
хондрии выделяли из печени крыс описанным
патологических изменений этого заболевания от-
ранее методом дифференциального центрифуги-
рования [19]. В состав среды выделения входили
водится моделям диабета на животных, которые
210 мМ маннитола, 70 мМ сахарозы, 1 мМ ЭДТА,
позволяют строго контролировать условия экспе-
10 мМ HEPES/KOH, рН 7,4. Последующие этапы
римента, что практически недостижимо в челове-
ческой популяции. Так, в настоящей работе
центрифугирования проводили с использовани-
были использованы крысы линии Sprague Dawley с
ем того же буфера, но с заменой ЭДТА на 100 мкМ
ЭГТА. Концентрацию митохондриального белка
экспериментальным сахарным диабетом I типа,
измеряли с помощью метода Лоури [20]. Полу-
полученным в результате селективного разруше-
ченная суспензия митохондрий содержала 70-
ния β-клеток с помощью стрептозотоцина, анти-
биотика широкого спектра действия, обладающего
80 мг белка в 1 мл.
диабетогенным эффектом. После введения стреп-
Электронно-микроскопические исследования.
тозотоцина у крыс появляются многие характер-
Для электронной микроскопии кусочки ткани
ные признаки, наблюдаемые у пациентов с инсу-
печени забирали у декапитированного животного
линзависимым типом диабета: гипоинсулинемия,
и фиксировали в 2,5%-м растворе глутаральдеги-
гипергликемия, кетонурия и гиперлипидемия [18].
да в 0,1 М фосфатно-солевом буфере, рН 7,4 в те-
В связи с вышесказанным, целью настоящей рабо-
чение 2 ч. После отмывания буфером ткань до-
ты являлось определение взаимосвязанных изме-
фиксировали в течение 2 ч 1%-м раствором осми-
нений ультраструктуры и функциональной актив-
евой кислоты в фосфатно-солевом буфере и
ности митохондрий печени крыс линии Sprague
обезвоживали в спиртах возрастающих концен-
Dawley при индукции у них сахарного диабета I ти-
траций. Полученные образцы заключали в смолу
па. В работе показано: 1) при стрептозотоцин-ин-
Epon 812. Ультратонкие срезы (толщиной 70-
дуцированном диабете у крыс происходит измене-
75 нм) готовили на микротоме Leica EM UC6
ние структуры крист митохондрий печени; 2) ос-
(ФРГ) и окрашивали уранилацетатом и цитратом
новные функциональные параметры митохондрий
свинца. Препараты просматривали и фотографи-
(АДФ/О, дыхательный контроль и время фосфо-
ровали в электронном микроскопе JEM-100B
рилирования) не изменяются при индукции диа-
(JEOL, Япония). Ультраструктурный анализ про-
бета I типа у крыс; вместе с тем увеличиваются ско-
водили на негативах, оцифрованных с помощью
рости дыхания митохондрий в состояниях 2, 3 и 4;
сканера Epson V700. Морфометрический анализ
БИОФИЗИКА том 64
№ 5
2019
940
СТАРИНЕЦ и др.
осуществляли на фотонегативах с использовани-
пробирку и высушивали в потоке аргона при
ем программы Image Tool.
25°С. Полученную фракцию подвергали метили-
рованию в результате добавления однократного
Определение параметров митохондриального
объема смеси 5%-й серной кислоты/метанола с
дыхания и окислительного фосфорилирования.
последующей инкубацией при 100°С в течение
Скорость потребления кислорода измеряли по-
лярографическим методом с помощью кислород-
3 ч. Реакцию останавливали добавлением трех-
кратного объема 5%-го K2CO3. Полученные ме-
ного электрода типа Кларка (Oxygraph-2k, Ав-
стрия) при постоянном перемешивании и темпе-
тиловые эфиры экстрагировали четырехкратным
ратуре 26°С [21]. Среда инкубации содержала
объемом гексана, а затем упаривали азотом до
130 мM KCl, 5 мM KH2PO4, 10 мкM ЭГТА, 10 мM
объема 100 мкл. Образцы анализировали в систе-
HEPES/KOH, pH 7,4. Были использованы следу-
ме для газовой хроматографии Chromatek-Crystal
5000 («Хроматэк», Россия). На основании полу-
ющие концентрации субстрата дыхания и других
ченных хроматограмм было рассчитано общее
реактивов: 5 мM сукцината калия, 0,2 мM AДФ,
количество жирных кислот в образце.
50 мкM 2,4-динитрофенола (ДНФ) и 1 мкM роте-
нона. Скорости дыхания митохондрий (V2, V3, V4
Статистическая обработка данных. Получен-
и VДНФ - скорости в состояниях 2, 3, 4 и разоб-
ные результаты были проанализированы с ис-
щенном состоянии соответственно) выражали в
пользованием программ GraphPad Prism 5 и Mic-
rosoft Excel и представлены как средние значения
нмоль O2 · мин-1 · мг-1 белка. Митохондриаль-
с учетом стандартной ошибки от трех до семи экс-
ное дыхание оценивали по следующим показате-
периментов. Статистическую значимость между
лям: состояние 2 - субстратное дыхание; состоя-
данными определяли с помощью t-критерия; зна-
ние 3 - АДФ-стимулированное дыхание; состоя-
чимыми считались различия, удовлетворяющие
ние 4 - скорость дыхания митохондрий при
условию p < 0,05.
полном исчерпании добавленного ранее АДФ;
разобщенное состояние - дыхание митохондрий,
стимулированное добавлением протонофорного
РЕЗУЛЬТАТЫ
разобщителя ДНФ. Дыхательный контроль опи-
сывается отношением скорости дыхания в при-
Изменения морфологии митохондрий, выделен-
сутствии АДФ к скорости, когда он полностью
ных из печени крыс со стрептозотоцин-индуциро-
перешел в АТФ (состояние 3/состояние 4), отно-
ванным диабетом I типа. Согласно литературным
шение АДФ/О определяли согласно работе [22].
данным, митохондрии различных тканей (мыш-
Время фосфорилирования измеряли в секундах и
цы, мозг и т.д.) претерпевают ряд как структур-
определяли как время, необходимое митохондри-
ных, так и функциональных изменений, опосре-
ям для фосфорилирования всего ранее добавлен-
дованных развитием сахарного диабета [24,25]. В
ного АДФ. При регистрации параметров дыхания
свою очередь, в данной работе с помощью метода
использовали митохондрии с концентрацией
электронной микроскопии были определены
белка 0,5-1,0 мг/мл.
морфологические изменения митохондрий, вы-
деленных из печени крыс с моделью диабета I ти-
Определение содержания и состава жирных кис-
па, индуцированной стрептозотоцином.
лот в мембранах митохондрий печени крыс. Содер-
жание жирных кислот в составе фосфолипидов,
На рис. 1 представлены микрофотографии ми-
образующих митохондриальные мембраны,
тохондрий гепатоцитов контрольных животных и
определяли методом газовой хроматографии.
со стрептозотоцин-индуцированным диабетом
Экстракцию липидов из митохондрий проводили
I типа. Исходя из представленных микрофотогра-
по методике, описанной в работе [23] с изменени-
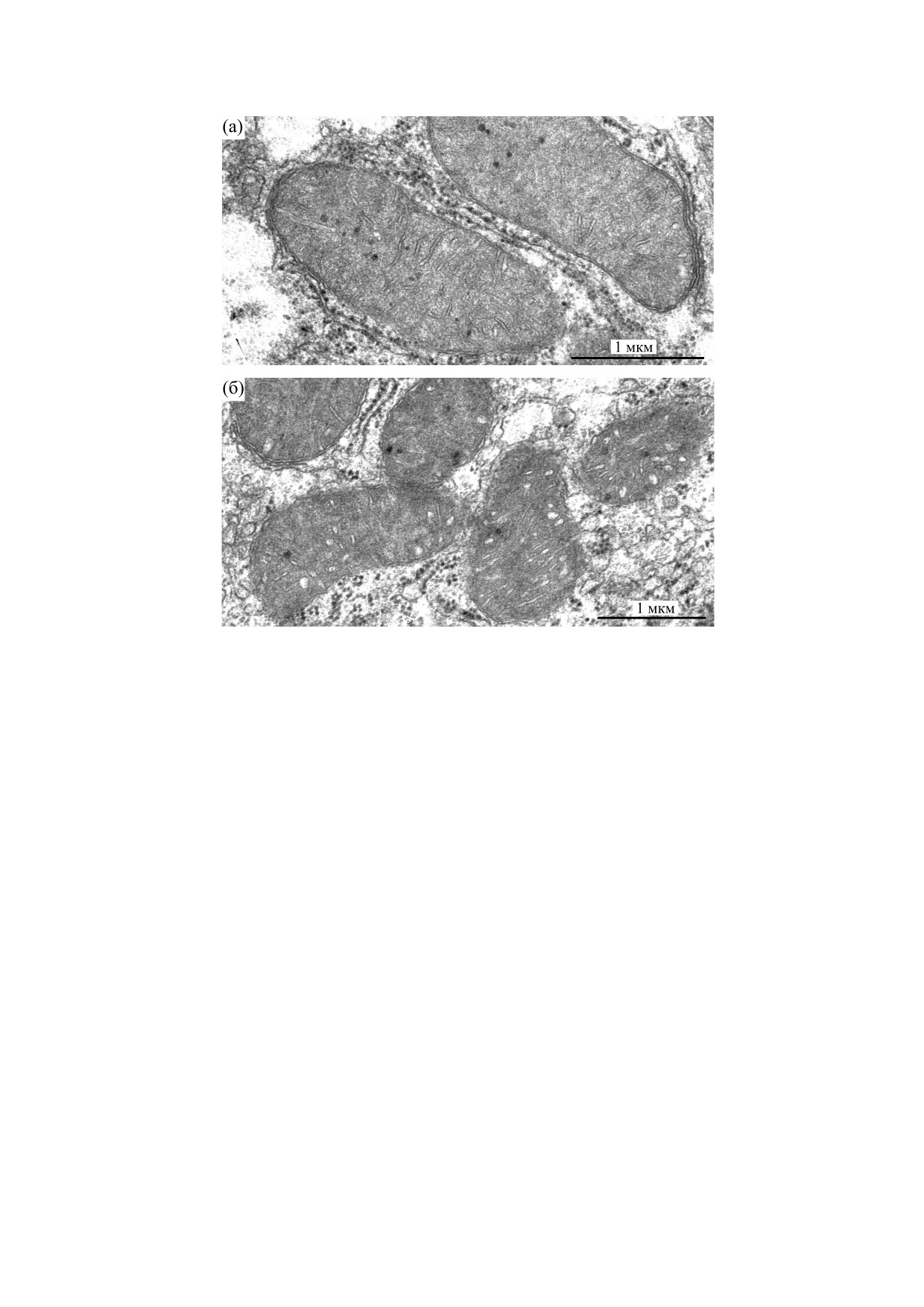
фий, видно, что митохондрии печени контроль-
ями. Митохондрии печени крыс (с концентраци-
ных животных имеют бобовидную структуру,
ей митохондриального белка 2 мг/мл) помещали
электронноплотный матрикс и равномерную ис-
в центрифужную пробирку, в которую затем до-
черченность крист. У крыс с экспериментальным
бавляли 200 мкл воды и 900 мкл смеси хлоро-
диабетом I типа митохондрии обладают меньшим
форм/метанол (в объемном соотношении 2 : 1).
размером по сравнению с митохондриями печени
Полученную смесь инкубировали при комнатной
контрольной группы. В целом форма митохон-
температуре в течение 30 мин при периодическом
дрий практически не изменяется. При этом
перемешивании. Также к образцам в качестве
структура митохондрий печени крыс с сахарным
внутреннего стандарта добавляли гептадекано-
диабетом претерпевает изменения - наблюдается
вую кислоту, растворенную в гексане (C17:0, с
деформация крист и внешней мембраны орга-
концентрацией 0,15 мкг/мл). Разделение слоев
нелл. В свою очередь, матрикс митохондрий со-
хлороформа и смеси вода/метанол осуществля-
храняется электронноплотным. Также можно за-
лось посредством центрифугирования при 10000 g
метить изменения во взаимодействии митохон-
в течение 10 мин при 4°C. Нижний слой, содержа-
дрий с эндоплазматическим ретикулумом: в
щий липидную фракцию, переносили в другую
клетках печени контрольных животных присут-
БИОФИЗИКА том 64
№ 5
2019
УЛЬТРАСТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ МИТОХОНДРИЙ
941
Рис. 1. Электронные микрофотографии митохондрий печени контрольной группы крыс (а) и крыс с эксперименталь-
ным стрептозотоцин-индуцированным диабетом I типа (б).
ствуют достаточно плотные контакты с митохон-
Из табл. 1 видно, что скорости дыхания мито-
дриями, в то время как в клетках печени крыс со
хондрий, выделенных из печени крыс со стрепто-
стрептозототоцин-индуцированным диабетом I
зотоцин-индуцированным диабетом I типа, до-
типа такая картина не повторяется.
стоверно увеличивались в метаболических состо-
яниях V2, V3 и V4. При этом параметры
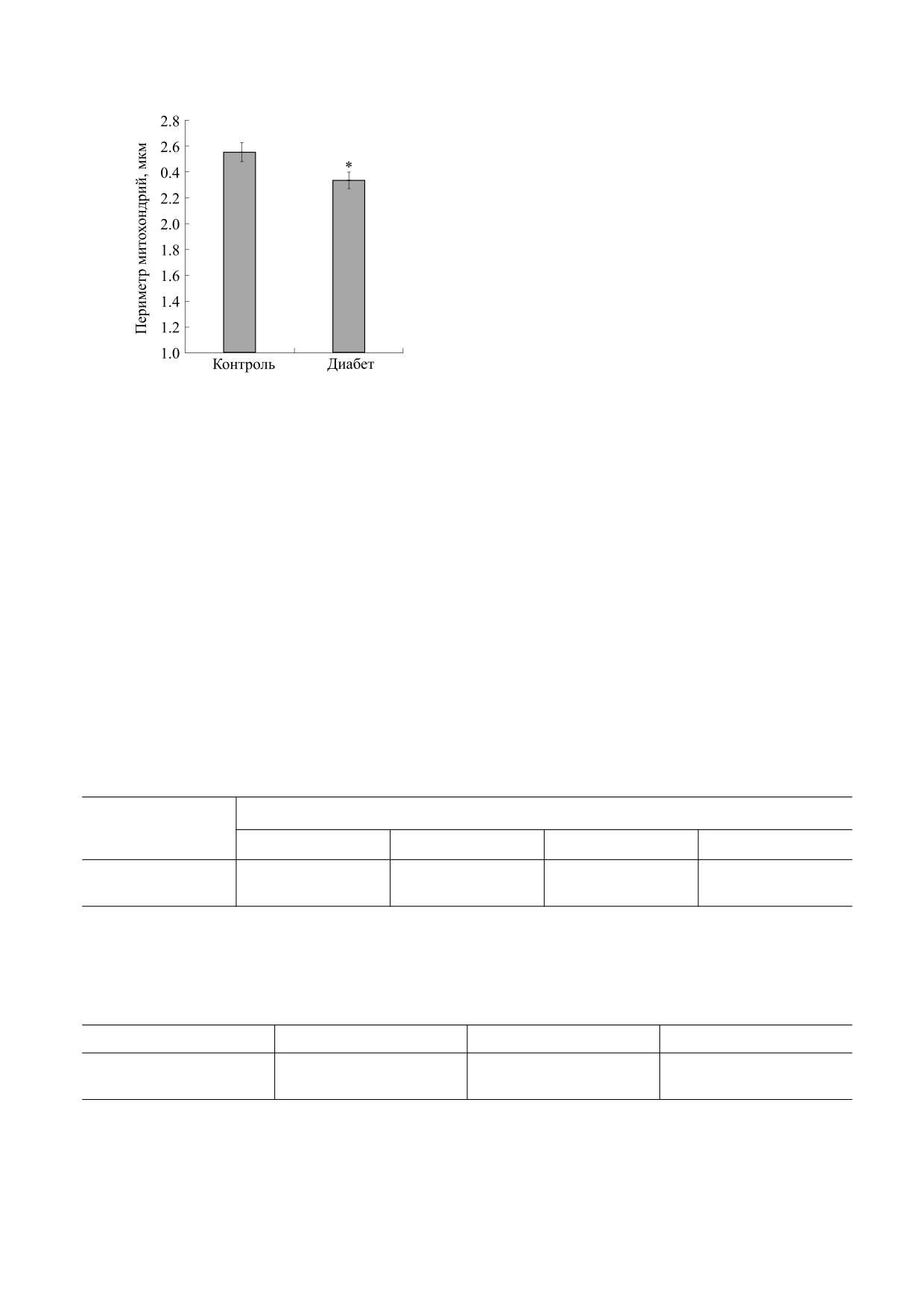
При этом результат подсчета периметра мито-
дыхательного контроля, АДФ/О и времени фос-
хондрий, представленный на рис. 2, позволил
форилирования оставались без значительных из-
также подтвердить уменьшение размера орга-
менений (табл. 2).
нелл, выделенных из печени крыс с сахарным
диабетом I типа. Из рис. 2 видно, что данный па-
Стрептозотоцин-индуцированный сахарный
раметр достоверно снижался у крыс опытной
диабет I типа сопровождается увеличением обще-
группы по сравнению с контрольными живот-
го количества жирных кислот в составе липидов
ными.
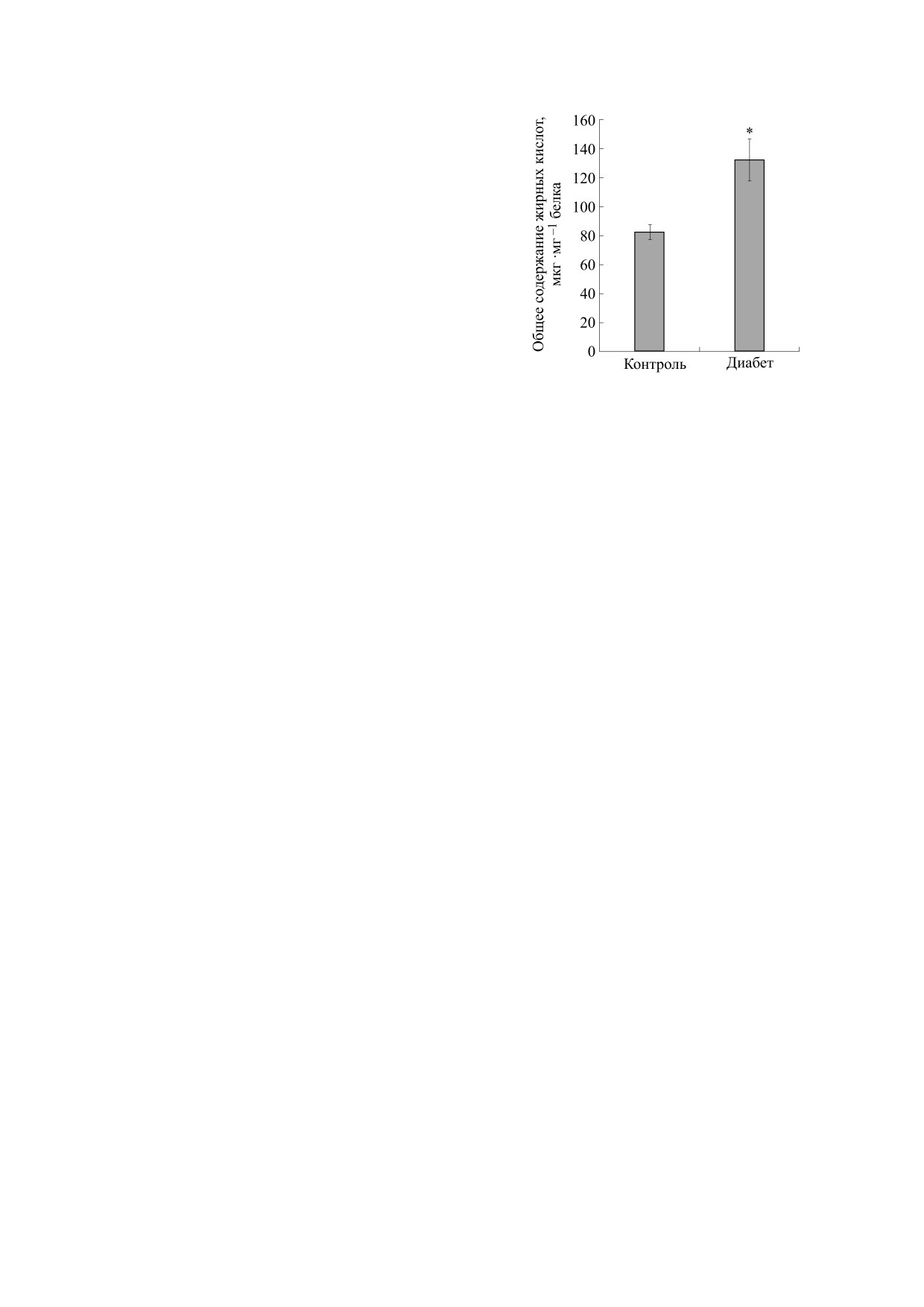
митохондриальных мембран печени. С помощью
Стрептозотоцин-индуцированный
сахарный
метода газовой хроматографии был проведен
диабет I типа способствует стимуляции скоростей
количественный анализ общего пула жирных
митохондриального дыхания. Функциональное
кислот (как свободных, так и этерифицирован-
состояние митохондрий, выделенных из печени
ных) мембран митохондрий, выделенных из пе-
крыс со стрептозотоцин-индуцированным диа-
чени контрольных животных и особей с моде-
бетом, оценивали по скорости митохондриально-
лью диабета I типа. На рис. 3 представлены по-
го дыхания в присутствии сукцината (субстрат II
лученные результаты, из которых следует, что
комплекса) с добавлением ротенона (табл. 1). Ос-
общий уровень жирных кислот в составе фосфо-
новываясь на этих данных, мы также оценили
липидов мембран митохондрий из печени жи-
скорости окислительного синтеза АТФ и уровень
вотных с индуцированным диабетом I типа зна-
сопряжения дыхания и фосфорилирования
чительно превышает (примерно в 1,6 раза) этот
(табл. 2).
параметр у контрольной группы.
БИОФИЗИКА том 64
№ 5
2019
942
СТАРИНЕЦ и др.
Таким образом, в настоящей работе были изуче-
ны как структурные, так и функциональные из-
менения, происходящие с митохондриями пече-
ни крыс со стрептозотоцин-индуцированным
диабетом I типа.
В первой части работы было установлено, что
при развитии сахарного диабета I типа с последу-
ющей гипергликемией происходят морфологиче-
ские изменения митохондрий печени крыс. Как
видно из рис. 2, при развитии диабета происходит
достоверное снижение размера митохондрий ге-
патоцитов крыс. При этом происходят и струк-
турные изменения митохондриальных мембран -
наблюдается деформация крист и видимое увели-
чение межмембранного пространства митохон-
дрий (рис. 1). Ранее было показано, что у крыс
Рис. 2. Периметр митохондрий, выделенных из пече-
линии Wistar не наблюдалось изменений в струк-
ни экспериментальных животных. Результаты пред-
туре митохондриальных крист при развитии диа-
ставлены как средние значения ± стандартная ошиб-
ка среднего (n = 6); * - разница между контролем и
бета I типа [26]. По-видимому, данные различия
экспериментальными образцами является статисти-
связаны с использованием другой линии живот-
чески значимой (p < 0,05).
ных (в данной работе были использованы крысы
линии Sprague Dawley). Вместе с тем, как и в рабо-
те [26], мы наблюдали увеличение числа мито-
ОБСУЖДЕНИЕ
хондрий в клетке (данные не приведены).
Сахарный диабет является одним из самых
Исходя из полученных результатов, можно
распространенных эндокринных заболеваний во
предположить два варианта изменения морфоло-
всем мире, связанным с нарушением усвоения
гической структуры митохондрий. Одним из них
глюкозы, которое вызвано относительной или
является нарушение митохондриального биоге-
абсолютной недостаточностью гормона инсули-
неза [27,28]. Так как при сахарном диабете проис-
на, это в конечном итоге приводит к развитию ги-
ходит снижение новообразования митохондрий,
пергликемии. Метаболическая природа данного
можно сделать вывод, что нарушение их биогене-
заболевания объясняет тесную связь сахарного
за, скорее всего, не провоцирует увеличение чис-
диабета с дисфункцией митохондрий, играющих
ла органелл и уменьшение их размеров в клетках
ключевую роль в регуляции путей метаболизма и
печени крыс с экспериментальным сахарным
поддержании энергетического баланса клеток.
диабетом [24]. Тогда логично предположить, что
Таблица 1. Скорости дыхания митохондрий контрольной и диабетической групп животных
Скорость дыхания, нмоль О2 · мин-1 · мг-1 белка
Группа животных
V
2
V3
V4
VДНФ
Контроль
9.9 ± 0.5
45.6 ± 0.5
10.6 ± 0.5
63.1 ± 1.8
Диабет
11.9 ± 0.4*
53.9 ± 2.7*
12.2 ± 0.4*
65.7 ± 2.7
Примечание. Состав среды инкубации указан в разделе «Материалы и методы». Дыхание митохондрий в состоянии 3 запус-
кали добавлением 200 мкМ АДФ. Скорость разобщенного дыхания измеряли в присутствии 50 мкМ ДНФ (VДНФ). Результаты
представлены как средние значения ± стандартная ошибка среднего (n = 6); * - разница между контрольной и диабетической
группами является статистически значимой (p < 0.05).
Таблица 2. Функциональные параметры митохондрий, выделенных из печени контрольной и диабетической
групп животных
Группа животных
Дыхательный контроль
АДФ/О
Время фосфорилирования
Контроль
4.3 ± 0.3
1.9 ± 0.03
104.8 ± 10.9
Диабет
4.4 ± 0.2
1.9 ± 0.01
98.3 ± 11.6
Примечание. В качестве субстрата был использован сукцинат в концентрации 5 мМ. Результаты представлены как средние
значения ± стандартная ошибка среднего (n = 6); * - разница между контрольной и диабетической группами является стати-
стически значимой (p < 0.05).
БИОФИЗИКА том 64
№ 5
2019
УЛЬТРАСТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ МИТОХОНДРИЙ
943
изменение размера митохондрий печени крыс со
стрептозотоцин-индуцированным диабетом мо-
жет быть связано с нарушением процессов слия-
ния и деления органелл. Это предположение со-
гласуется с литературными данными, из которых
следует, что экспрессия ответственного за слия-
ние митофузина снижается, в то время как экс-
прессия Drp1, регулирующего деление митохон-
дрий, увеличивается в диабетической группе жи-
вотных [29]. Так как происходит возрастание
экспрессии Drp1, а также нарушение биогенеза
органелл, на микрофотографиях можно наблю-
дать деформацию крист и наружной мембраны
митохондрий печени крыс со стрептозотоцин-
индуцированным диабетом I типа (рис. 1).
Несмотря на то, что при индукции сахарного
диабета I типа происходит изменение уль-
Рис. 3. Общее содержание жирных кислот в составе
фосфолипидов митохондриальных мембран экспе-
траструктуры митохондрий печени крыс, это
риментальных животных. Результаты представлены
практически не приводит к ухудшению функцио-
как средние значения ± стандартная ошибка средне-
нальных параметров митохондриального дыха-
го (n = 6); * - разница между контролем и экспери-
ния. Можно видеть, что дыхательный контроль,
ментальными образцами является статистически
значимой (p < 0,05).
параметр AДФ/O и время фосфорилирования
митохондрий печени крыс линии Sprague Dawley
при развитии диабета I типа практически не из-
митохондрий. При этом функциональные пара-
меняются. Ранее в литературе было показано, что
метры дыхания и окислительного фосфорилиро-
у крыс линии Wistar происходит улучшение
вания митохондрий печени крыс не только не
функциональных параметров митохондрий в те-
ухудшаются, но, по крайней мере, не изменяются
чение трех недель после введения стрептозотоци-
или даже улучшаются. Поэтому можно предполо-
на. Было предположено, что это связано с увели-
жить, что изменения в ультраструктуре митохон-
чением активности комплексов дыхательной це-
дрий на ранних этапах развития диабета могут но-
пи митохондрий [7]. Важно также отметить, что
сить адаптивный характер, что будет способство-
при развитии стрептозотоцин-индуцированного
вать поддержанию клеточной энергетики при
диабета происходит увеличение количества неко-
данной патологии.
торых анионных переносчиков внутренней мем-
браны митохондрий (пируватного, дикарбокси-
латного, фосфатного, но не цитратного) [30]. Все
ФИНАНСИРОВАНИЕ РАБОТЫ
это указывает на диабет-индуцированное ремоде-
Работа выполнена при финансовой поддержке
лирование биоэнергетической системы клетки и
Российского фонда фундаментальных исследова-
митохондрий.
ний (грант № 19-015-00117-а).
Наряду с отсутствием влияния диабета на
функциональные параметры митохондрий мож-
но видеть, что происходит достоверное увеличе-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ние скоростей дыхания в состояниях 2, 3 и 4 при
Работу с лабораторными животными выпол-
индукции сахарного диабета I типа. Это может
няли в соответствии с Европейской конвенцией о
быть связано как с увеличением активности ды-
защите позвоночных животных, используемых
хательных комплексов, так и с наблюдаемым в
для экспериментальных и иных целей (Страс-
настоящей работе увеличением общего уровня
бург, 1986) и с принципами Хельсинской Декла-
жирных кислот в митохондриальных мембранах.
рации (2000). Все протоколы экспериментов бы-
Как известно, свободные жирные кислоты явля-
ли утверждены Комитетом по этике ИТЭБ РАН
ются разобщителями окислительного фосфори-
(приказ № 173 / к от 03.10.2011 г., протокол
лирования, и увеличение их уровня в митохон-
№ 04/2019 от 05.03.2019 г.).
дриях будет приводить к стимуляции митохон-
дриального дыхания [31].
СПИСОК ЛИТЕРАТУРЫ
Таким образом, полученные в работе результа-
ты и имеющиеся литературные данные позволя-
1. American Diabetes Association, in Diabetes Care
ют говорить о том, что у животных со стрептозо-
(American Diabetes Association, 2011), pp. 62-69.
тоцин-индуцированным диабетом на ранних эта-
2. L. C. Groop and J. G. Eriksson, Ann. Med. 24, 483
пах уже происходит изменение ультраструктуры
(1992).
БИОФИЗИКА том 64
№ 5
2019
944
СТАРИНЕЦ и др.
3. W. H. Gispen and G. J. Biessels, Trends Neurosci. 23,
18. B. Rodrigues, P. Poucheret, M. L. Battell, et al., in Ex-
542 (2000).
perimental Models of Diabetes, Ed by J. H. McNeill (Bo-
ca Raton, FL, USA: CRC Press, 1999), pp 3-17.
4. D. M. D’Souza, D. Al-Sajee, and T. J. Hawke, Front.
Physiol. 4, 379 (2013).
19. K. N. Belosludtsev, N. V. Belosludtseva, A. V. Agafon-
ov, et al., Biochim. Biophys. Acta 1838 (10), 2600
5. M. A. Liu, H. B. Cao, Y. A. Hou,· et al., Cell Physiol.
(2014).
Biochem. 45 (4), 1423 (2018).
6. D. E. Frances, M. T. Ronco, J. A. Monti, et al., J. En-
20. O. H. Lowry, N. J. Rosebrough, A. L. Farr, et al., J Biol
docrinol. 205 (2), 187 (2010).
Chem. 193 (1), 265 (1951).
7. F. M. Ferreira, C. M. Palmeira, R. Seica, et al., J. Bio-
21. N. I. Venediktova, O. S. Gorbacheva, N. V. Belosludt-
chem. Mol. Toxicol. 17 (4), 214 (2003).
seva, et al., J. Bioenerg. Biomembr. 49 (2), 149 (2017).
8. M. K. Montgomery and N. Turner, Endocr. Connect.
22. B. Chance and G. R. Williams, Nature 176 (4475), 250
4 (1), R1 (2015).
(1955).
9. M. P. Murphy and R. A. Smith, Annu. Rev. Pharmacol.
23. E. Bligh and W. Dyer, Can. J. Biochem. Physiol. 37, 911
Toxicol. 47, 629 (2007).
(1959).
10. J. Chen, S. E. Stimpson, G. A. Fernandez-Bueno,
24. W. I. Sivitz and M. A. Yorek, Antioxid. Redox Signal.
et al., Antioxid. Redox Signal. 29 (14), 1361 (2018).
12 (4), 537 (2010).
11. K. Morino, K. F. Petersen, and G. I. Shulman, Diabe-
25. M. Patti and S. Corvera, Endocr. Rev. 31 (3), 364
tes 55 (2), S9 (2006).
(2010).
12. K. F. Petersen, D. Befroy, S. Dufour, et al., Science
26. R. N. Remedioa, A. Castellar, R. A. Barbosa, et al.,
300, 1140 (2003).
Micron 42 (5), 484 (2011).
13. F. Malka, O. Guillery, C. Cifuentes-Diaz, et al., EM-
27. D. A. Hood, L. D. Tryon, H. N. Carter, et al., Bio-
BO Rep. 6, 853 (2005).
chem. J. 473, 2295 (2016).
14. H. Chen, A. Chomyn, and D. C. Chan, J. Biol. Chem.
28. A. T. Erlich, L. D. Tryon, M. J. Crilly, et al., Integr.
280, 26185 (2005).
Med. Res. 5, 187 (2016).
15. H. Chen, M. Vermulst, Y. E. Wang, et al., Cell 141, 280
(2010).
29. P. A. Parone, S. Da Cruz, D. Tondera, et al., PLoS One
3, 3257 (2008).
16. J. A. Baur, K. J. Pearson, N. L. Price, et al., Nature
444, 337 (2006).
30. R. S. Kaplan, D. L. Oliveira, and G. L. Wilson, Arch
Biochem Biophys. 280 (1), 181 (1990).
17. T. Nishikawa, D. Kukidome, K. Sonoda, et al., Diabe-
tes Res/ Clin. Pract. 77, 161 (2007).
31. В. Н. Самарцев, Биохимия 65, 1173 (2000).
Ultrastructural and Functional Changes in the Liver Mitochondria in Experimental Rat
Models of Type I Diabetes Mellitus
V.S. Starinets*, E.V. Lebedeva*, I.B. Mikheeva**, N.V. Belosludtseva**,
M.V. Dubinin*, and K.N. Belosludtsev* **
*Mari State University, pl. Lenina 1, Yoshkar-Ola, 424000 Russia
**Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
ul. Institutskaya 3, Pushchino, 142290 Russia
Experimental rat models of type I diabetes mellitus developed on Sprague Dawley rats were used to study spe-
cific features of the ultrastructure and function of mitochondria in rat liver. It was found that diabetes mellitus
induced in rats after administration of a dose of 75 mg/kg body weight of streptozotocin is accompanied by
disturbances in the structural organization of mitochondrial cristae and a decrease in the size of the organelles
when compared to the control. It was shown that in the animal models of type I diabetes, the respiration rates
of liver mitochondria in metabolic states 2, 3 and 4 increased. This increase may be related to a higher content
of fatty acids in mitochondria isolated from the livers of diabetic rats. In addition, the modeling of diabetes
mellitus by using streptozotocin in rats showed no differences in the parameters of the efficiency of oxidative
phosphorylation (ADP/O, respiratory control ratio, and phosphorylation time) of liver mitochondria.
Keywords: type I diabetes mellitus, mitochondria, mitochondrial respiration, oxidative phosphorylation
БИОФИЗИКА том 64
№ 5
2019