БИОФИЗИКА, 2019, том 64, № 5, с. 963-973
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 576.311
ВЛИЯНИЕ ТАЛЛИЯ НА СПОНТАННОЕ СОКРАЩЕНИЕ СЕРДЕЧНОЙ
МЫШЦЫ И НА ЭНЕРГЕТИЧЕСКИЕ ПРОЦЕССЫ
В МИТОХОНДРИЯХ КАРДИОМИОЦИТОВ
© 2019 г. С.М. Коротков, В.П. Нестеров, К.В. Соболь
Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН,
194223, Санкт-Петербург, просп. Тореза, 44
E-mail: korotkov@SK1645.spb.edu
Поступила в редакцию 18.06.2019 г.
После доработки 18.06.2019 г.
Принята к публикации 08.07.2019 г.
Исследованы эффекты ионов Tl+ на спонтанное сокращение препаратов сердечной мышцы лягуш-
ки и на митохондрии сердца крысы. Ионы Tl+ в концентpациях 1,0, 2,5 и 5 мМ в pаcтвоpе Pингеpа
cнижали все параметры cпонтанныx cеpдечныx cокpащений. Наибольшие изменения наблюдались
для частоты сокращений, а также амплитуды и скоростей нарастания и падения напряжения оди-
ночного сокращения. Нагрузка митохондрий кальцием в среде с TlNO3 и NaNO3 индуцировала от-
крытие митохондриальной кальций-зависимой поры в их внутренней мембране, что проявлялось в
увеличении набухания этих органелл, снижении потенциала их внутренней мембраны и дыхания в
состоянии 3 по Чансу или в состоянии разобщения 2,4-динитрофенолом. Эти эффекты ионов Tl+
ингибировались АДФ и циклоспорином А. Таким образом, стимулируемое ионами Tl+ поступление
Ca2+ в кардиомиоциты может индуцировать перегрузку митохондрий сердца ионами Ca2+ и Na+ и
стимулировать открытие митохондриальных кальций-зависимых пор в их внутренней мембране.
Полученные результаты могут дать объяснение большей таллиевой токсичности in vivo для сердеч-
ной мышцы. Применение ионов Tl+ для исследования миокарда может быть нежелательно при сер-
дечных патологиях, включающих нарушения ритма, и при сердечной недостаточности, особенно
при диастолической дисфункции.
Ключевые слова: Tl+, Ca2+, Na+, сокращение миокарда, пейсмекерная активность, интоксикация,
митохондрии сердца крысы, митохондриальная кальций-зависимая пора.
DOI: 10.1134/S0006302919050181
шей степени в печени и почках [4-6]. При этом
Изотопы таллия используются в медицине,
были обнаружены значительные структурные по-
например в диагностике заболеваний миокарда
вреждения миофибрилл, ядер и мембран сарко-
(сцинциграфия), а его неорганические соедине-
плазматического ретикулума и митохондрий.
ния применяются в различных отраслях про-
мышленности [1,2]. Повышенная концентрация
Токсическое действие Tl+ на биологические ор-
таллия наблюдается вокруг металлургических за-
ганизмы связано с его способностью легко про-
водов, а также в районе электростанций, работа-
никать через внутреннюю митохондриальную
ющих на угле.
мембрану (ВММ) и замещать K+ в калий-зависи-
мых биохимических реакциях или ионтранспорт-
Tl+ может стехиометрически замещать K+ в
ных процессах [2,7]. Однако химическое поведе-
препаратах сердца и диафрагмы крыс [3]. Про-
ние Tl+ может быть отличным от поведения
никший в организм человека таллий в основном
накапливается в мозге и миокарде, в меньшей
ионов K+, что может нарушать некоторые жиз-
степени - в печени и почках [1]. У отравленных
ненно важные K+-зависимые процессы.
таллием крыс этот металл в основном концентри-
Известно, что умеренная кальциевая нагрузка
ровался в сердце и скелетных мышцах и в мень-
митохондрий приводит к открытию митохондри-
альной кальций-зависимой поры (МКЗП) во
Сокращения: ВММ - внутренняя митохондриальная мем-
внутренней мембране, которая становится про-
брана, МКЗП - митохондриальная кальций-зависимая
пóра, МСК - митохондрии сердца крысы, CsA - цикло- ницаемой для небольших катионов (H+, K+, Na+
спорин А, ДНФ - 2,4-динитрофенол, ДК - дыхательный
контроль.
и Ca2+) [8,9]. В этом случае наблюдается массив-
963
964
КОРОТКОВ и др.
ное набухание митохондрий, снижение потенци-
ала ВММ (ΔΨмито) и уменьшение дыхания мито-
хондрий в различных энергетических состояни-
ях. Действие Tl+ на изолированные гепатоциты
крысы сопровождалось увеличением концентра-
ций Ca2+ и Na+ в их цитоплазме [10]. Нагрузка
кальцием энергизованных сукцинатом митохон-
дрий печени крысы (МПК) в среде, содержащей
TlNO3 и нитраты (KNO3, NaNO3, NH4NO3), ин-
дуцировала зависящее от концентрации Tl+ от-
Рис. 1. Схема определения скорости нарастания
крытие МКЗП в их внутренней мембране [11].
(dP/dt) и падения напряжения (-dP/dt)для одиночно-
Подобный результат был достигнут в аналогич-
го сердечного сокращения.
ных опытах с митохондриями сердца крысы
(МСК) в среде с TlNO3 и KNO3 [12]. Открытие
иссеченные из средней и нижней части желудоч-
МКЗП, ингибируемой АДФ и циклоспорином А
ков сердца лягушки Rana ridibunda, как опиcано
(CsA), во внутренней мембране этих митохон-
pанее [19]. Во вpемя опыта такой пpепаpат cти-
дрий [11,12] сопровождалось массивным набуха-
мулиpовали чеpез платиновые электpоды
нием этих органелл, а также снижением ΔΨмито и
электpичеcкими импульcами cвеpxпоpоговой ам-
скоростей дыхания в состояни 3 и в разобщенном
плитуды с длительноcтью импульcа
1-2 мc.
2,4-динитрофенолом (ДНФ) состоянии. В насто-
Пpепаpаты помещали в cтеклянную теpмоcта-
ящее время отсутствуют данные о совместном
тиpованную ячейку пpи 10°C, оpиентиpовали
действии Ca2+ и Na+ на индуцированное ионами
веpтикально и pаcтягивали c помощью cтальныx
Tl+ открытие МКЗП во внутренней мембране на-
кpючков, cделанныx из мандpена, до оптималь-
груженных Ca2+ МСК.
ной длины. Один cтальной кpючок пpиcоединяли
к фикcиpованному платиновому кpючку, втоpой
Ранее было описано действие Tl+ на сердеч-
- к тензодатчику. Сокpащения pегиcтpиpовали в
ные сокращения и нервно-мышечные препараты
изометpичеcком pежиме. Cигналы обpабатывали
[3,13-18]. Однако полученные данные были не-
c помощью компьютеpной пpогpаммы WinPulse,
сколько противоречивы. Отмечался как положи-
cилу cокpащения опpеделяли в ньютонаx. Оцени-
тельный, так и отрицательный инотропный эф-
вали cледующие паpаметpы cокpащения:
фект таллия на сердечные сокращения. Более то-
макcимальное уcилие, pазвиваемое мышечным
го, не исследовались изменения скоростных
пpепаpатом (Р0); частоту сокращения (в Гц); мак-
характеристик одиночного сокращения сердца
симальные скорости нарастания напряжения
при воздействии Tl+. Для исследования пейсме-
керной активности сердца нами была получена
(dP/dt) и расслабления (-dP/dt) определялись по
модель спонтанного сокращения предсердий.
касательной в точках перегиба одиночного сокра-
Поэтому в данной работе мы исследуем, как вли-
щения (рис. 1).
яет таллий на скоростные характеристики спон-
В экcпеpиментаx по мышечному сокращению
танных сокращений предсердий сердца лягушки.
иcпользовали ноpмальный pаcтвоp Pингеpа,
Другой целью нашей работы было изучение вли-
cодеpжащий: NaCl - 110 мМ, KCl - 2,5 мМ,
яния Tl+ на натриевую проницаемость ВММ и
MgCl2 - 1 мМ, CaCl2 - 2,5 мМ, NaH2PO4 -
индукцию таллием МКЗП в нагруженных каль-
цием МСК. В связи с этим мы исследовали набу-
0,75 мМ, NaHCO3 - 0,5 мМ, глюкоза - 5 мМ
хание, ΔΨмито и дыхание энергизованных сукци-
(pH 7,4). При аппликации 1 мМ Tl+ в физиологи-
натом МСК в состоянии 3 и состоянии, стимули-
ческом растворе уменьшали концентрацию KCl
рованном ДНФ, в средах, содержащих TlNO3 и
до 1,5 мМ. При аппликации 2,5 и 5 мМ Tl+ ис-
NaNO3 в присутствии Ca2+ и ингибиторов МКЗП
пользовали физиологический раствор без KCl.
Нитрат таллия готовили в виде 125 мМ cток-
(АДФ и CsA).
pаcтвоpа и вноcили в экcпеpиментальный
pаcтвоp до конечныx концентpаций 1,0, 2,5 и
МАТЕРИАЛЫ И МЕТОДЫ
5 мМ непоcpедcтвенно пеpед экcпеpиментом.
Pегиcтpация и анализ паpаметpов cокpащения.
Дейcтвие Tl+ пpекpащали путем отмывания
Для изучения пейсмекерной активности сердца
пpепаpата ноpмальным pаcтвоpом Pингеpа.
иссекали предсердия с фрагментом венозного си-
Пpименяли cтандаpтные cпоcобы cтатиcти-
нуса из сердца лягушки Rana ridibunda. Для изуче-
чеcкой обpаботки pезультатов c иcпользованием
ния cокpащений, вызванныx электpичеcкой cти-
t-кpитеpия Cтьюдента. Pазличия cчитали доcто-
муляцией, иcпользовали кольцевые пpепаpаты,
веpными пpи p < 0,05.
БИОФИЗИКА том 64
№ 5
2019
ВЛИЯНИЕ ТАЛЛИЯ НА СПОНТАННОЕ СОКРАЩЕНИЕ СЕРДЕЧНОЙ МЫШЦЫ
965
Снижение параметров спонтанных сокращений пред-
дыхание (субстрат в среде); ДКДНФ = ДНФ акти-
сердий после инкубации в растворах с солями таллия по
вированное дыхание (ДНФ и субстрат в сре-
сравнению с контрольными сокращениями
де)/базальное дыхание.
[Tl], мМ
Спектрофотометрическая оценка изменения
Параметр
объема митохондрий. Набухание митохондрий
1
2.5
5
(рис. 4), сопровождающееся уменьшением оп-
(n = 3)
(n = 5)
(n = 3)
тической плотности их суспензии, изучали на
Р0
-20 ± 5%
-27 ± 3%
-37 ± 6%
спектрофотометре СФ-46 («ЛОМО», Россия)
при длине волны 540 нм и температуре 20°C.
Частота, Гц
-47 ± 6%
-30 ± 7%
-52 ± 8%
Митохондрии (1 мг белка на мл) вносили в
dP/dt
-27 ± 5%
-23 ± 6%
-33 ± 4%
400 мОсм среду, содержащую TlNO3 - 0-75 мМ,
NaNO3 - 125 мМ, трис-NO3 - 5 мМ (pH 7,3), ро-
–dP/dt
-33 ± 6%
-38 ± 8%
-65 ± 7%
тенон - 2 мкМ и олигомицин - 1 мкг/мл, трис-
Примечание. Р0 - макcимальное уcилие, pазвиваемое мы-
PO4 - 1 мМ, а также (где указано) CaCl2 -
шечным пpепаpатом; частота, Гц - частота сокращений;
200 мкМ, АДФ - 500 мкМ и CsA - 1 мкМ. После
dP/dt - максимальная скорость нарастания напряжения; -
dP/dt - максимальная скорость расслабления. Данные
митохондрий в среду вносили сукцинат до кон-
представлены для трех-пяти экспериментов. Различия до-
центрации 5 мМ.
стоверны (р < 0.05).
Определение митохондриального потенциала.
Потенциал на внутренней мембране МСК
(рис. 5) измеряли по стандартной методике [21]
Изоляция митохондрий. Для выделения мито-
при 20°С на спектрофлуориметре Shimadzu RF-
хондрий сердца крысы использовали самцов
1501 (Shimadzu, Япония) по изменению интен-
крыс линии Вистар массой 200-250 г. Изоляцию
сивности флуоресценции сафранина при возбуж-
МСК проводили на льду согласно разработанной
дающей длине волны 485 нм и регистрируемой
нами методике [20]. На окончательном этапе
длине 590 нм. Митохондрии (0,5 мг белка в 1 мл)
МСК суспендировали в 3 мл среды, содержащей
добавляли в кварцевую кювету с 3 мл 400 мОсм
сахарозу - 300 мМ и трис-HCl - 10 мМ (pH 7,3).
среды, содержащей TlNO3 - 15 мМ, сахарозу -
Концентрацию митохондриального белка, нахо-
120 мМ, NaNO3 -125 мМ, трис-NO3 - 5 мМ
дящуюся в пределах 20-30 мг/мл, определяли по
(pH 7,3), трис-PO4 - 1 мМ, сафранин - 3 мкМ,
методу Бредфорда. В работе использовали саха-
розу, очищенную от примесей катионов на ионо-
ротенон - 2 мкМ и олигомицин - 1 мкг/мл, а
обменной колонке со смолой КУ-2-8; 2,4-динит-
также (где указано) АДФ - 500 мкМ и CsA -
рофенол (ДНФ) квалификации ч.д.а.; маннитол,
1 мкМ. На рис. 3-5 показаны типичные результа-
Mg(NO3)2, MgCl2, CaCl2, H3PO4, TlNO3, NaCl,
ты, полученные для трех независимых экспери-
ментов. Применяли стандартные способы стати-
NaNO3 квалификации х.ч. Сафранин, трис-ОН,
стической обработки результатов с использова-
KCl, олигомицин, ротенон, АДФ, сукцинат, бы-
нием программы Origin 6.0. Различия считали
чий сывороточный альбумин, HEPES, MOPS,
достоверными при р < 0,05.
CsA и этилендиаминтетрауксусная кислота были
получены от фирмы Sigma (США).
РЕЗУЛЬТАТЫ
Измерение поглощения кислорода. Скорости
дыхания митохондрий (нг-атом О/(мин · мг бел-
Дейcтвие Tl+ на cилу и скорость cеpдечныx
ка)) измеряли полярографическим методом с
cокpащений. Инотpопное дейcтвие талия опpеде-
применением закрытого платинового электрода
ляли на изолиpованныx пpепаpатаx пpедcеpдия
Кларка на анализаторе Эксперт-001 (НПО «Эко-
cеpдца лягушки в уcловияx cпонтанного возбуж-
никс эксперт», Москва, Россия) при 26°С в ячей-
дения/cокpащения. Уcтановлено, что ионы Tl+ в
ке объемом 1,4 мл. Митохондрии (1 мг белка в
концентpациях 1,0, 2,5 и 5 мМ в pаcтвоpе Pингеpа
1 мл) добавляли в юстируемую сахарозой 400 мОсм
cнижали все параметры cпонтанныx cеpдечныx
среду, содержащую TlNO3 - 0-75 мМ, NaNO3 -
cокpащений (таблица, рис. 2). Наибольшие изме-
125 мМ, трис-NO3 - 5 мМ (pH 7,3), сукцинат -
нения наблюдались для частоты сокращений, а
5 мМ и ротенон - 2 мкМ, а также (где указано)
также амплитуды и скоростей нарастания и паде-
Mg(NO3)2 - 3 мМ и трис-PO4 - 3 мМ или
ния напряжения одиночного сокращения (табли-
1 мкг/мл олигомицина. Концентрации агентов
ца). Отрицательный инотропный и хронотроп-
(CaCl2, АДФ, ДНФ, CsA), добавляемых в среду
после митохондрий (показано стрелками), указа-
ный эффекты Tl+ проявлялись сразу после его до-
ны в подписи к рис. 3. Дыхательные контроли
бавления в раствор (рис. 2). В некоторых случаях
(ДК) вычисляли по формулам: ДКАДФ = состояние
(в трех опытах из пяти) частота сокращений до
3 по Чансу (АДФ и субстрат в среде)/базальное
некоторой степени восстанавливалась, однако
БИОФИЗИКА том 64
№ 5
2019
966
КОРОТКОВ и др.
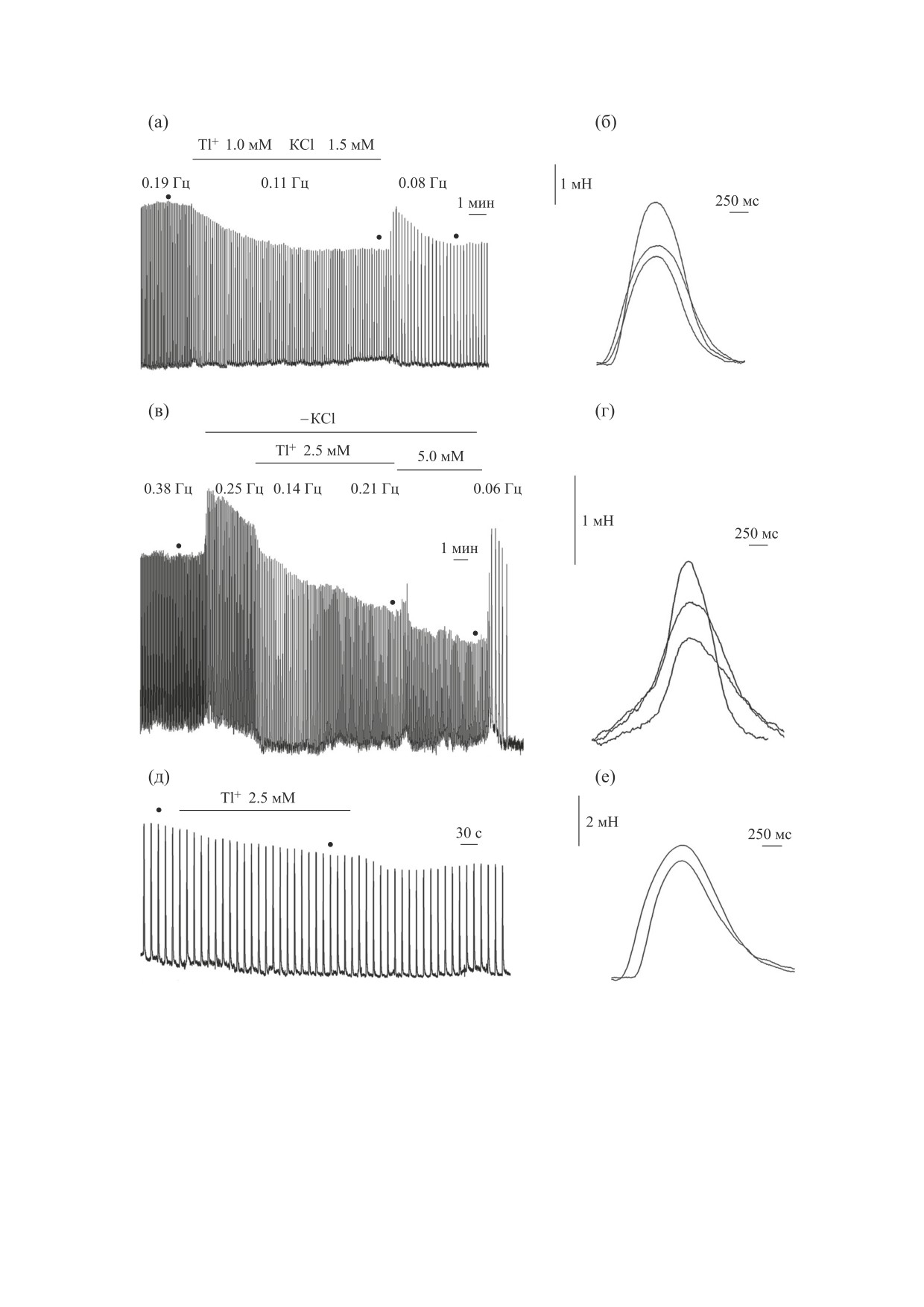
Рис. 2. Влияние таллия на cпонтанное cокpащение пpедcеpдий и cокpащение препарата желудочка cеpдца лягушки в
условиях электрической стимуляции. Полная cxема опыта показана слева (a, в, д), а соответствующие им одиночные
cокpащения при другой временной шкале - справа (б, г, е); они также помечены черными кружками на записях (a, в,
д). Вpемя дейcтвия, частота сокращения (в Гц) и концентpации Tl+ обозначены гоpизонтальными линиями над
pегиcтpацией cокpащения. На рисунках (a) и (в) - cпонтанное cокpащение пpедcеpдий, (д) - cокpащение препарата
желудочка cеpдца лягушки в условиях электрической стимуляции с частотой 0,07 Гц.
БИОФИЗИКА том 64
№ 5
2019
ВЛИЯНИЕ ТАЛЛИЯ НА СПОНТАННОЕ СОКРАЩЕНИЕ СЕРДЕЧНОЙ МЫШЦЫ
967
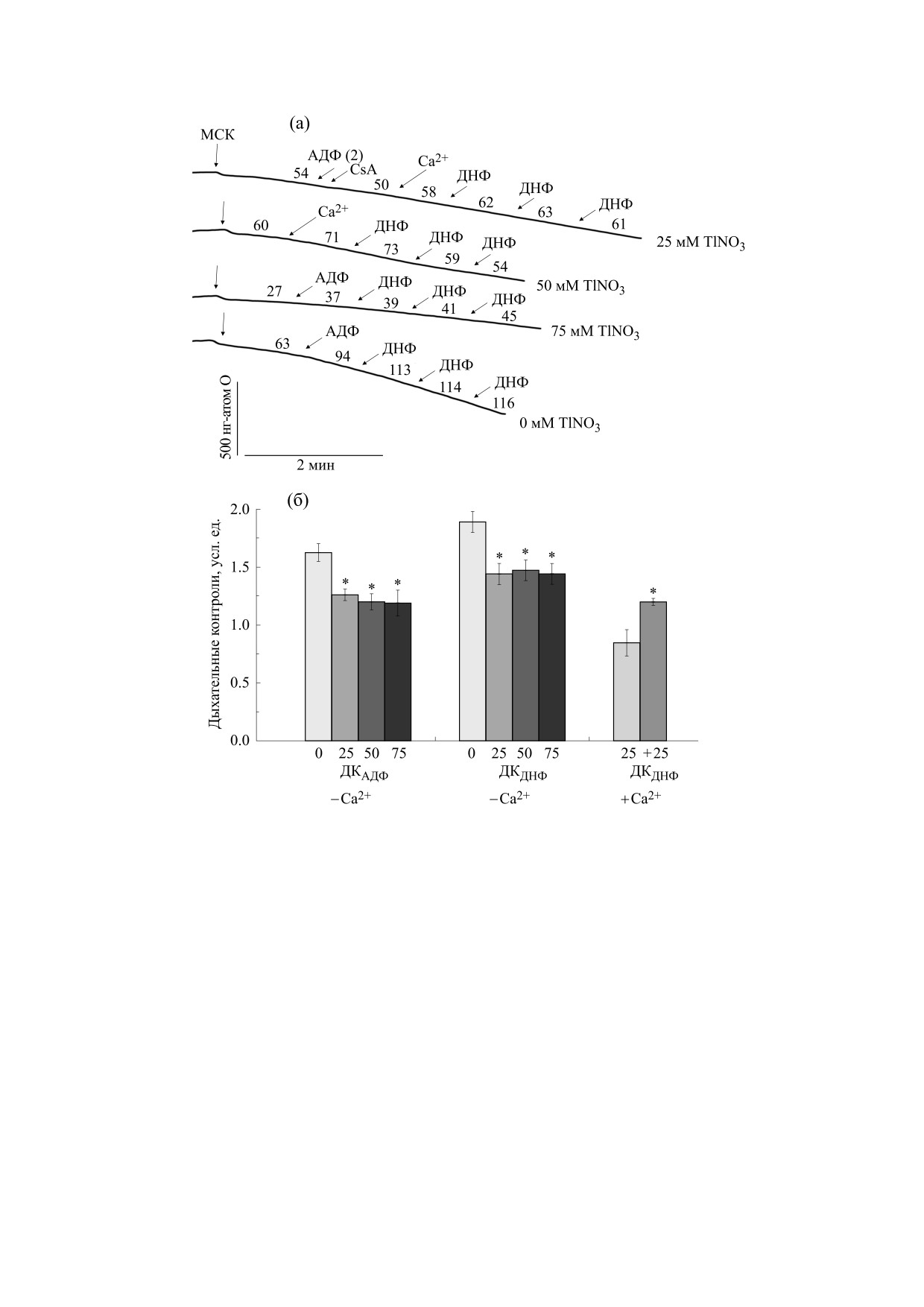
Рис. 3. Cкорости поглощения кислорода энергизованными сукцинатом митохондриями сердца крысы. Митохондрии
(1,0 мг/мл белка) добавляли в 400 мОсм среду, содержащую 0-75 мМ TlNO3, 125 мМ NaNO3, 5 мМ трис-NO3 (pH 7,3),
5 мМ сукцината и 2 мкМ ротенона, а также 3 мМ трис-PO4 и 3 мМ Mg(NO3)2 (опыты без Ca2+) или 1 мкг/мл
олигомицина (опыты с Ca2+). Стрелками показаны добавки: митохондрий сердца крысы (МСК), 75 мкМ Ca2+ (Ca2+),
500 мкМ АДФ (АДФ), 1 мкМ CsA (CsA) и 15 мкМ 2,4-динитрофенола (ДНФ) по сумме трех добавок. Цифрами над
кривыми на рисунке (а) обозначены скорости поглощения кислорода (нг-атом О/мин·мг белка). Цифрами справа от
кривых отмечено наличие в среде TlNO3 (мМ). По оси ординат на рисунке (б) показаны величины ДК и ДКДНФ.
Цифрами под осью абсцисс показано наличие в среде TlNO3 (мМ), а знаком (+) - присутствие в среде до митохондрий
500 мкМ АДФ (АДФ) и 1 мкМ CsA (CsA). Звездочкой показаны достоверные различия от контроля - опыты без Ca2+
(- Ca2+) или с предварительно (до митохондрий) добавленным 75 мкМ Ca2+ (+ Ca2+). Среднеквадратичное
отклонение скоростей и величин дыхательных контролей было в пределах 5% (p < 0,05).
оставалась намного меньше, чем до добавления
становление параметров одиночного сокращения
после отмывания больших концентраций таллия
Tl+. Иногда Tl+ обратимо блокировал спонтан-
ные сокращения при концентрации 1 мМ (в од-
из раствора происходит достаточно длительно. В
ном опыте из пяти), а при концентрации 5 мМ
то время как амплитуда сокращения имеет тен-
блокировал во всех трех опытах. Более того, вос-
денцию к восстановлению, частота сокращения
БИОФИЗИКА том 64
№ 5
2019
968
КОРОТКОВ и др.
практически не восстанавливается и может про-
Как мы показали ранее в аналогичных опытах с
должать падать. Особенно это было заметно при
МПК [23], такое сжатие энергизованных орга-
больших концентрациях таллия (более 2,5 мМ) и
нелл связано с удалением избытка Na+ из их мат-
при отмывании таллия из раствора (рис. 2) Ско-
рикса при участии митохондриального K+/H+-
рости нарастания и падения напряжения одиноч-
обменника с последующим удалением протонов
ного сокращения также практически не восста-
комплексами электрон-транспортной цепи
ВММ. До этого мы обнаружили [11], что набуха-
навливались до контрольного значения в течение
ние энергизованных сукцинатом МПК в среде с
нескольких часов наблюдения.
TlNO3, 125 мМ нитратами (KNO3, NH4NO3, Na-
Вызванные сокращения более устойчивы к
NO3) и 100 мкМ Ca2+ было обусловлено открыти-
влиянию таллия. На рис. 2д и 2е показано сокра-
ем МКЗП во внутренней мембране. После внесе-
щение сегментов желудочка сердца лягушки при
ния сукцината в аналогичную среду с 25 мМ Tl-
концентрации Tl+ 2,5 мМ и стимуляции с часто-
NO3, 125 мМ NaNO3 и 200 мкМ Ca2+ (рис. 4)
той 0,07 Гц. Скорость нарастания напряжения
происходило набухание митохондрий, которое
практически не зависит от ингибирующего влия-
сменялось, как и в случае аналогичных опытов с
ния таллия (рис. 2е). Уменьшение амплитуды
МПК [11], сжатием этих органелл.
(на 18 ± 3%) и скорости падения напряжения (на
16 ± 4%) были меньше, чем для спонтанных со-
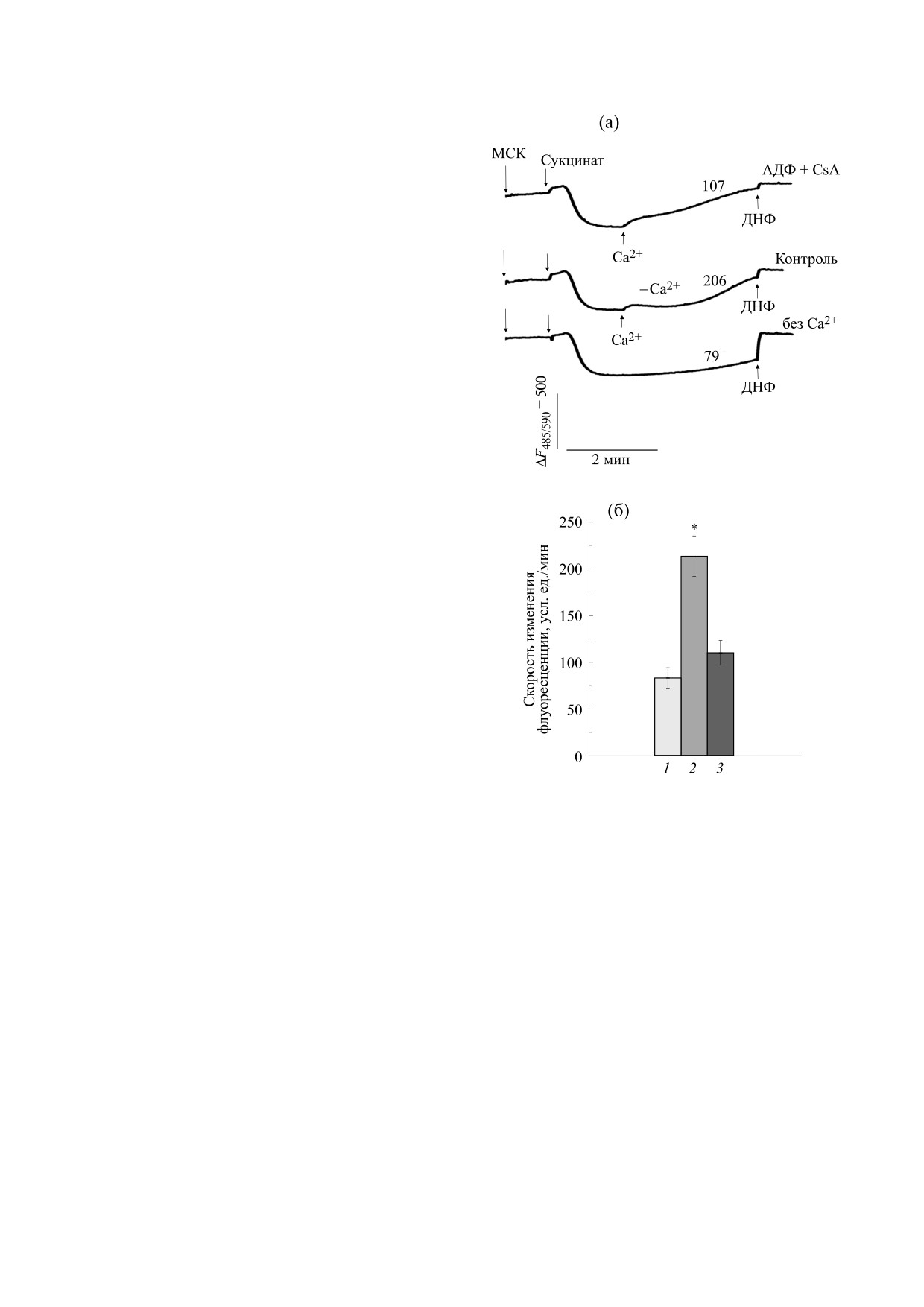
В опытах без Ca2+ (рис. 5а) после введения сук-
кращений (см. таблицу). Можно предположить,
цината в среду, содержащую TlNO3 - 15 мМ,
что кардиомиоциты желудочка (или электрости-
сахарозу - 110 мМ и NaNO3 - 125 мМ, умень-
мулируемые препараты сердца) более устойчивы
шение ΔΨмито внутренней мембраны МСК было
к повреждающему действию Tl+, чем кардиоми-
не столь значительным. Снижение ΔΨмито резко
циты и пейсмекерные клетки спонтанно сокра-
усилилось в опытах с Ca2+ что выразилось в об-
щающихся предсердий. Данные, представленные
ратном поступлении в среду поглощенного мито-
выше, указывают на то, что Tl+ может влиять на
хондриями сафранина (рис. 5а). Это хорошо вид-
процессы сопряжения возбуждения-сокраще-
но при сравнении соответствующих скоростей
ния в сердечной мышце.
изменения флуоресценции сафранина (рис. 5б),
Действие Ca2+ на дыхание, набухание и потен-
которые увеличились почти в три раза после вне-
циал внутренней мембраны митохондрий сердца
сения Ca2+ в среду. Однако данные эффекты Ca2+
крысы в среде с TlNO3 и NaNO3. На рис. 3а видно
практически полностью исчезли при наличии в
что дыхание энергизованных сукцинатом МСК в
среде АДФ и CsA, добавленных до митохондрий.
базальном состоянии, состоянии 3 и стимулиро-
ванном ДНФ состоянии заметно снижалось в
среде с 75 мМ TlNO3 и 125 мМ NaNO3 в сравне-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
нии с опытами без таллия. После инъекции
Tl+ может ингибировать Na/K-ATФазу [24] и
100 мкМ Ca2+ в среду с 25 мМ TlNO3 и 125 мМ
увеличивать внутриклеточную концентрацию
NaNO3 произошло заметное снижение стимули-
Na+ [16], что, в свою очередь, приводит к увели-
рованного ДНФ дыхания (рис. 3а) и величины
чению внутриклеточного кальция ([Ca2+]i) и по-
ДКДНФ (рис. 3б). При этом данный эффект
вышению как амплитуды сокращения, так и ско-
ослаблялся в присутствии АДФ и CsA.
рости нарастания напряжения. Однако мы на-
блюдаем обратные процессы, что может
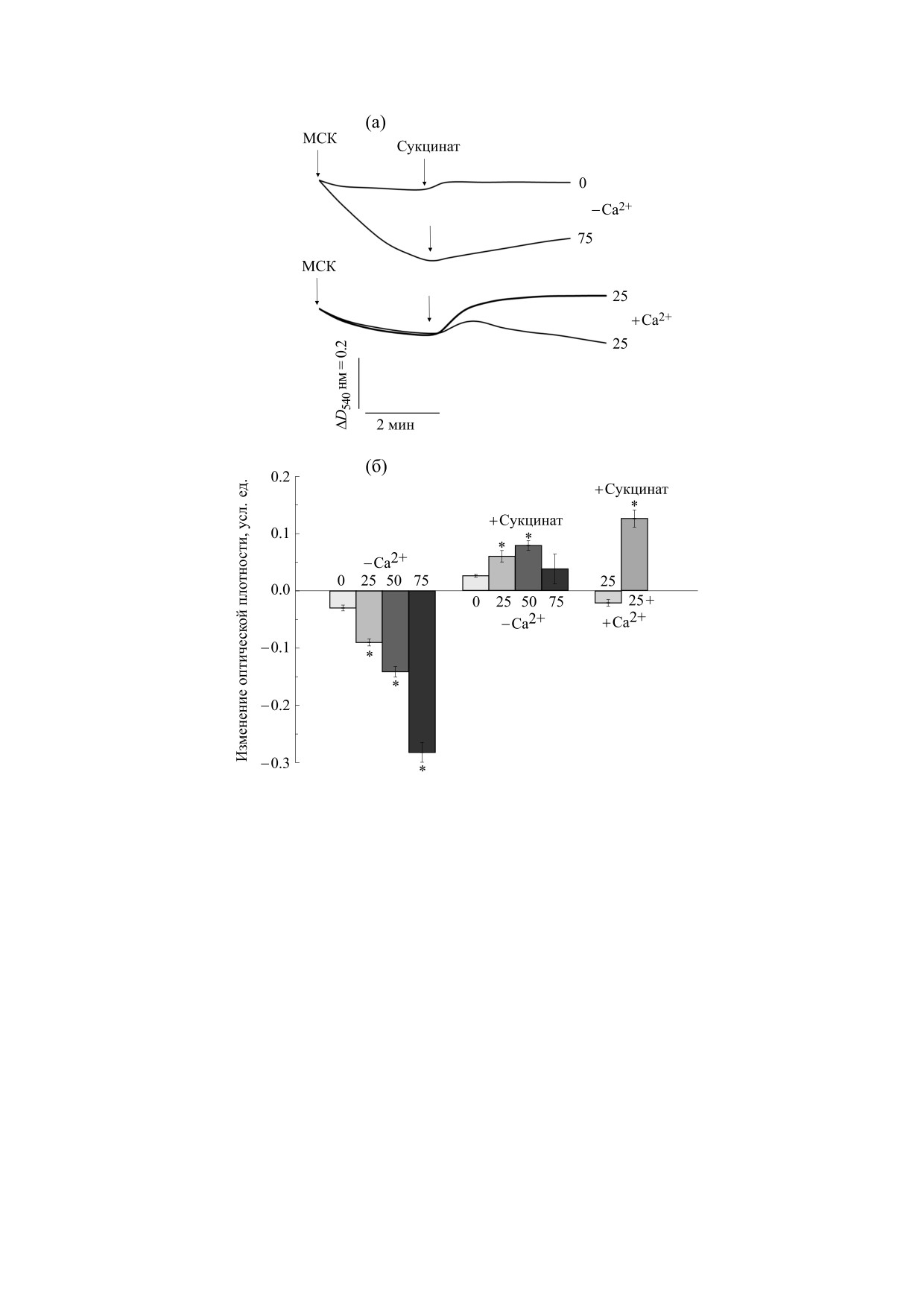
Пассивную натриевую проницаемость ВММ
свидетельствовать о сильных ингибирующих
можно оценить по набуханию деэнергизованных
свойствах самого таллия, подавляющих положи-
МСК в среде с NaNO3 [22]. Ранее мы показали,
тельный инотропный эффект, вследствие увели-
что Tl+ увеличивал пассивную натриевую прони-
чения внутриклеточного натрия. При этом наи-
цаемость внутренней мембраны МПК [23]. На
большее ингибирующее влияние Tl+ оказывает на
рис. 4 можно увидеть, что набухание деэнергизо-
спонтанное сокращение предсердий, обнаружи-
ванных МСК увеличивалось с ростом концентра-
вая выраженный отрицательный хронотропный
ции TlNO3 в среде с NaNO3. Это доказывает что
эффект [3,18] и наши данные. Однако электро-
Tl+, как и в опытах с МПК, стимулирует пассив-
стимулируемые препараты сердца могут быть бо-
ную натриевую проницаемость внутренней мем-
лее устойчивы к ингибирующему влиянию ионов
браны этих органелл. Набухание деэнэргизован-
таллия и обнаруживать значительный положи-
ных митохондрий не зависело от наличия Ca2+,
тельный инотропный эффект [16].
АДФ и CsA в среде с 25 мМ TlNO3 и 125 мМ Na-
Данные, приведенные в работах [25,26], ука-
NO3 (рис. 4б). Инъекция сукцината в среду сти-
зывают на то, что Tl+ снижает синтез АТФ в клет-
мулировала сжатие митохондрий, которое было
ках. Сердце весьма чувствительно к содержанию
не столь выражено в среде с 75 мМ TlNO3 (рис. 4).
концентрации макроэргов. Основными энерго-
БИОФИЗИКА том 64
№ 5
2019
ВЛИЯНИЕ ТАЛЛИЯ НА СПОНТАННОЕ СОКРАЩЕНИЕ СЕРДЕЧНОЙ МЫШЦЫ
969
Рис. 4. Набухание митохондрий сердца крысы в среде с NaNO3. Митохондрии (1 мг/мл белка) добавляли в среду,
содержащую TlNO3 - 0-75 мМ, NaNO3 - 125 мМ, трис-NO3 - 5 мМ (pH 7,3), ротенон - 2 мкМ и олигомицин -
1 мкг/мл, а также трис-PO4 - 1 мМ (опыты с Ca2+). Вертикальными стрелками показаны следующие добавки:
митохондрии сердца крысы (МСК) и сукцинат - 5 мМ (+ Сукцинат). Цифрами справа от кривых на рисунке (а) либо
вблизи оси абсцисс на рисунке (б) отмечено наличие в среде TlNO3 (мМ). Жирной кривой на рисунке (а) показано
присутствие 1 мкМ CsA в среде. По оси ординат на рисунке (б) показано изменение оптической плотности через 3 мин
после добавки митохондрий (- Ca2+) либо через 3 мин после внесения сукцината в среду (+ Сукцинат). Наличие 200
мкМ Ca2+ в среде обозначено на рисунке (б) как (+ Ca2+). Знаком (+) у концентрации 25 мМ TlNO3 под осью абсцисс
отмечено присутствие в среде до митохондрий 500 мкМ АДФ и 1 мкМ CsA. Звездочкой на рисунке (б) показаны
достоверные различия (р < 0,05) от контроля - опыты без Ca2+ (- Ca2+) или с предварительно (до митохондрий)
добавленным 200 мкМ Ca2+ (+ Ca2+).
емкими процессами являются развитие силы и
незначительное падение концентрации макроэр-
частота сокращений сердца. Сократительный ап-
гов в сердце. Наряду с уменьшением количества
парат за счет АТФазной активности миозина по-
мостиков между актиновыми и миозиновыми
требляет до 80% общей энергии кардиомиоцита.
миофибриллами возникают неразмыкающиеся
Поэтому, с целью экономии энергии в сердце, си-
связи между ними из-за накопления АДФ, повы-
ла и частота сокращения сразу реагируют даже на
шается ригидность сердца, затрудняющая его на-
БИОФИЗИКА том 64
№ 5
2019
970
КОРОТКОВ и др.
полнение кровью, падает его насосная функция.
Помимо этого, снижение АТФазной активности
саркоплазматического ретикулума приводит к
уменьшению его реабсорбционной способности
и, как следствие, к снижению скорости релакса-
ции одиночного сокращения (отрицательный лу-
зитропный эффект).
Не исключено, что таллий оказывает на сер-
дечную мышцу двойственное влияние. При ма-
лых концентрациях таллия, когда ингибирование
синтеза АТФ незначительно, увеличение внутри-
клеточного натрия и, соответственно, кальция,
может приводить к положительному инотропно-
му эффекту, как описано в работах [3,15-17]. Од-
нако при больших концентрациях таллия или
увеличении времени инкубации начинает прева-
лировать эффект ингибирования синтеза АТФ,
приводящий к отрицательному инотропно-
му/хронотропному [3,13-15,17,18] и лузитропным
эффектам, а также к снижению скорости нараста-
ния напряжения одиночных сокращений сердца,
которое мы наблюдали в наших экспериментах.
Подтверждением может служить также тот факт,
что увеличение частоты стимуляции сердца
(быстрое истощение пула макроэргов) в растворе
с таллием приводило к большему отрицательному
инотропному эффекту [15].
Таллий плохо выводится из клеток и имеет
свойство в них накапливаться [3], поэтому токси-
ческие эффекты малых концентраций таллия
могут проявляться в отдаленном периоде. При
запуске процессов апоптоза Tl+ увеличивает про-
ницаемость плазматической мембраны кардио-
миоцитов для ионов Са2+. Происходит неуправ-
ляемый вход кальция через поры плазматической
мембраны [27].
Увеличение [Ca2+]i, вызванное таллием, до-
полнительно стимулирует открытие МКЗП во
внутренней мембране митохондрий. Tl+ вызыва-
ет выраженную дисфункцию митохондрий [28-
Рис. 5. Интенсивность флуоресценции сафранина в
суспензии энергизованных сукцинатом митохондрий
30]. В этой cвязи пpедcтавлялоcь важным опpеде-
сердца крысы в среде с NaNO3. Митохондрии
лить влияние Tl+ на функциональное cоcтояние
(0,5 мг/мл) помещали в среду, содержащую TlNO3 -
митоxондpий кардиомиоцитов и уcтановить его
20 мМ, сахарозу - 110 мМ, NaNO3 -125 мМ, трис-
дейcтвие на катионный тpанcпоpт чеpез внутpен-
NO3 - 5 мМ (pH 7,3), трис-PO4 - 1 мМ, ротенон -
2 мкМ, сафранин - 3 мкМ и олигомицин - 1 мкг/мл.
ние мембpаны митоxондpий.
Стрелками показаны добавки: митохондрий сердца
Воздействие Tl+ на изолированные гепатоци-
крысы (МСК), 5 мМ сукцината (Сукцинат) и 40 мкМ
2,4-динитрофенола (ДНФ). Над кривыми на рисунке
ты и клетки PC12 индуцировало в них апоптоти-
(а) либо по оси ординат на рисунке (б) показаны
ческие процессы, приводило к уменьшению кон-
скорости изменения флуоресценции сафранина
центрации восстановленного глутатиона и к уве-
(усл. ед./мин) за 1 минуту до внесения в среду ДНФ.
личению продукции активных форм кислорода и
Цифрами под осью абсцисс отмечены опыты: (1) -
без Ca2+, (2) - с 40 мкМ Ca2+, (3) - с Ca2+ и
H2O2 в цитоплазме, а также стимулировало про-
внесенными до митохондрий 500 мкМ АДФ и 1 мкМ
цессы перекисного окисления липидов [29,30].
CsA. Звездочкой на рисунке (б) отмечены
Транспорт Tl+ в клетки HEK-293 и мышечные
достоверные различия от контроля - опыты без Ca2+
клетки крысы происходит при участии потенци-
(р < 0,05).
БИОФИЗИКА том 64
№ 5
2019
ВЛИЯНИЕ ТАЛЛИЯ НА СПОНТАННОЕ СОКРАЩЕНИЕ СЕРДЕЧНОЙ МЫШЦЫ
971
ал-зависимых и кальций-индуцируемых калие-
открытие МКЗП во внутренней мембране нагру-
вых каналов [31,32]. Основной причиной токсич-
женных кальцием МПК становилось возможным
ности таллиевых соединений является способ-
только в среде с TlNO3 [11]. В наших опытах с
энергизованными сукцинатом МСК в среде с Tl-
ность Tl+ замещать K+ в калий-зависимых
NO3 и NaNO3 ингибиторы МКЗП (АДФ и CsA)
биохимических процессах, легко проникать через
заметно тормозили вызываемое кальцием сниже-
внутреннюю митохондриальную мембрану и спо-
ние ΔΨмито (рис. 5) и уменьшение разобщенного
собствовать увеличению внутриклеточной кон-
ДНФ дыхания и величины ДКДНФ (рис. 3), также
центрации ионов Ca2+ и Na+ [2,7,10]. Транспорт
они препятствовали индуцированному кальцием
Tl+ в митохондрии сердца крысы осуществляется
набуханию этих органелл (рис. 4). Ранее подоб-
при участии АТФ-зависимых или кальций-акти-
ное торможение открытия этой поры наблюда-
вируемых калиевых каналов BK-типа [33-35].
лось в присутствии ингибиторов МКЗП
При изучении набухания деэнергизованных ми-
(АДФ, CsA, Mg2+) и ингибитора фосфатного сим-
тохондрий в средах с нитратами (KNO3, NaNO3,
портера - мерсалила [11,40]. В этом случае также
NH4NO3, TlNO3) обнаружили, что внутренняя
заметно снижалось вызываемое кальциевой
нагрузкой набухание митохондрий, а снижение
митохондриальная мембрана (ВММ) оказалась
разобщенного ДНФ дыхания митохондрий и по-
низкопроницаема для K+, Na+, H+ и высокопро-
тенциала ВММ (ΔΨмито) после инъекции Ca2+ в
ницаема для Tl+ соответственно [7,22]. В анало-
среду в присутствии этих ингибиторов в значи-
гичных опытах с митохондриями печени крысы в
тельной степени нивелировалось в аналогичных
400 мОсм среде, содержащей смесь TlNO3 с нит-
экспериментах с нагруженными кальцием МСК в
ратом (KNO3 или NH4NO3 или NaNO3), либо в
среде с TlNO3 и нитратом (KNO3 или NH4NO3)
[12] и с нагруженными кальцием МПК в среде с
опытах с митохондриями сердца крысы в среде,
TlNO3 и нитратом (KNO3 или NaNO3 или
содержащей смесь TlNO3 с нитратом (KNO3 или
NH4NO3) [11]. Обнаруженное сжатие нагружен-
NH4NO3), было показано, что Tl+ соответствен-
ных кальцием МСК, предварительно набухших в
но увеличивал пассивную проницаемость ВММ
среде с TlNO3 и NaNO3 (рис. 4а) либо с TlNO3 и
для K+, H+ и Na+ [12,23]. Увеличение набухания
нитратом (KNO3 или NH4NO3) [12], а также на-
деэнергизованных МСК в среде с 25-75 мМ Tl-
груженных кальцием МПК [11] в присутствии
NO3 и 125 мМ NaNO3 (рис. 4) указывает на стиму-
АДФ и CsA согласуется с предполагаемым ранее
лирование таллием пассивной проницаемости
[41] кооперативным взаимодействием этих инги-
биторов с расположенными вблизи транслоказы
внутренней мембраны этих органелл для Na+.
адениновых нуклеотидов Ca2+-связывающими
Полученные результаты позволяют сделать вы-
сайтами. Эксперименты с нагруженными каль-
вод, что Tl+, подобно Cd2+ [36], увеличивает пас-
цием как МСК (рис. 3-5) [12], так и МПК [11]
сивную проницаемость ВММ митохондрий серд-
позволяют предположить, что нагрузка кальцием
ца и печени крысы. Энергизация сукцинатом
митохондрий в среде, содержащей смесь TlNO3 с
МСК, предварительно набухших в среде с TlNO3
нитратами (KNO3, NaNO3, NH4NO3), может
и NaNO3 (рис. 4а) или с TlNO3 и нитратами
быть обусловлена открытием CsA-ингибируемой
(KNO3, NH4NO3) [12], стимулировала их сжатие,
АДФ-зависимой поры во внутренней мембране
что согласуется с аналогичными результатами с
этих органелл. Снижение базального и ДНФ-сти-
мулированного дыхания митохондрий в этих сре-
МПК в этой среде [23] и связано с удалением из-
дах может быть связано с уменьшением активно-
быточных ионов Na+ посредством митохондри-
сти дыхательных ферментов, вызванным искаже-
ального K+/H+-обменника.
нием пространственной структуры внутренней
мембраны вследствие набухания митохондрий
Цитотоксические эффекты Tl+ в опытах с изо-
[11].
лированными гепатоцитами крысы значительно
Таким образом, на основании полученных
снижались в присутствии ингибиторов МКЗП
данных и наших предыдущих исследований мож-
(CsA и карнитина) [30]. В настоящее время счита-
но сделать вывод, что более интенсивная стиму-
ют, что основными компонентами МКЗП явля-
ляция ионной проницаемости ВММ и Tl+-инду-
ются фосфатный симпортер, циклофилин D и
цированного МКЗП в экспериментах с МСК по
некоторые элементы протонной АТФ-синтазы,
сравнению с МПК может объяснять большую
также ранее относимую к основным компонен-
чувствительность сердечной мышцы по сравне-
там транслоказу адениновых нуклеотидов [37] те-
нию с печенью к интоксикации солями таллия.
перь классифицируют как регуляторный компо-
нент этой поры [38,39]. Ранее мы показали, что
Более того, применение Tl+ для исследования
БИОФИЗИКА том 64
№ 5
2019
972
КОРОТКОВ и др.
миокарда может быть нежелательно при сердеч-
14.
C. Achenbach, J. Wiemer, R. Ziskoven, and U. Winter,
ных патологиях, включающих нарушения ритма,
Z. Naturforsch. 37с, 1006 (1982).
таких как аритмия и/или брадикардия, а также
15.
W. Lameijer and P. A. van Zwieten, Arch Toxicol. 35,
при сердечной недостаточности, особенно при
49 (1976).
диастолической дисфункции.
16.
D. D. Ku, T. Akera, M. K. Olgaard, and T. M. Brody,
Naunyn Schmiedebergs Arch. Pharmacol. 304, 167
(1978).
БЛАГОДАРНОСТИ
17.
J. Wiemer, R. Ziskoven, and C. Achenbach. Z. Natur-
forsch. 37с, 1015 (1982).
Исследования по определению митохондри-
ального потенциала проводили на базе Центра
18.
I. Rusznyák, L. György, S. Ormai, and T. Millner, Ex-
коллективного пользования в ИЭФБ РАН.
perientia 24, 809 (1968).
Авторы благодарят И.В. Брайловскую за по-
19.
К. В. Cоболь, C. М. Коpотков и В. П. Неcтеpов,
Биофизика 59, 959, (2014).
мощь при выделении митохондрий, а также при
исследовании скоростей поглощения кислорода
20.
С. М. Коротков, Л. В. Емельянова, И. В. Брайлов-
ская и В. П. Нестеров, Докл. РАН 443, 632 (2012).
суспензией митохондрий сердца крысы.
21.
P. C. Waldmeier, J. J. Feldtrauer, T. Qian, and J. Le-
masters, J. Mol. Pharmacol. 62, 22 (2002).
ФИНАНСИРОВАНИЕ РАБОТЫ
22.
G. P. Brierley and M. Jurkowitz, Biochem. Biophys.
Res. Commun. 68, 82 (1976).
Работа выполнена в рамках государственного
задания Федерального агентства научных органи-
23.
S. M. Korotkov, J. Bioenerg. Biomembr. 41,
277
заций России (тема № АААА-А18-118012290142-9).
(2009).
24.
I. A. Skulskii, V. Manninen, and J. Järnefelt, Biochim.
Biophys. Acta 394, 569 (1975).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
25.
A. Skulskii, M. V. Savina, V. V. Glasunov, and
Все применимые международные, националь-
N. E. L. Saris, J. Membrane Biol. 44, 187 (1978).
ные и институциональные принципы ухода и ис-
26.
R L. Melnick, L. G. Monti, and S. M. Motzkin, Bio-
пользования животных при выполнении работы
chem. Biophys. Res. Comm. 69, 68 (1976).
были соблюдены.
27.
К. В. Соболь, В. П. Нестеров, Г. Б. Белостоцкая и
С. М. Коротков, Биофизика 62, 81 (2017).
28.
E. Bramanti, M. Onor, and L. Colombaioni, ACS
СПИСОК ЛИТЕРАТУРЫ
Chem. Neurosci. 10, 451 (2019).
1. R. Blain and G. Kazantzis, in Thallium, Handbook on
29.
C. E. Hanzel and S. V. Verstraeten, Toxicol. Appl.
the Toxicology of Metals, Ed. by G. F. Nordberg,
Pharmacol. 236, 59 (2009).
B. A. Fowler, and M. Nordberg (Elsevier, Amsterdam,
30.
J. Pourahmad, M. R. Eskandari, and B. Daraei, Env-
2015), p. 1229.
iron. Toxicol. 25, 456 (2010).
2. J. P. Mulkey and F. W. Oehme, Vet. Hum. Toxicol. 35,
31.
A. L. Blatz and K. L. Magleby, J. Gen. Physiol. 84, 1
445 (1993).
(1984).
3. M. N. Hughes, W. K. Man, and B. C. Whaler, Chem.-
32.
C. D. Weaver, D. Harden, S. I. Dworetzky, et al., J.
Biol. Interact. 23, 85 (1978).
Biomol. Screen. 9, 671 (2004).
4. M. M. Herman and K. G. Bensch, Toxicol. Appl. Phar-
33.
A. P. Wojtovich, D. M. Williams, and M. K. Karcz,
macol. 10, 199 (1967).
et al., Circ. Res. 106, 1190 (2010).
5. J. S. Woods and B. A. Fowler, Toxicol. Appl. Pharma-
34.
A. P. Wojtovich, S. M. Nadtochiy, W. R. Urciuoli,
col. 83, 218 (1986).
et al., Peer J. 1,e48, 1 (2013).
6. M. Fukumoto, D. Yoshida, and S. Yoshida, Ann. Nucl.
35.
L. Testai, A. Martelli, A. Marino, et al., Biochem.
Pharmacol. 85, 1634 (2013).
Med. 11, 291 (1997).
36.
S. M. Korotkov, V. V. Glazunov, E. V. Rozengart, et al.,
7. N. E. Saris, I. A Skulskii, M. V. Savina, and V. V. Glasu-
J. Biochem. Mol. Toxicol. 13, 149 (1999).
nov, J. Bioenerg. Biomembr. 13, 51 (1981).
37.
A. P. Halestrap and A. P. Richardson, J. Mol. Cell.
8. F. Ichas and J. P. Mazat, Biochim. Biophys. Acta 1366,
Cardiol. 78, 129 (2015).
33 (1998).
38.
P. Varanyuwatana and A. P. Halestrap, Mitochondrion
9. P. Bernardi, Physiol. Rev. 79, 1127 (1999).
12, 120 (2012).
10. K. Zierold, Toxicol. In Vitro. 14, 557 (2000).
39.
M. Bonora, C. Morganti, G. Morciano, et al., EMBO
11. S. M. Korotkov and N. E. Saris, J. Bioenerg. Biomem-
Rep. 18, 1077 (2017).
br. 43, 149 (2011).
40.
S. M. Korotkov, S. A. Konovalova, V. P. Nesterov, and
12. S. M. Korotkov, V. P. Nesterov, I. V. Brailovskaya,
I. V. Brailovskaya, Biochem. Biophys. Res. Commun.
et al., J. Bioenerg. Biomembr. 45, 531 (2013).
495, 1716 (2018).
13. R. Ziskoven, C. Achenbach, J. Wiemer, and U. Winter,
41.
A. P. Halestrap and C. Brenner, Curr. Med. Chem. 10,
Z. Naturforsch. 37с, 995 (1982).
1507 (2003).
БИОФИЗИКА том 64
№ 5
2019
ВЛИЯНИЕ ТАЛЛИЯ НА СПОНТАННОЕ СОКРАЩЕНИЕ СЕРДЕЧНОЙ МЫШЦЫ
973
The Effects of Thallium on the Spontaneous Contraction of Heart Muscle and Energetic
Processes in Cardiomyocyte Mitochondria
S.M. Korotkov, V.P. Nesterov, and K.V. Sobol
Sechenov Institute of Evolutionary Physiology and Biochemistry, Russian Academy of Sciences,
prosp. Toreza 44, St. Petersburg, 194223 Russia
We investigated the effects of Tl+ ions on the spontaneous contraction of the frog heart muscle and on rat
heart mitochondria. Tl+ ions at concentrations of 1.0, 2.5 and 5 mM in the Ringer's solution caused reduc-
tions in all parameters of the spontaneous contraction in cardiac muscle preparations. The greatest declines
were observed for the frequency of contractions, as well as for the amplitudes and the rate of rise and the rate
of relaxation of the twitch-type contraction. The addition of Ca2+ to mitochondria into the medium with Tl-
NO3 and NaNO3 resulted in the opening of permeability transition pore in the inner mitochondrial mem-
brane which followed by an increase in mitochondrial swelling, a reduction in its inner membrane potential,
and a decline in respiration rate in 3 or 2,4-dinitrophenol states. These effects of Tl+ were inhibited by ADP
and cyclosporine A. Thus, the Tl+-stimulated Ca2+ entry into cardiomyocytes may induce heart mitochon-
dria overload by Ca2+ and Na+ ions and stimulate the opening of mitochondrial permeability transition pore
in the inner membrane. These findings may provide additional information on explanation of thallium tox-
icity in the cardiac muscle. The use of Tl+ for myocardial studies may be undesirable during arrhythmia and
for heart failure, especially, for diastolic dysfunction.
Keywords: Tl+, Ca2+, Na+, myocardial contraction, pacemaker activity, intoxication, rat heart mitochondria, mi-
tochondrial permeability transition pore
БИОФИЗИКА том 64
№ 5
2019