БИОФИЗИКА, 2019, том 64, № 4, с. 982-987
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 576.5
АКТИВАЦИЯ САРКОЛЕММАЛЬНЫХ α2-АДРЕНОРЕЦЕПТОРОВ
ПОДДЕРЖИВАЕТ Са2+-ГОМЕОСТАЗ И ПРЕДОТВРАЩАЕТ
СОКРАТИТЕЛЬНУЮ АРИТМИЮ СЕРДЕЧНОЙ МЫШЦЫ В УСЛОВИЯХ
СИМПАТИЧЕСКОГО СТРЕССА
© 2019 г. А.С. Аверин*, О.В. Накипова*, Л.С. Косарский*, О.Ю. Пименов**, М.Х. Галимова**,
М.Н. Ненов** ***, А.В. Бережнов*, А.Е. Алексеев** ****
*Институт биофизики клетки РАН - обособленное подразделение ФИЦ ПНЦБИ РАН,
142290, Пущино Московской области, ул. Институтская, 3
**Институт теоретической и экспериментальной биофизики РАН,
142290, Пущино Московской области, ул. Институтская, 3
***Alzheimer's Center at Temple, Lewis Katz School of Medicine, Temple University, Philadelphia, PA, 19140, USA
****Department of Cardiovascular Medicine, Center for Regenerative Medicine, Stabile 5, Mayo Clinic, Rochester, MN, USA
E-mail: averinas82@gmail.com
Поступила в редакцию 19.06.2019 г.
После доработки 19.06.2019 г.
Принята к публикации 08.07.2019 г.
Реакция организма на стресс опосредуется взаимодействием катехоламинов с адренергическими α-
и β-рецепторами. Установлено, что в отличие от α1- и β-адренорецепторов, α2-адренорецепторы
встроены в петли обратной связи симпато-адреналовой системы, контролирующей выброс катехо-
ламинов (норадреналин, адреналин), что позволяет сохранять энергоресурсы и функцию перифе-
рических органов при перегрузке катехоламинами. Нарушения механизмов обратной связи ведут к
различным патологиям, включая гипертрофическую перестройку сердца с последующим развитием
сердечной недостаточности. Ранее мы обнаружили экспрессию α2-адренорецепторов в плазмати-
ческой мембране кардиомиоцитов, где они участвуют в регуляции внутриклеточного уровня Са2+.
Мы предположили, что в дополнение к традиционному механизму, эти рецепторы способны ло-
кально контролировать реакцию сердечной мышцы на стресс. В данной работе нами показано, что
контролируя уровень свободного Са2+ в цитозоле, сарколеммальные α2-адренорецепторы ограни-
чивают положительный инотропный эффект адренергической стимуляции в папиллярных мыш-
цах. Способность агонистов α2-адренорецепторов подавлять внутриклеточные спонтанные Са2+-
осцилляции повышает эффективность систолической функции папиллярных мышц и способствует
уменьшению вероятности возникновения опасной вентрикулярной аритмии. Таким образом, α2-
адренорецепторы в сарколеммальной мембране кардиомиоцитов обладают собственным защит-
ным потенциалом, который может найти применение в предотвращении патологической пере-
стройки сердечной мышцы в условиях хронического стресса.
Ключевые слова: норадреналин, изопротеренол, гуанабенз, сократимость, Са2+канал L-типа, осцилля-
ции внутриклеточного Са2+.
DOI: 10.1134/S000630291905020Х
хронический стресс вызывает функциональную
Физиологические системы, мобилизующие
перегрузку сердца, что приводит вначале к пере-
функции организма в условиях стресса, включа-
ют в себя адаптационные механизмы обратной
стройке сердечной мышцы (гипертрофия), а по
связи, которые препятствуют перерасходу кле-
исчерпанию адаптационных ресурсов к развитию
точных энергетических ресурсов [1,2]. Установ-
сердечной недостаточности
[5-7]. Состояние
лено, что нарушения механизмов обратных свя-
сердечной недостаточности характеризуется
зей повышают риск развития патологических из-
утратой способности сердца удовлетворять по-
менений в отдельных органах [2-4]. У человека
требности организма в адекватном кровоснабже-
нии, что, в свою очередь, приводит к дальнейшей
входящий Са2+-ток Са2+-каналов L-типа, ПМ - папил- стимуляции работы сердца, усугубляя развитие
лярная мышца.
болезни [5,6].
982
АКТИВАЦИЯ САРКОЛЕММАЛЬНЫХ α2-АДРЕНОРЕЦЕПТОРОВ
983
Роль сигнальных молекул, опосредующих
нение в лечении патологических перестроек
стресс-реакцию организма, играют катехолами-
сердечной мышцы в условиях избыточной адре-
ны - адреналин и норадреналин. Основными ми-
нергической стимуляции [19]. Тем не менее вклад
шенями для эндогенных катехоламинов являют-
α2-AR в регуляцию сократимости сердца при ад-
ся α- и β-адренергические рецепторы (AR) [8,9].
ренергической стимуляции остается малоизучен-
В ответ на выброс адреналина и норадреналина
ным. В данной работе мы оценили вклад актива-
сигналы от α1-AR и β-AR, помимо мобилизации
ции сарколеммальных α2-AR в изометрическую
различных клеточных процессов, вызывают до-
сократимость папиллярной мышцы (ПМ) сердца
полнительное фосфорилирование Са2+-каналов
крыс при физиологических частотах сокращения
L-типа, что значительно стимулирует входящий
и эффект антиаритмического действия α2-AR в
Са2+ ток (ICaL) и, как следствие, сократимость, с
изолированных кардиомиоцитах и папиллярной
мышце крысы.
целью увеличения сердечного выброса, необхо-
димого для поддержания уровня активности, тре-
буемого организмом в состоянии стресса [7,10,11].
МАТЕРИАЛЫ И МЕТОДЫ
Установлено, что в отличие от других адреноре-
цепторов симпатоадреналовой системы, которые
Исследования, описанные в данной работе,
стимулируют нейрональную активность и выброс
проводили на сердцах крыс.
катехоламинов, α2-AR ограничивают выброс но-
Электрофизиологические эксперименты. Токи
радреналина симпатическими нейронами нерв-
через мембраны изолированных кардиомиоцитов
ной системы и хромаффинными клетками надпо-
измеряли при помощи метода фиксации потен-
чечников [12,13]. Генетически-вызванный дефи-
циала (patch-clamp) в конфигурации «perforated
цит α2-AR повышает уровень циркулирующих
patch-clamp» от целой клетки. Кардиомиоциты
катехоламинов и увеличивает смертность мышей
выделяли методом протеолитической дисперсии
вследствие развития сердечной недостаточности
перфузируемых сердец, как описано ранее [17].
при фиброзе и гипертрофии левого желудочка
Электрический доступ к целой клетке достигался
[12,14]. Более того, пациенты с наследуемой мута-
перфорацией клеточной мембраны амфотереци-
цией Del322-325 в структуре α2-AR, уменьшаю-
ном В (200-250 мкг/мл), добавленным в измери-
щей способность этих рецепторов подавлять вы-
тельные электроды, имеющие сопротивление 3-
брос норадреналина, и мутацией в β1-AR, повы-
5 МОм и заполненные раствором следующего со-
шающей их чувствительность к катехоламинам,
става (в мМ): CsCl - 130, MgSO4- 5, HEPES - 10,
подвержены более высокому риску развития сер-
pH 7,25. Раствор, омывающий клетки в измери-
дечной недостаточности [15]. Поэтому, актива-
тельной камере, содержал (в мМ): NaCl - 80, Ca-
ция α2-AR традиционно рассматривается как ме-
Cl2 - 2, MgSO4 - 5, KH2PO4 - 1,2, CsCl - 10, хло-
ханизм отрицательной обратной связи в симпа-
рид тетраэтиламония (TEA-Cl) - 20, глюкозу -
тических нейронах, призванный уменьшать
20, L-аргинина - 1,0, HEPES - 10, pH 7,25. Токи
адренергическую стимуляцию сердца при пере-
измеряли при помощи усилителя Axopatch 200B
грузке катехоламинами.
(Molecular Devices, США). Протокол стимуля-
Однако недавние исследования показали, что
ции, вычисление клеточных параметров и оциф-
ранее не рассматриваемая активация перифери-
ровку данных осуществляли с использованием
ческих α2-AR в сарколемме кардиомиоцитов сти-
программного обеспечения BioQuest [17] цифро-
мулирует эндотелиальную NO-синтазу через ак-
аналогово/аналого-цифрового преобразователя
тивацию PI3K-Akt/PKB сигнального каскада,
L-154 («L-Card», Москва). Для экспериментов
что, через механизм S-нитролизирования фосфо-
использовали только клетки, в которых перфори-
ламбана и Са2+-насоса (SERCA), ускоряет закач-
рование обеспечивало сопротивление доступа
ку Са2+ в саркоплазматический ретикулум [16].
менее 30 МОм. Сопротивление доступа, ском-
Реализация этого сигнального механизма в усло-
пенсированное на 40-50%, и некомпенсирован-
виях реального сопряжения возбуждения и со-
ную электрическую емкость клетки измеряли на
основе анализа емкостной перезарядки клеточ-
кращения должна поддерживать запасы Са2+ в
ной мембраны в ходе всего эксперимента для
саркоплазматическом ретикулуме и, по-видимо-
оценки стабильности клеточного клямпирова-
му, способствовать сократительной устойчивости
ния. Измерения проводили при 32 ± 1°C.
миокарда. Помимо этого, активация этого же
сигнального пути от α2-AR через PI3K-
Измерение внутриклеточного Са2+. Спонтан-
Akt/PKB-NO-cGMP-PKG приводит к блоки-
ные Са2+-осцилляции измеряли в нестимулируе-
рованию ICaL [17]. Эти данные указывают на то,
мых одиночных кардиомиоцитах, нагруженных
что, в дополнение к контролю активности симпа-
5 мкМ Fluo4-AM, на длине волны 530 нМ при
тических нейронов, α2-AR на внешней мембране
возбуждении на длине волны 490 нМ при помо-
кардиомиоцитов могут обладать собственным за-
щи флуоресцентной станции
«Cell observer»,
щитным потенциалом, что может найти приме-
оснащенной инвертированным микроскопом
БИОФИЗИКА том 64
№ 4
2019
984
АВЕРИН и др.
Axiovert
200M и монохромной CCD-камерой
комплекса Са2+/кальмодулин приводит к актива-
AxioCam HSM (Carl Zeiss, Германия), как описа-
ции кальцинеурин- и протеинкиназа C-зависи-
но ранее [18]. Выделенные кардиомиоциты в из-
мых транскрипционных факторов [5]. Таким об-
мерительной камере омывались сбалансирован-
разом, препятствуя Са2+-перегрузке во время ад-
ным раствором Хенкса, содержащим (в мМ): Na-
ренергического стресса, α2-AR способны
Cl - 138; CaCl2 - 1,3; MgSO4 - 0,4; MgCl2 - 0,5;
предотвращать транскрипцию внутриклеточных
KCl - 5,3; KH2PO4 - 0,45; NaHCO3 - 4; Na2HPO4
факторов, ведущих к патологическим перестрой-
- 0,3; глюкозу - 10; L-аргинин - 1; HEPES - 10,
кам сердца [7,23,24]. С другой стороны, ослабле-
рН 7,4. Измерения проводили при 30 ± 0,5°C.
ние инотропного эффекта норадреналина через
активацию α2-AR уменьшает расход внутрикле-
Сократимость папиллярных мышц. Силу изо-
точных энергетических ресурсов миокарда, де-
метрического сокращения измеряли на выделен-
фицит которых также связан с развитием сердеч-
ных ПМ правого желудочка диаметром
0,2-0,5 мм и длиной 1,0-3,0 мм при температуре
ных дисфункций [2,6].
30
±
0,1°C. ПМ помещали в аэрируемый
Одним из проявлений патологии миокарда яв-
(95% О2 + 5% CО2) раствор Тиpоде, содержащий
ляются аритмии, связанные с изменениями кле-
(в мМ): NaCl - 135, KCl - 4, MgCl2 - 1, CaCl2 -
точного Са2+-гомеостаза
[19,24,26]. Основной
1,8, NaHCO3 - 13,2, NaH2PO4 - 1,8, L-аргинин -
причиной спонтанной активности миокарда счи-
1, глюкозу - 11, pН 7,4. Силу сокращения F в ответ
тается появление внутриклеточных Са2+-осцил-
на стимуляцию ПМ прямоугольными стимулами
ляций [25], которые наблюдаются примерно у
регистрировали при помощи компьютеризиро-
50% не стимулируемых кардиомиоцитов в попу-
ванной установки c механотроном 6X-2М [19].
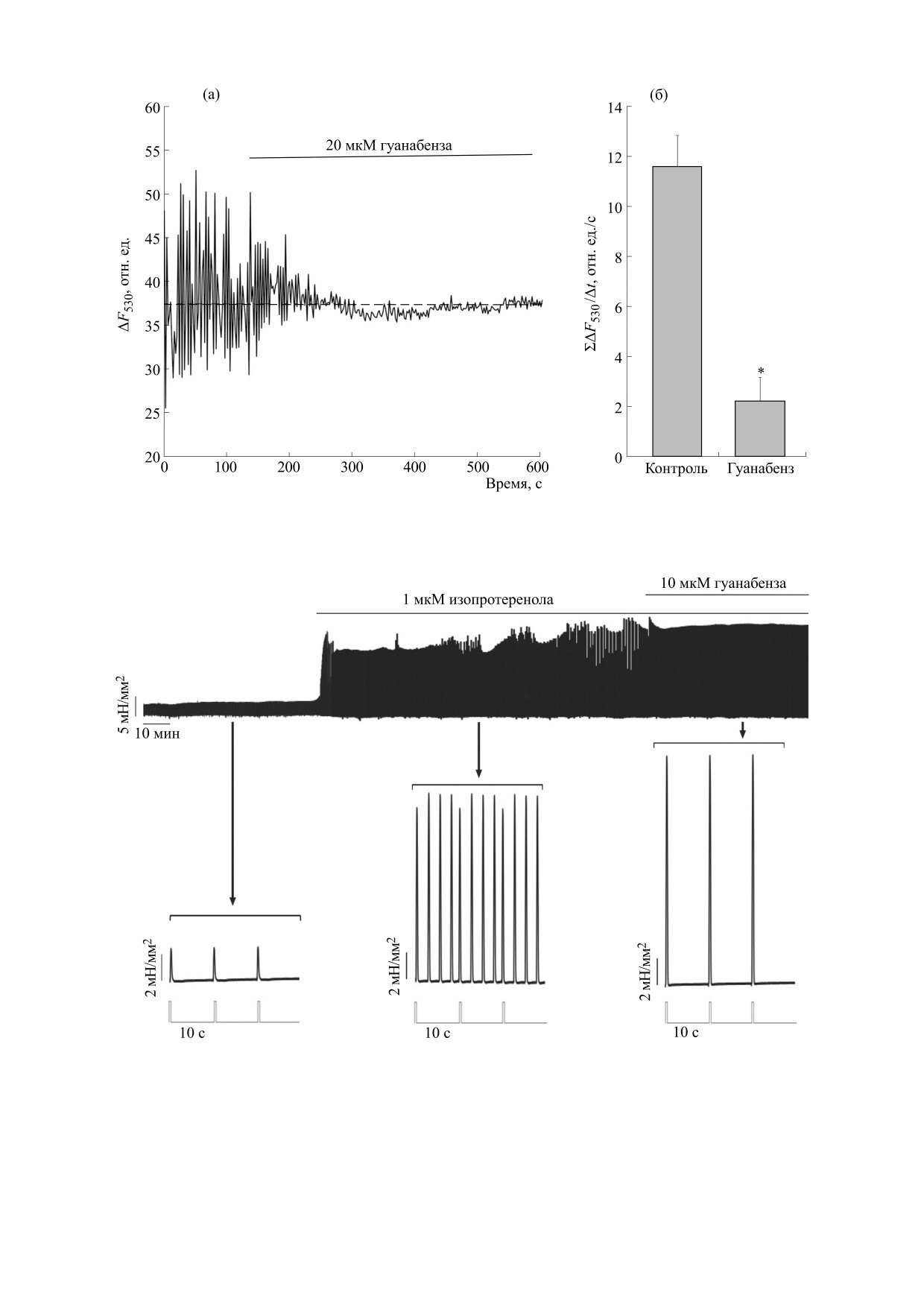
ляции первичной клеточной культуры (рис. 2). В
наших экспериментах активация α2-AR агони-
стом гуанабензом подавляла спонтанные Са2+-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
осциляции (рис. 2), что, как было показано нами
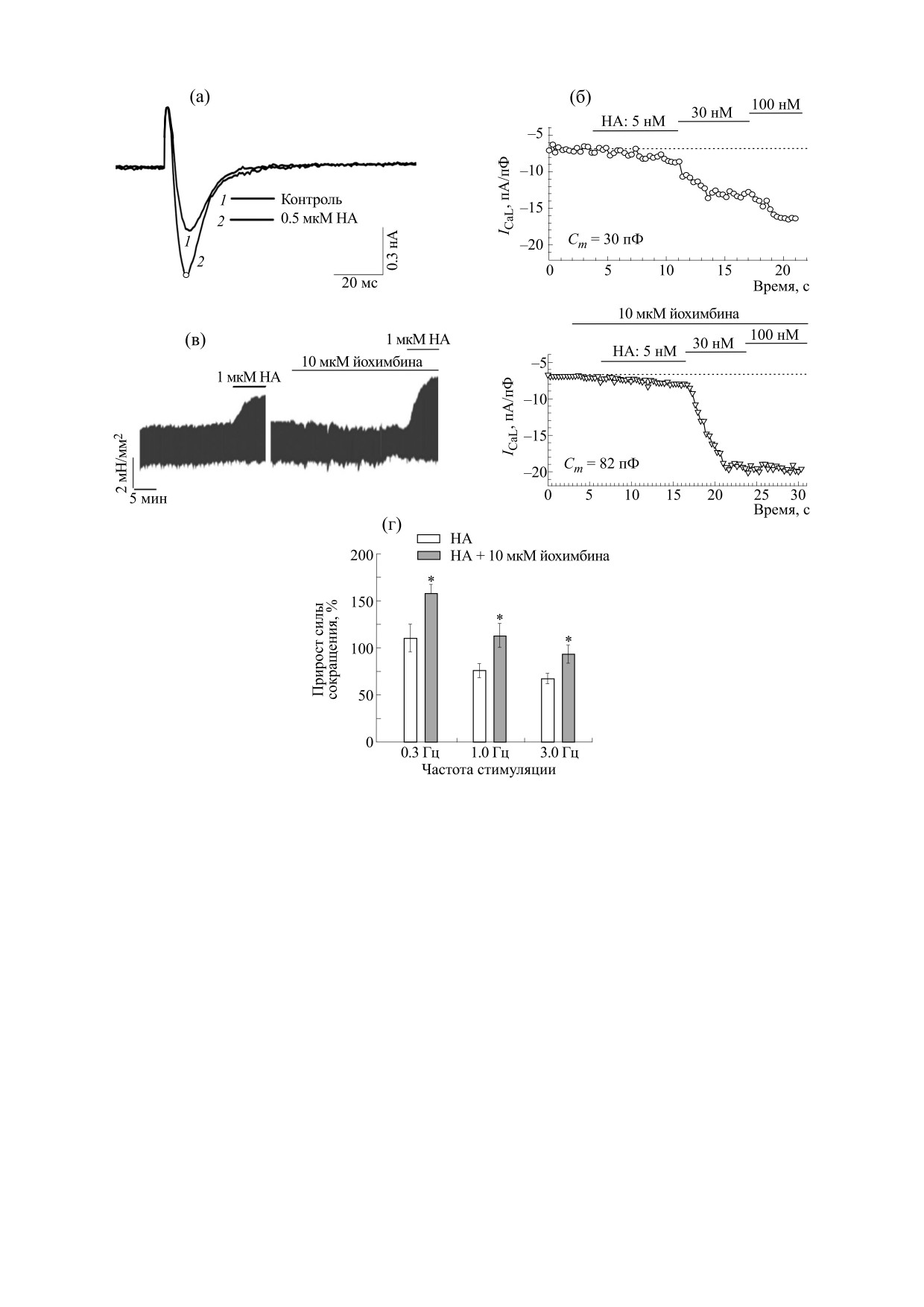
В условиях симпатической стимуляции норад-
ранее, опосредуется PI3K-Akt/PKB-еNOS-сиг-
реналином, агонистом как β- так и α-адреноцеп-
нальным каскадом [16].
торов, йохимбин, антагонист α2-AR, значительно
Несмотря на отсутствие точного понимания
увеличивает ICaL при концентрациях норадрена-
механизмов, увеличение внешнего Са2+, подавле-
лина, превышающих 10 нM (рис. 1а,б). Подгонка
ние активности Na+/K+-насоса, ацидоз, увеличе-
параметров уравнения Хилла для описания полу-
ние свободных радикалов, Са2+-парадокс и др.
ченных зависимостей выявила константу полу-
рассматриваются как факторы, способные каж-
эффекта К0,5 = 31 ± 11 нМ при максимальной ак-
дый сам по себе вызывать появление Cai-осцил-
тивации 105 ± 15% от контрольных значений, вы-
ляций, что может провоцировать сократительную
званных только норадреналином, и К0,5 = 9 ± 2 нМ
миокардиальную аритмию [25]. Среди прочих,
с максимальным эффектом 140 ± 5% от контроль-
катехоламины и другие инотропные агенты также
ных значений, вызванных норадреналином в
рассматриваются как источники появления Cai-
присутствии 10 мкМ йохимбина [17]. Адренерги-
осцилляций и последующих спонтанных сокра-
ческая стимуляция ПМ вызывает ожидаемый
щений сердечных клеток [25,26]. Приложение
значительный положительный инотропный эф-
симпатомиметика изопротеренола с небольшой
фект, который, однако, потенцируется при бло-
вероятностью вызывало появление автосократи-
кировании α2-AR йохимбином (рис. 1в). На ча-
тельной активности, которая не синхронизована
стотах стимуляции, близких к физиологическим
со стимуляцией ПМ, как показано на рис. 3. При
для сердца крыс (~3 Гц), вклад α2-AR в контроль
этом гуанабенз, активируя α2-AR, синхронизует
прироста сократимости ПМ сохраняется
сокращение ПМ со стимуляцией, что приводит к
(рис. 1г). Это указывает на то, что в дополнение к
увеличению силы сокращения (рис. 3).
известной роли нейрональных α2-AR в подавле-
нии активности симпатических нейронов сарко-
Механистической основой эффекта гуана-
леммальные α2-AR в кардиомиоцитах действуют
бенза является обнаруженная нами способ-
в противовес α1- и β-адренергической стимуля-
ность активации α2-AR подавлять Cain-осцил-
ции, препятствуя клеточной Са2+-перегрузке, ко-
ляции, меняя баланс между активностью риа-
торая, как известно, может вызывать гипертро-
нодинового рецептора и SERCA в пользу
фические перестройки сердца и приводить к раз-
увеличения скорости закачки Са2+ в саркоплаз-
витию сердечной недостаточности [21,22].
матический ретикулум
[16]. Гетерогенности
Было показано, что продолжительная актива-
Са2+-нагрузки саркоплазматического ретикулу-
ция α1-AR и β-AR катехоламинами через увели-
ма, вызванные Cain-осцилляциями в отдельной
чение внутриклеточного Са2+ и формирование
сердечной клетке, приводят к неравномерности
БИОФИЗИКА том 64
№ 4
2019
АКТИВАЦИЯ САРКОЛЕММАЛЬНЫХ α2-АДРЕНОРЕЦЕПТОРОВ
985
Рис. 1. Вклад α2-AR в модуляцию ICaL в изолированных кардиоцитах и сократимости ПМ в условиях адренергической
стимуляции. (а) - Норадреналин существенно усиливает входящий в клетку Са2+-ток. Токовые записи получены в от-
вет на деполяризацию клетки от -50 до 0 мВ. (б) - Норадреналин имеет более выраженный эффект на ICaL в присут-
ствии блокатора α2-AR йохимбина. Примеры развития эффекта норадреналина на пиковые значения ICaL-тока в от-
сутствие и в присутствии йохимбина. Значения тока нормализованы на измеренную клеточную емкость (Cm). (в) и
(г) - Репрезентативные записи сокращения ПМ при частоте стимуляции 0,3 Гц и статистические данные прироста си-
лы сокращения ПМ, вызванные норадреналином в отсутствие и в присутствии йохимбина (* - Р < 0,05; t-тест, n = 3
в обеих группах).
уровня систолического Са2+in и состояния сар-
ции сердечной мышцы, а также способствовать
уменьшению вероятности возникновения
комеров при стимуляции, что выражается в па-
опасной вентрикулярной аритмии [18,25].
дении силы сокращения. Таким образом, тка-
неспецифическая активация α2-AR в кардио-
миоцитах, подавляющая Cain-осцилляции,
ФИНАНСИРОВАНИЕ РАБОТЫ
может служить новым инструментом в терапии
Работа выполнена при финансовой поддержке
сердечной недостаточности, позволяющая по-
Российского научного фонда (грант № 18-15-
вышать эффективность систолической функ-
00198) и Российского фонда фундаментальных
БИОФИЗИКА том 64
№ 4
2019
986
АВЕРИН и др.
Рис. 2. (а) - Fluo4-AM-флуоресценция одиночного не стимулированного кардиомиоцита. Спонтанные Са2+-осцил-
ляции подавляются гуанабензом, агонистом α2-AR. (б) - Для построения гистограммы проводили интегрирование
значений флюоресценции, превышающих ее среднее значение (пунктирная линия на панели (а)), до и после прило-
жения гуанабенза с последующей нормировкой на соответствующий период суммирования (* - P < 0,05, t-тест, n = 3).
Рис. 3. Запись сократительной активности ПМ при частоте стимуляции 0,1 Гц. Появление автосокращений ПМ,
вызванных изопротеренолом, сопровождается флуктуацией амплитуды силы сокращения. Гуанабенз на фоне
изопротеренола синхронизует возбуждение и сокращение ПМ, что приводит к увеличению силы сокращения.
Протоколы стимуляции и фрагменты сократительной активности ПМ показаны соответствующими вставками под
основным временным ходом эксперимента.
БИОФИЗИКА том 64
№ 4
2019
АКТИВАЦИЯ САРКОЛЕММАЛЬНЫХ α2-АДРЕНОРЕЦЕПТОРОВ
987
исследований (в рамках научного проекта № 18-
11. N. Macrez-Leprêtre, F. Kalkbrenner, G. Schultz, and
04-00764).
J. Mironneau, J. Biol. Chem. 272, 5261 (1997).
12. M. Brede, F. Wiesmann, R. Jahns, et al., Circulation
106, 2491 (2002).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
13. M. Brede, G. Nagy, M. Philipp, et al., Mol. Endocri-
nol. 17, 1640 (2003).
Исследования проводили в соответствии c
14. L. Hein, J. D. Altman, and B. K. Kobilka, Nature 402,
требованиями Европейской конвенции по защи-
181 (1999).
те животных (86/609/EEC, 1986).
15. K. M. Small, L. E. Wagoner, A. M. Levin, et al., N. En-
gl. J. Med. 347, 1135 (2002).
16. A. V. Maltsev, Y. M. Kokoz, E. V. Evdokimovskii, et al.,
СПИСОК ЛИТЕРАТУРЫ
J. Mol. Cell. Cardiol. 68, 66 (2014).
1. H. Selye, The Physiology and Pathology of Exposure to
17. Y. M. Kokoz, E. V. Evdokimovskii, A. V. Maltsev, et al.,
Stress: A treatise based on the Concepts of the General-
J. Mol. Cell. Cardiol. 100, 9 (2016).
Adaptation-Syndrome and the Diseases of Adaptation
18. A. V. Berezhnov, E. I. Fedotova, M. N. Nenov, et al.,
(Acta, Inc., Montreal, Canada, 1950).
Biofizika. 53 (6), 1025 (2008)
2. L. V. Zingman, D. M. Hodgson, and A. E. Alekseev,
19. A. E. Alekseev, S. Park, O. Y. Pimenov, et al., Pharma-
J. Mol. Psychiatry 8, 253 (2003).
col. Ther.
197,
179
(2019). DOI:
10.1016/
3. D. S. Goldstein, In: Comprehensive Physiology, Ed. by
j.pharmthera.2019.01.007
R. Terjung (John Wiley & Sons, Inc., Hoboken, NJ,
20. O. V. Nakipova, A. S. Averin, E. V. Evdokimovskii,
USA, 2011), pp. 1569-2013.
et al., PLoS One 12, e0177469 (2017).
4. V. Maletic, A. Eramo, K. Gwin, et al., J. Front. Psychi-
21. D. M. Bers, D. A. Eisner, and H. H. Valdivia, Circ.
atry 8, 42 (2017).
Res. 93, 487 (2003).
5. J. J. McMurray and M. A. Pfeffer, Lancet 365, 1877
22. M. Vassalle and C. I. Lin, J. Biomed. Sci. 11, 542
(2005).
(2004).
6. S. Neubauer, N. Engl. J. Med. 356, 1140(2007).
23. Y. K. Tham, B. C. Bernardo, J. Y. Y. Ooi, et al., Arch.
7. A. Lymperopoulos, G. Rengo, and W. J. Koch, Circ.
Toxicol. 89, 1401 (2015).
Res. 113, 739 (2013).
24. J. O. Mudd and D. A. Kass, Nature 451, 919 (2008).
8. R. P. Ahlquist, J. Auton Pharmacol. 1, 101 (1980).
9. D. B. Bylund, Am. J. Physiol. 293, E1479 (2007).
25. E. G. Lakatta, Cardiovasc. Res. 26, 193 (1992).
10. N. Dzimiri, Pharmacol Rev. 51, 465 (1999).
26. S. Pogwizd, Trends. Cardiovasc. Med. 14, 61 (2004).
Activation of Sarcolemmal α2 Adrenoceptors Supports Са2+ Homeostasis
and Prevents Ventricular Arrhythmia under Sympathetic Stress
A.S. Averin*, O.V. Nakipova*, L.S. Kosarsky*, O.Yu. Pimenov**, M.H. Galimova**,
M.N. Nenov** ***, A.V. Berejnov*, and A. E. Alekseev** ****
*Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
***Alzheimer's Center at Temple, Lewis Katz School of Medicine, Temple University, Philadelphia, PA, 19140, USA
****Department of Cardiovascular Medicine, Center for Regenerative Medicine, Stabile 5, Mayo Clinic, Rochester, MN, USA
Reaction of organisms to stress is mediated by interaction of the catecholamines with adrenergic α- and β- recep-
tors. It has been established that in contrast to α1- and β-adrenoceptors, α2-adrenoceptors in the sympathoadrenal
system compose a short feedback loop aimed at controlling catecholamine (norepinephrine, epinephrine) release
from the synapses of sympathetic neurons and the adrenal medulla. Thus, activation of α2-adrenoceptors serves to
conserve cellular energy resources and maintain function of peripheral organs under catecholamine overload. Ab-
errant feedback control of the stress response results in a spectrum of pathologies including maladaptive cardiac
remodeling and development of heart failure. With our previous finding that α2-adrenoceptors in sarcolemma of
cardiac myocytes can govern intracellular Ca2+ handling, we have suggested that in addition to the conventional
mechanism, these receptors are capable of controlling cardiac muscle-delimited stress response. We demonstrated
that by controlling free Ca2+ levels in cytosol, sarcolemmal α2-adrenoceptors attenuate the positive inotropic effect
via adrenoceptor stimulation in papillary muscles. Activation of α2-adrenoceptors also improved the papillary
muscles systolic function and prevented detrimental ventricular arrhythmia via maintenance of the cellular Ca2+
homeostasis and suppression of spontaneous Ca2+ oscillations. Hence, α2-adrenoceptors in sarcolemma of ven-
tricular myocytes possess unique cardioprotective potential that may be implemented to mitigate adverse conse-
quences of sustained adrenergic stress.
Keywords: norepinephrine, isoproterenol, guanabenz, contractility, L-type Ca2+ channel, oscillations of intracellular Ca2+
БИОФИЗИКА том 64
№ 4
2019