БИОФИЗИКА, 2019, том 64, № 5, с. 1003-1009
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 612
ТЕРМОЧУВСТВИТЕЛЬНОСТЬ ПУРИНЕРГИЧЕСКОЙ МОДУЛЯЦИИ
СОКРАТИТЕЛЬНОЙ АКТИВНОСТИ ЛОКОМОТОРНОЙ И
ДЫХАТЕЛЬНОЙ МЫШЦ МЫШИ
© 2019 г. А.Е. Хайруллин*, А.Ю. Теплов*, С.Н. Гришин*, А.М. Фархутдинов*, А.У. Зиганшин* **
*Казанский государственный медицинский университет, 420012, Казань, ул. Бутлерова, 49
**Казанский (Приволжский) федеральный университет, 420008, Казань, ул. Кремлевская, 18
E-mail: khajrulli@yandex.ru
Поступила в редакцию 14.06.2019 г.
После доработки 14.06.2019 г.
Принята к публикации 08.07.2019 г.
Ранее авторами было показано, что гипотермия существенно модулирует влияние АТФ на сократитель-
ную активность различных типов локомоторных мышц грызунов. Цель настоящего исследования -
сравнить эффекты АТФ на сокращения локомоторной (m. soleus) и дыхательной (m. Diafragma) мышц
мыши при нормальной и пониженной температуре. Показано, что снижение температуры окружающей
среды до 22°С вызывает уменьшение силы сокращений m. Diafragma, вызванных как электрической сти-
муляцией, так и карбахолином, и увеличение силы сокращений m. soleus. Эффекты АТФ сохраняются на
этих мышцах и при снижении температуры, но усиливаются только в условиях карбахолин-вызванных
сокращений, что указывает на постсинаптическое расположение термочувствительного звена пуриновой
модуляции. Особенности модулирующего эффекта АТФ с преобладанием постсинаптического термо-
чувствительного звена в различных двигательных единицах мыши при гипотермии могут лежать в основе
адаптационных механизмов этого мелкого грызуна.
Ключевые слова: гипотермия, ATФ, P2-рецепторы, локомоторные и дыхательные мышцы, синапс,
сурамин.
DOI: 10.1134/S0006302919050247
Нами было обнаружено [14], что в медленных
Внеклеточные нуклеотиды, в том числе и
двигательных единицах крысы при снижении
АТФ, оказывают разнообразные эффекты, влияя
температуры усиливается как пре-, так и постси-
на мембранные рецепторы, названные Р2-рецеп-
наптическое действие АТФ, но не в равной степе-
торами [1-3]. Внеклеточное действие АТФ на
ни. Возрастающий потенцирующий эффект АТФ
скелетные мышцы было обнаружено более 40 лет
с задействованием постсинаптических Р2-рецеп-
назад [4]. Известно, что АТФ выделяется из нерв-
торов перекрывает и маскирует тоже увеличен-
ных окончаний при сокращении скелетных
ный, но в меньшей степени, ингибиторный пре-
мышц [5,6]. Установлено, что в нервно-мышеч-
синаптический. Для решения вопроса о том, на-
ных окончаниях лягушки АТФ угнетает выброс
сколько эти эффекты типичны, в настоящей
медиатора, действуя на P2Y-рецепторы, в то вре-
работе мы исследовали эффекты АТФ на сокра-
мя как конечный продукт ее метаболизма - аде-
щения мышечных препаратов медленной (m. sole-
нозин - оказывает аналогичное действие посред-
us) и смешанной (m. Diafragma) по типу миофиб-
ством аденозиновых рецепторов [7]. Пресинап-
рилл скелетных мышц мышей при различных
тическое ингибиторное действие АТФ в нервно-
температурных режимах и сопоставили пре- и
мышечном синапсе было описано в основном на
постсинаптические составляющие этих эффек-
препаратах холоднокровных животных [8-10].
тов при различной степени гипотермии.
Однако в последнее время накопились данные
о том, что АТФ в мионевральных синапсах тепло-
кровных обладает выраженным постсинаптиче-
МЕТОДЫ
ским эффектом, часто отличающимся по знаку от
того, который наблюдается при ее действии на
Подготовительные процедуры. Эксперименты
нервную терминаль [12,13].
проводились на изолированных препаратах
мышц диафрагмы (m. Diafragma) и камбаловид-
Сокращения: СЭП - стимуляция электрическим полем.
ной мышцы (m. soleus) белых мышей массой 25-
1003
1004
ХАЙРУЛЛИН и др.
нили на персональном компьютере. Сокращения
вызывали и записывали в течение двух минут
(12 пиков), а среднее значение силы всех 12 со-
кращений анализировали как один результат.
Силу сокращений, вызванных карбахолином в
концентрации 20 мкМ, оценивали как разницу в
амплитуде сократительных реакций до и после
добавления карбахолина.
Эффекты пуринергических агонистов и антаго-
нистов. В начале эксперимента сократительные
ответы регистрировали дважды с интервалом
5 мин (для электрической стимуляции) или
20 мин (для карбахолина). Раствор АТФ добавля-
ли в концентрации 100 мкМ в ванночку с раство-
ром Кребса, и через 10 мин инкубации записыва-
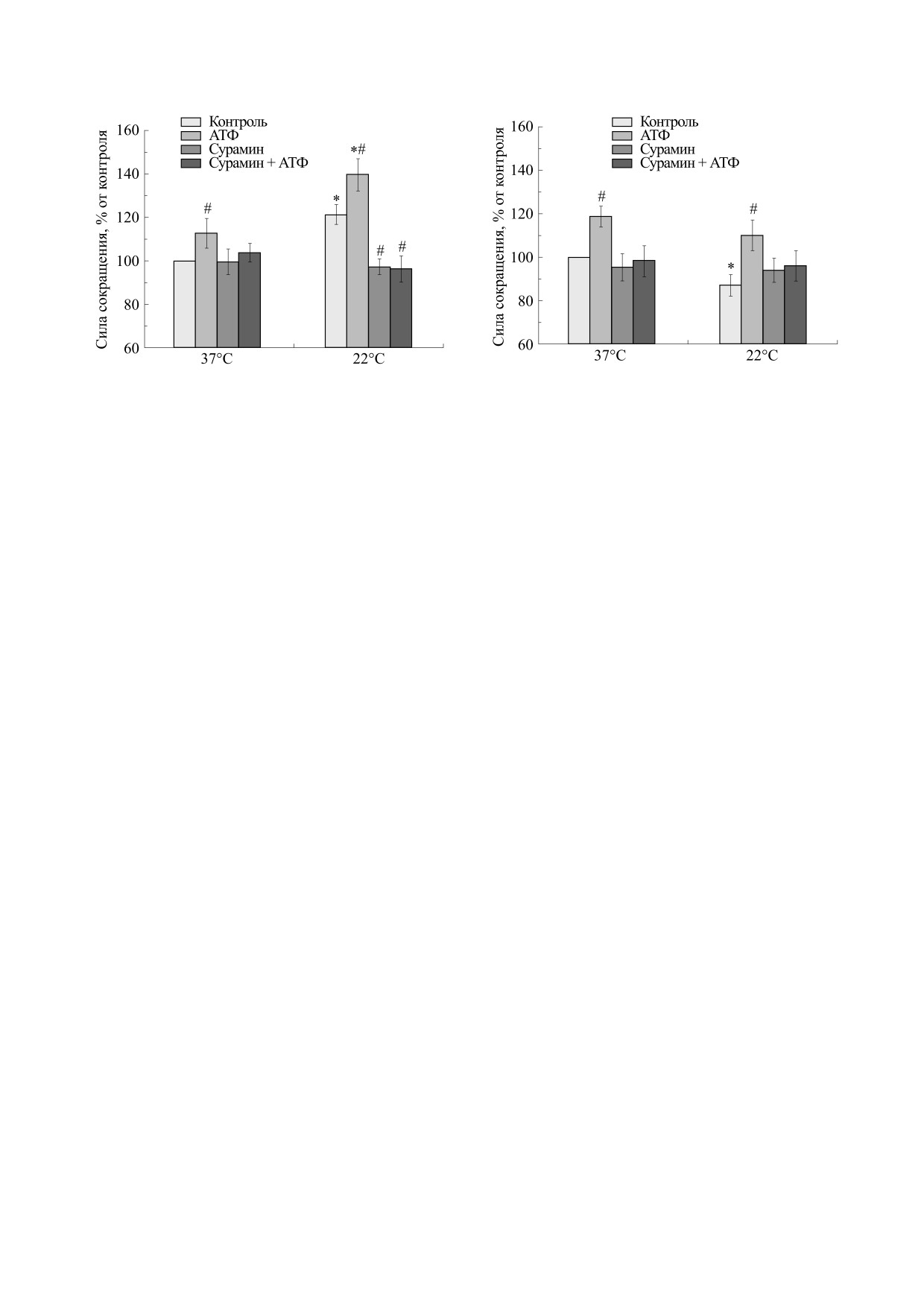
Рис. 1. Влияние температуры на силу сокращений
ли сократительные ответы на электрическую
m. Diafragma мыши, вызванных электрической сти-
стимуляцию или карбахолин. Затем ткань про-
муляцией, в отсутствие и в присутствии АТФ
мывали несколько раз и инкубировали в течение
(100 мкМ) и сурамина (100 мкМ). Результаты пред-
20 мин антагонистом (сурамином в концентра-
ставлены в виде M ± m в % от исходных величин, при-
ции 100 мкМ). После этого добавляли агонист
нятых за 100%; n = 10, * - р < 0,05 от эффекта при
37°С, # - р < 0,05 от контроля.
(АТФ в концентрации 100 мкМ), и сократитель-
ные ответы записывали еще раз. Все сократитель-
ные ответы вычисляли как процент от исходных
32 г. Животных содержали в специальных боксах
сокращений.
на обычном пищевом режиме, со свободным до-
Влияние гипотермии. Все начальные экспери-
ступом к воде. Для эксперимента животные были
менты проводили при физиологической темпера-
обескровлены под анестезией (этаминал натрия,
туре (37°C). Затем температуру раствора ванноч-
40 мг/кг), после чего выделяли m. Diafragma, а
ки постепенно уменьшали и исследовали сокра-
также m. soleus с обеих задних конечностей.
тительную активность каждого препарата
Условия проведения экспериментов по регистра-
мышцы повторно при температуре 22°С. При
ции параметров сокращения. Мышечные препара-
каждой температуре оценивали эффекты АТФ, а
ты были помещены вертикально в ванночках объ-
также сурамина.
емом 10 мл. Один конец мышцы был зафиксиро-
РЕЗУЛЬТАТЫ
ван, другой конец - при помощи шелковой нити
прикреплен к датчику механической активности.
Сокращения, вызванные электрической стиму-
Ванночки заполняли модифицированным рас-
ляцией. При физиологической температуре
твором Кребса следующего состава (в мМ):
(37°С) сила сокращения m. Diafragma составила
NaCl - 118,0, KCl - 4,75, CaCl2 - 2,5, NaHCO3 -
513,3 ± 25,6 мг (n = 10). При понижении темпера-
24,8, KH2PO4
- 1,18, MgSO4·7H2O
- 1,18,
туры окружающей среды сила сокращений мыш-
цы снижалась, достигая 464,5 ± 26,8 мг (n = 10)
глюкоза - 11,0, рН 7,4 ± 0,1.
при 22°С (рис. 1). При температуре 37°С АТФ в
Стимуляцию изолированных мышц проводи-
концентрации 100 мкМ вызывала достоверное
ли с помощью электрического стимулятора Mul-
увеличение силы сокращения m. Diafragma, кото-
tiStim D330 (Digitimer, Великобритания). Сокра-
рая достигала 120,2 ± 5,8% (n = 10) от сокращений
тительные реакции были вызваны прямоуголь-
мышцы при этой же температуре в контроле.
ными электрическими импульсами частотой
При понижении температуры до 22°С сила со-
0,1 Гц и длительностью 0,5 мс при напряжении 10
кращений мышцы в присутствии АТФ составила
В в течение двух минут. Эти параметры обеспечи-
115,5 ± 5,3% (n = 10) от величины контрольных со-
вали стабильные и воспроизводимые сокращения
кращений при 37°С, что достоверно отличается
в течение трех-четырех часов, что соответствова-
от контрольных значений при 22°С, но не от эф-
ло продолжительности нашего эксперимента.
фекта АТФ при 37°С (рис. 1).
Силу сократительных реакций оценивали в грам-
Инкубация мышцы с сурамином (100 мкМ)
мах и рассчитывали, как разницу в силе сокраще-
полностью предупреждала влияние АТФ на силу
ний до и после электрической стимуляции. Отве-
сокращений при всех температурах (рис. 1).
ты были записаны с использованием изометриче-
ского механического датчика FSG-01 (Linton
Сила сокращения m. soleus при температуре
Instrumentation, Великобритания), захватывали с
(37°С) составила 411,5 ± 28,8 мг (n = 12). При по-
помощью аналого-цифрового преобразователя
нижении температуры окружающей среды сила
MP100WSW (Biopack, США) и отображали и хра-
сокращений мышцы увеличивалась, достигая
БИОФИЗИКА том 64
№ 5
2019
ТЕРМОЧУВСТВИТЕЛЬНОСТЬ ПУРИНЕРГИЧЕСКОЙ МОДУЛЯЦИИ
1005
Рис. 2. Влияние температуры на силу сокращений
Рис. 3. Влияние температуры на силу сокращений
m. soleus мыши, вызванных электрической стимуля-
m. Diafragma мыши, вызванных карбахолином, в от-
цией, в отсутствие и в присутствии АТФ (100 мкМ) и
сутствие и в присутствии АТФ (100 мкМ) и сурамина
сурамина (100 мкМ). Результаты представлены в виде
(100 мкМ). Результаты представлены в виде M ± m в %
M ± m в % от исходных величин, принятых за 100%;
от исходных величин, принятых за 100%; n = 10, * -
n = 10, * - р < 0,05 от эффекта при 37°С, # - р < 0,05
р < 0,05 от эффекта при 37°С, # - р < 0,05 от контроля.
от контроля.
снижалась и составила 291,6 ± 14,3 мг (n = 18) при
497,5 ± 22,4 мг (n = 12) при 22°С (рис. 2). При тем-
22°С (рис. 3).
пературе 37°С АТФ в концентрации 100 мкМ вы-
АТФ в концентрации 100 мкМ при температу-
зывала достоверное увеличение силы сокраще-
ре 37°С вызывала достоверное увеличение силы
ния m. soleus до 112,3 ± 6,8% (n = 12) от силы со-
сокращения m. Diafragma, вызванной карбахоли-
кращений мышцы при этой же температуре в
ном, которая составила 118,7 ± 4,8% (n = 10) от ис-
контроле.
ходных сокращений в контроле.
При понижении температуры до 22°С сила со-
При снижении температуры потенцирующее
кращений мышцы в присутствии АТФ составила
действие АТФ усугублялось и при 22°С составило
139,1 ± 7,3% (n = 12) от величины контрольных со-
110,1 ± 7,0% (рис. 3) от уровня исходных сокраще-
кращений при 37°С, что достоверно отличается
ний в контроле, что достоверно отличается
как от контрольных значений при 22°С, так и от
(р < 0,05) от соответствующих контрольных зна-
эффекта АТФ при 37°С (рис. 2).
чений, но не от эффекта АТФ на этой мышце при
Аппликация сурамином в концентрации
37°С.
100 мкМ полностью предупреждала потенцирую-
Наличие сурамина в инкубационной среде
щее влияние АТФ на силу сокращений при всех
(100 мкМ) предупреждало не только влияние
температурах (рис. 2).
АТФ на мышцу, но и частично ингибиторный
При блокаде холинорецепторов d-тубокурари-
эффект гипотермии на карбахолин-индуциро-
ном в концентрации 10 мкМ сокращения, вы-
ванные сокращения.
званные непрямой стимуляцией, не наблюда-
лись. При повышении напряжения раздражаю-
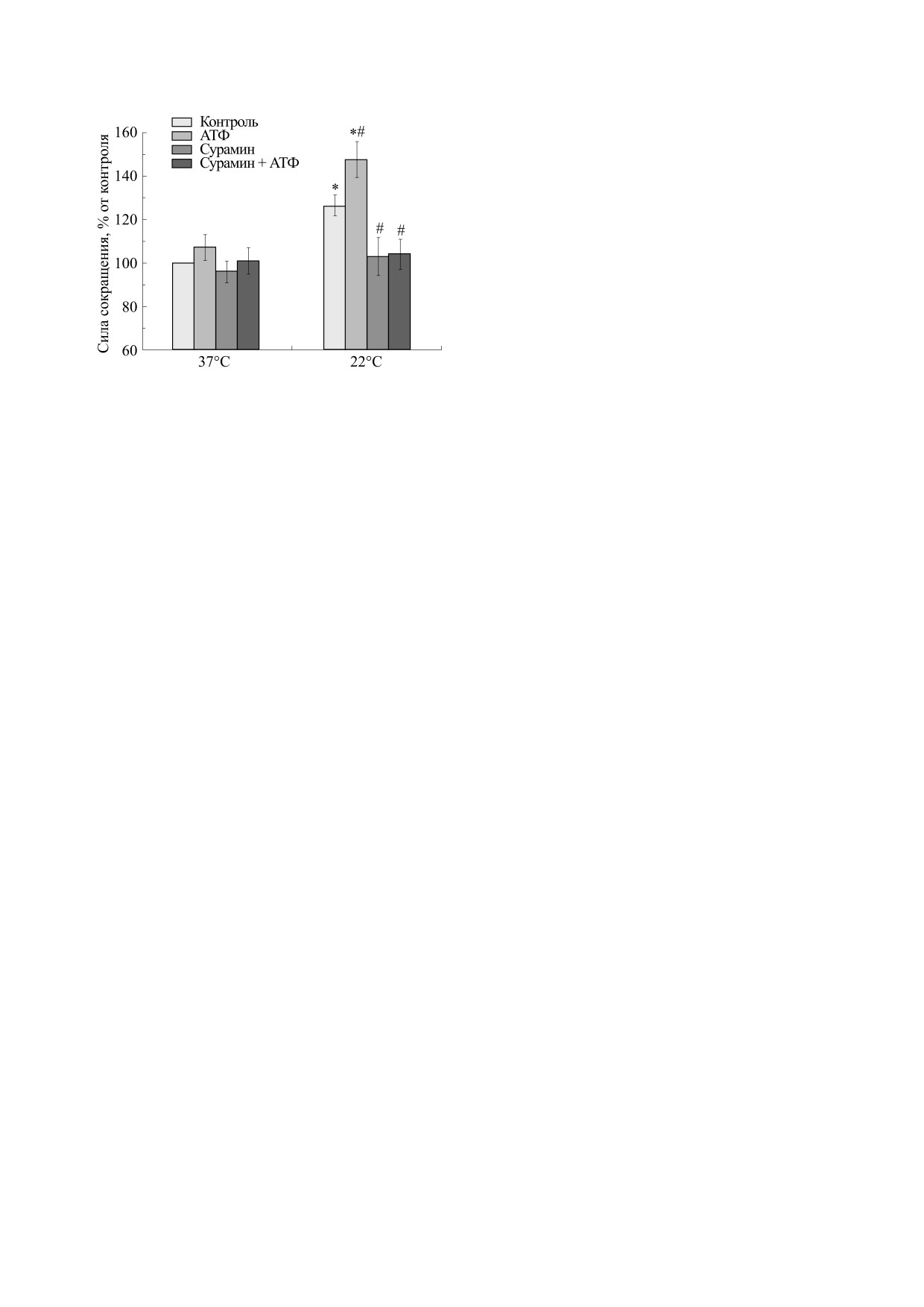
При температуре 37°С сила сокращения m. so-
щих импульсов до 100 В наблюдалась прямая
leus составила 180,5 ± 9,0 мг (n = 10). При пониже-
стимуляция мышечной ткани, при этом добавле-
нии температуры сила сокращения m. soleus уве-
ние 100 мкМ АТФ не оказало эффекта на силу со-
личивалась и составила 228,3 ± 10,9 мг (n = 10)
при 22°С (рис. 4).
кращения исследуемых мышц.
Сокращения, вызванные карбахолином. Пока-
АТФ в концентрации 100 мкМ при температу-
зано, что при 20-минутных интервалах между со-
ре 37°С вызывала незначительное увеличение си-
кращениями карбахолин в концентрации 20 мкМ
лы сокращения m. soleus, вызванной карбахоли-
способен в течение всего времени эксперимента
ном, которая составила 107,2 ± 5,9% (n = 10) от
(два-четыре часа) развивать стабильные воспро-
силы исходных сокращений в контроле.
изводимые сокращения m. Diafragma и m. soleus
При снижении температуры потенцирующее
мыши.
действие АТФ возрaстало и при 22°С составило
При температуре 37°С сила сокращения m. Dia-
147,7 ± 8,3% (рис. 4) от уровня исходных сокраще-
fragma составила 335,2 ± 16,7 мг (n = 10). При пони-
ний в контроле, что достоверно отличается
жении температуры сила сокращения m. Diafragma
(р < 0,05) как от соответствующих контрольных
БИОФИЗИКА том 64
№ 5
2019
1006
ХАЙРУЛЛИН и др.
новных функциональных периодов сокращения
поперечнополосатой мышцы, вызывает ее сокра-
щение за счет непосредственного возбуждения
холинорецепторов поверхностной мембраны мы-
шечного волокна. Такой способ стимуляции поз-
воляет оценить постсинаптические эффекты ис-
следуемых агентов.
Температурная зависимость АТФ-опосредо-
ванных процессов была продемонстрирована ра-
нее на гладкой и скелетной мускулатуре. На
изолированных препаратах мочевого пузыря и
семявыносящих протоков морской свинки со-
кращения в ответ на альфа,бета-метилен-АТФ
(агонист P2X-рецепторов) и в ответ на стимуля-
цию электрическим полем (СЭП) были значи-
тельно более заметными при низких температу-
Рис. 4. Влияние температуры на силу сокращений
рах, чем при физиологической температуре [1].
m. soleus мыши, вызванных карбахолином, в отсут-
ствие и в присутствии АТФ (100 мкМ) и сурамина
Кроме того, СЭП-индуцированное расслабление
(100 мкМ). Результаты представлены в виде M ± m в %
продольного тяжа слепой кишки морской свин-
от исходных величин, принятых за 100%; n = 10, * -
ки, опосредованное P2Y-рецепторами, увеличи-
р < 0,05 от эффекта при 37°С, # - р < 0,05 от контроля.
валось с уменьшением температуры среды [1].
Аналогичные результаты были показаны на изо-
лированных мышечных препаратах лягушки, в
значений, так и от эффекта АТФ на этой мышце
которых АТФ угнетала сокращения, вызванные
при 37°С.
СЭП, более заметно при 17°C, чем при 22°С [11],
Аппликация сурамином в концентрации
что отмечалось нами также и на камбаловидной
100 мкМ полностью предупреждала потенцирую-
мышце крысы [14]. Интересно отметить, что дей-
щее влияние АТФ на силу сокращений при всех
ствие АТФ угнеталось антагонистами P2-рецеп-
температурах
торов, но не антагонистами аденозиновых рецеп-
Наличие сурамина в инкубационной среде
торов, что указывает на вовлечение P2-рецепто-
(100 мкМ) полностью предупреждало не только
ров в опосредовании этих эффектов. Таким
влияние АТФ на мышцу, но и потенцирующий
образом, температурная зависимость P2-рецеп-
эффект гипотермии на карбахолин-индуциро-
тор-опосредованных реакций была показана на
ванные сокращения m. soleus.
трех различных препаратах мышц - гладких
мышцах млекопитающих [1], скелетной мускула-
туре амфибий [11] и скелетных мышцах млекопи-
ОБСУЖДЕНИЕ
тающих [14].
Нами были проведены серии механомиогра-
Во всех трех мышечных тканях мы видим один
фических экспериментов на препаратах локомо-
и тот же результат - эффективность P2-рецептор-
торной (m. soleus) и дыхательной (m. Diafragma)
опосредованных процессов выше при низких
мышцах мыши.
температурах, чем при физиологической темпе-
Одним из возможных подходов, используемых
ратуре. Мы предполагаем, что это свидетельству-
в физиологии и клинической патофизиологии
ет о сходной роли P2-рецепторов в мышечных
мышечных и нервно-мышечных заболеваний,
тканях - они малозаметны или маскируются дру-
является метод стимуляционной изометрической
гими системами регулирования при физиологи-
механомиографии [15]. Применение этого метода
ческих условиях, но их роль становится все более
позволило получить ряд принципиально новых
очевидной и важной при патологических или
данных о роли внешней регуляции в функциони-
экстремальных условиях. Такой характер поведе-
ровании скелетных мышц [16]. Соответственно
ния P2-рецепторов также был показан в некото-
определение участия пуринергических механиз-
рых ранее проведенных исследованиях [17].
мов модуляции возбуждения и сокращения
мышц в изменении их функции указывает на не-
В представленных в настоящей работе иссле-
обходимость изучения сокращения скелетной
дованиях потенцирующие эффекты АТФ сохра-
мышцы, вызванного гуморальным агонистом -
няются на камбаловидной и диафрагмальной
холиномиметиком карбахолином. Этот способ
мышцах и при снижении температуры в режиме
оценки сократительной деятельности мышцы
электровызванных сокращений практически без
имеет определенные преимущества перед тради-
изменения. Они усиливаются только в условиях
ционными, в которых мышца сокращается элек-
карбахолин-вызванных сокращений, что указы-
трическим импульсом, так как, не нарушая ос-
вает на постсинаптическое расположение термо-
БИОФИЗИКА том 64
№ 5
2019
ТЕРМОЧУВСТВИТЕЛЬНОСТЬ ПУРИНЕРГИЧЕСКОЙ МОДУЛЯЦИИ
1007
чувствительного звена пуриновой модуляции.
от площади синаптического образования. В на-
Что характерно, в последнее время накопились
стоящем исследовании отсутствием действия
данные о том, что АТФ в мионевральных синап-
АТФ при прямой стимуляции нами показана ис-
сах теплокровных обладает выраженным постси-
ключительно синаптическая природа наблюдае-
наптическим эффектом, часто отличающимся по
мых эффектов. Таким образом, надо еще внима-
знаку от того эффекта, который она оказывает на
тельней отнестись к тому, что размеры концевой
нервную терминаль [12,13]. Что касается исполь-
пластинки у «медленных» мышечных волокон
зуемых в настоящем исследовании камбаловид-
камбаловидной мышцы мыши протяженнее [38].
ной и диафрагмальной мышц мыши, в их мио-
Мы полагаем, что при изменении температуры
невральных синапсах пре- и постсинаптические
происходит колебание равновесия между АТФ-
эффекты АТФ, видимо, совпадают по вектору,
индуцированной пресинаптической модуляцией
как до этого наблюдалось (с другим знаком) толь-
высвобождения медиатора [7,10-13,39-42], с од-
ко в синапсах быстрой мышцы крысы [18].
ной стороны, и АТФ-зависимым постсинаптиче-
ским изменением чувствительности рецепторов
Как известно, снижение температуры значи-
ацетилхолина [43,44] - с другой стороны.
тельно уменьшает высвобождение ацетилхолина
в нервно-мышечном соединении дыхательной
Известно, что пресинаптический эффект АТФ
мышцы [19]. Аналогично, и в наших предыдущих
на высвобождение нейромедиатора в нервно-мы-
экспериментах на препаратах медленной муску-
шечном соединении опосредован P2Y-рецепто-
латуры амплитуда сокращений диафрагмы мыши
рами [7,10]. Недавними исследованиями было
понижалась при гипотермии, независимо от того,
предположено [13], а затем и доказано [45], что в
вызвано ли это было прямой (карбахолин) или
опосредовании этого эффекта главную роль игра-
непрямой (СЭП) активацией постсинаптических
ют P2Y12-рецепторы.
рецепторов.
Неселективный антагонист Р2-рецепторов -
В представляемых нами в настоящей статье
трипаноцидный препарат сурамин - имеет ши-
данных экспериментов с препаратами медленной
рокий спектр биологической активности [46,47],
мышцей грызунов виден эффект, обратный на-
включая неспецифическое ингибирование P2-
блюдаемым в смешанной скелетной мускулатуре:
рецепторов [48,49] и ингибирование нескольких
амплитуда сокращений повышалась при гипотер-
эктоферментов, разрушающих АТФ [50-52]. В
мии. Существует несколько работ о температур-
диафрагме крысы сурамин конкурентно отменял
ной зависимости сократительного аппарата мед-
действие антидеполяризующих, но не деполяри-
ленных скелетных мышц с противоречивыми
зующих миорелаксантов, не влияя на рецепторы
данными по мышцам одних и тех же животных
АТФ [53]. Другое исследование показало, что су-
[20-23]. Так, по одним источникам температур-
рамин может ингибировать пресинаптические
ная зависимость медленных волокон мышц кры-
кальциевые каналы [54] и угнетать высвобожде-
сы значительно более выражена, чем быстрых
ние медиатора. Таким образом, эффекты сурами-
[24-33], а по другим - температурная чувстви-
на на нервно-мышечную передачу являются
тельность миозина медленных мышечных воло-
очень сложными и, скорее всего, различными в
кон крысы не отличается от быстрых [34,35].
различных типах скелетных мышц. В наших экс-
Поэтому однозначных данных о характере темпе-
периментах (в данном исследовании и в работах
ратурной чувствительности сократимости мед-
[14,18]) он не только противодействовал АТФ-за-
ленных мышечных волокон до нашей работы не
висимому ингибированию СЭП- или карбахо-
было. Наши предыдущие исследования на камба-
лин-индуцированных сокращений быстрой
ловидной мышце и длинном разгибателе пальцев
мышцы как крысы, так и мыши, но и предотвра-
крысы показывали, что термочувствительность и
щал гипотермия-зависимое уменьшение сокра-
быстрых, и медленных мышц выражены почти
тимости - независимо от вида стимуляции. Это
одинаково сильно, но внешне могут быть «скра-
может означать, что так же, как и в других тканях
дены» изменением эффективности пре- и пост-
[55], в скелетных мышцах грызунов существует
синаптической пуриновой модуляции в этих
естественный механизм, с помощью которого Р2-
условиях [14,18].
рецепторы опосредуют увеличение высвобожде-
ния трансмиттера, который становится более за-
Как известно, камбаловидная мышца мыши
метным при низких температурах и который пол-
содержит 50-60% «медленных» мышечных воло-
ностью угнетается сурамином.
кон [36]. Диафрагма мыши, занимающая проме-
жуточное положение, содержит 88,6% быстрого
Мы считаем, что изучение влияния гипотер-
миозина [37]. Обнаруженные нами в результатах
мии на тканях млекопитающих потенциально
представленных исследований эффекты являют-
имеет важное клиническое значение. Переохла-
ся, очевидно, также и следствием различной чув-
ждение широко используется в клинической
ствительности мышечных волокон к карбахоли-
практике [56-62], прежде всего с целью защиты
ну, что может находиться в прямой зависимости
мозга во время хирургических вмешательств или
БИОФИЗИКА том 64
№ 5
2019
1008
ХАЙРУЛЛИН и др.
реанимации больных в критических состояниях.
7.
R. A. Giniatullin and E.M. Sokolova, Br. J. Pharmacol.
Это подчеркивает важность изучения реакции
124, 839 (1998).
других органов и тканей к гипотермии, а особен-
8.
J. A. Ribeiro and A. M. Sebastiao, J. Physiol. 384, 571
но то, что низкие температуры оказывают влия-
(1987).
ние на эффективность рецепторных процессов.
9.
W. M. Fu, J. Physiol. 477 (3), 449 (1994).
Это исследование добавляет важную информа-
10.
E. M. Sokolova, S. N. Grishin, A. V. Shakirzyanova, et
цию об эффективности Р2-рецептор-опосредо-
al., Eur. J. Neurosci. 18, 1254 (2003).
ванных процессов при гипотермии в скелетных
11.
A. U. Ziganshin, R. R. Kamaliev, S. N. Grishin, et al.,
мышцах млекопитающих. Хотя эти результаты
Eur. J. Pharmacol. 509, 187 (2005).
нельзя непосредственно перенести на ткани че-
12.
S. N. Grishin, A. Y. Teplov, A. V. Galkin, et al., Neuro-
ловека, они обеспечивают важное понимание то-
chem. Int. 49, 756 (2006).
го, как активация P2-рецепторов скелетных
13.
S. N. Grishin and A. U. Ziganshin, Biochemistry
мышц человека может вести себя при гипотер-
(Moscow), Suppl. Ser. A: Membrane and Cell Biology
7, 183 (2013).
мии, и позволяют предсказать, как могут быть из-
менены эффекты некоторых лекарств при этом
14.
A. U. Ziganshin, A. E. Khairullin, V. V. Zobov, et al.,
Muscle & Nerve 55 (3), 417 (2017).
нефизиологическом состоянии.
15.
А. Хилл, Механика мышечного сокращения (Мир,
Таким образом, мы установили разнонаправлен-
М., 1972).
ную температурную зависимость контрактильной
16.
Э. И. Богданов и P. P. Фасхутдинов, Журн.
активности локомоторной и дыхательной мышц
неврологии и психиатрии им. Корсакова 91 (2), 129
мыши при сохранении потенцирующего действия
(1991).
АТФ. Особенности модулирующего эффекта АТФ с
17.
G. Burnstock, Keio J. Med. 62, 63 (2013).
преобладанием постсинаптического термочувстви-
18.
A. U. Ziganshin, A. E. Khairullin, A. Y. Teplov, et al.
тельного звена в различных двигательных единицах
Muscle & Nerve 59 (4), 509 (2019).
мыши при гипотермии может лежать в основе адап-
19.
F. F. Foldes, S. Kuze, E. S. Vizi, and A. Deery, J. Neu-
тационных механизмов этого мелкого грызуна.
ral Transm. 43, 27 (1978).
20.
G. Asmussen and G. Maréchal, J. Physiol. 416, 245
(1989).
ФИНАНСИРОВАНИЕ РАБОТЫ
21.
C. J. Barclay, J. K. Constable, and C. L. Gibbs, J.
Работа выполнена при финансовой поддержке
Physiol. 472, 61 (1993).
Российского фонда фундаментальных исследова-
22.
W. J. Leijendekker and G. Elzinga, Pflugers Arch. 416
ний и Правительства Республики Татарстан в
(1-2), 22 (1990).
рамках научного проекта
№ 18-44-160009, а
23.
23. J. S. Petrofsky and A. R. Lind, Pflugers Arch. 389
также средств субсидии, выделенной в рамках го-
(2), 149 (1981).
сударственной поддержки Казанского (При-
24.
24. F. Kössler and G. Küchler, Biomed. Biochim. Acta
волжского) федерального университета в целях
46 (11), 815 (1987).
повышения его конкурентоспособности среди
25.
S. F. Gilliver, D. A. Jones, J. Rittweger, and H. Degens,
ведущих мировых научно-образовательных цен-
J. Comp. Physiol. A Neuroethol. Sens. Neural. Behav.
тров.
Physiol. 197 (4), 311 (2011).
26.
R. A. Binkhorst, L. Hoofd, and A. C. Vissers, J. Appl.
Physiol. Respir. Environ. Exerc. Physiol. 42 (4), 471
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
(1977).
Все применимые международные, националь-
27.
R. Bottinelli, M. Canepari, M. A. Pellegrino, and
ные и институциональные принципы ухода и ис-
C. Reggiani, J. Physiol. 495 (2), 573 (1996).
пользования животных при выполнении работы
28.
A. J. Buller, C. J. Kean, K. W. Ranatunga, and
были соблюдены.
J. M. Smith, J. Physiol. 355, 25 (1984).
29.
R. Candau, B. Iorga, F. Travers, et al., Biophys. J. 85
(5), 3132 (2003).
СПИСОК ЛИТЕРАТУРЫ
30.
A. F. Bennett, Am. J. Physiol. 247 (2), 217 (1984).
1. A. U. Ziganshin, A. V. Rychkov, L. E. Ziganshina, and
31.
J. Gulati, Proc. Natl. Acad. Sci. USA 73 (12), 4693
G. Burnstock, Eur. J. Pharmacol. 456, 107 (2002).
(1976).
2. R. A. North, Physiol. Rev. 82 (4), 1013 (2002).
32.
D. R. Claflin and J. A. Faulkner, J. Physiol. 411, 627
3. V. Ralevic and G. Burnstock, Pharmacol. Rev. 50 (3),
(1989).
413 (1998).
33.
Y. E. Goldman, J. A. McCray, and K. W. Ranatunga, J.
4. T. Forrester, J. Physiol. 224, 6118 (1972).
Physiol. 392, 71 (1987).
5. R. A. Cunha and A. M. Sebastiao, Pflugers Arch. 424
34.
R. Rossi, M. Maffei, R. Bottinelli, and M. Canepari, J.
(5-6), 503 (1993).
Appl. Physiol. 99 (6), 2239 (2005).
6. E. S. Vizi, K. Nitahara, K. Sato, and B. Sperlagh, J. Au-
35.
П. В. Кочубей и C. Ю. Беpшицкий, Биофизика 59
ton. Nerv. Syst. 81 (1-3), 278 (2000).
(5), 967 (2014).
БИОФИЗИКА том 64
№ 5
2019
ТЕРМОЧУВСТВИТЕЛЬНОСТЬ ПУРИНЕРГИЧЕСКОЙ МОДУЛЯЦИИ
1009
36. J. A. Florendo, J. F. Reger, and P. K. Law, Exp. Neurol.
50. E. Marti, C. Canti, I. Gomez de Aranda, et al., Br. J.
82 (2), 404 (1983).
Pharmacol. 118, 1232 (1996).
37. S. Blank, V. Chen, and C. D. Ianuzzo, Respir Physiol.
51. L. Savegnago, C. W. Nogueira, R. Fachinetto, and J. B.
74 (1), 115 (1988).
Rocha, Cell. Biol. Int. 29, 559 (2005).
38. M. A. Fahim, J. A. Holley, and N. Robbins, Neurosci-
52. T. Kiffer-Moreira, M. E. Fernandes Sampaio, D. S. Al-
ence 13 (1), 227 (1984).
viano, et al., FEMS Yeast Res. 10, 735 (2010).
39. S. De Lorenzo, M. Veggetti, S. Muchnik, and
53. R. H. Henning, A. Nelemans, A. H. Scaf, et al., Eur. J.
A. Losavio, Neuroscience 142, 71 (2006).
Pharmacol. 216, 73 (1992).
40. A. I. Malomouzh, E. E. Nikolsky, and F. Vyskocil,
54. R. H. Henning, A. Nelemans, A. H. Scaf, et al., Eur. J.
Neurosci Res. 71, 219 (2011).
Pharmacol. 216, 73 (1992).
41. J. Tomas, M. M. Santafe, N. Garcia, et al., J. Neurosci.
55. A. I. Salgado, R. A. Cunha, and J. A. Ribeiro, Brain
Res. 92, 543 (2014).
Res. 877, 245 (2000).
42. Y. Igusa, J. Physiol. 405, 169 (1988).
56. B. A. Ziganshin and J. A. Elefteriades, Ann. Cardiotho-
43. T. Akasu, K. Hirai, and K. Koketsu, Br. J. Pharmacol.
rac. Surg. 2, 303 (2013).
74, 505 (1981).
57. B. A. Ziganshin, B. G. Rajbanshi, M. Tranquilli, et al.,
44. T. E. Voogd, E. L. Vansterkenburg, J. Wilting, and
J. Thorac. Cardiovasc. Surg. 148, 888 (2014).
L. H. Janssen, Pharmacol. Rev. 45, 177 (1993).
58. P. J. Andrews, H. L. Sinclair, A. Rodriguez, et al., N.
45. A. Giniatullin, A. Petrov, and R. Giniatullin, Neuro-
Engl. J. Med. 373, 2403 (2015).
science 285, 324 (2015).
59. N. Nielsen, J. Wetterslev, T. Cronberg, et al., N. Engl.
46. T. E. Voogd, E. L. Vansterkenburg, J. Wilting, and
J. Med. 369, 2197 (2013).
L. H. Janssen, Pharmacol. Rev. 45,177 (1993).
60. F. W. Moler, F. S. Silverstein, R. Holubkov, et al., N.
47.
47. R. P. McGeary, A. J. Bennett, Q. B. Tran, et al.,
Engl. J. Med. 372, 1898 (2015).
Mini Rev. Med. Chem. 8, 1384 (2008).
61. A. E. Khairullin, A. U. Ziganshin, and S. N. Grishin,
48. C. H. Hoyle, G. E. Knight, and G. Burnstock, Br. J.
Biochemistry (Moscow), Suppl. Ser. A: Membrane and
Pharmacol. 99, 617 (1990).
Cell Biology 11 (1), 1 (2017).
49. G. Lambrecht, K. Braun, M. Damer, et al., Curr.
62. I. M. Vikhlyantsev and Z. A. Podlubnaya, Biophysics
Pharm. Des. 8, 2371 (2002).
53 (6), 592 (2008).
Thermal Sensitivity of Purinergic Modulation of Contractile Activity
of Locomotor and Respiratory Muscles of the Mouse
A.E. Khairullin*, A.Yu. Teplov*, S.N. Grishin*, A.M. Farkhutdinov*, and A.U. Ziganshin* **
*Kazan State Medical University, ul. Butlerova 49, Kazan, 420012 Russia
**Kazan (Volga region) Federal University, ul. Kremlevskaya 18, Kazan, 420008 Russia
Previously, we have shown that hypothermia significantly modulates the effect of ATP on the contractile ac-
tivity of various types of rodent locomotor muscles. The aim of this study was to compare the effects of ATP
on contraction of mouse locomotor (m. soleus) and respiratory (m. Diafragma) muscles at normal and low
temperatures. It is shown that a decrease in the ambient temperature to 22°C is associated with a decrease in
force of contraction (m. Diafragma) induced by electrical stimulation and carbachol as well as with an increase
in the contractile force of m. soleus. The potentiating effects of ATP are preserved in these muscles even if the
temperature is lowered, but they are increased only on carbachol-induced contractions, indicating that a
thermal sensitive link in purine modulation is located postsynaptically. Peculiarities of the modulation of
ATP release with the predominant postsynaptic thermal sensitive link in different motor units of the mouse
in hypothermia may underlie adaptive mechanisms of this small rodent.
Keywords: hypothermia, ATP, P2 receptors, locomotor and respiratory muscles, synapse, suramin
БИОФИЗИКА том 64
№ 5
2019