БИОФИЗИКА, 2019, том 64, № 6, с. 1052-1056
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 576.311.342.6
ВЛИЯНИЕ ВЯЗКОСТИ РАСТВОРОВ ТРЕГАЛОЗЫ
НА ГИДРОЛИЗ АТФ F1-АТФазой ХЛОРОПЛАСТОВ
© 2019 г. Н.С. Новичкова, А.Н. Мальян
Институт фундаментальных проблем биологии РАН - обособленное подразделение ФИЦ ПНЦБИ РАН,
142290, Пущино Московской области, ул. Институтская, 2
E-mail: alexander.malyan@gmail.com
Поcтупила в pедакцию 12.08.2019 г.
Поступила в редакцию 12.08.2019 г.
После доработки 12.08.2019 г.
Принята к публикации 06.09.2019 г.
Исследовано влияние вязкости растворов трегалозы на кинетику гидролиза АТФ CF1-АТФазой (F1-
АТФазой хлоропластов гороха). Включение трегалозы в реакционную среду вызывает двоякий эф-
фект: стимуляцию Mg-зависимой активности фермента при концентрациях до 20 вес. % и подавле-
ние активности - при более высоких. Са2+-зависимая активность CF1 с увеличением концентрации
трегалозы убывает монотонно. Показано, что стимуляция Mg-зависимой активности фермента
обусловлена ослаблением MgАДФ-зависимой инактивации фермента. В условиях, когда инактива-
цией можно пренебречь, увеличение концентрации трегалозы вызывает снижение максимальной
скорости гидролиза АТФ и возрастание кажущейся константы Михаэлиса. Увеличение значения
константы Михаэлиса и снижение активности фермента показывают, что доставка субстратов ре-
акции и конформационные изменения молекулы CF1-АТФазы, сопровождющие гидролиз, тормо-
зятся вязкостью среды, причем чем выше вязкость, тем сильнее ее влияние. Согласно теории Кра-
мерса, потери энергии на взаимодействие со средой позволяют сделать вывод, что энергетическая
эффективность CF1-АТФазы в реакции гилролиза АТФ не достигает 100%.
Ключевые слова: сопрягающий фактор хлоропластов CF1, F1-АТФаза хлоропластов, гидролиз АТФ,
MgАДФ-зависимая инактивация, вязкость.
DOI: 10.1134/S0006302919060024
F1-АТФаза хлоропластов (сопрягающий фак-
АТФазы быстро (~10 мин-1) подавляется в ре-
тор CF1) является экспонированной в строму ка-
зультате образования прочного комплекса
MgAДФ c одним из каталитических центров, со-
талитической частью АТФ-синтазы, ответствен-
провождающегося возрастанием сродства к АТФ
ной за производство энергетической валюты фо-
второго центра и диссоциацией нуклеотида с тре-
тосинтезирующей клетки - АТФ. Подобно F1-
тьего центра [5]. Прочность комплекса и соответ-
АТФазам бактерий и митохондрий она состоит из
ственно его степень инактивации ослабляются в
чередующихся 3α- и 3β-субъединиц, располо-
результате связывания оксианионов и нуклеоти-
женных вокруг двойной спирали γ-субъединицы
дов с «некаталитическими» центрами [6], а также
[1,2], а также одной δ- и одной ε-субъединицы. На
введения в реакционную среду полярных раство-
границах раздела α- и β-субъединиц расположе-
рителей или некоторых детергентов [7,8]. Превра-
ны три каталитических и три регуляторных («не-
щение трех молекул АТФ вызывает вращение γ- и
каталитических») нуклеотидсвязывающих центра
ε-субъединиц относительно α, β-гетеротримера
[3]. Каталитические центры функционируют со-
на 360° [9]. Таким образом, F1-АТФазы могут рас-
гласованно и последовательно: на одном из них
сматриваться как роторные двигатели, преобра-
происходит связывание АТФ, на другом - гидро-
зующие химическую энергию АТФ в механиче-
лиз, а на третьем - диссоциация продуктов реак-
скую энергию вращения γ- и ε-субъединиц. В
ции [4]. В водных растворах CF1-АТФаза прояв-
АТФ-синтазах описанный выше этап дополняет-
ляет Са2+-зависимую активность. Изначально
ся следующим этапом преобразования энергии -
более высокая Mg2+-зависмая активность CF1- превращением энергии вращения γ-, ε- и с-субъ-
единиц в трансмембранный потенциал протонов -
Сокращения: CF
при гидролизе АТФ или же превращением транс-
1 - сопрягающий фактор хлоропластов.
1052
ВЛИЯНИЕ ВЯЗКОСТИ РАСТВОРОВ ТРЕГАЛОЗЫ
1053
мембранного потенциала в энергию вращения -
форд [24]. Фермент освобождали от сульфата ам-
при фотофосфорилировании.
мония и избытка нуклеотидов гель-фильтрацией
на колонке с сефадексом G-50 Fine. Тиоловую ак-
В последние годы интенсивно обсуждается энер-
тивацию проводили инкубацией фермента в при-
гетическая эффективность преобразования энергии
сутствии 50 мМ дитиотреитола в течение 2 ч при
АТР-синтазами и, в частности, F1-АТФазами. Ряд
температуре 20°С. Реакцию проводили в термо-
исследователей утверждают, что энергетическая эф-
статированном сосуде при той же температуре и
фективность достигает 100% [10-12]. Другие авто-
перемешивании магнитной мешалкой в среде
ры, основываясь на деталях механизма вращения γ-,
объемом 0,5 мл, содержащей 50 мМ трицина-
ε- и с-субъединиц, оспаривают это утверждение
KOH, 0,25 мМ MgCl2, 75 мМ K2SO3, 10 об. %
[13-15]. В настоящей работе для оценки эффектив-
ности превращения энергии на этапе гидролиза
C2H5OH, 1,5-3,0 мкг/мл CF1,,MgATФ или Са-
АТФ CF1-АТФазой мы использовали вискозимет-
АТФ и трегалозу. Продолжительность инкубации
(10-20 мин) и концентрацию белка подбирали
рический анализ. Анализ основан на теоретических
таким образом, чтобы превращение АТФ не пре-
подходах Крамерса, который указал на возможные
вышало 10%. В качестве субстрата реакции ис-
потери энергии при конформационных изменениях
белковой молекулы в результате трения со средой
пользовали эквимолекулярную смесь MgCl2 или
[16]. Позднее для качественной оценки этих потерь
СаСl2 и АТФ. Для демаскирования Mg-зависи-
было предложено соотношение, учитывающее воз-
мой АТФазной активности CF1 в среду включали
растание потерь с увеличением вязкости среды:
оптимальные концентрации стимуляторов
-
K2SO3 и этанола [25]. Скорость гидролиза АТФ
k ~ (η/ηо)-n,
(1)
определяли с помощью высокоэффективной
где k - константа скорости реакции, η и ηо - вяз-
жидкостной хроматографии. С этой целью 15 мкл
кость реакционной среды в присутствии и в от-
реакционной среды наносили на колонку DEAE
сутствие вискозогена, 0 < n <1 [17]. Чем больше n,
5PW размерами 0,5 × 7,5 см, уравновешенную
тем сильнее влияние вязкости среды на конфор-
120 мМ NaCl и 80 мМ KH2PO4 (pH 4,0), и опреде-
мационные изменения фермента в ходе реакции.
ляли содержание АДФ и АТФ по площади соот-
В качестве вискозогенов используют такие соеди-
ветствующих пиков. Значения вязкости раство-
нения, как сахароза, глицерин, трегалоза и неко-
ров трегалозы определяли интерполяцией
торые другие [18]. Помимо влияния на актив-
данных [26]. Аппроксимацию получаемых зави-
ность фермента, вискозиметрический анализ
симостей и расчет кинетических параметров ре-
позволяет оценить диффузионное торможение
акции проводили с помощью компьютерной про-
реакции на стадиях связывания субстратов, кото-
граммы Origin 6.
рое приводит к возрастанию кажущейся констан-
ты Михаэлиса (Кm). Возрастание Кm было обна-
ружено в реакции циклического фотофосфори-
РЕЗУЛЬТАТЫ
лирования при введении в реакционную среду
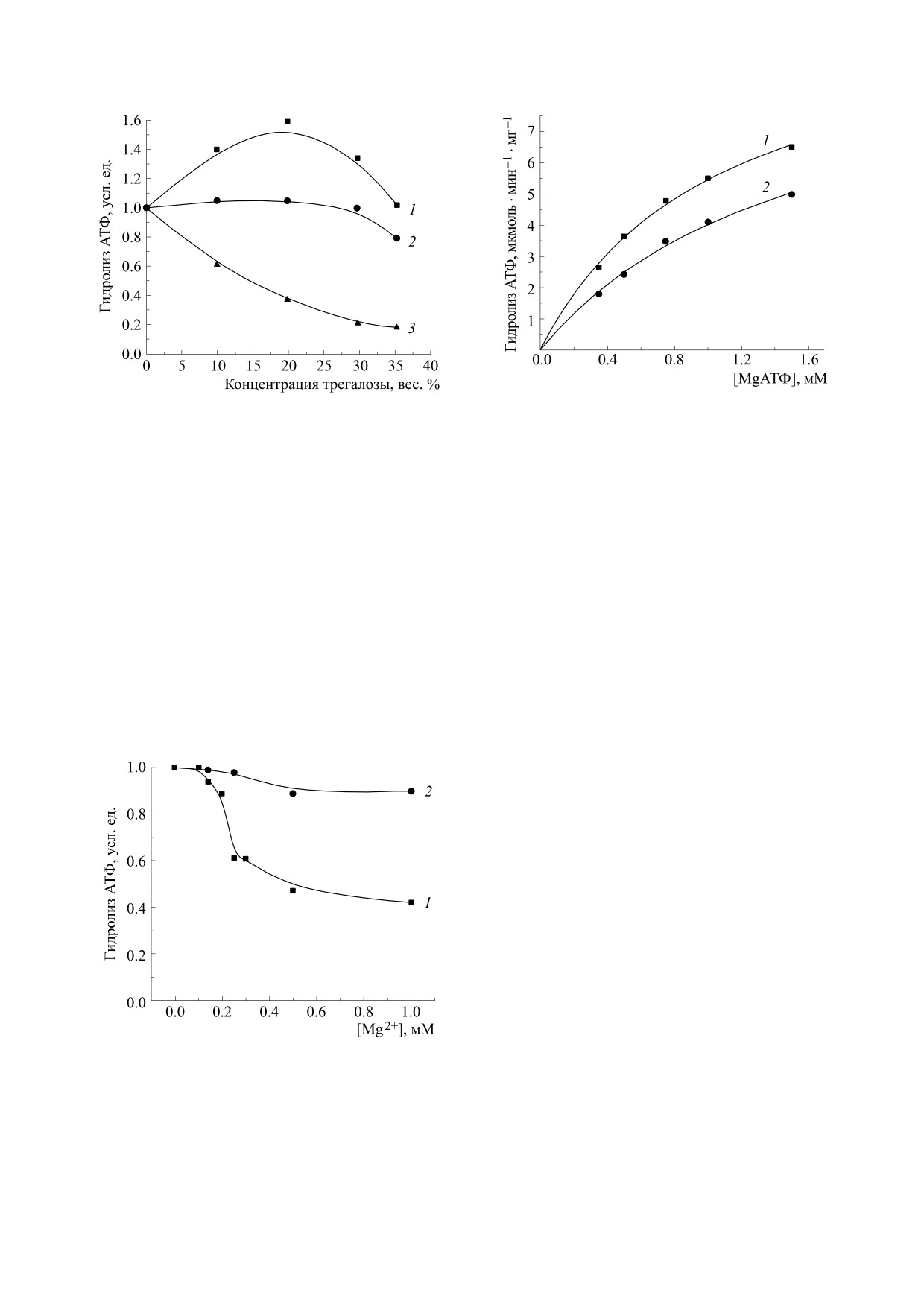
Варьирование концентрации трегалозы про-
полиэтиленгликоля, декстрана или сахарозы [19]
водили в пределах 0-35 вес. %, что соответствова-
и в катализируемой CF1-АТФазой реакции гид-
ло вязкости 1-5 сП [26]. При концентрации
ролиза АТФ в присутствии сахарозы или альбу-
MgАТФ, равной 3,5 мМ, увеличение концентра-
мина. В описываемом ниже исследовании в каче-
ции трегалозы первоначально вызывало возрас-
стве вискозогена мы использовали трегалозу. Из-
тание скорости гидролиза АТФ и только при кон-
вестно, что трегалоза синтезируется различными
центрациях более 20 вес. % скорость реакции
организмами для стабилизации белков и мембран
снижалась (рис. 1, кривая 1). В том же интервале
в стрессовых условиях и быстро гидролизуется по
концентраций трегалозы Са2+-зависимая актив-
окончании стресса [20]. В частности, трегалоза
ность снижалась монотонно (рис. 1, кривая 3).
увеличивает устойчивость растений к действию
Поскольку продукт гидролиза СаАДФ, в отличие
тяжелых металлов, влиянию засухи и засоленно-
от MgАДФ, не вызывает инактивации, можно бы-
сти почвы. Недавно было показано, что трегалоза
ло предположить, что стимулирующее действие
стимулирует выделение кислорода препратами
трегалозы вызвано снижением прочности неак-
фотосистемы II и защищает от фотоингибирова-
тивного комплекса MgАДФ с ферментом, допол-
ния лишенные Mn препараты этой системы
нительно к действию сульфита и этанола (см. вве-
[21,22].
дение). С целью проверки этого предположения
мы сравнили ингибирующее действие ионов маг-
МЕТОДЫ ИССЛЕДОВАНИЯ
ния на Са2+-зависимую активность CF1-АТФазы
Сопрягающий фактор хлоропластов гороха
в присутствии и в отсутствие 20% трегалозы. Как
получали по методу Биндера с соавт. [23]. Кон-
видно на рис. 2, в присутствии трегалозы ингиби-
центрацию белка определяли по методу Бред-
рование магнием снижается, что указывает на
БИОФИЗИКА том 64
№ 6
2019
1054
НОВИЧКОВА, МАЛЬЯН
Рис.
3. Зависимости скорости гидролиза АТФ от
Рис. 1. Влияние концентрации трегалозы на скорость
концентрации MgАТФ в отсутствие (1) и в присутствии
(2) 35% трегалозы.
гидролиза АТФ: 1 - 3,5 мМ MgАТФ; 2 - 0,5 мМ
MgАТФ; 3 - 4 мМ СаАТФ. За единицу принята
скорость реакции, равная 6,5 мкмоль · мин-1 мг-1 (1),
снижаться [27]. В согласии со сделанным предпо-
3,5 мкмоль · мин-1 мг-1 (2) и 0,4 мкмоль · мин-1 мг-1 (3).
ложением при низких концентрациях MgАТФ за-
метной стимуляции гидролиза не наблюдается
ослабление MgАДФ-зависимой инактивации
(рис. 1, кривая 2). Поэтому при определении ки-
фермента. Следует отметить, что выбранные на-
нетических параметров гидролиза АТФ для сни-
ми для преодоления MgАДФ-зависимой инакти-
жения концентрации свободного магния мы
вации концентрации сульфита и этанола являют-
ограничивались концентрацией MgАТФ, равной
ся оптимальными, так как дальнейшее их увели-
1,8 мМ. Зависимости скорости реакции от кон-
чение в случае сульфита ведет к ингибированию,
центрации MgАТФ в отсутствие и в присутствии
а в случае этанола - к необратимой инактивации
35% трегалозы описываются уравнением Миха-
фермента [25]. Расчеты показывают, что при
элиса-Ментен при максимальной скорости ре-
уменьшении концентрации MgАТФ в реакцион-
акции Vmax = 11,3 ± 0,9 мкмоль·мин-1мг-1 и
ной среде концентрации свободного магния, а
следовательно, и концентрации MgАДФ должны
Vmax= 9,3 ± 0,5 мкмоль·мин-1мг-1 соответствен-
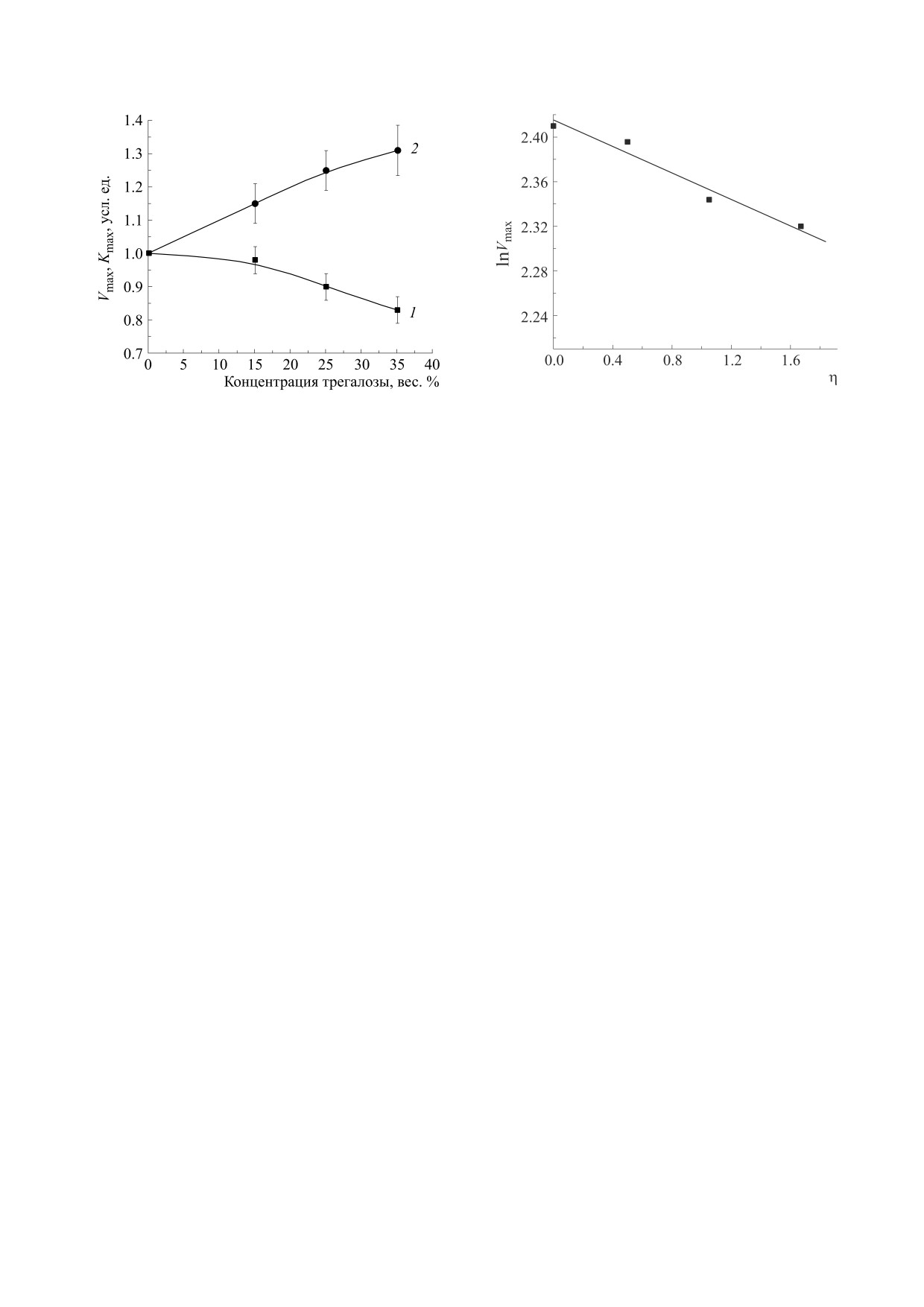
но (рис. 3). Как следует из рис. 4, максимальные
скорости реакции с увеличением концентраций
трегалозы монотонно снижаются, что указывает
на влияние вязкости среды на активность фер-
мента. В координатах «ln Vmax - ln η» эта зависи-
мость описывается соотношением (1) при значе-
нии n = 0,13 (рис. 5). Показанное на рис. 4
(кривая 2) возрастание кажущейся константы
Михаэлиса с увеличением концентрации трега-
лозы указывает на диффузионное торможение
реакции.
ОБСУЖДЕНИЕ
Как показывают результаты исследования,
включение трегалозы в реакционную среду вызы-
вает двоякий эффект: стимуляцию активности
фермента при низких ее концентрациях и подав-
ление активности - при высоких. Эффект стиму-
Рис. 2. Влияние 20 вес. % трегалозы на ингибирование
Са-зависимого гидролиза АТФ ионами Mg2+: 1 - в
ляции трегалозой согласуется с ослаблением ин-
отсутствие трегалозы; 2 - в присутствии 20% трегалозы.
гибирования CF 1-АТФазы MgАДФ. Ранее было
За единицу принята скорость реакции, равная
обнаружено, что аналогичным образом стимули-
0,36 мкмоль · мин-1 мг-1 (1) и 0,11 мкмоль · мин-1 мг-1
(2) при концентрации СаАТФ, равной 4 мМ.
руется Mg-зависимая АТФазная активность CF 1
БИОФИЗИКА том 64
№ 6
2019
ВЛИЯНИЕ ВЯЗКОСТИ РАСТВОРОВ ТРЕГАЛОЗЫ
1055
ln
Рис. 5. Зависимость скорости гидролиза АТФ от вязкости
Рис. 4. Зависимости максимальной скорости гидролиза
реакционной среды в логарифмических координатах.
АТФ (Vmax) и кажущейся константы Михаэлиса (Km) ре-
акции от концентрации трегалозы. За единицу принята
максимальная скорость, равная 11,2 мкмоль · мин-1 мг-1
(1), и константа Михаэлиса, равная 1,03 мМ (2).
митохондрий - органелл, выполняющих ту же
функцию, что и хлоропласты - лишь в три-четы-
ре раза меньше, чем в воде [36]. Многочисленные
при введении в реакционную среду содержащих
данные о вязкостях жидкостей, принадлежащих
ОН-группы соединений - спиртов и флавонолов
другим органеллам, находятся в пределах 2-11 сП
[25,28]. Трегалоза содержит несколько таких
групп, поэтому ее стимулирующий эффект не яв-
[18]. Несмотря на отмеченные противоречия, эти
ляется неожиданным. Он может вызываться вза-
данные указывают, что вязкость стромы хлоро-
имодействием ОН-групп с полярными амино-
пластов существенно выше вязкости воды.
кислотными остатками молекулы фермента. Ана-
Принимая во внимание результаты настояще-
логичным образом, по-видимому, объясняется
более слабо выраженный стимулирующий эф-
го исследования, функционирование CF1-АТФа-
фект сахарозы, обнаруженный ранее [29].
зы со 100%-й эффективностью представляется
Снижение сродства АТФ к ферменту (увеличе-
маловероятным. Формальным показателем этого
ние кажущегося значения Km), так же как и сниже-
служит значение n = 0,13 > 0 в соотношении (1).
ние его активности, показывает, что доставка суб-
Еще более высокое значение n получено при изу-
стратов реакции и конформационные изменения
чении кинетики гидролиза АТФ в растворах саха-
молекулы CF1- АТФазы, сопровождающие гидро-
розы [37]. Представляется, что завышенная оцен-
лиз, тормозятся вязкостью среды, причем чем вы-
ка энергетической эффективности функциони-
ше вязкость, тем ее влияние сильнее. В соответ-
рования F1-АТФаз авторами работы
[12],
ствии с современными представлениями о молеку-
несмотря на методическое совершенство их ис-
лярном механизме функционирования F1-АТФаз,
следования, обусловлена тем, что измерения про-
наиболее выраженные конформационные измене-
водились в условиях термодинамического равно-
ния связаны с вращением γ- и ε-субъединиц, по-
ступательно-возвратным движением С-концевой
весия реакции, т. е. в условиях, когда изменение
части β-субъединицы и, возможно, движением
свободной энергии гидролиза АТФ равно нулю.
С-концевого участка ε-субъединицы [2,30].
Представлялось интересным сопоставить ис-
пользованные в опытах значения вязкости с вяз-
ФИНАНСИРОВАНИЕ РАБОТЫ
костью стромы хлоропластов. Литературные дан-
Работа выполнена в рамках государственного
ные о вязкости стромы весьма противоречивы.
Согласно работе [31], она в 65 раз превышает вяз-
задания №АААА-А17-117030110135-1.
кость воды. Эта величина согласуется с данными
о высокой концентрации белка в строме. Ряд ав-
торов сообщает, что она составляет от 100 до
КОНФЛИКТ ИНТЕРЕСОВ
300 мг/мл при содержании свободных белков
около 40% от общего количества [32-35]. С дру-
Авторы заявляют об отсутствии конфликта
гой стороны, коэффициент диффузии матрикса
интересов.
БИОФИЗИКА том 64
№ 6
2019
1056
НОВИЧКОВА, МАЛЬЯН
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
18. E. O. Puchkov, Biochemistry (Moscow), Suppl. ser. A:
Membrane and Cell Biology 7, 270 (2013).
Настоящая работа не содержит описания ка-
19. И. М. Карташев, В. К. Опанасенко и А. Н. Мальян,
ких-либо исследований с использованием людей
Биофизика 60, 481 (2015).
и животных в качестве объектов.
20. J. E. Lunn, I. Delorge, C. M. Figueroa, et al., Plant J.
79, 544 (2014).
21. М. Д. Мамедов, И. О. Петрова, Д. В. Яныкин и др.,
СПИСОК ЛИТЕРАТУРЫ
Биохимия 80, 79 (2015).
1. M. Nakanishi-Matsui, M. Sekiya, and M. Futai, Bio-
22. D. V Yanykin, A. A. Khorobrykh, M. D. Mamedov and
chim. Biophys. Acta 1857 (2016) 129.
V. V. Klimov, J. Photochem. Photobiol. B: Biol. 164,
2. A. Hahn, J. Vonck, D. J. Mills, et al., Science 360
236 (2016). DOI: 10.1016/j.jphotobiol.2016.09.027.
(6389), eaat4318 (2018).
23. A. Binder, A. Jagendorf, and E. Ngo, J. Biol. Chem.
3. J. P. Abrahams, A. G. W. Leslie, R. Lutter, and J. E.
253, 3094 (1978).
Walker, Nature 370, 621 (1994).
24. M. M. Bradford, Anal. Biochem. 72, 248 (1976).
4. P. D. Boyer, J. Biol. Chem. 277, 39045 (2002).
25. A. N. Malyan, Photosynthetica 15, 474 (1981).
5. А. Н. Мальян и О. И. Вицева, Биохимия 48, 718
26. W. C. Parker, N. Chakraborty, R. Vrikkis, et al., Optic
(1983).
Express 18, 16607 (2010).
6. A. N. Malyan and W. S. Allison, Biochim. Biophys. Ac-
27. А. Н. Мальян и А. Д. Макаров, Биохимия 41, 1087
ta 1554, 153 (2002).
(1976).
7. А. Н. Мальян, Биохимия 45, 1731 (1980).
28. А. Н. Мальян, Е. А. Акулова и Е. Н. Музафаров,
8. U. Pick and S. Bassilian, Biochemistry 21, 6144 (1982).
Биоорган. химия 3, 639 (1977).
9. H. Noji, R. Yasuda, and K. Kinosita, Nature 386, 299
29. A. N. Malyan, Photosynth. Res. 128, 163 (2016).
(1997).
30. I. Yamato, Y. Kakinuma, and T. Murata, Biophys.
10. H. Itoh, A. Takahashi, K. Adachi, et al., Nature 427,
Physicobiol. 13, 37 (2016).
465 (2004).
31. K. Asada, in Photosynhesis and the Environment, Ed. by
11. S. Toyabe, T. Watanabe-Nakayama, T. Okamoto,
N. R. Baker (Kluwer Acad. Publ., Dordrecht-Boston-
et al., Proc. Natl. Acad. Sci. USA 108, 17951 (2011).
London, 2004), pp. 123-150.
12. N. Soga, K. Kimura, K. Kinosita, Jr., et al., Proc. Natl.
32. F. Menke and G. Menke, Protoplasma 46, 536 (1956).
Acad. Sci. USA 114 (19), 4960 (2017).
33. J. T. O. Kirk, The plastids. Their Chemistry, Structure,
13. J. L. Martin, R. Ishmukhametov, T. Hornung, et al.,
Growth and Inheritance (London-San Francisco,
Proc. Nat. Acad. Sci. USA 111, 3715 (2014).
1967).
14. B. Chapman and D. Loiselle, R. Soc. Open Sci. 3,
34. R. J. Ellis, Trends Biochem. Sci. 4, 241 (1979).
150379 (2016).
35. R. O. Wayne, Plant Cell Biology: from astronomy to zo-
15. O. Kulish, A. D.Wright, and E. M. Terentjev, Sci. Rep.
ology (Elsevier, 2009).
6, 28180 (2016).
36. A. S. Verkman, Trends Biochem. Sci. 27, 27 (2002).
16. H. A. Kramers, Phisica 7, 284 (1940).
37. A. N. Malyan, Photosynthetica 56, 1365 (2018).
17. A. E. Sitnitsky, Biophys. Struc. Mech. 4, 37 (2010).
Effect of Trehalose Solution Viscosity on ATP Hydrolysis by Chloroplast F1-ATPase
N.S. Novichkova, and A.N. Malyan
Institute of Basic Biological Problems, Russian Academy of Sciences,
ul. Institutskaya 2, Pushchino, Moscow Region, 142290 Russia
The effect of trehalose solution viscosity on ATP hydrolysis kinetics by CF1-ATPase (pea chloroplast F1-AT-
Pase) was studied. Trehalose added to the reaction mixture had a double effect: Mg-dependent enzyme ac-
tivity was stimulated when the trehalose content was less than 20% and suppressed at higher trehalose levels.
Ca-dependent activity of CF1 decreases monotonically with increasing trehalose content. It was shown that
stimulation of the Mg-dependent enzyme activity was a result of diminution of MgADP-dependent enzyme
inactivation. In case of negligible inactivation, the elevated trehalose content caused a decrease in the maxi-
mum rate of ATP hydrolysis and the value of the apparent Michaelis constant increased. Changes in the value
of Michaelis constant and in the enzyme activity indicate that the delivery of reaction substrates and hydro-
lysis-accompanying conformational changes in CF1-ATPase are hampered by medium viscosity. According
to Cramer’s rule, energy loss via interaction with the medium, it can be concluded that the efficiency of en-
ergy conversion by CF1-ATPase never reaches 100%.
Keywords: chloroplast coupling factor CF1, chloroplast F1-ATPase, ATP hydrolysis, MgADP-dependent inactiva-
tion, viscosity
БИОФИЗИКА том 64
№ 6
2019