БИОФИЗИКА, 2019, том 64, № 6, с. 1107-1114
БИОФИЗИКА КЛЕТКИ
УДК 577.352.2
ПОЛУЧЕНИЕ УПОРЯДОЧЕННЫХ СТРУКТУР БАКТЕРИАЛЬНЫХ
ПОРИНОВ В ЛИПИДНОМ БИСЛОЕ И ИССЛЕДОВАНИЕ ИХ
МОРФОЛОГИИ МЕТОДОМ АТОМНО-СИЛОВОЙ МИКРОСКОПИИ
© 2019 г. Г.А. Набережных, А.А. Карпенко*, В.А. Хоменко, Т.Ф. Соловьёва, О.Д. Новикова
Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН,
690022, Владивосток, просп. 100 лет Владивостоку, 159
E-mail: naber1953@mail.ru
*Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН,
690041, Владивосток,ул. Пальчевского, 17
E-mail: alex_karp@list.ru
Поступила в редакцию 02.08.2019 г.
После доработки 02.08.2019 г.
Принята к публикации 06.09.2019 г.
Формирование упорядоченных наноструктур порина OmpF из наружной мембраны Yersinia pseudo-
tuberculosis проводили двумя методами: из протеолипосом и прямой реконструкцией белка в пред-
варительно нанесенный на поверхность слюды фосфолипидный бислой. Морфологию полученных
структур анализировали с помощью атомно-силовой микроскопии. Показано, что эффективность
формирования, степень однородности и размер доменов порина существенным образом зависят от
условий эксперимента и присутствия липополисахарида в образцах порина или в бислое. Обнару-
жено, что при использовании протеолипосом на поверхности слюды образуются агрегаты нанодо-
менов порина, имеющих неравномерное распределение в бислое и большой разброс в диаметре
(50-250 нм). При прямой реконструкции порина показано, что снижение рН солюбилизирующего
буфера способствует включению достаточно большого количества белка в виде однородных доме-
нов со средним размером 35-40 нм, однако не приводит к формированию в бислое протяженных
наноструктурных участков. Наиболее эффективное встраивание порина в липидный бислой с обра-
зованием кластеров из плотно упакованных доменов белка было достигнуто при использовании об-
разца порина в комплексе с пептидогликаном и липополисахаридом, с которыми этот белок тесно
связан в нативной бактериальной мембране.
Ключевые слова: порин, липополисахарид, фосфолипидный бислой, наноструктура, атомно-силовая
микроскопия.
DOI: 10.1134/S0006302919060097
ского назначения, векторы направленной достав-
В последние годы наметился значительный
прогресс в использовании наноматериалов для
ки лекарств, нативные или искусственно скон-
струированные химические и биологические сен-
создания биосенсоров, в том числе с использова-
соры. Тем не менее, несмотря на преимущества
нием белковых структур [1,2]. В настоящее время
белковых наноструктур и успешные примеры их
при создании биологических нанопор все чаще
рассматриваются интегральные мемранные бел-
создания, одним из постоянных ограничений яв-
ки, имеющие прочную бета-баррельную структу-
ляется отсутствие методологии для получения
жесткой белковой «арматуры», которая сохраняет
ру. Основные преимущества использования бел-
ковых нанопор - знание их точной структуры
свою функциональность в широком спектре
при атомном разрешении, возможность внедрять
условий окружающей среды.
функциональные группы на стратегических по-
Одними из перспективных кандидатов для
зициях внутри канала. Подобные структуры на-
конструирования биологических нанопор явля-
ходят широкое применение в нанобиотехнологии
ются каналы неспецифических поринов наруж-
и наномедицине [3]. К ним относятся биогенные
ной мембраны грамотрицательных бактерий,
наночастицы терапевтического или диагностиче-
обеспечивающих транспорт низкомолекулярных
Сокращения: ЛПС - липополисахарид, АСМ - атомно-
веществ через наружную мембрану. Порины при-
силовая микроскопия, ОГ - β-D-октилглюкозид.
надлежат к бета-баррельным интегральным мем-
1107
1108
НАБЕРЕЖНЫХ и др.
бранным белкам, образующим в нативной мем-
держащий ЛПС. Дальнейшую его очистку прово-
бране олигомерные структуры (чаще всего триме-
дили гель-фильтрацией в присутствии 1%-го рас-
ры). Они состоят из антипараллельных
твора неионного детергента β-D-октилглюкозида
амфифильных бета-стрендов (тяжей), гидрофоб-
(ОГ) в трис-HCl-буфере (0,03 М, рН 7,5). В ре-
ные остатки аминокислот которых экспонирова-
зультате был получен образец
«порин-ОГ»,
ны в липидный бислой, а гидрофильные - во
cодержащий порин в тримерной форме и гомо-
внутреннюю часть барреля [4]. Амфифильная
генный по данным электрофореза в полиакрила-
природа молекул поринов позволяет им легко
мидном геле в присутствии додецилсульфата на-
встраиваться в липидный бислой [5]. В присут-
трия.
ствии фосфолипидов порины в результате белок-
Получение больших моноламелярных липосом,
белкового взаимодействия могут самопроизволь-
нагруженных карбоксифлуоресцеином. Для полу-
но формировать наноструктуры [6]. Такой метод
чения отрицательно заряженных липосом смесь,
самоорганизации двух- и трехмерных структур из
состоящую из 30 мг лецитина, 12,5 мг холестерина
наноразмерных составляющих рассматривается
и 1,8 мг дицетилфосфата, растворяли в 0,3 мл хло-
как простой и экономически выгодный способ
роформа, упаривали и высушивали в вакууме в
получения наноматериалов. Выбор детергента и
течение 3 ч. Остаток растворяли в 0,3 мл диэтило-
липида имеет большое значение для получения
вого эфира, добавляли 50 мкл воды и 50 мкл 0,2 М
двумерных кристаллов порообразующих белков,
раствора сульфородамина Б в 0,1 М Na2CO3.
при этом химическая структура указанных ком-
Смесь встряхивали, обрабатывали в ультразвуко-
понентов определяет параметры упорядоченных
вой бане (Elmi, Латвия) в течение 10 мин при 5°С
белковых структур [7,8].
и упаривали в вакууме до полного удаления эфи-
Целью данной работы явилась разработка под-
ра. Для удаления несвязавшегося сульфородами-
ходов к получению на основе OmpF-порина из
на Б суспензию липосом отмывали 0,03 М трис-
наружной мембраны Yersinia pseudotuberculosis
цитратным буфером с рН 5,5 или 8,0, осаждая
упорядоченных наноразмерных структур, а также
центрифугированием при 25000 g, а затем суспен-
выяснению роли отдельных компонентов бакте-
дировали в соответствующем буфере. Для получе-
риальной мембраны, липополисахарида (ЛПС) и
ния однородных по размерам липосом обе пор-
пептидогликана в качестве векторов самосборки
ции обрабатывали в ультразвуковой бане (Elmi,
в липидном бислое на твердой поверхности.
Латвия) в течение 10 мин при 5°С и десять раз
Сравнительное исследование морфологии нано-
пропускали через поликарбонатный фильтр с
структур, полученных в разных условиях, было
диаметром пор 200 нм (Nucleopore, США). Кон-
проведено с помощью атомно-силовой микро-
троль за размерами липосом осуществляли мето-
скопии (АСМ). Полученные результаты предпо-
дом динамического светорассеяния с использо-
лагается использовать при создании биоматриц
ванием прибора ZetaSizer Nano ZS (Malvern, Ве-
на основе поринов, потенциально пригодных для
ликобритания) при температуре
25°С, при
создания комплексных неорганических нано-
фиксированном угле рассеяния 173° и длине вол-
структурных композиций различного назначе-
ны лазера 633 нм.
ния.
Регистрация изменения проницаемости липосо-
мальной мембраны. Для определения порообразу-
МАТЕРИАЛЫ И МЕТОДЫ
ющей активности исследуемого белка регистри-
ровали изменение проницаемости липосомаль-
Культивирование бактерий. В работе использо-
ной мембраны. Вначале определяли фоновую
вали штамм Н-557 Y. pseudotuberculosis 0:1В серо-
флуоресценцию, добавляя 50 мкл суспензии ли-
вара. Культивирование микроорганизмов прово-
посом к 120 мкл 0,03 М трис-цитратного буфера с
дили при 4°С на питательном бульоне (Махачка-
рН 5,5 или 8,0. Затем к полученной суспензии ли-
ла, Россия) в колбах объемом 1 л с интенсивной
посом добавляли 20 мкл раствора порина, выдер-
аэрацией в течение 5 суток.
жанного в течение 5 ч в соответствующем буфере,
Выделение порина и его комплексов с пептидо-
и фиксировали изменение флуоресценции в тече-
гликаном. Комплекс пептидогликан-порин по-
ние 30 мин. Для определения максимальной флу-
лучали экстракцией бактериальных клеток ион-
оресценции при полном лизисе к суспензии ли-
ным детергентом додецилсульфатом натрия по
посом добавляли
100 мкл раствора
10%-го
методу Розенбуша [9]. Количество ЛПС в полу-
раствора додецилсульфата натрия. Процент спе-
ченном образце определяли по методу, описан-
цифического освобождения маркера (СОМ) рас-
ному в работе [10]. Изолированный порин, содер-
считывали по формуле:
жащий примесь ЛПС, получали по методу, опи-
санному в работе [11]. Для очистки белка от ЛПС
%СОМ = Fэксп - Fфон/Fmax - Fфон × 100%,
использовали обработку 30%-м раствором доде-
где Fэксп - флуоресценция после добавления бел-
цилсульфата натрия, как описано в работе [12]. В
результате был получен образец порина, не со-
ка, Fmax - флуоресценция после полного лизиса
БИОФИЗИКА том 64
№ 6
2019
ПОЛУЧЕНИЕ УПОРЯДОЧЕННЫХ СТРУКТУР БАКТЕРИАЛЬНЫХ ПОРИНОВ
1109
липосом, Fфон - флуоресценция без добавления
пида дидодецилфосфатидилхолина. Выбор дан-
белка.
ного фосфолипида был обусловлен тем, что, со-
гласно литературным данным, толщина гидро-
Получение образцов для исследований методом
фобной части липидного бислоя, полученного из
атомно-силовой микроскопии. Протеолипосомы
этого фосфолипида сопоставима с высотой бета-
получали методом длительного диализа (48 ч)
барреля поринов наружной мембраны [16], что
смеси раствора образца «порин-ОГ» (1 мг/мл) и
обеспечивает максимальную эффективность при
синтетического фосфолипида дидодецилфосфа-
реконструкции мембранных белков [17]. Второй
тидилхолина в соотношении 1:1000 (в/в) против
подход заключался в предварительном формиро-
трис-НCl-буфера (0,03 М, рН 7,5) [13]. Суспен-
вании на поверхности слюды поддерживающего
зию протеолипосом, отмытых от несвязавшегося
липидного бислоя, последующего встраивания
белка, наносили на свежесколотую пластинку
молекул порина в растворе детергента в бислой и
слюды размером 10×10 мм.
отмывки поверхности образца буфером без детер-
Формирование на слюде поддерживающего
гента [14].
липидного бислоя из дидодецилфосфатидилхо-
лина и последующую реконструкцию образцов
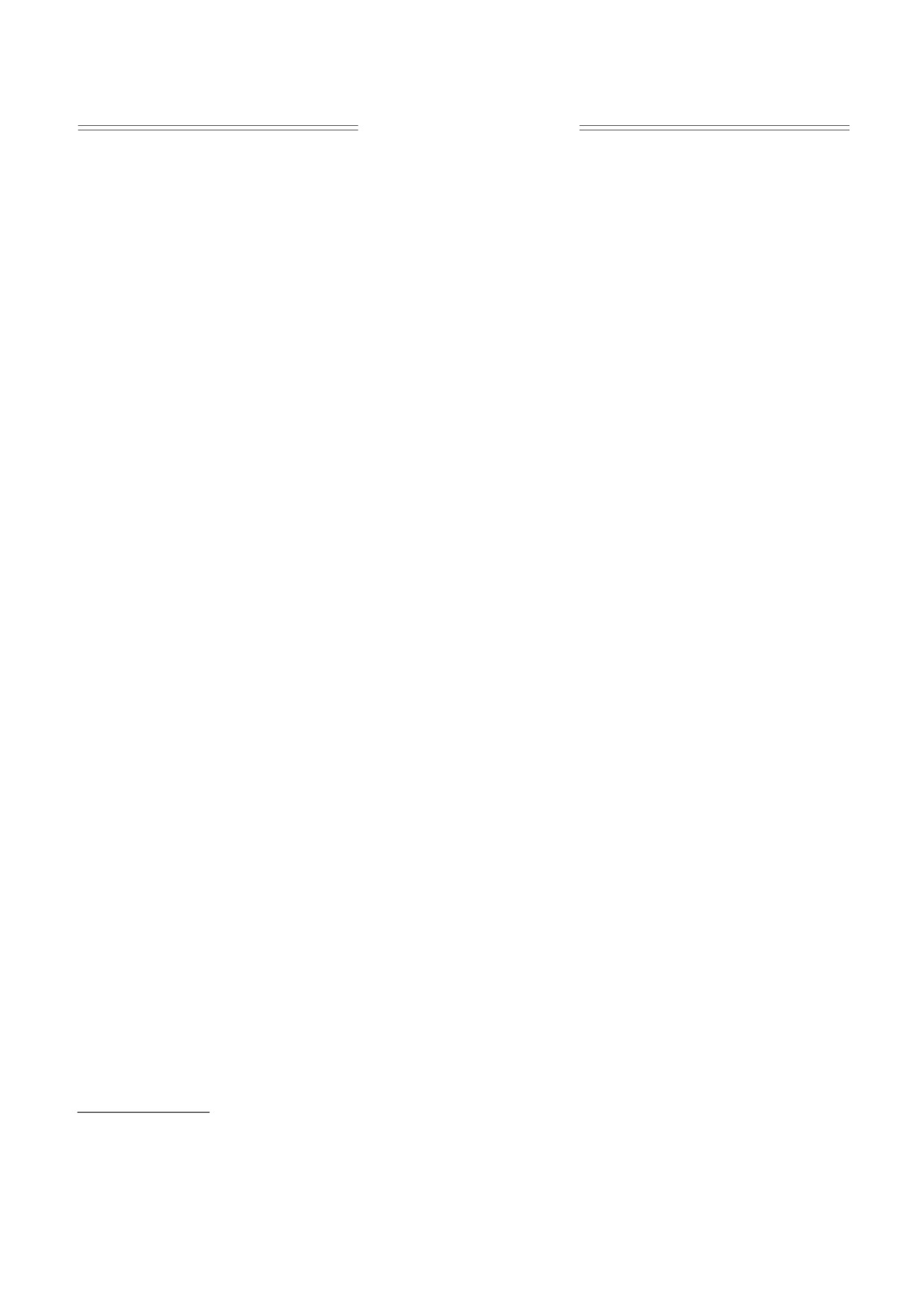
Как видно из рис. 1а, нанокластеры порина,
«порин-ОГ» и «пептидогликан-порин» в присут-
полученные по первому методу, имеют высокую
ствии 0,3 мМ неионного детергента додецил-
степень агрегации и значительный разброс в диа-
мальтозида осуществляли по методу [14]. При
метре (50-250 нм). Согласно шкале интенсивно-
включении образца «порин-ОГ» на предвари-
сти окраски, приведенной на рис.1а, агрегаты
тельно сформированный бислой использовали
белка выступают на 14-28 нм над липидным мат-
два варианта. В первом случае 50 мкл порина (100
риксом. Они неравномерно включены в фосфо-
мкг/мл) в трис-HCl-буфере (0,03 М, рН 7,5) ре-
липидный слой, образованный при взаимодей-
конструировали в бислой, не содержащий ЛПС.
ствия липида протеолипосом с плоской подлож-
В втором случае на липидный бислой наслаивали
кой. Большое различие в размерах наблюдаемых
50 мкл ЛПС (100 мкг/мл) из E. coli 055 (Sigma,
нанокластеров, скорее всего, обусловлено тем,
США), отмывали от несвязавшегося ЛПС, а за-
что они являются результатом спонтанной агре-
тем вводили белок в ацетатном буфере (0,05 М,
гации молекул белка в процессе длительного диа-
рН 5,5). Образец «пептидогликан-порин», сус-
лиза смеси «порин-детергент-фосфолипид» при
пендированный в ацетатном буфере (0,05 М,
получении протеолипосом. Следует отметить,
рН 5,5), наносили на предварительно сформиро-
что при сканировании поверхности этого образца
ванный на слюде липидный бислой, не содержа-
в полуконтактном режиме съемки наблюдалось
щий ЛПС.
значительное смещение АСМ-изображения (по-
Атомно-силовая микроскопия. Изображения
казано в нижней части рис. 1а), что свидетель-
препаратов порина, нанесенных на свежесколотую
ствует о подвижности агрегатов белка в составе
пластинку слюды, получали с помощью атомно-
бислоя, образованного при слиянии протеолипо-
силового микроскопа Bioscope Catalist (Bruker,
сом.
США) в контактном режиме в буфере, используя
Предварительное формирование поддержива-
оригинальную разработку фирмы Bruker в режиме
ющего фосфолипидного бислоя путем слияния
Scan Asyst mode. В эксперименте использовали
липосом на слюде обеспечивает достаточно пол-
кантилевер ScanAsyst-Fluid (k ~ 0,7 Н/м, радиус на-
ное покрытие ее поверхности. Тем не менее в
конечника < 10 нм), предназначенный для работы
правой части рис. 1б можно обнаружить светлую
в жидкой среде. Прижимное усилие к объекту вы-
область, по-видимому соответствующую «несли-
ставляли в пределах 120 пН. Наноструктурную ор-
тым» липосомам. Как видно на рис. 1в, высота
ганизацию порина в полученных образцах анали-
липидного слоя составляет 4-6 нм, что коррели-
зировали по методике [13].
рует с толщиной бислоя фосфолипидов. Более
темные участки на трехмерном изображении мо-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
гут соответствовать частично удаленному бис-
лою, который может быть дестабилизирован рас-
Неионный детергент ОГ был выбран для со-
твором детергента на стадии включения белка.
любилизации порина из Y. pseudotuberculosis, по-
скольку ранее было показано, что в растворе ОГ
Таким образом, при использовании прямого
белок имеет пространственную структуру, макси-
метода реконструкции порина в предварительно
мально приближенную к его структуре в натив-
сформированный поддерживающий фосфоли-
ной мембране [15]. Для получения на поверхно-
пидный слой не происходит образования протя-
сти слюды упорядоченных наноструктур из об-
женных участков 2D-кристаллов белка, заметны
разца «порин-ОГ» мы использовали два подхода.
только единичные включения. Предположитель-
Первый метод был основан на получении протео-
но, это может происходить по двум причинам.
липосом из солюбилизированного в детергенте
Во-первых, образцы порина были солюбилизи-
порина в присутствии синтетического фосфоли-
рованы в буфере со значением рН, близком к ней-
БИОФИЗИКА том 64
№ 6
2019
1110
НАБЕРЕЖНЫХ и др.
тральному (рН 7,5), и, возможно, эти условия не
являются оптимальными для эффективной ре-
конструкции порина в липидный бислой. Во-вто-
рых, в опыте были использованы высокоочищен-
ные образцы белка, не содержащие примесей
других компонентов наружной мембраны, преж-
де всего ЛПС. Как известно, в нативной мембра-
не порины существуют в виде комплексов с ЛПС,
эти два основных компонента бактериальной
мембраны связаны между собой прочной, но не-
ковалентной связью. В литературе имеются дан-
ные о том, что взаимодействие между ЛПС и по-
рином играет существенную роль при сборке бел-
ка в наружной мембране бактериальной клетки в
процессе биосинтеза [18]. Кроме того, показано,
что присутствие ЛПС значительно влияет на эф-
фективность встраивания порина в липидный
бислой [5]. Что же касается рН буферного раство-
ра, ранее нами было показано, что изменение рН
среды существенным образом влияет на конфор-
мацию молекулы порина из Y. pseudotuberculosis,
на его способность к самопроизвольной рекон-
струкции в бислой и соответственно на проявле-
ние его функциональной активности [19].
В связи с вышесказанным, следующий этап
исследования был посвящен определению опти-
мальных условий встраивания образца порина в
липидный бислой. Для этого мы использовали
метод вытекания флуоресцентной метки из отри-
цательно заряженных липосом при включении
белка. Концентрация флуорофора сульфорода-
мина Б внутри липосом в исходной суспензии
превышала концентрацию его самотушения. Об-
разование пор в липосомальной мембране при
добавлении образца порина сопровождалось вы-
теканием флуорофора сульфородамина Б во
внешний раствор и соответственно заметным
увеличением интенсивности его флуоресценции.
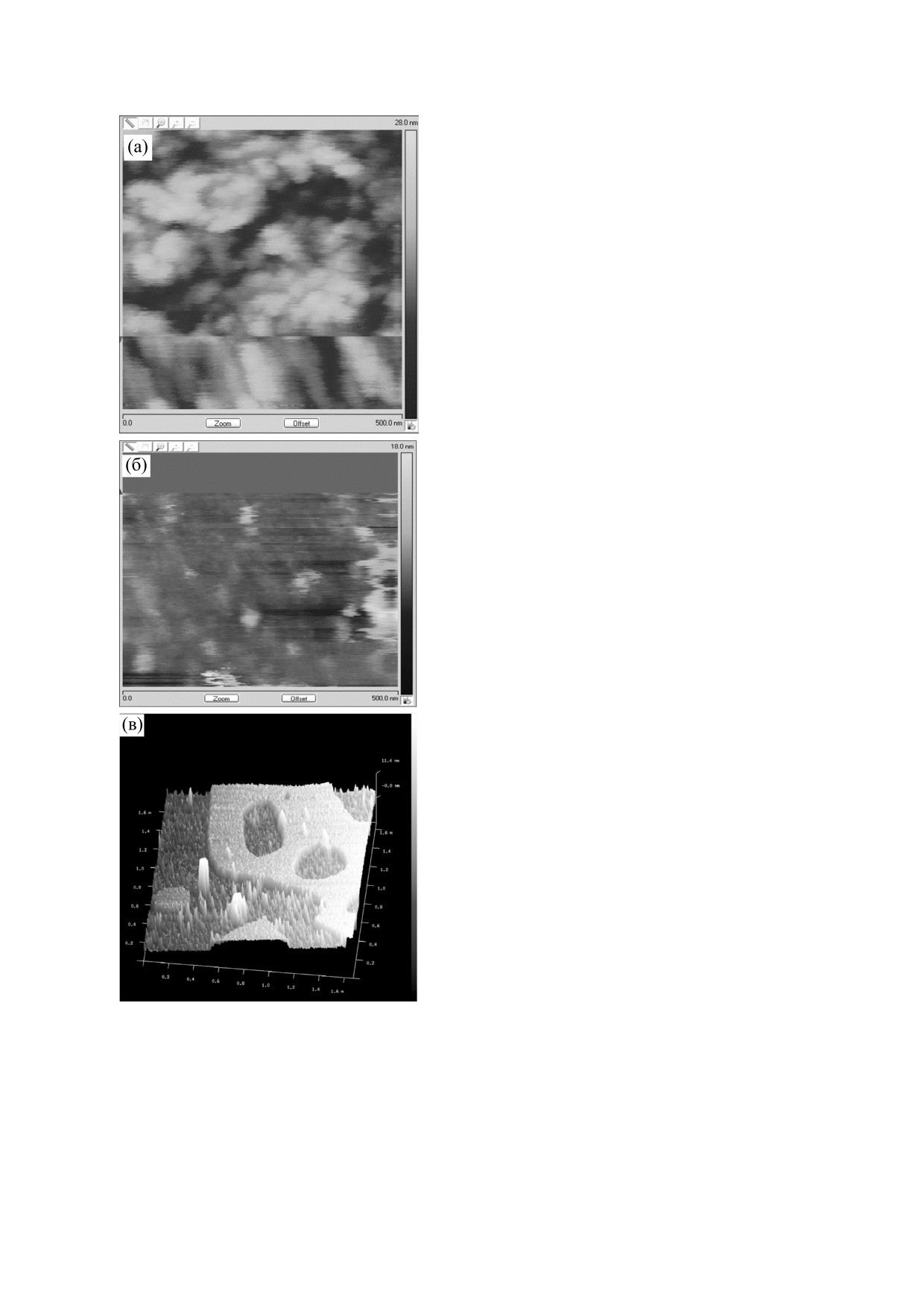
Липосомы, полученные из лецитина, холесте-
рина и дицетилфосфата, оказались достаточно
стабильны к действию буфера, содержащего ОГ, в
котором был солюбилизирован порин. Как сле-
дует из данных на рис. 2, графики выхода сульфо-
родамина Б из липосом при встраивании порина
в буферах с кислым и слабощелочным значения-
ми рН существенно отличаются. Наиболее эф-
фективное встраивание порина наблюдалось при
рН раствора, равном 5,5. Принимая во внимание
полученные данные, для последующих экспери-
ментов были использованы образцы белка, солю-
билизированные в кислом буферном растворе, а
именно в ацетатном буфере с рН 5,5.
Рис. 1. АСМ-изображения наноструктур образца по-
Для экспериментальной проверки влияния
рина-ОГ, полученных в результате нанесения протео-
ЛПС на формирование упорядоченных структур
липосом на слюду (а), включения белка в поддержива-
порина из Y. pseudotuberculosis были задействова-
ющий фосфолипидный бислой, предварительно
ны два образца белка, отличающихся содержани-
сформированный на слюде (б) и его трехмерное изоб-
ражение (в). Сканирование образцов проводили в
ем ЛПС: (1) изолированный порин, не содержа-
0,03 М трис-HCl-буфере, рН 7,5.
щий ЛПС («порин-ОГ»); (2) комплекс «пептидо-
БИОФИЗИКА том 64
№ 6
2019
ПОЛУЧЕНИЕ УПОРЯДОЧЕННЫХ СТРУКТУР БАКТЕРИАЛЬНЫХ ПОРИНОВ
1111
Рис. 2. Кинетика освобождения сульфородамина Б из отрицательно заряженных липосом при добавлении образца
«порин-ОГ» при различных значениях рН буферного раствора: кривая 1 - рН 5,5, кривая 2 - рН 8,0. Ось ординат -
специфическое освобождение сульфородамина Б.
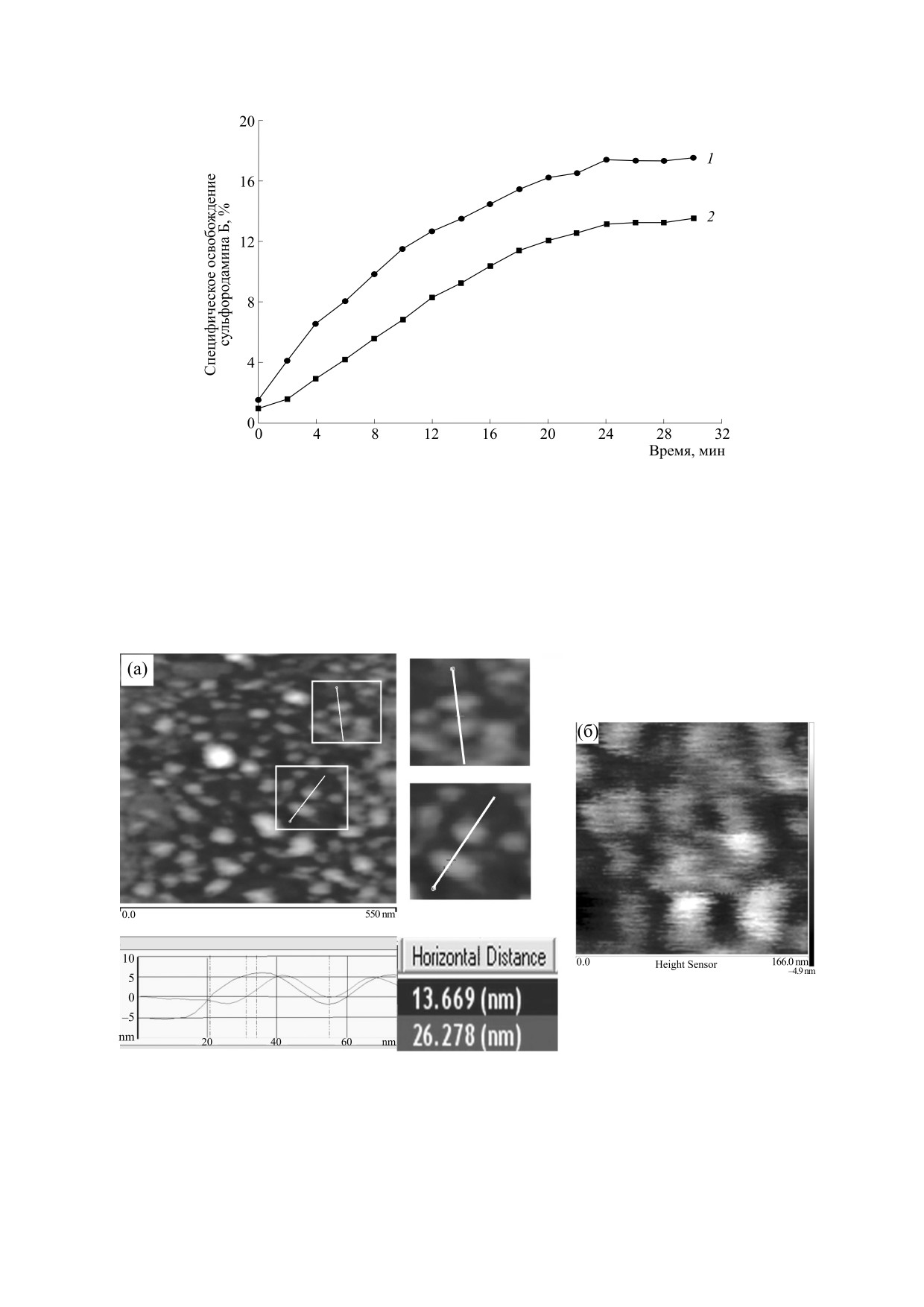
гликан-порин» с содержанием ЛПС 8-10%. В
Как видно из данных на рис. 3, в этих условиях
первом случае (рис. 3) образец «порин-ОГ» вно-
(в присутствии ЛПС и в слабокислой среде) коли-
сили в предварительно сформированный на слю-
чество включенного порина в бислой значитель-
де липидный бислой с включенным в него ЛПС.
но увеличивается по сравнению с реконструкци-
Рис. 3. АСМ-изображение образца «порин-ОГ» в поддерживающем фосфолипидном слое, содержащем ЛПС, при
разных масштабах: 0,5 мкм (а) и 0,16 мкм (б). В нижней части рисунка (а) приведены профили поверхности образца вдоль
линий в рамках, использованные для расчета среднего диаметра частиц. Высоту доменов, выступающих над
поверхностью бислоя, определяли по шкале цветности справа от рисунка (б). Сканирование образцов проводили в 0,05
М ацетатном буфере, рН 5,5.
БИОФИЗИКА том 64
№ 6
2019
1112
НАБЕРЕЖНЫХ и др.
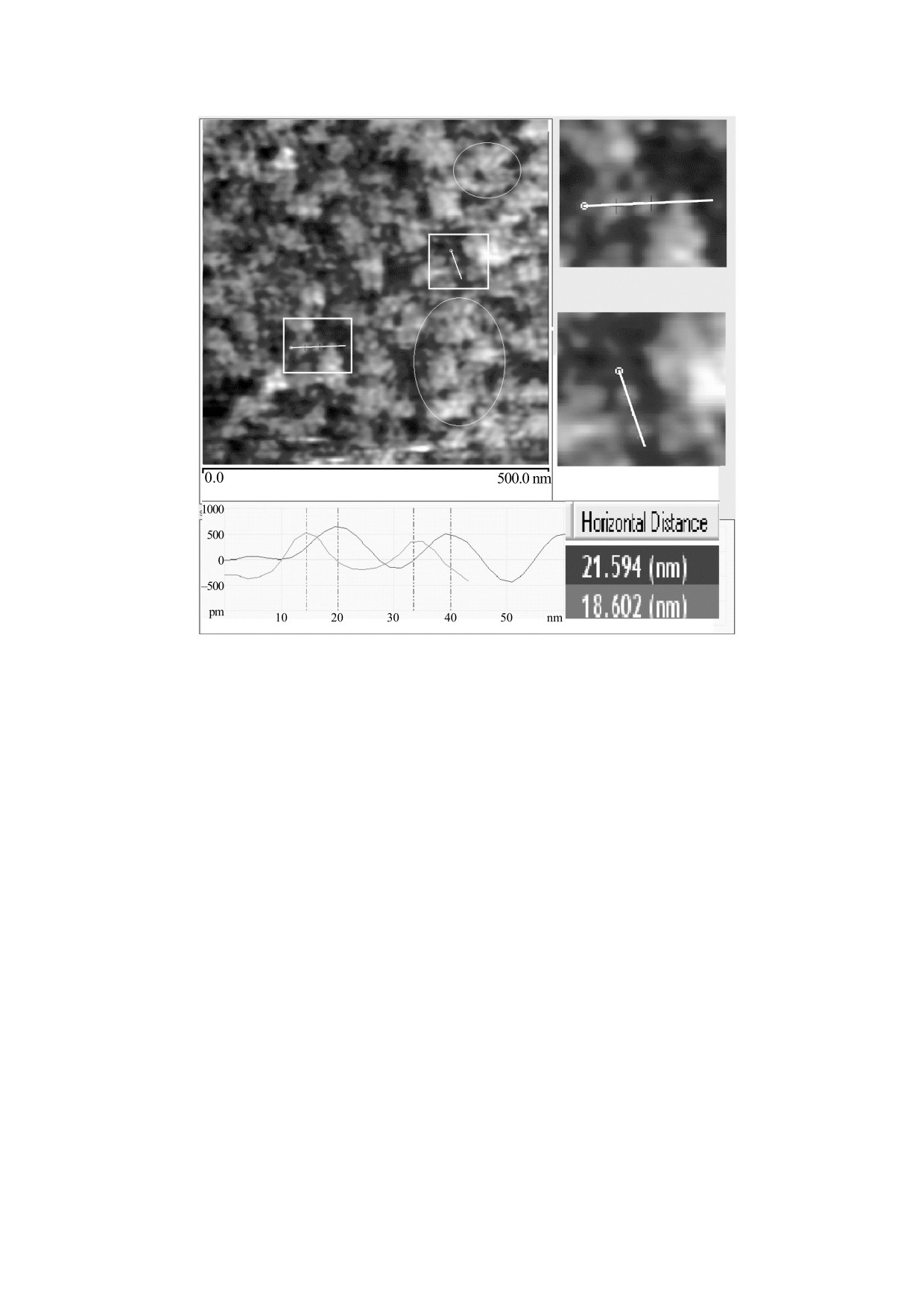
Рис. 4. АСМ-изображение комплекса «пептидогликан-порин» в предварительно сформированном липидном бислое,
не содержащем ЛПС. Эллипсами выделены кластеры порина, состоящие из доменов белка. Внизу показан профиль
поверхности образца вдоль линий в квадратных рамках, использованных для расчета средних размеров доменов порина.
ей белка в слабощелочной среде. На поверхности
жестким «каркасом» бактериальной мембраны,
бислоя обнаруживаются регулярно расположен-
мы предполагали, что при встраивании образца
ные домены порина со средним диаметром 35-40
пептидогликан-порин в бислой могут быть полу-
нм и высотой 6-10 нм.
чены максимально упорядоченные однородные
кластеры белка на поверхности слюды.
Во втором случае (рис. 4) в бислой не вводили
ЛПС, поскольку по данным работы [10] в составе
Как видно из данных на рис. 4, поверхность
используемого нами комплекса
«пептидогли-
образца
«пептидогликан-порин» в липидном
кан-порин» содержится не более 10% ЛПС, что
бислое представляет собой достаточно протяжен-
согласуется с литературными данными, получен-
ные участки, состоящие из набора близких по
ными для комплекса пептидогликан-порин из
размеру (порядка 80 нм) розеткообразных класте-
E. coli [9]. Количество порина в комплексе с пеп-
ров (выделены эллипсами). Однако протяжен-
тидогликаном более чем в четыре раза превосхо-
ность и плотность упаковки этих наноструктур-
дит содержание пептидогликана [9], при этом бе-
ных образований на разных участках поверхности
лок сохраняет все связи с пептидогликаном и
бислоя различаются. Указанные кластеры пред-
ЛПС. Вследствие этого пространственная орга-
ставляют собой скопление отдельных доменов.
низация молекулы порина максимально соответ-
Их латеральные размеры были оценены на при-
ствует его нативной конформации в мембране.
мере наиболее типичных минимальных деталей
Об этом свидетельствует высокая функциональ-
ная активность у такого комплекса, выявленная
полученного АСМ-изображения (выделены
нами ранее с помощью метода бислойных липид-
квадратными рамками). Расстояния между мини-
ных мембран [20]. Учитывая этот факт и то, что
мумами на графике профиля линейного сканиро-
пептидогликан, связанный с порином, является
вания равны в среднем 20 нм. Мы предполагаем,
БИОФИЗИКА том 64
№ 6
2019
ПОЛУЧЕНИЕ УПОРЯДОЧЕННЫХ СТРУКТУР БАКТЕРИАЛЬНЫХ ПОРИНОВ
1113
что эта величина соответствует размеру домена
КОНФЛИКТ ИНТЕРЕСОВ
встроенного в бислой белка. Такое предположе-
Авторы заявляют об отсутствии конфликта
ние основано на том, что молекула порина, со-
интересов.
стоящая из трех субъединиц, имеет латеральный
размер 7-8 нм, определенный с помощью АСМ
[21]. Учитывая это, можно предположить, что
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
указанные домены порина имеют в своем составе
Настоящая работа не содержит описания ка-
не одну молекулу тримеров порина, что вполне
ких-либо исследований с использованием людей
коррелирует с литературными данными. Cоглас-
и животных в качестве объектов.
но современным представлениям в нативной
мембране порин может существовать в виде гек-
СПИСОК ЛИТЕРАТУРЫ
са- и наномеров [22]. С другой стороны, видимое
увеличение размеров домена порина может про-
1.
H. Wang, T.-S. Chung, Y. W. Tong, et al., Small 8 (8),
исходитиь за счет известного эффекта латераль-
1185 (2012).
ного уширения, связанного с конечным радиусом
2.
M. Bieligmeyer, F. Artukovic, S. Nussberger, et al.,
Beilstein J. Nanotechnol. 7, 881 (2016).
кривизны кантилевера.
3.
Н. В. Медведева, О. М. Ипатова, Ю. Д. Иванов и
Таким образом, в результате проведенных ис-
др., Биомед. химия 52 (6), 529 (2006).
следований апробированы различные подходы к
4.
G. E. Schulz, Biochim. Biophys. Acta 1565 (2), 308
формированию упорядоченных наноструктур
(2002).
OmpF-порина из наружной мембраны Y. pseudo-
5.
A. Wiese, G. Schroder, K. Brandenburg, et al., Bio-
tuberculosis в присутствии фосфолипидного бис-
chim. Biophys. Acta 1190 (2), 231 (1994).
лоя. Анализ морфологии полученных АСМ-изоб-
6.
D. J. Muller and A. Engel, Curr. Opin. Colloid Inter-
ражений показал, что изолированные порины
face Sci. 13 (5), 338 (2008).
способны самопроизвольно встраиваться в фос-
7.
L. Hasler, J. B. Heymann, A. Engel, et al., J. Struct. Bi-
фолипидный бислой с образованием нанодоме-
ol. 121, 162 (1998).
нов. При этом степень эффективности и размер
8.
Б. Глик и Д. Пастернак, Молекулярная биотехноло-
доменов поринов существенным образом зависят
гия: принципы и применение. (Мир, М., 2002).
от условий эксперимента. Обнаружено, что сни-
9.
J. P. Rosenbusch, J. Biol. Chem. 249 (24), 8019 (1974).
жение рН раствора способствует увеличению
10.
T. I. Burtseva, L. I. Glebko, and Yu. S. Ovodov, Analyt.
числа встроенных в бислой доменов белка. Пока-
Biochem. 64 (1), 1 (1975).
зано, что эффективным вектором для встраива-
11.
О. Д. Новикова, Т. И. Вакорина, В. А. Хоменко и
ния порина при кислых значениях рН является
др., Биохимия 73 (2), 173 (2008).
ЛПС. Второй компонент наружной бактериаль-
12.
J. C. Todt, W. J. Roque, and E. J. McGroarty, Bio-
ной мембраны, пептидогликан, с которым порин
chemistry 31 (43), 10471, (1992).
связан в нативном состоянии, наибольшим обра-
13.
F. A. Schabert and А. Engel, Biophis. J. 67 (6), 2394
зом способствует образованию протяженных
(1994).
упорядоченных доменов белка.
14.
P.-E. Milhiet, F. Gubellin, A. Berquand, et al., Bio-
phys. J. 91 (9), 3268 (2006).
Следует отметить также, что комплекс пепти-
15.
О. П. Вострикова, Н. Ю. Ким, Г. Н. Лихацкая и др.
догликан-порин обогащен порином и не содер-
Биоорган. химия 32 (4), 371 (2006).
жит других мембранных белков, поскольку в про-
16.
J. H. Kleinschmidt and L. K. Tamm, J. Mol. Biol. 324
цессе его получения происходит практически
(2), 319 (2002).
полная очистка от других белков, входящих в со-
17.
J. H. Kleinschmidt, Chem. Phys. Lipids 141 (1-2), 30
став наружной бактериальной мембраны [9]. В
(2006).
связи с этим описанный в работе подход может
18.
K. Sen and H. Nikaido, J. Bacteriol. 173 (2), 926
оказаться достаточно перспективным для полу-
(1991).
чения наноструктур на основе функционально
19.
О. Д. Новикова, Н. Ю. Ким, П. А. Лукьянов и др.,
активных мембранных белков по сравнению с ис-
Биол. мембраны 24 (2), 159 (2007).
пользованием в качестве матрицы целых бакте-
20.
О. П. Вострикова, Г. Н. Лихацкая, О. Д. Новикова
риальных клеток [23].
и др., Биол. мембраны 17 (4), 399 (2000).
21.
S. Jaroslavski, K. Duquesne, J. N. Sturgis, et al., Mol.
Microbiol. Biochem. J. 74 (5), 1211 (2009).
ФИНАНСИРОВАНИЕ РАБОТЫ
22.
H. Nikaido, Microbiol. Mol. Biol. Rev. 676 (4), 593
Работа выполнена при финансовой поддержке
(2003).
Российского фонда фундаментальных исследова-
23.
M. W. Ullah, Z. Shi, X. Shi, et al., ACS Sustainable
ний (проект № 19-03-00318).
Chem. Eng. 5 (12), 11163 (2017).
БИОФИЗИКА том 64
№ 6
2019
1114
НАБЕРЕЖНЫХ и др.
The formation of Ordered Structures of Bacterial Porins in a Lipid Bilayer
and Analysis of Their Morphology by Atomic Force Microscopy
G.A. Naberezhnykh*, A.A. Karpenko**, V.A. Khomenko*, T.F Solov’eva*, and O.D. Novikova*
*G.B. Elyakov Pacific Institute of Bioorganic Chemistry, Far Eastern Branch of the Russian Academy of Sciences,
prosp. 100 Let Vladivostoku 159, Vladivostok, 690022 Russia
**A.V. Zhirmunsky National Scientific Center of Marine Biology, Far Eastern Branch of the Russian Academy
of Sciences,Vladivostok, ul. Palchevskogo 17, Vladivostok, 690041 Russia
The formation of ordered nanostructures of outer membrane porin from Yersinia pseudotuberculosis
(YpOmpF) was carried out in two ways: from the proteoliposomes and by direct protein reconstitution in the
pre-deposited phospholipid bilayer on the mica surface. Morphological analysis of structures obtained was
performed using atomic force microscopy. It was shown that the efficiency of the formation, the degree of
homogeneity, and the size of porin domains substantially depend on the experimental conditions and the
presence of lipopolysaccharide in porin sample or in a bilayer. It was found that when proteoliposomes are
used, aggregates of porin nanodomains, which are unevenly distributed throughout the bilayer and of very
different size ranges (50-250 nm) are formed on the mica surface. With direct reconstruction of porin, it was
shown that a decrease in the pH of the solubilizing buffer promotes the inclusion of a sufficiently large
amount of protein in the form of homogeneous domains with an average size of 35-40 nm, but does not lead
to the formation of extended nanostructured regions in the bilayer. The most efficient incorporation of porin
into the lipid bilayer with the formation of clusters from tightly packed protein domains was achieved using a
porin sample in combination with peptidoglycan and lipopolysaccharide, to which this protein is closely re-
lated in the native bacterial membrane.
Key words: porin, lipopolysaccharide, phospholipid bilayer, nanostructure, atomic force microscopy
БИОФИЗИКА том 64
№ 6
2019