БИОФИЗИКА, 2019, том 64, № 6, с. 1115-1123
БИОФИЗИКА КЛЕТКИ
УДК 577.352.4
СРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ ЭФФЕКТОВ ПАЛЬМИТИНОВОЙ
И ω-ГИДРОКСИПАЛЬМИТИНОВОЙ КИСЛОТ КАК ИНДУКТОРОВ
Ca2+-ЗАВИСИМОЙ ПЕРМЕАБИЛИЗАЦИИ МИТОХОНДРИЙ ПЕЧЕНИ
И ЛЕЦИТИНОВЫХ ЛИПОСОМ
© 2019 г. М.В. Дубинин*, В.Н. Самарцев*, А.Е. Степанова*, А.А. Семенова*,
Е.И. Хорошавина*, К.Н. Белослудцев*, **
*Марийский государственный университет, 424000, Йошкар-Ола, площадь Ленина, 1
**Институт теоретической и экспериментальной биофизики РАН, 142290 Пущино, Институтская ул., 3
E-mail: dubinin1989@gmail.com
Поступила в редакцию 09.07.2019 г.
После доработки 09.07.2019 г.
Принята к публикации 003.09.2019 г.
На энергизованных путем окисления сукцината изолированных митохондриях печени крыс и леци-
тиновых липосомах исследовано действие ω-гидроксипальмитиновой кислоты как индуктора Ca2+-
зависимой пермеабилизации мембран. Такие Сa2+-зависимые эффекты ω-гидроксипальмитино-
вой кислоты на митохондрии и липосомы сравнены с аналогичными хорошо изученными эффек-
тами пальмитиновой кислоты. Установлено, что в присутствии циклоспорина А ω-гидроксипаль-
митиновая кислота вызывает существенно более интенсивное набухание митохондрий, чем паль-
митиновая кислота и, таким образом, является более эффективным индуктором Ca2+-зависимой
циклоспорин А-нечувствительной пермеабилизации внутренней мембраны органелл. Вместе с тем
ω-гидроксипальмитиновая кислота как индуктор Са2+-зависимого выхода сульфородамина Б из
липосом значительно уступает в эффективности пальмитиновой кислоте. Показано, что в отличие
от пальмитиновой кислоты, действие ω-гидроксипальмитиновой кислоты как индуктора Ca2+-за-
висимой поры в митохондриях печени полностью блокируется неорганическим фосфатом в при-
сутствии циклоспорина А. Выяснено, что в этом случае неорганический фосфат не может быть за-
менен близким по свойству проникающим анионом - ванадатом. Полученные данные рассматри-
ваются как свидетельство того, что ω-гидроксипальмитиновая и пальмитиновая кислоты как ин-
дукторы Са2+-зависимой пермеабилизации митохондрий печени существенно отличаются по
механизму действия. Если Са2+-зависимый эффект пальмитиновой кислоты можно рассматривать
как формирование липидной поры, то Са2+-зависимый эффект ω-гидроксипальмитиновой кисло-
ты в присутствии неорганического фосфата - формирование циклоспорин А-чувствительной ми-
тохондриальной поры. Обсуждается действие неорганического фосфата как блокатора индуцируе-
мой ω-гидроксипальмитиновой кислотой Са2+-зависимой циклоспорин А-чувствительной поры в
митохондриях печени.
Ключевые слова: митохондриальная пора, ω-гидроксипальмитиновая кислота, пальмитиновая кисло-
та, циклоспорин А, ионы кальция, неорганический фосфат.
DOI: 10.1134/S0006302919060103
генных белков: цитохрома c, индуцирующего
Одним из связанных с митохондриями звеньев
апоптоз фактора, эндонуклеазы G и др. [1, 2].
в сложном механизме гибели клеток является ин-
дукция кальций-зависимой неспецифической
Известны различные гипотезы о механизме
проницаемости внутренней мембраны - форми-
формирования митохондриальной поры. В на-
рование митохондриальных пор. Это в свою оче-
стоящее время широкое распространение полу-
редь приводит к нарушению энергетических
чила гипотеза о том, что основной структурной
функций митохондрий, прежде всего синтеза
единицей митохондриальной поры является
АТФ, а также к выходу из межмембранного про-
FОF1-АТФ-синтаза, другие белки митохондрий:
странства в цитоплазму так называемых апопто-
АДФ/АТФ-антипортер, переносчик фосфата,
Сокращения: ЦсА - циклоспорин А, ГПК - ω-гидрокси-
циклофилин D выступают в качестве белковых
пальмитиновая .
модуляторов поры [2-6]. Циклоспорин А (ЦсА),
1115
1116
ДУБИНИН и др.
специфический блокатор такой «классической»
ствительной пермеабилизацией внутренней мем-
поры, связываясь на внутренней поверхности
браны [19].
внутренней мембраны с циклофилином D, сни-
Остается неизвестным механизм действия
жает чувствительность митохондрий к Са2+ как к
ГПК как индуктора Сa2+-зависимой пермеабили-
индуктору поры [1-8]. Эффективным физиоло-
зации внутренней мембраны митохондрий. Не-
гическим модулятором поры является неоргани-
обходимы дальнейшие исследования Сa2+-зави-
ческий фосфат (Pi) . Хорошо установлено, что Pi,
симых эффектов ГПК как на изолированных ми-
так же как и его химические аналоги арсенат и ва-
тохондриях печени, так и на липосомах. При
надат, повышает чувствительность митохондрий
проведении исследований такие Сa2+-зависимые
к Са2+ как к индуктору поры [9]. Наряду с этим Pi
эффекты ГПК на митохондрии и липосомы целе-
усиливает эффект ЦсА как блокатора поры [9]. В
сообразно сравнить с аналогичными хорошо изу-
последнем случае Pi не может быть заменен близ-
ченными эффектами пальмитиновой кислоты от
кими по свойствам проникающими анионaми ар-
которой ГПК отличается только наличием гид-
сенатом и ванадатом [9]. Было предположено су-
роксильной группы в ω-положении. Полученные
данные рассматриваются как свидетельство того,
ществование на внутренней поверхности внут-
что ГПК и пальмитиновая кислота, как индукто-
ренней мембраны регуляторного сайта, связыва-
ние с которым Pi сопровождается ингибировани-
ры Са2+-зависимой пермеабилизации митохон-
дрий печени, существенно отличаются по меха-
ем поры и который в отсутствие ЦсА замаскиро-
ван циклофилином D [9].
низму действия. Если Са2+-зависимый эффект
пальмитиновой кислоты можно рассматривать
Одними из эффективных индукторов Ca2+-за-
как формирование липидной поры, то Са2+-зави-
висимой поры в митохондриях животных явля-
симый эффект ГПК в присутствии Pi - как фор-
ются свободные монокарбоновые жирные
мирование «классической» ЦсА-чувствительной
кислоты [10-13]. Известно, что индукция Ca2+-
поры.
зависимой неспецифической проницаемости
внутренней мембраны митохондрий пальмити-
новой и другими насыщенными жирными кисло-
МАТЕРИАЛЫ И МЕТОДЫ
тами не подавляется ЦсА [11-13]. Установлено,
Митохондрии из печени белых половозрелых
что такие жирные кислоты в присутствии Са2+
крыс-самцов массой 210-250 г выделяли обще-
способны эффективно индуцировать неспеци-
принятым методом дифференциального центри-
фическую проницаемость как искусственных
фугирования с последующим освобождением от
мембран, так и плазматической мембраны эрит-
эндогенных жирных кислот с помощью бычьего
роцитов [12-15]. В основе механизма индукции
сывороточного альбумина в соответствии с мето-
такой проницаемости может лежать образование
дикой, описанной в работе [20]. Среда выделения
липидных пор при формировании комплексов
содержала 250 мМ сахарозы, 1 мМ EGTA, 5 мМ
жирных кислот и Cа2+ по механизму хемотропно-
MOPS-трис, рН 7,4. Концентрацию белка мито-
го фазового перехода [12-16].
хондрий определяли биуретовым методом, в ка-
Одним из путей метаболизма монокарбоновых
честве стандарта использовали раствор бычьего
жирных кислот у млекопитающих и человека яв-
сывороточного альбумина. Во время проведения
ляется их ω-окисление, происходящее, главным
эксперимента суспензию митохондрий (60-70 мг
образом, в клетках печени и почек и приводящее
митохондриального белка в 1 мл) хранили на льду
к образованию соответствующих ω-гидроксикар-
в узкой пластиковой пробирке.
боновых кислот [17,18]. Так, в процессе ω-окисле-
Изменение оптической плотности суспензии
ния пальмитиновой кислоты в качестве первич-
митохондрий регистрировали при длине волны
ного продукта образуется ω-гидроксипальмити-
540 нм на спектрометре
«FLAME-T-UV-VIS»
новая кислота (ГПК). Накопление этой кислоты
(Ocean Optics, США). Проницаемость внутрен-
в крови и клетках пациентов наблюдается при
ней мембраны митохондрий для Ca2+ определяли
различных патологических состояниях, связан-
с помощью Ca2+-селективного электрода. Раз-
ных с нарушением липидного обмена [18].
ность электрических потенциалов (Δψ) на внут-
Недавно нами было установлено, что в присут-
ренней мембране митохондрий оценивали по
ствии ионов кальция ГПК способна индуциро-
распределению катиона тетрафенилфосфония
вать слияние и/или агрегацию мембран лецити-
через внутреннюю мембрану, концентрацию ко-
новых липосом. Предположено, что этот меха-
торого регистрировали с помощью тетрафенил-
низм лежит в основе Са2+-зависимой агрегации
фосфоний-чувствительного электрода. Измене-
эритроцитов, индуцируемой ГПК [15]. ГПК в
ния концентраций тетрафенилфосфония и Ca2+ в
присутствии Са2+ также индуцирует агрегацию
среде регистрировали одновременно с помощью
митохондрий печени, которая сопровождается
оригинальной многоканальной электрометриче-
выходом цитохрома с из органелл и ЦсА-нечув-
ской системы Record 4usb в кювете объемом
БИОФИЗИКА том 64
№ 6
2019
СРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ ЭФФЕКТОВ
1117
Рис. 1. Зависимости скорости изменения оптической плотности суспензии митохондрий печени от концентрации до-
бавляемой жирной кислоты (а) и хлорида кальция (б). Добавки на рис. (а): пальмитиновая кислота (1) и ГПК (2) в ука-
занных концентрациях. Добавки на рис. (б): 30 мкМ пальмитиновой кислоты (1), 30 мкМ ГПК (2), хлорид кальция -
в указанных концентрациях. Концентрация митохондриального белка в ячейке - 0,4 мг/мл. Условия опыта и состав
среды инкубации описаны в разделе «Материалы и методы». Приведены средние значения ± стандартная ошибка
среднего (n = 3), в некоторых случаях значения стандартной ошибки среднего не превышают размера указанных на
рисунке символов.
1,2 мл при 25°С при постоянной аэрации и пере-
сутствии ЦсА, что также свидетельствует о высо-
мешивании. Среда инкубации митохондрий со-
коамплитудном набухании этих органелл. Было
держала 200 мМ сахарозы, 20 мМ KCl, 20 мкМ
также установлено [19] и подтверждено в настоя-
EGTA, 5 мМ янтарной кислоты и 10 мМ MOPS-
щей работе (данные не приведены), что ГПК так
трис (рН 7,4). Большие однослойные липосомы,
же эффективно, как и пальмитиновая кислота,
нагруженные сульфородамином Б, формировали
индуцирует быстрый выход Ca2+ из матрикса ми-
из лецитина методом экcтpузии в соответствии c
тохондрий и полное падение Δψ в отсутствие и в
описанной ранее методикой [19]. Выход сульфо-
присутствии ЦсА. Эти данные рассматриваются
родамина Б из липосом определяли по увеличе-
как свидетельство того, что ГПК, так же как и
нию интенсивности флуоресценции вследствие
пальмитиновая кислота, способна индуцировать
диссоциации димеров сульфородамина Б после
Ca2+-зависимую ЦсА-нечувствительную пору в
разбавления красителя во внешней среде [19].
митохондриях печени [19].
Для сравнения эффектов пальмитиновой кис-
РЕЗУЛЬТАТЫ
лоты и ГПК была исследована зависимость ско-
рости набухания митохондрий от концентраций
ГПК индуцирует Ca2+-зависимую ЦсА-нечув-
этих жирных кислот и хлорида кальция. Установ-
ствительную неспецифическую пермеабилизацию
лено, что в митохондриях, нагруженных хлори-
митохондрий печени более эффективно, чем паль-
дом кальция (50 мкМ), эффект ГПК как индукто-
митиновая кислота. Хорошо установлено, что
ра ЦсА-нечувствительной пермеабилизации про-
формирование как ЦсА-чувствительной, так и
является уже при концентрации
5 мкМ и
нечувствительной пор во внутренней мембране
достигает максимального значения при концен-
митохондрий сопровождается высокоамплитуд-
трации 30 мкМ, в то время как пальмитиновая
ным набуханием этих органелл, инкубируемых в
кислота значительно менее эффективна (рис. 1а).
сахарозной среде [10-12,19,21]. Набухание мито-
Концентрация добавляемого хлорида кальция,
хондрий приводит к уменьшению рассеивания
проходящего через суспензию митохондрий све-
при которой наблюдаются максимальные эффек-
ты 20 мкМ жирных кислот, составляет 50 мкМ
та, и это может быть зарегистрировано как сни-
жение оптической плотности этой суспензии
(рис. 1б). В присутствии ЦсА ГПК более интен-
[10-12,19,21]. Как показано нами ранее [19] и
сивно индуцирует набухание митохондрий пече-
подтверждено в настоящей работе (данные не
ни, чем пальмитиновая кислота при различных
приведены), ГПК, так же как и пальмитиновая
концентрациях хлорида кальция (рис. 1б). Следо-
кислота, вызывает значительное снижению опти-
вательно, ГПК как индуктор Ca2+-зависимой
ческой плотности суспензии в отсутствие и в при-
ЦсА-нечувствительной поры в митохондриях пе-
БИОФИЗИКА том 64
№ 6
2019
1118
ДУБИНИН и др.
ных мембранных систем - липосом для флуорес-
центного зонда сульфородамина Б [12,13,16]. Эти
данные легли в основу концепции липидной по-
ры, сформированной в липидном бислое по меха-
низму хемотропного фазового перехода [12,13,16].
Как установлено в настоящей работе (рис. 2, кри-
вая 1), в присутствии 1 мМ Са2+ пальмитиновая
кислота уже в концентрации 50 мкМ вызывает
интенсивный выход сульфородамина Б из липо-
сом. Последующее добавление неионного детер-
гента тритона Х-100 (0,1%) приводит к дальней-
шему выходу сульфородамина Б, что свидетель-
ствует о разрушении оставшейся части липосом.
ГПК в концентрации 50 мкМ не эффективен в
присутствии 1 мМ Са2+ (рис. 2, кривая 2). На
рис. 3а приведены данные зависимости относи-
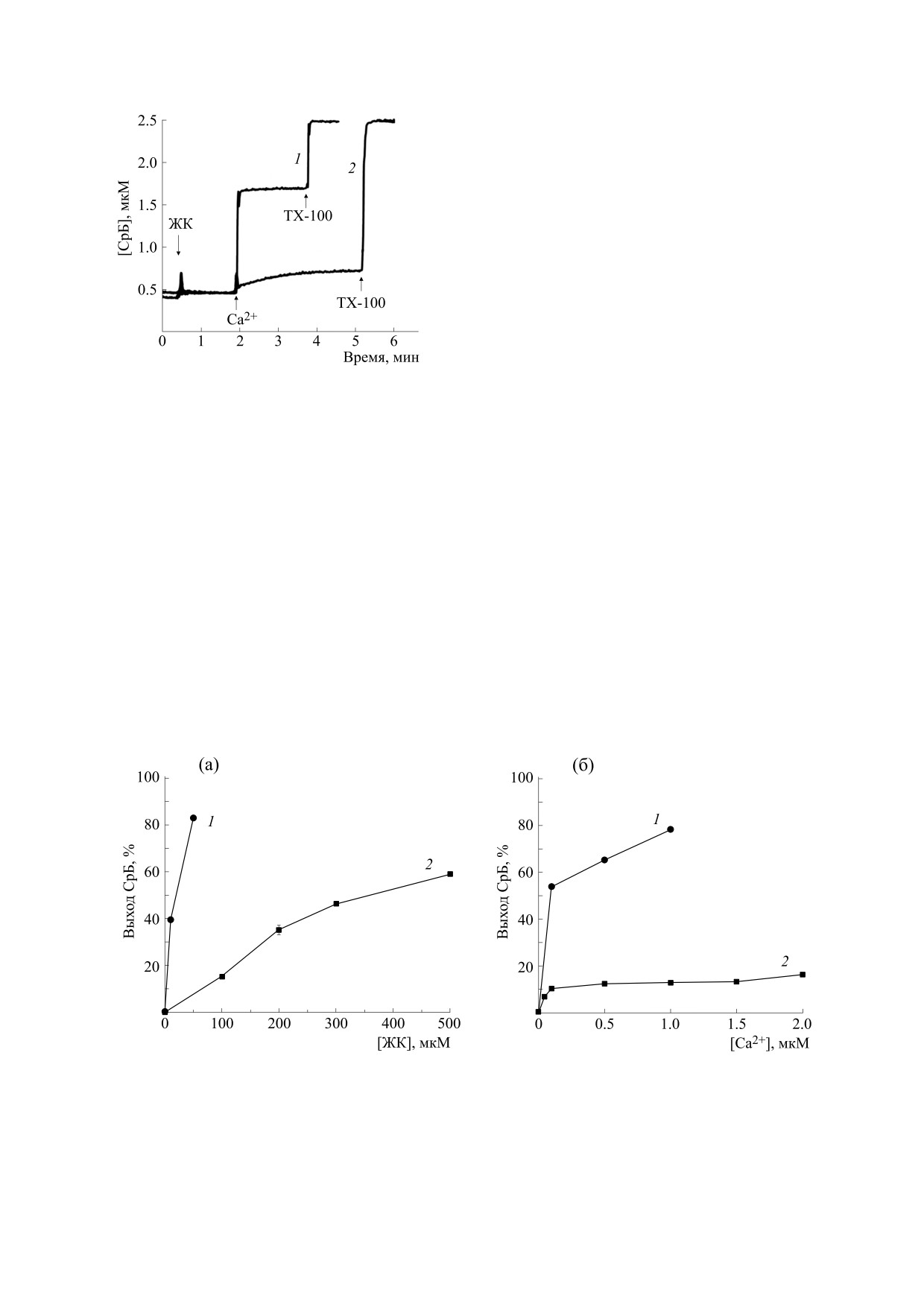
Рис. 2. Выход сульфородамина Б из однослойных ли-
посом, индуцированный пальмитиновой кислотой в
тельного количества вышедшего сульфородами-
присутствии Са2+ (1) и ГПК в присутствии Са2+ (2).
на Б из липосом от концентрации пальмитиновой
Условия опыта и состав среды инкубации описаны в
кислоты (кривая 1) и ГПК (кривая 2). Как видно
разделе «Материалы и методы». Добавки: 50 мкМ
из рисунка, пальмитиновая кислота в концентра-
пальмитиновой кислоты, 50 мкМ ГПК, 1 мM хлорида
кальция (Са2+), 0,1% тритона Х-100 (TX-100). Пред-
ции 50 мкМ в присутствии 1 мМ Са2+ индуцирует
ставлены данные типичного эксперимента, получен-
выход из липосом сульфородамина Б на 80%. Для
ные на одном препарате липосом. Аналогичные ре-
достижения подобного эффекта ГПК необходи-
зультаты были получены еще в трех независимых экс-
мо концентрацию этой жирной кислоты увели-
периментах.
чить до 500 мкМ (рис. 3а, кривая 2). Пальмитино-
вая кислота в концентрации 50 мкМ индуцирует
чени более эффективна, чем пальмитиновая кис-
существенный выход сульфородамина Б из липо-
лота.
сом уже при концентрации Са2+ 0,1 мМ (рис. 3б,
кривая 1). ГПК в концентрации 50 мкМ не эф-
ГПК в отличие от пальмитиновой кислоты слабо
фективен даже при концентрации Са2+ 2 мМ
индуцирует Са2+-зависимый выход сульфородами-
(рис. 3б, кривая 2). Следовательно, ГПК значи-
на Б из липосом. Во введении уже отмечалось, что
тельно слабее пальмитиновой кислоты индуци-
пальмитиновая кислота в присутствии Са2+ спо-
рует Са2+-зависимый выход сульфородамина Б из
собна индуцировать проницаемость искусствен-
липосом.
Рис. 3. Зависимости выхода сульфородамина Б из липосом от концентрации жирных кислот (а) и хлорида кальция (б).
Условия опыта и состав среды инкубации описаны в разделе «Материалы и методы». Добавки на рис. (а):
пальмитиновая кислота (1) и ГПК (2) в указанных концентрациях. Добавки на рис. (б): 50 мкМ пальмитиновой
кислоты (1), 50 мкМ ГПК (2), хлорид кальция - в указанных концентрациях. Приведены средние значения (n = 3),
значения стандартной ошибки среднего не превышают размера указанных на рисунке символов.
БИОФИЗИКА том 64
№ 6
2019
СРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ ЭФФЕКТОВ
1119
Неорганический фосфат (Pi) в присутствии ЦсА
не влияет на эффект пальмитиновой кислоты как
индуктора Са2+-зависимой пермеабилизации мито-
хондрий, но блокирует аналогичное действие ГПК.
Во введении уже отмечалось, что одним из эф-
фективных модуляторов ЦсА-чувствительной
поры является Pi, способный повышать чувстви-
тельность митохондрий к Са2+ как к индуктору
поры и наряду с этим усиливать действие ЦсА как
блокатора поры. Эти эффекты Pi достигают мак-
симальных значений уже при его концентрации в
1 мМ [9]. Представляет интерес выяснить, как
влияет Pi на эффекты пальмитиновой кислоты и
ГПК как индукторов поры. В присутствии в среде
инкубации 1 мМ Pi внесение 40 мкМ хлорида
кальция приводит к набуханию митохондрий пе-
чени (рис 4а и 4б, кривые 1). При этих условиях
1 мкМ ЦсА полностью блокирует набухание
(рис. 4а и 4б, кривые 2). Пальмитиновая кислота
индуцирует быстрое набухание митохондрий
приблизительно в равной степени как в отсут-
ствие (рис. 4а, кривая 3), так и в присутствии Pi
(рис. 4а, кривая 4). ЦсА в присутствии Pi не эф-
фективен (рис. 4а, кривая 5). При аналогичных
условиях ГПК, так же как и пальмитиновая кис-
лота, индуцирует быстрое набухание митохон-
дрий приблизительно в равной степени как в от-
сутствие (рис. 4б, кривая 3), так и в присутствии
Pi (рис. 4б, кривая 4). Однако при условии инку-
бации митохондрий с ЦсА и Pi ГПК, в отличие от
пальмитиновой кислоты, не индуцирует набуха-
ния органелл (рис. 4б, кривая 5).
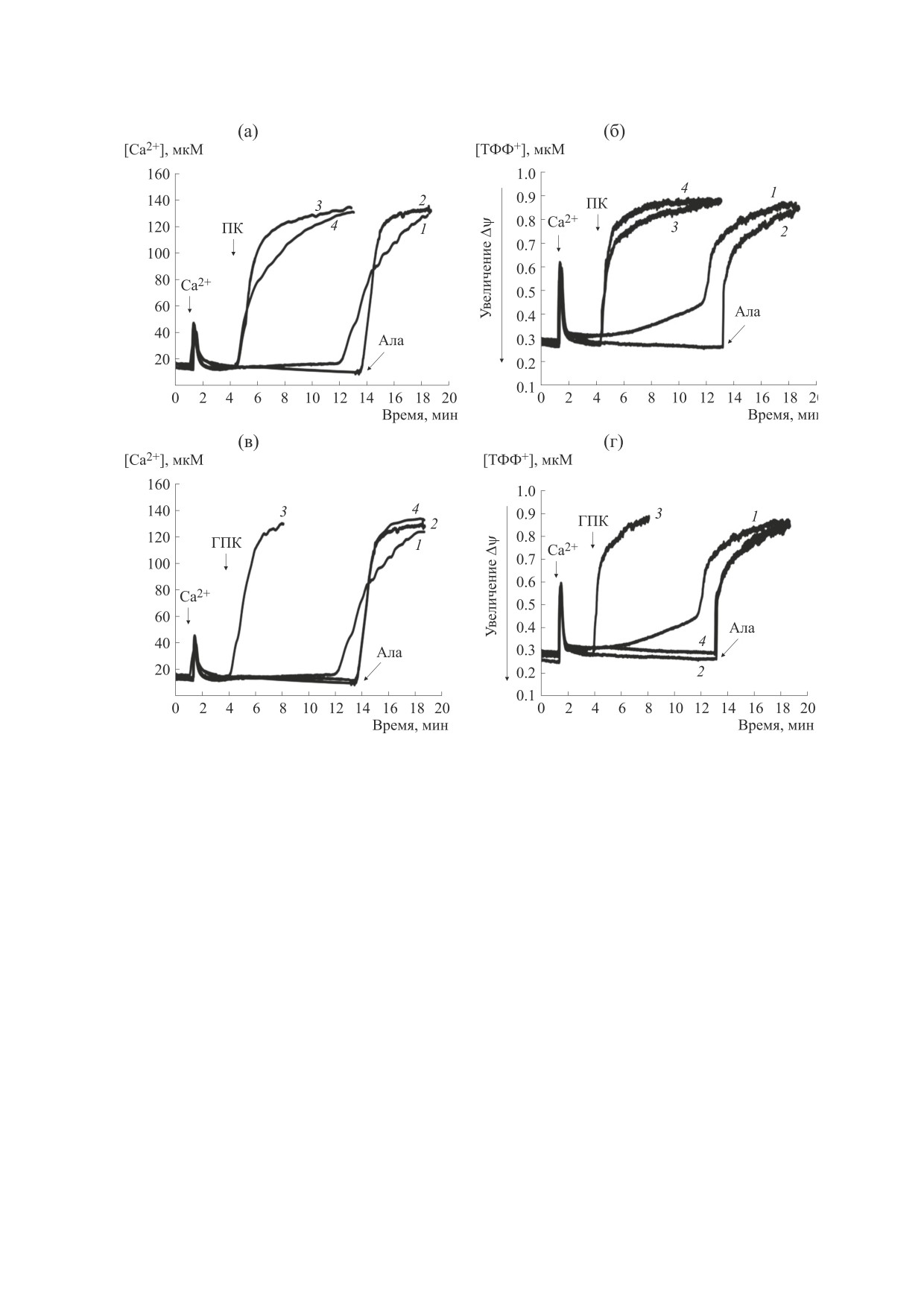
Рис. 4. Влияние неорганического фосфата и ЦсА на
кинетику изменения оптической плотности суспензии
На рис. 5а приведены данные сравнительного
митохондрий печени, индуцированную пальмитино-
исследования зависимости начальной скорости
вой кислотой (а) или ГПК (б). Цифрами обозначены
индуцируемого ГПК и пальмитиновой кислотой
кривые, полученные при добавках различных агентов:
Са2+-зависимого набухания митохондрий, инку-
1 - Pi + Са2+; 2 - Pi + ЦсА + Са2+; 3 - Са2+ + пальми-
бируемых с 1 мкМ ЦсА, от концентрации Pi. Как
тиновая кислота или ГПК; 4 - Pi + Са2+ + пальмити-
видно из рисунка (кривая 1), Pi в концентрации
новая кислота или ГПК; 5 - Pi + ЦсА + Са2+ + паль-
1 мМ эффективно блокирует индуцируемое ГПК
митиновая кислота или ГПК. 1 мМ Pi был добавлен в
набухание органелл. При тех же условиях, но при
среду инкубации до внесения митохондрий. Другие
условия эксперимента и добавки приведены в подписи
замене ГПК пальмитиновой кислотой, Pi в кон-
к рис. 1. Представлены данные типичного экспери-
центрации 1 мМ наоборот увеличивает скорость
мента, полученные на одном препарате митохондрий.
набухания митохондрий (рис. 5а, кривая 2).
Аналогичные результаты были получены еще в трех
независимых экспериментах.
При изучении эффектов Pi как модулятора
Ca2+-зависимой поры действие этого аниона
сравнивают с эффектами близкого по свойствам
митохондрий (рис. 6а) и полное падение Δψ
проникающего аниона ванадата [9]. Установле-
(рис. 6б). В отличие от пальмитиновой кислоты
но, что ванадат даже в концентрации 5 мМ не
ГПК при условии инкубации митохондрий с ЦсА
оказывает влияния на Ca2+-зависимое набухание
и Pi не индуцирует выход Ca2+ из матрикса (рис.
митохондрий, индуцируемое как ГПК (рис. 5б,
6в) и не влияет на Δψ (рис. 6г). В этом случае до-
кривая
1), так и пальмитиновой кислотой
бавление к митохондриям печени известного ка-
(рис. 5б, кривая 2).
налообразующего агента аламетицина (5 мкг/мл)
В присутствии Pi пальмитиновая кислота в
[22] индуцирует интенсивный выход Ca2+ из мат-
равной степени и в отсутствие, и в присутствии
рикса (рис. 6в, кривая 2) и падение Δψ (рис. 6г,
ЦсА индуцирует быстрый выход Ca2+ из матрикса
кривая 2).
БИОФИЗИКА том 64
№ 6
2019
1120
ДУБИНИН и др.
V
Рис. 5. Зависимости относительной скорости изменения оптической плотности (V, %) суспензии митохондрий печени
инкубируемых с Са2+ и ЦсА, от концентрации неорганический фосфата (а) и ванадата (б) в присутствии ГПК (кривая 1)
и пальмитиновой кислоты (кривая 2). Условия опыта и добавки - как на рис. 4. Неорганический фосфат (Pi) и ванадат в
указанных на рисунке концентрациях были добавлены в среду инкубации до внесения митохондрий. Приведены сред-
ние значения ± стандартная ошибка среднего (n = 3), в некоторых случаях значения стандартной ошибки среднего не
превышают размера указанных на рисунке символов.
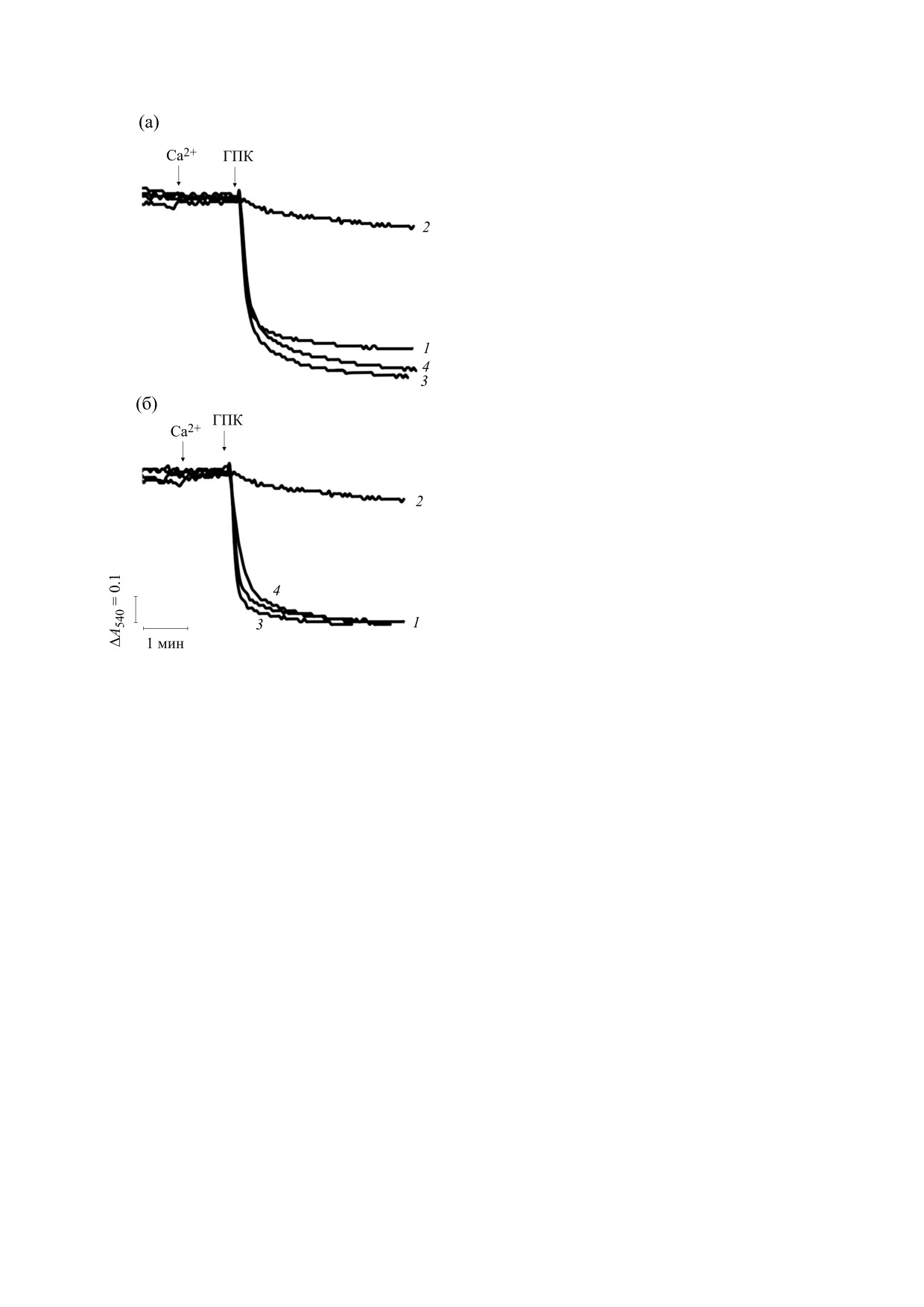
Ванадат даже в концентрации 2 мМ, т. е. в бо-
ность ГПК как индуктора Са2+-зависимого набу-
лее высокой, чем концентрация Pi, в присутствии
хания органелл, а также снимает ингибирующее
ЦсА не влияет на способность ГПК индуцировать
влияние Pi при его предварительном добавлении
выход Ca2+ из матрикса и падение Δψ (данные не
в среду инкубации. Аналогичным действием об-
приведены). Эти и представленные на рис. 5 дан-
ладает и н-этилмалеимид (250 нмоль/мг белка)
ные свидетельствуют о том, что в наших условиях
(рис. 7б). Эти данные свидетельствуют о том, что
Pi как блокатор ГПК-индуцируемой поры не мо-
действие Pi как блокатора индуцируемой ГПК
жет быть заменен близким по свойствам прони-
Са2+-зависимой пермеабилизации митохондрий
кающим анионом - ванадатом.
устраняется при условии их инкубации с указан-
Можно предположить, что действие Pi как
ными SH-реагентами, эффективно действующи-
ми как ингибиторы переносчика Pi.
блокатора индуцируемой ГПК ЦсА-нечувстви-
тельной пермеабилизации митохондрий возмож-
но только при его транспорте в матрикс при уча-
ОБСУЖДЕНИЕ
стии специального фосфатного переносчика и,
следовательно, может быть устранено путем ин-
Особенностью действия насыщенных жирных
гибирования этого переносчика. Эффективными
кислот и, в частности, пальмитиновой является
ингибиторами переносчика фосфата являются
то, что их эффект может проявляться и в присут-
SH-реагенты мерсалил и н-этилмалеимид, вызы-
ствии специфического блокатора «классической»
вающие полное ингибирование активности этого
поры - ЦсА [11-13]. На основании данных, полу-
переносчика в митохондриях печени в количе-
ченных на модельных мембранных системах -
стве 10 и 170 нмоль/мг белка соответственно [23].
липосомах, была сформулирована гипотеза о том,
Известно, что мерсалил не проходит через внут-
что в основе механизма индукции такой прони-
реннюю мембрану митохондрий печени и взаи-
цаемости лежит формирование в липидной фазе
модействует с SH-группой Сys41 переносчика
внутренней мембраны митохондрий поры вслед-
фосфата на его наружной поверхности. С этой же
ствие образования комплексов жирных кислот и
SH-группой взаимодействует и н-этилмалеимид
Cа2+ по механизму хемотропного фазового пере-
[24].
хода [12,13,16]. В рамках подтверждения этой ги-
Как показано на рис.
7а, мерсалил
потезы можно рассматривать также представлен-
(12,5 нмоль/мг белка), будучи добавленный к ми-
ные на рис. 2 и 3 наши данные о том, что пальми-
тохондриям печени крыс, инкубируемых в при-
тиновая кислота эффективно индуцирует Са2+-
сутствии ЦсА и отсутствии Pi, снижает эффектив-
зависимый выход сульфородамина Б из липосом.
БИОФИЗИКА том 64
№ 6
2019
СРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ ЭФФЕКТОВ
1121
Рис. 6. Сравнение эффектов пальмитиновой кислоты (а, б) и ГПК (в, г) на кинетику выхода из митохондрий Са2+ (а, в)
и тетрафенилфосфония (б, г) инкубируемых в присутствии Pi. 1 - Pi + Са2+; 2 - Pi + ЦсА + Са2+; 3 - Pi + Са2+ + паль-
митиновая кислота или ГПК; 4 - Pi + ЦсА + Са2+ + пальмитиновая кислота или ГПК. Концентрация митохондриаль-
ного белка в ячейке - 1,0 мг/мл. Pi (1 мМ) был добавлен в среду инкубации до внесения митохондрий. Условия опыта и
состав среды инкубации описаны в разделе «Материалы и методы». Добавки: 50 мкМ хлорида кальция (Са2+), 30 мкМ
пальмитиновой кислоты (ПК), 30 мкМ ГПК, 5 мкг/мл аламетицина (Ала). Представлены данные типичного экспери-
мента, полученные на одном препарате митохондрий. Аналогичные результаты были получены еще в двух независимых
экспериментах.
Молекула ГПК отличается от молекулы паль-
новлено, что ГПК вызывает существенно более
митиновой кислоты только наличием гидрок-
интенсивное набухание митохондрий, чем паль-
сильной группы на конце ацильной цепи - в ω-
митиновая кислота. Следовательно, ГПК являет-
положении. Так же как и пальмитиновая кислота,
ся более эффективным индуктором Ca2+-зависи-
ГПК в нагруженных Ca2+ митохондриях печени
мой пермеабилизации внутренней мембраны ор-
вызывает высокоамплитудное набухание этих ор-
ганелл. Можно было бы предположить, что
ганелл, выход Ca2+ из матрикса и падение Δψ оди-
механизм действия ГПК, так же как и пальмити-
наково эффективно в отсутствие и в присутствии
новой кислоты, заключается в формировании во
ЦсА [19] (рис. 1). При сравнении эффектов этих
внутренней мембране митохондрий Ca2+-зависи-
жирных кислот при их равных концентрациях и
мой липидной поры. Однако ГПК, как индуктор
при одинаковых концентрациях Ca2+ было уста-
Са2+-зависимого выхода сульфородамина Б из
БИОФИЗИКА том 64
№ 6
2019
1122
ДУБИНИН и др.
стью блокируется Pi (рис. 4-6). Таким образом,
пальмитиновая кислота и ГПК как индукторы
Са2+-зависимой поры существенно отличаются
по механизму действия: если Са2+-зависимый эф-
фект пальмитиновой кислоты можно рассматри-
вать как формирование липидной поры, то Са2+-
зависимый эффект ГПК в присутствии Pi - как
формирование
«классической» ЦсА-чувстви-
тельной поры.
Эффект Pi как блокатора индуцируемой ГПК
Са2+-зависимой ЦсА-чувствительной поры
устраняется путем инкубации митохондрий с SH-
реагентами мерсалилом и н-этилмалеимидом,
эффективно действующими как ингибиторы пе-
реносчика Pi. Это предполагает, что для эффек-
тивного действия Pi необходим его транспорт в
матрикс митохондрий. Как уже отмечалось во
введении, на внутренней поверхности внутрен-
ней мембраны митохондрий предполагается су-
ществование регуляторного сайта, связывание с
которым Pi сопровождается ингибированием по-
ры и который в отсутствие ЦсА замаскирован
циклофилином D [9]. Такое действие Pi является
уникальным, так как близкие по свойствам про-
никающие анионы арсенат и ванадат не обладают
подобным эффектом [9]. ЦсА, препятствуя свя-
зываю циклофилина D, вызывает демаскировку
такого регуляторного сайта и таким образом спо-
собствует взаимодействию с ним Pi [9]. По-види-
мому, связывание Pi с таким сайтом приводит
также к ингибированию действия ГПК как ин-
Рис. 7. Влияние мерсалила (а) и н-этилмалеимида
(б) на кинетику ЦсА-нечувствительного изменения
дуктора «классической» Са2+-зависимой поры
оптической плотности суспензии митохондрий пе-
митохондрий печени. И в этом случае ванадат
чени, индуцированную ГПК в присутствии и в от-
сутствие неорганического фосфата (Pi) . Цифрами
также не эффективен. Тот факт, что в отсутствие
обозначены кривые, полученные при добавках раз-
Pi ЦсА не влияет на эффект ГПК как индуктора
личных агентов: 1 - ЦсА + Са2+ + ГПК; 2 - Pi + ЦсА +
Са2+-зависимой митохондриальной поры, позво-
+ Са2+ + ГПК; 3 - ЦсА + н-этилмалеимид или мер-
ляет предположить, что связывание циклофили-
салил + Са2+ + ГПК; 4 - ЦсА + Pi+ н-этилмалеимид
на D с мембранными сайтами не является необ-
или мерсалил + Са2+ + ГПК. Pi (1 мМ), н-этилмале-
ходимым условием формирования этой поры.
имид
(250 нмоль/мг белка) или мерсалил
(12,5 нмоль/мг белка) были добавлены в среду инкуба-
ции до внесения митохондрий. Другие условия экспе-
ФИНАНСИРОВАНИЕ РАБОТЫ
римента и добавки приведены в подписи к рис. 1.
Работа выполнена при финансовой поддержке
грантов Президента Российской Федерации
(№ МК-61.2019.4) и Министерства науки и выс-
липосом, значительно уступает в эффективности
шего образования Российской Федерации
пальмитиновой кислоте (рис. 2 и 3). Ранее уже
(№ 17.4999.2017/8.9).
было установлено, что ГПК существенно уступа-
ет в эффективности пальмитиновой кислоте и
КОНФЛИКТ ИНТЕРЕСОВ
как индуктор Са2+-зависимой пермеабилизации
плазматической мембраны эритроцитов [15]. Как
Авторы заявляют об отсутствии конфликта
интересов.
уже отмечалось во введении, эффект ЦсА как
блокатора поры усиливается Pi [2,9]. В настоящей
работе установлено, что, в отличие от пальмити-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
новой кислоты, действие ГПК как индуктора
Все применимые международные, националь-
Ca2+-зависимой поры в присутствии ЦсА полно-
ные и институциональные принципы ухода и ис-
БИОФИЗИКА том 64
№ 6
2019
СРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ ЭФФЕКТОВ
1123
пользования животных при выполнении работы
12. K. N. Belosludtsev, N. V. Belosludtseva, A. V. Agafon-
были соблюдены.
ov, et al., Biochim. Biophys. Acta 1838, 2600 (2014).
13. K. N. Belosludtsev, N. V. Belosludtseva, A. V. Agafon-
ov, et al., Biochim. Biophys. Acta 1848, 2200 (2015).
СПИСОК ЛИТЕРАТУРЫ
14. K. N. Belosludtsev, A. S. Trudovishnikov, N. V. Be-
losludtseva, et al., J. Membr. Biol. 237, 13 (2010).
1. D. B. Zorov, M. Juhaszova, and S. J. Sollott, Physiol.
15. М. В. Дубинин, А. Е. Степанова, К. А. Щербаков
Rev. 94, 909 (2014).
и др. Биофизика 61, 916 (2016).
2. К. Н. Белослудцев, М. В. Дубинин, Н. В. Белослуд-
16. A. Agafonov, E. Gritsenko, K. Belosludtsev, et al., Bio-
цева и др., Биохимия 84, 759 (2019).
chim. Biophys. Acta 1609, 153 (2003).
3. M. Bonora, A. Bononi, E. De Marchi, et al., Cell. Cy-
17. R. J. Sanders, R. Ofman, F. Valianpou, et al., J. Lipid.
cle 12, 674 (2013).
Res. 46, 1001 (2005).
4. V. Giorgio, S. von Stockum, M. Antoniel, et al., Proc.
18. R. J. Wanders, J. Komen, and S. Kemp, FEBS J. 278,
Natl. Acad. Sci. USA 110, 5887 (2013).
182 (2011).
5. C. Gerle, Biochim. Biophys. Acta 1857, 1191 (2016).
19. M. V. Dubinin, V. N. Samartsev, A. E. Stepanova,
6. A. W. Leung, P. Varanyuwatana, and A. P. Halestrap, J.
et al., J. Bioenerg. Biomembr. 50, 391 (2018).
Biol. Chem. 283, 26312 (2008).
7. A. P. Halestrap and A. M. Davidson, Biochem. J. 268,
20. V. N. Samartsev, A. V. Smirnov, I. P. Zeldi, et al., Bio-
153 (1990).
chim. Biophys. Acta 1339, 251 (1997).
8. A. P. Richardson and A. P. Halestrap, Biochem. J. 473,
21. V. Petronilli, C. Cola, S. Massari, et al., J. Biol. Chem.
1129 (2016).
268, 21939 (1993).
9. E. Basso, V. Petronilli, M. A. Forte, et al., J. Biol.
22. I. S. Gostimskaya, V. G. Grivennikova, T. V. Zharova,
Chem. 283, 26307 (2008).
et al., Anal. Biochem. 313, 46 (2003).
10. M. E. Bodrova, V. I. Dedukhova, V. N. Samartsev,
23. E. Ligeti, G. Brandolin, Y. Dupont, et al., Biochemis-
et al., IUBMB Life 50, 189 (2000).
try 24, 4423 (1985).
11. A. Sultan and P. Sokolove, Arch. Biochem. Biophys.
24. G. C. Ferreira, R. D. Pratt, and P. L. Pedersen, J. Biol.
386, 52 (2001).
Chem. 265, 21202 (1990).
A Comparative Study of the Effects of Palmitic Acid and ω-Hydroxypalmitic Acid
as Inducers of Ca2+-Dependent Permeabilization of Liver Mitochondria
and Lecithin Liposomes
M.V. Dubinin*, V.N. Samartsev*, A.E. Stepanova*, A.A. Semenova *,
E.I. Khoroshavina*, and K.N. Belosludtsev*, **
*Mari State University, pl. Lenina 1, Yoshkar-Ola, 424000 Russia
** Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
The effects of ω-hydroxypalmitic acid as an inducer of Ca2+-dependent membrane permeabilization were
studied on succinate-fueled isolated rat liver mitochondria and lecithin liposomes. Ca2+-dependent effects of
ω-hydroxypalmitic acid on mitochondria and liposomes are compared with similar well-studied effects of
palmitic acid. It was found that in the presence of cyclosporin A, ω-hydroxypalmitic acid induced significant-
ly more intensive mitochondrial swelling than palmitic acid and, thus, was a more effective inducer of Ca2+-
dependent cyclosporin A-insensitive permeabilization of the inner membrane of organelles. At the same
time, ω-hydroxypalmitic acid, as an inducer of Ca2+-dependent release of sulforhodamine B from liposomes,
was much inferior to palmitic acid. It was shown that, as opposed to palmitic acid, the action of ω-hydroxy-
palmitic acid as an inducer of Ca2+-dependent pore in the liver mitochondria was completely blocked by in-
organic phosphate in the presence of cyclosporin A. It has been found that in this case, inorganic phosphate
cannot be replaced by a similar permeable anion vanadate. The results obtained provide evidence that mech-
anisms of action of ω-hydroxypalmitic acid and palmitic acid as inducers of the Ca2+-dependent permeabi-
lization of liver mitochondria differ significantly. When the Ca2+-dependent effect of palmitic acid is consid-
ered as the formation of a lipid pore, the Ca2+-dependent effect of ω-hydroxypalmitic acid in the presence of
inorganic phosphate is the formation of a cyclosporin A-sensitive MPT pore. The action of inorganic phos-
phate as an inhibitor of ω-hydroxypalmitic acid-induced Ca2+-dependent cyclosporin A-sensitive pore in liv-
er mitochondria is discussed.
Keywords: mitochondrial pore, ω-hydroxypalmitic acid, palmitic acid, cyclosporin A, calcium ions, inorganic
phosphate
БИОФИЗИКА том 64
№ 6
2019