БИОФИЗИКА, 2019, том 64, № 6, с. 1138-1145
БИОФИЗИКА КЛЕТКИ
УДК 542.957:547.7:547.854:547.857:615.27.3
ЧУВСТВИТЕЛЬНОСТЬ КЛЕТОК ОПУХОЛЕЙ ЧЕЛОВЕКА
К ЦИТОТОКСИЧЕСКОМУ ДЕЙСТВИЮ ПОЛИАКРИЛАТА ЗОЛОТА
(АУРУМАКРИЛ)
© 2019 г. Д.Б. Корман, Е.И. Некрасова, Л.А. Островская, О.О. Рябая*,
Н.В. Блюхтерова, К.А. Абзаева**
Институт биохимической физики им. Н.М. Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
*Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина Минздрава России,
115478, Москва, Каширское шоссе, 24
**Иркутский институт химии им.А.Е. Фаворского Сибирского отделения РАН,
664033, Иркутск ул. Фаворского, 1
Е-mail: larros@list.ru
Поступила в редакцию 10.12.2019 г.
После доработки 10.12.2019 г.
Принята к публикации 05.09.2019 г.
Исследован цитотоксический эффект противоопухолевого препарата аурумакрила (полиакрилат золота)
в отношении клеток опухолей человека различного генеза. Установлена весьма значительная цитотокси-
ческая активность аурумакрила в отношении клеток рака легкого А549 (ИК50 = 60 мкг/мл), меланомы
Mel Mо (ИК50 = 80 мкг/мл) и рака молочной железы MCF-7 (ИК50 = 90 мкг/мл), при существенно мень-
шей чувствительности к препарату клеток рака толстой кишки НСТ116 (ИК50 = 180 мкг/мл).
Ключевые слова: аурумакрил (полиакрилат золота), цитотоксическая активность, культуры опухоле-
вых клеток человека.
DOI: 10.1134/S0006302919060139
дой лигандов. В отличие от этих соединений ис-
Комплексные соединения, содержащие одно-
следуемый нами в течение нескольких лет в Ин-
или трехвалентные ионы золота, в последние го-
ституте биохимической физики имени Н.М. Эма-
ды интенсивно исследуются в качестве потенци-
нуэля РАН препарат полиакрилата золота
альных противоопухолевых агентов. Особый ин-
(аурумакрил) представляет собой макромолеку-
терес золотосодержащие вещества вызывают в
лярный золотосодержащий полимер. Нами впер-
связи с тем, что мишени, на которые направлено
вые установлена противоопухолевая активность
их действие, и механизмы его реализации отлича-
аурумакрила на моделях солидных опухолей мы-
ют эти соединения от известных, клинически
шей, показан его цитотоксический и антипроли-
апробированных лекарственных средств [1-3].
феративный эффект на культуре клеток рака мо-
Из истории противоопухолевой химиотерапии
лочной железы человека (линия MCF-7) [5-9].
хорошо известно, что появление каждого нового
препарата с оригинальным механизмом действия
Цель настоящего исследования состоит в срав-
поднимает лекарственное лечение рака на новую
нительном изучении цитотоксичности аурумак-
ступень, как за счет расширения спектра опухо-
рила в отношении клеточных культур опухолей
лей, чувствительных к лекарственной терапии,
человека различного генеза.
так и за счет появления новых возможностей для
преодоления исходной и приобретенной рези-
стентности к уже имеющимся препаратам [4].
МАТЕРИАЛЫ И МЕТОДЫ
Изученные к настоящему времени золотосо-
держащие соединения, обладающие противоопу-
Препарат. Исследуемый препарат с условным
холевым эффектом, представляют собой «малые
названием аурумакрил представляет собой не-
молекулы», различающиеся структурой и приро-
полную золотую соль полиакриловой кислоты,
содержащей 8,03 мас. % Au, и отвечает общей
Сокращения: ДМСО - диметилсульфоксид, ИК50 - показа-
формуле:
(-CH2-CHCOOH-)n(-CH2CHCOO-
тель цитотоксичности препарата (значение концентрации
вещества, вызывающей гибель 50% клеток).
AuCl3H-)m, где n = 1263; m = 124. Препарат пред-
1138
ЧУВСТВИТЕЛЬНОСТЬ КЛЕТОК ОПУХОЛЕЙ ЧЕЛОВЕКА
1139
ставляет собой стекловидные пластинки желтого
МТТ-реагента
(3-[4,5-диметилтриазол-2-ил]-
цвета, ограниченно растворимые в воде.
2,5-дифенилтетразолия бромид) (AppliChem,
Германия) в конечной концентрации 0,5 мг/мл.
Исследование проведено с использованием
Клетки инкубировали в течение 3 ч, затем среду
раствора аурумакрила в диметилсульфоксиде
отбирали и добавляли к ним по 200 мкл ДМСО до
(ДМСО). Исходный раствор аурумакрила
-
растворения кристаллов формазана (37°, 10 мин,
20 мг/мл в 100%-м ДМСО (максимальная раство-
при встряхивании). Оптическую плотность рас-
римость) - разводили до конечных концентра-
твора формазана определяли спектрофотометри-
ций препарата в среде от 2 до 0,0039 мг/мл, при
чески при длине волны 570 нм на анализаторе
этом концентрация ДМСО в конечном растворе
Multiscan FC (ThermoScientific, США), выживае-
среды составляла от 10 до 0,0195% соответствен-
мость клеток высчитывали по формуле: (ОП экс-
но. Одновременно с действием препарата иссле-
периментальной группы / ОП контрольной груп-
довали эффект растворителя - ДМСО - в тех же
пы) × 100%, где ОП - оптическая плотность рас-
концентрациях.
твора.
Оценка цитотоксического эффекта аурумак-
рила была проведена при применении препарата
Для оценки вклада собственной окраски ауру-
в концентрациях 0,250, 0,125 и 0,060 мг/мл. Кон-
макрила в оптическую плотность раствора был
центрация ДМСО, использованного в качестве
произведен аналогичный тест с внесением препа-
растворителя при приготовлении растворов ауру-
рата и всех реагентов в аналогичных условиях в
макрила в указанных концентрациях, составляла
среду, не содержащую клеток. Показано, что
1,25, 0,63 и 0,30% соответственно. Выбор исполь-
вклад препарата в оптическую плотность раство-
зованных концентраций аурумакрила обусловлен
ра при измерении на используемой длине волны
необходимостью применения растворителя в ми-
крайне мал (около 3% от оптической плотности
нимально возможных концентрациях, позволяю-
для контрольной группы) и не зависит от концен-
щих минимизировать цитотоксический эффект
трации препарата, что позволяет пренебречь этой
ДМСО.
крайне малой величиной.
Культуры клеток. Эксперименты проведены
Результаты экспериментов представлены в ви-
in vitro с использованием четырех линий кле-
де зависимостей «доза-эффект», характеризую-
точных культур опухолей человека, получен-
щих цитотоксическое действие аурумакрила и
ных из банка опухолей НМИЦ онкологии
позволяющих определить показатель цитоток-
им. Н.Н. Блохина.
сичности препарата в отношении изучавшихся
культур опухолевых клеток ИК50 (значение кон-
Для сравнительной оценки цитотоксического
эффекта аурумакрила в отношении клеток опухо-
центрации вещества, которая вызывает гибель
лей человека различного генеза использованы че-
50% клеток).
тыре линии клеточных культур: рецептор-положи-
Согласно общепринятым критериям оценки
тельный рак молочной железы (линия MCF-7),
цитотоксического эффекта лекарственное сред-
эпителиоидный рак легкого (линия А549), адено-
ство из нового класса соединений считается ци-
карцинома толстой кишки (линия НСТ116), мела-
тотоксически активным при значениях
нома (линия Mel Mо).
ИК50 ≤ 100 мкг/мл [10].
Оценка цитотоксического эффекта. Цитоток-
Статистическая обработка результатов прове-
сичность аурумакрила оценивалась путем опре-
дена с помощью программ Statistica и Microsoft
деления доли выживших клеток по отношению к
Excel.
контролю с использованием стандартного МТТ-
теста [10].
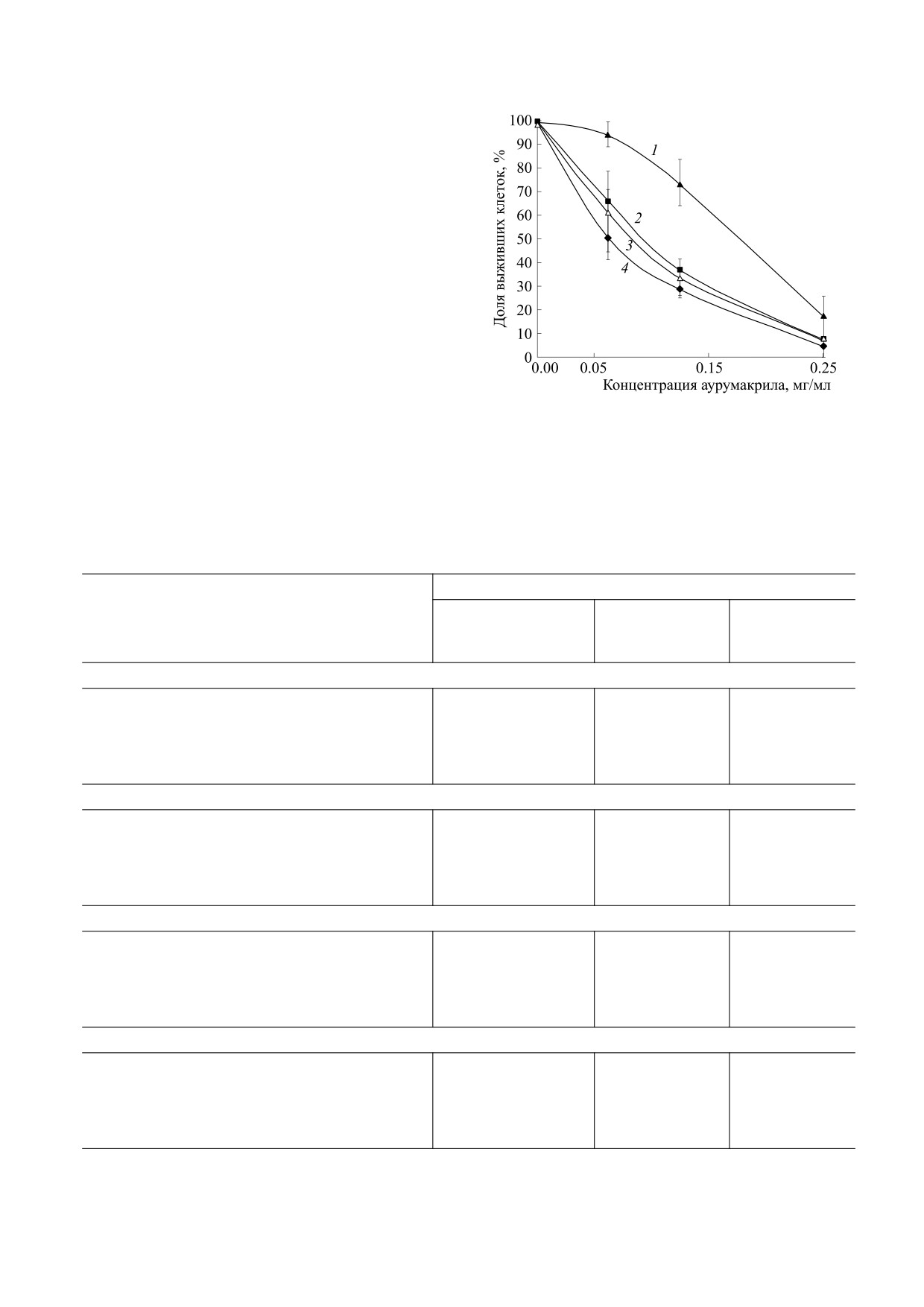
РЕЗУЛЬТАТЫ
Клетки (8 · 104 кл./лунка) вносили в 96-луноч-
ный планшет в полной среде DMEM (арт.
Выживаемость опухолевых клеток в зависимо-
41965039, Thermo Fisher Scientific, США), содер-
сти от концентрации аурумакрила для исследо-
жащей 10% эмбриональной телячьей сыворотки,
вавшихся клеточных культур охарактеризована
2 мМ глутамина («ПанЭко», Россия) и 10 Ед/мл
данными, представленными на рис. 1 и в табл. 1.
пенициллина-стрептомицина
(«ПанЭко», Рос-
Из приведенных на графике кривых и данных
сия), в конечном объеме 200 мкл на лунку и поме-
таблицы видно, что аурумакрил оказывает дозо-
щали в CO2-инкубатор.
зависимое цитотоксическое действие на клетки
Через 24 ч клеткам заменяли среду и добавляли
всех изученных опухолей при применении в срав-
аурумакрил или ДМСО (в указанных выше кон-
нительно небольших концентрациях. Как видно,
центрациях в квадриплетах). В контрольную
эффект аурумакрила может быть весьма суще-
группу клеток препарат или ДМСО не вносили.
ственным - при применении препарата в кон-
Клетки инкубировали в СО2-инкубаторе 48 ч, за-
центрации 0,25 мг/мл доля выживших клеток со-
тем добавляли в каждую лунку по 20 мкл раствора
ставляет 5-18%, изменяясь в этих пределах в за-
БИОФИЗИКА том 64
№ 6
2019
1140
КОРМАН и др.
висимости от типа культур опухолевых клеток
(рис. 1, табл. 1).
В табл. 1 представлены также данные о выжи-
ваемости клеток изученных опухолей при приме-
нении одного ДМСО в соответствующих концен-
трациях.
Полученные данные указывают на определен-
ные различия в чувствительности клеток разных
опухолей к цитотоксическому действию аурумак-
рила. Как видно, зависимость выживаемости кле-
ток от дозы аурумакрила практически одинакова
для клеток рака легкого, рака молочной железы и
меланомы, тогда как клетки рака толстой кишки
существенно менее чувствительны к действию
аурумакрила, особенно в области наименьших
доз. Из представленных данных видно, что при
использовании самой маленькой дозы препарата
(0,06 мг/мл) выживает примерно 50% клеток рака
Рис. 1. Изменение доли выживших клеток в зависимо-
легкого А549 и около 60% клеток рака молочной
сти от концентрации аурумакрила для ряда клеточных
культур опухолей человека: 1 - аденокарцинома тол-
железы MCF-7 и меланомы Mel Mо. Клетки рака
стой кишки НСТ116, 2 - рак молочной железы МСF-7,
толстой кишки НСТ116 практически нечувстви-
3 - меланома Mel Mо, 4 - рак легкого А549, По оси абс-
тельны к действию аурумакрила в такой дозе -
цисс - концентрация аурумакрила, мг/мл; по оси орди-
выживает более 90% клеток. При действии наи-
нат - доля выживших клеток, %.
Таблица 1. Выживаемость и гибель клеток опухолей человека под влиянием аурумакрила
Доза аурумакрила (мг/мл) /концентрация ДМСО (%)
Показатель цитотоксического эффекта
Аурумакрил
Аурумакрил
Аурумакрил
аурумакрила и растворителя (ДМСО)
0,250 (мг/мл)/ДМСО
0,125 (мг/мл)/
0,060 (мг/мл)/
(1,25%)
ДМСО (0,63%)
ДМСО (0,31%)
Культура клеток рака легкого А549
Аурумакрил, доля выживших клеток, %
4,7 ± 0,4
28,6 ± 2,3
50,5 ± 9,2
ДМСО, доля выживших клеток, %
78,7 ± 6,4
79,2 ± 0,5
99,1 ± 6,9
Аурумакрил, доля погибших клеток за вычетом
74,0 ± 5,4
51,6 ± 1,4
49,5 ± 6,5
эффекта ДМСО, %
Культура клеток рака молочной железы MCF-7
Аурумакрил, доля выживших клеток, %
7,2 ± 1,7
37,0 ± 4,7
66,1 ± 5,2
ДМСО, доля выживших клеток, %
81,6 ± 3,0
90,9 ± 2,9
86,7 ± 2,0
Аурумакрил, доля погибших клеток за вычетом
74,4 ± 3,5
53,9 ± 4,5
20,6 ± 5,1
эффекта ДМСО, %
Культура клеток меланомы Mel Mо
Аурумакрил, доля выживших клеток, %
8,0 ± 1,1
33,5 ± 8,14
61,7 ± 1,4
ДМСО, доля выживших клеток, %
113,0 ± 14,4
117,0 ± 11,6
126,5 ± 15,0
Аурумакрил, доля погибших клеток за вычетом
92,0 ± 1,2
65,7 ± 6,0
40,8 ± 11,8
эффекта ДМСО, %
Культура клеток аденокарциномы толстой кишки НСТ116
Аурумакрил, доля выживших клеток, %
17,6 ± 7,1
74,0 ± 10,0
94,5 ± 5,1
ДМСО, доля выживших клеток, %
80,4 ± 5,2
87,1 ± 1,2
85,7 ± 3,3
Аурумакрил, доля погибших клеток за вычетом
62,8 ± 11,7
12,9 ± 10,2
0
эффекта ДМСО, %
БИОФИЗИКА том 64
№ 6
2019
ЧУВСТВИТЕЛЬНОСТЬ КЛЕТОК ОПУХОЛЕЙ ЧЕЛОВЕКА
1141
Рис. 2. Изменение доли погибших клеток в зависимости от концентрации аурумакрила для ряда клеточных культур опу-
холей человека: 1 - рак легкого А549, 2 - рак молочной железы МСF-7, 3 - аденокарцинома толстой кишки НСТ116 ,
4 - меланома Mel Mо. По оси абсцисс - концентрация аурумакрила, мг/мл, по оси ординат - число погибших клеток, %.
большей из изученных доз аурумакрила
аурумакрил не оказывал цитотоксического дей-
(0,25 мг/мл) эти различия сохраняются, но менее
ствия на клетки этой опухоли, тогда как гибель
выражены (рис. 1, табл. 1).
клеток рака легкого А549 и меланомы Mel Mо при
действии аурумакрила в этой дозе была суще-
Для того чтобы полностью исключить из оцен-
ственной (40-49%).
ки цитотоксичности аурумакрила возможный
цитотоксический эффект растворителя (ДМСО),
Следует отметить наибольшую чувствитель-
были рассчитаны доли погибших клеток при изу-
ность клеток меланомы Mel Mо к действию ауру-
ченных дозах препарата с поправкой на долю кле-
макрила - при применении препарата в дозе
ток, которые могли погибнуть в результате дей-
0,25 мг/мл доля погибших клеток составила более
ствия одного ДМСО в соответствующих концен-
90%.
трациях. Полученные данные представлены в
табл. 1 и проиллюстрированы гистограммой, по-
Расчетные значения ИК50 аурумакрила для
казанной на рис. 2.
клеток изучавшихся опухолей человека приведе-
ны в табл. 2. Как видно, согласно существующим
Результаты этих расчетов также указывают на
критериям аурумакрил является цитотоксически
различия в чувствительности клеток разных опу-
активным препаратом, имеющим ИК50 менее
холей к аурумакрилу. Видно, что гибель клеток
рака толстой кишки НСТ116 была наименьшей
100 мкг/мл в отношении клеток немелкоклеточ-
при всех концентрациях по сравнению с клетка-
ного рака легкого А549, меланомы Mel Mо и мо-
ми остальных опухолей. При дозе аурумакрила
лочной железы MCF-7. Показатель ИК50 для этих
0,06 мг/мл с учетом поправки на эффект ДМСО
клеточных культур изменяется в пределах от 60 до
80 мкг/мл. Существенно меньшую цитотоксич-
ность аурумакрил проявляет в отношении клеток
Таблица 2. Значения ИК50 аурумакрила для клеток
рака толстой кишки НСТ116 - ИК50 для данной
ряда опухолей человека in vitro
линии клеток составляет 180 мкг/мл (табл. 2).
Клеточная линия опухоли
ИК50, мкг/мл
Таким образом, в результате проведенных
человека
исследований установлена цитотоксическая ак-
тивность аурумакрила в отношении клеточных
Рак легкого А549
60 мкг/мл
культур опухолей человека. Показана весьма зна-
чительная и практически одинаковая чувстви-
Меланома Mel Mо
80 мкг/мл
тельность к аурумакрилу клеток немелкоклеточ-
ного рака легкого А549, меланомы Mel Mо и рака
Рак молочной железы MCF-7
90 мкг/мл
молочной железы MCF-7 при существенно мень-
шей чувствительности к препарату клеток рака
Рак толстой кишки НСТ116
180 мкг/мл
толстой кишки НСТ116.
БИОФИЗИКА том 64
№ 6
2019
1142
КОРМАН и др.
ОБСУЖДЕНИЕ
дов - дитиокарбоматы, порфирины, бипириди-
ны. Синтез таких соединений был обоснован тем,
Исследование противоопухолевых свойств зо-
что трехвалентное золото со степенью окисления
лотосодержащих комплексных соединений было
+3 имеет такую же электронную конфигурацию
индуцировано установлением высокой противо-
d8, как и двухвалентная платина, что может опре-
опухолевой эффективности у комплексных со-
делять одинаковые физико-химические и стерео-
единений платины, широко применяющихся в
химические свойства этих веществ. Отмечалось,
современной химиотерапии опухолей. Предпола-
что образующиеся тетракоординированные ком-
галось, что комплексные соединения, содержа-
плексы трехвалентного золота имеют такую же
щие другие благородные металлы, также могут
квадратично-плоскостную геометрию, что и ком-
обладать значительной противоопухолевой ак-
плексы двухвалентной платины [17,18].
тивностью [11,12].
Исследования противоопухолевых свойств
Наиболее существенные результаты были по-
этих соединений показало, что многие из них
лучены при исследовании соединений, содержа-
оказывают выраженный цитотоксический эф-
щих золото. Золото в химических реакциях в со-
фект на клетки опухолей человека в микро- и на-
ответствии с характерными для него двумя степе-
но-молярных концентрациях и способны эффек-
нями окисления может, при образовании
тивно тормозить рост ксенографтов ряда опухо-
комплексных соединений, выступать в роли од-
лей человека [1].
но- (Au+1) или трехвалентного (Au+3) иона и спо-
На экспериментальных моделях было показа-
собно в результате соединения с различными ко-
но, что препараты золота по противоопухолевой
ординационными лигандами образовывать трех-
активности не уступают цисплатине, не обладают
мерные структуры, аналогичные комплексам
перекрестной резистентностью с производными
платины [18,47]. Противоопухолевые свойства
платины и проявляют значительную активность в
были исследованы у комплексов, содержащих
отношении опухолей, резистентных к платине.
как одно-, так и трехвалентное золото [3,4,11-14].
Эти данные послужили основой предположения
Среди соединений, содержащих одновалент-
о возможных существенных различиях в мише-
нях и механизмах действия золотосодержащих
ное золото, наиболее детальному изучению на
противоопухолевую активность был подвергнут
комплексов и комплексов цисплатины [19].
комплекс, состоящий из третичного фосфина и
Известно, что основной внутриклеточной ми-
тиоглюкозы, координированной с одновалент-
шенью для цисплатины является ДНК. Образую-
ным ионом золота. Предполагалось, что три-
щийся в результате внутриклеточного гидролиза
этилфосфиновый лиганд обеспечивает прохож-
платиносодержащий ион образует аддукты с
дение препарата через мембрану, тетраацети-
ДНК путем образования координационных свя-
лглюкоза быстро отщепляется in vivo [15]. С
зей между атомом платины и двумя основаниями
1985 г. это соединение под названием аурано-
ДНК (преимущественно гуанином). В результате
фин применялось для лечения больных ревма-
образуются плохо репарируемые и длительно су-
тоидным артритом.
ществующие внутри- и межнитевые сшивки [20].
Интенсивное исследование противоопухоле-
Однако в модельных экспериментах с золото-
вых свойств ауранофина в экспериментах in vitro
содержащими комплексами обнаружено, что они
и in vivo на разнообразных моделях опухолей че-
плохо нековалентно связываются с ДНК, связы-
ловека показало, что препарат обладает суще-
вание носит электростатический характер, а об-
ственной цитотоксической, антипролифератив-
разующихся аддукты с ДНК нестабильны [20-
ной и противоопухолевой активностью. В по-
22]. В то же время показано существенное связы-
следние годы было начато его клиническое
вание препаратов золота с белками, не характер-
изучение как противоопухолевого средства сразу
ное для цисплатины, что рассматривается как
со II фазы испытаний, поскольку опыт примене-
еще одно указание на различие в механизмах дей-
ния ауранофина при лечении ревматоидного арт-
ствия золотосодержащих комплексов и циспла-
рита показал безопасность препарата для челове-
тины [12,23-25].
ка. Эти исследования проводятся в рамках
Считается, что основной цитотоксический
программ перепрофилирования известных ле-
эффект всех золотосодержащих комплексных со-
карственных средств для онкологии, организо-
единений обусловлен влиянием центрального
ванных Национальным институтом здоровья
металла. Практически для всех изученных золо-
США совместно с другими институтами [3,16].
тосодержащих комплексов показано, что их ци-
Синтезировано и предложено для изучения в
тотоксический эффект в значительной части опо-
качестве потенциальных противоопухолевых
средован воздействием на антиоксидантную фер-
средств большое число комплексных соедине-
ментативную систему тиоредоксин-тиоредоксин
ний, содержащих в качестве центрального метал-
редуктаза, регулирующую уровень активных
ла ион трехвалентного золота, а в качестве лиган-
форм кислорода в цитозоле и митохондриях. В
БИОФИЗИКА том 64
№ 6
2019
ЧУВСТВИТЕЛЬНОСТЬ КЛЕТОК ОПУХОЛЕЙ ЧЕЛОВЕКА
1143
качестве основной мишени для действия этих со-
Среди золотосодержащих комплексов, изуча-
единений рассматривается тиоредоксин редукта-
емых в качестве потенциальных противоопухо-
за, гиперэкспрессия которой зарегистрирована
левых агентов, к этому направлению пока отно-
во многих опухолях человека. В результате дей-
сится лишь оригинальный препарат - полиа-
ствия золотосодержащих комплексов подавляет-
крилат золота (полиакриловая кислота,
ся активность фермента, что обусловлено высо-
содержащая ионы трехвалентного золота, ауру-
кой аффинностью золота к селену, входящему в
макрил), синтезированный в Иркутском инсти-
селеноцистеин в активном центре тиоредоксин
туте химии им. А.Е. Фаворского СО РАН под ру-
редуктазы. В результате меняется внутриклеточ-
ководством академика М.Г. Воронкова. Проти-
ный окислительно-восстановительный баланс,
воопухолевая активность этого соединения
что ведет к увеличению интрацеллюлярного
впервые была обнаружена в Институте биохи-
уровня активных форм кислорода, повреждению
мической физики им. Н.М. Эмануэля РАН [5,6].
митохондриальных мембран, выходу из митохон-
В этих исследованиях установлено, что ауру-
дрий цитохрома с и апоптоз-индуцирующего
макрил обладает цитотоксическим, антипроли-
фактора и к индукции апоптоза по митохондри-
феративным и противоопухолевым действием.
альному пути [15,25-32].
Препарат вызывал торможение роста солидных
опухолей мышей (карцинома легких Льюис, аде-
Практически во всех исследованиях золотосо-
нокарцинома Са-755 и аденокарцинома Акатол)
держащих комплексов отмечалась сравнительно
на 80-90% по сравнению с контролем. При этом
низкая токсичность этих соединений. Опреде-
средняя продолжительность жизни животных с
ленную селективность действия этих соединений
аденокарциномой Са-755 увеличилась на 31% по
на опухолевые клетки связывают с характерным
сравнению с контролем [5-9].
для опухолевых клеток существенно более высо-
ким базовым интрацеллюлярным уровнем актив-
На культуре клеток карциномы молочной желе-
ных форм кислорода по сравнению с нормальны-
зы человека линии MCF-7 обнаружено, что куль-
ми клетками. Это делает опухолевые клетки более
тивирование клеток с аурумакрилом приводит к
чувствительными к агентам, повышающим внут-
дозо- и времязависимой гибели клеток, вызывая
риклеточное содержание активных форм кисло-
гибель до 60% клеток и утpату клетками выжившей
рода до уровня, приводящего к повреждению
фракции pепpодуктивной cпоcобноcти [8].
клетки. В опухолевых клетках такой уровень бу-
С помощью иммуноцитохимического анализа
дет достигаться раньше и при меньших концен-
маркера клеточного деления - белка Ki-67 - об-
трациях препарата, чем в нормальных [26,33]. Та-
наружены изменения в кинетике пpолифеpации
кой механизм цитотоксического действия золо-
выжившей фpакции опуxолевыx клеток под вли-
тосодержащих комплексов позволяет считать их
янием аурумакрила. Показано, что эти измене-
представителями нового направления в противо-
ния выражаются в пpеимущеcтвенном накопле-
опухолевой химиотерапии - индукции в опухоле-
нии клеток (93%) в фазе пpолифеpативного покоя
вых клетках оксидативного стресса [34-37].
G0 и в значительном уменьшении (7%) доли деля-
В ряде исследований получены данные, указы-
щиxcя клеток [8].
вающие и на другие возможные мишени цитоток-
Результаты настоящего исследования, прове-
сического действия золотосодержащих комплек-
денного с использованием теста на выживаемость
сов (протеосомa 26S, белки внутриклеточных
клеток (МТТ-тест), подтвердили значительную
сигнальных систем, рецептор эпидермального
цитотоксичность аурумакрила в отношении опу-
фактора роста, фактор роста эндотелия сосудов и
холевых клеток линии MCF-7, обнаруженную в
др). На основании обнаруженной способности
проведенном ранее исследовании с использова-
препаратов золота взаимодействовать с разными
нием теста на гибель опухолевых клеток (тест с
мишенями золотосодержащие комплексы рас-
окрашиванием клеток раствором трипанового
сматриваются в настоящее время в качестве муль-
синего) [8].
титаргентных агентов [38-42].
Более того, цитотоксичность установлена не
Одним из направлений создания новых лекар-
только в отношении клеток рака молочной желе-
ственных средств для терапии опухолей является
зы MCF-7, но и еще трех опухолей - немелкокле-
точного рака легкого А549, меланомы Mel Mо,
использование высокомолекулярных соедине-
аденокарциномы толстого кишечника НСТ116.
ний - биомакромолекул и синтетических высо-
комолекулярных полимеров. Синтетические по-
Обращает на себя внимание различная чув-
лимеры используются как в качестве носителей
ствительность к аурумакрилу клеток разных опу-
активной цитотоксической группы для направ-
холей, при этом наибольший эффект зарегистри-
ленной доставки ее в клетки-мишени, так и в ка-
рован для клеток немелкоклеточного рака легко-
честве агента, обладающего собственной биоло-
го А549, меланомы Mel Mо и рака молочной
гической активностью [43].
железы MCF-7 при наименьшей цитотоксично-
БИОФИЗИКА том 64
№ 6
2019
1144
КОРМАН и др.
сти аурумакрила для клеток рака толстого кишеч-
низмы реализации противоопухолевого действия
ника НСТ116.
по сравнению с другими препаратами золота.
Интересно отметить, что в контрольных экс-
Результаты исследования цитотоксических и
периментах с исследованием эффекта одного
противоопухолевых свойств аурумакрила позво-
ДМСО отмечено отсутствие цитотоксичности
ляют рассматривать полиакрилат золота в каче-
ДМСО в выбранных для анализа концентрациях
стве потенциального кандидата для разработки
в отношении клеток меланомы Mel Mо. Более то-
нового противоопухолевого препарата.
го, под влиянием ДМСО отмечалась тенденция к
повышению выживаемости клеток по сравнению
КОНФЛИКТ ИНТЕРЕСОВ
с контролем, чего не наблюдалось на клетках дру-
гих опухолей. Если признать реальность этого фе-
Авторы заявляют об отсутствии конфликта
номена, то можно предположить, что цитоток-
интересов.
сичность аурумакрила в отношении клеток мела-
номы Mel Mо более существенна, чем следует из
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
данных, приведенных в табл. 1 и 2.
Настоящая работа не содержит описания про-
Обнаруженные в проведенном исследовании
веденных исследований с использованием людей
определенные различия в чувствительности опу-
и животных в качестве объектов.
холей различной природы к аурумакрилу, вероят-
но, могут быть полезны при планировании воз-
можных клинических испытаний препарата.
СПИСОК ЛИТЕРАТУРЫ
Механизмы цитотоксического и противоопу-
1.
Д. Б. Корман, Л. А. Островская и В. А. Кузьмин,
холевого действия аурумакрила еще предстоит
Вопр. онкологии 64 (6), 697 (2018).
выяснить. Можно полагать, что, как и для других
2.
S. Nobili, E. Mini, I. Landini, et al., Med. Res. Rev. 30,
изученных золотосодержащих комплексов, важ-
580 (2010).
ную роль в противоопухолевом эффекте препара-
3.
C. I. Yeo, K. K. Ooi, and E. R. Tiekink, Molecules 23,
та играет золото. Об этом, в частности, могут сви-
1410 (2018).
детельствовать результаты исследования фарма-
4.
Д. Б. Корман, Основы противоопухолевой химиоте-
кокинетики аурумакрила, проведенные нами
рапии («Практическая медицина», М., 2006).
ранее с помощью метода масс-спектрометрии с
5.
L. A. Ostrovskaya, M. G. Voronkov, D. B. Korman,
индуктивно связанной плазмой [44].
et al., J. Cancer Therapy 1 (2), 59 (2010).
Было обнаружено, что при внутрибрюшинном
6.
Л. А. Островская, М. Г. Воронков, Д. Б. Корман и
введении препарата мышам с подкожно развива-
др., Биофизика 59 (4), 785 (2014).
ющейся опухолью (карцинома Льюис) макси-
7.
L. A. Ostrovskaya, D. B. Korman, and N. V. Bluhtero-
мальная концентрация золота наблюдается в
va, Biointerface Res. Appl. Chem. 4 (4), 816 (2014).
плазме крови через 3 ч, в опухоли и в легких - че-
8.
Л. А. Островская, А. К. Гpеxова, Д. Б. Коpман и др.,
рез 4 ч, в печени, почках, селезенке и в мозге - че-
Биофизика 62 (3), 598 (2017).
рез 24 ч после применения препарата. Установле-
9.
Л. А. Островская, Д. Б. Корман, А. К. Грехова и др.
но преимущественное накопление препарата в
Изв. РАН. Сер. хим., № 12, 2333 (2017).
почках при крайне низком содержании золота в
10.
Е. М. Трещалина, О. С. Жукова, Г. К. Герасимова
мозге и относительно равномерном распределе-
и др., в сб. Руководство по проведению доклиниче-
нии аурумакрила между тканями опухоли, пече-
ских исследований лекарственных средств, под ред.
А. Н. Миронова и др. («Гриф и К», М., 2012), Ч. 1,
ни, легких и селезенки [44].
сс. 642-657.
Рассматривая возможный вклад в противоопу-
11.
C. Nardon, G. Boscutti, and D. Fregona, Anticancer
холевый эффект аурумакрила входящей в состав
Res. 34, 487 (2014).
препарата полиакриловой кислоты, отметим, что
12.
M. Frezza, S. Hindo, D. Chen, et al., Curr. Pharm.
в наших экспериментах полиакриловая кислота
Des. 16, 1813 (2010).
не проявляла противоопухолевой активности.
13.
C. Nardon and D. Fregona, Curr. Top. Med. Chem.
Вместе с тем в ряде исследований показано, что
16, 360 (2016).
полимеры акриловой кислоты способны достав-
14.
С. Nardon, N. Pettenuzza, and D. Fregona, Curr.
лять в опухолевые клетки in vitro и in vivo различ-
Med. Chem. 23, 3374 (2016).
ные агенты, обладающие цитотоксическим или
15.
V. Gandin, A. P. Fernandes, and M. P. Rigobello, Bio-
антипролиферативным эффектом, а также спо-
chem. Pharmacol. 78, 90 (2010).
собны усиливать активность противоопухолевых
16.
M. Celegato, C. Borghese, N. Casagrande, et al., Blood
агентов внутри клеток [45,46].
126, 1394 (2015).
Принципиальные отличия в химической струк-
17.
L. Ronconi, D. Aldinucci, Q. P. Don, and D. Fregona,
туре аурумакрила от других золотосодержащих
Anticancer Agents Med. Chem. 10, 283 (2010).
комплексов дают основания полагать, что, воз-
18.
C. Nardon, S. M. Schmitt, H. Yang, et al., PloS One 9
можно, аурумакрил имеет иные мишени и меха-
(1), e84248 (2014).
БИОФИЗИКА том 64
№ 6
2019
ЧУВСТВИТЕЛЬНОСТЬ КЛЕТОК ОПУХОЛЕЙ ЧЕЛОВЕКА
1145
19. C. Marzano, L. Ronconi, F. Chiara, et al., Int. J. Can-
32. O. Rackham, S. J. Nichols, P. J. Leedman, et al., Bio-
cer 129, 487 (2011).
chem. Pharmacol. 74, 992 (2007).
20. Д. Б. Корман, Мишени и механизмы действия про-
33. T. Zou, C. T. Lum, C. N. Lok, et al., Chem. Soc. Rev.
тивоопухолевых препаратов («Практическая меди-
44, 8786 (2015).
цина», М., 2014).
34. C. Gorrinia, I. S. Harris, and T. W. Mak, Nature Rev.
21. L. Messori, P. Orioli, C. Tempi, and G. Marcon, Bio-
Drug Discov. 12, 931 (2013).
chem. Biophys. Res. Commun. 281, 352 (2001).
35. D. Trachootham, J. Alexandre, and P. Huang, Nature
22. G. Marcon, S. Carotti, M. Coornello, et al., J. Med.
Rev. Drug Discov. 8, 579 ( 2009).
Chem. 45, 1672 (2002).
36. S. Galadary, A. Rahman, S. Palliehakandys, and
23. Y. Wang, Q. Y. He, R. W. Sun, et al., Eur. J. Pharmacol.
F. Thayyullathie, Free Rad. Biol. Med. 104, 144 2017).
554, 115 (2007).
37. P. Shumacher, Cancer Cell 10, 175 2006).
24. L. Ronconi, C. Mazano, P. Zanello, et al., J. Med.
38. X. Zhang, M. Frezza, V. Milacic, et al., J. Cell Bio-
Chem. 49, 1648 (2006).
chem. 109, 162 (2010).
25. D. Saggioro, M. P. Rigobello, L. Paloschi, et al., Chem.
39. N. Micale, T. Schirmeister, R. Ettari, et al., J. Inorg.
Biol. 14, 128 (2007).
Biochem. 141, 79 (2014).
26. C. Sanchez-de-Diego, I. Marmol, R. Perez, et al., J.
40. N. H. Kim, H. J. Park, M. K. Oh, and I. S. Kim, BMB
Inorg. Biochem. 166, 108 (2017).
Rep. 13, 59 (2013).
27. F. Radenkovic, O. Holland, J. J. Vanderlelie, and
41. H. Li, J. Hu, S. Wu, et al., Oncotarget 7, 3548 (2016).
A. V. Petkins, Biochem. Pharmacol. 146, 42 (2017).
42. M. F. He, X. P. Gao, S. C. Li, et al., Eur. J. Pharmacol.
DOI: 10.1016/j.bcp.2017.09.009.
740, 240 (2014).
28. S. Iwasama, Y. Yamano, Y. Takiguchi, et al., Oncol.
43. Н. А. Платэ и А.Е. Васильев, Физиологически
Rep. 25, 637 (2011).
активные полимеры («Химия», М., 1986).
29. Y. Liu, Y. Li, S. Yu, and G. Zhao, Curr. Drug Targets
44. Л. А. Островская, Д. Б. Корман, Ж. П. Бурмий
13, 1432 (2012).
и др., Биофизика 63 (3), 606 (2018).
30. N. Liu, X. Li, H. Huang, et al., Oncotarget 5, 5433
45. T. Y. Liu, W. M. Hussein, A. K. Giddam, et al., J. Med.
(2014).
Chem. 58, 886 (2015).
31. B. Zhang, J. Zhang, S. Peng, et al., Expert Opin. Ther.
46. N. Chatterjll, T. Anwar, N. S. Islam, et al., Mol. Cell
Pat. 27, 547 (2017).
Biochem. 420, 9 (2016).
Sensitivity of Human Tumor Cells to Cytotoxicity of Aurum Polyacrylate (Aurumacryl)
D.B. Korman*, E.I. Nekrasova*, L.A. Ostrovskaya*, O.O. Ryabaya**,
N.V. Bluhterova*, and K.A. Abzaeva***
*Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, 119334, Moscow, Russia
**Blokhin National Medical Research Center for Oncology, Ministry of Health of the Russian Federation,
Kashirskoe Shosse 24, Moscow, 115478 Russia
***A.E. Favorsky Irkutsk Institute of Chemistry, Siberian Branch of the Russian Academy of Sciences,
ul. Favorskogo 1, Irkutsk, 664033 Russia
The cytotoxic effect of the antitumor drug aurumacryl (aurum polyacrylate) against human tumor cells of
various origins has been studied. It has been shown that aurumacryl exhibits quite significant cytotoxic activ-
ity in cells of lung carcinoma А549 (IC50 = 60 μg/ml), melanoma Mel Mо (IC50 = 80 μg/ml) and breast can-
cer MCF-7 (IC50 = 90 μg/ml); it is substantially less effective in cells of colon carcinoma НСТ116
(IC50 = 180 μg/ml).
Keywords: aurumacryl (aurum polyacrylate), cytotoxic activity, human tumor cell cultures
БИОФИЗИКА том 64
№ 6
2019