БИОФИЗИКА, 2019, том 64, № 6, с. 1146-1150
БИОФИЗИКА КЛЕТКИ
УДК 577.23+576.311
НАДН-ОКСИДАЗНАЯ АКТИВНОСТЬ МИТОХОНДРИЙ В ГИПОТОНИИ
ПРИ БЛОКИРОВКЕ ДЫХАТЕЛЬНОЙ ЦЕПИ
© 2019 г. А.М. Львов, Н.Л. Векшин
Институт биофизики клетки Российской академии наук - обособленное подразделение ФИЦ «Пущинский научный
центр биологических исследований РАН», 142290, Пущино Московской области, ул. Институтская, 3
E-mail: nvekshin@rambler.ru
Поступила в редакцию 07.02.2019 г.
После доработки 23.05.2019 г.
Принята к публикации 19.09.2019 г.
Рассмотрен вопрос о вкладе НАДН-оксидазы в дыхание митохондрий в суспензии в экстремальных
условиях: в гипотонической среде и при блокировке дыхательными ядами - ротеноном, антимици-
ном А и азидом натрия. На изолированных митохондриях печени крысы показано, что заметное по-
требление кислорода при окислении добавленного НАДН идет не только на цитохромоксидазе, но
и на НАДН-дегидрогеназе дыхательной цепи. Именно поэтому дыхание митохондрий на НАДН по-
давляется ядами не полностью. Нечувствительная к ядам дыхательная активность является резуль-
татом шунтирования электронов с НАДН на кислород непосредственно на НАДН-дегидрогеназе.
Такое остаточное дыхание на НАДН-оксидазе, не подавляемое ингибиторами дыхательной цепи,
может в экстремальных условиях достигать половины всего потребления кислорода.
Ключевые слова: митохондрии, гипотония, потребление кислорода, супероксид, НАДН-дегидрогеназа,
ротенон, антимицин А, азид натрия, дыхательная цепь.
DOI: 10.1134/S0006302919060140
При окислении НАДН в дыхательной цепи
ление кислорода изолированными печеночными
митохондрий в нормальных физиологических
митохондриями в гипотонических условиях при
условиях потребление кислорода осуществляется
блокировке дыхательной цепи ядами - ротено-
практически только на цитохромоксидазе [1]. Од-
ном, антимицином А и азидом натрия.
нако, в зависимости от конкретных условий, от
0,1 до 1% кислорода все же может потребляться не
на цитохромоксидазе, а на НАДН-оксидазе [2,3].
МАТЕРИАЛЫ И МЕТОДЫ
При этом кислород на НАДН-оксидазе, прини-
мая электрон, восстанавливается до опасного су-
Фракцию митохондрий из печени крысы вы-
пероксида [2-4]. При обратном переносе элек-
деляли по методике, описанной в работе [7], с не-
тронов с других комплексов цепи на НАДН-де-
большими модификациями. Выделение мито-
гидрогеназу на ней может потребляться до 5%
хондрий проводили при температуре 4oС, все рас-
кислорода [5]. При блокировке дыхательной цепи
творы охлаждали на льду. Сначала печень крысы
антимицином в присутствии НАДН наблюдается
помещали в 20 мл ледяной среды выделения, со-
повышенная продукция супероксида [6].
держащей 250 мМ сахарозы, 0,5 мМ EDTA и
10 мМ HEPES (pH 7,5), после чего печень продав-
Интересно понять, каков может быть вклад
ливали через пресс, добавляли 80 мл той же среды
НАДН-оксидазы в дыхание митохондрий в экс-
и затем производили гомогенизацию в стеклян-
тремальных условиях. Это особенно важно с био-
ном гомогенизаторе с тефлоновым пестиком. По-
медицинской точки зрения, так как: а) в клетках
лученный гомогенат центрифугировали 10 мин
печени осуществляется детоксикация ядовитых
при 1000 g для осаждения неразрушенных клеток
веществ, вследствие чего печеночные митохон-
и эритроцитов. Осадок отбрасывали, а суперна-
дрии повреждаются ядами, б) митохондрии кле-
тант центрифугировали 15 мин при 3000 g (тяже-
ток органов при воспалении, отеках, ушибах, де-
лая фракция митохондрий). Полученный осадок
фиците соли и других подобных случаях попада-
митохондрий осторожно гомогенизировали в 5-
ют в экстремальные гипотонические условия.
8 мл среды выделения и затем использовали для
Целью наших модельных опытов является
опытов (хранили на льду и использовали в тече-
установление вклада НАДН-оксидазы в потреб- ние нескольких часов).
1146
НАДН-ОКСИДАЗНАЯ АКТИВНОСТЬ МИТОХОНДРИЙ
1147
Концентрацию митохондрий по белку опреде-
ляли при 286 нм УФ-экспресс-методом [8] на
спектрофотометре
5400УФ
(«ПромЭкоЛаб»,
Санкт-Петербург).
Изотоническая среда инкубации митохондрий
содержала 150 мМ сахарозы, 10 мМ трис, 5 мМ
NaH2PO4, 1 мМ EGTA (pH 7,5); гипотоническая
среда инкубации - 10 мМ Tris, 5 мМ NaH2PO4,
1 мМ EGTA (pH 7,5). В опытах с полной гипото-
нией использовали чистую дистиллированную
воду без добавок. Гипертоническая среда содер-
жала 300 мМ сахарозы, 10 мМ трис, 5 мМ
NaH2PO4, 1 мМ EGTA (pH 7,5).
Измерение потребления кислорода суспензи-
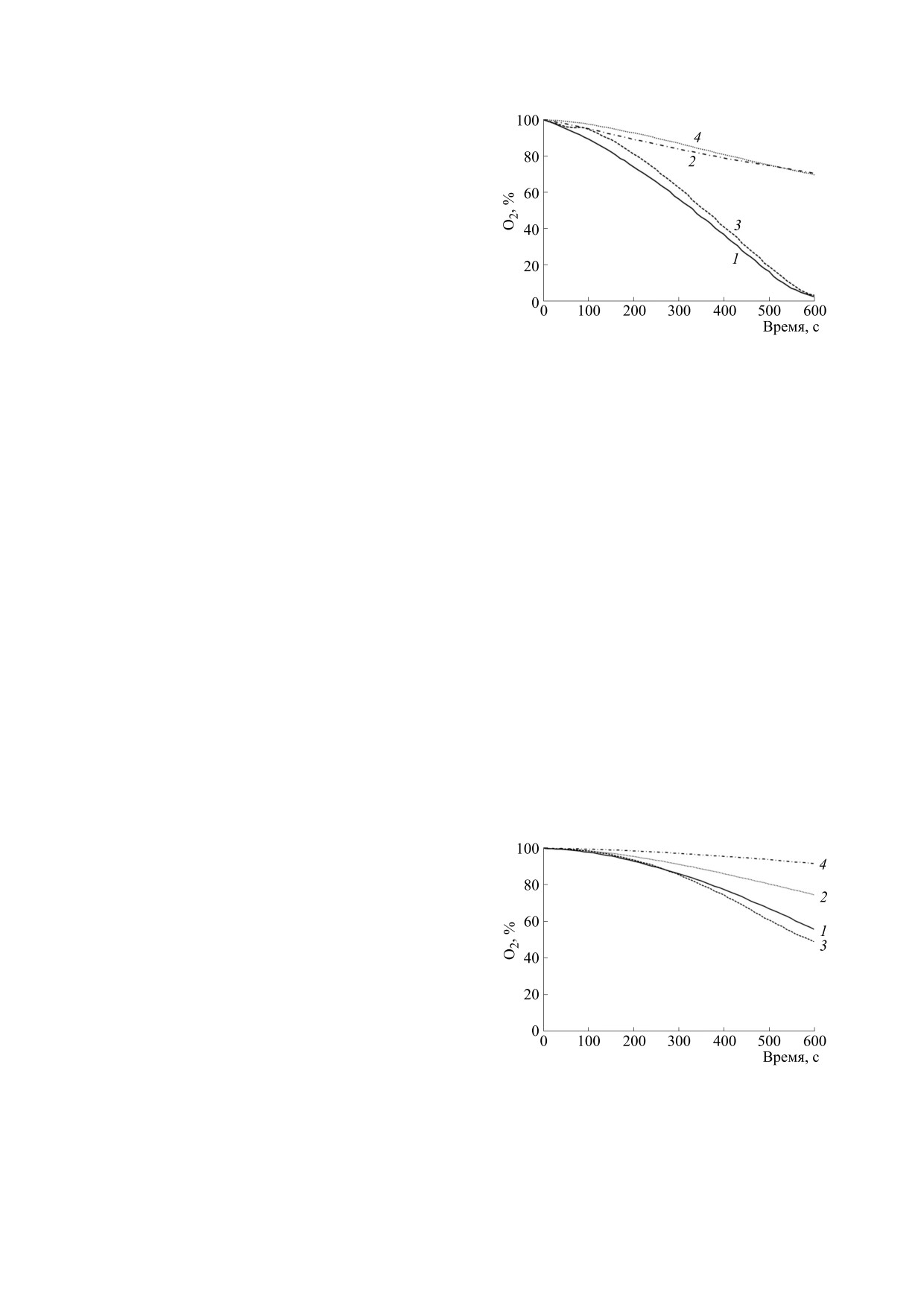
Рис. 1. Потребление кислорода в суспензии митохон-
ей митохондрий (в гипотонической, гипертони-
дрий (2 мг /мл) при добавке 5 мМ сукцината в изото-
нической среде без ядов (1), с 5 мМ азида натрия (2), с
ческой или изотонической среде при добавлении
5 мкМ ротенона (3) и с 5 мкМ антимицина А (4). По
сукцината или НАДН) проводили полярографи-
оси ординат - содержание кислорода в процентах,
ческим методом в 1,5-миллилитровой герметич-
100% соответствуют 250 мкМ кислорода в воде при
ной ячейке при перемешивании. Дыхание мито-
нормальном атмосферном давлении.
хондрий регистрировали, используя кларковский
электрод с термооксиметром
«Эксперт-001»
страта (данные по скорости - в таблице). Данный
(ООО «Эконикс», Москва). Приводятся средние
критерий назвали остаточным дыханием.
данные по 20-30 измерениям митохондрий, вы-
деленных из десяти животных. Погрешность в
Добавление сукцината к митохондриям при-
определении скорости дыхания не превышала
водит, как известно [9], к его окислению сукци-
0,001 мг/(л · мин). Остаточное дыхание рассчиты-
натдегидрогеназой с последующим переносом
валось по десятиминутным кинетикам после
электронов по дыхательной цепи на цитохромок-
усреднения 20-30 экспериментов, в расчете ско-
сидазу, на которой происходит восстановление
рости в одну минуту. Погрешность в определении
кислорода до воды. Наблюдаемое в изотониче-
остаточного дыхания не превышала 1%.
ской среде потребление кислорода на сукцинате
немного ускоряется в гипотонической среде, но
Концентрации антимицина А (до 5 мкМ) и
сильно подавляется в гипертонической (табли-
азида натрия (до 5 мМ) подбирали в изотониче-
ца). Это можно объяснить тем, что при гипото-
ской среде, добиваясь максимального подавле-
нии проницаемость мембран митохондрий воз-
ния дыхания митохондрий на 3 мМ сукцинате.
растает, а при гипертонии - снижается. Это озна-
Эти концентрации дыхательных ядов использо-
чает, что скорость дыхания лимитируется
вали далее для ингибирования поглощения кис-
пассивной проницаемостью мембран для сукци-
лорода, возникающего при окислении НАДН
ната, входящего в наших условиях внутрь просто
(800 мкМ) суспензией митохондрий в гипотони-
по градиенту (по-видимому, без участия какого-
ческой среде или воде (в изотонической среде на-
тивные митохондрии практически не окисляют
экзогенный НАДН). Концентрацию ротенона (до
5 мкМ) подбирали для максимального блокиро-
вания окисления НАДН непосредственно в при-
сутствии НАДН (без сукцината).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
С использованием полярографического мето-
да были детектированы кинетики потребления
кислорода в суспензии печеночных митохондрий
в течение 10 мин (рис. 1-5). В качестве оценочно-
го критерия эффективности дыхательных ядов
использовали отношение скорости потребления
кислорода в суспензии митохондрий при сов-
местном добавлении субстрата (сукцинат или
Рис. 2. Потребление кислорода в суспензии митохон-
НАДН) и яда (азид натрия, ротенон, антимицин
дрий (1 мг /мл) при добавке 5 мМ сукцината в гипото-
А) к скорости потребления кислорода в суспен-
нической среде без ядов (1), с 5 мМ азида натрия (2), с
зии митохондрий при добавлении только суб-
5 мкМ ротенона (3) и с 5 мкМ антимицина А (4).
БИОФИЗИКА том 64
№ 6
2019
1148
ЛЬВОВ, ВЕКШИН
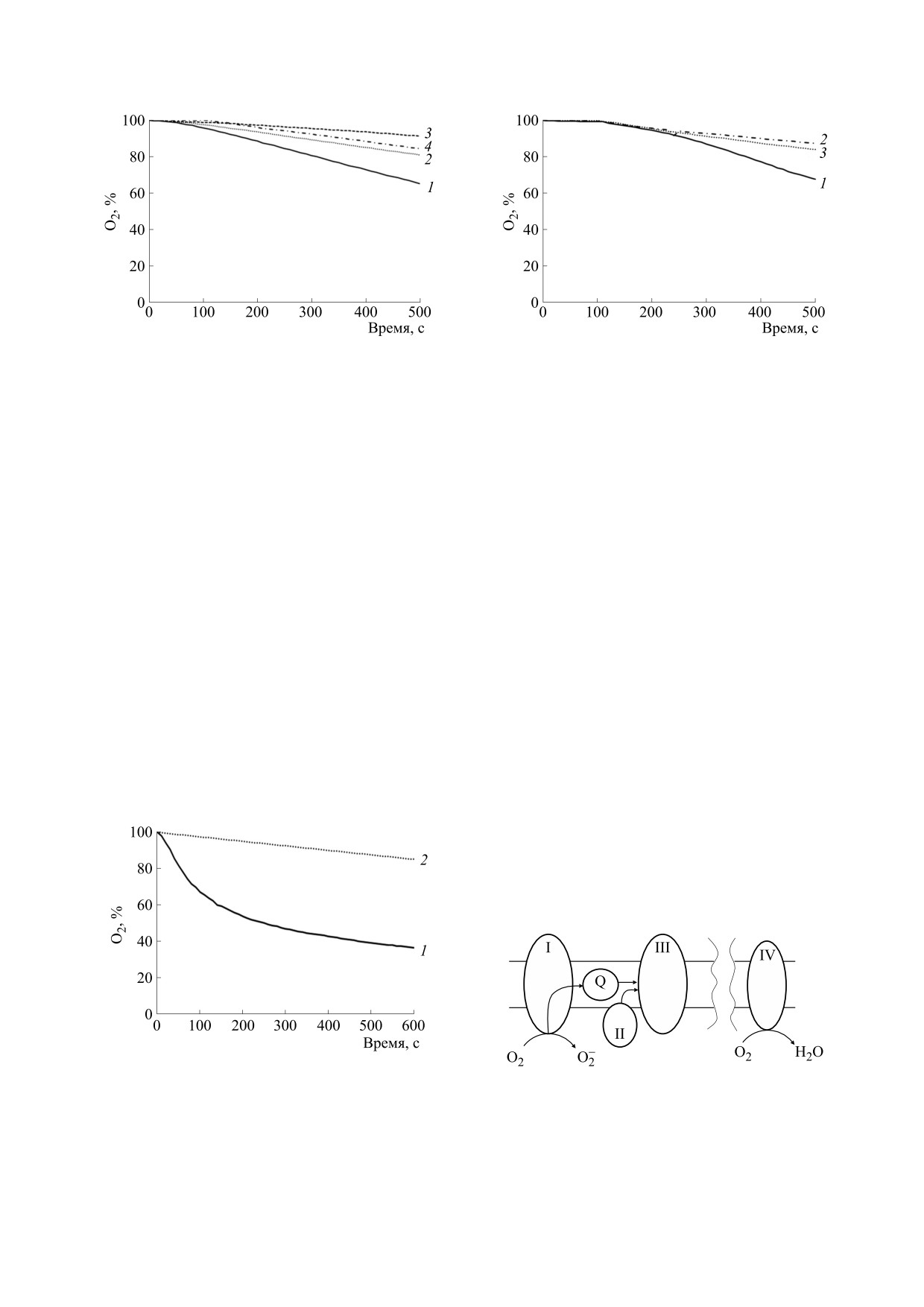
Рис. 3. Потребление кислорода в суспензии митохон-
Рис. 5. Потребление кислорода в суспензии митохон-
дрий (1 мг /мл) при добавке 800 мкМ НАДН в гипото-
дрий (1 мг /мл) при добавке 800 мкМ НАДН в гипото-
нической среде без ядов (1), с 5 мМ азида натрия (2), с
нической среде без ядов (1), с 5 мкМ ротенона (2) и с
5 мкМ ротенона (3) и с 5 мкМ антимицина А (4).
совместной добавкой 5 мМ азида натрия и 5 мкМ ан-
тимицина А (3).
либо специального транслоказного перенос-
чика).
хания на сукцинате означает, что либо перенос
электронов с сукцинатдегидрогеназы на цитохро-
Сукцинат-зависимое потребление кислорода
мы происходит без участия убихинона, либо роте-
подавляется, как известно [1], дыхательными
нон не является конкурентом убихинона, что ма-
ядами, например антимицином А и азидом на-
ловероятно.
трия, первый из которых блокирует перенос элек-
тронов на уровне цитохромов в и с, а второй - на
Добавление НАДН к интактным печеночным
уровне цитохромоксидазы. Антимицин А оказы-
митохондриям в изотонической среде не приво-
вал в наших опытах чуть большее ингибирующее
дило, как и следовало ожидать, к его окислению
действие на сукцинат-зависимое дыхание мито-
(таблица). Причиной этого является очень низ-
хондрий (остаточное дыхание 20%), чем азид на-
кая проницаемость внутренней мембраны для
трия (остаточное дыхание 30%) (рис. 1 и 2). При
НАДН [1]. В изотонии окисление НАДН в сус-
этом в условиях гипотонии антимицин ингиби-
пензии митохондрий имело место только при их
ровал дыхание практически полностью (рис. 2).
повреждении (особенно сильно при заморажива-
Ротенон на сукцинат-зависимое дыхание практи-
нии-размораживании; данные не приводятся).
чески не влиял, как и ожидалось. Считается, что
В гипотонической среде в суспензии митохон-
ротенон взаимодействует с сайтом связывания
дрий наблюдалось быстрое окисление НАДН
убихинона [1]. Хорошо известное (и повторенное
(таблица), не полностью подавляемое ингибито-
нами) отсутствие ингибирования ротеноном ды-
рами дыхательной цепи.
Интересно, что в гипертонической среде
(остаточное дыхание 24%) тоже возникало окис-
ление НАДН (таблица). По-видимому, в гиперто-
нической среде внутренняя мембрана поврежда-
ется и поэтому становится проницаемой для
Рис. 4. Потребление кислорода в суспензии митохон-
дрий (1 мг /мл) при добавке 800 мкМ НАДН в гипото-
Рис. 6.Схема работы ферментных комплексов I-IV
нической среде без ядов (1) и с совместной добавкой
дыхательной цепи в гипотонических условиях и/или
5 мМ азида натрия, 5 мкМ ротенона и 5 мкМ антими-
при блокировке ядами. Повреждение цепи в гипото-
цина А (2).
нии обозначено как разрыв мембраны.
БИОФИЗИКА том 64
№ 6
2019
НАДН-ОКСИДАЗНАЯ АКТИВНОСТЬ МИТОХОНДРИЙ
1149
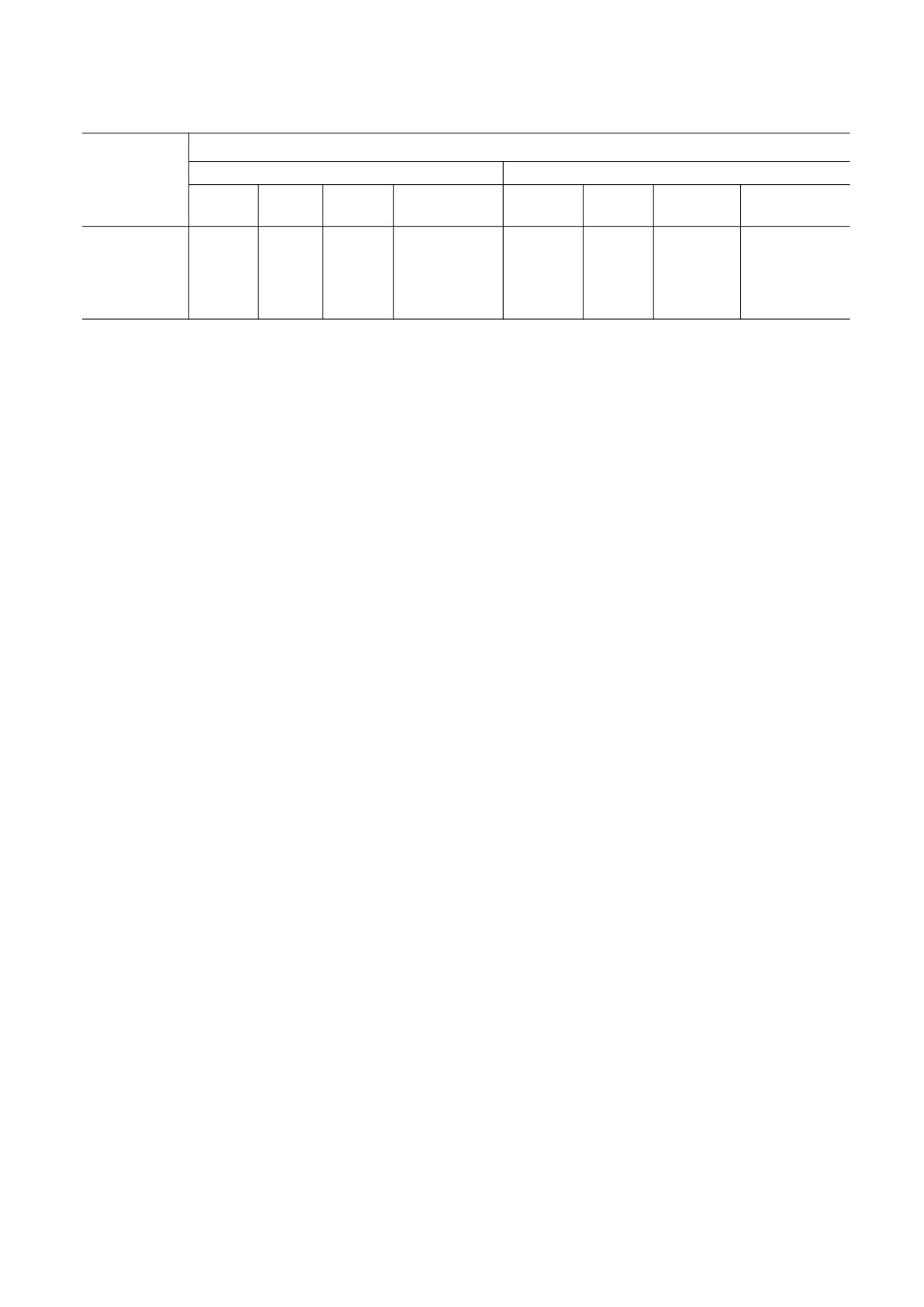
Скорость потребления кислорода суспензией митохондрий
Скорость потребления О2, мг/(л·мин)
НАДН
Сукцинат
Без
Без
NaN3
Ротенон
Антимицин А
NaN3
Ротенон
Антимицин А
добавок
добавок
Вода
0,07
0,055
0,03
0,03
0,34
0,05
0,25
0,05
Гипотония
0,085
0,045
0,025
0,035
0,11
0,05
0,11
0,02
Изотония
0,01
0,09
0,03
0,11
0,025
Гипертония
0,02
0,05
Примечание. Приводятся средние данные по 20-30 измерениям на митохондриях из десяти животных. Погрешность в
скорости не превышала 0,001 мг/л/мин.
НАДН (но остается не слишком проницаемой
фере с низкой ионной силой) происходит
для сукцината).
активнее, чем при полной гипотонии (в воде).
При использовании НАДН в качестве субстра-
Казалось бы, два яда - антимицин А и азид
та в гипотонической среде ротенон существенно
натрия - должны делать то же самое, что и
блокирует перенос электронов с НАДН-дегидро-
ротенон
- блокировать цепочку, полностью
геназы на убихинон [10], но в наших опытах оста-
устраняя дыхание. Однако они в условиях
валось заметное остаточное дыхание, составляю-
гипотонии подавляют НАДН-зависимое дыхание
щее 29%.
только частично, причем даже при применении
обоих ядов одновременно (рис. 5). Это означа-
В гипотонической среде окисление НАДН со-
ет, что последовательность переноса электронов
провождалось почти таким же сильным потреб-
с НАДН на кислород здесь совершенно иная,
лением кислорода, как при окислении сукцината
чем с сукцината. Иными словами, остаточное
(таблица). Скорость процесса лимитируется пас-
дыхание, не ингибируемое антимицином А и
сивной проницаемостью мембран для НАДН,
азидом натрия,
имеет место
не
на
входящего внутрь по градиенту (в наших услови-
цитохромоксидазе, а непосредственно на самой
ях - без участия какого-либо транслоказного пе-
НАДН-оксидазе. Его величина достигает
44%.
реносчика). Нужно подчеркнуть, что митохон-
Это автоматически означает образование боль-
дрии в гипотонии представляют собой не натив-
шого количества супероксида на НАДН-оксидазе.
ные органеллы, а тени, т. е. структуры с
На рис. 6 показана схема шунтирования элек-
поврежденными мембранами и почти без внут-
тронов с НАДН (в комплексе I) на молекулярный
реннего содержимого. Их наружная мембрана ча-
кислород (с образованием супероксида) вместо
стично разрушена, а значительная часть матрикса
нормального переноса на убихинон (коэнзим Q) и
выходит наружу, что приводит к падению свето-
далее.
рассеяния [11].
Такое шунтирование может в принципе воз-
НАДН-зависимое дыхание подавляется, как
никать в клеточных митохондриях не только при
известно [10], ротеноном, блокирующим перенос
отравлении дыхательными ядами, но и при
электронов с железо-серных кластеров НАДН-
утрате солей, при отеках и других случаях, когда
дегидрогеназы на убихинон. Ротенон в наших
клетки попадают в экстремальные гипотони-
условиях сильно подавлял потребление кислоро-
ческие условия. В этих случаях потребление
да (рис. 3). Это означает, что нет никакой «внеш-
кислорода на цитохромоксидазе (комплекс IV)
ней» (в наружной мембране) ротенон-нечувстви-
будет минимальным, а на НАДН-окисдазе
тельной НАДН-дегидрогеназы, что согласуется с
(комплекс I) - максимальным. При этом в таких
нашими специальными исследованиями [12,13].
условиях потребление кислорода на цитохром-
Из рис. 3 видно, что в гипотонической среде
оксидазе может активироваться только напрямую
антимицин А или азид натрия подавляют НАДН-
(без участия комплексов I, II и III), например
зависимое дыхание митохондрий не полностью.
аскорбатом.
Антимицин А подавляет сильнее (остаточное ды-
хание 41%), чем азид натрия (остаточное дыхание
Количество супероксида, образующегося на
53%). Обращает внимание на себя тот факт, что в
НАДН-дегидрогеназе в митохондриях, должно
условиях гипотонии даже одновременное сочета-
значительно увеличиваться в экстремальных
ние всех трех ядов не ингибирует дыхания полно-
условиях: в гипотонической среде и при блоки-
стью (рис. 4). Как видно из таблицы, ингибирова-
ровке дыхательными ядами, что действительно
ние ядами в условиях умеренной гипотонии (в бу-
имеет место [13].
БИОФИЗИКА том 64
№ 6
2019
1150
ЛЬВОВ, ВЕКШИН
Кроме того, полученные данные по сильному
2. R. G. Hansford, B. A. Hogue, and V. Mildaziene, J. Bio-
ингибированию дыхания антимицином А или
energ. Biomembr. 29 (1), 89 (1997).
азидом натрия на сукцинате, но существенно бо-
3. M. P. Murphy, Biochem. J. 417 (1), 1 (2009).
лее слабому на НАДН, позволяют предположить,
что дыхательная цепь не линейна, а разветвлена,
4. J. F. Turrens and A. Boveris, Biochem. J. 191 (2), 421
состоит как минимум из двух цепей, соединяю-
(1980).
щихся на уровне цитохромов, а не убихинона. Это
5. F. L. Muller, Y. Liu, M. A. Abdul-Ghani, and M. S. Lust-
делает ее менее уязвимой. Данный вопрос требует
garten, Biochem. J. 409 (2), 491 (2008).
отдельного изучения.
6. A. Boveris and E. Cadenas, FEBS Lett. 54 (3), 311
(1975).
КОНФЛИКТ ИНТЕРЕСОВ
7. M. S. Frolova and N. L. Vekshin, J. Fluores. 24, 1061
Авторы заявляют об отсутствии конфликта
(2014).
интересов.
8. N. L. Vekshin, Photonics of Biopolymers (Springer,
Berlin, 2002).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
9. В. П. Скулачев, А. В. Богачев и Ф. О. Каспарин-
ский, Мембранная биоэнергетика (МГУ, М., 2010).
Все применимые международные, националь-
10. B. Chance and G. Hollunger, J. Biol. Chem. 278 (1),
ные и институциональные принципы ухода и ис-
418 (1963).
пользования животных при выполнении работы
11. Д. Н. Курдюков и Н. Л. Векшин, Биофизика 61 (4),
были соблюдены.
736 (2016).
12. И. В. Шарова и Н. Л. Векшин, Биофизика 49 (5),
СПИСОК ЛИТЕРАТУРЫ
814 (2004).
13. Н. Л. Векшин, Биофизика митохондрий (Фотон-
1. А. Ленинджер, Биохимия (Мир, М., 1974).
Век, Пущино, 2019).
NADH-Oxidase Activity of Mitochondria in Hypotonia
in the Presence of Respiratory Chain Inhibitors
A.M. Lvov and N.L. Vekshin
Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
Contribution of NADH oxidase to mitochondrial respiration in the suspension under extreme conditions: in
a hypotonic environment and in the presence of respiratory poisons such as rotenone, antimycin and azide
has been studied. The experiment was carried out on rat liver mitochondria. It was shown that in oxidation of
added NADH not only cytochrome oxidase, but also NADH dehydrogenase of the respiartory chain remark-
ably consume oxygen. This is the reason why NADH-limked mitochndrial respiration is not completely in-
hibited by respiratory poisons. Insensitivity of respiration to poisoning is the result of a shunt of electron
transfer from NADH to oxygen with direct involvement of NADH-dehydrogenase. This residual respiration
insensitive to respiratory chain inhibitors in NADH-oxidase under extreme conditions may account for one
half of the total oxygen consumption.
Keywords: mitochondria, hypotonia, oxygen consumption, superoxide, NADH-dehydrogenase, rotenone, antimy-
cin, azide, respiratory chain
БИОФИЗИКА том 64
№ 6
2019