БИОФИЗИКА, 2019, том 64, № 6, с. 1200-1207
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 577.3
ИЗУЧЕНИЕ АНТИОКСИДАНТНЫХ И РАДИОПРОТЕКТОРНЫХ СВОЙСТВ
ИЗОБОРНИЛФЕНОЛОВ ПРИ РЕНТГЕНОВСКОМ ОБЛУЧЕНИИ
В МАЛОЙ ДОЗЕ
© 2019 г. Л.Н. Шишкина, А.Ю. Бабкин, М.А. Климович, М.В. Козлов, Л.И. Мазалецкая,
Н.И. Шелудченко, И.Ю. Чукичева*, И.В. Федорова*, А.В. Кучин*
Институт биохимической физики им. Н.М. Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
*Институт химии Коми научного центра Уральского отделения РАН,
167000, Сыктывкар, Первомайская ул., 48, Республика Коми
E-mail: shishkina@sky.chph.ras.ru
Поступила в редакцию 02.11.2018 г.
После доработки 25.06.2019 г.
Принята к публикации 04.07.2019 г.
Изучены эффективность ингибирования и радиопротекторные свойства двух изоборнилфенолов
при их введении за 30 мин до рентгеновского облучения беспородных мышей (самки) в дозе 50 сГр.
Установлено, что высокая ингибирующая эффективность 1,3-дигидрокси-4,6-диизоборнилбензола
обусловлена взаимодействием с пероксирадикалами. Профилактическое введение 2-изоборнилок-
сифенола нормализует индекс селезенки и содержание продуктов перекисного окисления липидов
в плазме крови облученных мышей, показатели, ранее предложенные в качестве тестов для оценки
противолучевых свойств препаратов при облучении лабораторных животных в малых дозах. Выяв-
лена нежелательность применения водного раствора этанола как растворителя для введения гидро-
фобных соединений в организм при слабых радиационных воздействиях. Полученные данные и
анализ литературы позволяют предположить перспективность применения изоборнилфенолов как
противолучевых средств при радиационных воздействиях в разных диапазонах доз.
Ключевые слова: изоборнилфенолы, антиоксидантная активность, перекисное окисление липидов,
рентгеновское излучение, малые дозы, радиопротекторные свойства.
DOI: 10.1134/S000630291906019X
процессов окисления, обусловленную активаци-
Различие ведущих молекулярных механизмов
ей активных форм кислорода, в качестве основ-
формирования последствий воздействия ионизи-
ной причины развития окислительного стресса,
рующих излучений на организм [1,2] обусловли-
играющего важную роль медиатора поражения
вает отсутствие универсальных противолучевых
мембран, липидов, белков, ДНК и других компо-
средств, обеспечивающих защиту биологических
нентов клетки [7,8]. Система окислительно-вос-
объектов от повреждающего воздействия иони-
становительного гомеостаза играет важную роль в
зирующих излучений во всех диапазонах доз [3,4].
формировании радиационно-индуцированной
Это следует из сформулированных еще в 70-х го-
нестабильности генома [9].
дах прошлого столетия представлений о том, что
не только ДНК, но и мембрана является мише-
В системе защиты организма от острого облу-
нью действия ионизирующих излучений на био-
чения в сублетальных и летальных дозах более
логические объекты. Процессы перекисного
эффективными оказались синтетические соеди-
окисления липидов (ПОЛ), протекающие на
нения и цитокины, однако при облучении в ма-
мембранном, клеточном и органном уровнях, от-
лых дозах преимущество отдается препаратам
носятся к одним из наиболее древних в эволюци-
природного происхождения
[4,10-14]. Поиск
онном плане регуляторных механизмов. Это поз-
средств защиты от действия ионизирующих излу-
воляет рассматривать их как нормальный физио-
чений в малых дозах в настоящее время становит-
логический процесс [5,6], а интенсификацию
ся все более актуальным в связи с широким ис-
пользованием источников ионизирующих излу-
Сокращения: ПОЛ
- перекисное окисление липидов;
чений в медицинской практике и повседневной
ИБФ - изоборнилфенол; ТБК-активные продукты
-
жизни человека. Это вызывает необходимость
продукты окисления, реагирующие с 2-тиобарбатуровой
поиска эффективных, недорогих и нетоксичных
кислотой; ИС - инлекс селезенки; ИП - индекс печени.
1200
ИЗУЧЕНИЕ АНТИОКСИДАНТНЫХ И РАДИОПРОТЕКТОРНЫХ СВОЙСТВ
1201
Рис. 1. Структурные формулы изученных соединений.
радиопротекторных средств, среди которых боль-
лоты. Кинетику поглощения кислорода в процес-
шую группу соединений представляют препара-
се окисления регистрировали с помощью высо-
ты, обладающие способностью тормозить про-
кочувствительной
волюмометрической
цессы ПОЛ при введении в организм. В послед-
установки при 333 К и скорости инициирования
ние годы усилия исследователей направлены на
Wi = (5-10) · 10-8 моль/(л·с). Этилбензол с рас-
поиск новых полусинтетических антиоксидан-
творенным инициатором предварительно термо-
тов, обладающих меньшей токсичностью по
статировали, после чего вводили добавку веще-
сравнению с синтетическими соединениями. В
ства. Из кинетических кривых поглощения кис-
качестве перспективных рассматриваются и ак-
лорода определяли величину периода индукции
тивно изучаются изоборнилфенолы (ИБФ), ки-
(τ) по методу [18] и начальную скорость поглоще-
нетические характеристики и физико-химиче-
ния кислорода.
ские свойства которых обобщены в работе [15].
Антиоксидантные свойства ИБФ 2 изучали
Целью данной работы являлись оценка инги-
при автоокислении метилолеата в тонком слое
бирующей эффективности и изучение радиопро-
при свободном доступе воздуха (323 К). Вещество
текторных свойств двух ИБФ при их введении
в метилолеат вводили в этиловом спирте. Исход-
мышам за 30 мин до воздействия рентгеновского
ная доля спирта в общем объеме реакционной
излучении в дозе 50 сГр.
смеси во всех опытах была постоянной и состав-
ляла 4%. За ходом окисления следили по накоп-
МАТЕРИАЛЫ И МЕТОДЫ
лению гидропероксидов (ROOH), концентрацию
которых определяли методом йодометрического
Объектами исследования были белые беспо-
титрования (ГОСТ
26593-85). Эффективность
родные мыши (самки) массой 20,5-25 г, общее
ингибирующего действия добавок определяли по
количество животных 80 особей, возраст к мо-
величине периода индукции (τ1). За τ1 принимали
менту облучения составлял 10-11 недель. Живот-
отрезок времени от нуля до перпендикулярной
ных содержали в стандартных условиях вивария в
проекции на ось времени точки пересечения двух
соответствии с правилами, разработанными Ев-
линейных участков кинетической кривой накоп-
ропейской конвенцией о защите животных, ис-
ления -ROOH, соответствующих начальной и
пользуемых для экспериментальных целей.
максимальной скорости образования пероксидов
2-Изоборнилоксифенол (ИБФ 1) и 1,3-дигид-
[19].
рокси-4,6-диизоборнил-бензол (ИБФ 2) раство-
Мышей (корм из клеток был вынут накануне
ряли в 9,5%-м водном этаноле и вводили внутри-
вечером) облучали в специальных контейнерах
брюшинно в дозах 5 и 7,8 мг/кг массы мыши со-
группами по 10 особей, располагая каждую мышь
ответственно (10-5 моль/л). Синтез изученных
в отдельной ячейке с сохранением свободы дви-
ИБФ, подробно представленный в работах
жения, однократно на рентгеновской установке
[16,17], осуществляли путем алкилирования двух-
РУМ-17 («Мосрентген», Россия) в суммарной до-
атомных фенолов камфеном в присутствии раз-
зе 50 сГр (мощность дозы 16 сГр/мин; фильтр
личных гомогенных и гетерогенных катализато-
Al+Cu 0,5 мм) с 11.05 до 11.25 ч, чтобы исключить
ров: эффективным катализатором для получения
влияния суточных колебаний антиокислитель-
ИБФ 1 является сульфокатионит Фибан К-1 [16],
ной активности липидов тканей [20]. Предвари-
а для ИБФ 2 - изопропилат алюминия [17].
тельно мыши были разделены на восемь близких
Структурные формулы исследованных в работе
по массе тела групп:
ИБФ представлены на рис. 1.
- К - исходная контрольная группа;
Ингибирующую активность ИБФ 2 изучали в
модельной реакции окисления этилбензола, ини-
- группа 1 - введение 9,5%-го водного раство-
циированного динитрилом азоизомасляной кис-
ра этанола;
БИОФИЗИКА том 64
№ 6
2019
1202
ШИШКИНА и др.
- группа 2 - введение 9,5%-го водного этанола
РЕЗУЛЬТАТЫ
за 30 мин до облучения в дозе 50 сГр;
При введении в организм животных антиокси-
- группа 3 - введение раствора ИБФ 1 в 9,5%-м
данты являются эффективными регуляторами
водном растворе этанола;
окислительных процессов, играющих важную
роль в клеточном метаболизме в норме и при дей-
- группа 4 - введение раствора ИБФ 2 в 9,5%-м
ствии повреждающих факторов. При этом радио-
водном растворе этанола;
защитная эффективность антиоксидантов суще-
ственно зависит от величины их константы ско-
- группа 5 - введение раствора ИБФ 1 в 9,5%-м
рости реакции с пероксидными радикалами (k7),
водном растворе этанола за 30 мин до облучения в
дозе 50 сГр;
а исходный антиоксидантный статус тканей игра-
ет важную роль в проявлении противолучевых
- группа 6 - введение раствора ИБФ 2 в 9,5%-м
свойств и синтетических, и природных антиокси-
водном растворе этанола за 30 мин до облучения в
дантов [13]. Это обусловлено тем, что эффектив-
дозе 50 сГр;
ность ингибирующего действия антиоксидантов
- группа 7 - интактный возрастной контроль.
в сложных системах определяется не только спо-
собностью реагировать с ведущими цепи окисле-
Забой мышей, корм у которых был убран зара-
ния пероксирадикалами, но и их участием в по-
нее, был осуществлен декапитацией. Кровь отби-
бочных реакциях.
рали в пробирки, обработанные 5%-м раствором
В настоящее время экспериментально показано,
цитрата натрия. Плазму от форменных элементов
что все ферменты антиоксидантной защиты явля-
крови отделяли центрифугированием, используя
ются субстрат-индуцируемыми, что обусловливает
лабораторную клиническую центрифугу ОПн-3
участие антиоксидантов на первых этапах зашиты
(АО ТНК «Дастан», Кыргызская Республика),
организма вследствие их взаимодействия с актив-
при 1500 об/мин в течение 5 мин. Печень и селе-
ными формами кислорода, концентрация которых
зенку сразу после забоя помещали в бюксы, охла-
увеличивается при воздействии ионизирующих из-
ждаемые льдом. Содержание продуктов окисле-
лучений. Это вызывает необходимость оценить спо-
ния, реагирующих с 2-тиобарбатуровой кислотой
собность вновь синтезированных соединений тор-
(ТБК-активных продуктов), определяли по мето-
мозить процессы окисления сначала в модельных
ду, описанному в работе [21]. Концентрацию бел-
системах. Поэтому первым этапом работы явилось
ка анализировали микробиуретовым методом
изучение антирадикальной активности ИБФ 2, ОН-
[22], используя в качестве стандарта бычий сыво-
группы которого расположены в м-положении от-
роточный альбумин в диапазоне концентраций от
носительно друг друга и содержат два изоборниль-
0,09 до 0,76 мг/мл. Коэффициенты корреляции
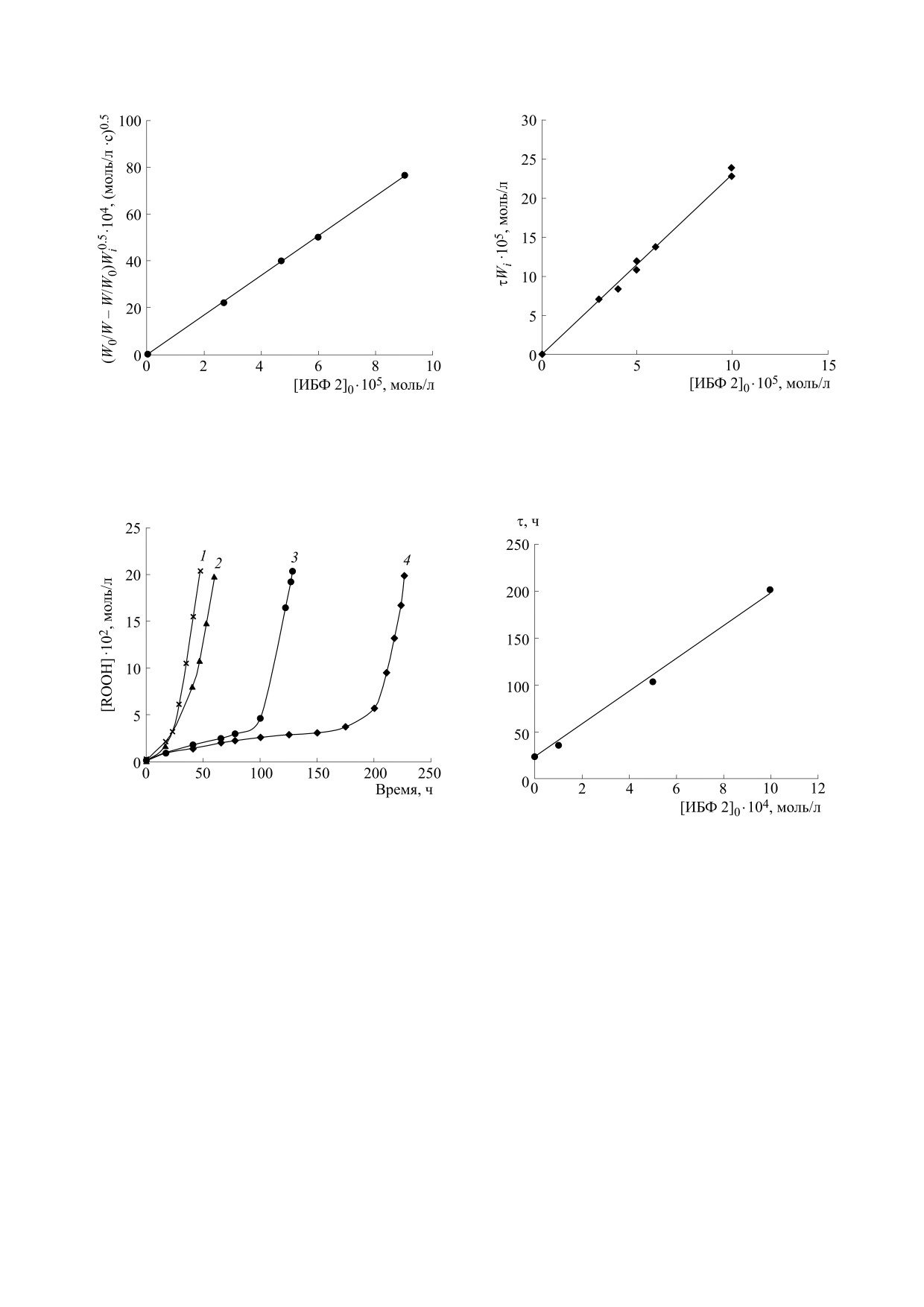
ных заместителя (рис. 1). Для определения величи-
калибровочных прямых R варьируют в пределах
ны параметра ингибирования - fk7, где k7 - кон-
0,99-1,0. Анализ количества ТБК-активных про-
станта скорости взаимодействия ИБФ
2 с
дуктов и белка в каждой пробе проводили в трех
пероксирадикалами, а f - стехиометрический коэф-
параллельных измерениях.
фициент ингибирования, начальные скорости
Для определения исходных биохимических по-
окисления в присутствии ИБФ (W) представляли в
казателей в партии мышей забой мышей группы К
координатах уравнения (W0/W - W/W0) × Wi0,5 =
был проведен в начале эксперимента. Для оценки
=fk7[ИБФ 2]0/k60,5, где W0 - скорость окисления в
отдаленных последствий воздействия все осталь-
ные группы мышей забивали одновременно спустя
отсутствие добавок, а k6 - константа скорости квад-
30 суток после начала экспериментов, в том числе
ратичной рекомбинации радикалов RО2• (рис. 2).
и группу возрастного контроля. Определяли как
Из тангенса угла наклона полученой прямой (рис. 2)
абсолютную, так и относительную массу (индекс)
определили величину параметра ингибирования
селезенки и печени, выраженную как отношение
массы органа в мг к массе особи в г (‰). Определе-
fk7 = 3,7·105 л/(моль · с). Для расчета величины кон-
ние всех изученных показателей проводили инди-
станты k7 из зависимости τWi = f[ИБФ 2]0 (рис. 3)
видуально для каждой особи в день забоя живот-
определили значение стехиометрического коэффи-
ных.
циента ингибирования, которое оказалось равным
f = 2,3. Эта величина превышает значение f = 2 для
Для статистической обработки результатов ис-
монофенолов и замещенных пирокатехина и гидро-
пользовали стандартные методы вариационной
хинона, у которых за счет образования энергетиче-
статистики, достоверность различий оценивали с
ски выгодной хиноидной структуры с OH-группой
помощью t-критерия Стьюдента [23]. Экспери-
взаимодействует только один свободный радикал. С
ментальные данные представлены в виде средне-
учетом полученного значения f = 2,3 величина кон-
арифметических значений с указанием средне-
станты скорости реакции ИБФ 2 с пероксирадика-
квадратичной ошибки средней арифметической
величины (M ± m).
лами этилбензола равна k7 = 1,6 · 105 л/(моль · с), что
БИОФИЗИКА том 64
№ 6
2019
ИЗУЧЕНИЕ АНТИОКСИДАНТНЫХ И РАДИОПРОТЕКТОРНЫХ СВОЙСТВ
1203
Рис. 2. Зависимость начальной скорости ингибиро-
Рис. 3. Зависимость периода индукции τ, рассчитанно-
ванного окисления этилбензола от начальной концен-
го из кинетических кривых поглощения кислорода
трации изоборнилфенола 2 в координатах уравнения
при инициироованном окислении этилбензола, от на-
(W0/W - W/W0) · Wi0,5 = fk7[ИБФ 2]0/k60,5.
Темпера-
чальной концентрации изоборнилфенола 2. Темпера-
тура 333 К.
тура 333 К.
Рис. 4. Кинетические кривые накопления гидроперок-
Рис. 5. Зависимость периода индукции, определенного
сида при автоокислении метилолеата в тонком слое при
из кинетических кривых накопления пероксидов при
323 К в отсутствие (1) и в присутствии изоборнилфенола
автоокислении метилолеата в тонком слое, от началь-
2 в концентрациях 1 · 10-4 (2), 5 · 10-4 (3) и 1 · 10-3 (4)
ной концентрации изоборнилфенола 2. Температура
моль/л.
323 К.
свидетельствует о его весьма высокой антиради-
для зависимости периода индукции от начальной
кальной активности по отношению к пероксиради-
концентрации соединения и обусловливающие
калам. Ранее для ИБФ 1 была выявлена достаточно
снижение его эффективности. На рис. 4 пред-
низкая ингибирующая эффективность, обусловлен-
ставлены кинетические кривые накопления гид-
ная наличием в молекуле внутримолекулярной во-
ропероксида метилолеата при различных кон-
дородной связи [24].
центрациях ИБФ 2. Из представленных данных
видно, что увеличение количества введенного
Антиокислительную активность ИБФ 2 изучи-
препарата приводит к увеличению времени тор-
ли в модельной системе автоокисления метило-
леата, т. е. в условиях, в которых могут проявлять
можения процесса окисления, при этом величина
себя побочные реакции с участием антиоксидан-
периода индукции линейно возрастает с увеличе-
тов, приводящие к отклонению от линейности
нием его начальной концентрации (рис. 5). Ли-
БИОФИЗИКА том 64
№ 6
2019
1204
ШИШКИНА и др.
Таблица 1. Величины относительной массы (индекса) селезенки в контрольных и опытных группах беспородных
мышей (самки)
Условия эксперимента (группа мышей)
Индекс селезенки (‰)
Исходный контроль (группа К)
3,58 ± 0,21
Возрастной контроль (группа 7)
4,20 ± 0,26
30 суток после введения 9,5%-го водного раствора этанола (группа 1)
4,30 ± 0,30
30 суток после введения 9,5%-го водного раствора этанола за 30 мин до облучения
3,94 ± 0,33
в дозе 50 сГр (группа 2)
30 суток после введения ИБФ 1 в 9,5%-м водном растворе этанола (группа 3)
4,20 ± 0,29
30 суток после введения ИБФ 2 в 9,5%-м водном растворе этанола (группа 4)
4,70 ± 0,36
30 суток после введения ИБФ 1 в 9,5%-м водном растворе этанола за 30 мин
4,44 ± 0,33
до облучения в дозе 50 сГр (группа 5)
30 суток после введения ИБФ 2 в 9,5%-м водном растворе этанола за 30 мин до
4,80 ± 0,50
облучения в дозе 50 сГр (группа 6)
нейная зависимость τ1 от концентрации ИБФ 2
ионизирующих излучений в малых дозах. Это
свидетельствует о незначительном влиянии по-
обусловило выбор данных показателей для оцен-
бочных реакций в механизме ингибирования им
ки противолучевых свойств исследованных со-
процесса автоокисления в исследованном интер-
единений. Результаты анализа величин индекса
вале концентраций.
селезенки мышей спустя 30 суток после внутри-
брюшинного введения препаратов представлены
Поскольку антиоксидантный статус биологи-
в табл. 1.
ческих объектов подвержен выраженным сезон-
ным и суточным колебаниям, а величина анти-
Как видно из представленных данных, введе-
окислительной активности липидов тканей явля-
ние и
9,5%-го водного раствора этанола
ется одним из важных факторов для оценки
(группа 1), и раствора ИБФ 1 в 9,5%-м водном
эффективности радиозащитных свойств препа-
растворе этанола в дозе 5 мг/кг (группа 3) через
ратов [13,20], то следующим этапом работы яви-
месяц после воздействия не оказывают достовер-
лась оценка исходного антиоксидантного статуса
ного влияния на величины ИС (значение показа-
партии мышей группы К в день начала экспери-
теля соответствуют величине ИС у возрастного
мента. В сложных биологических системах ин-
контроля и в группе 1). Введение ИБФ 2 в том же
тенсивность ПОЛ обычно оценивают по содер-
растворе в дозе 7,8 мг/кг (группа 4) через месяц
жанию ТБК-активных продуктов в тканях мы-
после воздействия вызывает хотя и незначитель-
шей
[25]. В работе было обнаружено, что
ный (на 12%), но достоверный рост показателя и
концентрации ТБК-активных продуктов равны
относительно величины у возрастного контроля
0,244 ± 0,0255 и 0,0131 ± 0,0011 нмоль/мг белка
(p < 0,001), и по сравнению со значением у мышей
для плазмы крови и печени соответственно. Это
группы 1 (p < 0,01), которым однократно вводили
свидетельствует о низкой интенсивности процес-
только водный раствор этанола.
сов ПОЛ в тканях мышей и согласуется с данны-
Несколько иная картина выявлена спустя ме-
ми литературы о высоком антиоксидантном ста-
сяц после совместного действия ИБФ и острого
тусе лабораторных грызунов в зимний сезон [20].
рентгеновского излучения в относительно малой
Морфометрические показатели, являющиеся
дозе 50 сГр (табл. 1). Прежде всего необходимо
индикаторами физиологического состояния и
отметить, что введение 9,5%-го водного раствора
позволяющие судить о напряженности обменно-
этанола вызывает некоторое снижение средней
го баланса в организме, обычно используются в
величины ИС мышей в группе 2, хотя можно го-
экологических исследованиях для выявления по-
ворить лишь о тенденции такого изменения. Спу-
следствий воздействия техногенного загрязнения
стя 30 суток после совместного действия рентге-
окружающей среды на организм [26,27]. Тем не
новского излучения и ИБФ, введенных за 30 мин
менее в работах [28,29] было показано, что и в ла-
до облучения, обнаружен рост ИС в обоих случа-
бораторных экспериментах индекс селезенки
ях по сравнению со значением показателя в груп-
(ИС) и содержание ТБК-активных продуктов в
пе 2, мыши которой получали только водный рас-
плазме крови являются чувствительными тестами
тор этанола (табл. 1). Однако если в случае ИБФ 1
для оценки биологических эффектов воздействия
достоверное (p < 0,01) увеличение ИС происходит
БИОФИЗИКА том 64
№ 6
2019
ИЗУЧЕНИЕ АНТИОКСИДАНТНЫХ И РАДИОПРОТЕКТОРНЫХ СВОЙСТВ
1205
Таблица 2. Содержание ТБК-активных продуктов в плазме крови контрольных и опытных групп беспородных
мышей (самки)
Условия эксперимента (группа мышей)
[ТБК-АП], нмоль/мг белка
Возрастной контроль (группа 7)
0,0748 ± 0,0089
30 суток после введения 9,5%-го водного раствора этанола (группа 1)
0,0656 ± 0,0066
30 суток после введения 9,5%-го водного раствора этанола за 30 мин до облучения
0,0624 ± 0,0084
в дозе 50 сГр (группа 2)
30 суток после введения ИБФ 1 в 9,5%-м водном растворе этанола (группа 3)
0,0489 ± 0,0066
30 суток после введения ИБФ 2 в 9,5%-м водном растворе этанола (группа 4)
0,0739 ± 0,0047
30 суток после введения ИБФ 1 в 9,5%-м водном растворе этанола за 30 мин до
0,0755 ± 0,0100
облучения в дозе 50 сГр (группа 5)
30 суток после введения ИБФ 2 в 9,5%-м водном растворе этанола за 30 мин
0,0960 ± 0,0190
до облучения в дозе 50 сГр (группа 6)
Примечание. ТБК-АП - ТБК-активные продукты (продукты окисления, реагирующие с 2-тиобарбитуровой кислотой).
только до величины в группе возрастного контро-
месяц после введения ИБФ 2 в водном растворе
ля, то при введении ИБФ 2 обнаружен достовер-
этанола выявлен как относительно значения у
ный рост показателя на 11,7% (p < 0,01) и 21,8%
возрастного контроля на 28,6% (p < 0,01), так и по
(p < 0,001) относительно аналогичных значений в
сравнению с величиной в группе мышей 2 - в
группах мышей 7 и 2 соответственно (табл. 1).
1,5 раза (p < 0,001) (табл. 2).
Следует отметить, что спустя 30 суток введе-
ние 9,5%-го водного раствора этанола приводит к
ОБСУЖДЕНИЕ
некоторому снижению содержания продуктов
окисления в плазме крови мышей (табл. 2), как и
Полученные результаты показывают, что спу-
введение 9,5%-го водного раствора этанола за 30
стя месяц после воздействия как при введении
мин до воздействия рентгеновского излучения в
исследованных ИБФ интактным мышам, так и
дозе 50 сГр (табл. 2). При этом изученные ИБФ
при совместном действии препаратов и рентге-
оказывают разное влияние на интенсивность
новского облучения животных в дозе 50 сГр био-
процессов ПОЛ в плазме крови. Так, через месяц
логические последствия существенно различают-
после воздействия содержание ТБК-активных
ся в зависимости от химической структуры ИБФ.
продуктов в плазме крови мышей, которым ИБФ
Так, ИБФ 1 вызывает нормализацию интенсив-
2 вводили в водном растворе этанола, практиче-
ности ПОЛ в плазме крови облученных мышей и
ски такое же, как значение показателя у возраст-
поддерждивает значение ИС также на уровне по-
ного контроля и на 13% (p < 0,02) превышает ве-
казателя в группе возрастного контроля. Введе-
личину в группе 1. Через месяц после введения
ние ИБФ 2 и/или применение этого препарата
ИБФ 1 в водном растворе этанола содержание
при совместном действии с рентгеновским излу-
ТБК-активных продуктов в плазме крови мышей
чением обусловливает достоверные различия и
достоверно снижено в 1,3 (p < 0,001) и 1,5
ИС, и интенсивности ПОЛ в плазме крови мы-
(p < 0,001) раза относительно величины показате-
шей относительно аналогичных показателей
ля и у возрастного контроля, и в группе мышей,
в группах возрастного контроля и опытных груп-
которым вводили только водный раствор этано-
пах мышей, которым вводили водный раствор
ла, соответственно (табл. 2).
этанола.
Иная картина последствий наблюдается после
Кроме того, необходимо отметить следующее
совместного действия ИБФ и рентгеновского из-
обстоятельство. Через месяц после введения мы-
лучения. Так, интенсивность ПОЛ в плазме кро-
шам только 9,5%-го водного раствора этанола не
ви мышей, которым вводили водно-спиртовый
обнаружено достоверных различий как индексов
раствор ИБФ 1 за 30 мин до облучения (группа 5),
селезенки (табл. 1) и печени (ИП = 42,2 ± 1,0‰ в
достоверно не отличается от значения в группе
группе 1), так и содержания ТБК-активных про-
возрастного контроля и лишь на 21,1% (p < 0,1)
дуктов в плазме крови (табл. 2) по сравнению с
выше по сравнению с величиной показателя в
величинами показателей в группе возрастного
группе 2 (табл. 2). В то же время достоверный рост
контроля (ИП = 45,1 ± 2,1‰). Однако при сов-
интенсивности ПОЛ в плазме крови мышей через
местном действии 9,5%-го водного раствора эта-
БИОФИЗИКА том 64
№ 6
2019
1206
ШИШКИНА и др.
нола и рентгеновского излучения в дозе 50 сГр
ний для отбора среди терпенофенольных полу-
выявлена четкая гетерогенность ИП: у одной по-
синтетических антиоксидантов наиболее пер-
ловины опытной группы 2 ИП достоверно увели-
спективных соединений в качестве возможных
чивался, достигая значения 47,7 ± 1,25‰ (n = 5),
радиопротекторов.
а у второй половины достоверно уменьшился до
величины 37,1 ± 1,7‰ (n = 5). Эти данные свиде-
ФИНАНСИРОВАНИЕ РАБОТЫ
тельствуют о нежелательности использования
водного раствора этанола как растворителя для
Работа выполнена при финансовой поддержке
введения гидрофобных препаратов при изучении
Российского фонда фундаментальных исследова-
их влияния на формирование биологических по-
ний (проект №15-29-01220 офи_м).
следствий воздействия ионизирующих излуче-
ний в малых дозах.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта
ЗАКЛЮЧЕНИЕ
интересов.
Анализ полученных экспериментальных дан-
ных свидетельствует о том, что кинетические ха-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
рактеристики полусинтетических антиоксидантов
оказывают существенное влияние на формирова-
Все применимые международные, националь-
ние последствий радиационного воздействия в ма-
ные и институциональные принципы ухода и ис-
лой дозе на организм. Так, достаточно высокая ве-
пользования животных при выполнении работы
личина константы скорости взаимодействия
были соблюдены.
ИБФ 2 с пероксирадикалами в сочетании с его
способностью влиять на параметры физико-хими-
ческой системы регуляции ПОЛ в тканях при вве-
СПИСОК ЛИТЕРАТУРЫ
дении в организм позволяет рассматривать пер-
1.
А. М. Кузин, Изв. АН СССР. Сер. биол., № 6, 212
спективность его применения как противолучево-
(1980).
го средства при острых радиационных
2.
Е. Б. Бурлакова, Г. Ф. Иваненко и Л. Н. Шишкина,
воздействиях в сублетальных и минимально ле-
Изв. АН СССР. Сер. биол., № 4, 588 (1985).
тальных дозах. Такое предположение основано на
3.
В. И. Легеза и В. Г. Владимиров, Радиац. биология.
полученной ранее прямой корреляционной взаи-
Радиоэкология 38 (3), 416 (1998).
мосвязи между радиозащитными свойствами син-
4.
Ю. Б. Кудряшов, Радиац. биология. Радиоэколо-
тетических антиоксидантов при остром облучении
гия 37 (4), 673 (1997).
мышей линии Balb/c в летальной дозе 6,0 сГр и ан-
тиокислительной активностью исследованных со-
5.
Е. Б. Бурлакова, в кн. Химическая и биологическая
единений [30]. Более высокое значение стехиомет-
кинетика. Новые горизонты. Т. 2. Биологическая
рического коэффициента ингибирования ИБФ 2
кинетика (Химия, М., 2005), сс. 10-45.
по сравнению с замещенными пирокатехином и
6.
M. Valko, D. Leibfritz, J. Moncol, et al., Int. J. Bio-
гидрохиноном позволяет допустить, что у полифе-
chem. Cell Biol. 39 (1), 44 (2007).
нола с расположением OH-групп в м-положении
7.
Ye. B. Burlakova, N. P. Pal’mina, and Ye. L. Mal’tseva,
каждая из OH-групп может действовать независи-
In: Membrane Lipid Oxidation, Ed. by C. Vigo-Pelfrey
мо. Тогда величина стехиометрического коэффи-
(CRC Press, Boston, 1991), V. III, pp. 209-237.
циента могла бы достигать f = 4. Причина заметно-
8.
K. Hensley, K. A. Robinson, and S. P. Gabbita, et al.,
го снижения f для ИБФ 2 до 2,3 по сравнению с
Free Radic. Biol. Med. 28, 1456 (2000).
ожидаемым значением пока остается неясной и
9.
Е. Б. Бурлакова, В. Ф. Михайлов и В. К. Мазурик,
требует дополнительного изучения.
Радиац. биология. Радиоэкология
41
(5),
489
Совокупность представленных данных позво-
(2001).
ляет рассматривать ИБФ 1 как перспективный
10.
Л. М. Рождественский, Мед. радиология и радиац.
противолучевой агент при радиационных воздей-
безопасность 46 (4), 5 (2001).
ствиях в малых и/или относительно малых дозах.
11.
М. В. Васин, Противолучевые лекарственные сред-
Это предположение соответствует и полученным
ства (М., 2010).
ранее результатам о росте ингибирующей эффек-
тивности ИБФ 1 в полярных средах [31,32], не-
12.
А. Н. Гребенюк и В. И. Легеза, Противолучевые
смотря на его достаточно низкую антирадикаль-
свойства Интерлейкина-1 (ООО «Изд-во Фоли-
ную активность в реакциях инициированного
ант», СПб., 2012).
окисления этилбензола, т.е. при окислении непо-
13.
Л. Н. Шишкина, Радиац. биология. Радиоэколо-
лярного сувбстрата [24].
гия 53 (3), 536 (2013).
Полученные данные свидетельствуют о необ-
14.
Р. А. Тарумов, В. А. Башарин и А. Н. Гребенюк,
ходимости проведения дальнейших исследова-
Рентгенология и радиология 13, 682 (2012).
БИОФИЗИКА том 64
№ 6
2019
ИЗУЧЕНИЕ АНТИОКСИДАНТНЫХ И РАДИОПРОТЕКТОРНЫХ СВОЙСТВ
1207
15.
Л. Н. Шишкина и А. В. Кучин, в кн. Биоантиокси-
24. Л. И. Мазалкцкая, Н. И. Шелудченко, Л. Н. Шиш-
дант: Труды IX Междунар. конф. (РУДН, Москва,
кина и др. Нефтехимия 51 (5), 354 (2011).
2015), сс. 5-19.
25. В. Е. Каган, О. Н. Орлов и Л. Л. Прилипко, Итоги
16.
И. Ю. Чукичева, И. В. Федорова, Ю. С. Матвеев и
науки и техники ВИНИТИ СССР. Биофизика, т. 18
А. В. Кучин, Журн. общ. химии 82 (6), 1130 (2012).
(М., 1986).
26. Г. В. Оленев и И. В. Пасичник, Экология, № 3, 208
17.
И. Ю. Чукичева, И. В. Федорова, Е. В. Буравлёв и
(2003).
др., Журн. общ. химии 82 (8), 1354 (2012).
27. А. Г. Кудяшева, Л. Н. Шишкина, О. Г. Шевченко и
18.
В. Ф. Цепалов, А. А. Харитонова, Г. П. Гладышев и
др., Биологические эффекты радиоактивного за-
Н. М. Эмануэль, Кинетика и катализ 18 (5), 1261
грязнения в популяциях мышевидных грызунов (Ека-
(1977).
теринбург, 2004).
19.
Л. И. Мазалецкая, Н. И. Шелудченко и Л. Н.
28. Л. Н. Шишкина, Е. В. Кушнирева и М. А. Смотря-
Шишкина, Прикл. биохимия и микробиология 46
ева, Радиац. биология. Радиоэкология 44 (3), 289
(2), 148 (2010).
(2004).
20.
Л. Н. Шишкина и Е. Б. Бурлакова, в кн. Химиче-
29. М. А. Климович, М. А. Смотряева, В. Д. Гаинцева
ская и биологическая кинетика. Новые горизонты.
и Л. Н. Шишкина, Радиац. биология. Радиоэколо-
Т. 2. Биологическая кинетика (Химия, М., 2005),
гия 49 (4), 473 (2009).
сс. 365-395.
30. Е. Б. Бурлакова, А. В. Алесенко, Е. М. Молочкина
21.
T. Asakawa and S. Matsushita, Lipids 15 (3), 1137
и др., Биоантиоксиданты в лучевом поражении и
(1980).
злокачественном росте (Наука, М., 1975).
22.
R. Itzhaki and D. M. Gill, Annal. Biochem. 9, 401
31. Л. И. Мазалецкая, Н. И. Шелудченко, Ю. К. Лука-
(1964).
нина и Л. Н. Шишкина, Хим. физика 32, 31 (2013).
23.
Г. Ф. Лакин, Биометрия, 2-е изд. (Высш. шк., М.,
32. О. Г. Шевченко, С. Н. Плюснина, Л. Н. Шишкина
1990).
и др., Биол. мембраны 30 (1), 40 (2013).
Study of Antioxidative and Radioprotective Properties of Isobornylphenols
under X-Ray Irradiation at Low Dose
L.N. Shishkina*, A.Yu. Babkin*, M.A. Klimovich*, M.V. Kozlov*, L.I. Mazaletskaya*,
N.I. Sheludchenko*, I.Yu. Chukicheva**, I.V. Fedorova**, and A.V. Kutchin**
*Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**Institute of Chemistry, Komi Scientific Center, Ural Branch of Russian Academy of Sciences,
ul. Pervomaiskaya 48, Syktyvkar, Republic of Komi, 167000 Russia
The inhibitory efficiency and radioprotective properties of two isobornylphenols were studied under their ad-
ministration for 30 minutes before X-ray irradiation of mice (females) at the dose of 50 sGy. It was found that
1,3-dihydroxy-4,6-diisopropylbenzene exhibited a high inhibitory efficiency due to its interaction with per-
oxy radicals. The spleen index and the content of the lipid peroxidation products in the blood plasma, earlier
suggested as tests for the assessment of the radioprotective properties of substances under the irradiation of
animals at the low doses, are returned to norm by the prophylactic injection of 2-isobornyloxyphenol. Perni-
ciousness of the application of water solution of ethanol as solvent for the hydrophobic substances under their
administration in organism under the week radiation actions is revealed. The data obtained and the literature
analysis allows us to predict a possibility of the isobornylphenols employment as radioprotective agents under
the radiation actions at the different ranges of doses.
Keywords: isobornylphenols, antioxidant activity, lipid peroxidation, X-rays, low doses, radioprotective properties
БИОФИЗИКА том 64
№ 6
2019