БИОФИЗИКА, 2020, том 65, № 1, с. 5-16
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.342;577.344
ЭМИССИОННАЯ ИК-ФУРЬЕ-СПЕКТРОСКОПИЯ В ИССЛЕДОВАНИИ
БИОЛОГИЧЕСКИХ МОЛЕКУЛ
© 2020 г. Е.Л. Терпугов
Институт биофизики клетки РАН- обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, ул. Институтская, 3
E-mail: el_terpugov@rambler.ru
Поступила в редакцию 29.11.2019 г.
После доработки 29.11.2019 г.
Принята к публикации 11.12.2019 г.
Инфракрасная спектроскопия является мощным аналитическим методом, который еще полностью
не разработан применительно к биологическим системам. Ранее этот метод метод успешно
применялся для анализа вторичной структуры. Этот миниобзор показывает последние достижения
в изучении белков с применением ИК-Фурье-техники. Обсуждается применение эмиссионной
ИК-Фурье-спектроскопии к исследованию фотофизических и фотохимических реакций в
фоторецепторных белках.
Ключевые слова: ИК-Фурье-спектроскопия, стимулированная инфракрасная эмиссия, видимый свет,
инфракрасный свет, белок, пигмент-белковый комплекс, аминокислоты.
DOI: 10.31857/S0006302920010019
представленная в ИК-спектре, уникальна, ее не-
Колебательная спектроскопия представляет
возможно получить с помощью спектроскопии в
собой мощный инструмент для изучения биоло-
ультрафиолетовой и видимой области.
гических образцов [1-5]. Инфракрасная спектро-
скопия (ИК-спектроскопия) и спектроскопия
комбинационного рассеяния света (рамановская
МАТЕРИАЛЫ И МЕТОДЫ
спектроскопия) являются двумя взаимодополня-
ющими методами колебательной спектроскопии,
Приготовление пленок исследуемых образцов. В
которые основаны на двух принципиально раз-
работе использовали L-лизина моногидрохлорид
ных физических процессах. Однако в обоих слу-
(Aldrich-Sigma, США) без предварительной
чаях наблюдают возбуждение молекулы до более
очистки. Пленку получали путем высаживания
высоких энергетических колебательных состоя-
образца из 1 М водного раствора на подложку из
ний. ИК-спектроскопия связана с поглощением
кристаллического кремния. Толщина слоя плен-
ИК-квантов, в результате которого происходит
ки составляла приблизительно 1 мм. Материал
усиление колебательных и вращательных движе-
подложки имеет область прозрачности в ИК-диа-
ний молекул, обусловленных химическим соста-
пазоне.
вом образца [3, 5]. Химические связи претерпева-
Равномерно распределенный по гладкой по-
ют различные формы колебаний, такие как рас-
верхности подложки образец в объеме 200-300
тяжения, изгибы и вращения. Энергия
мкл высушивали на воздухе при комнатной тем-
большинства молекулярных колебаний соответ-
пературе и относительной влажности воздуха
ствует энергии квантов с длиной волны 25-
около 60% в течение нескольких часов.
2,5 мкм или волновыми числами 4000-400 см-1.
Для приготовления раствора использовали де-
Полосы в спектре ИК-поглощения появляются в
ионизованную воду при рН 7.0. Деионизованная
результате переходов между колебательными
вода, используемая в этих экспериментах, была
подуровнями основного электронного состояния
получена на системе Nanopure Diamond ultrapure
и связаны с изменением дипольного момента,
(Barnstead International, США). Чистота воды
правилами отбора, симметрией молекул и степе-
подтверждается величиной проводимости в
нью ангармоничности колебаний. Информация,
18 МОм.
Спектроскопические исследования. Основные
Сокращения: ИК - инфракрасный, НПВО - нарушенное
полное внутреннее отражение, ИКЭС - эмиссионная ИК-
спектроскопические исследования проводили с
Фурье-спектроскопия.
использованием ряда спектроскопических мето-
5
6
ТЕРПУГОВ
дов - дифференциальной ИК-Фурье-спектро-
ее способности обнаруживать изменения в относи-
скопии, низкотемпературной дифференциаль-
тельной ориентации и водородных связях пептид-
ной ИК-Фурье-спектроскопии, эмиссионной
ных групп C=O, которые являются основными ос-
ИК-Фурье-спектроскопии.
цилляторами, связанными со структурой. Одним из
основных его применений является анализ вторич-
При дифференциальных и низкотемператур-
ных измерениях сначала записывали спектр све-
ной структуры белка, основанный на том, что суще-
тоадаптированной формы основной формы бак-
ствует тесная корреляция между положением спе-
териородопсина БР568, который сохраняли в па-
цифических ИК-полос в спектре и вторичной
структурой [12-15]. Эти корреляции были опреде-
мяти компьютера. Затем записывали спектр
лены посредством связи частот структурно-чув-
исследуемого интермедиата. Разностный спектр
ствительных амидных полос со специфическими
получали путем вычитания из полученного спек-
типами структуры, такими как α-спирали, β-сшив-
тра исследуемого интермедиата спектра основ-
ки или петли [12, 13, 16]. При большом числе степе-
ной формы. В частности, спектр М412-интер-
ней свободы молекулы белка ее ИК-спектр, тем не
медиата получали при температуре 190 К.
менее, имеет немного полос. Это обусловлено тем,
Эмиссионные измерения были выполнены на
что в ИК-спектрах белковых полимеров активны
базе отечественного ИК-Фурье-спектрометра
только те нормальные колебания, для которых ато-
ФС-02 путем модификации его оптической схе-
мы в повторяющихся единицах полимерной цепи
мы. Для этого источник ИК-излучения был уда-
колеблются в фазе [2, 7].
лен из прибора. Вместо него был установлен об-
Наиболее изучено белковое колебание, свя-
разец, который непрерывно облучался видимым
занное с полосой Амид I, локализованной в спек-
светом умеренной мощности и, по сути, являлся
непосредственным источником ИК-излучения,
тральной области 1700-1620 см-1. Полоса Амид I
которое направлялось на собирающее зеркало и
почти полностью состоит из С=О-валентных ко-
далее в интерферометр. Геометрия освещения об-
лебаний, связанных с растяжением пептидной
разца видимым светом была такова, что возбуж-
связи, и обладает высокой чувствительностью к
дающий свет падал практически нормально к по-
вторичной структуре. В зависимости от типа вто-
верхности образца и фокусировался в пятно да-
ричной структуры, в которой участвуют пептид-
метром 2-4 мм с помощью короткофокусной
ные C=O-группы, нормальные моды имеют тен-
линзы. Регистрацию вторичного ИК-излучения
денцию локализоваться в пределах определенных
осуществляли в геометрии отражения. При этом
спектральных областей, создавая полосы частот,
возбуждающий (паразитный) свет не попадал на
каждая из которых имеет свои собственные спек-
приемник. Случайное проникновение видимого
тральные параметры (положение, ширина поло-
света отсекалось пластиной из германия, уста-
сы и коэффициент ослабления).
новленной на входном окошке приемника. Гер-
Полоса Амид II, напротив, происходит от
маний, как известно, пропускает ИК-свет и не
плоских колебаний, связанных с изгибом N-H-
пропускает свет видимого диапазона.
связи, и от валентных колебаний, связанных с
Варьирование мощности возбуждающего из-
растяжением C-N-связи. Колебание Амид II де-
лучения от ксеноновой лампы при исследовании
монстрирует гораздо меньшую чувствительность
интенсивностной зависимости спектра ИК-
к конформации белка [2]. Другие амидные поло-
эмиссии осуществлялось при помощи поглоща-
сы являются очень сложными и сильно зависят от
ющих светофильтров (ЛОМО, Россия). Калиб-
величины силовых полей, природы боковых це-
ровку светофильтров проводили с помощью из-
пей и водородных связей и практически не ис-
мерителя мощности. Также использовали поло-
пользуются в анализе конформационных иссле-
совые инфракрасные фильтры.
дований.
Записывали эмиссионные спектры в однока-
Одним из наиболее значительных практиче-
нальном режиме со спектральным разрешением
ских преимуществ детального структурного ана-
4 см-1, которое было выбрано для лучшей вос-
лиза является то, что полоса «Амид I» содержит
производимости спектров.
больше информации, чем просто сведения о кон-
формации глобулярных белков. Точное положе-
ние этой полосы колебаний зависит от характера
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
водородных связей с участием C=O- и N-H-
ИК-спектроскопия в исследовании глобулярных
групп [14]. В свою очередь, это определяется упа-
белков. В структурных исследованиях белков ИК-
ковкой полипептидной цепи, отражающей кон-
спектроскопия начала применяться с 50-x годов
формацию основной цепи и паттерн водородных
прошлого столетия [6-8] и до сих пор является бле-
связей. Таким образом, наблюдаемые контуры
стящим инструментом при изучении конформации
амидных полос белков состоят из перекрываю-
и динамики белковых структур [2, 9-11]. Полез-
щихся полос различных компонентов, представ-
ность инфракрасной спектроскопии проистекает из
ляющих α-спирали, β-сшивки, изгибы и неупо-
БИОФИЗИКА том 65
№ 1
2020
ЭМИССИОННАЯ ИК-ФУРЬЕ-СПЕКТРОСКОПИЯ
7
рядоченные элементы структуры [2, 7, 17]. Полоса
зеров и компьютеризованный инструментарий
«Амид I» часто показывает сложную, неразре-
современных ИК-Фурье-спектрометров улучшил
шенную форму линии с большим числом широ-
отношение «сигнал/шум» и позволил проводить
ких полос с неясными максимумами. Ее форма
обширные манипуляции с данными. Спектры
может изменяться под воздействием растворите-
могут быть получены в широком диапазоне сред с
ля [16, 18, 19], из-за локальных деформаций [9],
меньшими затратами времени и вещества, что
размера [9] и структурной организации локаль-
стало исключительным преимуществом метода.
ных элементов во вторичной структуре [20]. Эти
При этом могут быть обнаружены прямые корре-
явления увеличивают внутреннее информацион-
ляции между частотами полосы «Амид I» и ком-
ное содержание, но усложняют интерпретацию.
понентами вторичной структуры на основе уста-
Таким образом, основным аспектом в изучении
новленных экспериментальных методик анализа
белков с помощью инфракрасной спектроскопии
вторичной структуры полипептидов и белков
становится расшифровка ИК-спектров, включа-
[33-36]. Такие возможности в последние годы
ющая в себя идентификацию и характеристики
значительно расширили применение ИК-Фурье-
полос основных компонентов определяющих
спектроскопии в исследованиях вторичной
профиль полосы «Амид I» [21-24].
структуры и динамики белка [32].
Появление в 1980-х годах новой техники -
В настоящее время ИК-Фурье-спектроскопия
ИК-Фурье-спектрометров - открыло новую эру в
используется не только для изучения вторичной
исследовании белков. Принципиально новая
структуры, но и при исследованиях структурной
конструкция ИК-спектрометров в сочетании с
динамики, конформационных изменений (отра-
разработкой метода преобразования Фурье для
жает связывание лигандов [37], зависимость от
сбора ИК-данных и надежного цифрового вычи-
температуры, рН и давления [38-40]), она также
тания позволила быстро и эффективно обрабаты-
используется для изучения структурной стабиль-
вать и преобразовывать интерферограммы с по-
ности, сворачивания и агрегации белков [26, 27].
мощью алгоритма преобразования Фурье, в ре-
Дифференциальная ИК-Фурье-спектроскопия.
зультате чего быстро получать зависимости
Хотя ИК-спектроскопия позволяет изучать кон-
коэффициента пропускания от энергии в волно-
формацию и динамику белка, на практике трудно
вых числах [25]. Полученный в результате мате-
определить локальные структурные изменения в
матической обработки спектр указывает на нали-
белковом остове. Эта проблема происходит от су-
чие химических связей и, следовательно, дает
ществования сильного перекрывания между ко-
представление о составе и строении вещества. В
лебательными модами множества одинаковых
настоящее время ИК-Фурье-спектроскопия при-
групп в белке. Например, в ИК-спектре в области
знана ценным инструментом для изучения кон-
1700 см-1 и 1500 см-1 вносят вклад полосы «Амид I»
формации белка в растворе на основе обычной
(1620-1690 см-1) и «Амид II» (около 1550 см-1)
воды, а также ее дейтерированных форм; она так-
(точная частота которых зависит от вторичной
же используется для изучения структурной ста-
структуры белка), но также вносит вклад и погло-
бильности, сворачивания и агрегации белков
щение боковых аминокислотных остатков, таких
[26-32].
как аспартат, глутамат, тирозин, триптофан, ли-
Однако поначалу практическое использова-
зин и аргинин (поглощающих в области локали-
ние этой техники было сильно ограничено таки-
зации полос «Амид Ι» и «Амид II» [28-31]). В эту
ми факторами, как низкая чувствительность при-
область могут также попадать колебания хромо-
боров, отсутствие понимания корреляции между
фора. При этом в типичном спектре ИК-погло-
конкретными типами упаковки основной цепи и
щения пигментно-белкового комплекса в сред-
полосами отдельных компонентов [22]. Тогда
нем инфракрасном диапазоне будет доминиро-
считалось, что ИК-спектр белка в водном раство-
вать поглощение белка, в то время как
ре трудно, если не невозможно, получить, если
поглощение молекул хромофора обычно состав-
только в качестве растворителя не использовать
ляет только очень незначительный вклад (∼10-3-
тяжелую воду, поскольку вода сильно поглощает
в наиболее важной области спектра примерно
10-4, в зависимости от размера белка). Поэтому
чтобы получить информацию о хромофоре или
при 1640 см-1 и может полностью маскировать
других составляющих биологической системы
белковые полосы. Даже в растворе D2O обычно
(белки, мембраны и так далее), участвующих в те-
получали только качественную информацию, по-
чение заданной фотореакции, в 1980-х годах про-
тому что компоненты полос поглощения, связан-
шлого столетия был разработан новый метод -
ные с конкретными субструктурами, такими как
дифференциальная ИК-Фурье-спектроскопия.
α-спираль и β-сшивки, не могли быть разрешены
Впервые он был применен к бактериородопсину
[11].
[41-43]. В последнее время этот метод особенно
В настоящее время высокая чувствительность
широко используется для исследований ранней
современных ИК-приемников, стабильность ла-
фотофизики, процессов переноса энергии и мо-
БИОФИЗИКА том 65
№ 1
2020
8
ТЕРПУГОВ
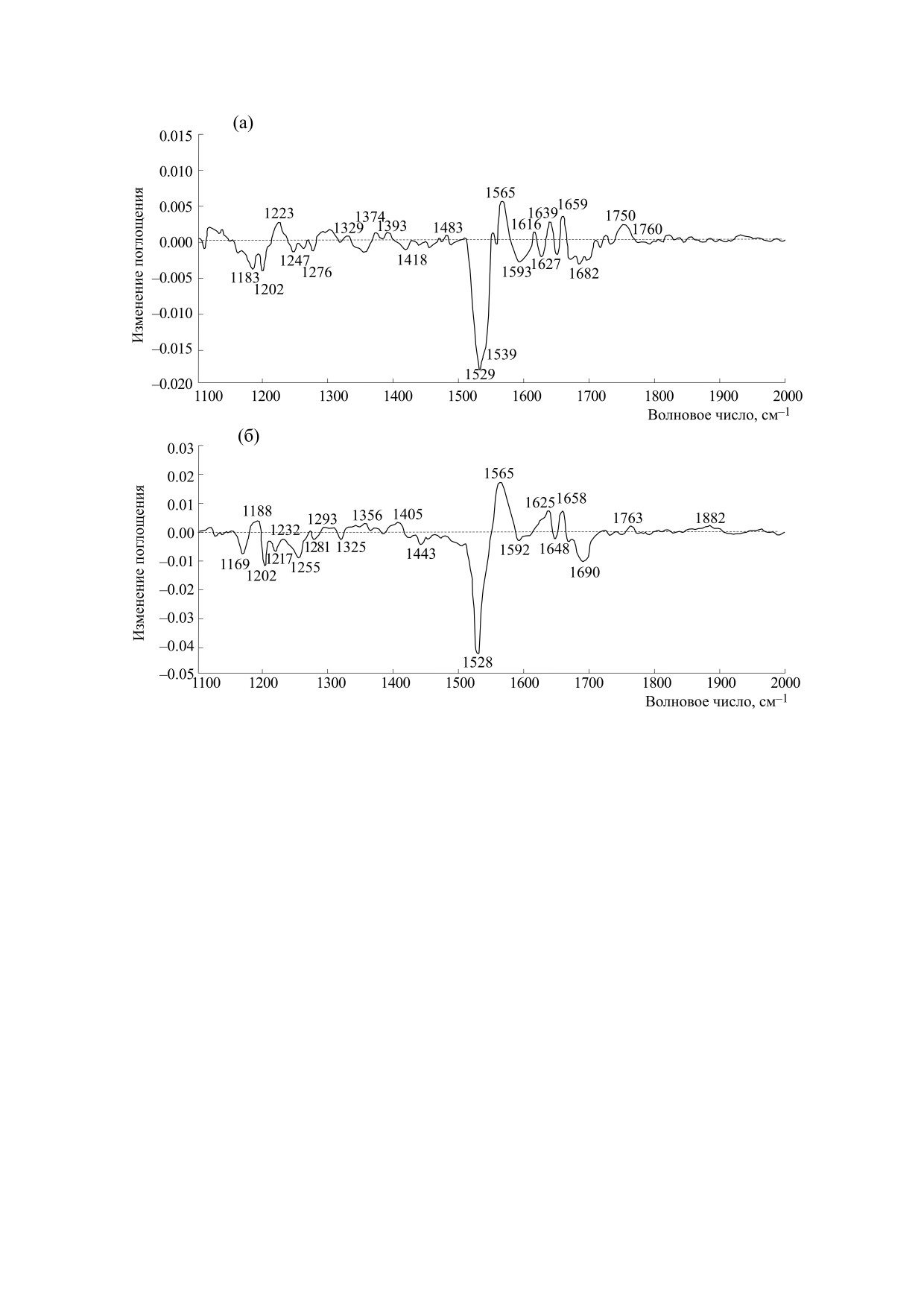
Рис. 1. Дифференциальные спектры между исходной формой бактериородопсина БР568 и формой М412, записанные
при температуре 190 К и относительной влажности пленок 0% (а) и 93% (б). Спектры записаны в одноканальном ре-
жиме с использованием охлаждаемых жидким азотом ртуть-кадмий-теллуровых (в английской аббревиатуре - МСТ)
приемников, накоплением 600 сканов и спектральным разрешением 4 см-1.
лекулярных механизмов функционирования фо-
фора или белка и так далее. Эта информация
тосистем разной сложности (см., например, обзо-
носит также структурный характер: например, в
ры [44, 45] и ссылки в них).
спектрах можно наблюдать не только образова-
ние водородной связи, но и получить качествен-
Основной эксперимент заключается в сравне-
ную оценку прочности связи [44, 45].
нии двух ИК-спектров, зарегистрированных до и
С появлением ИК-Фурье-спектрометров с
после данной реакции (см. рис. 1). Все колеба-
технологией «степ-скан» за состоянием биологи-
тельные полосы, принадлежащие молекулярным
ческой системы можно следить с временным раз-
группам, участвующим в реакции, появятся в раз-
решением от нано- до фемтосекунд [ 46-48].
ностном спектре, тогда как все остальные колеба-
ния будут подавлены. В результате чувствитель-
Как было сказано выше, исторически первые
ность метода проявляется на уровне отдельных
исследования с помощью дифференциальной
молекулярных групп и даже химических связей.
ИК-Фурье-спектроскопии были проведены на
Получаемая в дифференциальном спектре ин-
бактериородопсине. Они позволили определить
формация касается таких важных событий, как
вовлеченность индивидуальных групп на разных
протонирование/депротонирование боковой це-
стадиях фотоцикла [49, 50]. Во многом успешно-
пи одной аминокислоты, окисление/восстанов-
му практическому применению этого метода спо-
ление пигмента или кофактора, смещение моле-
собствовало разработка новых методик, связан-
кулы воды, конформационные изменения хромо-
ных с подготовкой образца. Кроме мечения изо-
БИОФИЗИКА том 65
№ 1
2020
ЭМИССИОННАЯ ИК-ФУРЬЕ-СПЕКТРОСКОПИЯ
9
топами и водородно-дейтериевого обмена были
В основе метода НПВО лежит поглощение по-
разработаны специальные методики, такие как
верхностным слоем исследуемой пробы падаю-
метод генетических замен или сайт-направлен-
щего излучения световой волны, выходящей из
ный мутагенез [51], избирательное прокрашива-
призмы полного внутреннего отражения, находя-
ние изотопами боковых аминокислотных остат-
щейся в оптическом контакте с изучаемой по-
ков или молекул внутренней воды [52-54]. Таким
верхностью. Детально метод описан в работе [59].
способом были идентифицированы каталитиче-
Для регистрации спектров НПВО необходимы
ски важные аминокислоты в родопсинах [55-58].
специальные приставки в ИК-Фурье-спектро-
В связи с этим особенность подготовки образцов
метрах. В этом случае получаемые методом
для дифференциальной ИК-Фурье спектроско-
НПВО инфракрасные спектры практически
пии заслуживает отдельного рассмотрения.
идентичны поглощению, а определение вторич-
ной структуры белков по спектрам НПВО пока-
Прежде всего, следует учитывать тот факт, что
зало схожие результаты. В то же время метод так-
молярные коэффициенты экстинкции колеба-
же не лишен недостатков. Один из них связан с
тельных мод значительно меньше, чем у элек-
серьезными ошибками при интерпретации спек-
тронных переходов. Это влечет за собой необхо-
тров. В последнее время метод НПВО чаще всего
димость использования очень концентрирован-
используется для определения ориентации бел-
ных образцов. Кроме того, учитывая, что
ков в мембране.
огибающая полосы поглощения воды в значи-
тельной степени маскирует важные полосы ком-
Эмиссионная ИК-Фурье-спектроскопия. Если
понентов белка, необходимо уменьшить содер-
рассмотренные методы в ИК-Фурье-спектроско-
жание воды при условии сохранности нативности
пии - пропускание (поглощение) и отражение
белка или мембраны и его биохимических реак-
(нарушенное полное внутреннее отражение) -
ций при изменении гидратного состояния образ-
наиболее прочно и широко применяются в био-
ца. Более серьезные проблемы возникают при ис-
логических исследованиях, то этого нельзя ска-
следовании водорастворимых белков. Для того
зать об эмиссии, которая не используется в био-
чтобы решить эту проблему, было предложено
логии.
использовать образцы в виде прессованных таб-
Современные исследования с помощью эмис-
леток с использованием порошка бромида калия,
сионной ИК-Фурье-спектроскопии (ИКЭС) в
прозрачного в ИК-области спектра. Этот метод
большинстве случаев касаются изучения спек-
прессования таблеток с помощью бромида калия
тров естественных и искусственных источников
был введен в 1952 г. и широко используется до сих
света или лабораторных образцов, возбужденных
пор. Он заключается в тщательном перемешива-
термальными способами [60-63]. Помимо спек-
нии тонко измельченной пробы с порошком бро-
троскопии небесных тел, изучаемых в области
мида калия, ее прессовании и формировании по-
астрофизики, существуют два основных направ-
лупрозрачной таблетки. Несмотря на преимуще-
ления эмиссионной спектроскопии, используе-
ство, заключающееся в отсутствии большинства
мых в лабораторных условиях, - атомная эмисси-
мешающих полос поглощения, к недостаткам
онная спектроскопия, как один из наиболее ши-
этого метода относят возможность изменения
роко используемых методов элементного анализа
кристаллической структуры полиморфных ве-
вещества, и ИКЭС, сконцентрированная глав-
ществ в процессе растирания и прессования таб-
ным образом на термоэмиссии молекулярных си-
леток. Также из-за высокой гигроскопичности
стем. ИКЭС может быть применима к анализу
бромида калия не удается полностью избежать
широкого спектра веществ органической и неор-
присутствия в ИК-спектрах полос адсорбирован-
ганической природы в твердом, жидком и газооб-
ной воды возле 1640 см-1 и 3450 см-1. Возможно
разном состоянии, а также к анализу таких ве-
химическое взаимодействие вещества пробы с
ществ, как сыпучие материалы, поверхности, ка-
материалом таблетки.
тализаторы и тонкие пленки и минералы [62, 63].
Метод нарушенного полного внутреннего отра-
Хотя ИКЭС имеет потенциал стать очень чув-
жения. Начиная с 1963 г., в качестве альтернативы
ствительной, универсальной молекулярно-спе-
ИК-поглощению для анализа водных растворов
цифической техникой анализа молекулярного
биологических образцов стали использовать ме-
состава и структуры вещества, в настоящее время
тод ИК-отражения, известный как метод нару-
она все еще редко используется на практике. Од-
шенного полного внутреннего отражения
ной из основных причин является отсутствие
(НПВО, в английской аббревиатуре
- ATR
специализированной техники, позволяющей
(Attenuated total reflection)) [59]. Метод нарушен-
проводить рутинные измерения. Все измерения
ного полного внутреннего отражения требует ми-
проводятся на базе ИК-Фурье-спектрофотомет-
нимальных усилий в приготовлении образца, он
ров, которые имеют специализированные при-
также позволяет исследовать поверхности самых
ставки, или проводится модификация оптиче-
различных материалов.
ской схемы, позволяющая адаптировать прибор
БИОФИЗИКА том 65
№ 1
2020
10
ТЕРПУГОВ
для эмиссионных экспериментов. Эти экспери-
условиях под действием видимого света амино-
менты зачастую происходят на грани искусства
кислоты, так же как и ретиналь, способны гене-
[61]. Между тем в настоящее время метод ИКЭС
рировать ИК-излучение в среднем ИК-диапазо-
достаточно востребован из-за безальтернативно-
не. Это может иметь важное значение при реше-
сти его применения в таких научных областях,
нии вопроса о происхождении колебательного
как астрофизика, химический катализ или мине-
возбуждения в опсине в первичной фотофизике
ралогия [63]. Поэтому метод ИКЭС продолжает
бактериородопсина.
совершенствоваться и развиваться. Одним из та-
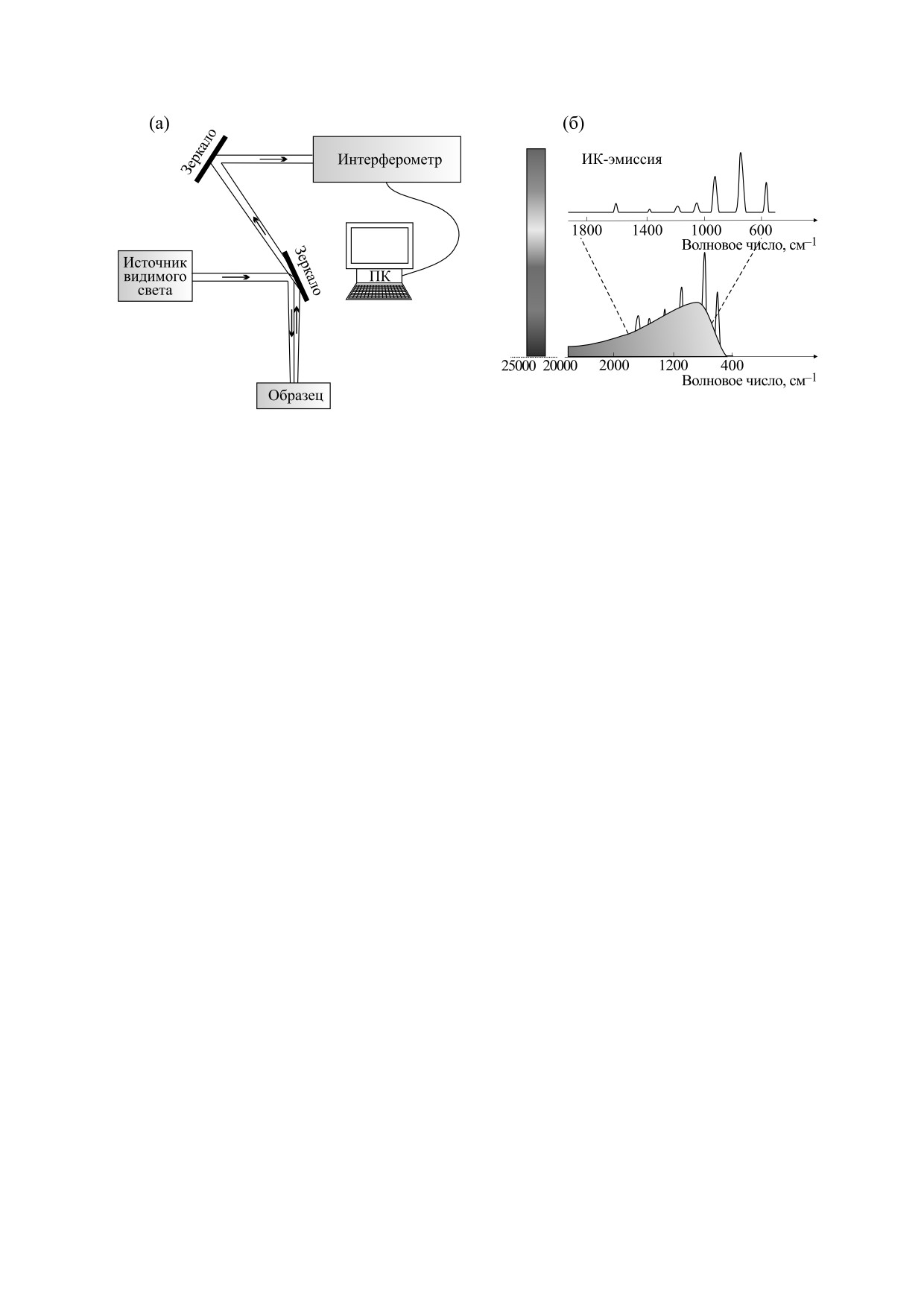
Подробное описание ИК-эмиссионных экс-
ких достижений является возможность его ис-
периментов на базе ИК-Фурье-спектрометра
пользования применительно к биологическим
ФС-02 было представлено ранее [68]. ИКЭС со-
образцам, когда исключается прямой контакт-
четает использование источника видимого света
ный нагрев, а эмиссия возбуждается с помощью
и адсорбционную ИК-Фурье-технику для записи
видимого света с энергией, не вызывающей на-
спектров ИК-эмиссии в широком ИК-диапазо-
грева образца.
не. В этом случае стандартный источник ИК-из-
лучения заменяется на непосредственно образец,
Спектр ИК-эмиссии, как и спектры комбина-
как это схематически показано на рис. 3.
ционного рассеяния света или ИК-поглощения,
содержит подробную информацию о присутству-
Как видно, спектр состоит из двух компонент
ющих химических связях, следовательно, он дает
- широкой гладкой фоновой кривой и располо-
представление о химическом составе образца.
женных на ее фоне отдельных резких пиков. Ре-
Преимущество метода состоит в том, что он не
альный спектр ИК-эмиссии образца получали
имеет ограничений для водных растворов, по-
вычитанием широкой компоненты фонового из-
скольку молекулы воды не дают ИК-сигнала,
лучения с использованием процедур сглажива-
способного маскировать важные белковые поло-
ния и фитизации полиномом 25-й степени с по-
сы. Следовательно, измерения могут проводиться
мощью компьютерной программы Origin 6. Реги-
в водных растворах или непосредственно на не-
страцию спектров проводили с максимальным
высушенных образцах. Образец не требует специ-
уровнем полезного ИК-сигнала и минимальным
альной подготовки, что позволяет исследовать
влиянием фонового излучения от нагретых по-
целостные клетки и даже ткани [64] . В спектраль-
верхностей. Оптимальные условия регистрации
спектров задавали программно. Видимый свет в
ной области
«Амид I»
(1600-1700 см-1) и
виде паразитных засветок отсекали оптическими
«Амид II» (1480-1575 см-1) содержатся не еди-
фильтрами и германиевым фильтром, установ-
ничные широкие полосы, а множество хорошо
ленным на входном окошке ИК-приемника.
разрешенных полос, что позволяет получать бо-
То, что в этих условиях резонансного погло-
лее подробную информацию об исследуемых
щения ретинальным хромофором бактериоро-
процессах. При этом анализ эмиссионных спек-
допсин может излучать ИК-радиацию в среднем
тров включает в себя пока что редко исследуемые
ИК-диапазоне (4000-400 см-1) [68-70], подтвер-
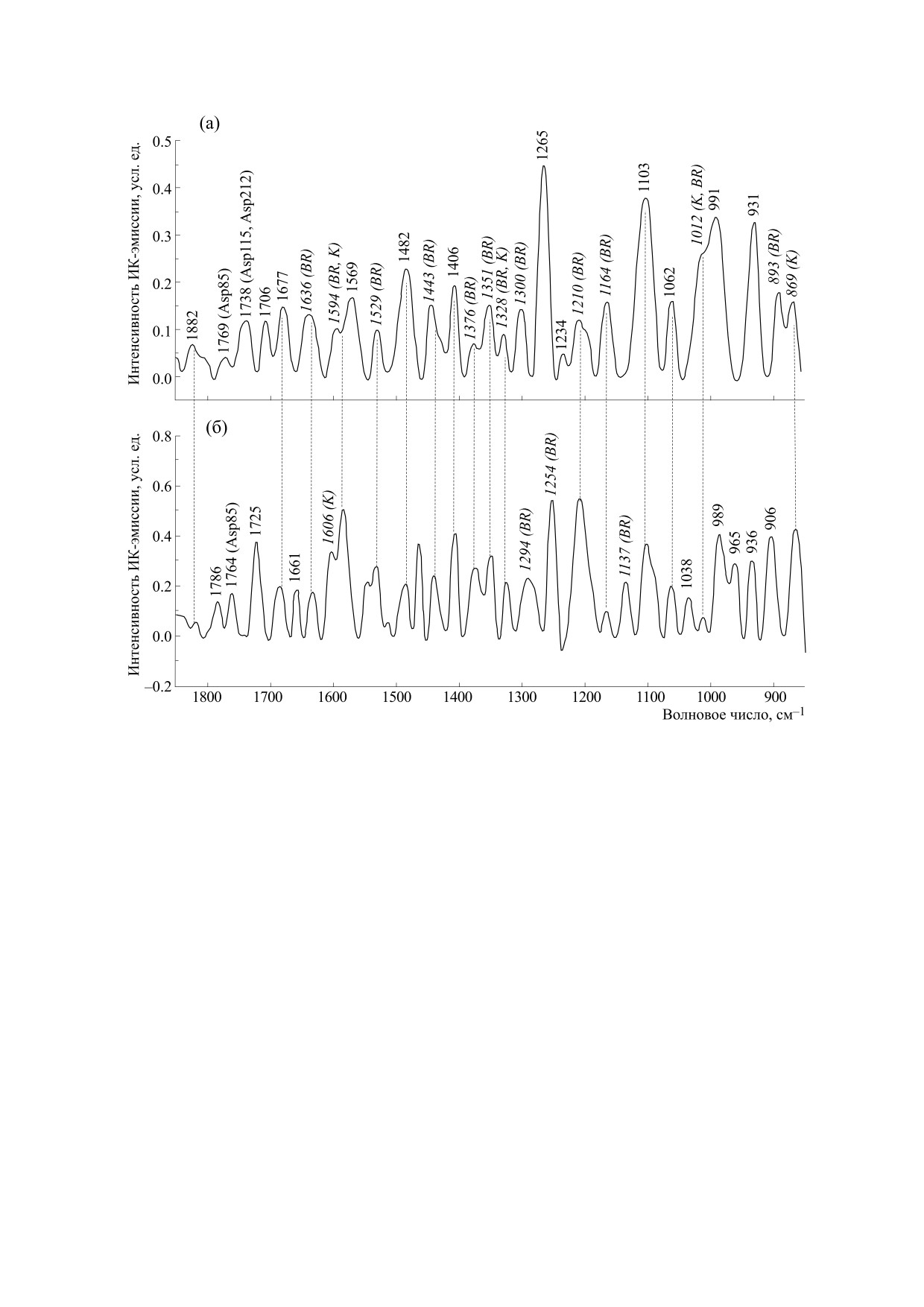
спектральные области (>1800 см-1 и <1000 см-1).
дили также другие авторы [71-74].
Их исследование в фоточувствительных белках
становятся все более популярными (см., напри-
В процессе исследования нами было показано,
мер, работы [65-67]) (рис. 2). Как правило, в
что многочастотный (широкополосный) види-
спектрах ИК-поглощения или дифференциаль-
мый свет помимо собственной флуоресценции
ных спектрах спектральное окно между 1800 см-1
может возбуждать в пигментах стимулированное
ИК-излучение по механизму комбинационного
и 1900 см-1 лишено какого-либо спектрального
типа [70, 75, 76]. В этом случае, как и при вынуж-
вклада, в то время как в этой области в спектрах
денном комбинационном рассеянии, ИК-эмис-
ИК-эмиссии проявляются хорошо разрешенные
сия наблюдается с теми же самыми резонансны-
пики (рис. 2) . Их идентификацию проводили в
ми условиями, которые имеют место при смеши-
экспериментах с использованием модельных со-
вании оптических волн в нелинейной среде [77-
единений ретиналя и аминокислот.
80]. Возможность процесса нелинейного оптиче-
Рис. 2 иллюстрирует возможности метода в по-
ского смешивания при использовании некоге-
лучении информации о хромофорном ретинале и
рентного источника была показана еще в 1965 г.
белковых компонентах бактериродопсина в вод-
[81]. Хотя вероятность такого процесса не столь
ном растворе и влажных пленках. Идентифика-
велика, особенно при использовании низкоин-
ция полос, относящихся к ретиналю, проводи-
тенсивных источников света, чувствительность
лась на основе сравнения с данными комбинаци-
современных ИК-Фурье-спектрометров вполне
онного рассеяния света и ИК-поглощения
достаточна, чтобы надежно регистрировать спек-
модельных соединений ретиналя. Идентифика-
тры ИК-эмиссии в этих условиях. Спектры сти-
цию белковых полос проводили на основе анали-
мулированной ИК-эмиссии могут быть получены
за спектров аминокислот, используемых в каче-
в нерезонансных и резонансных условиях. В по-
стве моделей. Оказалось, что в нерезонансных
следнем случае можно получить значительное
БИОФИЗИКА том 65
№ 1
2020
ЭМИССИОННАЯ ИК-ФУРЬЕ-СПЕКТРОСКОПИЯ
11
Рис. 2. Спектр ИК-эмиссии бактериородопсина в пленке (а) и водном растворе (б). Спектры записаны с
использованием видимого света, попадающего в резонанс с полосой электронного поглощения хромофорного
ретиналя (λmax = 568 нм), тем самым обеспечивающего избирательность процесса по отношению к ретинальному
хромофору. Спектры записаны при комнатной температуре с накоплением 400 сканов и спектральном разрешением
4 см-1. Курсивом отмечены колебания хромофорного ретиналя (см-1), обычным шрифтом - колебания белка.
усиление сигнала (более чем в десять раз) [82].
полосные фильтры (рис. 4). Образцы лизина бы-
Извлекаемая из спектров ИК-эмиссии структур-
ли использованы в виде пленок.
ная информация аналогична той, что извлекается
из спектров ИК-поглощения и комбинационного
Линейная структура молекулы лизина прояв-
рассеяния, поскольку и в том и другом случае на-
ляла заметную чувствительность к частотам воз-
блюдаются те же самые колебательные моды [61,
буждающего света. Получаемый избыток
83].
колебательной энергии в лизине напрямую не пе-
В данной работе представлены результаты экс-
реизлучался акцептирующей модой, а перерас-
периментов по селективному возбуждению от-
пределялся между модами. Характер перераспре-
дельных репортерных групп в лизине с целью де-
деления полученного избытка колебательной
монстрации возможностей метода в получении
энергии и величина сигнала ИК-эмиссии зависе-
информации об энергетических состояниях и ме-
ли не столько от величины получаемого избытка
ханизмах диссипации поглощенной энергии.
энергии, сколько от специфики самой акцепти-
В этих экспериментах в качестве внешнего ис-
рующей моды (см., например, рис. 5), что, по-ви-
точника света использовали глобар, излучение
димому, определяется характером внутримолеку-
которого пропускали через инфракрасные узко-
лярного взаимодействия между модами.
БИОФИЗИКА том 65
№ 1
2020
12
ТЕРПУГОВ
Рис. 3. (а) - Схема установки, используемой для возбуждения эмиссии; (б) - схематическое изображение
регистрируемых спектров. Регистрация ИК-спектров эмиссии проводится с помощью охлаждаемых жидким азотом
низкотемпературных ртуть-кадмий-теллуровых приемников.
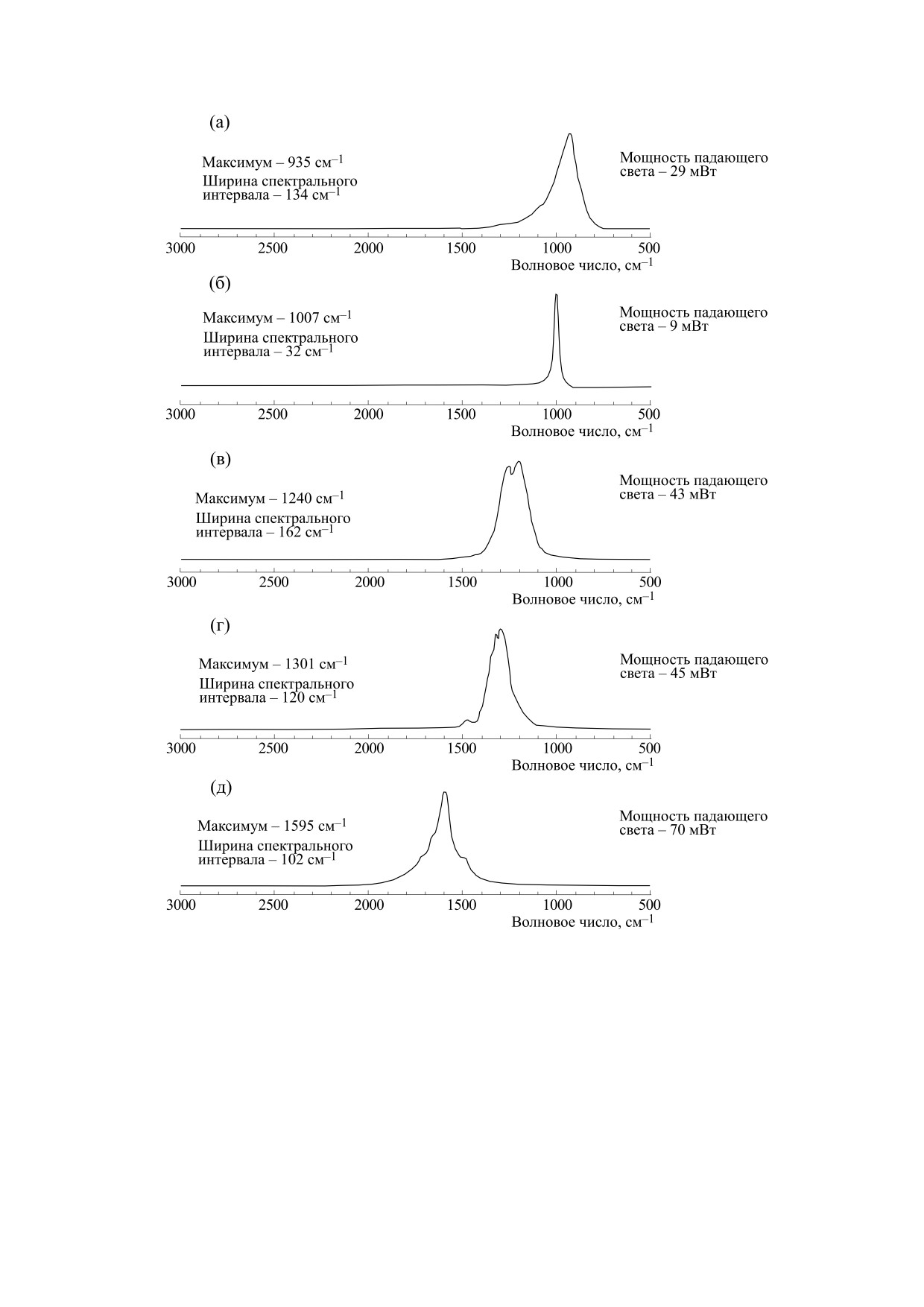
Так, при использовании полосового фильтра,
имеющие другое относительное распределение
интенсивности по сравнению со спектрами
максимально пропускающего при 936 см-1 в
(рис. 5а и 5б). Среди них наиболее сильными яв-
спектральном интервале шириной 134 см-1 в ИК-
ляются полосы возле
674 см-1 (СОО-)деф,
спектре излучения (рис. 5а), наблюдается целый
821 см-1 (не отнесена) см-1, 911 см-1 (не отнесе-
ряд полос, наиболее сильные из которых - возле
на), 1186 см-1 (СН2)деф, 1401 см-1 (СОО-), ши-
669 см-1 (СОО-)деф.,
794 см-1 (СОО-)деф.,
рокая полоса с максимумом возле 1860 см-1 и уз-
1221 см-1 (С-ОН)деф., 1336 см-1 (СН2)деф. и
кая полоса 2123 см-1 . Эти две высокочастотные
2826 см-1 (валентные (СН)СН-колебания). В то
же время при использовании полосового филь-
полосы попадают в область составных частот и
обертонов валентных колебаний С-Н-групп.
тра, максимально пропускающего при 1007 см-1 в
Аналогично, спектры на рис. 5г и 5д демонстри-
спектральном интервале шириной 32 см-1, где
руют большой набор полос, относительное рас-
акцептирующей модой являются валентные ко-
пределение интенсивности между которыми от-
лебания С-С-группы, в ИК-спектре излучения
личалось от того, что наблюдали выше. Интерес-
(рис. 5б) наблюдаются полосы, наиболее сильные
но, что во всех рассмотренных случаях
из которых находятся возле 674 см-1 (СОО-)деф.,
рассеивание колебательной энергии происходи-
ло преимущественно с участием СН- и СОО-
1600 см-1 (NH3+)asдеф., 1884, 2280 и 2882 см-1.
групп, а не NH3+. При этом в спектрах можно ви-
Высокочастотные полосы 1884, 2280 и 2882 см-1
деть, что перенос энергии происходит не только в
попадают в область составных частот и обертонов
направлении от высокочастотных высоких коле-
валентных колебаний С-Н-групп. Хотя во вто-
баний на более низкие по энергии низкочастот-
ром случае мощность падающего света была по-
ные колебания, но и, наоборот, с низкочастотных
чти в три раза ниже, интенсивность ИК-спектров
колебаний происходит перенос энергии на бóль-
(рис. 5а и 5б) была практически одинаковой.
шие по энергии высокочастотные колебания.
Фактически в этих экспериментах в молекуле ли-
В то же время при использовании полосового
зина наблюдалось движение энергии не только
фильтра, максимально пропускающего излуче-
вниз, как при механизме ступенчатого размена
ние при 1240 см-1,в спектральном интервале ши-
энергии, но и вверх, что возможно только при на-
риной
162 см-1 интенсивность ИК-спектра
личии в молекуле тесного ангармонического вза-
(рис. 5в) была ниже при более высокой мощности
имодействия между модами [87-89]. За счет этого
падающего света. В этом случае зондирующий
возбуждение какого-либо локального колебания
луч попадал в область крутильных СН2-групп. В
было способно «активировать» достаточно боль-
спектре ИК-излучения наблюдались полосы, шое число колебательных мод, частоты которых
БИОФИЗИКА том 65
№ 1
2020
ЭМИССИОННАЯ ИК-ФУРЬЕ-СПЕКТРОСКОПИЯ
13
Рис. 4. Характеристики ИК-фильтров, используемых для возбуждения молекулы лизина разными участками ИК-спектра.
локализованы в широком спектральном диапазо-
во множество разнообразных колебательных дви-
не, включая область «отпечатков пальцев», низ-
жений, многие из которых могли совершаться с
ких частот и область обертонов. Этот результат
большой амплитудой. Участие большого числа
представляется особенно важным, поскольку он
колебаний в релаксационном процессе является
показывает, что небольшое по энергии колеба-
отображением легкого преодоления энергетиче-
тельное возбуждение равновесной структуры мо-
ских барьеров в распространении энергии и вы-
лекулы вполне достаточно для того, чтобы изме-
сокой подвижности структуры молекулы лизина
нить подвижную геометрию лизина, вовлекая ее
в колебательно-возбужденном состоянии. Лизин,
БИОФИЗИКА том 65
№ 1
2020
14
ТЕРПУГОВ
Рис. 5. Спектр ИК-эмиссии L-лизина гидрохлорида в диапазоне 2000-700 см-1, записанный при освещении узкими
участками среднего ИК-диапазона. Отнесение полос в спектре проводили на основе данных работ [5, 31, 84-86].
как известно, присутствует практически во всех
ЗАКЛЮЧЕНИЕ
активных центрах белков и ферментов, и такая
Полученные результаты показали, что воз-
лабильность его структуры имеет большое значе-
можность регистрации с помощью ИК-Фурье-
ние для проявления биологической активности
техники слабой ИК-эмиссии представляет собой
лизина.
простое и в то же время чувствительное средство
БИОФИЗИКА том 65
№ 1
2020
ЭМИССИОННАЯ ИК-ФУРЬЕ-СПЕКТРОСКОПИЯ
15
получения химической и структурной информа-
21.
H. Susi and D. M. Byler, Biochem. Biophys. Res.
ции о биологических молекулах. Инфракрасная
Comm. 115 (1), 391 (1983).
эмиссионная спектроскопия с преобразованием
22.
D. M. Byler and H. Susi, Biopolymer 25, 469 (1986).
Фурье как биофизический метод может быть осо-
23.
W. K. Surewicz and H. H. Mantsch, Biochim. Biophys.
бенно полезен при изучении механизма фотофи-
Acta 952, 115 (1988).
зических и биохимических реакций.
24.
A. Barth, Prog. Biophys. Mol. Biol. 74, 141 (2000).
25.
P. R. Griffiths and J. A. de Haseth, Fourier Transform
Infrared Spectroscopy (Wiley Interscience, N.-Y., 1986).
КОНФЛИКТ ИНТЕРЕСОВ
26.
P. I. Haris and D. Chapman, Biochim. Biophys. Acta
943 (2), 375 (1988).
Авторы заявляют об отсутствии конфликта
27.
M. C. Manning, Expert. Rev. Proteom. 2 (5), 731
интересов.
(2005).
28.
S. Y. Venyaminov and N. N. Kalnin, Biopolymers 30,
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
1243 (1990).
29.
S. Y. Venyaminov and N. N. Kalnin, Biopolymers 30,
Настоящая работа не содержит описания ка-
1259 (1990).
ких-либо исследований с использованием людей
30.
N. N. Kalnin, I. A. Baikalov, and S. Y. Venyaminov,
и животных в качестве объектов.
Biopolymer 30, 1273 (1990).
31.
Y. N. Chirgadze, O. V. Fedorov, and N. P. Trushina,
СПИСОК ЛИТЕРАТУРЫ
Biopolymers 14, 679 (1975).
32.
A. Dong, P. Huang, and W. S. Caughey, Biochemistry
1. E. Smith and G. Dent, Modern Raman spectroscopy: a
29, 3303(1990).
practical approah (John Wiley& Sons, 2005).
33.
B. C. Smith, Fundamentals of Fourier Transform Infra-
2. S. Krimm and J. Bandekar, Adv. Protein Chem. 38, 181
red Spectroscopy (CRC Press, Boca Raton, 1996).
(1986).
34.
J. K. Kauppinen, D. J. Moffatt, H. H. Mantsch, et al.,
3. E. B. Wilson, Jr., J. C. Decius, and P. C. Cross, Mole-
Appl. Spectrosc. 35, 271 (1986).
cular Vibrations: The Theory of Infrared and Raman
35.
D. C. Lee, P. I. Haris, D. Chapman, et al., Biochemis-
Vibrational Spectra (Dover Publications, N.-Y., 1980).
try 29, 9185 (1990).
4. H. Callender and B. Honig, Annu. Rev. Biophys. Bio-
36.
R. W. Sarver and W. C. Krueger, Anal. Biochem. 194,
eng. 6, 33 (1977).
89 (1991).
5. L. J. Bellamy, The Infra-Red Spectra of Complex Mole-
37.
A. Barth and C. Zscherp, FEBS Lett. 477, 151 (2000).
cules, 3rd ed. (Halsted Press, J. Wiley & Sons, Inc., N.-
38.
M. van de Weert, P. I. Haris, W. E. Hennink, et al.,
Y., 1975).
Anal. Biochem. 297 (2), 160 (2001).
6. Р. Збинцен, Инфракрасная спектроскопия высоко-
39.
R. Chehín, I. Iloro, M. J. Marcos, et al., Biochemistry
полимеров, под ред. Л. А. Блюменфельда (Мир, М.,
38, 1525 (1999).
1966).
40.
P. Herman, M. Staiano, A. Marabotti, et al., Proteins
7. A. Elliott and E. J. Ambrose, Nature 165, 921 ( 1950).
Struct. Funct. Bioinform. 63, 754 (2006).
8. T. Miyazawa, J. Am. Chem. Soc. 83, 712 (1961).
41.
K. J. Rothschild, M. Zagaeski, and A. Cantore, Bio-
9. A. Barth, Biochim Biophys. Acta 1767 (9),
1073
chem. Biophys. Res. Commun. 103 (2), 483 (1981).
(2007).
42.
K. J. Rothschild, H. Marrero, M. Braiman, et al., Pho-
10. W. Mäntele, Spectrochim. Acta. Part A - Mol. Biomol.
tochem. Photobiol. 40, 675 (1984).
Spectrosc. 138, 964 (2015).
43.
K. J. Rothshild, J. Bioenerg. Biomembr. 24, 147 (1992).
11. J. K. Koenig and Sh. Yu, Acta Biochim. Biophys. Sini-
44. K. J. Rothschild, Biomed. Spectroscopy and Imaging
ca 39 (8), 549 (2007).
5 (3), 231 (2016).
12. А. Эллиот, Инфракрасные спектры и структура
45.
W. Mantele, Trends Biosci. J. 18, 197 (1993).
полимеров (Мир, М., 1972).
46.
F. Siebert, W. Mäntele, and W. Kreutz, FEBS Lett. 141,
13. A. Barth and C. Zscherp, Q. Rev. Biophys. 35 (4), 369
82 (1982).
(2002).
47.
F. Siebert and W. Mäntele, Eur. J. Biochem. 130 (3),
14. S. Krimm and J. Bandekar, Biopolymers 19, 1 (1980).
565 (1983).
15. M. C. Manning, Expert. Rev. Proteom. 2 (5), 731
48.
F. Siebert, Methods Enzymol. 246, 501 (1995).
(2005).
16. Ю. Н. Чиргадзе, Структура и стабильность
49.
R. A. Mathies, C. H. Cruz Brito, W. T. Pollard, et. al.,
биологических макромолекул (Наука, М., 1973).
Science 240 (4853), 777 (1988).
17. T. Miyazawa, J. Am. Chem. Soc. 83, 712 (1961).
50.
R. A. Mathies, S. W. Lin, J. B. Ames, et al., Annu. Rev.
18. W. K. Surewicz and H. H. Mantsch, Biochim. Biophys.
Biophys. Biophys. Chem. 20, 491 (1991).
Acta 952, 115 (1988).
51.
51. H. G. Khorana, G. E. Gerber, W. C. Herlihy, et al.,
19. R. Gilmanshin, S. Williams, R. H. Callender, et al.,
Proc. Natl. Acad. Sci. USA 76 (10), 5046 (1979).
Proc. Natl. Acad. Sci. USA 94, 3709 (1997).
52.
A. Maeda, Isr. J. Chem. 35, 387 (1995).
20. E. L. Karjalainen and A. Barth, J. Phys. Chem. B 116,
53.
A. Maeda, J. E. Morgan, R. B. Gennis, et al., Photo-
4448 (2012).
chem. Photobiol. 82 (6), 1398 (2006).
БИОФИЗИКА том 65
№ 1
2020
16
ТЕРПУГОВ
54. A. Maeda, R. B. Gennis, S. P. Balashov, et al., Bio-
72.
G. I. Groma, J. Hebling, I. Z. Kozma, et al., Proc.
chemistry 44 (16), 5960 (2005).
Natl. Acad. Sci. USA 81 (6), 1706 (2008).
55. M. S. Braiman, T. Mogi, T. Marti, et al., Biochemistry
73.
G. I. Groma, A. Colonna, J. Lambry, et al., Proc. Natl.
27, 8516 (1988).
Acad. Sci. USA 105 (19), 6888 (2004).
56. M. S. Braiman, T. Mogi, L. J. Stern, et al., Proteins:
74.
I. G. Groma, A. Colonna, J.-L. Martin, et al., Biophys.
Structure, Function and Bioinformatic 3 (4),
219
J. 100 ( 6), 1578 (2011).
(1988).
75.
Е. Л. Терпугов и О. В. Дегтярева, Письма ЖЭТФ 73
57. K. Gerwert and F. Siebert, EMBO J. 5 (4), 805 (1986).
(6), 320 (2001).
58. K.Gerwert, B. Hess, and M. Engelhard, FEBS Lett.
76.
Е. Л. Терпугов, О. В. Дегтярева, А. Г. Гагаринов и
261, 449 (1990).
др., Краткие сообщения по физике ФИАН 12, 13
59. Н. Харрик, Спектроскопия внутреннего отражения
(2004).
(Мир, М., 1970).
77.
Y. R. Shen, The Principles of Nonlinear Optics (John-
60. J. M. Chalmers and M. W. Mackenzie, in Advances in
Willey & Sons, N.-Y., 1984).
Applied Fourier Transform Infrared Spectroscopy, ed. by
78.
S. A. Akhmanov and R. V. Khokhlov, Problems of Non-
M. W. Mackenzie (Wiley & Sons. Ltd., Chichester and
linear Optics (Nauka Publ., Moscow, 1964).
N.-Y., 1988), pp. 170-188.
79.
В. С. Горелик, В. А. Зубов, М. М. Сущинский и др.,
61. P. R. Griffiths, Appl. Spectrosc. 26, 73 (1972).
Письма ЖЭТФ 4, 52 (1966).
62. F. J. De Blase and S. Compton, Appl. Spectrosc. 45 (4),
80.
F. De Martini, Appl. Phys. 37, 4503 (1966).
611 (1991).
81.
D. H. McMahon and A. R. Franklin, J. Appl. Phys. 36,
63. J. Mink and G. Keresztury, Appl. Spectrosc. 47 (9),
2073 (1965).
1446 (1993).
82.
S. E. Terpugova, O. V. Degtyareva, V. V. Savransky,
64. E. L. Terpugov, O. V. Degtyareva, and V. V. Savransky,
et al., Am. J. Anal. Chem. 6,
731
(2015). DOI:
J. Rus. Laser Research 37 (5), 401 (2016).
10.4236/ajac.2015.69070
65. J. Breton, E. Nabedryk, and A. Clerici, Vib. Spectrosc.
83.
A. Tsuge, Y. Uwamino, and T. Ishizuka, Appl. Spec-
19, 71(1999).
trosc. 43 (7), 1145 (1989).
66. F. Garczarek, J. Wang, M. A. El-Sayed, et al., Biophys.
84.
M. Wolpert and P. Hellwig, Spectochim. Acta Part A
J. 87 (4), 2676 (2004).
64, 987(2006).
67. J. Wang and M. A. El-Sayed, Biophys. J. 90, 961
85.
A. M. Petrosyan and V. V. Ghazaryan, J. Mol. Struct.
(2001).
917, 56 (2009).
68. E. L. Terpugov and O. V. Degtyareva, Biochemistry
86.
Handbook of vibrational spectroscopy, Ed. by J. M. Chal-
(Moscow) 66, 1315 (2001).
mers and P. R. Griffiths (Wiley & Sons Ltd, 2002).
69. E. L. Terpugov and O. V. Degtyareva, J. Mol. Struct.
87.
М. В. Волькенштейн, М. А. Ельяшевич и
565-566, 287 (2001).
Б. И. Степанов, Колебания молекул (Гос. изд-во
70. A. G. Gagarinov, O. V. Degtyareva, A. A. Khodonov,
науч.-теор. лит-ры, М.-Л., 1949).
et al., Vibrat. Spectrosc. 42, 231 (2006).
88.
А. Н. Теренин, Фотоника молекул красителей
71. J. Wang and M. A. El-Sayed, Biophys. J. 83 (3), 1589
(Наука, Л., 1967).
(2002).
89.
D. D. Dlott, Chem. Physics 266, 149 (2001).
Fourier Transform Infrared Emission Spectroscopy
in the Studying of Biological Molecules
E.L. Terpugov
Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
Infrared spectroscopy is a powerful analytical tool that is yet to be fully developed in relation to biological sys-
tems. Previously, this method has been successfully used to analyze the secondary structure. This mini-review
shows the latest advances in the study of proteins using the Fourier transform infrared technique. The appli-
cation of Fourier transform infrared emission spectroscopy to the study of photophysical and photochemical
reactions in photoreceptor proteins is discussed.
Keywords: FT-IR spectroscopy, stimulated infrared emission, visible/infrared light, protein, protein-pigment com-
pex, aminoacids
БИОФИЗИКА том 65
№ 1
2020