БИОФИЗИКА, 2020, том 65, № 1, с. 17-23
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.322.9
К ВОПРОСУ О ВЫБОРЕ БЛОКИРУЮЩЕГО БЕЛКОВОГО АГЕНТА
ПРИ СОЗДАНИИ МЕТОДА ИММУНОХИМИЧЕСКОГО АНАЛИЗА
С ИСПОЛЬЗОВАНИЕМ ПОВЕРХНОСТНО-УСИЛЕННОЙ
РАМАНОВСКОЙ СПЕКТРОСКОПИИ
© 2019 г. А.Ю. Cубекин, В.И. Кукушкин*, Т.И. Новожилова,
С.П. Мамонтов, Л.В. Кулик*, Р.А. Хрусталёв
Государственный научно-исследовательский институт органической химии и технологии,
111024, Москва, шоссе Энтузиастов, 23
*Институт физики твердого тела РАН,
142432, Черноголовка Московской области, ул. Академика Осипьяна, 2
E-mail: kukushvi@mail.ru
Поступила в редакцию 10.07.2019 г.
После доработки 10.07.2019 г.
Принята к публикации 22.08.2019 г.
Целью работы является выбор блокирующего белкового агента для проведения быстрого и чувстви-
тельного иммунохимического анализа с использованием метода SERS (поверхностно-усиленной
рамановской спектроскопии). Для усиления сигнала рамановского рассеяния света от белковых
структур использована оптимизированная наноостровковая металл-диэлектрическая SERS-струк-
тура, а для измерения спектров усиленного оптического отклика использовался рамановский спек-
трометр с широким выходным лазерным пучком с длиной волны 532 нм. В результате проведенной
работы были оптимизированы SERS-подложки для получения высокоинтенсивного поверхностно-
усиленного рамановского рассеяния света от используемой в исследованиях метки (ТРИТЦ - тет-
раметилродамина изоцианат), также были изучены параметры адсорбции белков, традиционно ис-
пользуемых в твердофазном иммунохимическом анализе, и выбраны оптимальные - бычий сыво-
роточный альбумин и казеин. Показано, что при адсорбционном взаимодействии белка и SERS-по-
верхности действуют закономерности, описанные в классической адсорбционной теории.
Ключевые слова: рамановское рассеяние света, SERS, биосенсор, иммунохимический анализ, адсорбция
белков.
DOI: 10.31857/S0006302920010020
электрическом поле которой происходят осцил-
В последнее время области и объемы исполь-
ляции дипольного момента молекул. Все органи-
зования рамановской спектроскопии стреми-
ческие молекулы имеют характерные наборы
тельно расширяются. Этот вид оптической спек-
низкочастотных колебаний. Низкочастотное
троскопии является уникальным и мощным ин-
внутримолекулярное колебание атомов модули-
струментом для осуществления неразрушающего
рует высокочастотное колебание осциллирующе-
экспресс-метода в целях идентификации химиче-
го (и поэтому излучающего) дипольного момента
ских веществ и фармацевтических препаратов [1],
молекул. Из-за этого в спектре рассеянного света
обнаружения взрывчатых [2] и наркотических ве-
появляются частотные компоненты, сдвинутые
ществ [3], клинического исследования биологи-
относительно частоты лазерного излучения на ха-
ческих тканей и жидкостей [4], медицинской ди-
рактерные частоты внутримолекулярных колеба-
агностики состояния тканей [5] и др.
ний. Этот рамановский сдвиг позволяет одно-
Главная причина рамановского рассеяния све-
значно распознавать разнообразные вещества.
та в веществах заключается в том, что свет - это
электромагнитная волна, в высокочастотном
Однако чувствительность рамановских мето-
дов детектирования различных молекулярных
субстанций является чрезвычайно низкой, так
Сокращения: SERS - surface-enhanced Raman scattering (по-
верхностно-усиленная рамановская спектроскопия), как вероятность стоксовой компоненты раманов-
БСА - бычий сывороточный альбумин, ТРИТЦ - тетра-
метилродамина изоцианат.
ского рассеяния света составляет 10-6, что ставит
17
18
CУБЕКИН и др.
под сомнение возможность использования рама-
500 нм помимо рамановского сигнала возникает
новской спектроскопии для детектирования низ-
интенсивная фотолюминесценция, которая пре-
ких концентраций веществ. Эту ситуацию можно
пятствует надежному измерению рамановского
радикально изменить, если исследуемые молеку-
рассеяния света. Самый простой способ подавле-
лы нанести, к примеру, вблизи границы раздела
ния сигнала фотолюминесценции заключается в
металла и диэлектрика, на которой формируются
уменьшении энергии фотонов накачки (ниже ха-
поверхностные плазмон-поляритоны и происхо-
рактерной ширины запрещенной зоны молеку-
дит фокусировка электромагнитного излучения
лы). И наконец, чувствительность рассматривае-
вблизи границы раздела этих сред. При взаимо-
мого метода может быть значительно увеличена
действии молекул веществ, находящихся на таких
за счет эффектов резонансной рамановской спек-
поверхностях, с усиленным электромагнитным
троскопии. Традиционные наноостровковые ме-
полем происходит значительное увеличение ин-
талл-диэлектрические SERS-подложки имеют
тенсивности рамановского рассеяния света - в
пик плазмонного поглощения на длинах волн
450-600 нм. По этим причинам наиболее целесо-
105-107 раз [6]. Это явление называется поверх-
образным представляется использование лазер-
ностно-усиленным рамановским рассеянием
ного излучения в диапазоне длин волн 500-
света (в англоязычной литературе SERS - surface-
550 нм для детектирования SERS-сигналов ис-
enhanced Raman scattering) и используется при со-
следуемых веществ.
здании биосенсоров. Эти биосенсоры являются
чрезвычайно перспективными для решения задач
После выбора длины волны лазерного излуче-
по высокочувствительному и быстрому детекти-
ния второй важной задачей в процессе создания
рованию белковых молекул при проведении им-
метода иммунохимического анализа на основе
мунохимического анализа
[7]. Применение
SERS-эффекта является подбор блокирующего
SERS-репортеров, т. е. молекул, обладающих ин-
агента. При проведении теста свободные сайты
дивидуальным высокоинтенсивным раманов-
на поверхности твердой фазы, не связанные с
ским спектром, в качестве маркеров исследуемых
анализируемым антигеном, могут неспецифиче-
белков способствует дополнительному усилению
ски фиксировать меченые антитела, что приводит
сигнала [8].
к повышению фонового сигнала. Для предотвра-
щения неспецифического связывания после им-
Оптимизация методов иммунного анализа с
мобилизации на твердую фазу аналита проводят
использованием SERS-биосенсоров особенно
обработку нейтральными для теста веществами -
актуальна для создания чувствительной, селек-
блокирующими агентами.
тивной и быстрой диагностики различных пато-
генов, что имеет первостепенное значение при
К блокирующим агентам предъявляются сле-
обеспечении экологической и биологической
дующие требования:
безопасности, а также в случаях, требующих не-
- отсутствие конкуренции с антигеном за цен-
отложной медицинской помощи. SERS-биосен-
тры адсорбции на поверхности;
соры можно рассматривать как хорошую альтер-
- отсутствие маскирующих для антител
нативу широко применяемым в настоящее время
свойств;
методам твердофазного иммуноферментного
- большая аффинность к поверхности по
анализа, которые, к сожалению, не являются экс-
пресс-методами.
сравнению с антителами;
- инертность по отношению к антителам, от-
При создании высокочувствительной методи-
сутствие перекрестного взаимодействия.
ки детектирования белков на основе поверхност-
но-усиленного рамановского рассеяния света в
Приемлемый блокирующий агент подбирает-
первую очередь необходимо выбрать длину вол-
ся для конкретного исследования в процессе оп-
ны лазерного излучения. Важность правильного
тимизации методики. Широкое распространение
выбора обусловлена несколькими причинами.
в иммуноферментном анализе получили такие
Возбуждение рамановского рассеяния света вы-
вещества, как бычий сывороточный альбумин
сокочастотным лазерным излучением по сравне-
(БСА) [9], казеин [2], обезжиренное молоко [10] и
нию с низкочастотным излучением имеет на по-
ряд других. В случаях, когда аналитический от-
рядок большую эффективность вследствие выра-
клик сильно зависит от расстояния между SERS-
женной частотной зависимости рамановской
репортером и поверхностью с плазмонными
активности молекул. Кроме этого, чувствитель-
свойствами [6], на которой образуется иммунный
ность (квантовая эффективность) кремниевых
комплекс, рекомендуется применять в качестве
матриц-детекторов является функцией длины
блокирующих агентов низкомолекулярные веще-
волны излучения. Максимум их чувствительно-
ства, например глутатион [11] и подобные ему со-
сти приходится на диапазон 450-550 нм. К тому
единения, содержащие амино- или сульфгид-
же при фотовозбуждении с длинами волн 350-
рильную группы.
БИОФИЗИКА том 65
№ 1
2020
К ВОПРОСУ О ВЫБОРЕ БЛОКИРУЮЩЕГО БЕЛКОВОГО АГЕНТА
19
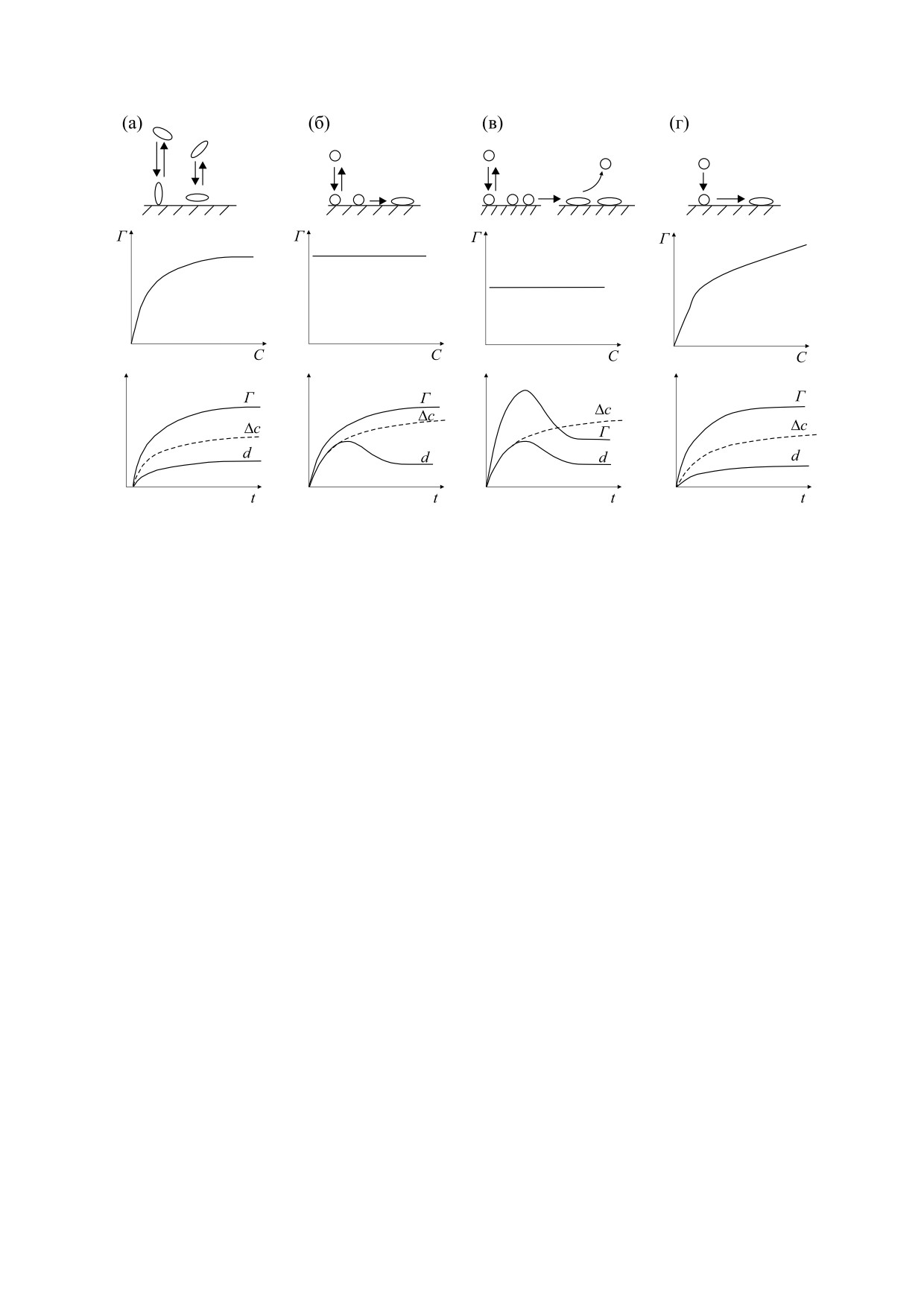
Рис. 1. Возможные процессы взаимодействия белков с поверхностью с соответствующими им изотермами и
кинетическими кривыми адсорбции [14]. Г - количество адсорбированного белка; Δс - количество необратимо
адсорбированного белка; d - толщина белкового слоя.
Ключевым моментом при создании метода
ствует изотерме Лэнгмюра, однако толщина бел-
иммунного анализа является изучение адсорбции
кового слоя на поверхности твердой фазы вслед-
его компонентов. На сегодняшний день суще-
ствие переориентации молекул становится мень-
ствует множество работ, посвященных адсорбци-
ше. Изменение ориентации молекулы с
онному взаимодействию белков с различными
увеличением площади адсорбции приводит к уве-
поверхностями (кремнезем, силикагель, различ-
личению десорбции белка (рис. 1в), что соответ-
ные пластики для иммуноферментного анализа)
ствует наличию локального максимума на кине-
и влиянию условий адсорбции [12,13]. Известны
тической кривой и уменьшению толщины белко-
вого слоя на поверхности твердой фазы. И
модели адсорбции белков из одно- и многоком-
наконец, когда все адсорбированные молекулы,
понентных систем, созданные на основании тео-
изменяя конформацию, переходят в необратимо
ретических расчетов уравнения Лэнгмюра и на
адсорбированное состояние (рис. 1г), кинетиче-
многочисленных экспериментальных данных
ские кривые имеют не пологий наклон, как в
[14]. В этой работе представлена обширная теоре-
классической кривой, а скорее похожи на пря-
тическая база для понимания процессов адсорб-
мую, меняющую угол наклона [14]. Таким обра-
ции белков из растворов на поверхности твердых
зом, при создании метода анализа белковых
фаз различной природы (пластик, стекло и др.).
структур, в котором существенную роль играют
Выкладки с описанием возможных процессов
адсорбционные процессы, необходимо правиль-
взаимодействия белков с поверхностью, заслужи-
но выбрать эффективный блокирующий агент,
вающие особого внимания в рамках нашей ста-
изучить его адсорбцию как индивидуально, так и
тьи, представлены на рис. 1.
в присутствии других иммунореагентов для пони-
мания их взаимодействия друг с другом на по-
Из представленных на рис. 1 данных автор де-
верхности в условиях эксперимента.
лает вывод, что при отсутствии белок-белкового
взаимодействия на поверхности сорбента адсорб-
ция белка соответствует изотерме Лэнгмюра и
МАТЕРИАЛЫ И МЕТОДЫ
гладкой кинетической кривой (рис. 1а). В случае
если молекулы белка обратимо адсорбируются в
1. Для измерения спектров рамановского рассея-
одном конформационном (или ориентационном)
ния света использовали рамановский спектрометр
состоянии, но затем часть из них может перейти в
EnSpectr SERS R532 (Enhanced Spectrometry, США)
необратимо
адсорбированное
состояние
с широким выходным лазерным пучком, который за
(рис. 1б), кинетическая кривая также соответ-
одно измерение проводил усреднение сигнала со
БИОФИЗИКА том 65
№ 1
2020
20
CУБЕКИН и др.
Рис. 2. (а) - Микрофотография поверхности островковой SERS-подложки, полученная на сканирующем электронном
микроскопе; (б) - гистограмма распределения наночастиц по размерам; (в) - спектр поглощения SERS-подложки; (г) -
SERS-спектр ТРИТЦ на полученной подложке.
позиции проводили промывку дистиллирован-
всей площади SERS-зон (4 мм2) и тем самым мини-
ной водой, подложку высушивали на воздухе и
мизировал ошибку измерения, связанную с неодно-
измеряли SERS-сигнал (по пику ТРИТЦ при
родностью распределения молекул по поверхности
подложки. Длина волны лазерного излучения со-
1640 см-1). Процедуру повторяли до достижения
ставляла 532 нм, мощность - 30 мВт, спектральный
суммарного времени адсорбции 60 мин.
диапазон - 100-4000 см-1, спектральное разреше-
6. Десорбцию белков проводили погружением
подложки с иммобилизованным меченым белком
ние - 6 см-1.
(сигнал предварительно измеряли) в раствор три-
2. SERS-структуру для детектирования белко-
тона Х-100 с концентрацией 0,2% в фосфатном
вых структур в низких концентрациях формиро-
физиологическом буфере, подложку выдержива-
вали на поверхности кремния с выращенным
ли определенное время, ополаскивали дистилли-
слоем оксида кремния SiO2 с помощью установки
рованной водой от избытка буфера, высушивали
вакуумного термического напыления NANO 38
на воздухе, после чего проводили измерение сиг-
(скорость напыления серебра - 0,4 Å/с, толщина
нала. Процедуру повторяли до достижения сум-
эквивалентной пленки 60 Å) и последующим тер-
марного времени десорбции 60 мин.
мическим отжигом при температуре 120°С в тече-
ние 6 мин.
РЕЗУЛЬТАТЫ
3. БСА, папаин и флуоресцентный краситель
тетраметилродамина изоцианат (ТРИТЦ) полу-
По разработанной нами методике были полу-
чены от компании Sigma-Aldrich (США), а казеин
чены и охарактеризованы серебряные SERS-суб-
от компании Serva (Германия).
страты на основе оксида кремния. Результаты
4. Меченые белки синтезировали в соответ-
этой работы представлены на рис. 2.
ствии со стандартной методикой [15].
Как видно на фотографии (рис. 2а), при напы-
5. Адсорбцию меченых белков (БСА, казеин,
лении серебра толщиной эквивалентной пленки
папаин) проводили погружением подложки в их
60 Å с последующим термическим отжигом под-
растворы с концентрацией 0,1 мг/мл в физиоло-
ложки при 120°C поверхность SERS-зон покры-
гическом фосфатном буфере (рН 7,4). После экс-
валась серебряными гранулами, средний размер
БИОФИЗИКА том 65
№ 1
2020
К ВОПРОСУ О ВЫБОРЕ БЛОКИРУЮЩЕГО БЕЛКОВОГО АГЕНТА
21
Рис. 3. (а) - Кинетические кривые адсорбции белков, (б) - кинетические кривые десорбции БСА, (в) - кинетические
кривые десорбции папаина, (г) - кинетические кривые десорбции казеина.
которых в плоскости подложки составлял 23 нм
традиционно используемых в твердофазном им-
(рис. 2б), средняя высота гранул - 8 нм, средний
муноферментном анализе. Результаты этого ис-
зазор между ними - 22,5 нм. Диэлектрические
следования представлены на рис. 3.
проницаемости серебра и оксида кремния обес-
Из данных рис. 3а следует, что БСА соответ-
печивают подстройку пика плазмонного погло-
щения (рис. 2в) данной SERS-структуры (560 нм)
ствует адсорбционной модели, представленной
на рис. 1в. Сначала под действием градиента кон-
вблизи длины волны выбранного нами лазерного
излучения (532 нм). Нанесенное на подложку ве-
центрации на подложку адсорбируется макси-
щество ТРИТЦ показало высокоинтенсивный
мальное количество белка. Однако большая часть
усиленный сигнал рамановского рассеяния света
белковых молекул адсорбирована обратимо. Да-
(рис. 2г).
лее следуют конформационные изменения бел-
ковых молекул на поверхности подложки или их
Таким образом, полученные SERS-подложки
переориентация относительно поверхности вви-
удовлетворяют требованиям по дисперсности ча-
ду геометрической анизотропии. В результате
стиц по форме и размеру, а также дают равномер-
действия того или иного процесса происходит де-
ное распределение кластеров по поверхности.
сорбция обратимо связанных молекул с поверх-
Спектр поверхностно-усиленного рамановского
ности подложки и на кинетической кривой ад-
рассеяния света от используемого в исследовани-
сорбции наблюдается локальный максимум. Па-
ях красителя показывает хорошую интенсив-
паин ведет себя по классической модели
ность.
адсорбции Лэнгмюра (рис. 1а), что говорит о том,
Для выбора блокирующего агента, пригодного
что большинство молекул связано с SERS-под-
для последующего создания метода иммунного
ложкой обратимо. Казеин ведет себя согласно
анализа с использованием SERS-детекции, изу-
модели, близкой к рис. 1в. Наличие локального
чали параметры адсорбции некоторых белков,
максимума на кинетической кривой адсорбции
БИОФИЗИКА том 65
№ 1
2020
22
CУБЕКИН и др.
казеина можно связать с конформационны-
По результатам работы можно сделать вывод о
ми/ориентационными перестройками белковых
том, что в качестве блокирующих агентов для им-
молекул, переходящих в необратимо связанное
мунного анализа с применением SERS-эффекта
состояние, и частичной десорбцией.
предпочтительнее использовать БСА или казеин,
так как высокое удельное содержание необратимо
Были поставлены опыты (рис. 3б-г) по де-
адсорбированных молекул дает основания пола-
сорбции каждого из белков (см. раздел «Материа-
гать, что при постановке метода применяемый бе-
лы и методы», п. 6). Из данных рисунков следует,
лок не будет частично или полностью вытеснен с
что десорбция присутствует в каждом опыте и с
поверхности антителами к исследуемому аналиту.
течением времени достигает своего предела, со-
ответствующего необратимо связавшемуся коли-
честву белка. На рис. 3б видно, что при адсорбции
ФИНАНСИРОВАНИЕ РАБОТЫ
БСА на SERS-подложку в течение 2 мин белок
Исследование выполнено при финансовой
смывается с подложки интенсивнее, чем при вре-
поддержке Российского научного фонда (проект
мени его адсорбции 20 мин. Остаточный сигнал
№ 19-72-30003).
соответственно составил 65 и 95% от исходного.
На рис. 3в видно, что папаин десорбируется с
подложки одинаково хорошо для обеих точек ад-
КОНФЛИКТ ИНТЕРЕСОВ
сорбционной кривой, остаточный сигнал по от-
ношению к исходному составил 59% в случае
Авторы заявляют об отсутствии конфликта
2 мин и 62% - для 20 мин адсорбции. Из рис. 3г
интересов.
следует, что казеин, аналогично БСА, хорошо
смывается с подложки при времени его адсорб-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ции 2 мин и практически полностью остается
прикрепленным при времени его адсорбции
Настоящая работа не содержит описания ка-
20 мин. Остаточный сигнал составил 75 и 95 % со-
ких-либо исследований с использованием людей
ответственно.
и животных в качестве объектов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
СПИСОК ЛИТЕРАТУРЫ
1. A. Kudelski, Talanta 76 (1), 1 (2008).
В результате проделанной работы были полу-
2. R. Monjezi, S. Tan, B. Tey, et al., J. Virol. Methods 187
чены SERS-подложки, дающие значительное
(1), 121 (2013).
усиление рамановского сигнала выбранной для
аналитических целей метки (ТРИТЦ). На них
3. M. Sanles-Sobrido, L. Rodríguez-Lorenzo, and S. Lo-
renzo-Abalde, Nanoscale 1 (1), 153 (2009).
были изучены адсорбционные свойства белковых
веществ, наиболее часто употребляемых в каче-
4. S. Stockel, J. Kirchhoff, U. Neugebauer, et al., J. Ra-
стве блокирующих агентов в классическом имму-
man Spectroscopy 47 (1), 899 (2016).
ноферментном анализе. Показано, что при
5. G. W. Auner, S. K. Koya, C. Huang, et al., Cancer Me-
адсорбционном взаимодействии белка и SERS-
tastasis Rev. 37 (4), 691 (2018).
поверхности действуют закономерности, описан-
6. A. Wokaun, H.-P. Lutz, A. P. King, et al., J. Chern.
ные в классической адсорбционной теории.
Phys. 79 (1), 509 (1983).
7. A. Kaminska, E. Witkowska, K. Winkler, et al., Bios-
Из полученных данных следует, что при дости-
ens. Bioelectron. 66, 461 (2015).
жении равновесного состояния БСА и казеин яв-
8. K. Faulds, W. E Smith., and D. Graham, Anal. Chem.
ляются необратимо адсорбированными на по-
76 (2), 412 (2004).
верхности SERS-подложек. Интерпретация ки-
9. B. Dan, Zh. Huisheng, Y. Guangxin, and P. Xianyin,
нетических
кривых адсорбции хорошо
Anal. Methods 7 (1), 99 (2015).
коррелирует с данными по десорбции белков. В
10. T. Kuczius, K. Becker, A. Fischer, et al., Anal. Bio-
момент времени, когда еще не достигнута точка
chem. 431 (1), 4 (2012).
локального максимума (2 мин, рис. 3а), суще-
ственная часть белковых молекул адсорбирована
11. D. V. Rodrigo, J. Liu, C. Zhou, et al., ACS Appl. Mater.
обратимо, а после достижения равновесного со-
Interfaces 6 (15), 11829 (2014).
стояния практически все молекулы переходят в
12. Т. Д. Хохлова, Вестн. МГУ. Сер. Химия 43 (3), 144
необратимо связанное состояния. Приведенные
(2002).
выше данные по десорбции (рис. 3б,г) подтвер-
13. Н. А. Эльтекова и А. Ю. Эльтеков, Физикохимия
ждают это. При адсорбции папаина отношение
поверхности и защита материалов 46 (1), 56 (2010).
необратимо адсорбированных молекул к общему
14. В.И. Севастьянов, Биосовместимость (ИЦ
их числу примерно всегда одинаково и составляет
ВНИИгеосистем, М., 1999).
около 60% вне зависимости от того, достигнуто
15. Л. И. Казакова, А. В. Дубровский, И. М. Санталова
состояние равновесия или нет (рис. 3в).
и др., Биоорган. химия 38 (1), 64 (2012).
БИОФИЗИКА том 65
№ 1
2020
К ВОПРОСУ О ВЫБОРЕ БЛОКИРУЮЩЕГО БЕЛКОВОГО АГЕНТА
23
Choice of Protein Blocking Agent in Development
of a Method for Immunochemical Assay Using Surface-Enhanced
Raman Spectroscopy
A.Yu. Subekin*, V.I. Kukushkin**, T.I. Novozhilova*, S.P. Mamontov*,
L.V. Kulik**, and R.A. Khrustalev*
*State Research Institute of Organic Chemistry and Technology,
shosse Entuziastov 23, Moscow, 111024 Russia
**Institute of Solid State Physics, Russian Academy of Sciences,
ul. Akademika Ossipyana 2, Chernogolovka, Moscow Region, 142432 Russia
The aim of the work is to choose a protein blocking agent for fast and sensitive immunochemical analysis us-
ing surface-enhanced Raman spectroscopy. An optimized SERS-based metal-dielectric nanostructure was
used to obtain higher enhancement factor of Raman scattering protein molecules, and a Raman spectrometer
with a wide output, imaged with the 532 nm laser line was employed to measure enhanced optical spectra of
molecular adsorbates. Ultimately, SERS-substrates were optimized to obtain high-intensity surface-en-
hanced Raman scattering from the dye used in the studies (Tetramethylrhodamine isothiocyanate). Param-
eters of the adsorption process of proteins typically used in solid-phase immunochemical analysis were ex-
plored, and bovine serum albumin and casein were chosen for optimum assay results. It is shown that the in-
teraction of a protein and SERS substrate during adsorption occurs according to classical theoretical
description of adsorption.
Keywords: Raman scattering, SERS, biosensor, immunochemical analysis, protein adsorption
БИОФИЗИКА том 65
№ 1
2020