БИОФИЗИКА, 2020, том 65, № 1, с. 24-28
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ОБ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА АМИЛОИДНЫМИ
АГРЕГАТАМИ ПЕПТИДОВ Aβ(1-40) И Aβ(1-42): ФАКТЫ
И ПРЕДПОЛОЖЕНИЯ
© 2020 г. Э.И. Якупова*, Л.Г. Бобылёва*, И.М. Вихлянцев*, **, А.Г. Бобылёв*, **
*Институт теоретической и экспериментальной биофизики РАН,
142290, Пущино Московской области, ул. Институтская, 3
**Пущинский государственный естественно-научный институт,
142290, Пущино Московской области, просп. Науки, 3
E-mail: yakupova.mira@mail.ru
Поступила в редакцию 20.11.2019 г.
После доработки 20.11.2019 г.
Принята к публикации 29.11.2019 г.
В статье поднят вопрос о способности активации системы комплемента амилоидными агрегатами,
в частности амилоидными фибриллами пептидов Aβ(1-40) и Aβ(1-42), обнаруживаемых при болез-
ни Альцгеймера в головном мозге. В 1992 г. на основании данных о колокализации амилоидных
включений и белков системы комплемента в мозгу пациентов с болезнью Альцгеймера было выска-
зано предположение о прямой активации этой системы амилоидами. Впоследствии был опублико-
ван еще ряд работ в пользу такого предположения. В ходе наших исследований эти данные не под-
тверждаются. Так активируют ли амилоиды систему комплемента, а если нет, то что же ее активи-
рует? На эти вопросы авторы пытаются ответить в данной статье.
Ключевые слова: система комплемента, амилоиды, амилоидозы, болезнь Альцгеймера.
DOI: 10.31857/S0006302920010032
С описания в XVII веке увеличенной селезен-
болезнь Альцгеймера, которую связывают с на-
ки женщины началась история изучения амилои-
коплением в головном мозге амилоидных отло-
дозов - заболеваний, связанных с отложением в
жений пептидов Aβ(1-40) и Aβ(1-42) [1-3]. Из-
тканях органов амилоидных включений [1]. В
вестно, что для этого заболевания также харак-
дальнейшем были описаны амилоидозы таких
терно интенсивное нейровоспаление, в котором
органов, как печень, почки и ряда других, что по-
задействована и система комплемента [5].
служило началом исследования природы данных
Система комплемента является частью врож-
заболеваний [1,2].
денной иммунной системы и состоит из большо-
К настоящему времени известно, что амилои-
го количества различных белков плазмы, которые
ды представляют собой агрегаты/фибриллы пеп-
реагируют друг с другом, чтобы опсонизировать
тида или белка, который претерпел частичное
патогены, и вызывают ряд воспалительных реак-
или полное разворачивание своей аминокислот-
ций, которые помогают бороться с инфекцией
ной цепи и впоследствии дальнейшего сворачи-
[4]. Существуют три пути активации комплемен-
вания сформировал неправильную конформа-
та: 1) классический путь, который запускается
цию. В конечном счете пептидные цепи форми-
антителом или напрямую связыванием компо-
руют сложную кросс-β-структуру, наделяющую
нента комплемента C1q с поверхностью патогена;
амилоиды такими свойствами, как нераствори-
2) лектиновый (маннозный) путь, который ини-
мость и устойчивость к протеолизу [3]. Из-за это-
циируется маннансвязывающим лектином, нор-
го происходит накопление/отложение амилоидов
мальным компонентом сыворотки, связываю-
и связанные с этим серьезные изменения в мета-
щимся с некоторыми инкапсулированными
болизме тканей и органов [4], что, как считается,
бактериями; 3) альтернативный путь, запускаю-
приводит к развитию амилоидозов.
щийся непосредственно на поверхности патогена
Более тридцати различных амилоидогенных
[4]. Заключительный итог любого из трех путей
белков на сегодняшний день причисляют к тем
активации комплемента - это образование мем-
или иным заболеваниям у людей [1-3]. Наиболь-
бранного атакующего комплекса C5b-9, макро-
шую известность среди амилоидозов приобрела
молекулы, состоящей из C5-, C6-, C7-, C8- и
24
ОБ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА
25
множественных C9-фрагментов системы
[4].
которые должны были активировать систему
Комплекс C5b-9 связывается с клеточной мем-
комплемента. Однако они также не активировали
браной, формируя трансмембранный канал, про-
систему комплемента. Полученные результаты
воцируя свободную диффузию ионов и малых мо-
легли в основу дискуссии о способности актива-
лекул в клетку и из нее, нарушая клеточный го-
ции системы комплемента амилоидными агрега-
меостаз, что в конечном итоге приводит к лизису
тами, в частности амилоидными фибриллами
клетки, если на клетке собирается достаточное
пептидов Aβ(1-40) и Aβ(1-42), обнаруживаемых в
количество мембранного атакующего комплекса
головном мозге при болезни Альцгеймера.
[4]. Примечательно, что мембранный атакующий
комплекс также может вызывать лизис соседних
МАТЕРИАЛЫ И МЕТОДЫ
здоровых клеток организма [6].
В 1992 г. были проведены иммуногистохими-
В ходе настоящей работы использовали стан-
ческие исследования, которые показали, что бе-
дартную методику формирования амилоидных
лок C1q колокализуется с амилоидными отложе-
фибрилл пептидов Aβ: синтетические пептиды
ниями Aβ-пептидов в мозге пациентов с болез-
Aβ(1-40) и Aβ(1-42) (Sigma, США) были раство-
нью Альцгеймера
[7]. Было сделано пред-
рены в 100%-м диметилсульфоксиде до концен-
положение, что Aβ-амилоиды активируют сис-
трации 10 мг/мл, после чего разводились биди-
тему комплемента. Последующие исследования,
стилированной H2O до концентрации 1 мг/мл, а
проведенные in vitro, подтвердили возможность
затем до 0.3 мг/мл буферным раствором, содер-
прямой активации системы комплемента ами-
жащим 0.1 М трис-HCl, pH 7.4. В таком разведе-
лоидными фибриллами по классическому пути
нии образцы двое суток инкубировали при темпе-
при отсутствии антител [7-14]. Прямая анти-
ратуре 37°C. Далее амилоидные фибриллы с раз-
тело-независимая активация системы компле-
личной концентрацией инкубировали в течение
мента фибриллами Aβ-пептидов была продемон-
ночи в 96-луночных планшетах при температуре
стрирована и для альтернативного пути [15-17].
4°C. Выявление факта формирования амилоид-
Кроме того, было показано, что активация ком-
ных фибрилл происходило при помощи поликло-
племента фибриллами Aβ-пептидов in vitro при-
нальных LOC-антител (Millipore, США), специ-
водит к образованию C5a - мощного цитокин-
фически связывающихся с амилоидными фиб-
подобного продукта расщепления C5, а также к
риллами и фибриллярными олигомерами белков.
сборке провоспалительного мембранного атаку-
Процедура проведения твердофазного иммуно-
ющего комплекса C5b-9 [12, 15]. Показано, что
ферментного анализа для исследования связыва-
многие белки, входящие в состав системы ком-
ния амилоидных фибрилл с белками системы
племента, включая C1q, C4, C3, C5, C6, C7, C8,
комплемента представлена на рис. 1. Для этого
C9, фрагменты активации C3, C4 и C5b-9, также
использовали следующие материалы: бычий сы-
колокализуются с отложениями Aβ и нейрофиб-
вороточный альбумин, белки системы компле-
риллярными клубками в головном мозге пациен-
мента C1q (Sigma, США) и C3b (Millipore, США),
тов с болезнью Альцгеймера [10, 12, 18-20]. Исхо-
сыворотка крови человека (Millipore, США); пер-
дя из этих данных, считается, что при данном за-
вичные поликлональные антитела кролика про-
болевании активация системы комплемента
тив C1q (Thermo Scientific, США) (1 : 1000) и мо-
усиливает нейровоспалительный процесс вслед-
ноклональные антитела мыши против C3
ствие непосредственного связывания системы
(ab11871; Abcam, Великобритания) (1 : 1000); вто-
комплемента с амилоидными фибриллами. Раз-
ричные антитела козла, конъюгированные с ще-
рабатываются даже новые терапевтические под-
лочной фосфатазой против антител кролика или
ходы для уменьшения повреждения при нейро-
мыши (ab6722/ab6790 (1:3000); Abcam, Велико-
воспалении от воздействия системы комплемента
британия), раствор NBT/BCIP (Roche, Швейца-
при развитии болезни Альцгеймера [21].
рия).
Учитывая все вышесказанное и проводя соб-
ственные исследования амилоидной агрегации
мышечного белка титина [22], мы заинтересова-
РЕЗУЛЬТАТЫ
лись вопросом о возможной антитело-независи-
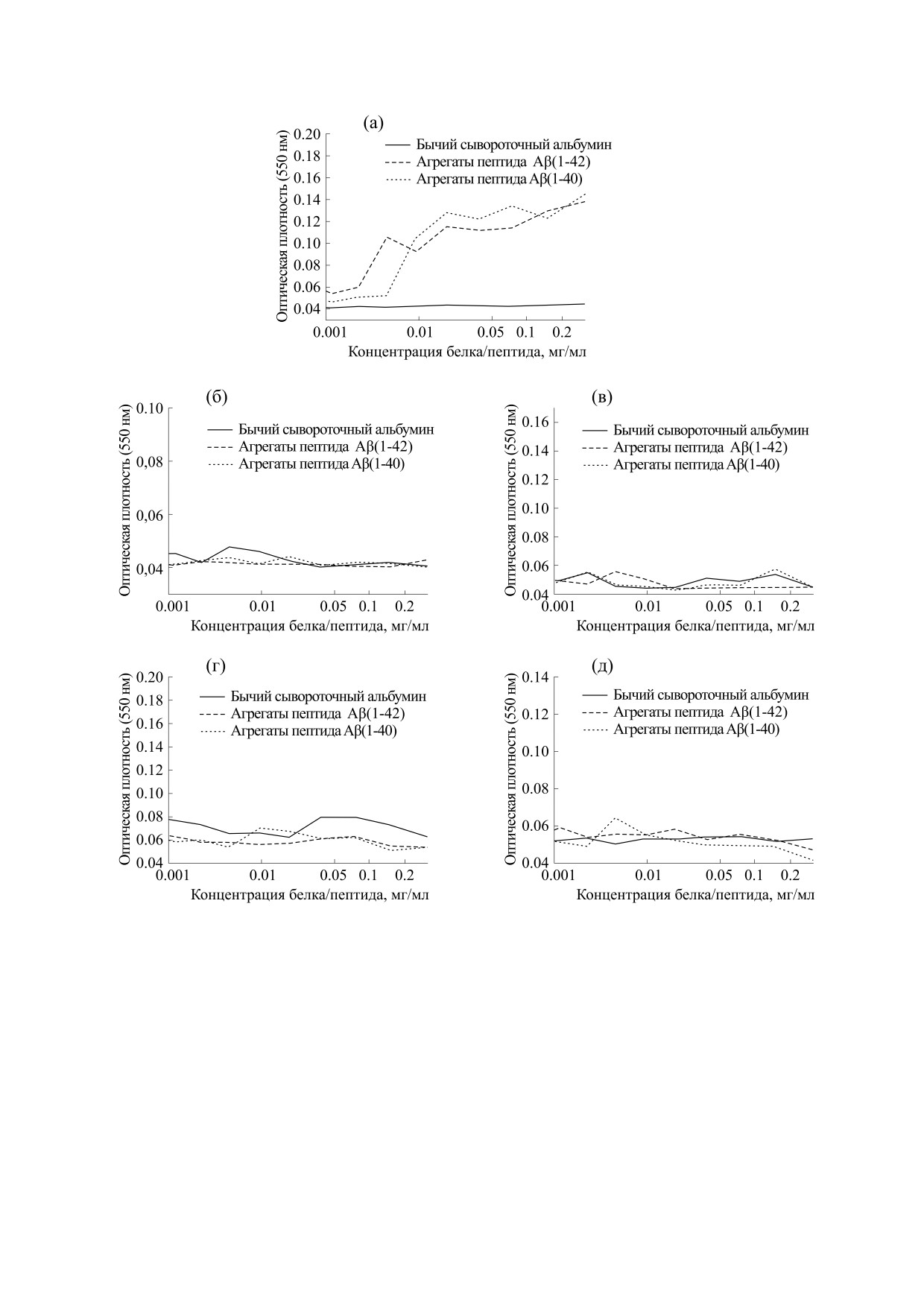
В ходе нашего эксперимента были сформиро-
мой активации системы комплемента амилоида-
ваны амилоидные фибриллы пептидов Aβ(1-40) и
ми этого белка. В ходе наших экспериментов не
Aβ(1-42), что подтверждается их связыванием с
было обнаружено активации системы компле-
амилоидо-специфическими антителами LOC
мента аморфными амилоидными агрегатами ти-
(рис. 2а). Исследования по связыванию фибрилл
тина [23], что, по-видимому, исключает его роль в
развитии воспаления при мышечных амилоидо-
Aβ-пептидов с белками системы комплемента
зах. В этих экспериментах в качестве положитель-
(см. схему на рис. 1) как при использовании от-
ного контроля мы пытались использовать амило-
дельных белков C1q (рис. 2б) и C3b (рис. 2в), так
идные фибриллы пептидов Aβ(1-40) и Aβ(1-42),
и сыворотки крови, содержащей эти белки
БИОФИЗИКА том 65
№ 1
2020
26
ЯКУПОВА и др.
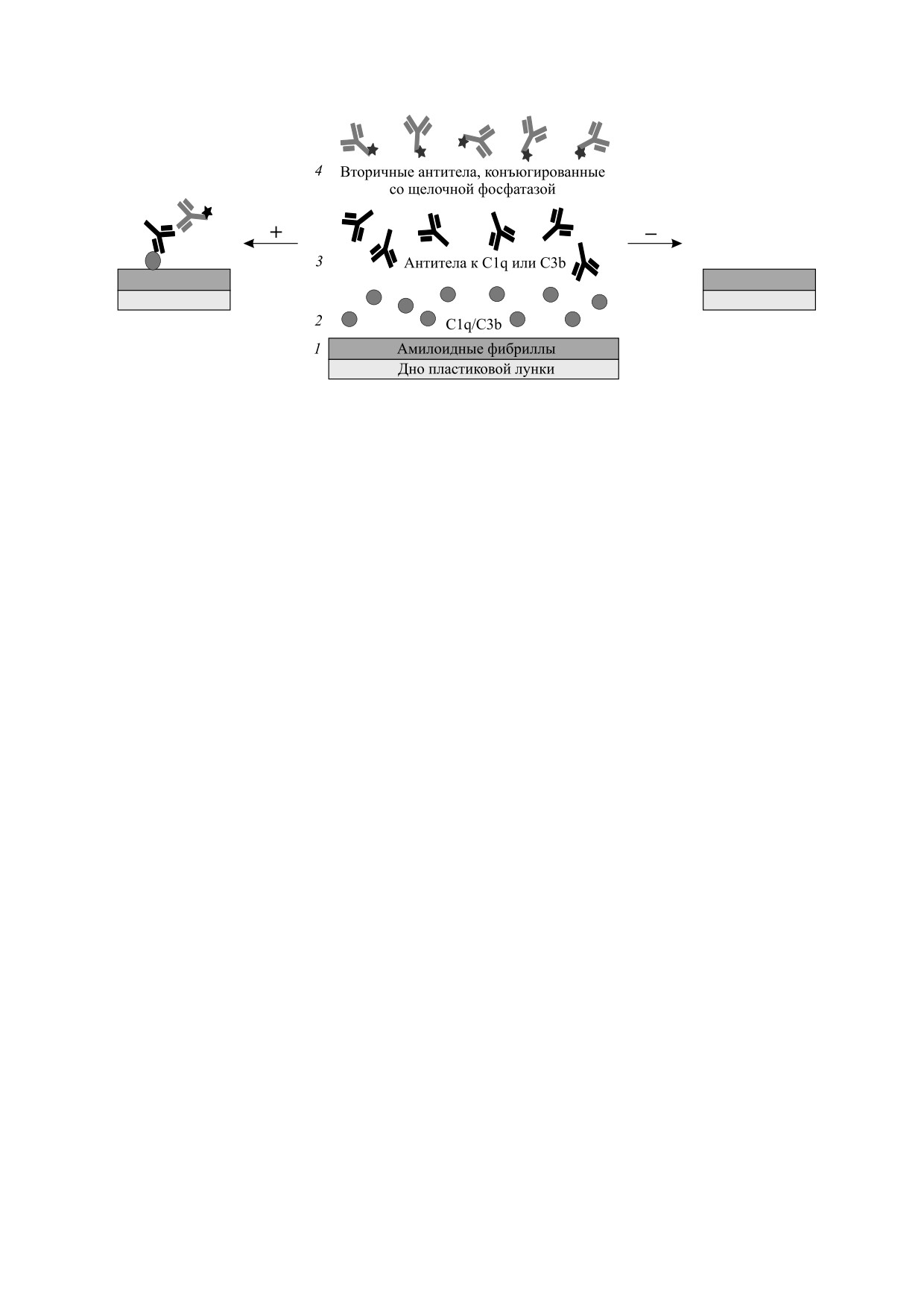
Рис. 1. Схема твердофазного иммуноферментного анализа для исследования связывания системы комплемента с
амилоидными фибриллами. Этапы: 1 - фиксация амилоидных фибрилл на пластиковых стенках 96-луночных
планшетов (инкубация в лунках в течение ночи при 4°C); 2 - после блокировки свободных участков планшетов сухим
молоком, разведенным в фосфатном буферном растворе, в течение часа при 37°С в лунки добавляли либо отдельные
белки системы комплемента C1q или C3b в фосфатном буферном растворе, либо содержащую их сыворотку крови
человека, на 2 ч при 37°С; 3 - после трехкратной промывки фосфатным буферным раствором на 1 ч при 37°С
добавляли первичные антитела против белков C1q или C3b; 4 - после трехкратной промывки фосфатным буферным
раствором на 1 ч при 37°С добавляли вторичные антитела против первичных антител. Для визуализации связывания
(стрелка влево) или демонстрации отсутствия связывания (стрелка вправо) исследуемых амилоидных фибрилл с
белками системы комплемента добавляли раствор NBT/BCIP и проводили спектрофотометрическое исследование. В
качестве отрицательного контроля вместо амилоидных фибрилл использовали бычий сывороточный альбумин.
(рис. 2г,д), не выявили положительной реакции.
было обнаружено увеличение популяций бакте-
Таким образом, в наших экспериментах не выяв-
рий в сравнении с мозгом здоровых людей [24].
лена способность амилоидных фибрилл пептидов
Авторы высказали предположение о возможном
Aβ(1-40) и Aβ(1-42) активировать систему ком-
вкладе таких микроорганизмов, как Firmicutes,
племента.
Actinobacteria и в особенности P. acnes, в развитие
нейровоспаления в мозге больных [24]. Учитывая
предположение об антимикробных свойствах
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
амилоидных агрегатов [25], колокализация ами-
Результаты наших экспериментов поднимают
лоидов и системы комплемента, выполняющих
вопрос о противоречивости данных, полученных
одну и ту же роль, не кажется неожиданной. Та-
в разных лабораториях, при исследовании акти-
ким образом, вполне вероятно, что не фибриллы
вации системы комплемента амилоидными агре-
Aβ-пептидов или другие компоненты амилоид-
гатами. Мы не подвергаем сомнению то, что
ных включений, а в большей мере микроорганиз-
белки системы комплемента действительно коло-
мы участвуют в активации системы комплемента
кализуются с амилоидными отложениями/бляш-
при развитии нейровоспаления у больных болез-
ками. Однако стоит помнить, что в состав амило-
нью Альцгеймера.
идных включений в тканях органов помимо Aβ-
пептидов входят и другие компоненты, например
В контексте обсуждаемых результатов также
гликозаминогликаны, аполипопротеин Е, амило-
необходимо упомянуть следующие данные. В
идный компонент сыворотки P [3]. Но связь с ак-
проведенных недавно исследованиях с помощью
тивацией системы комплемента была выявлена
криоэлектронной микроскопии было продемон-
только в случае Aβ-пептидов. Полученные
стрировано, что выделенные и очищенные ами-
нами результаты свидетельствуют о том, что ами-
лоидные фибриллы Aβ-пептидов из ткани мозга
лоидные агрегаты титина и пептидов Aβ(1-40) и
пациентов с болезнью Альцгеймера полиморфны
Aβ(1-42) не участвуют в активации системы ком-
и структурно отличаются от фибрилл, которые
племента. Тогда что же может ее активировать?
формируются in vitro [5]. В частности, получен-
Возможно, что непосредственно микроорганиз-
ные из мозга амилоидные фибриллы Aβ-пепти-
мы. В подтверждение этому имеются следующие
дов являются, как отмечают авторы работы, пра-
данные. В мозге больных болезнью Альцгеймера
возакрученными, а их in vitro аналоги - левоза-
БИОФИЗИКА том 65
№ 1
2020
ОБ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА
27
Рис. 2. Результаты экспериментов с использованием твердофазного иммуноферментного анализа: (а) - твердофазный
иммуноферментный анализ с использованием LOC-антител, детектирующих наличие амилоидных фибрилл в
образцах; (б) - исследование связывания амилоидных фибрилл Aβ-пептидов с изолированным компонентом C1q;
(в) - исследование связывания амилоидных фибрилл Aβ-пептидов с изолированным компонентом С3b; (г) -
исследование активации системы комплемента по классическому пути с использованием сыворотки крови человека;
(д) - исследование активации системы комплемента по альтернативному пути с использованием сыворотки крови
человека.
крученными
[5]. Эти результаты поднимают поляции результатов исследований амилоидов,
актуальный вопрос о целесообразности экстра- полученных in vitro, на in vivo системы.
БИОФИЗИКА том 65
№ 1
2020
28
ЯКУПОВА и др.
ФИНАНСИРОВАНИЕ РАБОТЫ
9.
H. Jiang, D. Burdick, C. G. Glabe, et al., J. Immunol.
152, 5050 (1994).
Работа выполнена при финансовой поддержке
10.
A. Afagh, Exp. Neurol. 138, 22 (1996).
Российского фонда фундаментальных исследова-
11.
S. Webster, B. Bradt, J. Rogers, et al., J. Neurochem.
ний (грант №18-315-00012).
69, 388 (1997).
12.
S. Webster, L. F. Lue, and L. Brachova, Neurobiol. Ag-
КОНФЛИКТ ИНТЕРЕСОВ
ing 18, 415 (1997).
13.
R. Veerhuis, M. J. Van Breemen, and J. M. Hooze-
Авторы заявляют об отсутствии конфликта
mans, Acta Neuropathol. 105 (2), 135 (2003).
интересов.
14.
P. Tacnet-Delorme, S. Chevallier, and G. J. Arlaud, J.
Immunol. 167 (11), 6374 (2001).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
15.
B. M. Bradt, W. P. Kolb, and N. R. Cooper, J. Exp.
Med 188, 431 (1998).
Настоящая работа не содержит описания ка-
16.
R. Strohmeyer, Y. Shen, and J. Rogers, Brain Res. Mol.
ких-либо исследований с использованием людей
Brain Res. 81 (1-2), 7 (2000).
и животных в качестве объектов.
17.
M. D. Watson, A. E. Roher, K. S.Kim, et al., Amyloid
4, 147 (1997).
СПИСОК ЛИТЕРАТУРЫ
18.
P. Eikelenboom and F. C. Stam, Acta Neuropathol 57,
239 (1982).
1. A. A. Nizhnikov, K. S. Antonets, and S. G. Inge-Vech-
19.
P. L. McGeer, H. Akiyama, S. Itagaki, et al., Neurosci.
tomov, Biochemistry (Moscow) 80 (9), 1127 (2015).
Lett. 107, 341 (1989).
2. R. Kyle, Br. J. Haematol. 114, 529-538 (2001).
20.
Y. Shen, R. Li, E. G. McGeer, et al., Brain Res. 769,
3. P. Westermark, M. D. Benson, J. N. Buxbaum, et al.,
391 (1997).
Amyloid 14 (3), 179-183 (2007).
21.
C. Landlinger, L. Oberleitner, P. Gruber, et al., J. Neu-
4. C. A. Janeway, Jr., P. Travers, M. Walport, et al., Im-
roinflammation 12, 150 (2015).
munobiology: The Immune System in Health and Disease,
22.
E. I. Yakupova, I. M. Vikhlyantsev, L. G. Bobyleva,
5th ed. (Garland Science, N.-Y., 2001).
et al., J. Biomol. Structure and Dynamics 36 (9), 2237
5. M. Kollmer, W. Close, L. Funk, et al., Nature Commun.
(2018).
10, 4760 (2019).
23.
E. I. Yakupova, A. G. Bobylev, L. G. Bobyleva, and
6. M. Cedzyński, N. M. Thielens, T. E. Mollnes, et al.,
I. M. Vikhlyantsev, J. Immunoassay Immunochem.
Front. Immunol. 10, 1869 (2019).
(2019). DOI:10.1080/15321819.2019.1694943
7. J. Rogers, N. R. Cooper, S. Webster, et al., Proc. Natl.
24.
D. C. Emery, D. K. Shoemark, T. E. Batstone, et al.,
Acad. Sci. USA 89, 10016 (1992).
Front. Aging Neurosci. 9, 195 (2017).
8. S. Chen, R. C. Frederickson, and K. R. Brunden, Neu-
25.
D. K. Kumar, S. H. Choi, K. J Washicosky, et al., Sci.
robiol. Aging 17, 781 (1996).
Transl. Med. 8 (340), 340ra72 (2016).
On Complement System Activation by Amyloid Aggregates of Aβ(1-40)
and Aβ(1-42) Peptides: Facts and Assumptions
E.I. Yakupova*, L.G. Bobyleva*, I.M. Vikhlyantsev*, **, and A.G. Bobylev*, **
*Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
ul. Institutskaya 3, Pushchino, Moscow Region, 142290 Russia
**Pushchino State Institute of Natural Sciences, prosp. Nauki 3, Pushchino, Moscow Region, 142290 Russia
In this paper, the question has arisen of whether the complement system can be activated by amyloid aggre-
gates, in particular, by the amyloid fibrils of Aβ (1-40) and Aβ (1-42) peptides found in the brains of patients
with Alzheimer's disease. In 1992, based on data on colocalization of amyloid inclusions with proteins of the
complement system in the brains of patients with this disease, it was suggested that this system was directly
activated by amyloids. Then, this assumption had been supported by a number of subsequent studies. In our
research, there is no confirmation of it. Indeed, do amyloids activate the complement system, and if no, what
activates it? We try to answer these questions in this paper.
Keywords: complement system, amyloids, amyloidoses, Alzheimer's disease
БИОФИЗИКА том 65
№ 1
2020