БИОФИЗИКА, 2020, том 65, № 1, с. 48-60
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 542.957:547.7:547.854:547.857:615.27.3
ПРОТИВООПУХОЛЕВЫЕ СВОЙСТВА ДИНИТРОЗИЛЬНЫХ
КОМПЛЕСОВ ЖЕЛЕЗА С ТИОЛСОДЕРЖАЩИМИ ЛИГАНДАМИ
И S-НИТРОЗОГЛУТАТИОНА В ЭКСПЕРИМЕНТЕ
© 2020 г. А.Ф. Ванин*, **, Л.А. Островская***, Д.Б. Корман***,
Н.В. Блюхтерова***, В.А. Рыкова***, М.М. Фомина***
*Институт химической физики им. Н.Н. Семёнова РАН, 119334, Москва, ул. Косыгина, 4
**Институт регенеративной медицины Первого Московского государственного медицинского университета
им. И.М. Сеченова, 119991, Москва, Трубецкая ул., 8
***Институт биохимической физики им. Н.М. Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
E-mail: vanin@polymer.chph.ras.ru
Поступила в редакцию 04.09.2019 г.
После доработки 04.09.2019 г.
Принята к публикации 05.09.2019 г.
Изучена противоопухолевая активность S-нитрозоглутатиона, би- и моноядеpной фоpм ди-
нитpозильныx комплекcов железа c различными тиолсодержащими лигандами - глутатионом, мер-
каптосукцинатом, тиосульфатом - на моделях солидных перевиваемых опухолей мышей (карцино-
ма легких Льюис, аденокарциномы Акатол и Са-755). Наибольшую противоопухолевую актив-
ность, выразившуюся в торможении роста опухоли на 90%, проявили препараты комплекcов железа
c глутатионом при внутривенном введении (карцинома легких Льюис) и S-нитрозоглутатиона при
внутрибрюшинном введении животным (аденокарцинома Са-755). Исходя из этих и ранее полу-
ченных нами данных о противоопухолевой активности такого рода соединений, а также принимая
во внимание результаты других авторов в той же области исследований, сделано предположение о
том, что противоопухолевый эффект вышеперечисленных препаратов определяется в основном их
способностью выступать в качестве доноров ионов нитрозония. Инициированное ионами нитрозо-
ния S-нитрозирование тиолсодержащих белков, локализованных на поверхности опухолевых кле-
ток, приводит к повышению внутриклеточного окислительного потенциала и тем самым к разви-
тию апоптоза и гибели этих клеток.
Ключевые слова: динитрозильные комплексы железа, S-нитрозотиолы, противоопухолевая актив-
ность, солидные опухоли мышей.
DOI: 10.31857/S0006302920010068
но, и колебался в пределах от 60 до 90%, изменя-
Ранее нами было обнаружено, что генерирую-
ясь в зависимости от дозового режима, схемы
щие оксид азота соединения, такие как би-
применения, времени оценки эффекта и приро-
ядеpные фоpмы динитpозильныx комплекcов
ды опухолевого штамма [1-6].
железа c глутатионом (Б-ДНКЖ-GSH) и меркап-
В 2016 г. группой исследователей, возглавляе-
тосукцинатом (Б-ДНКЖ-MS), а также S-нитро-
мой профессором W.-F. Liaw (Тайвань), была об-
зоглутатион (GS-NO) обладают способностью
наружена также высокая противоопухолевая
ингибировать развитие ряда cолидных опуxолей
активность водорастворимых моноядерных ди-
мышей (каpцинома легкиx Льюиc, аденокарци-
нитрозильных комплексов железа c этилмеркап-
номы Акатол и Са-755). Противоопухолевый эф-
таном при их внутривенном введении на модели
фект изученных препаратов проявлялся при их
ксенографтов рака предстательной железы чело-
введении как внутрибрюшинно, так и внутривен-
века [7].
В продолжение данного направления работ
Сокращения: Б-ДНКЖ-GSH - биядеpные динитpозиль-
нами с целью выявления оптимальных подходов
ные комплекcы железа c глутатионом, Б-ДНКЖ-MS - би-
ядеpные динитpозильные комплекcы железа c меркапто- для дальнейшего исследования доноров оксида
сукцинатом, GS-NO - S-нитрозоглутатион, М-ДНКЖ-
азота в качестве противоопухолевых агентов про-
ТS - моноядерные динитpозильные комплекcы железа с
ведено изучение противоопухолевых свойств ря-
тиосульфатом, ТРО - коэффициент торможения роста
да соединений, представляющих собой би-
опухоли, СПЖ - средняя продолжительность жизни.
48
ПРОТИВООПУХОЛЕВЫЕ СВОЙСТВА
49
ядеpную фоpму динитpозильныx комплекcов же-
∼2.5 мМ (5 мМ в пересчете на один железа в ком-
леза c глутатионом, меркаптосукцинатом,
плексе).
моноядерную форму динитpозильныx ком-
Синтез биядерной формы динитpозильныx ком-
плекcов железа с тиосульфатом, а также препара-
плекcов железа с меркаптосукцинатом. Б-ДНКЖ-
та S-нитрозоглутатиона.
MS синтезировали с помощью обработки газооб-
разным NO (при давлении 150 мм рт. ст.) 1 мл рас-
твора ферросульфата в дистиллированной воде и
МАТЕРИАЛЫ И МЕТОДЫ
4 мл 15 мМ раствора меркаптосукцината в 15 мМ
Материалы. В экспериментах использовали
HEPES-буфере (рН 7.4), помещенных соответ-
ферросульфат железа (FeSO4⋅7H2O) (Fluka,
ственно в верхнюю и нижнюю части аппарата
Швейцария), восстановленный глутатион, тио-
Тунберга, с последующим смешиванием этих
сульфат, меркаптосукцинат и нитрит натрия (Sig-
растворов в присутствии NO, как это описано в
ma, США). Газообразный NO получали в реак-
работе [8]. Концентрация ферросульфата в этой
ции ферросульфата железа с нитритом натрия в
смеси составляла 5 мМ. После пятиминутного
0.1 М растворе HCl с последующим разделением
встряхивания смеси, приводившей к включению
NO и примесного диоксида азота (NO2) методом
всего двухвалентного железа в Б-ДНКЖ-MS, NO
удаляли из аппарата откачкой, раствор получен-
низкотемпературной сублимации жидкой смеси
ного Б-ДНКЖ-MS замораживали и использова-
этих газов в вакуумированной системе, как это
ли (после разморозки) в экспериментах на живот-
описано в работах [1, 8].
ных. Концентрацию препарата Б-ДНКЖ-MS
Синтез биядерной формы динитpозильныx ком-
оценивали по интенсивности полосы его оптиче-
плекcов железа с глутатионом. Б-ДНКЖ-GSH
ского поглощения на 360 нм с коэффициентом
синтезировали согласно описанному ранее «про-
экстинкции, равным 6000 М-1см-1 (в пересчете
стейшему» методу синтеза ДНКЖ с тиолсодержа-
на один атом железа в Б-ДНКЖ).
щими лиганадами [1, 9]. В соответствие с этим
методом синтез 5 мМ раствора Б-ДНКЖ-GSH с
Синтез моноядерной формы динитpозильныx
глутатионом проводили следующим образом. К
комплекcов железа с тиосульфатом. М-ДНКЖ-TS
10 мл дистиллированной воды на воздухе добав-
синтезировали аналогичным образом в аппарате
ляли 62 мг глутатиона (20 мМ), вызывавшего под-
Тунберга с использованием газообразного NO.
кисление раствора до 4,0, с последующим введе-
Концентрация ферросульфата и тиосульфата на-
нием в него 28 мг (10 мМ) сернокислого железа,
трия в смеси, обрабатываемой NO, составляла со-
приводившего к дальнейшему снижению рН до
ответственно 5 и 20 мМ. Концентрацию получен-
3.8. После этого в раствор добавляли 6.9 мг
ного препарата М-ДНКЖ-TS оценивали методом
(10 мМ) нитрита натрия, что приводило к розово-
ЭПР по интенсивности характерного для этого
му окрашиванию раствора, обусловленного обра-
комплекса сигнала ЭПР с g⊥ = 2.042 и g|| = 2.014 с
зованием S-нитрозоглутатиона. Судя по интен-
использованием соответствующего ЭПР-стан-
сивности оптического поглощения на 334 нм, ха-
дартного образца [10].
рактерного для GS-NO, реакция заканчивалась
Синтез S-нитрозоглутатиона. GS-NO в виде
через 1.5 ч с образованием 10 мМ этого соедине-
5 мМ раствора в 15 мМ HEPES-буфере (рН 7.4)
ния. После этого рН раствора повышали до 7.2,
получали, понижая pH смеси 5.5 мМ глутатиона и
что приводило к оранжевому окрашиванию рас-
5 мМ нитрита натрия до значения, равного 3.0-
твора, обусловленному начавшимся процессом
3.5, добавлением в раствор соляной кислоты, что
образования Б-ДНКЖ-GSH в растворе при уча-
приводило
к
розовому
окрашиванию
стии GS-NO, Fe2+ и глутатиона [9]. Для полного
раствора. После одночасовой инкубации на воз-
превращения GS-NO в Б-ДНКЖ-GS-GSH тре-
духе pH раствора повышали до нейтральных зна-
бовалось несколько часов. После удаления обра-
чений. Концентрацию полученного GS-NO оце-
зовавшегося за это время осадка гидроокиси
нивали оптическим методом по интенсивности
трехвалентного железа путем фильтрования рас-
характерной для него полосы поглощения на
твора через фильтровальную бумагу полученный
334 нм с коэффициентом экстинкции, равным
раствор замораживали в жидком азоте и исполь-
0.904 М-1см-1 [11].
зовали (после разморозки) в экспериментах на
животных. Оценку полученного количества Б-
Биологический эксперимент. Эксперименты
были проведены на 75 инбредных мышах-самках
ДНКЖ-GSH (молекулярная масса 846 Да) прово-
линий BDF1 и Balb/c, с массой тела 18-20 г, раз-
дили оптическим методом по интенсивности ха-
рактерных для этого комплекса полос поглоще-
ведения питомника
«Филиал
«Столбовая»
ния на 310 и 360 нм, характеризующихся коэффи-
ФГБУН НЦБМТ ФМБА России».
циентами экстинкции, равными соответственно
В качестве опухолевых тест-систем служили
9200 и 7400 М-1см-1 [1]. Согласно этой оценке,
солидные опухоли мышей - карцинома легких
концентрация Б-ДНКЖ в растворе составляла
Льюис, аденокарциномы Акатол и Са-755, пере-
БИОФИЗИКА том 65
№ 1
2020
50
ВАНИН и др.
виваемые подкожно в соответствии со стандарт-
восьми мышей пpи восьми-десяти животныx в
ной методикой [12].
контpоле. Наблюдение за животными пpодолжа-
Исследовавшиеся препараты вводили живот-
лоcь в течение вcего пеpиода pазвития опуxоли
ным в виде водных растворов внутривенно в хво-
вплоть до гибели животныx.
стовую вену либо внутрибрюшинно при исполь-
Статистическая обработка данных. Статисти-
зовании различных дозовых режимов и схем при-
ческая обработка оценок размеров опухолей
менения.
(массы опухолей) у животных проведена с ис-
Б-ДНКЖ-GSH вводили внутривенно мышам
пользованием пакета компьютерных программ
с карциномой легких Льюис в суточных дозах 20,
Statistica 6.0.
10, 2, 1 и 0,5 мкмоль/кг шестикратно на 1-е, 4-е,
7-е, 11-е и 14-е сутки после перевивки опухоли;
РЕЗУЛЬТАТЫ
животным с аденокарциномой Акатол - в суточ-
ной дозе 10 мкМ/кг на 1-е, 4-е, 6-е, 8-е и 11-е сут-
В представленной работе обобщены результа-
ки.
ты экспериментального изучения зависимости
М-ДНКЖ-TS вводили внутривенно мышам с
противоопухолевого эффекта от дозы для препа-
аденокарциномой Акатол в суточной дозе
ратов Б-ДНКЖ-GSH и GS-NO (при их внутри-
10 мкмоль/кг на 1-е, 4-е, 6-е, 8-е и 11-е сутки раз-
брюшинном и внутривенном введении), оценки
вития опухоли.
активности сочетанного применения Б-ДНКЖ-
GSH и GS-NO (внутрибрюшинное введение),
Б-ДНКЖ-MS вводили внутривенно в суточ-
определения влияния природы лиганда на ро-
ных дозах 2,5 и 5 мкМ/кг шестикратно на 1-е, 4-е,
стингибирующий эффект таких динитpозильныx
7-е, 10-е, 14-е и 17-е сутки после перевивки опу-
комплекcов железа, как Б-ДНКЖ-GSH, Б-ДН-
холи мышам с карциномой легких Льюис и с пер-
КЖ-MS и М-ДНКЖ-ТS (внутривенное введе-
вых по шестые сутки - животным с аденокарци-
ние) на моделях солидных опухолей мышей.
номой Акатол.
GS-NO вводили мышам с аденокарциномой
Противоопухолевая активность биядеpных ди-
Са-577 внутрибрюшинно в суточных дозах 50,
нитpозильных комплекcов железа c глутатионом на
100, 200 и 400 мкМ/кг с первых по десятые сутки,
модели карциномы легких Льюис. Ранее нами была
мышам с карциномой легких Льюис - внутри-
установлена значительная противоопухолевая
венно в суточных дозах 10 и 20 мкМ/кг на 1-е, 4-е,
активность Б-ДНКЖ-GSH при внутривенном
8-е, 12-е и 15-е сутки, животным с аденокарцино-
введении на модели карциномы легких Льюис
мой Акатол - внутривенно в суточных дозах
[4]. Как было показано в этой работе, эффектив-
10 мкМ/кг на 1-е, 4-е, 6-е, 8-е и 11-е сутки после
ность торможения роста опухоли увеличивалась
перевивки опухоли.
по мере уменьшения дозы препарата в диапазоне
суточных доз 20, 10 и 2 мкмоль/кг и составляла 30,
Оценка противоопухолевой активности. Пока-
70 и 90% соответственно (рис. 1а, табл. 1). В до-
зателем ростингибирующего эффекта препарата
полнение к этим данным и для проверки отме-
служили различия в кинетике роста опухолей (ко-
ченного парадоксального эффекта увеличения
эффициент торможения роста опухоли ТРО, %).
активности препарата с уменьшением его дозы
Коэффициент торможения роста опухоли опре-
нами исследован эффект Б-ДНКЖ-GSH в разо-
деляли из соотношения: ТРО
=
[(РС
-
вых дозах 1 и 0,5 мкмоль/кг при той же схеме
‒ РТ)/РС]⋅100%, где РС и РТ - объем (или масса)
внутривенного введения (пятикратно с интерва-
опухоли в группах контрольных (С) и леченых (Т)
лом в трое суток) на модели карциномы легких
животных соответственно. Для изучения кинети-
Льюис (рис. 1б, табл. 1).
ки роста опухолей проводили измерение двух вза-
Анализ результатов, полученных при вве-
имно перпендикулярных размеров опухолевого
дении препарата в суточных дозах
1,0 и
узла на протяжении всего периода развития опу-
0,5 мкмоль/кг, свидетельствует о том, что эти ма-
холей. Объем опухоли вычисляли в соответствии
лые дозы Б-ДНКЖ-GSH обладают примерно
с формулой для эллипсоида как V = ab2/2, где a -
одинаковой эффективностью и тормозят разви-
длина, b - ширина и высота опухолевого узла.
тие опухоли на 50 и 60% соответственно (рис. 1б,
При оценке массы опухоли использовали вели-
табл. 1).
чину плотности опухолевой ткани, равную
Сопоставление противоопухолевого эффекта
1 г/см3. Показатель изменения средней продол-
Б-ДНКЖ-GSH во всем диапазоне изученных су-
жительности жизни мышей (СПЖ) определяли
точных доз (от 20 до 0,5 мкмоль/кг) при внутри-
как Δτ = [(τС - τТ)/τС]⋅100%, где τС и τТ - средняя
венном введении на модели карциномы легких
продолжительность жизни контрольных и лече-
Льюис свидетельствует о нелинейном характере
ных животных [12].
зависимости эффекта от дозы, при которой мак-
Каждая гpуппа животныx, получавшиx
симальная активность препарата - 90% торможе-
теpапевтичеcкое воздейcтвие, cоcтояла из шести-
ния роста опухоли по сравнению с контролем -
БИОФИЗИКА том 65
№ 1
2020
ПРОТИВООПУХОЛЕВЫЕ СВОЙСТВА
51
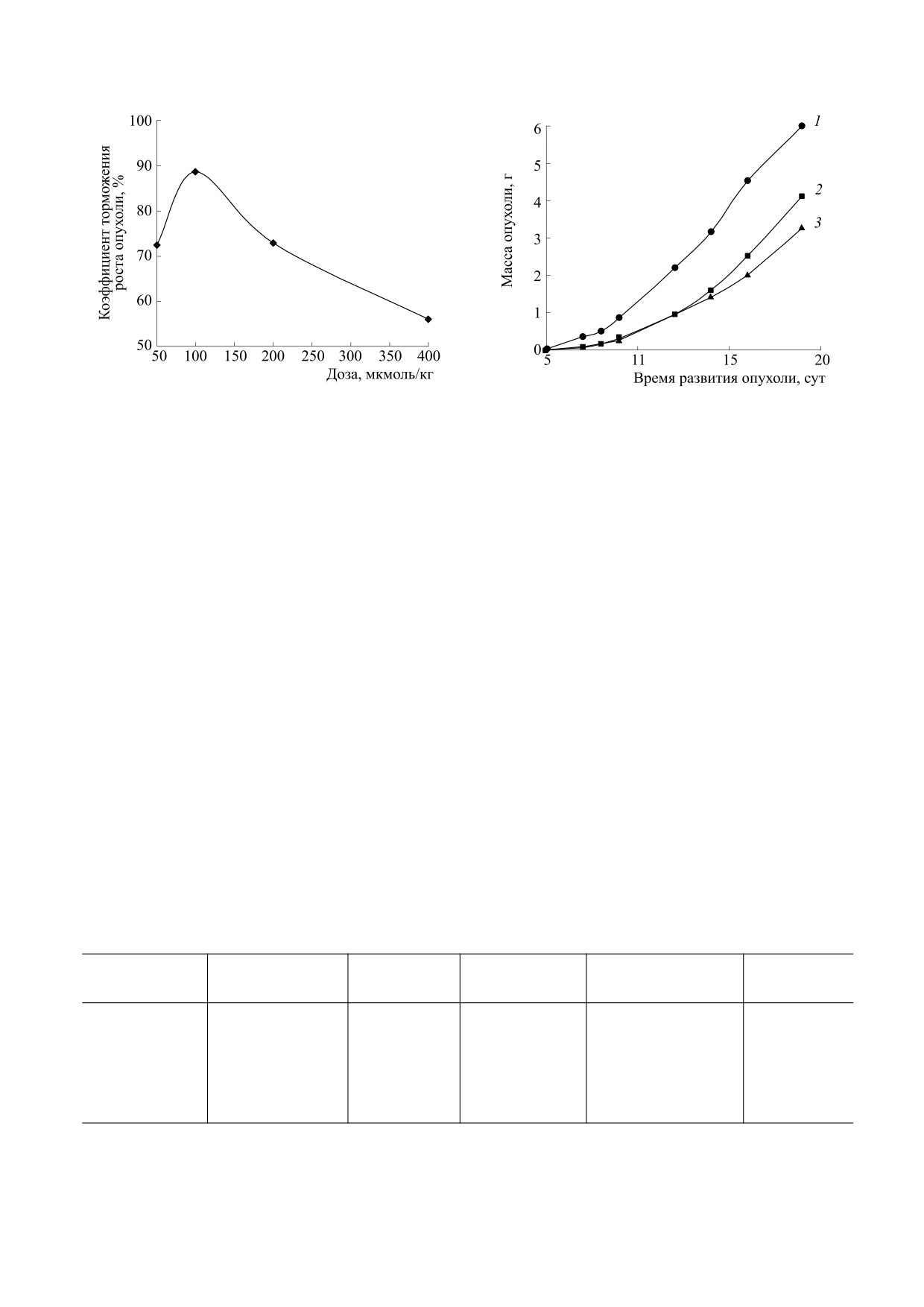
Рис. 1. Противоопухолевая активность Б-ДНКЖ-GSH при внутривенном введении различных доз препарата на мо-
дели карциномы легких Льюис: (а) - 1 - контроль, 2-4 - Б-ДНКЖ-GSH в суточных дозах 20, 10 и 2 мкмоль/кг
соответственно; (б) - 1 - контроль, 2 и 3 - Б-ДНКЖ-GSH в суточных дозах 1 и 0,5 мкМ/кг соответственно. Дозы
Б-ДНКЖ-GSH приводятся в пересчете на один Fe(NO)2-фрагмент. Введение препарата внутривенно, пятикратно, на
1-е, 4-е, 7-е, 9-е и 11-е сутки после перевивки опухоли.
наблюдается при его введении в разовой дозе
Рассматривая вопросы оптимизации приме-
2 мкмоль/кг (рис. 2, табл. 1).
нения Б-ДНКЖ-GSH в качестве противоопухо-
левого агента, мы представляли целесообразным
Таким образом, исследование противоопухо-
оценить толерантность животных опухоленоси-
левого эффекта Б-ДНКЖ-GSH в широком диа-
телей к введению высоких доз препарата внутри-
пазоне доз (от 20 до 0,5 мкмоль/кг в сутки) позво-
брюшинно.
лило установить, что оптимальным режимом
применения препарата, вызывающим ингибиро-
С этой целью проведено сравнительное изуче-
вание роста опухоли (карцинома легких Льюис)
ние активности Б-ДНКЖ-GSH при внутрибрю-
на 90%, является его внутривенное введение в су-
шинном введении в относительно высоких дозах
точной дозе 2 мкмоль/кг, пятикратно с интерва-
(100 и 200 мкмоль/кг), причем более высокая доза
лом в трое суток.
препарата вводилась дробно, по 100 мкмоль/кг
два раза в сутки (карцинома легких Льюис).
Следует отметить, что Б-ДНКЖ-GSH сохра-
няет определенную противоопухолевую актив-
Как видно из данных, приведенных на рис. 3 и
ность, выразившуюся в торможении роста опухо-
в табл. 2, торможение роста опухоли под влияни-
ли на 50%, даже при позднем начале применения
ем внутрибрюшинного введения Б-ДНКЖ-GSH
препарата - на седьмые сутки развития опухоли
возрастало с увеличением дозы. Ингибирование
(табл. 1).
роста опухоли при оценке эффекта на 12-е сутки
Таблица 1. Противоопухолевый эффект Б-ДНКЖ-GSH в ряде доз при внутривенном введении на модели
карциномы легких Льюис
Торможение
Суточная доза,
Время оценки
Средняя масса
Серия опыта
Группа
роста опухоли,
мкмоль/кг
эффекта, сутки
опухоли, г
%
1
Б-ДНКЖ-GSH
20
16
2.76 ± 0.54
30
1
Б-ДНКЖ-GSH
10
16
1.19 ± 0.14
70
1
Б-ДНКЖ-GSH
2
16
0.37 ± 0.08
90
1
Б-ДНКЖ-GSH*
2*
16*
1.96 ± 0.07*
50*
1
Контроль
-
16
3.93 ± 0.65
-
2
Б-ДНКЖ-GSH
1.0
19
3.22? ± 0.24
50
2
Б-ДНКЖ-GSH
0.5
19
2.50 ± 0.13
60
2
Контроль
-
19
6.05 ± 0.45
-
Примечание. Препарат вводили на 1-е, 4-е, 7-е, 9-е и 11-е сутки после перевивки опухоли. * -Препарат вводили на 7-е, 9-е,
11-е и 14-е сутки после перевивки опухоли.
БИОФИЗИКА том 65
№ 1
2020
52
ВАНИН и др.
ния препарата играет весьма существенную роль
в реализации его противоопухолевой активности.
Так, внутривенное применение Б-ДНКЖ-GSH в
дозе
2 мкмоль/кг приводит к торможению
роста опухоли на 90%, в то время как внутрибрю-
шинное введение препарата в дозе, на два поряд-
ка более высокой и составляющей 200 мкмоль/кг,
вызывает торможение роста опухоли на 60 %
(табл. 1 и 2).
Противоопухолевая активность S-нитрозоглу-
татиона на моделях аденокарциномы Са-755 и кар-
циномы легких Льюис. Ранее нами была установ-
лена значительная противоопухолевая актив-
ность препарата GS-NO на двух моделях
солидных опухолей мышей - карциноме легких
Льюис и аденокарциноме Са-755. Торможение
Рис. 2. Зависимость противоопухолевого эффекта Б-
роста опухолей при применении препарата внут-
ДНКЖ-GSH от дозы при внутривенном введении на
рибрюшинно, десятикратно, ежедневно, в суточ-
модели карциномы легких Льюис.
ных дозах 200 и 400 мкмоль/кг составляло 70 и
60% при введении мышам с карциномой легких
после перевивки составило 49 и 62% для доз 100 и
Льюис, а на модели аденокарциномы Са-755 - 90
200 мкмоль/кг соответственно, по сравнению с
и 50% соответственно. При этом было показано,
контролем. СПЖ животных практически не от-
что GS-NO проявляет более высокую эффектив-
личалась от контроля (рис.3, табл.2).
ность при применении в меньшей дозе
200 мкмоль/кг по сравнению с дозой
Таким образом, показано, что животные спо-
400 мкмоль/кг. Такая парадоксальная дозовая за-
собны переносить сублетальную для мышей дозу
висимость была отмечена в отношении обоих
Б-ДНКЖ-GSH, составляющую 200 мкмоль/кг,
штаммов опухолей, но особенно четко выражена
при условии ее внутрибрюшинного дробного вве-
на модели аденокарциномы Са-755, что требова-
дения, по 100 мкмоль/кг дважды в сутки. Такое
ло специального объяснения [3].
применение препарата приводило к более значи-
тельному ингибированию роста опухоли, чем его
С этой целью нами на модели аденокарцино-
введение в дозе 100 мкмоль/кг один раз в сутки.
мы Са-755 проведено изучение зависимости эф-
В целом сопоставление эффекта Б-ДНКЖ-
фекта от дозы GS-NO в диапазоне доз от 50 до
GSH при внутривенном и внутрибрюшинном
400 мкмоль/кг, при внутрибрюшинном десяти-
введении свидетельствует о том, что путь введе-
кратном введении препарата.
Рис. 3. Противоопухолевая активность Б-ДНКЖ-GSH в высоких дозах при внутрибрюшинном введении на модели
карциномы легких Льюис: (а) - 1 - контроль; 2 - Б-ДНКЖ-GSH, 100 мкмоль/кг/сутки; (б) - 1 - контроль; 2 -
Б-ДНКЖ-GSH, 200 мкмоль/кг/сутки, дробно, два раза в сутки по 100 мкмоль/кг. Введение препарата внутрибрюшин-
но с первых по четвертые и с восьмых по одиннадцатые сутки.
БИОФИЗИКА том 65
№ 1
2020
ПРОТИВООПУХОЛЕВЫЕ СВОЙСТВА
53
Таблица 2. Противоопухолевый эффект Б-ДНКЖ-GSH в высоких дозах при внутрибрюшинном введении на
модели карциномы легких Льюис
Суточная доза,
Время оценки
Средняя масса
СПЖ
ТРО, %
Δτ, %
мкмоль/кг
эффекта, сутки
опухоли, г
τ, сутки
100
12
2.2
49
31.0 ± 4.8
1
200 (по 100
мкмоль/кг), 2 раза
12
1.5
62
27.5 ± 5.6
-7
в сутки
Контроль
12
3.9
-
29.6 ± 9.0
-
Примечание. Препарат вводили с первых по одиннадцатые сутки внутрибрюшинно, восьмикратно.
Как видно из данных, представленных на
сравнению с контролем. При этом наибольший
рис. 4 и 5, а также в табл. 3, GS-NO тормозит раз-
эффект GS-NO - 88% торможения роста опухоли
витие аденокарциномы Са-755 на 56-88% по
и увеличение средней продолжительности жизни
сравнению с контролем. СПЖ животных увели-
животных на 24% - наблюдается при примене-
чивается под влиянием GS-NO на 14-24% по
нии препарата в суточной дозе 100 мкмоль/кг.
Рис. 4. Противоопухолевая активность GS-NO при внутрибрюшинном введении на модели аденокарциномы Са-755:
(а) - GS-NO, 50 мкмоль/кг/сутки; (б) - GS-NO, 100 мкмоль/кг/сутки, (в) - GS-NO, 200 мкмоль/кг/сутки; (г) - GS-
NO, 400 мкмоль/кг/сутки. Кривая 1 - контроль, кривая 2 - GS-NO.
БИОФИЗИКА том 65
№ 1
2020
54
ВАНИН и др.
Рис. 5. Зависимость противоопухолевого эффекта
Рис. 6. Влияние ряда доз GS-NO при внутривенном
GS-NO от дозы при внутрибрюшинном введении на
введении на кинетику развития карциномы легких
модели аденокарциномы Са-755.
Льюис мышей: 1 - контроль; 2 - GS-NO, 20 мкмоль/
кг/сутки; 3 - GS-NO, 10 мкмоль/ кг/сутки. Препарат
вводился внутривенно, пятикратно - на 1-е, 4-е, 8-е,
Таким образом, исследование противоопухо-
12-е и 15-е сутки после перевивки опухоли.
левого эффекта GS-NO в широком диапазоне доз
(50-400 мкмоль/кг) при внутрибрюшинном вве-
карциномы легких Льюис. Определенный интерес
дении на модели аденокарциномы Са-755 позво-
представляет изучение возможности усиления
лило обнаружить нелинейный характер зависи-
противоопухолевого эффекта соединений, гене-
мости эффекта от дозы и выявить оптимальный
рирующих оксид азота, путем сочетанного при-
режим применения препарата - введение в разо-
менения двух разных по химическому строению
вой дозе 100 мкмоль/кг, десятикратно, ежеднев-
веществ.
но, внутрибрюшинно, обеспечивающий тормо-
жение роста опухоли на 90% и увеличение сред-
С этой целью исследована эффективность сов-
ней продолжительности жизни животных на 24%
местного применения Б-ДНКЖ-GSH и GS-NO
по сравнению с контролем (рис. 4 и 5, табл. 3).
на модели карциномы Льюис при внутрибрю-
шинном введении.
Тенденция к некоторому повышению актив-
ности с уменьшением дозы препарата сохраняет-
Как видно из данных, представленных на
ся и при внутривенном применении GS-NO. Так,
рис. 7 и в табл. 5, торможение роста опухоли при
введение GS-NO внутривенно, пятикратно (с ин-
индивидуальном применении Б-ДНКЖ-GSH и
тервалом в трое суток) в разовых дозах 10 и
GS-NO в дозах 100 и 200 мкмоль/кг/сутки в дан-
20 мкмоль/кг приводит к ингибированию роста
ном опыте не превышает 40 и 20% соответствен-
карциномы легких Льюис мышей на 45 и 32% по
но, при оценке эффекта на 16-е сутки после пере-
сравнению с контролем (рис. 6, табл. 4).
вивки опухоли (рис. 7а, б).
Противоопухолевая эффективность сочетанного
Ингибирование роста опухоли при совмест-
применения Б-ДНКЖ-GSH и GS-NO на модели ном применении в половинных дозах (рис. 7в) со-
Таблица 3. Противоопухолевый эффект Б-ДНКЖ-GSH в высоких дозах при внутрибрюшинном введении на
модели карциномы легких Льюис
Суточная доза,
Время оценки
Средняя масса
СПЖ
ТРО, %
Δτ, %
мкмоль/кг
эффекта, сутки
опухоли, г
τ, сутки
50
18
1.28 ± 0.40
72
30.3 ± 7.4
23
100
18
0.57 ± 0.30
88
30.7 ± 4.8
24
200
18
1.26 ± 0.40
73
29.2 ± 7.6
19
40
18
2.05 ± 0.50
56
28.0 ± 6.7
14
Контроль
18
4.67 ± 0.80
-
24.6 ± 2.3
-
Примечание. Препарат вводили с первых по десятые сутки внутрибрюшинно.
БИОФИЗИКА том 65
№ 1
2020
ПРОТИВООПУХОЛЕВЫЕ СВОЙСТВА
55
Таблица 4. Противоопухолевый эффект GS-NO в ряде доз при внутривенном введении на модели карциномы
легких Льюис
Суточная доза, мкмоль/кг
Время оценки эффекта, сутки
Средняя масса опухоли, г
ТРО, %
20
19
4.1 ± 0.4
32
10
19
3.3 ± 0.3
45
Контроль
19
6.0 ± 0.8
-
Примечание. Препарат вводили на 1-е, 4-е, 8-е, 12-е и 15-е сутки внутривенно.
ставило 55%, а при применении в полных дозах
табл. 5). Средняя продолжительность жизни у
(рис. 7г) - 45% по сравнению с контролем.
всех леченых животных на 4-12% ниже, чем в
контроле (табл. 5).
Таким образом, очевидно, что наибольший
эффект наблюдается при комбинации препара-
Представленные данные по оценке эффектив-
тов в половинных дозах и составляет 55% тормо-
ности совместного внутрибрюшинного примене-
жения на 16-е сутки развития опухоли (рис. 7,
ния Б-ДНКЖ-GSH и GS-NO свидетельствуют о
Рис. 7. Влияние Б-ДНКЖ-GSH, GS-NO и комбинации этих препаратов при внутрибрюшинном введении на развитие
карциномы легких Льюис: (а) - 1 - контроль; 2 - Б-ДНКЖ-GSH, 100 мкмоль/кг/сутки; (б) - 1 - контроль; 2 - GS-
NO, 200 мкмоль/кг/сутки; (в) - 1 - контроль; 2 - комбинация в половинных дозах: Б-ДНКЖ-GSH, 50 мкмоль/кг/сут-
ки + GS-NO, 100 мкмоль/кг/сутки; (г) - 1 - контроль; 2 - комбинация в полных дозах: Б-ДНКЖ-GSH,
100 мкмоль/кг/сутки + GS-NO, 200 мколь/кг/сутки. Введение препаратов с первых по десятые сутки, внутрибрю-
шинно.
БИОФИЗИКА том 65
№ 1
2020
56
ВАНИН и др.
Таблица 5. Противоопухолевая активность препаратов Б-ДНКЖ-GSH, GS-NO и их комбинации при
внутрибрюшинном введении на модели карциномы легких Льюис
Суточная доза
(мкмоль/кг) и
Время оценки
Средняя масса
СПЖ мышей
Препарат
ТРО, %
Δτ, %
схема введения
эффекта, сутки
опухоли, г
τ, сутки
препарата
100
ДНКЖ-GSH
16
3.4 ± 0.3
40
31.2 ± 4.0
9.5
1-10 сутки
200
GS-NO
16
4.5 ± 0.3
20
31.5 ± 3.1
-9.0
1-10 сутки
ДНКЖ-GSH
50 + 100
16
2.6 ± 0.4
55
30.2 ± 5.2
-12.0
+ GS-NO
1-10 сутки
ДНКЖ-GSH
100 + 200
16
3.2 ± 0.2
45
33.2 ± 3.0
-3.8
+ GS-NO
1-10 сутки
Контроль
16
5.6 ± 0.3
-
34.5 ± 3.2
-
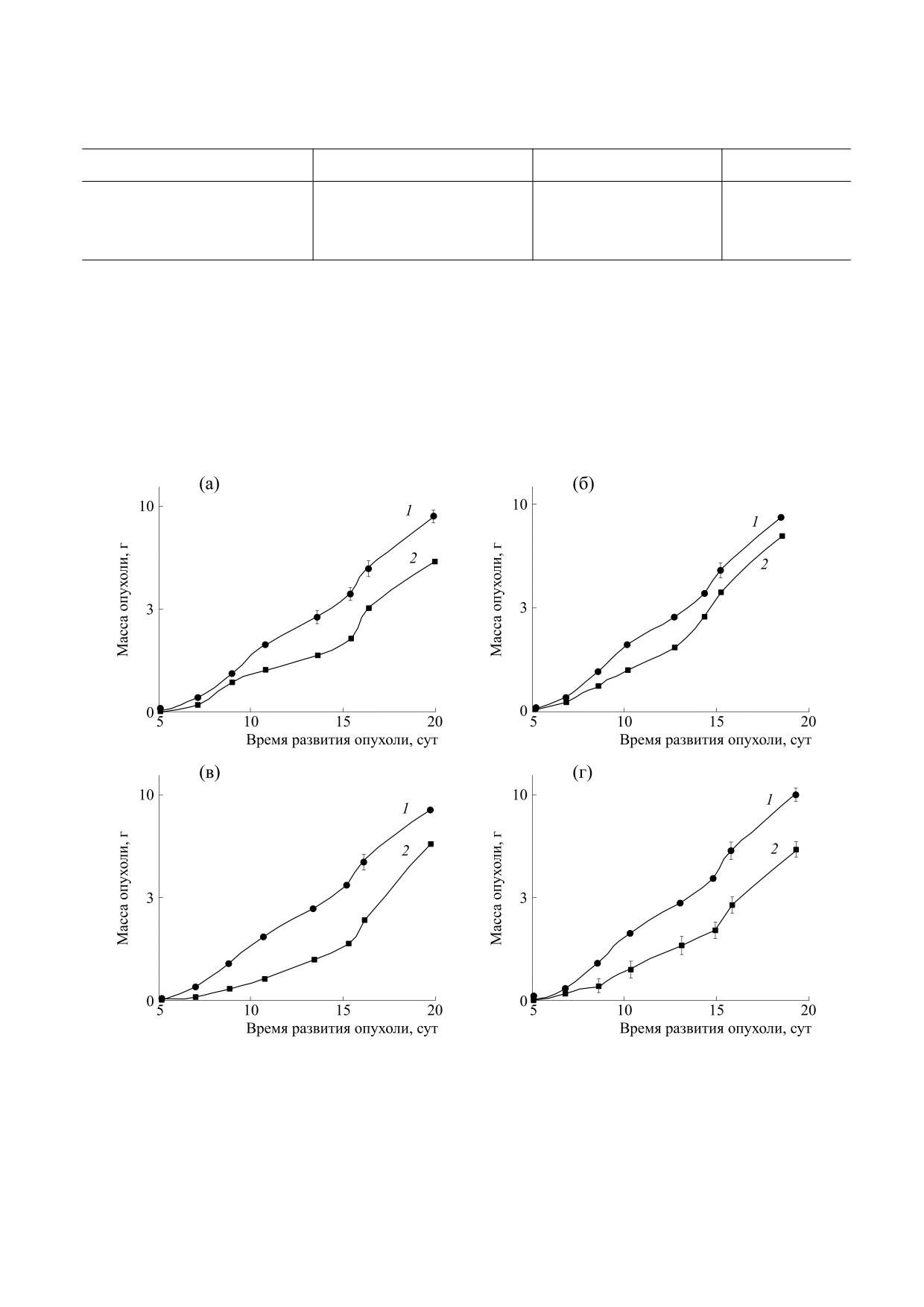
Рис. 8. Противоопухолевая активность ряда доноров оксида азота при внутривенном введении на модели
аденокациномы Акатол: (а) - Б-ДНКЖ-GSН, 10 мкмоль/кг; 1-е, 4-е, 6-е, 8-е и 11-е сутки; (б) - M-ДНКЖ-ТS,
10 мкмоль/кг; 1-е, 4-е, 6-е, 8-е и 11-е сутки; (в) - Б-ДНКЖ-MS, 2,5 мкмоль/кг, с первых по шестые сутки; (г) - GS-
NO, 10 мкмоль/кг; 1-е, 4-е, 6-е, 8-е и 11-е сутки. 1 - Контроль, 2 - препарат.
БИОФИЗИКА том 65
№ 1
2020
ПРОТИВООПУХОЛЕВЫЕ СВОЙСТВА
57
Таблица 6. Противоопухолевый эффект ряда доноров оксида азота при внутривенном введении на модели
аденокарциномы Акатол
Суточная доза
Режим введения
Время оценки
Средняя масса
Группа
ТРО, %
(мкмоль/кг)
(сутки)
эффекта, сутки
опухоли, г
Б-ДНКЖ-GSH
10
1, 4, 6, 8,11
18
4.04 ± 0.27
18
M-ДНКЖ-ТS
10
1, 4, 6, 8,11
18
3.43 ± 0.26
30
GS-NO
10
1, 4, 6, 8,11
18
4.88 ± 0.32
0
Контроль
4.92 ± 0.37
-
Б-ДНКЖ-MS
2.5
1-6
16
3.04 ± 0.25
30
Контроль
4.31 ± 0.35
-
Примечание. * - Контроль в эксперименте с препаратом Б-ДНКЖ-MS.
Таблица 7. Максимальный противоопухолевый эффект препаратов Б-ДНКЖ-GSH, M-ДНКЖ-ТS, Б-ДНКЖ-
MS и GS-NO на моделях солидных опухолей мышей
Препарат
ТРО, %
Штамм опухоли
Суточная доза, режим введения
2 мкмоль/кг, внутривенно на 1-е, 4-е,
Б-ДНКЖ-GSH
90
Карцинома легких Льюис
7-е, 9-е и 11-е сутки
10 мкмоль/кг, внутривенно на 1-е, 4-е,
M-ДНКЖ-ТS
30
Аденокарцинома Акатол
6-е, 8-е и 11-е сутки
2,5 мкмоль/кг, внутривенно на 1-е, 4-е,
Б-ДНКЖ-MS
30
Аденокарцинома Акатол
6-е, 8-е и 11-е сутки
100 мкмоль/кг, внутрибрюшинно на
90
Аденокарцинома Са-755
первые-десятые сутки
GS-NO
10 мкмоль/кг, внутривенно на 1-е, 4-е,
45
Карцинома легких Льюис
8-е, 12-е и 15-е сутки
тенденции к некоторому увеличению противо-
ОБСУЖДЕНИЕ
опухолевой активности препаратов (с 40 до 55%)
Обобщая результаты проведенных исследова-
при их комбинированном использовании (кар-
ний, отметим, что изученные препараты, облада-
цинома легких Льюис).
ющие способностью генерировать оксид азота,
Сравнительная оценка противоопухолевой ак-
проявляют определенную ростингибирующую
тивности ряда доноров оксида азота на модели аде-
активность в отношении солидных опухолей
нокациномы Акатол. С целью определения среди
мышей.
доноров оксида азота препарата, обладающего
наибольшей противоопухолевой активностью,
Выраженность противоопухолевого эффекта
проведено сравнительное изучение соединений
зависит от природы соединения, режима его при-
Б-ДНКЖ-GSH, M-ДНКЖ-ТS, Б-ДНКЖ-MS и
менения и чувствительности опухолевого штам-
ма. Наибольшую противоопухолевую актив-
GS-NO при внутривенном введении на модели
аденокациномы Акатол (рис. 8, табл. 6).
ность, выразившуюся в торможении роста опухо-
ли на 90%, проявили препараты Б-ДНКЖ-GSH
Как видно из представленных данных, адено-
при внутривенном введении мышам с карцино-
карцинома Акатол обладает весьма слабой чув-
мой легких Льюис и GS-NO при внутрибрюшин-
ствительностью к действию изученных препара-
ном введении животным с аденокарциномой Са-
тов, уступая в этом отношении таким моделям со-
755 (табл. 7).
лидных опухолей, как аденокарцинома Са-755 и
карцинома легких Льюис. Максимальное инги-
Особенностью действия протестированных
бирование роста аденокарциномы Акатол под
препаратов является нелинейный характер зави-
влиянием протестированных препаратов не пре-
симости противоопухолевого эффекта от дозы,
вышает 30% по сравнению с контролем и наблю-
которая проходит через максимум (рис. 2 и 5). Та-
дается под влиянием таких соединений, как
кой характер зависимости «доза-эффект» явля-
M-ДНКЖ-ТS и Б-ДНКЖ-MS (рис. 8, табл. 6).
ется нетипичным для действия большинства из-
БИОФИЗИКА том 65
№ 1
2020
58
ВАНИН и др.
вестных цитостатиков и, возможно, отражает
кроме молекул NO, которые могут высвобож-
определенные особенности фармакологического
даться как из ДНКЖ с тиолсодержащими лиган-
механизма действия генерирующих оксид азота
дами, так и из S-нитрозотиолов, оба типа этих
препаратов.
нитрозосоединений могут выступать еще и в ка-
При рассмотрении приведенных выше дан-
честве доноров иона нитрозония (NO+) - про-
ных, а также результатов, полученных нами ранее
дукта одноэлектронного окисления NO [16]. Есть
в работах [1-6] при изучении противоопухолево-
основание предполагать, что и этот катион спосо-
го действия ДНКЖ c тиолсодержащими лиганда-
бен, как и нейтральные молекулы NO, иниции-
ми и GS-NO, возникает ряд вопросов, на которые
ровать гибель опухолевых клеток, вызывая S-нит-
мы попытаемся ответить.
розирование белков, локализованных на клеточ-
ной поверхности, и тем самым провоцируя
1. При сопоставлении противоопухолевого
развитие апоптоза клеток, обусловленного повы-
действия всех изученных соединений при их вну-
шением внутриклеточного окислительного по-
трибрюшинном и внутривенном введении обна-
тенциала [17].
руживается четкое различие в отношении их доз,
при которых достигался оптимальный эффект.
Что касается губительного действия на эти
При внутрибрюшинном введении он имел место
клетки молекул NO, то его обычно связывают с
при наиболее высокой дозе препаратов, тогда как
превращением NO в реакции с супероксидом в
при внутривенном введении наблюдалась обрат-
пероксинитрит. Последний оказывает на клетки
ная картина. Исходя из результатов работы [13], в
мощное токсическое действие, высвобождая в
которой было изучено влияние способов введе-
клеточную среду после протонирования свобод-
ния Б-ДНКЖ-GSH крысам на гипотензивное
ные радикалы гидроксила [18].
действие этих комплексов, есть основание пред-
Какой из этих агентов - NO или NO+ - мог
полагать, что при внутрибрюшинном введении
оказывать в наших опытах решающее цитотокси-
использованных ДНКЖ и GS-NO только незна-
чительная часть этих соединений достигает цир-
ческое действие на опухоли? Есть основание
кулирующей крови. Другими словами, даже при
предполагать, что в качестве такого агента могли
их наибольшей дозе (100-200 мкмолей/кг веса
выступать ионы нитрозония. Об этом четко сви-
детельствуют результаты упомянутой выше рабо-
животных) при внутрибрюшинном введении в
ты [17], в которой было показано, что обработка
кровь попадает менее 1 мкмоля/кг этих соеди-
нений.
М-ДНКЖ-TS одним из производных дитиокар-
бамата, способным перехватывать на себя из
2. Здесь же возникает вопрос, почему
ДНКЖ группу Fe-NO с сопутствующим высво-
при внутривенном введении препаратов их про-
бождением из этих комплексов ионов NO+, ни-
тивоопухолевое действие снижается при повы-
коим образом не влияла на эффективность цито-
шении их дозы? Ответить на этот вопрос
можно, если учесть, что, согласно работе [14],
токсического действия М-ДНКЖ-TS.
вводимые в кровь ДНКЖ и, по-видимому, S-нит-
Что касается NO, то опухолевые клетки могли
розотиолы поглощаются иммунокомпетентными
выработать защиту от его действия, как это «дела-
клетками
- в первую очередь макрофагами,
ет» ряд патогенных бактерий [19]. Как и бакте-
включение в которые большого количества доно-
рии, злокачественные клетки могли экспресси-
ров NO может оказаться для этих клеток губи-
ровать синтез гемсодержащих белков, способных
тельным [15]. Естественно, что погибшие макро-
или окислять, или восстанавливать молекулы
фаги, включившие в себя значительное количе-
NO, удаляя тем самым NO из внутриклеточной
ство доноров NO, не могут обеспечить транспорт
среды. Вот почему в начале при контакте опухо-
этих доноров к опухолям, как это могли бы осу-
лей с использованными нитрозосоединениями,
ществить интактные иммунокомпетентные клет-
когда злокачественные клетки начинали выраба-
ки. Такую доставку макрофаги могли осуще-
тывать защиту от NO, наблюдалась задержка в
ствить только при включении в них небольшого
развитии опухолей, которая затем, после созда-
количества доноров NO, например, при внутри-
ния этой защиты, сменялась быстрым развитием
венном введении в кровь мышей Б-ДНКЖ-GSH
опухолей.
в дозе не более 2 мкмолей/кг.
Что касается способности злокачественных
3. Возникает также вопрос, почему во всех на-
клеток вырабатывать защиту против катионов
ших опытах нам не удалось достичь оптимально-
нитрозония, появление такого качества у этих
го результата - полного подавления роста злока-
клеток представляется маловероятным. В
чественных опухолей, подобно тому, как это бы-
пользу этого предположения свидетельствует
ло показано в работе китайских исследователей
факт 90%-го ингибирования роста аденокарци-
[7].
номы Са-755 при внутрибрюшинном введении
Прежде чем сделать какое-либо предположе-
мышам GS-NO (рис. 4б). Последний, как типич-
ние в ответ на этот вопрос, следует отметить, что
ный представитель S-нитрозотиолов, мог по ме-
БИОФИЗИКА том 65
№ 1
2020
ПРОТИВООПУХОЛЕВЫЕ СВОЙСТВА
59
ханизму S-транс-нитрозирования [11] передавать
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
катионы NO+ на тиоловые группы поверхност-
Все применимые международные, националь-
ных белков злокачественных клеток и тем самым
ные и институциональные принципы ухода и ис-
подавлять, в соответствии с данными работы [17],
пользования животных при выполнении работы
пролиферацию клеток аденокарциномы Ca-755 в
были соблюдены.
организме мышей.
Почему китайским исследователям в работе
[7] удалось полностью подавить пролиферацию
СПИСОК ЛИТЕРАТУРЫ
клеток рака простаты человека под действием мо-
1.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
ноядерных динитрозильных комплексов железа с
Биофизика 59 (3), 508 (2014).
этилмеркаптаном в качестве тиолсодержащего
2.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
лиганда, способного, как и все ДНКЖ с тиолсо-
Биофизика 60 (1), 152 (2015).
держащими лигандами, выступать в качестве до-
3.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
норов NO и NO+? Не исключено, что этот успех
Биофизика 60 (6), 1157 (2015).
был обусловлен тем, что молекулы этилмеркапта-
на из-за своих небольших размеров гораздо сла-
4.
A. F. Vanin, L. A. Ostrovskaya, and D. B. Korman,
бее, чем молекулы глутатиона, могли противосто-
Austin J. Reprod. Medicine & Infertility 2, 1109 (2015).
ять переходу катионов нитрозония на тиоловые
5.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
группы белков в злокачественных клетках, то есть
Биофизика 62 (3), 591 (2017).
препятствовать S-нитрозированию этих белков,
6.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
что и могло приводить к гибели опухолевых кле-
Биофизика 64 (5), 1216 (2019).
ток. Другими словами, успех китайских исследо-
вателей мог быть обусловлен существенно мень-
7.
S-H. Wu, C.-Y. Lu, Y.-L. Chen, et al., Inorg. Chem.
55, 9384 (2016).
шей устойчивостью S-нитрозоэтилмеркаптана и
в соответствии с этим меньшей устойчивостью
8.
A. F. Vanin, A. P. Poltorakov, V. D. Mikoyan, et al., Ni-
моноядерных динитрозильных комплексов желе-
tric Oxide Biol. Chem. 23, 1236 (2010).
за с этилмеркаптаном по сравнению с устойчиво-
9.
R. R. Borodulin, L. N. Kubrina, V. O. Shvydkiy, et al.,
стью тех же соединений глутатиона, использовав-
Nitric Oxide Biol. Chem. 35, 110 (2013).
шихся в наших опытах [8, 20, 21].
10.
10. D. Sh. Burbaev, A. F. Vanin, and L. A. Blumenfeld,
Нами предполагается проверка высказанных
Zhurn. Strukt. Khimii 2, 252 (1971).
соображений в последующих исследованиях на
11.
D. L. H. Williams, in Nitrosation Reactions and the
опухолях, которые будут подвергаться действию
Chemistry of Nitric Oxide (Elsevier, Amsterdam, 2004),
ДНКЖ с тиолсодержащими лигандами с мень-
p. 35.
шими, чем глутатион, размерами молекул. Для
12.
Е. М. Трещалина, О. С. Жукова, Г. К. Герасимова
ответа на вопрос, какой из компонентов ДНКЖ -
и др., в кн. Руководство по проведению доклиниче-
NO или NO+ - может быть ответственен за
ских исследований лекарственных средств. Часть
противоопухолевую активность ДНКЖ, предпо-
первая, под ред. А. Н. Миронова и др. («Гриф и К»,
лагается изучить влияние на эту активность про-
М., 2012), сс. 642-657.
изводных дитиокарбамата, как это было сделано
13.
A. A. Timoshin, V. L. Lakomkin, A. A. Abramov, et al.,
в работе [17]. В том случае, если производные
Eur. J. Pharmacol. 705, 525 (2015).
дитиокарбамата не будут проявлять противоопу-
14.
H. Levandovska, T. M. Stepkowski, S. Meczynska-
холевый эффект, это будет означать, что про-
Wielgosz, et al., J. Inorg. Biochem. 188, 29 (2018).
тивоопухолевая активность ДНКЖ и соответ-
ствующих S-нитрозотиолов обусловлена высво-
15.
J. Mier-Carbrera, S. Gonzalez-Gallardo, and C. Her-
nandez-Guerrero, Reprod. Sci. 20, 1332 (2013).
бождающимися из них катионами нитрозония.
16.
A. F. Vanin, Austin J. Analyt. Pharmac. Chem. 5, 1104
(2018).
ФИНАНСИРОВАНИЕ РАБОТЫ
17.
A. L. Kleschyov, S. Strand, S. Schmitt, et al., Free Rad-
ic. Biol. Med. 40, 1340 (2006).
Работа выполнена при финансовой поддержке
Российского фонда фундаментальных исследова-
18.
J. Scicinski, B. Oronskya, S. Ning, et al., Redox Biol. 6,
ний (грант № 18-04-00059а).
1 (2015).
19.
J. Green, M. D. Rolfe, and L. J. Smith, Virulence 5, 1
(2013).
КОНФЛИКТ ИНТЕРЕСОВ
20.
A. F. Vanin, R. A. Stukan, and E. B. Manukhina, Bio-
chim. Biophys. Acta 1295, 5 (1996).
Авторы заявляют об отсутствии конфликта
интересов.
21.
A. F. Vanin, Nuitric Oxide Biol. Chem. 21, 1 (2009).
БИОФИЗИКА том 65
№ 1
2020
60
ВАНИН и др.
Antitumour Properties of Dinitrosyl Iron Complexes with Thiol-Containing Ligands
and S-Nitrosoglutathione in the Experiment
A.F. Vanin*, **, L.A. Ostrovskaya***, D.B. Korman***, V.A. Rykova***,
N.V. Bluchterova***, and M.M. Fomina***
*Semenov Institute of Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**Institute of Regenerative Medicine, Sechenov First Moscow State Medical University,
ul. Trubetskaya 8, Moscow, 119991 Russia
***Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
The antitumor activity of S-nitrosoglutathione, bi- and mononuclear dinitrosyl iron complexes with different
thiol-containing ligands such as glutathione, mercaptosuccinate, thiosulfate agaisnt murine transplantable
solid tumors (Lewis lung carcinoma, Acatol adenocarcinoma and Ca-755 adenocarcinoma) was studied.
Preparations of dinitrosyl iron complexes with glutathione after intravenous injection (Lewis lung carcinoma)
and S-nitrosoglutathione after intraperitoneal injection (Ca-755 adenocarcinoma) in animals exhibited the
highest antitumor activity. They caused 90% tumor cell growth inhibition. The results obtained, in conjunc-
tion with our earlier data concerning the antitumor activity of this type of compounds as well as the results
of other researchers in this filed of study, suggest that the antitumor effect of the above mentioned com-
pounds is due to the ability of these preparations to act as donors of nitrosonium ions. Nitrosonium ion-in-
duced S-nitrosylation of thiol-containing proteins localized to tumor cell surfaces leads to the enhancement
of the intracellular oxidative capacity thereby promoting apoptosis and death of tumor cells.
Keywords: dinitrosyl iron complexes, S-nitrosothiols, antitumor activity, murine solid tumor models
БИОФИЗИКА том 65
№ 1
2020