БИОФИЗИКА, 2020, том 65, № 1, с. 69-73
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.336+ 57.01
ОБРАЗОВАНИЕ ЛИПОФУСЦИНА У ДРОЗОФИЛ ПРИ НАГРЕВАНИИ
И УЛЬТРАФИОЛЕТОВОМ ОБЛУЧЕНИИ
© 2020 г. А.Е. Крылова, А.В. Чаплыгина, Н.Л. Векшин
Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, ул. Институтская, 3
E-mail: nvekshin@rambler.ru
Поступила в редакцию 04.09.2019 г.
После доработки 04.09.2019 г.
Принята к публикации 05.09.2019 г.
Проведено спектроскопическое изучение возникновения липофусцинового «мусора» в туловищах
и головах дрозофил Drosophila melanogaster (vestigial) под действием повышенной температуры и
интенсивного ультрафиолетового облучения. После часового воздействия температуры (48°С) или
ультрафиолетового облучения в туловищах и головах дрозофил обнаруживается деградация
триптофановых остатков белков, сопровождающаяся появлением голубой флуоресценции
термолипофусцина или фотолипофусцина соответственно. Предполагается, что триптофановые
остатки активно участвуют в формировании этих липофусцинов. Кроме того, наблюдалась
термодеструкция и фотодеструкция ретиналя глазного родопсина.
Ключевые слова: липофусцин, ретиналь, Drosophila melanogaster, ультрафиолетовое облучение.
DOI: 10.31857/S0006302920010081
Накопление внутриклеточного «мусора» липо-
ры, при особом питании и при отборе для раз-
фусцина (этот общепринятый термин неудачен,
множения только молодых самок продолжитель-
так как не в каждом липофусцине много липи-
ность жизни возрастает многократно [8].
дов) является одним из индикаторов старения ор-
Одним из экологических факторов, ускоряю-
ганизмов [1, 2]. При естественном старении, а
щих старение, является повышенная температу-
также при воздействии некоторых вредных эко-
ра, активирующая образование перекиси водоро-
логических факторов на животных количество
да и перекисное окисление липидов, вызываю-
внутриклеточного «мусора» увеличивается [3, 4].
щих денатурацию белков и накопление
В зависимости от условий в разных органах могут
липофусцина в разных объектах [5, 7-9, 12, 14,
накапливаться различные виды липофусцина,
15]. Другим экологическим фактором является
сильно варьирующего по своему составу и свой-
ультрафиолетовое облучение, которое может дей-
ствам
[4-6]. Когда
«мусора» накапливается
ствовать аналогичным образом [8, 16, 17].
слишком много, животное умирает [7-10]. Поми-
Целью данной работы является спектроскопи-
мо накопления липофусцина, у старых животных
ческое изучение возникновения липофусциново-
увеличивается количество межбелковых сшивок
го «мусора» в тушках и головах нелетающих дро-
[6, 11], уменьшается содержание цитохромов и
зофил (Drosophila melanogaster, мутация vestigial)
флавинов [12] и т.д.
под действием двух экологических факторов -
Хотя продолжительность жизни животных,
повышенной температуры и интенсивного уль-
как известно, сильно зависит от генетических
трафиолетового облучения. Кроме того, показана
особенностей и мутаций, никакой специальной
деградация ретиналя глазного родопсина и его
«программы» смерти, о которой иногда говорят
участие в образовании липофусцинового «мусо-
[13], у животных не существует [7].
ра» в головах дрозофил после этих воздействий.
Плодовые мушки (Drosophila melanogaster) яв-
ляются удобным объектом для изучения есте-
МАТЕРИАЛЫ И МЕТОДЫ
ственного и искусственного старения [8-10, 13,
14], так как у них небольшая продолжительность
Опыты проводили на нелетающих дрозофилах
жизни, высокая плодовитость, маленькие разме-
Drosophila melanogaster (мутация vestigial) в воз-
ры и неприхотливость к условиям содержания.
расте 10-20 суток. Дрозофил выращивали и со-
При комнатных температурах эти мушки живут
держали согласно протоколу, описанному в рабо-
обычно 20-30 суток. При понижении температу-
те [8]. Чтобы минимизировать влияние компо-
69
70
КРЫЛОВА и др.
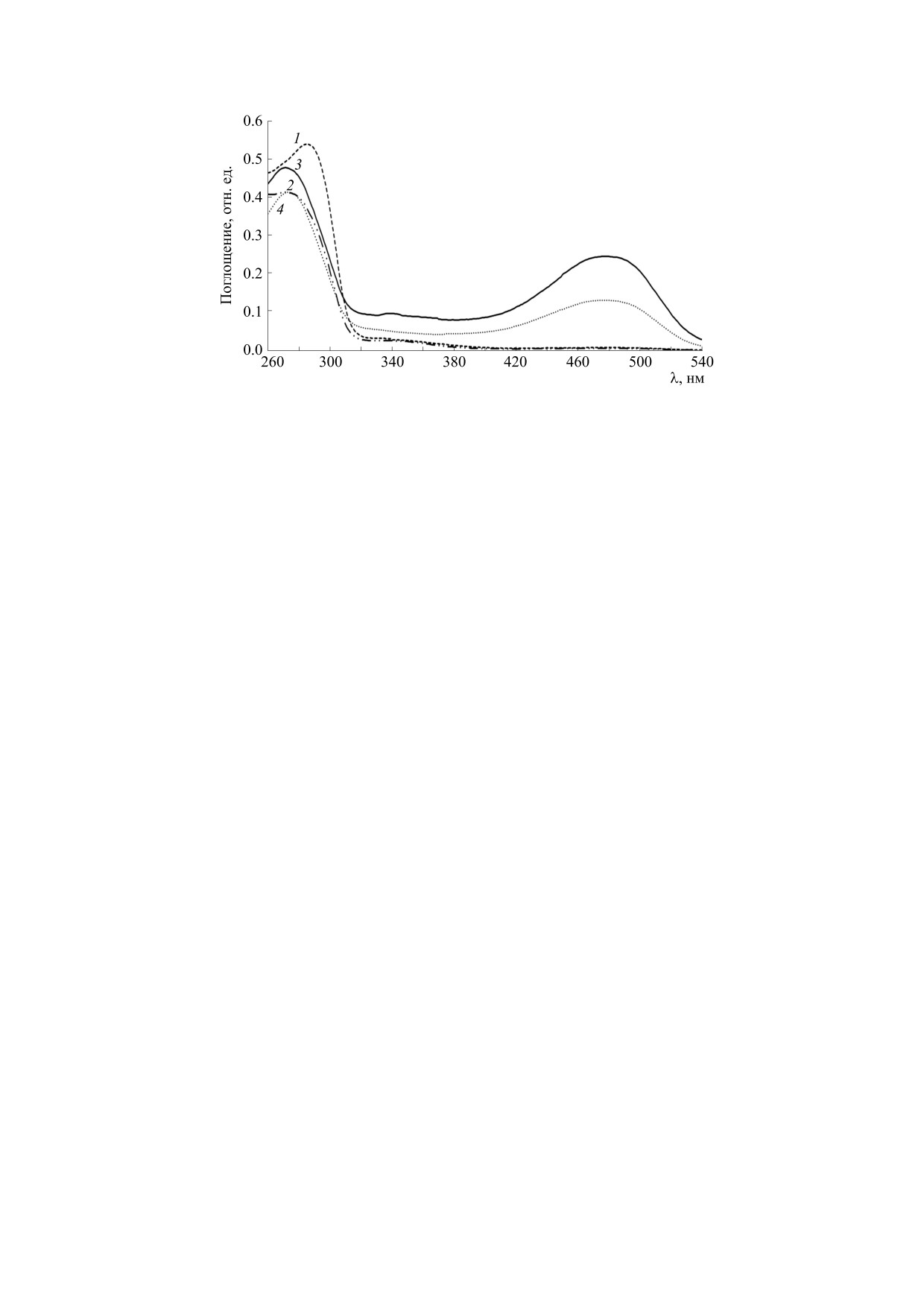
Рис. 1. Спектры поглощения экстрактов туловищ и голов дрозофил до и после часового воздействия на мушек
повышенной температуры (48°С): 1 - туловище, контроль, 2 - туловище, опыт, 3 - голова, контроль, 4 - голова, опыт.
нентов пищи кишечника на регистрируемые
товой и видимой области регистрировали на
показатели (оптическую плотность и флуорес-
спектрофотометре ПЭ-5400-УФ (ООО «Экохим»,
ценцию экстрактов туловищ и голов мушек), за
Санкт-Петербург). Спектры флуоресценции экс-
восемь часов до опыта дрозофил оставляли без
трактов снимали на спектрофлуориметре Cary
еды (давали только воду).
Eclipse (Agilent , США) в кварцевых кюветах с
длиной оптического пути 1 см по известным ме-
Для исследования воздействия повышенной
тодикам [17, 18].
температуры на мушек их помещали в пластико-
вую пятимиллилитровую пробирку типа Eppen-
dorf, устанавливаемую в камеру термостата при
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
48°С на 1 ч.
В спектрах поглощения экстрактов голов дро-
Для облучения дрозофил ультрафиолетовым и
зофил наблюдаются две интенсивные полосы - в
видимым светом (250-800 нм) использовали ксе-
районе 260-290 нм и 420-520 нм (рис. 1). Первая
ноновую лампу мощностью 450 Вт, дополнитель-
обусловлена в основном ДНК (260 нм) и белками
но снабженную водным светофильтром (в боль-
(270 нм - тирозины, 280 нм - триптофаны) [17,
шой кварцевой ячейке), ослабляющим ближний
18], а вторая - ретиналем, принадлежащем ро-
инфракрасный свет и полностью отрезающим
допсину пигментных клеток глаз [19]. Кроме то-
среднее инфракрасное (тепловое) излучение (эта
го, имеется слабая, едва заметная полоса в районе
лампа моделирует естественное солнечное облу-
330-370 нм. В этой области поглощают флавины,
чение, т.к. имеет сходный спектр). Живых мушек
НАДН, НАДФН, антраниловая кислота и липо-
помещали в кварцевую кювету с длиной оптиче-
фусцин [7, 11, 18], количество которых у дрозофил
ского пути 1 см и облучали в течение 1 ч. При
мало и не определенно.
этом кювету держали открытой, чтобы не проис-
ходило сильного повышения температуры внутри
После часового воздействия на дрозофил по-
кюветы.
вышенной температуры (48°С) в спектрах погло-
щения наблюдается уменьшение оптической
Затем десять опытных и десять контрольных
плотности в ультрафиолетовой области (рис. 1). В
(без нагрева или облучения) мушек декапитиро-
туловищах снижение оптической плотности в
вали, после чего отдельно гомогенизировали го-
ультрафиолетовой области обусловлено исклю-
ловы и отдельно - туловища. Гомогенизацию
чительно деградацией триптофановых остатков
проводили путем тщательного растирания в фар-
белков. Об этом свидетельствует то, что уменьша-
форовой ступке пестиком в 0,5 мл изопропаноль-
ется поглощение при 280 нм, но не при 260 нм.
но-водного (с соотношением 1 : 4) раствора с по-
ДНК при умеренном нагреве не деградирует. В
следующим добавлением еще 1,5 мл такого же
случае же голов после нагрева в спектре в ультра-
раствора. Нерастворимые частицы (крылышки,
фиолетовой области не возникает коротковолно-
ножки и др.) отбрасывали или отфильтровывали.
вого сдвига. Это связано с тем, что значительный
Все полученные экстракты проб были выров-
вклад в ультрафиолетовую полосу экстрактов го-
нены по величине поглощению при 280 нм для
лов дает ретиналь глазного родопсина, а не трип-
получения сходных концентраций по белку.
тофаны белков. Ретиналевая полоса в видимой
Спектры поглощения экстрактов в ультрафиоле-
области после часового нагрева мушек уменьши-
БИОФИЗИКА том 65
№ 1
2020
ОБРАЗОВАНИЕ ЛИПОФУСЦИНА У ДРОЗОФИЛ
71
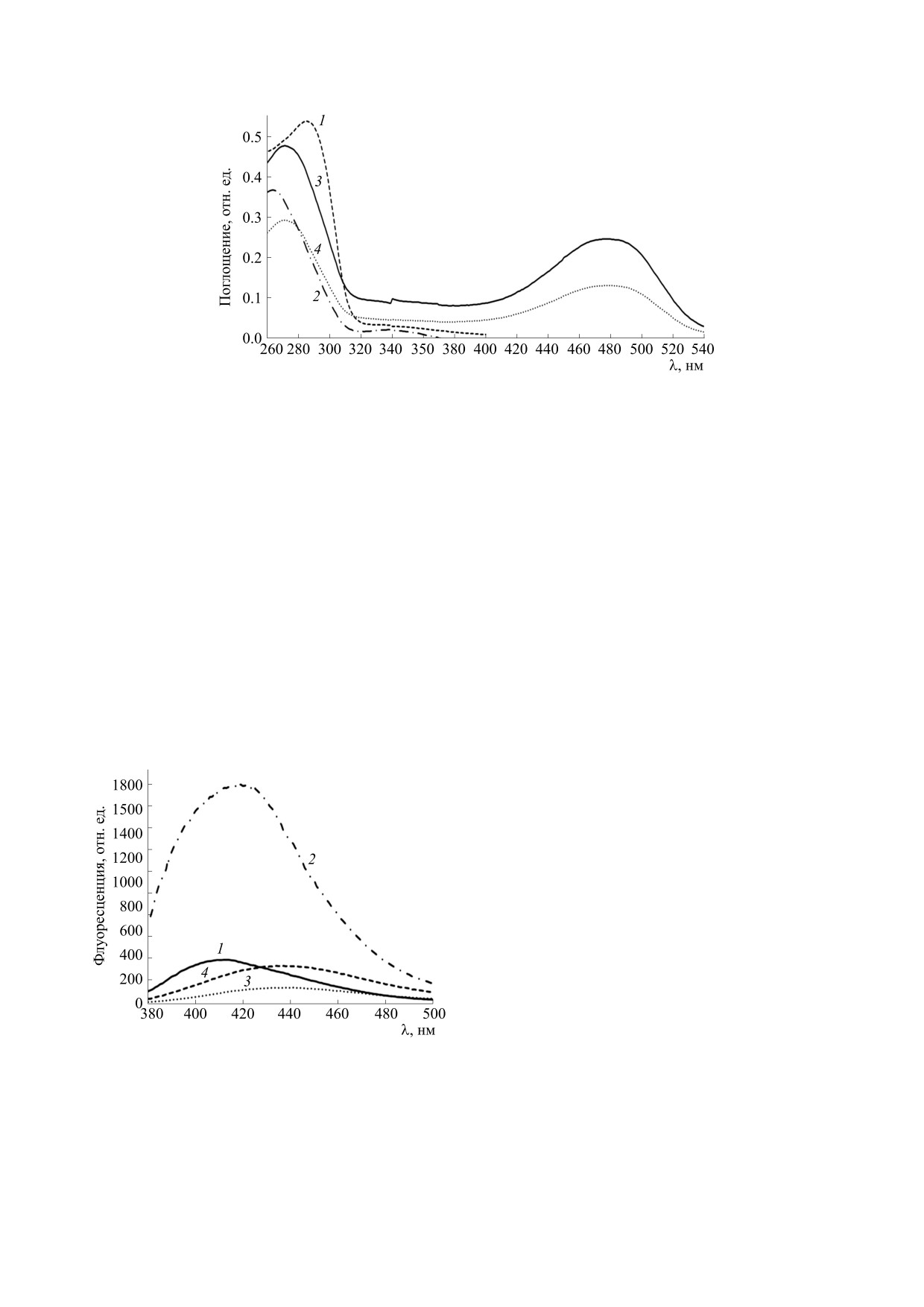
Рис. 2. Спектры поглощения экстрактов туловищ и голов дрозофил до и после часового ультрафиолетового облучения
мушек: 1 - туловище, контроль, 2 - туловище, опыт, 3 - голова, контроль, 4 - голова, опыт.
лась вдвое. Значит, при высокой температуре
Поскольку спектрофотометрически детекти-
происходит повреждение пигментных клеток
ровать липофусцин практически невозможно
глаз, сопровождающееся окислением и деграда-
(слишком слаба полоса в районе 360 нм из-за его
цией ретиналя. Деградировавший ретиналь мож-
малого количества), то он был детектирован
но рассматривать как внутриклеточный «мусор».
спектрофлуориметрически. Одним из свойств
липофусцина является его интенсивная
Аналогичные изменения возникают после ча-
флуоpеcценция в голубой области при возбужде-
сового ультрафиолетового облучения дрозофил
нии в ближней ультрафиолетовой области [12, 16,
(рис. 2), причем ароматические аминокислоты в
20]. При этом наибольший вклад часто вносит
этом случае деградируют сильнее, чем при нагре-
митохондриальный липофусцин [5, 6, 10, 12, 16].
вании, а ретиналь - почти настолько же. Интен-
сивный ультрафиолетовой свет поглощается
В спектре изопропанольно-водных экстрактов
триптофановыми и тирозиновыми остатками
контрольных дрозофил видна полоса голубой
белков, вызывая денатурацию, а интенсивный
флуоресценции (при возбуждении на 360 нм, см.
видимый свет поглощается глазным ретиналем
рис. 3). Интенсивность и положение максимума
родопсина, вызывая его деградацию.
спектров экстрактов туловищ и голов различают-
ся. В экстрактах туловищ голубая полоса втрое
сильней, чем в экстрактах голов, и имеет макси-
мум при 410 нм, а не при 435 нм. В голубую полосу
могут вносить неопределенный вклад несколько
флуорофоров: шиффовый хромофор липофусци-
на, НАДН, НАДФН, антраниловая кислота и др.,
что, по-видимому, и обусловливает существен-
ный спектральный сдвиг между экстрактами из
туловищ и голов.
После часового прогрева дрозофил при темпе-
ратуре 48°С в экстрактах туловищ возникает
очень интенсивная полоса с максимумом при
420 нм (рис. 3), принадлежащая исключительно
образовавшемуся термолипофусцину. Спектр
термолипофусцина сдвинут в длинноволновую
сторону относительно исходной полосы (до на-
грева). Нельзя исключить, что одной из флуоро-
форных групп термолипофусцина является ан-
траниловая кислота - продукт деградации белко-
Рис. 3. Спектры голубой флуоресценции экстрактов
вого триптофана.
туловищ и голов дрозофил до и после часового
воздействия на мушек повышенной температуры
В экстрактах голов после часового прогрева
(48°С): 1 - туловище, контроль, 2 - туловище, опыт,
3 - голова, контроль, 4 - голова, опыт. Возбуждение
дрозофил при температуре 48°С интенсивность
флуоресценции - 360 нм.
голубой полосы возрастает вдвое, но без суще-
БИОФИЗИКА том 65
№ 1
2020
72
КРЫЛОВА и др.
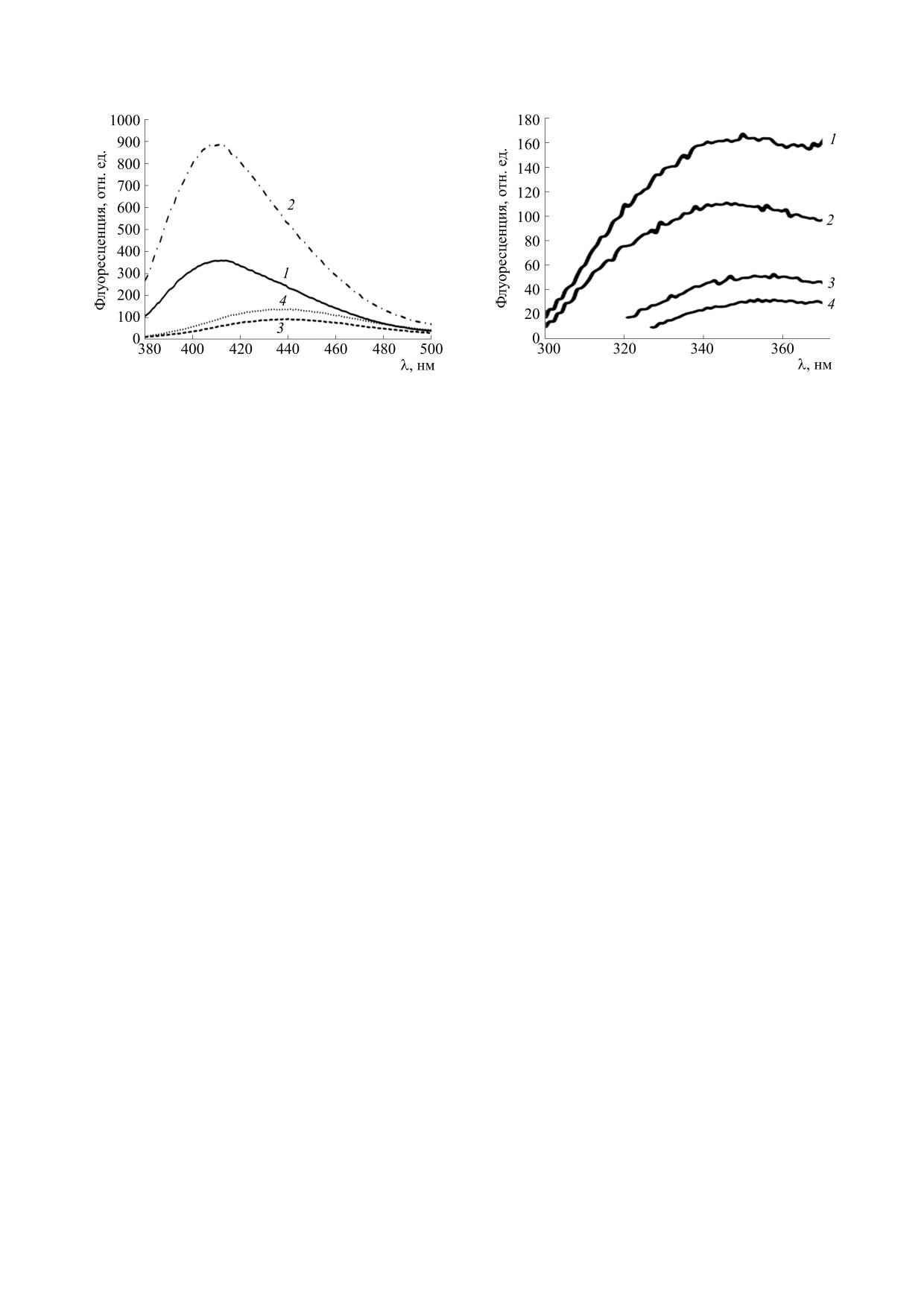
Рис. 4. Спектры голубой флуоресценции экстрактов
Рис. 5. Спектры белковой флуоресценции экстрак-
туловищ и голов дрозофил до и после часового уль-
тов туловищ и голов дрозофил после часового воз-
трафиолетового облучения мушек: 1 - туловище,
действия повышенной температуры (48°С): 1 - ту-
контроль, 2 - туловище, опыт, 3 - голова, контроль,
ловище, контроль, 2 - туловище, опыт, 3 - голова,
4 - голова, опыт. Возбуждение флуоресценции -
контроль, 4 - голова, опыт. Возбуждение флуорес-
360 нм.
ценции - 280 нм.
ственного спектрального сдвига (рис. 3). Значит,
приводить как к образованию шиффовых основа-
в этом случае термолипофусцин сильно схож с
ний белков с окисленными липидами, так и к де-
исходным липофусцином. Можно предполо-
градации триптофановых остатков до антранило-
жить, что они оба в значительной степени явля-
вой кислоты. В обоих случаях должна возникать
ются продуктами деградации ретиналя, а не толь-
голубая флуоресценция термолипофусцинового
ко белков.
«мусора» (при возбуждении на 360 нм), что и на-
блюдалось нами (см. рис. 3).
После часового ультрафиолетового облучения
дрозофил в спектрах голубой флуоресценции
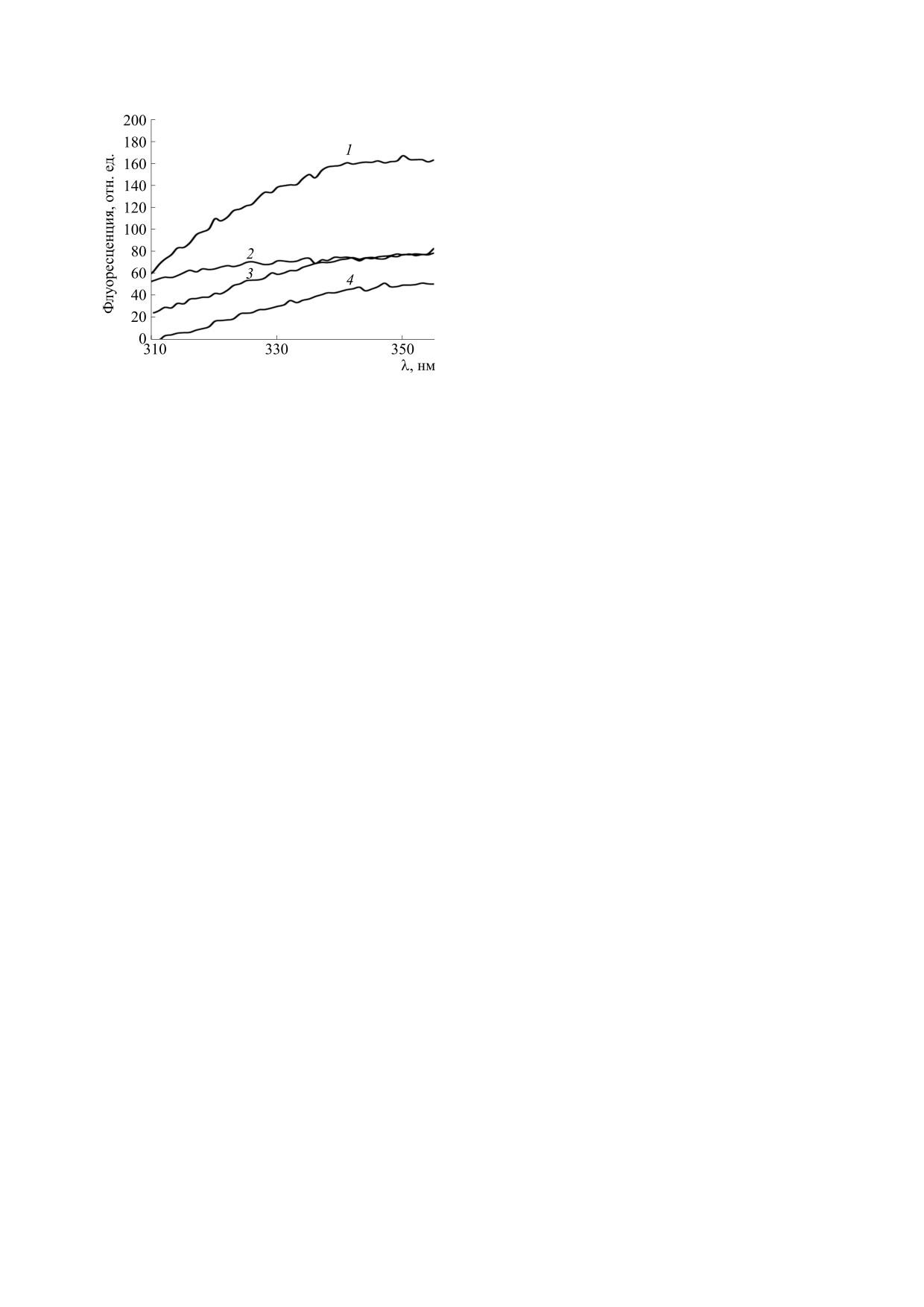
Сходное, но еще более выраженное падение
экстрактов туловищ и голов наблюдаются явле-
триптофановой флуоресценции наблюдается в
ния, аналогичные наблюдаемым при нагреве
экстрактах туловищ после часового ультрафиоле-
(рис. 4). Однако, в отличие от нагрева, для экс-
тового облучения (рис. 6). В экстрактах голов
трактов туловищ при этом не наблюдается длин-
снижение тоже имело место, но было существен-
новолнового сдвига. Фотолипофусцин туловищ
но меньше. Данный факт хорошо согласуется с
отличен от термолипофусцина туловищ. В случае
тем, что при ультрафиолетовом облучении дрозо-
же голов фотолипофусцин спектрально не отли-
фил в их головах возникает мало фотолипофус-
чается от исходного липофусцина голов. Вероят-
цина (рис. 4). Это можно объяснить тем, что рети-
но, фотолипофусцин голов в значительной степе-
наль, поглощая ультрафиолетовой свет, экрани-
ни является продуктом фотодеградации ретина-
рует собой белки, защищая триптофаны от
ля, а не только триптофановых остатков белков.
ультрафиолетового воздействия. Вероятно,
Предположение о важной роли триптофано-
именно поэтому белки туловищ менее подверже-
вых остатков белков в формировании голубой
ны фотодеструкции, чем белки голов.
флуоресценции термолипофусцина и фотолипо-
Вышеприведенные результаты хорошо согла-
фусцина подтверждается данными по белковой
суются с ранее полученными на митохондриях
флуоресценции.
печени крысы [1, 6, 16,] и на нематодах [11] дан-
На рис. 5 приведены спектры белковой флуо-
ными о важной роли деградации триптофановых
ресценции экстрактов туловищ и голов после ча-
остатков в формировании двух типов внутрикле-
сового воздействия на дрозофил повышенной
точного «мусора» - нефлуоресцирующих меж-
температуры. В обеих пробах после воздействия
белковых сшивок и флуоресцирующего липофус-
обнаруживается снижение интенсивности трип-
цина.
тофановой полосы. Это согласуется со спектро-
фотометрическими данными. Значит, количе-
Итак, возникновение липофусцинового «му-
ство триптофановых остатков после прогрева
сора» в тушках и головах нелетающих дрозофил
дрозофил действительно заметно уменьшается.
(Drosophila melanogaster, vestigial) под действием
По-видимому, термолипофусцин, как и фотоли-
повышенной температуры или интенсивного
пофусцин, образуется из любых триптофансодер-
ультрафиолетового облучения весьма сходно.
жащих белков. Повышенная температура может
Оно в значительной степени обусловлено дегра-
БИОФИЗИКА том 65
№ 1
2020
ОБРАЗОВАНИЕ ЛИПОФУСЦИНА У ДРОЗОФИЛ
73
СПИСОК ЛИТЕРАТУРЫ
1.
U. T. Brunk and A. Terman, Eur. J. Biochem. 269, 1996
(2002).
2.
A. Terman and U. T. Brunk, Acta Pathol. Microbiol.
Immunol. Scand. 106 (2), 265 (1998).
3.
A. Höhn and T. Grune, Redox Biol. 1, 140 (2013).
4.
T. Jung, N. Bader, and T. Grune, Ann. N. Y. Acad. Sci.
1119, 97 (2007).
5.
А. В. Чаплыгина и Н. Л. Векшин, Биофизика 64
(1), 101 (2019).
6.
А. В. Чаплыгина и Н. Л. Векшин, Успехи геронто-
логии 31 (2), 197 (2018).
7.
Н. Л. Векшин и М. С. Фролова, Биофизика 64 (1),
162 (2019).
8.
N. Linford, C. Bilgir, J. Ro, and S. Pletcher, J. Visual.
Рис. 6. Спектры белковой флуоресценции экстрак-
Exp. 71, 1 (2013).
тов туловищ и голов дрозофил после часового уль-
9.
J. Miquel, P. Lundrgen, K. Bensch, and H. Atlan,
трафиолетового облучения: 1 - туловище, контроль,
Mechanisms of Ageing and Development 5, 347 (1976).
2 - туловище, опыт, 3 - голова, контроль, 4 - голо-
10.
F. Scialo, A. Sriram, J. Enriquez, et al., Cell Metabo-
ва, опыт. Возбуждение флуоресценции - 280 нм.
lism 23, 725 (2016).
11.
Е. Л. Гагаринский и Н. Л. Векшин, Успехи герон-
тологии, № 5, 676 (2017).
дацией триптофановых остатков белков и рети-
наля.
12.
M. S. Frolova and N. L. Vekshin, Biochem. & Analyt.
Biochem. 7 (3), 357 (2018).
13.
D. Denton, M. T. Aung-Htat, and S. Kumar, Biochim.
БЛАГОДАРНОСТИ
Biophys. Acta 1833, 3499 (2013).
Авторы выражают признательность А.М. Львову
14.
F. Wood and J. H. Nordin, Insect. Biochem. 10, 95
за участие в проведении предварительных экспери-
(1980).
ментов.
15.
R. S. Sohal, I. Svensson, and U. T. Brunk, Mechanisms
of Ageing and Development 53, 209 (1990).
16.
М. С. Фролова, А. М. Сурин, А. В. Браславский и
КОНФЛИКТ ИНТЕРЕСОВ
Н. Л. Векшин, Биофизика 60 (5), 1125 (2015).
Авторы заявляют об отсутствии конфликта
17.
N. L. Vekshin, Photonics of Biopolymers (Springer,
интересов.
2002).
18.
N. L. Vekshin, Fluorescence Spectroscopy of Biomacro-
molecules (Photon-Vek, Pushchino, 2009).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
19.
F. Schutt, B. Ueberle, M. Schnölzer, et al., FEBS Lett.
Настоящая работа не содержит описания ка-
528 (1-3), 217 (2002).
ких-либо исследований с использованием людей
20.
H. Donato and R. S. Sohal, Exp. Gerontol. 13 (3-4),
и животных в качестве объектов.
171 (1978).
The Formation of Lipofuscin in Drosophila after Exposure
to Elevated Temperature and UV Radiation
A.E. Krylova, A.V. Chaplygina, and N.L. Vekshin
Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
In this work, we studied by spectroscopy how exposure to elevated temperature regime or intense UV radia-
tion leads to the occurrence of lipofuscin debris in carcasses and heads of Drosophila melanogaster (vestigial).
After one-hour exposure to elevated temperature ( 48°C) or UV radiation degradation of tryptophan residues
followed by the appearance of blue fluorescence of thermo-lipofuscin or photo-lipofuscin, respectively, was
observed in Drosophila carcasses and heads. Evidence suggests that tryptophan residues are actively involved
in the formation of these lipofuscins. Thermal and photo-destruction of retinal of the eye rhodopsin were also
seen.
Keywords: lipofuscin, retinal, Drosophila melanogaster, ultraviolet irradiation
БИОФИЗИКА том 65
№ 1
2020