БИОФИЗИКА, 2020, том 65, № 1, с. 74-79
БИОФИЗИКА КЛЕТКИ
УДК 577.352.4+576.314.63
МЕХАНИЗМ ВЗАИМОДЕЙСТВИЯ НАНОЧАСТИЦ ОКСИДОВ МЕТАЛЛОВ
С БИОЛОГИЧЕСКИМИ МЕМБРАНАМИ
© 2020 г. П.В. Мокрушников
Новосибирский государственный архитектурно-строительный университет («Сибстрин»),
630008, Новосибирск, ул. Ленинградская, 113
E-mail: pwm64@ngs.ru
Поступила в редакцию 17.05.2019 г.
После доработки 29.09.2019 г.
Принята к публикации 30.09.2019 г.
Развитие нанотехнологий, искусственное получение наночастиц оксидов металлов с размерами от
1 до 100 нм поднимает вопрос о биологической безопасности таких наночастиц. Наночастицы
размером менее 10 нм способны проникнуть в кровоток, а оттуда уже в различные органы - мозг,
печень, почки, легкие, селезенку. Наночастицы - патогенный экзогенный фактор, меняющий
структуру и функции природных биомембран. Ранее было установлено in vitro, что в мембрану
проникают наночастицы, имеющие радиус меньше критического значения Rcr. При этом
микровязкость липидного бислоя биомембран уменьшается, образуются сквозные поры, которые
могут слиться в трещины и разрушить мембрану. Если радиус наночастиц больше критического, то
они адсорбируются на поверхности мембран, увеличивая их микровязкость. В обоих случаях
наночастицы нарушают нормальное функционирование природных биомембран и клеток. В
представленной работе дана термодинамическая модель прямого (не за счет эндоцитоза)
проникновения наночастиц в липидный бислой мембраны. Показано, что при увеличении дзета-
потенциала наночастицы увеличивается значение Rcr.
Ключевые слова: плазматические мембраны, механические напряжения в биомембранах, структурные
переходы в биомембранах, взаимодействие наночастиц и биомембран.
DOI: 10.31857/S0006302920010093
Наночастицы оксидов металлов находят ши-
рез микрокапилляры [10-12]. На механические
рокое применение в машиностроении, космосе,
напряжения в мембранах влияют экзогенные и
химической промышленности, электронике,
эндогенные факторы, например присутствие гор-
косметике и т.п. [1]. Развитие нанотехнологий,
монов [13, 14], белков плазмы крови [15], витами-
искусственное получение наночастиц с размера-
на Е [16]. Изменение микровязкости мембран
ми от 1 до 100 нм поднимает вопрос об их биоло-
эритроцитов является, по-видимому, одним из
гической безопасности. Наночастицы размером
механизмов приспособления человеческого орга-
меньше 10 нм способны проникнуть в кровоток, а
низма к суровым условиям Крайнего Севера [17,
оттуда уже в различные органы: мозг, печень,
18]. Попадание внутрь организма человека нано-
почки, легкие, селезенку [2]. Установлено, что
частиц может помешать работе такого приспосо-
наночастицы - патогенный экзогенный фактор,
бительного механизма.
меняющий структуру и функции биологических
Полученные в этих работах результаты позво-
мембран [3, 4].
лили сформулировать общий принцип, согласно
Наночастицы, взаимодействуя с эритроцита-
которому нативная мембрана эритроцита в крови
ми, меняют микровязкость и механические на-
при физиологических параметрах крови находит-
пряжения липидного бислоя их мембран [3, 4].
ся в состоянии структурного перехода. Под этим
Экспериментально in vitro установлено, что меха-
понимается следующее. Природная биомембрана
нические напряжения в биомембране влияют на
состоит из белок-липидных доменов, в которых
активность некоторых мембранных белков [5, 6].
укладка молекул более плотная, и мезополос раз-
Это объясняется структурными изменениями в
рыхления липидного бислоя между доменами с
биомембранах [7-9]. Известно, что механические
менее плотной укладкой молекул [7, 13, 14]. До-
напряжения и структурные изменения в биомем-
мены и мезополосы разрыхления образуют моза-
бранах влияют на некоторые функции эритроци-
ичную структуру биомембраны, соотношение за-
тов, например, на их способность проходить че-
нимаемых ими площадей постоянно меняется. В
74
МЕХАНИЗМ ВЗАИМОДЕЙСТВИЯ НАНОЧАСТИЦ ОКСИДОВ МЕТАЛЛОВ
75
нативных природных биомембранах идет посто-
Если размер наночастиц меньше критическо-
янный процесс перестройки структуры. Неболь-
го, то они проникают в мембрану. При этом про-
шие изменения рН крови, концентрации гормо-
исходит снижение микровязкости липидного
нов в крови, ее температуры резко изменяют кон-
бислоя мембран эритроцитов, что говорит об
формацию биомембраны, ее функции с помощью
уменьшении плотности упаковки липидного бис-
изменения поля механических напряжений в
лоя. Структура биомембраны разрыхляется. Не-
биомембране [13, 14]. Под конформацией натив-
сколько пор в поверхности биомембраны, распо-
ной природной биомембраны понимается не
ложенных на небольшом расстоянии друг от дру-
га, сливаются между собой с образованием
только состав ее белков и липидов, но и конфор-
трещин на поверхности биомембраны. Посте-
мация мембранных белков и фазы липидного
пенное увеличение количества таких трещин на
бислоя, распределение белков и липидов по
поверхности приводит к деградации мембраны
бислою.
эритроцита и дальнейшему ее разрушению [3, 4].
Наночастицы, взаимодействуя с мембранами
Появившиеся после внедрения наночастиц в бис-
эритроцитов, тоже способны резко менять кон-
лой поры уменьшают средние механические на-
формацию биомембран, делая невозможным вы-
пряжения в биомембране. Возникает снятие ме-
полнение биомембранами их функций [3, 4]. В
ханического напряжения в биомембране (раз-
этом и заключается цитотоксичность наноча-
рыхление структуры липидного бислоя), оно
передается липидам, которые прилегают к инте-
стиц. Уже при концентрации 10-15 моль/мг белка
гральным белкам (преимущественно связанным с
наночастиц кварца или корунда во взвеси эритро-
цитоскелетом эритроцита - спектрин-актин-ан-
цитов наблюдаются изменения рельефа поверх-
кириновой сетью). Таким образом, снижается
ности эритроцитов [3, 4]. Крупные наночастицы,
также микровязкость и в области белок-липидно-
обладающие размером больше критического, ад-
го взаимодействия. В данном случае можно пола-
сорбируются на поверхности мембран, неспеци-
гать, что структурные переходы в эритроцитар-
фически связываясь с молекулами фосфолипи-
ных мембранах инициируются в основном в
дов бислоя, образуя с ними электростатические,
области липид-липидных взаимодействий. Дей-
ван-дер-ваальсовы, гидрофобные связи и увели-
ствие на белки передается за счет кооперативно-
чивая микровязкость липидного бислоя и меха-
сти гетероструктуры биомембраны.
нические напряжения в мембране. Наночастицы
Экспериментально in vitro показана возмож-
кварца и корунда не вызывают заметного туше-
ность прямого (не за счет эндоцитоза) проникно-
ния собственной флуоресценции триптофаниль-
вения нанокристаллов оксидов металлов в мем-
ных радикалов мембранных белков [3, 4]. Это
браны эритроцитов [3, 4]. В мембрану проникают
значит, что не происходит конформационных из-
нанокристаллы, имеющие радиус меньше крити-
менений в мембранных белках, наночастицы свя-
ческого значения Rcr. Значение Rcr для корунда
зываются с белками очень слабо. Крупные нано-
(Al2O3) составляет от 15 до 20 нм (дзета-потенци-
частицы внутрь бислоя не проникают, конформа-
цию белков они сильно не изменяют. Похожая
ал поверхности равен +15 мВ). Значение Rcr для
ситуация наблюдается при взаимодействии кле-
кварца (SiO2) составляет 5-8 нм (дзета-потенци-
ток с гормонами [13, 14]. Более гидрофильные
ал поверхности равен -35 мВ). Установлено, что
гормоны хуже проникают в гидрофобный липид-
значение критического радиуса зависит от дзета-
ный бислой, слабее связываются с белками. Из-
потенциала наночастицы [3, 4]. Механизм внед-
менение микровязкости мембран при воздей-
рения нанокристаллов в биомембраны оставался
ствии на них более гидрофильных гормонов ни-
неясным. В нашей работе приведена термодина-
же, чем при воздействии более гидрофобных [13,
мическая модель прямого (не за счет эндоцитоза)
14]. Возможно, неспецифическому связыванию
проникновения наночастиц в липидный бислой
гормонов и гидрофильных наночастиц с гидро-
мембраны.
фильными участками белков, находящихся на
поверхности мембраны, препятствуют молекулы
PЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
воды, гидратированные на полярных участках
мембранных белков. По-видимому, гидратиро-
Встраивание наночастиц в бислой обусловле-
ванные молекулы воды, связываясь с гидрофиль-
но гидрофобным эффектом. В эксперименте дав-
ными наночастицами или гормонами, уменьша-
ление и температура остаются постоянными [3,
ют энергию системы «белок-вода-наночастица»
4]. Термодинамическим методом можно рассчи-
за счет ограничения своей подвижности. Проис-
тать значение критического радиуса наночасти-
ходит стабилизация системы, уменьшается веро-
цы, при котором она встраивается в биомембра-
ятность того, что наночастицы или гормоны мо-
ну. В результате тепловых колебаний бислоя на-
гут напрямую неспецифически связаться с мем-
ночастица может выйти из мембраны. После ее
бранными белками [13, 14].
выхода из мембраны в последней остается пора,
БИОФИЗИКА том 65
№ 1
2020
76
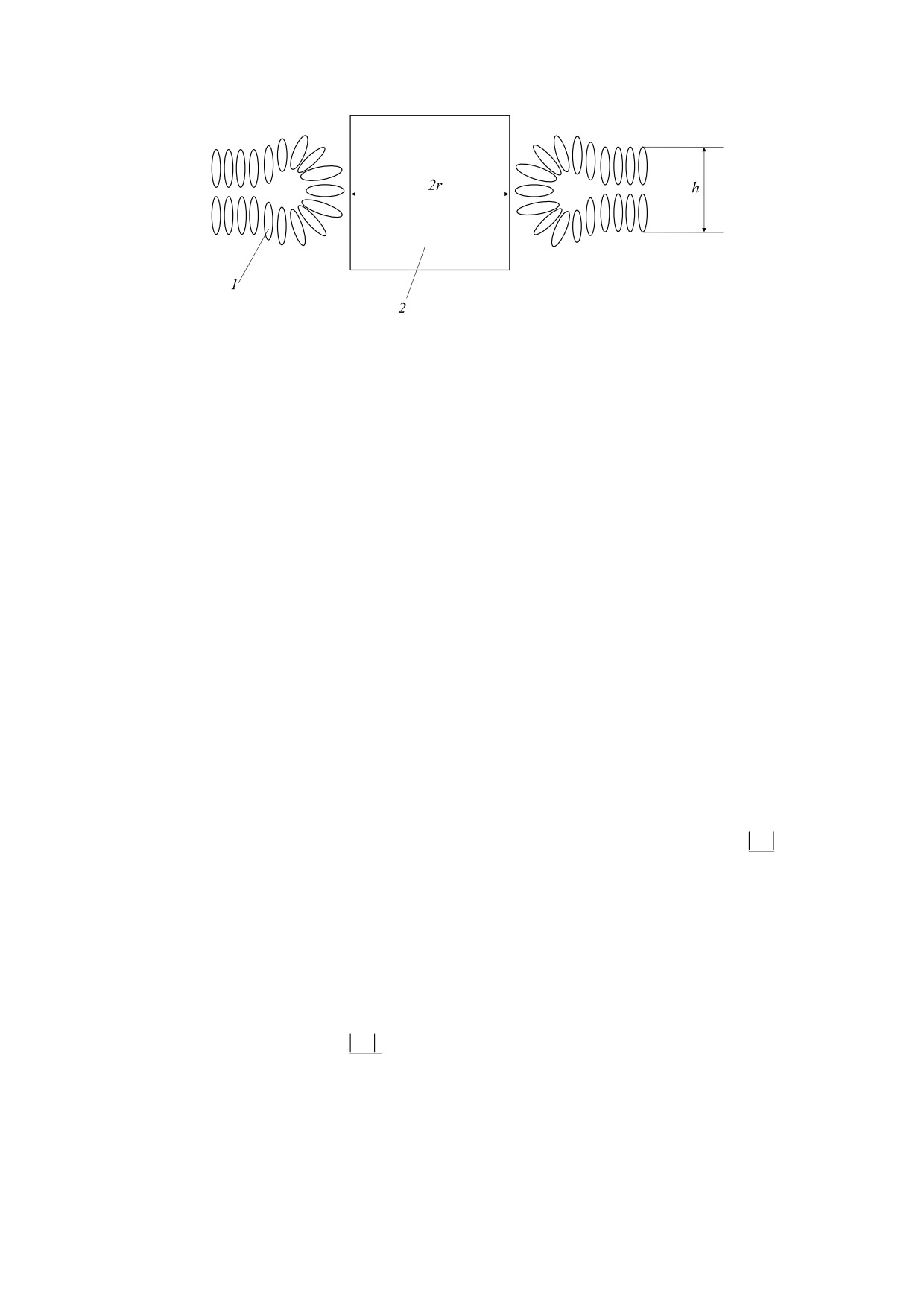
МОКРУШНИКОВ
Участок биомембраны с наночастицей: 1 - липид бислоя, 2 - наночастица радиусом r и высотой 2r, h - толщина
бислоя.
если радиус поры больше некоторого значения
тенциалов на внутренней и внешней поверхно-
[19, 20]. Для простоты расчетов примем, что рас-
стях мембраны, ΔC0
- изменение удельной
сматриваемые наночастицы - круглые цилиндры
электрической емкости мембраны после появле-
высотой 2r и радиусом r (рис. 1). На рис. 1 изобра-
ния в ней поры.
жен участок биомембраны со встроенной наноча-
При встраивании наночастицы в мембрану в
стицей: 1 - липид бислоя, 2 - наночастица ради-
выражении для изменения энергии Гиббса систе-
усом r и высотой 2r, h - толщина бислоя. В своей
мы «мембрана-наночастица» нужно дополни-
модели мы предполагаем, что наночастица при
тельно учесть гидрофобный эффект, равный из-
встраивании в мембрану не взаимодействует с
менению энтропии «размороженных» молекул,
гидрофобными участками мембранных белков
умноженной на температуру. Нужно учесть рабо-
(вероятность близкого расположения наночасти-
ту электрического поля мембраны по встраива-
цы и белка мала). Поверхность поры выстилают
нию наночастицы в мембрану (взятого с обрат-
полярные группы фосфолипидов. Толщина мем-
ным знаком). Эта работа появляется из-за нали-
браны около поры немного увеличивается [21,
чия заряда на поверхности наночастицы. Одна из
22]. Этим увеличением в нашей модели пренебре-
возможностей образования заряда на неметалли-
гаем. До встраивания наночастиц в бислой они
ческих частицах - поверхностная диссоциация
окружены сольватным слоем молекул связанной
твердой фазы, которая содержит какие-либо
воды, белков, ионов. Молекулы сольватного слоя
функциональные группы, способные к электро-
образуют водородные связи с полярными группа-
литической диссоциации. В буфере вокруг нано-
ми на поверхности наночастиц. Часть этих моле-
частицы образуется двойной электрический
кул теряет свою подвижность, «замораживается».
слой, который характеризуется дзета-потенциа-
При встраивании наночастицы в бислой молеку-
лом [23]. Таким образом, при встраивании нано-
лы его сольватной оболочки сдергиваются с нее
частицы в мембрану изменение энергии Гиббса
липидами бислоя. Происходит «разморажива-
системы «мембрана-наночастица» равно:
ние» этих молекул. Водородные связи между мо-
лекулами сольватной оболочки и полярными
Δφ
ΔG
1
=ΔG -T ⋅ΔS
⋅ 2π
r⋅ h− q
,
(1)
группами поверхности наночастицы замещаются
2
водородными связями между полярными группа-
где ΔS - увеличение энтропии молекул при их
ми поверхности наночастицы и головок фосфо-
«размораживании» на единицу площади наноча-
липидов.
стицы; h - толщина мембраны, q - заряд наноча-
Ранее были получены оценки критического
стицы. Предполагаем, что радиус поры совпадает
размера водной поры, самопроизвольно образу-
с радиусом наночастицы.
ющейся в липидном бислое [19, 20]. Изменение
Наночастица будет встраиваться в мембрану,
свободной энергии липидного бислоя при этом
если изменение энергии Гиббса бислоя и нано-
равно
кристалла DG1 будет меньше нуля. Сделаем оцен-
2
ки для величин, входящих в DG1 согласно выра-
⎛
Δφ
⎞
ΔG
=
2πr ⋅γ − πr
γ
+ΔС
⋅
,
жению (1). До вхождения нанокристалла в бислой
0
2⎜
⎟
2
этот участок бислоя представлял из себя заряжен-
⎝
⎠
ный конденсатор. После вхождения наночастицы
где γ - линейное натяжение кромки поры, r - ра-
конденсатор исчезал. Разность электрических
~
диус поры,
γ
- энергия поверхностного натяже-
потенциалов на наружной стороне плазматиче-
ния мембраны, Δϕ - разность электрических по-
ской мембраны и на ее внутренней стороне созда-
БИОФИЗИКА том 65
№ 1
2020
МЕХАНИЗМ ВЗАИМОДЕЙСТВИЯ НАНОЧАСТИЦ ОКСИДОВ МЕТАЛЛОВ
77
ется в основном за счет разности концентраций
φ
ε
Δφ
8h
0
cr
ионов. Разность концентраций ионов поддержи-
ΔG
гидр
⋅
+
⋅
-
2πγ
2
D
⋅ с⋅N
k
2
А
вается работой Na+,K+-АТФаз мембран [24].
R
cr
=
(6)
2
πε
ε
Δφ
Толщина слоя этих ионов, прилегающего к мем-
0
cr
⋅
-
πγ
бране, очень мала. Высота наночастицы (2r) боль-
h
2
ше толщины мембраны h. В модели предполага-
ется, что слой ионов, создающих разность потен-
При радиусе цилиндра наночастицы меньше
циалов в биомембране, не обвалакивает
Rcr энтропийный член в выражении (1) для сво-
наночастицу. Изменение энергии при этом равно
бодной энергии будет превышать энергию связи
«выбитых» липидов и внедрение наночастицы в
2
2
Δφ
ε
⋅ε
Δφ
л
0
бислой будет термодинамически выгодным, так
ΔС
0
⋅
=-
⋅
,
(2)
как в этом случае значение ΔG1 < 0. Если наноча-
2
h
2
стица заряжена отрицательно (в выражении (6)
где εл - диэлектрическая проницаемость липид-
ϕ0 ≤ 0), это затрудняет ее внедрение в мембрану. В
ного бислоя, ε0 - электрическая постоянная. В
этом случае ей нужно преодолеть силы электро-
экспериментах [3, 4] измеряли дзета-потенциал
статического отталкивания, критический радиус
ϕ(x) наночастиц, который связан с поверхност-
Rcr из выражения (6) уменьшается. Напротив, ес-
ным потенциалом ε0 следующим соотношением
ли наночастица заряжена положительно, то элек-
[24]:
тростатические силы помогают ей внедриться в
ϕ(x) = ϕ0⋅exp(-χ⋅x).
(3)
бислой. Критический радиус Rcr из выражения (6)
при этом увеличивается.
Здесь x - расстояние от плоскости скольжения
до поверхности наночастицы:
Сделаем оценки критических радиусов нано-
1
частиц для оксидов кремния и алюминия. По ли-
2
2
2
⎛2
⋅
z
⋅ С
⋅
F
⎞
0
0
тературным данным можно взять следующие зна-
χ
,
=⎜
⎟
ε⋅ε ⋅
R
⋅
Т
чения: линейное натяжение кромки поры ≈ 10-11 Н,
⎝
0
⎠
энергия поверхностного натяжения мембраны
где z - валентность ионов буфера, Т - абсолютная
температура буфера, F0 - число Фарадея, C0 -
толщина мембраны h ≈ 10-8 м, раз-
γ ≈ 0.03 мН/м,
ность электрических потенциалов на внутренней
средняя концентрация ионов в буфере, ε - ди-
и внешней поверхностях мембраны Δϕ = 0.5 В,
электрическая проницаемость буфера, R - газо-
диэлектрическая проницаемости липидного бис-
вая постоянная. При выводе соотношения (3)
лоя εл = 3, диаметр молекулы воды D ≈ 0,28 нм,
считаем, что буфер - симметричный электролит.
расстояние от плоскости скольжения до поверх-
Заряд на поверхности наночастицы q можно
ности наночастицы х ≈ 2D, коэффициент гидро-
оценить по формуле заряда для заряженной сфе-
фобности сольватной оболочки наночастицы сг =
ры, поскольку наночастица в виде цилиндра с вы-
90, диэлектрическая проницаемость наночастиц
сотой 2r и радиусом r близка по форме к сфере ра-
кварца εcr = 4, дзета-потенциал наночастиц квар-
диусом r:
ца ϕ(x) = -35 мВ, диэлектрическая проницае-
ε
⋅ φ
cr
0
мость наночастиц оксида алюминия εcr = 10, дзе-
q
=
r,
(4)
k
та-потенциал наночастиц оксида алюминия
где εcr - диэлектрическая проницаемость нано-
ϕ(x) = 15 мВ, концентрация анионов в буфере
C0 = 140 мМ/л, валентность ионов буфера z = 1,
кристалла, k = 1/4πε0. Энтропийный член можно
диэлектрическая проницаемость буфера ε =120
записать в виде
[24]. Подставив эти величины в выражение (6),
2π
⋅
r ⋅ h⋅ 4
получим величины критических диаметров нано-
T ⋅ΔS
⋅ 2π
⋅
r ⋅ h
=ΔG
гидр
⋅
,
(5)
2
π
⋅
D
⋅ с
⋅
N
частиц кремния 6 нм, оксида алюминия - 20 нм.
г
А
где ΔGгидр - энергия гидрофобного взаимодей-
Действительно, ранее экспериментально уста-
ствия, D - диаметр молекулы воды, NА - число
новлено, что значение Rcr для корунда Al2O3 со-
Авогадро, сг
- коэффициент гидрофобности
ставляет 15-20 нм (дзета-потенциал поверхности
+15 мВ). Значение Rcr для кварца SiO2 составляет
сольватной оболочки наночастицы. Коффициент
гидрофобности показывает, какая часть молекул
5-8 нм (дзета-потенциал поверхности -35 мВ) [3,
сольватной оболочки лишилась подвижности,
4]. Чем выше дзета-потенциал поверхности, тем
«заморозилась». Если выражения (2) - (5) подста-
выше и критический радиус наночастицы. Нано-
вить в уравнение (1) и приравнять к нулю, то
частицы с большим радиусом, чем Rcr, просто ад-
можно получить выражение для критического
сорбируются на поверхности и не разрушают
значения радиуса наночастицы Rcr:
биомембрану.
БИОФИЗИКА том 65
№ 1
2020
78
МОКРУШНИКОВ
Можно предположить, что при радиусах на-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ночастиц, меньших некоторого значения Rmin,
Настоящая работа не содержит описания ка-
поры в мембранах не будут появляться. После вы-
ких-либо исследований с использованием людей
хода наночастиц такого размера из мембран обра-
и животных в качестве объектов.
зованные ими поры будут затягиваться. В работе
[20] приведена оценка для Rmin:
СПИСОК ЛИТЕРАТУРЫ
γ
R
min
=
1.
B. H. Kim, M. J. Hackett, J. Park, and T. Hyeon,
2
ε
0
(ε
в
−
ε
л
)
Δφ
Chem. Mater. 26, 59 (2014).
γ
+
⋅
2.
M. A. Maurer-Jones, I. L. Gunsolus, C. J. Murphy, and
h
2
C. L. Haynes, Anal. Chem. 85 (6), 3036 (2013).
Подставляя приведенные выше значения, по-
3.
П. В. Мокрушников, Л. Е. Панин, Б. Н. Зайцев
лучим Rmin = 1.1 нм. Можно сделать вывод, что
и др., Биофизика 56 (6), 1105 (2011).
происходит разрушение мембраны эритроцита
4.
A. I. Kozelskaya, A. V. Panin, I. A. Khlusov, et al., Tox-
при взаимодействии с наночастицами радиусом
icology in Vitro 37, 34 (2016).
Rmin ≤ r ≤ Rcr. Этот процесс нарушает транспорт-
5.
Л. Е. Панин и П. В. Мокрушников, Биофизика 59
ные функции эритроцитов, ускоряет процессы
(1), 127 (2014).
старения красных кровяных клеток. Все эти фак-
6.
P. V. Mokrushnikov, L. E. Panin, and B. N. Zaitsev,
торы могут привести к различным сердечно-сосу-
Gen. Physiol. Biophys. 34 (3), 311 (2015).
дистым заболеваниям у человека уже в довольно
7.
Л. Е. Панин, П. В. Мокрушников, В. Г. Куницин
молодом возрасте. Наночастицы такого рода,
и др., Физич. мезомеханика 14 (1), 5 (2011).
проникнув через ядерную мембрану, могут «при-
8.
П. В. Мокрушников, Биофизика 62 (2), 330 (2017).
липать» к различным органеллам или образовы-
9.
П. В. Мокрушников, Труды Новосибирского
вать аддукты ДНК, способные вызывать струк-
государственного
архитектурно-строительного
турные разрушения и мутации [1, 2].
университета (Сибстрин) 21 (1) 17 (2018).
Становится понятно, почему некоторые кос-
10.
Л. Е. Панин, П. В. Мокрушников, Р. А. Князев
метические кремы и скрабы являются опасными
и др., Атеросклероз 6, 12 (2012).
для кожи. Кристаллы минералов, используемых в
11.
В. Г. Куницын, П. В. Мокрушников и Л. Е. Панин,
этих кремах, измельчаются до очень маленького
Бюл. СО РАМН 5 (127), 28 (2007).
размера. Если этот размер меньше Rcr для данного
12.
П. В. Мокрушников, Бюл. СО РАМН 1 (147), 38
кристалла, то наночастицы, содержащиеся в кре-
(2010).
ме, начнут разрушать клетки эпидермиса.
13.
L. E. Panin, P. V. Mokrushnikov, V. G. Kunitsyn, and
B. N. Zaitsev, J. Phys. Chem. B 114, 9462 (2010).
14.
L. E. Panin, P. V. Mokrushnikov, V. G. Kunitsyn, and
ВЫВОДЫ
B. N. Zaitsev, J. Phys. Chem. B 115, 14969 (2011).
Наночастицы - патогенный экзогенный фак-
15.
П. В. Мокрушников, А. Н. Дударев, Т. А. Ткаченко
тор, меняющий структуру и функции биомем-
и др., Биол. мембраны 33 (6), 406 (2016).
бран [1-4]. В мембрану проникают наночастицы,
16.
Л. Е. Панин и П. В. Мокрушников, Вестн.
имеющие радиус меньше критического значения
Новосибирского гос. пед. ун-та 5 (15), 101 (2013).
Rcr. При этом микровязкость липидного бислоя
17.
О. Н. Потеряева, Г. С. Русских, П. В.
биомембран уменьшается, образуются сквозные
Мокрушников и др., Вестн. Уральской мед. акад.
поры, которые могут слиться в трещины и разру-
науки 48 (2), 149 (2014).
шить мембрану [3, 4]. Если радиус наночастиц
18.
П. В. Мокрушников, Л. П. Осипова, Т. В. Гольцова
больше критического, то они адсорбируются на
и А. А. Розуменко, Якутский мед. журн. 54 (2), 15
поверхности мембран, увеличивая их микровяз-
(2016).
кость [3, 4]. В обоих случаях наночастицы нару-
19.
В. Ф. Антонов, Е. Ю. Смирнова и Е. В. Шевченко,
шают нормальное функционирование мембран и
Липидные мембраны при фазовых превращениях
клеток. В представленной работе дана термоди-
(Наука, М., 1992).
намическая модель прямого (не за счет эндоцито-
20.
Ю. А. Чизмаджев, В. Б. Аракелян и В. Ф.
за) проникновения наночастиц в липидный бис-
Пастушенко, Биофизика мембран (Наука, М.,
лой мембраны. Показано, что при увеличении
1981).
дзета-потенциала наночастицы увеличивается ее
21.
S. A. Akimov, P. E. Volynsky, T. R. Galimzyanov, et al.,
значение Rcr.
Sci. Reports 7 (1), 12152 (2017).
22.
S. A. Akimov, P. E. Volynsky, T. R. Galimzyanov, et al.,
Sci. Reports 7 (1), 12509 (2017).
КОНФЛИКТ ИНТЕРЕСОВ
23.
В. Н. Вережников, Избранные главы коллоидной
Авторы заявляют об отсутствии конфликта
химии (Воронежский гос. ун-т, Воронеж, 2011).
интересов.
24.
А. Б. Рубин, Биофизика (Наука, М., 2004).
БИОФИЗИКА том 65
№ 1
2020
МЕХАНИЗМ ВЗАИМОДЕЙСТВИЯ НАНОЧАСТИЦ ОКСИДОВ МЕТАЛЛОВ
79
The Mechanism of Interaction of Metal-Oxide Nanoparticles
with Biological Membranes
P.V. Mokrushnikov
Novosibirsk State University of Architecture and Civil Engineering (SIBSTRIN),
Leningradskaya ul. 113, Novosibirsk, 630008 Russia
Advances in nanotechnologies, artificial methods for synthesis of metal-oxide nanoparticles with sizes be-
tween 1 to 100 nm bring up the concern about the appropriate biosafety level for the materials obtained.
Nanoparticles having size less than 10 nm are able to penetrate into the bloodstream, and through the blood-
stream can enter various organs such as brain, liver, kidneys, lungs, and spleen. Nanoparticles show bacteri-
cidal activity against pathogenic bacteria that disturb the structure and functions of natural biomembranes.
Earlier in vitro studies showed that nanoparticles with a diameter below a critical value of Rcr permeate the
membrane. As a result, microviscosity of the lipid bilayer of biomembranes decreases. This process is accom-
panied with the formation of transversal pores which can merge into cracks and destroy the membrane. When
nanoparticles are larger than a critical size, adsorption of these nanoparticles onto the membrane surfaces
leads to an increase in membrane microviscosity. In both cases, nanoparticles disrupt normal function of
natural biomembranes and cells. This paper presents a thermodynamic model of the direct (not relying on
endocytosis) penetration of nanoparticles into the lipid bilayer membrane. It was shown that the Rcr value in-
creases with increase in zeta potential of the nanoparticle.
Keywords: plasma membranes, mechanical stresses in biomembranes, structural transitions in biomembranes, in-
teraction of nanoparticles with biomembranes
БИОФИЗИКА том 65
№ 1
2020