БИОФИЗИКА, 2020, том 65, № 1, с. 80-86
БИОФИЗИКА КЛЕТКИ
УДК 539.611
ИССЛЕДОВАНИЕ МЕЖКЛЕТОЧНЫХ АДГЕЗИОННЫХ КОНТАКТОВ
НЕЙТРОФИЛЬНЫХ ГРАНУЛОЦИТОВ И ЛИМФОЦИТОВ МЕТОДОМ
АТОМНО-СИЛОВОЙ МИКРОСКОПИИ
© 2020 г. С.Н. Плескова*, **, Р.Н. Крюков*, С.З. Бобык*, **, А.В. Боряков*, А.А. Брилкина*
*Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
603950, Нижний Новгород, просп. Гагарина, 23/3
**Нижегородский государственный технический университет им. Р.Е. Алексеева
603950, Нижний Новгород, ул. Минина, 24/1
E-mail: pleskova@mail.ru
Поступила в редакцию 23.07.2019 г.
После доработки 23.07.2019 г.
Принята к публикации 27.11.2019 г.
Атомно-силовая микроскопия была использована для создания системы измерения межклеточных
адгезионных контактов. Методом сканирующей электронной микроскопии была доказана
эффективность использования поли-L-лизина для фиксации нейтрофилов и лимфоцитов на зонде.
Было показано, что при фиксации одной клетки на зонде, а второй - на поверхности подложки
можно проводить релевантные измерения сил межклеточной адгезии, используя режим FS-
спектроскопии. Были измерены силы межклеточной адгезии между нейтрофилами и
лимфоцитами. Для нейтрофилов она составила - 38.5 ± 13.7 пН, а для лимфоцитов - 35.6 ± 8.3 пН.
Таким образом, адгезия между нейтрофилами статистически значимо выше адгезии, возникающей
между лимфоцитами.
Ключевые слова: межклеточная адгезия, атомно-силовая микроскопия, FS-спектроскопия,
нейтрофилы, лимфоциты, сканирующая электронная микроскопия.
DOI: 10.31857/S000630292001010X
гандами позволяет оценить силу лиганд-рецеп-
Атомно-силовая микроскопия позволяет:
торных белковых взаимодействий [2-4]. Таким
1) получать изображения отдельных клеточных
образом, этот тип микроскопии является един-
структур и самих клеток с высоким разрешением;
ственным, который позволяет не только визуали-
2) осуществлять динамический мониторинг из-
зировать происходящие явления, но и активно
менений клеток (деления, гибели, движения по
моделировать различные экспериментальные
субстрату, отдельных метаболических процессов)
процессы.
в режиме реального времени; 3) определять мик-
ромеханические свойства клеток, в том числе
В пионерской работе [5] впервые были иссле-
оценивать резерв ее механической прочности;
дованы силы межклеточной адгезии на примере
4) вносить в клетку или доставать из нее отдель-
склонных к агрегации клеток Dictyostelium dis-
ные молекулы (например, РНК) не нарушая ее
coideum (клеточный слизевик, относящийся к ти-
жизнеспособности;
5) определять наличие и
пу Mycetosoa). Той же группой авторов была про-
укладку основных белков клеток; 6) оценить осо-
демонстрирована действенность модели исследо-
бенности свертки/развертки белков; 7) получать
вания
адгезионных
контактов
клеток
информацию о локализации и плотности экс-
млекопитающих между рецептором VLA-4 (α4β1
прессии основных адгезинов; 8) изучать сенсосо-
integrin) лимфоцитов (метастазирующая мелано-
мы; 9) разрезать вирусы; 10) связывать механиче-
мы В 16) человека и рецептором VCAM-1, кото-
ские свойства белков с местом локализации на
рый экспрессируется на мембране эндотелия со-
поверхности клетки; 11) исследовать молекуляр-
судов bEnd.3 [6]. Они установили, что сила спе-
ные динамические процессы, протекающие с вы-
цифического одномолекулярного контакта
сокой скоростью методом высокоскоростной
составляет 33 ± 12 пН. Аналогичные взаимодей-
микроскопии [1]. Функционализация зондов ли-
ствия измерены между молекулой ICAM-1 эндо-
телиальных клеток и MUC-1 и CD43, экспресси-
Сокращениe: СФР - стерильный физиологический раствор.
руемых на клетках рака мочевого пузыря. Было
80
ИССЛЕДОВАНИЕ МЕЖКЛЕТОЧНЫХ АДГЕЗИОННЫХ КОНТАКТОВ
81
установлено, что сила взаимодействия ICAM-1 и
CD43 соответствовала 43 пН, а связывание между
молекулами ICAM-1 и MUC-1 - около 53 пН [7].
Однако в клинической практике трудно вы-
членить единичные молекулярные контакты в
суммарной силе взаимодействия, возникающей
между клетками в процессе межклеточной адге-
зии, агрегации и при других физиологических и
патологических процессах. Тем не менее адгези-
онные контакты между целыми клетками крайне
важны. В частности, дефициты адгезии нейтро-
Рис. 1. Схема проведения эксперимента по изучению
филов к эндотелию (например, впервые описан-
межклеточной адгезии: одна клетка фиксирована на
ный иммунодефицит, связанный с генетическим
зонде, вторая - на подложке. Обе клетки живые, по-
скольку все исследования ведутся в физиологических
дефектом CD18) сопровождаются тяжелыми ре-
жидкостях.
цидивирующими инфекциями, в том числе глу-
бокими тканевыми абсцессами и нейтрофилией
[8]. И напротив, гиперадгезия нейтрофилов к эн-
физиологического раствора (СФР). После от-
дотелию, тромбоцитам и друг к другу является од-
мывки на кантилевер с зондом наносили суспен-
ним из патогенетических звеньев синдрома дис-
зию клеток (10 мкл), инкубировали 20 мин при
семинированного внутрисосудистого свертыва-
37°С и трижды отмывали СФР. Кантилевер уста-
ния и следствием септического процесса [9].
навливали на головку с каплей СФР, которая
Поэтому важно разрабатывать системы, которые
обеспечивала жизнеспособность клетки во время
могли бы исследовать суммарную силу адгезион-
короткого времени транспорта и погружения
ных контактов между клетками.
зонда в чашку Петри.
Целью данного исследования было использо-
В стерильную чашку Петри (35 мм, Corning®
вание режима спектроскопии в атомно-силовой
Treated Culture Dishes, США) вносили 2 мл сус-
микроскопии для разработки принципиально но-
пензии клеток, инкубировали для достижения
вой системы исследования сил межклеточной ад-
спонтанной адгезии 20 мин при 37°С и трижды
гезии и измерение с помощью этой системы силы
отмывали СФР. Затем «жидкостную ячейку» пе-
адгезионных контактов между нейтрофилами и
реносили на столик атомно-силового микроско-
лимфоцитами.
па NTegra (NT-MDT, Россия).
Силы межклеточной адгезии определяли ме-
тодом FS-спектроскопии. Теоретические основы
МАТЕРИАЛЫ И МЕТОДЫ
метода и его подробное описание изложены в ра-
Исследовали венозную кровь здоровых доно-
ботах [1,11,12]. Проводили выставление зонда над
ров обоих полов в возрасте 20-40 лет, получен-
клеткой, под контролем оптического микроско-
ную из Нижегородского областного центра крови
па, затем выполняли захват обратной связи в кон-
им. Н.Я. Климовой. Кровь стабилизировали ге-
тактном режиме. После этого выставляли диапа-
парином (25 ЕД/мл) и разводили забуференным
зон измерения высоты положения кантилевера
физиологическим раствором, содержащим
над клеткой - 100-5000 нм. Сила прижатия ва-
0.137 М NaCl и 0.0027 М KCl, рН 7.35 (200 g, 3 мин)
рьировала в диапазоне 10-50% от максимально
в соотношении 1:1. Для выделения нейтрофиль-
возможного, а время снятия кривой - от 2 до 60 с.
ной и лимфоцитарной фракции использовали
После получения FS-кривой обратную связь от-
двойной градиент фиколла-урографина (ρ1 =
ключали, чтобы не повредить клетки, проводили
1.077 г/мл, ρ2 = 1.117 г/мл, 200 g, 40 мин) [10]. По-
переход на новую область и процесс повторяли.
лученные фракции раздельно отмывали забуфе-
Каждый образец подвергали исследованию в те-
ренным физиологическим раствором
(200 g,
чение 1 ч. Далее проводили замену образцов как
3 мин), и использовали в конечной концентра-
на зонде, так и на чашке Петри. Исследования
ции 1 · 106 кл/мл. Клетки брали в эксперимент
проводили до получения 816 кривых.
сразу после выделения, жизнеспособность по те-
Схема проведения эксперимента представлена
сту с трипановым синим составляла не менее
на рис. 1.
99%.
По окончании эксперимента зонд с фиксиро-
Клетки высаживали на Si3N4-зонд (С-MSCT,
ванной на нем клеткой трижды отмывали СФР,
Bruker, США), имеющий следующие характери-
клетку фиксировали глутаровым альдегидом
стики: f0 - 4-10 кГц, k - 0.010 Н/м. Предвари-
(2.5%, 10 мин), отмывали трехкратно СФР, высу-
тельно кантилевер с зондом был обработан в тече-
шивали и исследовали методом сканирующей
ние 50 мин поли-L-лизином (Merck, США), за-
электронной микроскопии, доказывающим ее
тем трехкратно отмыт
10 мкл стерильного
присутствие на поверхности зонда.
БИОФИЗИКА том 65
№ 1
2020
82
ПЛЕСКОВА и др.
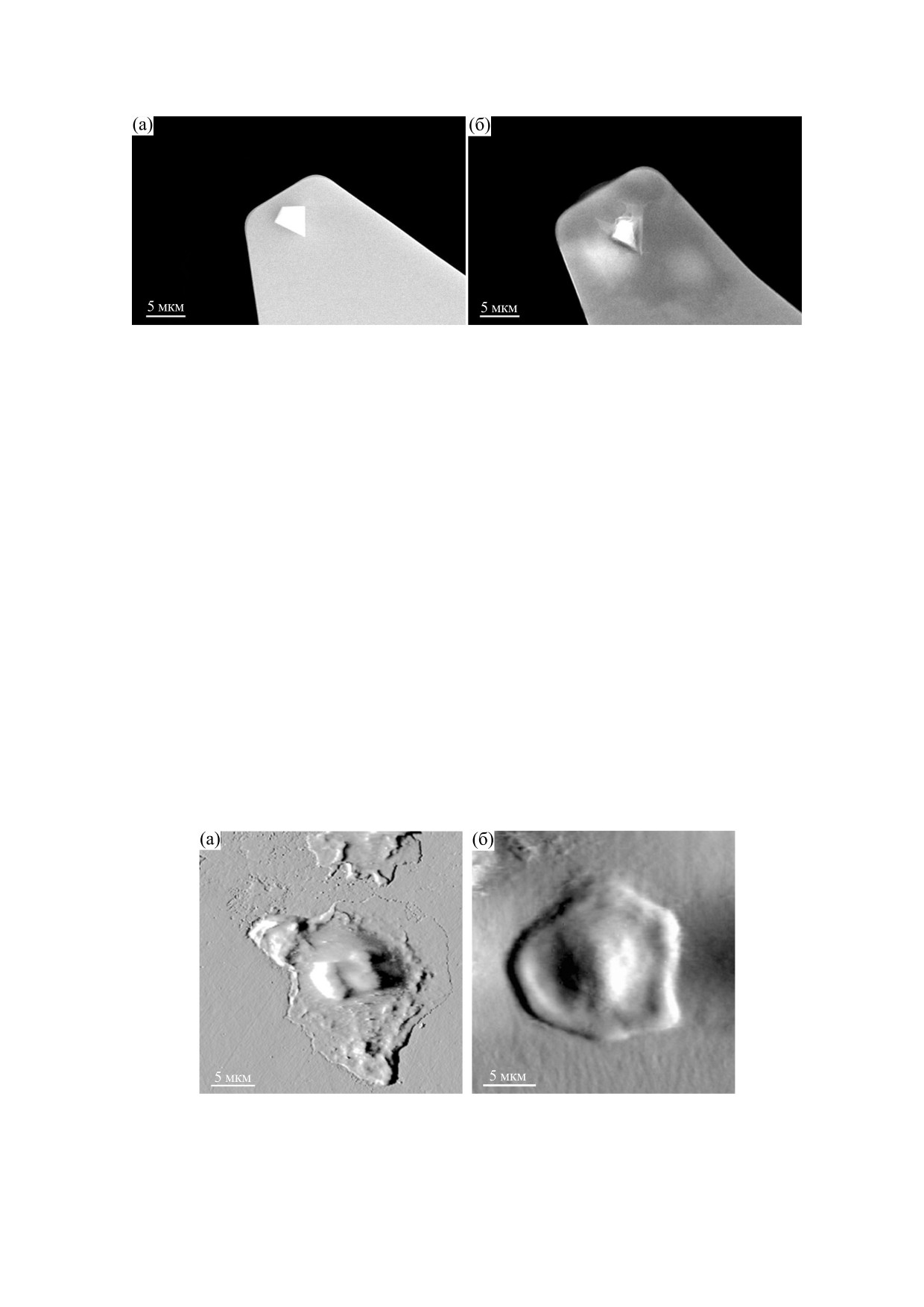
Рис. 2. Изображение, полученное методом сканирующей электронной микроскопии: (а) - интактный зонд, имеет
четкие грани и форму, близкую к пирамидальной; (б) - нейтрофил, расположенный на кончике зонда (после
сканирования нейтрофил был фиксирован 2.5%-м глутаровым альдегидом. Ядро нейтрофила расположено на
вершине зонда, цитоплазматическая часть тесно связана с поверхностью кантилевера. Сам зонд не деформирован, его
размеры форма и характер вершины не изменены.
Электронно-микроскопической исследование
РЕЗУЛЬТАТЫ
зондов проводили на электронном микроскопе
На первом этапе доказывалась эффективность
JSM-IT300LV (JEOL, Япония) в режиме высокого
поли-L-лизина для фиксации клетки на зонде.
вакуума при ускоряющем напряжении 20 кВ и то-
На рис. 2 представлены результаты исследований
ке зонда не более 0.25 нА для минимизации воз-
методом сканирующей электронной микроско-
действия тока на образцы, разрешение составля-
пии. Рис. 2а показывает, что зонд без обработки
ло не менее 10 нм. Изображения были получены
имеет четкую геометрию призмы, поверхность
одновременно в низкоэнергетичных вторичных
кантилевера чистая, свободная от органики. На
электронах и отраженных электронах.
рис. 2б видно, что после обработки зонда и канти-
левера поли-L-лизином клетка надежно закреп-
Статистическую обработку проводили в про-
ляется на зонде. Нейтрофил оказывается фикси-
грамме Origin 8.0 (Origin Lab Corp., США). Опре-
рованным на зонде, причем его цитоплазматиче-
деляли границы нормального распределения ко-
ская часть зафиксирована на кантилевере, тогда
личественных показателей выборок с использо-
как ядросодержащая часть фиксируется непо-
ванием критерия Шапиро-Уилка. Поскольку
средственно на вершине зонда.
распределения не соответствовали критериям
На втором этапе проводили сканирование
нормальности, определяли медиану и 25-й про-
клеток на поверхности чашки Петри в СФР в ви-
центиль. Для сравнения двух выборок использо-
тальном состоянии. На рис. 3 представлен резуль-
вали непараметрический критерий Вилкоксона.
тат сканирования лимфоцита и нейтрофила в на-
Рис. 3. Живые интактные клетки, адгезированные на поверхности чашки Петри в результате процесса самопроизволь-
ной адгезии: (а) - нейтрофил, (б) - лимфоцит.
БИОФИЗИКА том 65
№ 1
2020
ИССЛЕДОВАНИЕ МЕЖКЛЕТОЧНЫХ АДГЕЗИОННЫХ КОНТАКТОВ
83
Рис. 4. Кривые отвода при взаимодействии двух нейтрофилов: один иммобилизован на зонде, второй - адгезирован
на поверхности чашки Петри. Серая кривая - соответствует выраженному адгезионному контакту между двумя
клетками, черная кривая - слабому взаимодействию между двумя клетками.
тивном состоянии. Концентрацию клеток подби-
точкой «ступени». Результаты расчета представ-
рали таким образом, чтобы они располагались
лены на рис. 5.
близко друг к другу, чтобы облегчить позициони-
Медианные значения сил межклеточной адге-
рование зонда при проведении FS-спектроско-
зии составили для нейтрофилов 38.5 ± 13.7 пН,
пии. Внесение дополнительных закрепляющих
для лимфоцитов - 35.6 ± 8.3 пН. Статистический
агентов на чашку Петри не требовалось, посколь-
анализ позволил опровергнуть «0»-гипотезу и по-
ку и нейтрофилы и лимфоциты имеют высокую
казал, что различия между силами межклеточной
собственную адгезионную активность и прочно
адгезии у нейтрофилов и лимфоцитов статисти-
прикрепляются к пластику. Нейтрофил на рис. 3
чески значимы (W = 148823.5; Z = -2.0279).
имеет типичную морфологию: сегментированное
ядро и хорошо распластанную цитоплазматиче-
скую часть, в которой четко видны гранулы.
ОБСУЖДЕНИЕ
Представленная на рис. 3 клетка относится к хо-
Из рис. 4 следует, что характер силовых кри-
рошо распластанным [13]. Очевидны морфологи-
вых был разным. Например, черная кривая соот-
ческие различия между лимфоцитом и нейтрофи-
ветствует минимальному взаимодействию между
лом: лимфоцит имеет ровное округлое ядро,
клетками, тогда как серая - обычному взаимо-
меньший размер и высокоразвитую мембранную
действию, сопровождающемуся многочисленны-
поверхность.
ми рецепторными контактами. Нулевой уровень
соответствует отсутствию взаимодействия между
В результате проведения FS-спектроскопии
клетками (релаксированный кантилевер), а рабо-
получили силовые кривые. На рис. 4 представле-
та адгезии может быть оценена как площадь под
ны кривые отвода кантилевера от поверхности
кривой отвода по следующей формуле:
клетки. На них четко визуализируются скачки
(«ступени»). Каждая ступень соответствует раз-
A
ад
= ∫Fdl
,
рыву связей между рецепторами клетки находя-
щейся на зонде и рецепторами, экспрессирую-
где F - сила взаимодействия клеток, Н; l - рас-
щимися на мембране нейтрофила, адгезирован-
стояние между клетками, м.
ного на чашке Петри.
Для черной кривой интеграл площади между
Были расчитаны силы всех адгезионных кон-
нулевой силой и кривой составлял < 100 аДж, то-
тактов, возникающих между клетками, как раз-
гда как о наличии большого количества рецеп-
ница между начальным уровнем и максимальной
торных контактов можно говорить при достиже-
БИОФИЗИКА том 65
№ 1
2020
84
ПЛЕСКОВА и др.
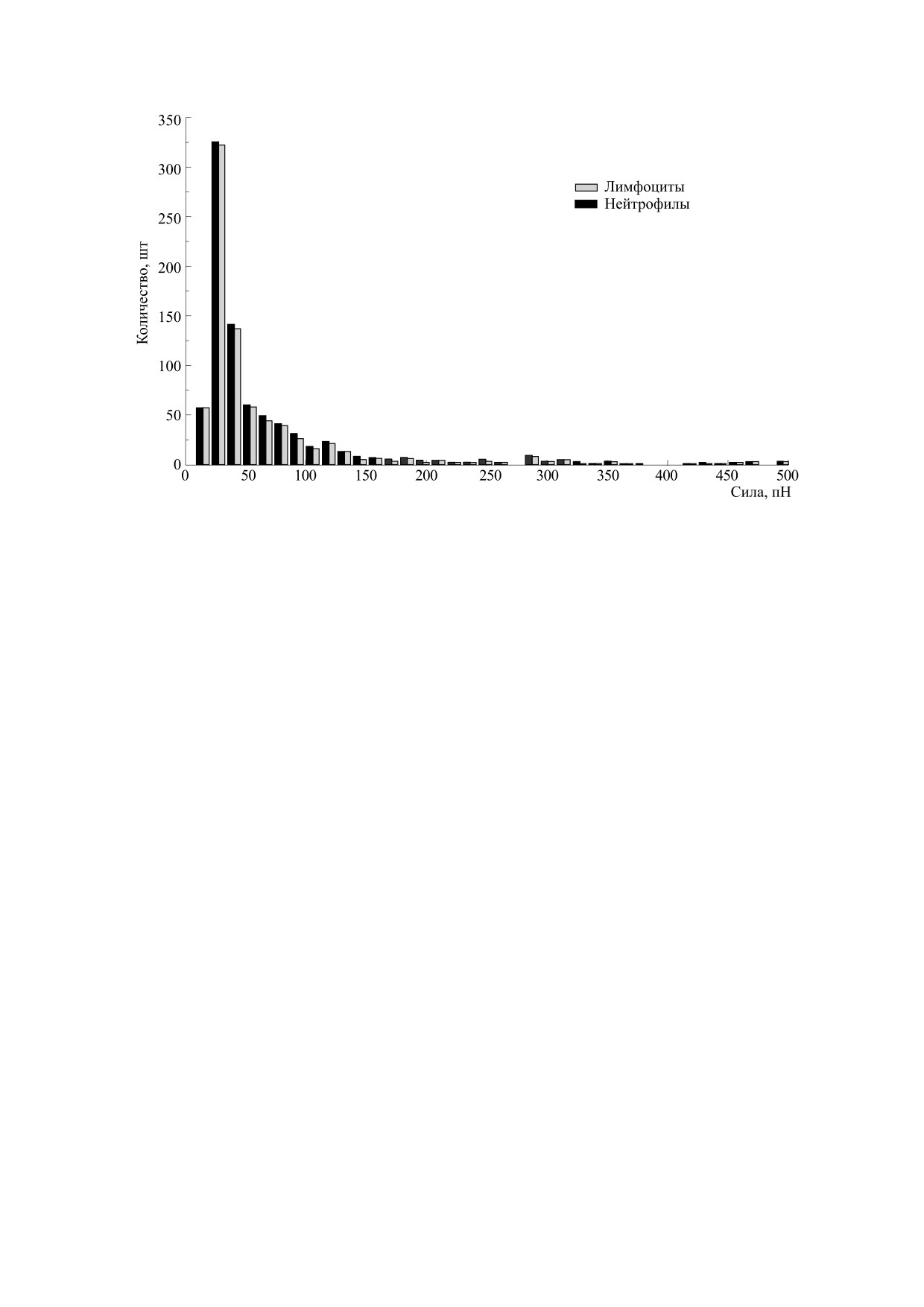
Рис. 5. Распределения сил адгезионных контактов, возникающих между клетками.
нии работы адгезии ≥100 аДж (в случае, описан-
ней. С учетом разного количества рецепторов
ном на рис. 4 она составила ~ 500 аДж).
каждого класса (интегрины, селектины и так да-
лее), экспрессируемых на мембранах, и разной
Анализ серой кривой показывает, что характер
аффинности этих рецепторов, а также учитывая
рецепторного связывания не однороден. На мем-
возможное неспецифическое взаимодействие
бране нейтрофилов экспрессируется большое
между клетками, суммарную силу адгезионных
число рецепторов, принимающих участие в адге-
контактов между клетками можно рассчитать по
зии: E -, Р - и L-селектины, ICAM-1, VCAM-1,
следующей формуле:
CD11a/CD18, CD11b/CD18, αvβ2-интегрины, а на
мембране лимфоцитов - VLA-4 (и ряд других ин-
ΔF
k
=a⋅ f
1
+b⋅ f
2
+∑c
i
⋅ f
i
+C,
тегринов, например, CD103/β7), CD11a/CD18,
i
MAdCAM-1 [14].
где ΔFk - высота k-ступеньки силовой кривой от-
Поэтому каждая ступень может соответство-
вода; а, b, ci - количество рецепторов различных
вать как разрыву единичных рецептор-рецептор-
типов; f1, f2, fi - силы разрыва между рецепторами
ных связей, так и нескольких рецепторных связей
различных типов; С - неспецифическое взаимо-
между клетками. Достоверно определить разрыв
действие.
единичного рецептор-рецепторного взаимодей-
Нужно учитывать и тот факт, что характер рас-
ствия в данной системе невозможно, поскольку
пределения рецепторов на поверхности неодно-
всегда будет существовать вероятность разрыва
роден, поскольку они могут располагаться как
нескольких связей в интервал времени меньший,
поодиночке, так и формировать «рецепторные
чем возможно разрешить аппаратно. Для оценки
поля» как, например, наблюдается в иммуноло-
работы адгезии в системе молекулярных связей
гических синапсах. Формирование рецепторных
на уровне единичных рецепторов необходимо ис-
полей происходит на основе рафтов - особых
пользовать другую систему: зонд, функционали-
мембранных структур, которые представляют со-
зированный отдельной молекулой, фиксирован-
бой специализированную платформу, контроли-
ной через линкер, и клетку либо единичную мо-
рующую большое количество клеточных функ-
лекулу, фиксированную на подложке [15].
ций [16]. Но и в самих рафтах характер распреде-
Очевидно, что высокие ступени, например
ления рецепторов неоднороден. Различают три
ΔF4, составлены из множества маленьких ступе- основных варианта поведения рецепторов в раф-
БИОФИЗИКА том 65
№ 1
2020
ИССЛЕДОВАНИЕ МЕЖКЛЕТОЧНЫХ АДГЕЗИОННЫХ КОНТАКТОВ
85
тах: 1) рецепторы ассоциируются в устойчивом
ФИНАНСИРОВАНИЕ РАБОТЫ
состоянии с липидными рафтами и могут быть
Работа выполнена при финансовой поддержке
активированы связыванием с лигандами; 2) ин-
Российского научного фонда (проект № 16-14-
дивидуальные рецепторы со слабой аффинно-
10179).
стью к рафтам олигомеризуются лигандным свя-
зыванием, и это приводит к увеличению времени
КОНФЛИКТ ИНТЕРЕСОВ
пребывания в рафте; 3) активированные рецепто-
Авторы заявляют об отсутствии конфликта
ры рекрутируются перекрестно-связывающими
интересов.
протеинами в соседние рафты, и это приводит к
коалесценции платформ [17]. Эти факты делают
оценку рецепторных взаимодействий еще более
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
сложной. Возможно, в том случае, если рецепто-
Исследование было одобрено Комиссией по
ры сконцентрированы в виде рецепторных полей
биоэтике ННГУ им. Н.И. Лобачевского (создана
на рафтах, мы получаем большие ступени
11.11.16 г., приказ о создании № 497-ОД), прото-
>100 пН, а в тех случаях, когда речь идет о более
кол № 9 от 17.07.17 г.
слабых взаимодействиях между рецепторами на
внерафтовой части мембраны величина одиноч-
СПИСОК ЛИТЕРАТУРЫ
ных ступеней уменьшается до 30-60 пН. Нельзя
1.
1. С. Н. Плескова, Атомно-силовая микроскопия в
также полностью исключить возможность олиго-
биологических и медицинских исследованиях
меризации рецепторов, экспрессируемых на
(Издательский дом «Интеллект», Долгопрудный,
мембране клетки, фиксированной на зонде, от
2011).
первичного взаимодействия с клеткой на под-
2.
H. Kim, H. Arakawa, T. Osada, et al., Ultramicroscopy
ложке и рекрутинг рецепторов в рафт после пер-
97 (1-4), 359 (2003).
вичного взаимодействия.
3.
L. A. Chtcheglova, L. Wildling, J. Waschke, et al., J.
Mol. Recognition 23, 589 (2010).
На рис. 5 распределение ограниченно 500 пН,
4.
L. Xiao, Q. Chen, Y. Wu, et al., Biochim. Biophys.
однако при измерениях максимальное регистри-
Acta - Biomembranes 1848 (10), 1988 (2015).
руемое значение составило 2400 пН. Распределе-
5.
M. Benoit, D. Gabriel, G. Gerisch, et al., Nat. Cell
ние сил адгезионных контактов представляет со-
Biol. 2 (6), 313 (2000).
бой ассиметричную кривую с максимумом в рай-
6.
R. H. Eibl and M. Benoit, IEE Proc. Nanobiotechnol.
оне 30-40 пН для обоих типов клеток. Тем не
151 (3), 128 (2004).
менее распределение сил адгезионных контактов
7.
V. S. Rajan, V. M. Laurent, C. Verdier, et al., Biophys.
статистически отличается у нейтрофильных гра-
J. 112, 1246 (2017).
нулоцитов и лимфоцитов, что говорит о различи-
8.
M. C. Dinauer, Blood 133 (20), 2130 (2019).
ях в рецепторных полях этих типов клеток.
9.
S. Gando, T. Kameue, N. Matsuda, et al., Thromb.
Res. J. 116 (2), 91 (2004).
Таким образом, при фиксации одной клетки
10.
M. T. Aguado, N. Pujol, E. Rubiol, et al., J. Immunol.
на поверхности зонда поли-L-лизином и связы-
Methods 32, 41 (1980).
вании другой клетки на поверхности чашки Пет-
11.
E. A. Hassan, W. F. Heinz, M. D. Antonik, et al.,
ри можно получить действенную систему измере-
Biophys. J. 74, 1564 (1998)
ния сил межклеточной адгезии. Поскольку про-
12.
A. A. Bukharaev, A. A. Mozhanova, N. I. Nurgazizov,
исходит постепенное отведение зонда от
et al., Phys. Low-Dim. Struct. 3, 31 (2003).
поверхности клетки, регистрируются все силы
13.
С. Н. Плескова, М. Б. Звонкова и Ю. Ю. Гущина,
Морфология. Архив анатомии, гистологии и
межклеточного взаимодействия от слабых (пред-
эмбриологии 127 (1), 60 (2005).
положительно неспецифических), лежащих в
14.
С. М. Белоцкий и Р. Р. Авталион, Воспаление.
районе 10 пН, до сильных (предположительно,
Мобилизация клеток и клинические эффекты
формируемых обширными рецепторными поля-
(БИНОМ, М., 2008).
ми, из-за которых разорвать контакты при отве-
15.
H. Yang, J. Yu, G. Fu, et al., Exp. Cell Res. 313 (16),
дении зонда труднее), лежащих в диапазоне от 100
3497 (2007).
до 2400 пН. Подавляющее большинство связей
16.
С. Н. Плескова и Е. Е. Пудовкина, Цитология 55
определялось в районе 30-40 пН, что, на наш
(8), 586 (2013).
взгляд, соответствует силе единичных рецептор-
17.
K. Simons and D. Toomre, Nat. Rev. Mol. Cell. Biol. 1
ных взаимодействий.
(1), 31 (2000).
БИОФИЗИКА том 65
№ 1
2020
86
ПЛЕСКОВА и др.
Investigation of the Adhesive Intercellular Contacts between Neutrophil Granulocytes
and Lymphocytes by Atomic Force Microscopy
S.N. Pleskova*, **, R.N. Kriukov*, S.Z. Bobyk*, **, A.V. Boryakov*, and A.A. Brilkina*
*National Research Lobachevsky State University of Nizhny Novgorod,
prosp. Gagarina 23/3, Nizhni Novgorod, 603950 Russia
**Nizhny Novgorod State Technical University named after R.E. Alekseev,
ul. Minina 24/1, Nizhni Novgorod, 603950 Russia
Atomic force microscopy was used to create a system for measuring intercellular adhesion. Scanning electron
microscopy was applied to confirm that poly-L-lysine is the best for fixation of neutrophil granulocytes and
lymphocytes on the tip. It was shown that when one cell is fixed on the tip and the other one on the substrate
surface, it is possible to carry out relevant measurements of intercellular adhesion forces by FS spectroscopy.
Intercellular adhesion forces of neutrophils and lymphocytes were measured. The adhesion forces of neutro-
phils and lymphocytes were: 38.5 ± 13.7 pN and 35.6 ± 8.3 pN, respectively. Thus, adhesion of neutrophils
is statistically significantly higher than adhesion of lymphocytes.
Keywords: intercellular adhesion, atomic force microscopy, FS spectroscopy, neutrophils, lymphocytes, scanning
electron microscopy
БИОФИЗИКА том 65
№ 1
2020