БИОФИЗИКА, 2020, том 65, № 1, с. 87-96
БИОФИЗИКА КЛЕТКИ
УДК 57.085.23
ЭФФЕКТЫ КОМБИНИРОВАННОГО ДЕЙСТВИЯ ДИМЕРНЫХ
БИСБЕНЗИМИДАЗОЛОВ И ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ
НА СТВОЛОВЫЕ КЛЕТКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ЛИНИИ MCF-7
© 2020 г. К.А. Чурюкина*, А.Л. Жузе**, А.А. Иванов**, И.А. Замулаева*
*Медицинский радиологический научный центр им. А.Ф. Цыба - филиал Национального медицинского
исследовательского центра радиологии МЗ РФ, 249036, Обнинск Калужской области, ул. Королева, 4
**Институт молекулярной биологии им. В.А. Энгельгардта РАН, 119991, Москва, ул. Вавилова, 32
E-mail: churiukina@inbox.ru
Поступила в редакцию 16.08.2019 г.
После доработки 25.11.2019 г.
Принята к публикации 29.11.2019 г.
Работа посвящена поиску способов элиминации и/или повышения радиочувствительности попу-
ляции опухолевых стволовых клеток, составляющих радиорезистентную часть злокачественных но-
вообразований. Исследованы эффекты раздельного и комбинированного действия γ-излучения в
дозе 4 Гр и димерных бисбензимидазолов серии DB(n) с количеством групп в метиленовом линкере,
соединяющем два бисбензимидазола (n), равном 5 или 7, на опухолевые стволовые клетки линии
MCF-7 рака молочной железы человека. Показано, что бисбензимидазол DB(5) значимо снижает
относительное и абсолютное количество опухолевых стволовых клеток в 5.8 и 7.5 раза соответствен-
но по сравнению с контролем (p = 0,001 в обоих случаях), а бисбензимидазол DB(7) - в 3.6
(p = 0.003) и 5.2 раза (p = 0.004) соответственно. Облучение приводит к увеличению относительного
и абсолютного количества опухолевых стволовых клеток в 1.7 и 1.6 раза (р < 0.05) соответственно по
сравнению с контролем. При комбинированном воздействии бисбензимидазолов DB(5,7) и облу-
чения происходит значительное снижение относительного количества опухолевых стволовых кле-
ток в 8.2 (р = 0.003) и 4.1 раза (р = 0.004) соответственно по сравнению с раздельным облучением.
Еще более выраженные эффекты обнаружены в отношении абсолютного количества опухолевых
стволовых клеток, которое уменьшалось при комбинированном воздействии в 16.6 и 14.1 раза соот-
ветственно по сравнению с облучением (р = 0.006 в обоих случаях). При комбинированном дей-
ствии бисбензимидазолов DB(5,7) и облучения происходит блокирование радиационно индуциро-
ванной эпителиально-мезенхимальной трансзиции по критерию экспрессии виментина - одного
из основных маркеров этого процесса, играющего важную роль в формировании пула опухолевых
стволовых клеток.
Ключевые слова: опухолевые стволовые клетки, димерные бисбензимидазолы, ионизирующее излучение,
комбинированное воздействие, проточная цитометрия.
DOI: 10.31857/S0006302920010111
ленные механизмы радиорезистентности опухо-
Лучевая терапия широко применяется в кли-
левых клеток, которые могут обеспечить выжива-
нике в качестве одного из основных методов ле-
ние части из них как источника рецидивирования
чения злокачественных новообразований. Не-
смотря на постоянное совершенствование суще-
опухолевого процесса после лучевой терапии,
изучаются уже не один десяток лет и с разных по-
ствующих и внедрение новых методов лучевого
лечения (адронная, бинарная, тканевая, фотоди-
зиций, но в последние годы внимание специали-
намическая терапия и др.), остается нерешенной
стов в области радиационной онкологии привле-
проблема возникновения рецидивов и метастазов
чено к концепции о существовании опухолевых
у части пролеченных больных с полной клиниче-
стволовых клеток (ОСК) [1, 2]. Показано, что
ской регрессией первичного очага. Многочис-
ОСК, обнаруженные in vitro в стабильных и пер-
вичных культурах опухолевых клеток, а также
in vivo в большинстве злокачественных новообра-
Сокращения: ОСК
- опухолевые стволовые клетки,
DB(n) - димерные бисбензимидазолы (dimeric bisbenzim- зований экспериментальных животных и челове-
idazoles, n - число метильных групп в линкере), ЭМТ -
ка, обладают способностью к самообновлению и
эпителиально-мезенхимальная трансзиция, ФИТЦ - флу-
оресцеинизотиоцитат, ФЭ - фикоэритрин .
дифференцировке в гетерогенные линии клеток,
87
88
ЧУРЮКИНА и др.
Рис. 1. Химическая формула димерных бисбензимидазолов DB(n), где n = 1-11.
которые составляют опухоль (в отличие от не-
или изменения их свойств являются сигнальные
стволовых клеток). Кроме того, результаты соб-
пути, активные преимущественно в ОСК, вклю-
ственных исследований и данные литературы до-
чая Hengehog, Notch, Stat, Wnt/β-катенин и дру-
казывают, что ОСК являются более радио- и хи-
гие, транспортеры оттока веществ из клеток, си-
миорезистентными по сравнению с остальной
стемы репарации ДНК, и пути клеточной гибели,
массой опухолевых клеток [3-8].
различные факторы микроокружения опухоли,
поверхностные антигены ОСК (CD44, CD133
Эти обстоятельства, во-первых, дают основа-
и др.) [12, 14, 18-21].
ние предполагать, что именно ОСК определяют
неблагоприятные отдаленные результаты луче-
Недавние исследования продемонстрировали
вой и комбинированной терапии и, во-вторых,
важную роль эпигенетических механизмов, таких
обосновывают необходимость поиска средств,
как метилирование ДНК и модификация гисто-
направленных на элиминацию ОСК и/или повы-
нов, в процессах дифференцировки/дедиффе-
шение их чувствительности к известным проти-
ренцировки опухолевых клеток и поддержании
воопухолевым воздействиям. В этой связи следу-
резистентности ОСК к противоопухолевым воз-
ет отметить, что в последнее время происходит
действиям (в том числе к ионизирующему излу-
стремительный рост количества публикаций, со-
чению) [22, 23]. В связи с этим соединения, спо-
общающих о результатах поиска и разработки та-
собные влиять на ремоделирование хроматина и
ких средств не только на стадии доклинических,
другие эпигенетические изменения, могут пред-
но и клинических испытаний [9-11]. В основе та-
ставлять интерес в плане поиска средств элими-
ких исследований лежат многочисленные данные
нации и/или повышения радиочувствительности
о молекулярно-клеточных особенностях и меха-
ОСК. Российскими химиками из Института мо-
низмах радио- и химиорезистентности ОСК,
лекулярной биологии им. В.А. Энгельгардта РАН
включая более высокую эффективность репара-
были синтезированы оригинальные ДНК-связы-
ции радиационных повреждений ДНК (напри-
вающие соединения - димерные бисбензимида-
мер, за счет активации чекпоинт-киназ CHK1 и
золы (dimeric bisbenzimidazoles - DB(n), которые
CHK2), высокую активность антиоксидантной
содержат в своей структуре два 2,6-замещенных
системы (например, вследствие повышенной
бензимидазола, связанных между собой олигоме-
экспрессии белков, участвующих в утилизации
тиленовым линкером разной длины (n - число
свободных радикалов), быстрое выведение во
метильных групп в линкере, может варьировать
внеклеточную среду многих цитотоксических
от 1 до 11) (рис. 1) [24]. Во внеклеточных модель-
препаратов из ОСК (в результате гиперэкспрес-
ных системах было показано, что эти соединения
сии АТФ-зависимых белковых транспортеров на
эффективно ингибируют ДНК-метилтрансфера-
клеточной мембране) по сравнению с остальны-
зу и ДНК-топоизомеразу I [25, 26]. Кроме того,
ми (нестволовыми) клетками и т. д. [4, 12-15].
некоторые бисбензимидазолы (с n = 5 или 7) ока-
Формирование резистентности ОСК на уровне
зались высокотоксичными для общей массы кле-
организма - еще более сложный процесс, по-
ток рака молочной железы линии MCF-7 по кри-
скольку включает влияние множества сигналь-
териям снижения их количества, жизнеспособ-
ных молекул (например, TGF-b1, FGF, IL-6, HIF,
ности и клоногенной активности в условиях
Wnt-лиганды и так далее), секретируемых не
in vitro [27], однако влияние этих соединений на
только опухолевыми, но и различными стромаль-
ОСК ранее не исследовалось. Поэтому целью
ными клетками, и таких факторов, как концен-
данной работы является выяснение эффектов
трация кислорода и рН внеклеточной среды, вли-
действия бисбензимидазолов DB(5,7) на ОСК ли-
яющих на радиочувствительность [16, 17]. Соот-
нии MCF-7 при раздельном применении и в ком-
ветственно, мишенями средств элиминации ОСК
бинации с ионизирующим излучением. Оценива-
БИОФИЗИКА том 65
№ 1
2020
ЭФФЕКТЫ КОМБИНИРОВАННОГО ДЕЙСТВИЯ
89
ли эффекты действия DB(5,7) на ОСК и осталь-
которых бисбензимидазольные блоки соединены
ные клетки по критериям внутриклеточного
между собой линкером с числом метильных
содержания этих соединений, относительного и
групп (n), равным 5 или 7.
абсолютного количества клеток, сохранивших
Инкубация с изучаемыми соединениями и облу-
жизнеспособность в близкие сроки после воздей-
чение клеток. Через сутки после посева к клеткам
ствия. Кроме того, в работе впервые исследовали
добавляли DB(5) или DB(7) в конечной концен-
влияние указанных соединений на эпителиаль-
трации 20 мкмоль/л, при которой, как ранее было
но-мезенхимальную трансзицию (ЭМТ), кото-
показано [25], происходит выраженное уменьше-
рая, как известно, участвует в формировании пу-
ние общего количества опухолевых клеток. Клет-
ла ОСК, резистентности этих клеток к поврежда-
ки инкубировали с соединениями 24 ч в стандарт-
ющим воздействиям и усиливается под влиянием
ных условиях и затем подвергали воздействию
ионизирующего излучения [28-31]. В частности,
γ-излучения на установке «Рокус-АМ» в дозе 4 Гр
показано, что при облучении в опухолевых клет-
(мощность дозы 1,5 Гр/мин), которая также была
ках активируется транскрипция основных регу-
выбрана ранее для исследования эффектов ком-
ляторов ЭМТ (Snail, ZEB-1, STAT3, HIF-1b и др.),
бинированного действия DB(n) на общую попу-
которые, в свою очередь запускают сигнальные
ляцию клеток MCF-7 [25]. Далее клетки помеща-
пути, в том числе TGF-β, WNT, p38 MAPK и дру-
ли в стандартные условия культивирования в
гие, способствующие приобретению выжившими
CO2-инкубатор на двое суток.
после облучения опухолевыми клетками феноти-
па ЭМТ и ОСК [29]. Поэтому, учитывая важную
Определение количества CD44+СD24-/low-ОСК.
роль ЭМТ в радиационном ответе опухолевых
Выбор маркеров для идентификации ОСК рака мо-
клеток эпителиального происхождения и прини-
лочной железы в нашей работе был сделан на основе
мая во внимание известные данные о значении
литературных данных. Как известно, рак молочной
метилирования ДНК для ЭМТ, мы предположи-
железы был первой солидной опухолью, в которой
ли, что DB(n), способные ингибировать актив-
установлено наличие ОСК [32]. Авторы этого иссле-
ность ДНК-метилтрансферазы, могут влиять на
дования идентифицировали ОСК по экспрессии
ЭМТ и таким образом изменять размер пула
CD44 при отсутствии или низкой экспрессии CD24
ОСК. Для проверки этого предположения была
на поверхности этих клеток с помощью соответ-
исследована экспрессия виментина (белка про-
ствующих антител. По настоящее время этот имму-
межуточных филаментов цитоскелета, являюще-
нофенотип (CD44+CD24-/low) наиболее часто ис-
гося одним из основных маркеров ЭМТ) после
пользуется в различных исследованиях для выявле-
раздельного или комбинированного действия
ния ОСК рака молочной железы, в том числе в
DB(5,7) и ионизирующего излучения.
стабильной культуре линии MCF-7. Учитывая мно-
гочисленные доказательства принадлежности
МАТЕРИАЛЫ И МЕТОДЫ
CD44+CD24-/low-клеток к популяции ОСК рака
Культивирование клеток. Клетки аденокарци-
молочной железы, именно этот иммунофенотип
номы молочной железы человека линии MCF-7
был выбран нами для выявления ОСК.
культивировали во флаконах площадью 25 см2
Клетки извлекали из флаконов в холодный
(Corning, США) в среде DMEM («ПанЭко», Рос-
раствор Хэнкса и инкубировали со смесью моно-
сия) c добавлением 10% сыворотки крупного ро-
клональных антител к CD44, меченных флуорес-
гатого скота (Biosera, Франция), пенициллина
цеинизотиоцитатом (ФИТЦ) (BD Biosciences,
(50000 ед/л), стрептомицина (50 мг/л) и глютами-
США), и антител к CD24, меченных фикоэритри-
на (292 мг/л) в СО2-инкубаторе (NuAire, США)
ном (ФЭ) (BD Biosciences, США), из расчета по
при 37°С в увлажненной атмосфере, содержащей
20 мкл антител на 1 млн клеток. Для контроля не-
5% СО2. Клетки рассевали два раза в неделю, сни-
специфического связывания использовали моно-
мая с подложки с помощью раствора версена и
клональные антитела соответствующих изотипов
трипсина (ПанЭко, РФ).
к гемоцианину улитки, конъюгированные с теми
же флуорохромами, что и антитела к указанным
Исследуемые химические соединения. Димер-
поверхностным маркерам (BD Biosciences,
ные бисбензимидазолы DB(n) синтезированы в
США).
Институте молекулярной биологии им. В.А. Эн-
гельгардта РАН по методике, подробно описан-
Пробы инкубировали с антителами 30 мин на
ной в работе [24]. Они представляют собой низ-
льду в темноте, затем отмывали в 0,01 моль/л фос-
комолекулярные флуоресцентные соединения,
фатно-солевом буферном растворе (PBS, pH 7.2) и
нековалентно связывающиеся с А-Т-парами в
анализировали на проточном цитофлуориметре
узкой бороздке ДНК. Из всей линейки DB(n) в
FACS Vantage (BD Biosciences, США). Для измере-
данной работе использовали два соединения, в
ния флуоресценции ФИТЦ использовали узкопо-
БИОФИЗИКА том 65
№ 1
2020
90
ЧУРЮКИНА и др.
лосные фильтры 530/30 нм, для ФЭ - 585/42 нм.
20°С. Перед окрашиванием клетки трехкратно от-
Полученные данные об интенсивности прямого и
мывали в фосфатно-солевом буферном растворе
бокового светорассеяния, флуоресценции ФИТЦ и
c 1% бычьего сывороточного альбумина, после
ФЭ записывали в файл, который обрабатывали с по-
чего инкубировали с моноклональными антите-
мощью программы CellQuestPro (BD Biosciences,
лами к виментину, меченными ФЭ, в течение 1 ч
США). Определяли относительное количество ОСК
при комнатной температуре в соотношении 5 мкл
антител/250 тыс. клеток. Для контроля неспеци-
(в %) с иммунофенотипом CD44+СD24-/low среди
фического связывания использовали монокло-
неповрежденных клеток, выделенных по парамет-
нальные антитела того же изотипа к гемоцианину
рам прямого и бокового светорассеяния по обще-
улитки, конъюгированные с ФЭ. После инкуба-
принятой методике. Абсолютное количество
ции клетки отмывали от несвязавшихся антител
CD44+СD24-/low-ОСК определяли путем умноже-
фосфатно-солевым буферным раствором и не-
ния доли этих клеток на общее количество клеток во
медленно анализировали с помощью проточного
флаконе, определенное с помощью камеры Горяева.
цитофлуориметра FACS Calibur (BD Biosciences,
Оценка внутриклеточного содержания бисбен-
США) по показателям интенсивности светорас-
зимидазолов DB(5,7) в стволовых и нестволовых
сеяния и флуоресценции ФЭ. C помощью про-
опухолевых клетках. Благодаря тому, что ком-
граммы CellQuestPro определяли среднюю ин-
плекс DB(n)-ДНК обладает достаточно высокой
тенсивность флуоресценции ФЭ в клетках после
флуоресценцией [33] в рабочем диапазоне совре-
исключения дебриса по показателям светорассе-
менных проточных цитофлуориметров, осна-
яния.
щенных ультрафиолетовым лазером, существует
В следующей серии экспериментов изучали
возможность анализа внутриклеточного содержа-
влияние DB(5,7) и облучения на экспрессию ви-
ния этих соединений с помощью метода проточ-
ментина. Использовали те же условия комбини-
ной цитометрии. Для оценки внутриклеточного
рованного воздействия, что при исследовании
содержания DB(5,7) отдельно в ОСК и в осталь-
количественных изменений пула ОСК, т. е. кон-
ных (нестволовых) клетках общую культуру инку-
центрация соединений составляла 20 мкмоль/л,
бировали с соединениями в концентрации
доза облучения - 4 Гр, а время после облучения
20 мкМ в течение 72 ч, окрашивали с помощью
(48 ч) было выбрано по результатам описанных
антител к CD44-ФИТЦ и CD24-ФЭ, как описано
выше предварительных экспериментов. Методи-
выше, затем выполняли исследование с помощью
ка подготовки проб к проточноцитометрическо-
проточного цитометра FACS Vantage, оснащен-
му анализу в экспериментах по комбинированно-
ного двумя лазерами с длинами волн 488 нм и
му действию DB(n) и облучения не отличалась от
365 нм. Для измерения флуоресценции ФИТЦ и
вышеописанной методики, использованной в
ФЭ использовали стандартные светофильтры
предварительных экспериментах по изучению
530/30 нм и 585/42 нм соответственно (при
временной зависимости экспрессии виментина
λвозб = 488 нм). Интенсивность флуоресценции
после облучения.
DB(5,7) оценивали в диапазоне 424/44нм (при
Статистическая обработка результатов. Стати-
λвозб= 365 нм). Данные о флуоресценции ФИТЦа,
стическую обработку результатов проводили по
ФЭ и DB(5,7) записывали в файл. При последую-
критерию Манна-Уитни с помощью программы
щей обработке данных с помощью программы
Statistica 6.0 (StatSoft Inc., США). Для построения
CellQuestPro выделяли регион CD44+СD24-/low-
графиков использовали программу Origin 6.0 (Mi-
клеток, после чего анализировали интенсивность
crocal Software, Inc., США). Все эксперименты
флуоресценции DB(5) или DB(7) в этом регионе и
выполнены не менее чем в трех повторах. Полу-
в остальных клетках отдельно.
ченные результаты объединяли. Различия счита-
Определение экспрессии виментина после ком-
ли значимыми при р < 0.05.
бинированного
действия
бисбензимидазолов
DB(5,7) и облучения. В предварительной серии
РЕЗУЛЬТАТЫ
экспериментов изучали экспрессию виментина в
различные сроки после облучения в дозе 4 Гр.
Внутриклеточное содержание бисбензимидазо-
Экспрессию указанного белка определяли через
лов DB(5) и DB(7) в ОСК и остальных клетках.
24, 48, 72 и 96 ч после радиационного воздействия
Внутриклеточное содержание DB(5) и DB(7) оце-
с помощью проточной цитометрии после имму-
нивали в сравниваемых популяциях опухолевых
ноцитохимического окрашивания соответствую-
клеток через 72 ч инкубации с соединениями. В
щими антителами. Для этого клетки снимали со
течение этого времени могли происходить как на-
дна культуральных флаконов, из каждого флако-
копление, так и откачивание соединений из жи-
на отбирали аликвоты по 250 тыс. клеток, далее
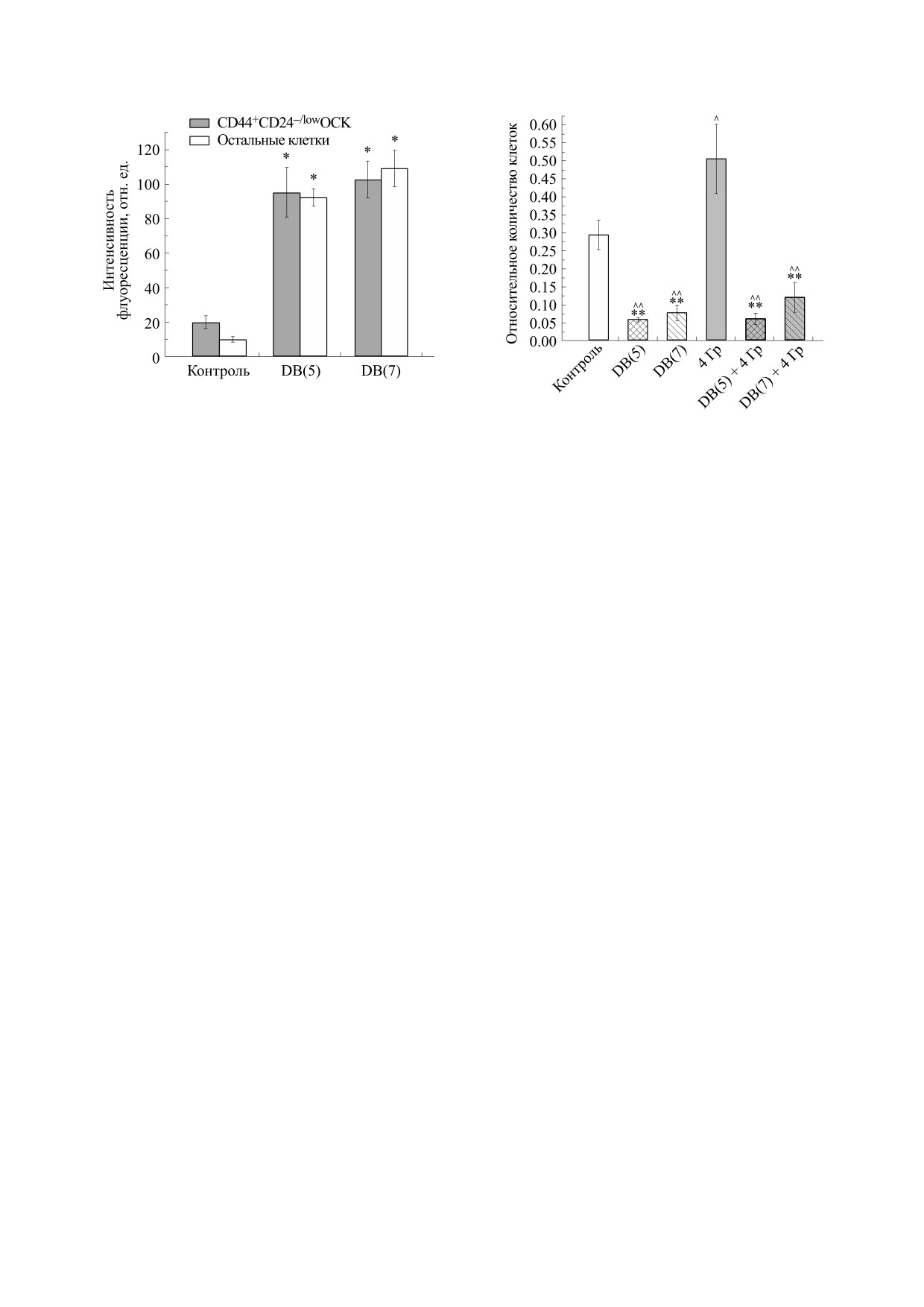
вых клеток. Как показано на рис. 2, интенсив-
клетки фиксировали и хранили в ацетоне при -
ность флуоресценции как DB(5), так и DB(7) в
БИОФИЗИКА том 65
№ 1
2020
ЭФФЕКТЫ КОМБИНИРОВАННОГО ДЕЙСТВИЯ
91
Рис.
2. Средняя интенсивность флуоресценции
опухолевых стволовых и нестволовых клеток линии
MCF-7, инкубированных с DB(5,7), по данным
Рис.
3. Изменение относительного количества
витального исследования с помощью проточной
CD44+СD24-/low ОСК после раздельного и комбини-
цитофлуориметрии; * - р < 0.001 при сравнении с
рованного действия DB(5,7) и γ-излучения в дозе
интенсивностью контрольной аутофлуоресценции.
4 Гр. Клетки облучали через 24 ч после добавления
соединений, количество ОСК определяли через 48 ч
после облучения. Обозначения: ** - p ≤ 0.004 при
ОСК и остальных клетках была примерно одина-
сравнении с облучением, ^ - p < 0.05 при сравнении
с контролем,
^^- p ≤ 0.006 при сравнении с кон-
кова, но значительно выше контрольной авто-
тролем.
флуоресценции (p < 0,001). Эти данные указыва-
ют на то, что исследуемые соединения способны
проникать в живые клетки и сохраняться в них в
CD44+СD24-/low клеток в 4.8 раза по сравнению с
течение длительного времени. При этом важно
контролем: средняя доля ОСК (± SE) в контроле
отметить, что содержание DB(5,7) в ОСК и
составляет 0.29 ± 0.04%, доля этих клеток в груп-
остальных клетках не отличается, хотя известно,
пе «DB(5) + облучение» - 0.06 ± 0.01% (р = 0.002).
что ОСК способны более эффективно откачивать
DB(7) в комбинации с ионизирующим излучени-
во внеклеточную среду многие химические со-
ем снижает долю ОСК в меньшей степени - до
единения, включая традиционные химиопрепа-
0.12 ± 0.04%, т.е. в 2.4 раза по сравнению с кон-
раты. В дальнейшем представляет интерес иссле-
тролем (р = 0.006). Важно, что DB(5,7) в комбина-
довать отдельно процессы накопления и выведе-
ции с ионизирующим излучением еще сильнее
ния DB(n) из клеток изучаемых популяций.
уменьшают относительное количество ОСК по
сравнению с раздельным облучением - в 8.2 и
Изменение относительного и абсолютного количе-
4.1 раза (р = 0.003 и р = 0.004) соответственно - и
ства опухолевых стволовых клеток CD44+СD24-/low
тем самым нивелируют стимулирующее влияние
после комбинированного действия бисбензимидазо-
облучения на количество CD44+СD24-/low ОСК.
лов DB(5) или DB(7) и γ-излучения. Эффекты раз-
дельного и комбинированного действия изучае-
Интересно, что и одиночное действие DB(5,7)
мых соединений и γ-излучения оценивали через
также значимо снижает относительное количе-
48 ч после облучения по изменению количества
ство ОСК по сравнению с интактным контролем
в 5.8 и 3.6 раза соответственно: средняя доля ОСК
клеток с иммунофенотипом CD44+СD24-/low.
в группе
«DB(5)» составляет
0.05
± 0.01%
Установлено, что облучение клеток линии
(p = 0.001), в группе «DB(7)» - 0.08 ± 0.02%
(р = 0.003).
MCF-7 приводит к увеличению относительного
количества CD44+СD24-/low ОСК в 1.7 раза по
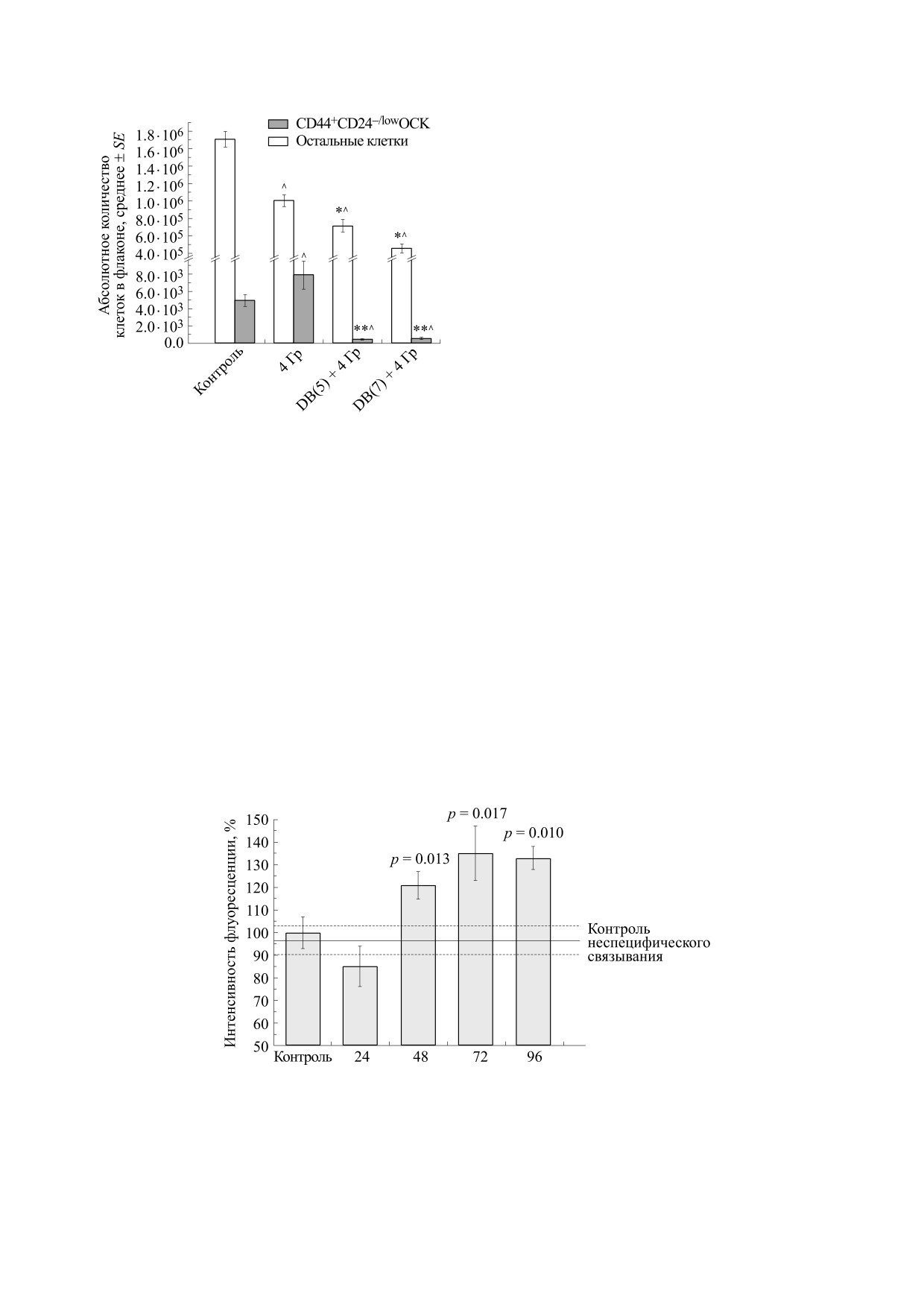
На рис. 4 представлены данные об изменении
сравнению с контролем (рис. 3). Предваритель-
абсолютного количества клеток CD44+СD24-/low
ная инкубация с DB(5,7) перед облучением зна-
после раздельного и комбинированного действия
чительно снижает этот показатель как по сравне-
изучаемых соединений и γ-излучения. Показано,
нию с раздельным действием облучения, так и по
что облучение приводит к росту абсолютного ко-
сравнению с интактным контролем. Так, показа-
личества ОСК в 1.6 раза по сравнению с контро-
но, что DB(5) в комбинации с ионизирующем из-
лем, в то время как общее количество клеток, на-
лучением уменьшает относительное количество
против, уменьшается в 1.7 раз. Установлено, что в
БИОФИЗИКА том 65
№ 1
2020
92
ЧУРЮКИНА и др.
а DB(7) - в 8.9 раза по сравнению с контролем
(р = 0.004) и в 14.1 раза по сравнению с облучени-
ем (р = 0.006). При этом количество остальных
клеток, составляющих подавляющее большин-
ство, тоже уменьшается после комбинированного
действия исследуемых соединений и облучения,
но в меньшей степени - в 2.4 и 3.8 раза соответ-
ственно по сравнению с контролем (р = 0.004 в
обоих случаях) и в 1.4 и 2.2 раза соответственно по
сравнению с облучением (р < 0.05).
Раздельное действие DB(5,7) также приво-
дит к снижению абсолютного количества кле-
ток CD44+СD24-/low по сравнению с интакт-
ным контролем в 7.5 и 5.2 раза (р = 0.001 и
p=0.004) соответственно. При этом абсолют-
ное количество остальных клеток уменьшается
лишь в 1.8 и 3.3 раза (р = 0,001 и p = 0,003) (дан-
ные не показаны).
Рис.
4.
Изменение абсолютного количества
Изменение экспрессии виментина после раз-
CD44+СD24-/low ОСК и остальных опухолевых кле-
дельного и комбинированного действия бисбензи-
ток после раздельного и комбинированного действия
мидазолов DB(5,7) и ионизирующего излучения.
DB(5) или DB(7) и облучения в дозе 4 Гр. Клетки об-
Как показано с помощью проточной цитомет-
лучали через 24 ч после добавления соединений, ко-
личество ОСК определяли через 48 ч после облуче-
рии, интактные клетки рака молочной железы
ния. Обозначения: *- p < 0.05 при сравнении с облу-
линии MCF-7 в общей массе не экспрессируют
чением, ** - p < 0.006 при сравнении с облучением,
виментин, так как средняя интенсивность флуо-
^ - p ≤ 0.004 при сравнении с контролем.
ресценции клеток, обработанных антителами к
этому белку, не отличается от таковой после ин-
кубации с контрольными иммуноглобулинами
комбинации с ионизирующим излучением как
того же изотипа (рис. 5). Однако через 48-96 ч по-
DB(5), так и DB(7) значимо снижают абсолютное
сле облучения в дозе 4 Гр обнаружено специфиче-
количество клеток CD44+СD24-/low по сравне-
ское связывание антител к виментину, что свиде-
нию с раздельным облучением и контролем. Так,
тельствует об индукции ЭМТ под влиянием γ-из-
в комбинации с облучением DB(5) приводит к
лучения. Таким образом, было установлено, что
снижению абсолютного количества ОСК в
через 48 ч после облучения можно зарегистриро-
10.4 раза по сравнению с контролем (р = 0.004) и
вать не только описанное выше увеличение пула
в 16.6 раза по сравнению с облучением (р = 0.006),
ОСК, но и радиационно-индуцированный про-
Рис. 5. Уровень экспрессии виментина в различные сроки после облучения клеток линии MCF-7 в дозе 4 Гр. По оси
ординат - средняя интенсивность флуоресценции с антителами к виментину в процентах от контроля (без облуче-
ния). Указана величина р при сравнении с контролем неспецифического связывания, среднее значение которого по-
казано сплошной горизонтальной линией, величины SE - пунктирными линиями .
БИОФИЗИКА том 65
№ 1
2020
ЭФФЕКТЫ КОМБИНИРОВАННОГО ДЕЙСТВИЯ
93
Рис. 6. Интенсивность связывания клеток линии MCF-7 с антителами к виментину после раздельного и
комбинированного действия DB(5) или DB(7) и облучения в дозе 4Гр. Через 24 ч после добавления соединений клетки
облучали, через
48 ч после облучения выполняли фиксацию клеток для последующего окрашивания и
проточноцитометрического анализа. Сплошная горизонтальная линия показывает среднюю интенсивность
флуоресценции клеток после обработки контрольными иммуноглобулинами (изотипический контроль
неспецифического связывания), пунктирные линии отмечают стандартную ошибку (± SE) средней интенсивности
флуоресценции в контроле неспецифического связывания; * - p = 0.03 при сравнении с интактным контролем,
^ p = 0.003 при сравнении с контролем неспецифического связывания .
цесс ЭМТ. Поэтому эта временная точка была
холевого и радиомодифицирующего действия
выбрана для дальнейшего исследования комби-
на ОСК.
нированного действия DB(5,7) и ионизирующего
В данном исследовании показано, что раздель-
излучения на ЭМТ по критерию белковой экс-
ное облучение приводит к росту доли ОСК, выде-
прессии виментина. Интересно отметить, что в
исследуемой клеточной культуре через 24 ч после
ленных по иммунофенотипу CD44+СD24-/low.
облучения экспрессия виментина еще не обнару-
Эти данные подтверждают более высокую рези-
живается, как не удается выявить на этом сроке
стентность ОСК к действию редкоионизирующе-
и повышения количества ОСК (данные не пока-
го излучения (по сравнению с основной массой
заны).
опухолевых клеток) и согласуются с результатами
многочисленных исследований, в которых ис-
Инкубация клеток с DB(5,7) перед облучением
пользовались различные подходы к идентифика-
и в течение 48 ч после него блокирует радиацион-
ции ОСК рака молочной железы как в экспери-
ную ЭМТ (рис. 6), одновременно снижая размер
ментальных, так и в клинических условиях [4, 5,
пула ОСК до уровня ниже, чем в контроле.
7, 14, 35-37].
В последнее время помимо механизмов высо-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
кой радиорезистентности ОСК, приводящих к
сохранению их жизнеспособности и пролифера-
Известно, что одним из важных свойств ОСК
ции после облучения, обсуждается еще один ме-
является высокая интенсивность откачивания во
ханизм увеличения количества ОСК после воз-
внеклеточную среду многих химических соедине-
действия редкоионизирующего излучения
-
ний, включая противоопухолевые препараты,
перепрограммирование дифференцированных
благодаря высокой экспрессии соответствующих
опухолевых клеток, выживших после облучения,
AТФ-связывающих транспортеров на клеточной
в опухолевые стволовые клетки [14, 36]. Процесс
мембране [34]. Нами показано, что внутрикле-
дедифференцировки может объяснить увеличе-
точное содержание DB(n), где n = 5 или 7, при-
ние не только относительного, но и абсолютного
мерно одинаково в ОСК и остальных клетках в
количества ОСК после радиационного воздей-
отличие от многих известных химиопрепаратов.
ствия - эффект, который наблюдался нами в дан-
Эта базовая информация позволяет использовать
ном исследовании при выявлении ОСК по иму-
данные соединения для изучения их противоопу-
нофенотипу и ранее при использовании другого
БИОФИЗИКА том 65
№ 1
2020
94
ЧУРЮКИНА и др.
метода идентификации этих клеток по интенсив-
по сравнению с таковым при облучении, но и по
ному откачиванию флуоресцентного красителя
сравнению с интактным контролем. Можно
Хехста 33342 [7, 38]. Очевидно, такая дедиффе-
предположить, что в этом случае эффекты дей-
ренцировка является достаточно редким событи-
ствия изучаемых соединений обусловлены инги-
ем в интактных опухолях/клеточных культурах,
бированием спонтанной ЭМТ, которая происхо-
но может происходить чаще под влиянием раз-
дит редко и затрагивает малое число опухолевых
личных факторов, включая ионизирующее излу-
клеток, вызывая их дедифференцировку в ОСК,
чение. Механизмы этого явления изучались в по-
составляющих в контроле лишь 0.29%. Вполне
следние годы во многих лабораториях мира, в ре-
объяснимо, что в интактной культуре MCF-7 не
зультате чего была выяснена роль ЭМТ в
удается зарегистрировать ЭМТ в общей клеточ-
поддержании и даже увеличении пула ОСК после
ной массе, поскольку этот процесс происходит
облучения путем дедифференцировки нестволо-
только в небольшой части клеток, составляющих
доли процента от общей популяции. Для подтвер-
вых клеток [29, 36, 39]. Как хорошо известно, ра-
ждения этого предположения о способности
диационное воздействие способно индуцировать
DB(5,7) влиять на спонтанную ЭМТ необходимы
ЭМТ опухолевых клеток эпителиального проис-
дальнейшие исследования экспрессии генов и
хождения [29-31], что было подтверждено в дан-
белковых продуктов, контролирующих этот про-
ной работе на примере рака молочной железы ли-
цесс, в отсортированных ОСК.
нии MCF-7 и показано, что повышение белковой
экспрессии виментина (одного из основных мар-
В целом полученные результаты согласуются с
керов ЭМТ) можно зарегистрировать через 48 ч
рядом экспериментальных исследований, в кото-
после облучения и в более отдаленные сроки, ис-
рых показано, что ингибиторы ДНК-метилиро-
следованные в работе (до 96 ч).
вания повышают эффективность радиационного
воздействия на опухолевые клетки как в условиях
В настоящее время накапливаются данные о
in vitro, так и in vivo [45, 47]. При этом существенно
возможности ингибирования ЭМТ с помощью
снижается экспрессия генов, контролирующих
различных средств, среди которых достаточно
поддержание ОСК в состоянии дедифференци-
эффективными оказались разнообразные моди-
ровки, как показано на примере рака поджелу-
фикаторы структуры хроматина [40-42]. В экспе-
дочной железы [47].
риментах с клеточными культурами показано,
что блокаторы ЭМТ снижают количество ОСК,
поэтому их использование считается очень пер-
ЗАКЛЮЧЕНИЕ
спективным в сочетании с традиционными про-
тивоопухолевыми воздействиями [43, 44].
Таким образом, внутриклеточное содержание
синтетических DB(n), где n = 5 или 7, оказалось
Следует отметить, что в процесс перепрограм-
одинаковым в опухолевых стволовых и нестволо-
мирования вовлечены эпигенетические механиз-
вых клетках. Оба соединения способны нивели-
мы, в том числе изменение метилирования ДНК
ровать стимулирующее действие γ-излучения на
[45]. Показано, что метилирование ДНК играет
популяцию ОСК, заключающееся в повышении
непосредственную роль в клеточной миграции,
относительного и абсолютного количества этих
инвазии, метастазировании и ЭМТ опухолевых
клеток. При комбинированном действии DB(5,7)
клеток, а также является важным регуляторным
и облучения происходит блокирование радиаци-
механизмом для поддержания ключевых характе-
онно индуцируемого процесса ЭМТ и значитель-
ристик ОСК [22, 23, 46]. Логично было предполо-
ное уменьшение пула ОСК по сравнению не
жить, что DB(n), которые обладают ингибирую-
только с облучением, но и с интактным контро-
щей активностью в отношении ДНК-метил-
лем. Возможным механизмом действия изучен-
трансферазы, способны влиять на размер пула и
ных соединений на ОСК является ингибирование
свойства ОСК путем блокирования ЭМТ. И дей-
ДНК-метилирования ряда генов, контролирую-
ствительно, при совместном применении DB(n)
щих дедифференцировку опухолевых клеток и
(где n = 5 или 7) и ионизирующего излучения по-
свойства ОСК, что требует дальнейшего изуче-
казано отсутствие экспрессии виментина (одного
ния.
из основных маркеров ЭМТ), что свидетельствует
о блокировании радиационно индуцированного
процесса ЭМТ. Важно, что при этом, как и ожи-
ФИНАНСИРОВАНИЕ РАБОТЫ
далось, происходило снижение относительного и
абсолютного количества ОСК. Интересно, что
Исследование выполнено при финансовой
сама по себе инкубация клеток с DB(5,7) приво-
поддержке Российского научного фонда (проект
дила к уменьшению количества ОСК не только
№ 18-75-10025).
БИОФИЗИКА том 65
№ 1
2020
ЭФФЕКТЫ КОМБИНИРОВАННОГО ДЕЙСТВИЯ
95
КОНФЛИКТ ИНТЕРЕСОВ
24.
А. А. Иванов, В. И. Салянов, С. А. Стрельцов и др.,
Биоорган. химия 37 (4), 530 (2011).
Авторы заявляют об отсутствии конфликта
интересов.
25.
N. A. Cherepanova, A. A. Ivanov, D. V. Maltseva, et al.,
J. Enzyme Inhib. Med. Chem. 26, 295 (2011).
26.
О. Ю. Сусова, А. А. Иванов, С. С. Моралес Руис
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
и др., Биохимия 75 (6), 781 (2010).
Настоящая работа не содержит описания ка-
27.
К. А. Чурюкина, И. А. Замулаева, А. А. Иванов и
ких-либо исследований с использованием людей
др., Радиац. биология. Радиоэкология 57 (2), 136
и животных в качестве объектов.
(2017).
28.
N. Loret, H. Denys, P. Tummeres, et al., Cancers 11
СПИСОК ЛИТЕРАТУРЫ
(6), 838 (2019). DOI: 10.3390/cancers11060838.
1. R. P. Coppes and A. Dubrovska, Clin. Oncol. 29, 329
29.
S. Y. Lee, E. K. Jeong, M. K. Ju, et al., Mol. Cancer 16
(2017).
(1), Article No 10 (2017). DOI: 10.1186/s12943-016-
2. C. Peitzch, I. Kurth, N. Ebert, et al., Int. J. Radiat.
0577-4.
Biol. 95, 1 (2019).
30.
H.-R. Park, S.-K. Jo, and U. Jung, In Vivo 33 (6), 1773
3. P. Zhu and Z. Fan, Biophys. Rep. 4 (4), 178 (2018).
(2019).
4. N. K. Lytle, A. G. Barber, and T. Reya, Nat. Rev. 18,
31.
J. Lu, Y. Zhong, J. Chen, et al., Cell Physiol. Biochem.
669 (2018).
50, 721 (2018).
5. E. Battle and H. Clevers, Nat. Med. 23 (8), 1124 (2017).
6. О. Н. Матчук, И. А. Замулаева, Е. И. Селиванова
32.
M. Al-Hajj, M. S. Wicha, A. Benito-Hernandez, et al.,
и др. Радиац. биология. Радиоэкология 52 (3), 261
Proc. Natl. Acad. Sci. USA 100 (7), 3983 (2003).
(2012).
33.
К. В. Попов, Е. И. Егорова, А. А. Иванов и др.,
7. О. Н. Матчук и А. С. Саенко, Радиация и риск 22
Биол. мембраны 25 (3), 173 (2008).
(2), 67 (2013).
34.
R.-R. Begicevic and M. Falasca, Int. J. Mol. Sci. 18
8. О. Н. Матчук и И. А. Замулаева, Радиация и риск
(11), 2362 (2017). DOI: 10.3390/ijms18112362.
28 (2), 112 (2019).
35.
M. Krause, A. Dubrovska, A. Linge, et al., Adv. Drug
9. J. Kaiser, Science 347, 226 (2015).
Delivery Rev. 109, 63 (2017).
10. M. Ahmed, K. Chaudhari, R. Babaeli-Jadidi, et al.,
Stem Cells 35, 839 (2017).
36.
F. Li, K. Zhou, B. Zhang, et al., Oncol. Lett. 12, 3059
11. A. Desai, Y. Yan, and L. S. Gerson, Stem Cells Trans-
(2016).
lational Medicine 8 (1), 75 (2019).
37.
И. А. Замулаева, О. Н. Матчук, Е. И. Селиванова
12. Y. J. Kim, E. L. Siengler, N. Siriwon, and P. Wang, J.
и др., Радиац. биология. Радиоэкология 54 (3), 256
Cancer Metastasis and Treatment 2, 233 (2016).
(2014).
13. M. Diehn, R. W. Cho, N. A. Lobo, et al., Nature 458
38.
О. Н. Матчук, Н. В. Орлова и И. А. Замулаева,
(7239), 780 (2009).
Радиац. биология. Радиоэкология.
56
(5),
487
14. C. Lagadec, E. Vlashi, L. D. Donna, et al., Stem Cells
(2016).
30, 833 (2012).
39.
H.-C. Chi, C.-Y. Tsai, M.-M. Tsai, et al., Int. J. Mol.
15. C.-H. Chang, M. Zang, K. Rajapaksha, et al., Stem
Sci. 18 (9), 1903 (2017). DOI: 10.3390/ijms18091903.
Cell Reports 5, 378 (2015).
16. S. Skvortsov, I. I. Skvortsova, D. G. Tang, and
40.
T. Boulding, R. D. McCuaig, A. Tan, et al., Sci. Rep. 8,
A. Dubrovska, Stem Cells 36 (10), 1457 (2018).
Article No 73 (2018). DOI: 10.1038/s41598-017-17913-x.
17. V. Plaks, N. Kong, and Z. Werb, Cell Stem Cell 16 (3),
41.
S. Ambrosio, C. D. Sacca, and B. Majello, Biochim.
225 (2015).
Biophys. Acta - Gene Regulatory Mechanisms 1860,
18. Y. Pan, S. Ma, K. Cao, et al., J. Cancer Research and
905 (2017).
Therapeutic 14, 1469 (2018).
42.
A. Kanamoto, I. Ninomiya, S. Harada, et al., Int. J.
19. J. D. Kuhlmann, L. Hein, I. Kurth, et al., Anti-Cancer
Oncol. 49, 1858 (2016).
Agents in Medical Chemistry 16, 38 (2016).
20. T. Nunes, D. Hamdan, C. Leboeuf, et al., Int. J. Mol.
43.
M. Garg, World J. Stem Cells 9 (8), 118 (2017).
Sci. 19 (12). DOI: 10.3390/ijms19124036 1 (2018).
44. S. Kotiyal and S. Bhattacharya, Biochem. Biophys.
21. L. Phi, I. Sari, Y.-G. Yang, et al., Stem Cells Int. 2018,
Res. Commun. 453, 112 (2014).
Article ID
5416923
(2018).
DOI:
10.1155/
45.
R. I. Miousse, R. K. Kutanzi, and I. Koturbash, Int. J.
2018/5416923.
Radiat. Biol. 93, 457 (2017).
22. E. N. Wainwright and P. Scaffidi, Trends in Cancer 3
46.
M. W. Luczak and P. P. Jagodzinski, Folia Histochem.
(5), 372 (2017).
Cytobiol. 44 (3), 143 (2006).
23. T. B. Toh, J. J. Lim, and E. K.-H. Chow, Mol. Cancer
16 (1), Article No 79 (2017). DOI: 10.1186/s12943-017-
47.
H.-M. Kwon, E.-J. Kang, K. Kang, et al., Oncotarget 8
0596-9.
(51), 89005 (2017).
БИОФИЗИКА том 65
№ 1
2020
96
ЧУРЮКИНА и др.
Outcomes of the Combined Effects of Dimeric Bisbenzimidazoles and Exposure
to Ionizing Radiation on MCF-7 Breast Cancer Stem Cells
K.A. Churyukina*, A.L. Zhuze**, A.A. Ivanov**, and I.A. Zamulaeva*
*A. Tsyb Medical Radiological Research Center - Branch of the National Medical Research Radiological Center of the Ministry
of Health of the Russian Federation, ul. Koroleva 4, Obninsk, Kaluga Region, 249036 Russia
**Engelhardt Institute of Molecular Biology, Russian Academy of Sciences, ul. Vavilova 32, Moscow, 119991 Russia
The study aims to determine how to eliminate and/or increase radiosensitivity of a population of cancer stem
cells, which are responsible for radioresistance in malignant neoplasms. The single and combined effects of
γ-radiation at a dose of 4 Gy and dimeric bisbenzimidazoles of DB(n) series with the number of groups in the
methylene linker connecting two benzimidazoles, n = 5 or 7 on the cancer stem cells were studied in the
MCF-7 human breast cancer cell line. It was shown that DB(5) significantly reduces the relative and absolute
number of cancer stem cells by a factor of 5.8 and 7.5 compared to control, respectively (p = 0.001 in both
cases), DB(7) - by a factor of 3.6 (p = 0.003) and 5.2 (p = 0.004), respectively. The single irradiation resulted
in an increase of the relative and absolute number of cancer stem cells by a factor of 1.7 and 1.6 (p < 0.05)
compared to control, respectively. The combined effects of DB(5,7) and exposure to ionizing radiation re-
sulted in a significant decrease in the relative number of cancer stem cells by a factor of 8.2 and 4.1, respec-
tively, as opposed to the effects after single radiation exposure (p = 0.003 and p = 0.004). Even more pro-
nounced outcomes of the combined effects of DB(5,7) and exposure to radiation were found with regard to
the absolute number of cancer stem cells, which decreased by a factor of 16.6 and 14.1, respectively, compared
to those after single irradiation (p = 0.006 in both cases). DB(5,7) in combination with ionizing radiation in-
hibits radiation-induced epithelial-mesenchymal transition as it was shown by the expression of vimentin,
one of the markers linked to this process, vimentin plays an important role in the formation of the cancer stem
cell pool.
Keywords: cancer stem cells, dimeric bisbenzimidazoles, ionizing radiation, combined effect, flow cytometry
БИОФИЗИКА том 65
№ 1
2020