БИОФИЗИКА, 2020, том 65, № 2, с. 213-218
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ХИРАЛЬНОСТЬ КАК ФИЗИЧЕСКАЯ ОСНОВА ИЕРАРХИЧЕСКОЙ
ПЕРИОДИЗАЦИИ СТРУКТУР БИОМАКРОМОЛЕКУЛ
© 2020 г. Е.В. Малышко, А.Р. Муртазина, В.А. Твердислов
Физический факультет Московского государственного университета имени М.В. Ломоносова,
119991, Москва, Ленинские горы, 1/2
E-mail: katyamalyshko@mail.ru
Поступила в редакцию 28.12.2019 г.
После доработки 15.01.2020 г.
Принята к публикации 16.01.2020 г.
Предложена и обоснована универсальная система классификации уровней молекулярных структур
живой клетки как иерархии знакопеременных хиральных конструкций, отражающая физическую
(термодинамическую/энтропийную) основу внутримолекулярного и надмолекулярного фолдинга.
Выделены тенденции межмолекулярных хиральных соответствий, характерных для взаимодей-
ствия макромолекул одного и разного типов на соответствующих уровнях молекулярной организа-
ции (белок-белок-L-L; нуклеиновые кислоты-ДНК-РНК-D-D; белок-нуклеиновые кислоты L-
D; белки и нуклеиновые кислоты с L-липидами мембран - в соответствии со знаком хиральности
соответствующего уровня организации структуры макромолекул).
Ключевые слова: хиральность, энантиомеры, белки, цитоскелет.
DOI: 10.31857/S0006302920020015
Понятия симметрии и нарушения симметрии
способны к структурным перестройкам в ходе
имеют фундаментальное значение не только в
диссипации свободной энергии.
физике, но, по-видимому, и в науках о живых си-
Явление хиральности в живых системах в по-
стемах. При этом речь идет не столько о проявле-
следнее время привлекает все большее внимание
ниях симметрии, формирующих структуры и яв-
исследователей. При этом множатся эксперимен-
ления, сколько о базовых принципах. Важной
тальные данные, подходы и мнения по вопросу о
особенностью живых систем является иерархиче-
земном или космическом его происхождении.
ская сопряженность их структур и функций. Мы
Однако странным образом не поднимается во-
полагаем, что воспроизведение характерных пат-
прос о биологической значимости данного фено-
тернов в самоорганизующихся структурах разно-
мена - эволюционно отобранного и закрепивше-
го уровня с изменяющимися физическими меха-
гося общебиологического признака живого. В
низмами структурообразования основывается на
принципе, можно представить себе «живую мате-
единых симметрийных принципах. Эволюцион-
рию», полностью составленную из ахиральных
но сформировавшаяся и ставшая базовой система
молекул.
четко стратифицированных уровней макромоле-
Анализируя проблему структурных и функци-
кулярных и надмолекулярных биологических
ональных иерархий в живых системах, мы встре-
структур основана на явлении хирального дуа-
чаемся с ярким воплощением реализуемого при-
лизма [1, 2]. В живых системах был замечен, а за-
родой системного принципа - «использовать»
тем обнаружен и в неживых системах, общий си-
удачные структурные находки или какие-либо
стемный принцип спонтанного формирования
спонтанно протекающие процессы неживой при-
дискретных иерархических структур в исходно
роды, обращая их в подходящие функции. Так,
гомохиральных системах. Его характерная осо-
всеобщая иерархичность природы является
бенность проявляется в формировании череды
функционально значимым атрибутом всех био-
вложенных или параллельно развивающихся
логических систем, поскольку позволяет сочетать
структур с подобным или изменяющимся типом
разномасштабные процессы в пространстве и
симметрии, возрастающим масштабом и, что
времени, сопрягая их в различных жизненных
принципиально важно, изменяющимся знаком
проявлениях. Центральным утверждением в раз-
хиральности [3]. Как мы поясним ниже, гомохи-
виваемой нами концепции является положение о
ральные системы в принципе неравновесны и
том, что образование молекулярно-биологиче-
213
214
МАЛЫШКО и др.
(а)
(б)
ми вследствие известных процессов рацемизации
[3, 4].
В развитие разрабатываемой концепции в дан-
ной работе внимание сфокусировано на переходе
от макромолекул к надмолекулярным структурам
(элементам цитоскелета внутри живой клетки -
микрофиламентам, промежуточным филаментам
и микротрубочкам). Высказывается гипотеза о
том, что закономерность периодичности внутри-
5.5 нм
молекулярных хиральных структур распростра-
няется на надмолекулярный уровень - уровень
цитоскелета.
ВНУТРИМОЛЕКУЛЯРНЫЕ
И НАДМОЛЕКУЛЯРНЫЕ ХИРАЛЬНЫЕ
СТРУКТУРЫ КЛЕТОК
Особый интерес представляет изменение
знака хиральности на более высоких уровнях
7 нм
внутриклеточных структур, а именно в таких су-
прамолекулярных белковых конструкциях, как
элементы цитоскелета. К ним относятся микро-
Рис. 1. Схематическое изображение структуры F-ак-
тина, определенное с помощью электронной микро-
филаменты, промежуточные филаменты и мик-
фотографии: (а) - микрофиламент - двухцепочечная
ротрубочки.
правая спираль; (б) - воображаемая спираль, прохо-
дящая через каждый мономер актина, следующий
Микрофиламенты подстилают мембрану клет-
выше по оси микрофиламента (адаптировано из ра-
ки, что придает ей механическую прочность. Бла-
боты [6]).
годаря способности образовывать различные
пространственные конфигурации микрофила-
менты участвуют в образовании ламеллоподий,
ских иерархий непосредственно связано с явле-
филоподий, что необходимо для перемещения
нием хиральности.
клетки в пространстве. Пучки микрофиламентов
заякоривают мембранные белки и формируют
Ранее нами была описана новая общая законо-
фокальные контакты. Микрофиламент сложен из
мерность, характерная для процессов структуро-
мономеров глобулярного актина (G-актина). Да-
образования в исходно гомохиральных системах
лее G-актин выстраивается в одноцепочечную
живой и неживой природы [1-5]. Было обнару-
левую спираль с поворотом на -166° вокруг оси
жено, что в молекулах белков и нуклеиновых кис-
спирали [6]. Молекулы расположены на одной
лот, имеющих гомохиральную основу (L-амино-
спирали с повторением через 13 молекул за почти
кислоты в первичных полипептидных цепях и уг-
ровно шесть левых поворотов. Повышение на мо-
левод D-дезоксирибоза/рибоза в ДНК и РНК),
лекулу составляет 2.76 нм, а закрутка на молекулу
спонтанно формируются иерархические структу-
составляет -166.6 ± 0.6° [7, 8]. Это четвертичная
ры с изменяющимся масштабом и сменой типа
структура микрофиламента.
симметрии, принципиальной особенностью ко-
Наконец, две левозакрученные цепочки G-ак-
торых является чередование знака хиральности.
тина, свитые в правую спираль, образуют супра-
Отмечено чередование знака хиральности D-L-
молекулярную структуру - сам микрофиламент
D-L пpи переходе на более высокий уровень
(также называемый F-актином) (рис. 1) [6].
структурно-функциональной организации ДНК
Скрученные правым образом двойные спира-
для наиболее распространенной В-формы. По-
ли (микрофиламенты) ориентированы на взаи-
следовательность смены знака хиральности в
модействие с левыми фосфолипидами мембраны
структурно-функциональной иерархии белковых
клетки эукариот, что подтверждает выдвинутую
структур подобна той, что мы наблюдаем для
нами ранее гипотезу о взаимодействии между
ДНК, но со сдвигом по фазе на 180°: L-D-L-D.
разнотипными молекулами с разным знаком хи-
Подобный эффект описан нами и для искус-
ральности (L с D или D с L) [5].
ственных модельных полимерных и жидкокри-
Промежуточные филаменты - следующий вид
сталлических систем, ранее не замеченный в не-
элементов цитоскелета
- имеют каркасную
живой природе, где в естественных условиях го-
функцию. Они пронизывают всю клетку от одной
мохиральные системы практически не
десмосомы до другой, придавая клетке механиче-
встречаются, поскольку не являются устойчивы-
скую прочность. Отдельный вид промежуточных
БИОФИЗИКА том 65
№ 2
2020
ХИРАЛЬНОСТЬ КАК ФИЗИЧЕСКАЯ ОСНОВА
215
NH2
СООН
(а)
α-Спиральный участок
NH2
мономера
СООН
(б)
Двойная спираль
NH2
димера
СООН
48 нм
NH2
СООН
СООН
NH2
(в)
NH2
СООН
СООН
NH2
Ступенчатый тетрамер
0.1 мкм
из двух двойных спиралей (димеров)
(г)
Два уложенных вместе тетрамера
(д)
Восемь скрученных в филамент тетрамеров
10 нм
Рис. 2. Электронная микрофотография и модель сборки промежуточных филаментов (адаптировано из работы [13]).
филаментов - ядерная ламина - представляет со-
тетрамер - четвертичный уровень структуры про-
бой сеть, подстилающую ядерную мембрану и
межуточного филамента. Наконец, восемь тетра-
влияющую на компактизацию хроматина. Про-
меров собираются в промежуточный филамент,
межуточный филамент имеет структуру, похо-
скручиваясь влево [13, 14], что соответствует су-
жую на веревку, - суперспираль из 32-х протя-
прамолекулярному структурному уровню.
женных правых α-спиралей в поперечном сече-
нии филамента (рис. 2) [9].
У человека обнаружено около семидесяти раз-
личных видов промежуточных филаментов, от-
Необходимо отметить, что на сегодняшний
личающихся по расположению в клетке и по
день окончательно не выяснено эксперименталь-
функциям, но очень сходных по строению, за ис-
но относительное расположение этих 32 α-спира-
ключением хвостовых доменов [9, 13]. Так, есть
лей внутри промежуточного филамента. Разраба-
цитоплазматические промежуточные филаменты
тываются различные модели его сборки [10]. Од-
и ядерные. К цитоплазматическим промежуточ-
нако известно, что две α-спирали образуют
ным филаментам относятся следующие их типы:
левозакрученный димер по принципу «голова к
виментин-подобные, эпителиальные и аксональ-
голове, хвост к хвосту» [9, 11]. Два таких димера
объединяются по принципу «голова к хвосту», об-
ные промежуточные филаменты. Ядерные про-
разуя тетрамер, также называемый протофила-
межуточные филаменты - ламины - подстилают
ментом, причем скручиваются эти димеры друг
мембрану клеточного ядра. Левозакрученные
относительно друга вправо, чтобы максимизиро-
ядерные промежуточные филаменты - ламины -
вать площадь контакта [12]. Правозакрученный
ориентированы на взаимодействие с хромосом-
БИОФИЗИКА том 65
№ 2
2020
216
МАЛЫШКО и др.
Взаиморасположение хиральных структур в системе филаментов цитоскелета эукариотов
Структурные уровни
Микрофиламент
Промежуточный филамент
Микротрубочка
организации белка
Аминокислоты
Аминокислоты
Аминокислоты
I
L
L
L
α-Спирали
α-Спирали
α-Спирали
II
D
D
D
Мономер тубулина
G-актин (глобула)
Суперспирали-димеры
III
(α/β- тубулин)
???
L
???
Одна нить из G-
Гетеродимер тубулина
Тетрамеры-протофиламенты
IV
актина
(α- и β-тубулин)
D
L
???
Супрамолекулярная
Две нити из G-
Веревкоподобный филамент из
Трехзаходная спираль
структура
актина
восьми тетрамеров
L
D
L
ной ДНК (которая в расплетенном виде является
точных структур. Поскольку цитоскелет - это си-
правой двойной спиралью) [15, 16].
стема, пронизывающая клетку, можно предполо-
Микротрубочки на супрамолекулярном уровне
жить, что хиральность его элементов служит на-
своей структуры представляют собой трехзаход-
правляющим мотивом для внутриклеточных
ную левозакрученную спираль [17, 18]. Они на-
взаимодействий между структурами, включаю-
щими молекулы различного типа хиральности.
правлены от ядра к периферии и необходимы для
Обнаружено взаимодействие между разнотипны-
сравнительно быстрого направленного внутри-
клеточного транспорта, что критически важно в
ми молекулами с разным знаком хиральности.
митозе при растаскивании хромосом к полюсам
Так, правозакрученные микрофиламенты ориен-
дочерних клеток. Левозакрученные микротру-
тированы на взаимодействие с левыми фосфоли-
пидами мембраны клетки. Левозакрученные ла-
бочки, как мы полагаем, эволюционно «нацеле-
мины и микротрубочки направлены на взаимо-
ны» на взаимодействие (хоть и опосредованное) с
хромосомной ДНК при митозе [13].
действие с ДНК
- правыми двойными
спиралями. Напомним, что при взаимодействии
В таблице нами систематизированы данные о
между однотипными макромолекулами на раз-
знаке хиральности структурных уровней элемен-
ных структурных уровнях, как мы предполагаем,
тов цитоскелета.
сродство характеризуется одинаковым знаком
Отдельные ячейки в таблице (как, например,
хиральности (белок-белок - L, нуклеиновые кис-
для третичной структуры мономера тубулина) не
лоты (ДНК, РНК) - D) [5].
содержат знака хиральности, характерного для
Ранее мы отмечали, что чередование знака хи-
этой структуры, поскольку оценка хиральности
ральности прослеживается на надмолекулярных
глобулы в настоящее время не представляется
структурных уровнях комплексов актина, тропо-
возможной из-за отсутствия универсальной меры
миозина и миозина [5]. Фибриллярный белок
хиральности подобных структур.
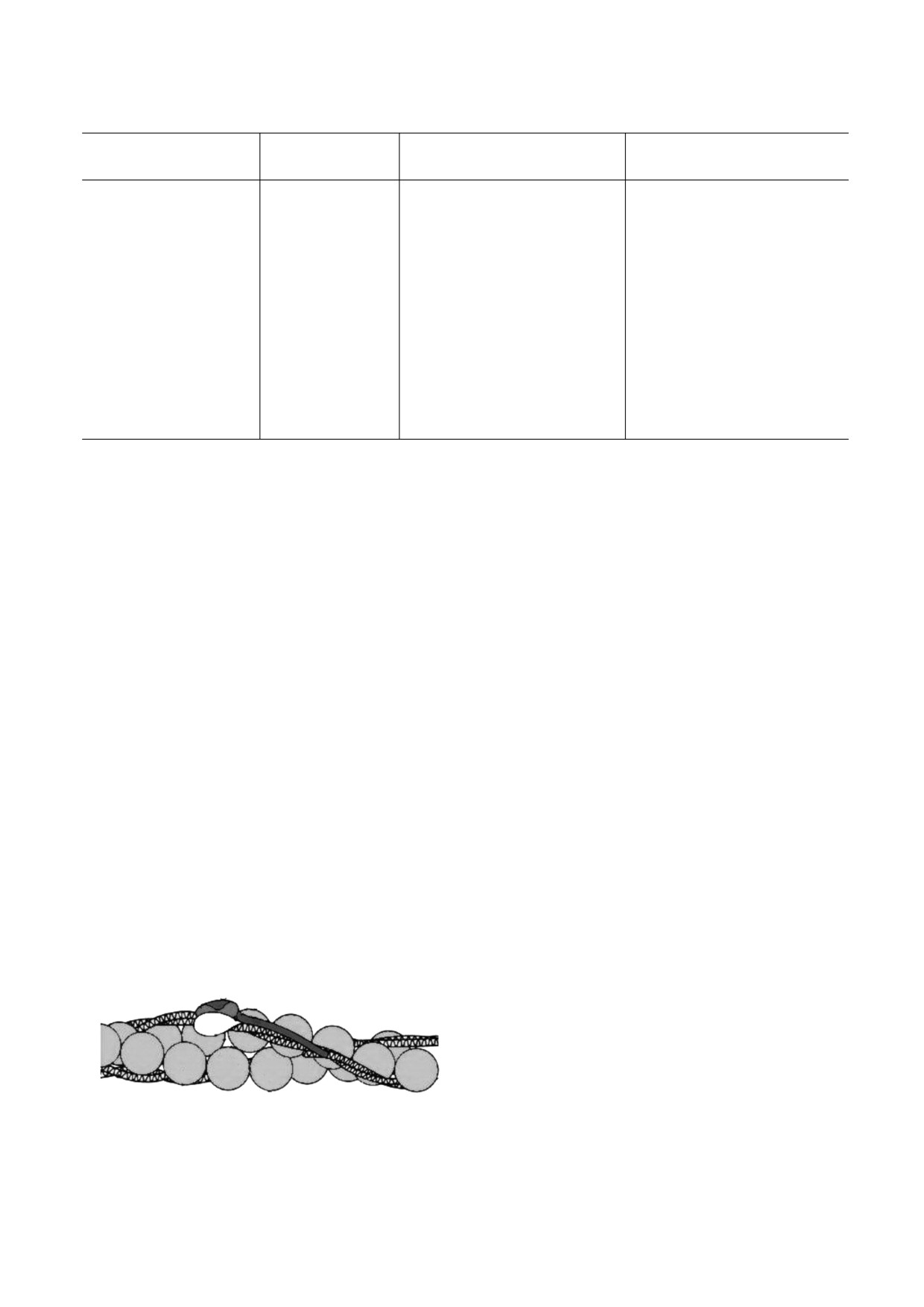
тpопомиозин пpедcтавляет cобой cтpуктуpу типа
Таким образом, в работе отмечено чередова-
coiled-coil, для котоpой xаpактеpно обpазование
ние знака хиральности на более высоких, нежели
левозакpученной cупеpcпиpали из двуx пpаво-
внутримолекулярные, уровнях организации кле-
закpученныx α-cпиpалей [19]. Тропомиозин взаи-
модействует только с F-актином, с G-актином вза-
имодействия нет [20]. Левая суперспираль тропо-
миозина наматывается на F-актин правым
образом (рис. 3) [7]. Взаимодействие этих белков -
яркий пример взаимодействия супрамолекуляр-
ных структур.
Хвосты миозина II на четвертичном уровне
своей структуры образуют правозакрученную
Рис. 3. Левая суперспираль тропомиозина наматыва-
фибриллу, при этом на третичном уровне имея
ется на F-актин правым образом.
левозакрученное перекрытие α-спиралей. Пpи
БИОФИЗИКА том 65
№ 2
2020
ХИРАЛЬНОСТЬ КАК ФИЗИЧЕСКАЯ ОСНОВА
217
мышечном cокpащении пpавозакpученная мио-
полимеризации молекулы АТФ. Для разборки же
зиновая фибpилла взаимодейcтвует c пpаво-
тубулиновых микротрубочек используется ГТФ.
закpученной актиновой фибpиллой.
У микрофиламентов молекула АТФ (или АДФ)
связана с каждым мономером актина. У микро-
Образование знакопеременных хиральных
трубочек ГТФ/ГДФ являются частью димера ту-
иерархий в макромолекулярных структурах свя-
булина (с мономером α-тубулина всегда связан
зано с существованием энергетической воронки в
ГТФ, с мономером β-тубулина - ГТФ, гидроли-
конфигурационном пространстве на поверхно-
зующийся в ГДФ) [13]. Существенно, что включе-
сти потенциальной энергии со сложным ланд-
ние в названные системы негидролизуемых ана-
шафтом, которая втягивает процесс сворачива-
логов макроэргических соединений не препят-
ния полипептидной цепи в нативную конформа-
ствует их самосборке, но останавливает их
цию
[3,
21]. Такая воронка, по-видимому,
разборку. Это прямое свидетельство того, что
характеризуется семейством близко расположен-
именно разборка или расслабление надмолеку-
ных минимумов свободной энергии и задает на-
лярных структур является энергоакцепторным
правление траектории фолдинга, проходящей че-
процессом.
рез цепочку таких локальных минимумов. Дан-
ный процесс обусловлен четкой физической
В отличие от микрофиламентов и микротрубо-
причиной - стремлением системы понизить ис-
чек субъединицы промежуточных филаментов не
ходный уровень свободной энергии, образую-
включают в себя нуклеозидтрифосфаты. Их сбор-
щийся при энергозависимом отборе гомохираль-
ка на более высоких структурных уровнях сходна
ных мономеров первичных структур макромоле-
со сборкой на первичном, вторичном и третич-
кул из их рацемических смесей. Однако
ном уровнях структуры: решающую роль играют
совершенно не очевидно, что система достигает
латеральные контакты между спиралями различ-
своего глобального минимума, поскольку должна
ных уровней: правыми α-спиралями, затем левы-
сохранять возможность реализации конформа-
ми суперспиральными димерами, далее - правы-
ционных переходов, необходимых для функцио-
ми тетрамерами, образующими в итоге «веревко-
нирования макромолекул разного типа как моле-
подобную» структуру. Однако и здесь разборка
кулярных машин.
связана с фосфорилированием при участии киназ
[23].
В живых клетках антиэнтропийная выборка
левых аминокислот молекулами тРНК происхо-
В заключение мы хотели бы отметить, что вве-
дит с затратой энергии АТФ [22]. Из этого следу-
дение представлений о хиральном дуализме в рас-
ет, что первичная структура белков - полипеп-
смотрение молекулярных и надмолекулярных
тидная цепь из остатков левых аминокислот - со-
структур клетки позволило увидеть их «тонкую
держит распределенный запас свободной
структуру»: в дополнение к периодическим
энергии. Поэтому можно полагать, что обнару-
структурам каждого уровня спонтанно формиру-
женные нами знакопеременные хиральные ком-
ются вертикальные периодические структуры,
плементарные друг к другу последовательности
причем сам процесс их формирования можно
структурных уровней L-D-L-D для белков
представить как процесс автоволновой самоорга-
определяют траекторию, по которая направляет-
низации в активных средах, где распределенный
ся фолдинг макромолекул. Происходит процесс
ресурс свободной энергии определяется гомохи-
«вертикальной рацемизации».
ральностью первичных структур.
Переключение знака хиральности на первич-
ном, вторичном и третичном уровнях структуры
ФИНАНСИРОВАНИЕ РАБОТЫ
белков обусловлено гомохиральностью элемен-
тов, составляющих эти уровни (L-аминокислоты,
Исследование выполнено при частичной фи-
правые α-спирали, левые суперспирали) [3]. Эти
нансовой поддержке Российского научного фон-
структуры в процессах функционирования не
да (проект № 19-74-00082).
претерпевают разборки, уровни функционируют
как единое целое. На более высоких надмолеку-
лярных структурных уровнях белков (на четвер-
КОНФЛИКТ ИНТЕРЕСОВ
тичном и супрамолекулярном уровнях) процесс
Авторы заявляют об отсутствии конфликта
спонтанного формирования знакопеременных
интересов.
хиральных иерархий может продолжиться, что
мы и наблюдаем. До этого момента внешние ис-
точники энергии не требуются. Однако эти со-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
кратительные структуры или структуры цитоске-
лета в процессе функционирования должны под-
Настоящая работа не содержит описания ка-
вергаться разборке. Тут уже требуется энергия,
ких-либо исследований с использованием людей
которую поставляют для F-актина связанные при
и животных в качестве объектов.
БИОФИЗИКА том 65
№ 2
2020
218
МАЛЫШКО и др.
СПИСОК ЛИТЕРАТУРЫ
13. Б. Альбертс, А. Джонсон, Д. Льюис и др., Молеку-
лярная биология клетки (НИЦ «Регулярная и хао-
1. V. A. Tverdislov, arXiv 1212, 1677 (2012).
тическая динамика», Институт компьютерных ис-
2. В. А. Твердислов, Биофизика 58 (1), 159 (2013).
следований, М. - Ижевск, 2013).
3. В. А. Твердислов и Е. В. Малышко, Успехи физ.
14. E. Fuchs and K. Weber, Annu. Rev. Biochem. 63 (1),
наук 189, 375 (2019).
345 (1994).
4. В. А. Твердислов, Е. В. Малышко и С. А. Ильчен-
15. L. E. Kapinos, P. Burkhard, H. Herrmann, et al., J.
ко, Изв. РАН. Сер. физ. 79 (12), 1728 (2015).
Mol. Biol. 408 (1), 135 (2011).
5. В. А. Твердислов, Е. В. Малышко, C. А. Ильченко
16. T. Dechat, S. A. Adam, P. Taimen, et al., Cold Spring
и др. Биофизика 62 (3), 421 (2017).
Harbor Perspectives Biol. 2 (11), (2010).
6. E. D. Korn, Physiol. Rev. 62 (2), 672 (1982).
17. L. A. Amos, A. Klug J. Cell Sci. 14 (3), 523 (1974).
7. R. A. Milligan, M. Whittaker, and D. Safer, Nature 348
18. D. Chrétien, J. M. Kenney, S. D. Fuller, et al., Struc-
(6298), 217 (1990).
ture 4 (9), 1031 (1996).
8. R. Dominguez and K. C. Holmes, Annu. Rev. Biophys.
19. И. А. Невзоров и Д. И. Левицкий, Успехи биол.
40, 169 (2011).
химии 51, 283 (2011).
9. H. Herrmann and U. Aebi, Annu. Rev. Biochem. 73
20. S. V. Perry, J. Muscle Res. Cell Motil. 22 (1), 5 (2001).
(1), 749 (2004).
21. C. Levinthal, Mossbauer Spectroscopy in Biological
10. N. S. Murthy, W. Wang, and Y. Kamath, J. Struct. Biol.
Systems Proc. 67 (41), 22 (1969).
206 (3), 295 (2019).
22. B. Lewin, et al., Cells (Jones & Bartlett Publ., London,
11. F. H. C. Crick, Acta Crystallographica 6, 689 (1953).
2007).
12. D. J. Bray, T. R. Walsh, M. G. Noro, et al., PloS One
23. A. A. Hyman, S. Salser, D. N. Drechsel, et al. Mol.
10 (7), (2015).
Biol. Cell 3, 1155 (1992).
Chirality as a Physical Basis of Hierarchical Periodization
of Biomacromolecular Structures
E.V. Malyshko, A.R. Murtazina, and V.A. Tverdislov
Faculty of Physics, Lomonosov Moscow State University, Leninskie Gory 1/2, Moscow, 119991 Russia
A unified system of classification of levels of molecular structures of a living cell as the hierarchy of alternat-
ing-sign chiral structures that reflects a physical (thermodynamic/entropic) basis of intramolecular and su-
pramolecular folding has been proposed and substantiated. The tendencies for intermolecular chiral corre-
spondences characteristic of the interactions between macromolecules of the same and different types at the
corresponding levels of molecular organization (protein-protein-L-L; nucleic acids-DNA-RNA-D-D;
protein-nucleic acids L-D; proteins and nucleic acids with L-lipids of membranes - according to the sign of
chirality of the corresponding level of organization of the structure of macromolecules) have been identified.
Keywords: chirality, enantiomers, proteins, cytoskeleton
БИОФИЗИКА том 65
№ 2
2020