БИОФИЗИКА, 2020, том 65, № 2, с. 229-236
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.325.5: 57.021
ИЗМЕНЕНИЕ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ПЕРОКСИДАЗЫ
ХРЕНА И БЫЧЬЕГО СЫВОРОТОЧНОГО АЛЬБУМИНА В СРЕДАХ
С РАЗЛИЧНЫМ ИЗОТОПНЫМ 2H/1H-СОСТАВОМ
© 2020 г. С.В. Козин*, **, А.А. Кравцов*, **, К.К. Туроверов***, А.В. Фонин***,
Е.В. Чихиржина***, В.В. Малышко**, ****, А.В. Моисеев*****, А.В. Чуркина*
*Кубанский государственный университет, 350040, Краснодар, ул. Ставропольская, 149
**Южный научный центр РАН, 344006, Ростов-на-Дону, просп. Чехова, 41
***Институт цитологии РАН, 194064, Санкт-Петербург, Тихорецкий просп., 4
****Кубанский государственный медицинский университет МЗ РФ, 350063, Краснодар, ул. Седина, 4
*****Кубанский государственный аграрный университет, 350004, Краснодар, ул. Калинина, 13
E-mail: kozinsv85@mail.ru
Поступила в редакцию 123.123.2019 г.
После доработки 123.123.2019 г.
Принята к публикации 123.123.2019 г.
Установлено, что среда с пониженным содержанием дейтерия не оказывает влияния на вторичную
структуру пероксидазы хрена и бычьего сывороточного альбумина и не вызывает конформацион-
ных изменений в структуре этих белков. Помещение данных белков в буферный раствор, приготов-
ленный на обедненной дейтерием воде, приводило к уменьшению интенсивности собственной
триптофановой флуоресценции, при этом спектры кругового дихроизма практически не изменя-
лись. Снижение содержания дейтерия в реакционной среде приводило к уменьшению активности
пероксидазной реакции окисления о-дианизидина и люминола пероксидом водорода.
Ключевые слова: дейтерий, протий, изотопный обмен, пероксидаза хрена, бычий сывороточный альбу-
мин, собственная триптофановая флуоресценция, спектроскопия кругового дихроизма, кинетика ре-
акции.
DOI: 10.31857/S0006302920020039
Известно, что в природе содержание дейтерия
образом благотворно сказывается на функцио-
в воде колеблется в разных регионах планеты, но
нальной активности организма [11-13].
в среднем находится на уровне около 150 ppm [1,
Однако несмотря на достаточно широкий
2]. Также экспериментально установлено, что да-
спектр результатов о стимулирующем влиянии
же относительно небольшое изменение изотоп-
понижения содержания дейтерия в потребляемой
ного состава воды (двух-трехкратное повышение
воде на физиологические функции живых систем
или понижение содержания дейтерия) суще-
[14-17], механизм этого феномена до сих пор
ственным образом сказывается на метаболизме
остается не вполне ясным, хотя установлено, что
как микроорганизмов [3-5], так и высших расте-
всегда происходит изменение изотопного состава
ний [6-8] и животных, а также характеризуется
тканей внутренних органов [18]. Считается, что
изменением активности модельных систем [9].
термодинамическая неравноценность изотопо-
Полученные на сегодняшний день данные свиде-
логов воды, обусловленная различиями свойств
тельствуют в пользу того, что дейтерий является
ядер протия и дейтерия, вызывает появление ки-
необходимым элементом для нормального мета-
нетического изотопного эффекта. Предполагает-
болизма живых систем, а колебания его концен-
ся, что различия в кинетике химических и биохи-
трации способны как стимулировать, так и угне-
мических реакций в воде с различным содержа-
тать разнообразные физиологические процессы
нием дейтерия могут являться следствием
[10]. Например, возрастание содержания дейте-
большей прочности связи D-O по сравнению со
рия в воде вызывает изменение физиологии и
связью H-O [19]. В ряде работ рассматривается
морфологии клеток и нередко оказывает отрица-
роль воды как ключевого фактора, определяюще-
тельное влияние на их метаболизм. С другой сто-
го физико-химические свойства растворов [20,
роны, снижение содержания дейтерия главным
21]. Кроме того, при изменении изотопного со-
229
230
КОЗИН и др.
става воды диссоциирующие атомы водорода рас-
товленном на воде с природным содержанием дей-
творенных биомолекул подвергаются замещению
терия (150 ppm); за два часа до измерений готовили
и при уменьшении содержания дейтерия в рас-
два рабочих раствора пероксидазы и термостатиро-
творителе происходит его замещение протием в
вали при 37°С - первый рабочий раствор готовили
молекулах органических соединений, а повыше-
разведением основного раствора фосфатным буфе-
ние содержания дейтерия в воде приводит к дей-
ром (pH 7.5), приготовленного на воде с природным
терированию биомолекул. Этот процесс обратим
содержанием дейтерия (150 ppm); второй рабочий
и протекает с большей скоростью и вероятностью
раствор готовили разведением основного раствора
у атомов водорода, которые находятся ближе к
фосфатным буфером, приготовленным на воде с
поверхности биомолекулы и менее прочно связа-
пониженным содержанием дейтерия
(50 ppm).
ны с соседними атомами (азота, кислорода, серы
Концентрацию пероксидазы в рабочих растворах,
и других). Очевидно, что в силу различий свойств
составившую 7.5 нг/мл, определяли спектрофото-
протия и дейтерия такое замещение может при-
метрическим методом при длине волны 403 нм
водить к изменению экспрессии регуляторных
(ε403 = 10 · 104 M-1 см-1 [29]). Растворы перекиси
белков [22], а также, возможно, к изменению
готовили разбавлением исходного 38%-го раствора
структуры белков, кроме того, поскольку суще-
водой. Концентрацию пероксида водорода опреде-
ственная часть беков - это ферменты, осуществ-
ляли титриметрически с раствором перманганата
ляющие катализ самых разнообразных и часто
калия. Раствор о-дианизидина готовили в этаноле
критически важных для метаболизма реакций,
по навеске до его конечной концентрации
логично ожидать, что даже относительно неболь-
0.25 мг/мл. Люминол (Sigma-Aldrich, США) раство-
шие изменения их конформации будут иметь
ряли в диметилсульфоксиде также по навеске до
весьма серьезные последствия для функциониро-
концентрации 7 мг/мл. Из этого раствора готовили
вания как отдельных клеток, так и всего организ-
рабочий раствор люминола путем стократного раз-
ма. Ввиду этого представляется весьма актуаль-
ведения фосфатным буфером (150 ppm).
ным исследование влияния изменения изотопно-
Первый эксперимент состоял из следующих эта-
го состава воды на структуру растворенных в ней
пов: в шестилуночные планшеты с диаметром лун-
белков.
ки 3.5 см последовательно приливали 2 мл рабочего
Целью исследования являлось изучение влия-
буферного раствора пероксидазы и 0.1 мл спиртово-
ния сниженного содержания дейтерия в растворе
го раствора о-дианизидина. Реакцию инициирова-
на функциональные свойства пероксидазы хрена
ли добавлением пероксида водорода требуемой
и структуру бычьего сывороточного альбумина.
концентрации в объеме 0.1 мл. Кинетику реакции
изучали спектрофотометрически, измеряя началь-
ную скорость окисления о-дианизидина (V0) при
МЕТОДЫ
длине волны 460 нм (ε460 = 3 · 104 M-1 см-1 для ко-
Обедненную по дейтерию воду получали на
нечного продукта при температуре 37°С [30]). Из-
установке, разработанной в Кубанском государ-
мерения проводили на многофункциональном ри-
ственном университете [23-25]. Затем получен-
дере для микропланшетов FilterMax F5 (Molecular
ную воду с пониженным содержанием дейтерия и
Devices, США). По результатам измерений строили
дистиллированную воду с естественным содержа-
график зависимости начальной скорости перокси-
нием дейтерия подвергали дополнительной
дазной реакции окисления от начальной концен-
очистке в системе очистки воды LaboStar TWF 7
трации пероксида водорода при постоянной кон-
(Evoqua, Германия) до показателей по сопротив-
центрации о-дианизидина. Линеаризацию зависи-
лению 18.2 МОм·см.
мости начальной скорости пероксидазной реакции
Для определения активности пероксидазы
окисления от начальной концентрации пероксида
хрена в средах с различным содержанием дейте-
водорода осуществляли в координатах Лайнуиве-
рия (50 и 150 ppm, здесь и далее в ppm указано со-
ра-Берка и Иди-Хофсти. По данным графикам
держание дейтерия) использовали две модельные
определяли максимальную скорость реакции и
системы. Первая представляет собой реакцию пе-
константу Михаэлиса.
роксидазного окисления о-дианизидина (Sigma-
Эксперимент со второй модельной системой
Aldrich, США) пероксидом водорода [26, 27]. Вто-
состоял в следующем: к 2 мл рабочего буферного
рая модельная система - сопровождающееся хе-
раствора пероксидазы (50 и 150 ppm) при темпе-
милюминесценцией окисление люминола перок-
ратуре 37°С добавляли 15 мкл люминола. Реак-
сидом водорода в присутствии пероксидазы хрена
цию инициировали добавлением пероксида во-
[28].
дорода (0.25 мМ) в объеме 30 мкл. Свечение, вы-
Для этих модельных систем были приготовлены
званное окислением люминола пероксидом
следующие растворы: стоковый (основной) раствор
водорода в отсутствие фермента, было на уровне
пероксидазы хрена (Sigma-Aldrich, США) готовили
фонового. Кинетику реакции измеряли хемилю-
в 0.01 М калий-фосфатном буфере (pH 7.5), приго-
минесцентным методом с помощью аппаратно-
БИОФИЗИКА том 65
№ 2
2020
ИЗМЕНЕНИЕ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ПЕРОКСИДАЗЫ
231
программного комплекса
«Lum-5773» (ООО
135
«ДИСофт», Москва) и специализированного
программного обеспечения PowerGraph 3 Profes-
115
sional с определением светосуммы и тангенса угла
95
наклона касательной [31].
Структуру пероксидазы хрена и бычьего сыво-
75
роточного альбумина в средах с различным со-
держанием дейтерия (50 и 150 ppm) изучали с по-
55
мощью спектров собственной флуоресценции
этих белков и спектров кругового дихроизма. Для
35
150 ppm
этого были приготовлены следующие растворы:
50 ppm
стоковые (основные) растворы пероксидазы и
15
альбумина готовили на воде с природным содер-
жанием дейтерия (150 ppm) в 0.01 М калий-фос-
5
0.5
1.0
1.5
2.0
2.5
3.0
фатном буфере при pH 7.5. За два часа до измере-
[H O ],22 ммоль
ний готовили два рабочих раствора пероксидазы
и два рабочих раствора альбумина и термостати-
Рис. 1. Зависимости начальной скорости перокси-
ровали при 37°С. Первый рабочий раствор для
дазного окисления о-дианизидина от начальной кон-
каждого белка готовили разведением основного
центрации пероксида водорода (M ± m) в среде с по-
ниженным содержанием дейтерия (pH 7.5).
раствора фосфатным буфером (pH 7.5, 150 ppm).
Второй рабочий раствор для обоих белков готови-
ли разведением основного раствора фосфатным
реакции на плато, где ее начальная скорость
буфером, приготовленным на обедненной дейте-
практически перестает зависеть от концентрации
рием воде (50 ppm). Концентрацию пероксидазы
пероксида водорода (порядок ферментативной
и альбумина, составившую 0.1 мг/мл, в рабочих
реакции становится нулевым). Таким образом, в
растворах определяли спектрофотометрически:
диапазоне концентраций от 0.01 до 1 мМ данная
ε403 = 10 · 104 M-1 см-1 для пероксидазы хрена [5]
ферментативная реакция описывается уравнени-
ем Михаэлиса-Ментен. При более высоких кон-
и ε279 = 43824 M-1 см-1 для бычьего сывороточ-
центрациях H2O2 (больше 1 мМ) в средах с содер-
ного альбумина [32, 33].
жанием дейтерия 50 ppm и 150 ppm происходит
Флуоресцентные измерения проводили на
ингибирование реакции пероксидазного окисле-
спектрофлуориметре Cary Eclipse (Varian, Австра-
ния о-дианизидина пероксидом водорода. В сре-
лия). Собственную триптофановую флуоресцен-
де, приготовленной на обедненной дейтерием во-
цию возбуждали светом длиной волны 297 нм
де, начальная скорость реакции достоверно мень-
[33], а совместную триптофановую и тирозино-
ше, чем в среде с концентрацией дейтерия
вую флуоресценцию измеряли при возбуждении
150 ppm, во всех исследуемых разведениях
светом с длиной волны 280 нм [34, 35]. Спектры
(рис. 1).
кругового дихроизма регистрировали на дихро-
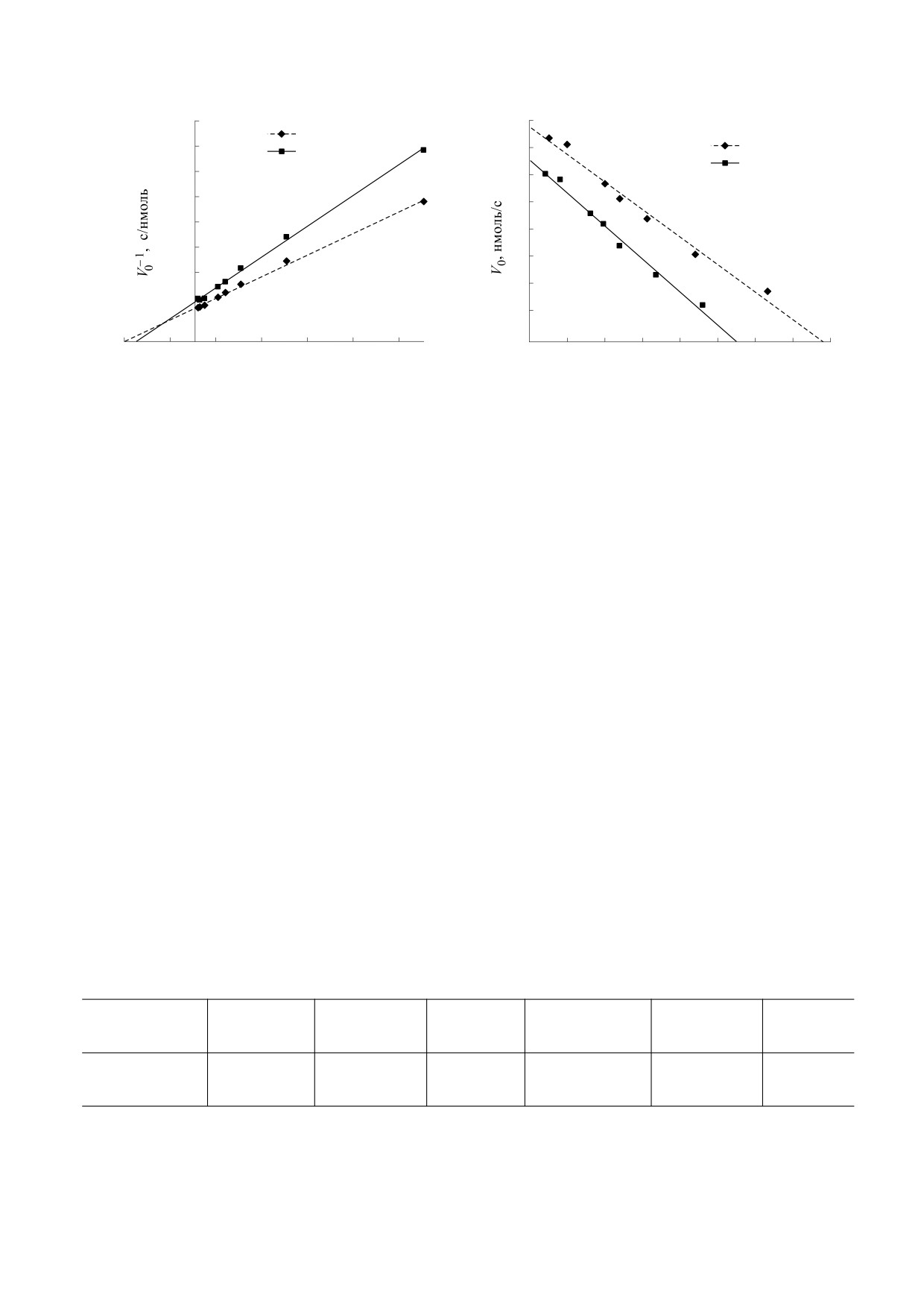
Линеаризацию проводили в двойных обрат-
графе J-810 (Jacso Inc., США).
ных координатах Лайнуивера-Берка и координа-
Статистическую обработку данных проводили
тах Иди-Хофсти, поскольку при таких концен-
на лицензионной программе Statistika 10 с помо-
трациях окислителя ферментативная реакция
щью t-критерия Стьюдента.
описывается уравнением Михаэлиса-Ментен
(рис. 2 и 3), по результатам построения были най-
дены максимальная скорость реакции и констан-
ОБСУЖДЕНИЕ И РЕЗУЛЬТАТЫ
та Михаэлиса (таблица).
При исследовании ферментативной реакции в
Анализ полученных экспериментальных пря-
модельной системе «о-дианизидин - пероксидаза
мых в двух координатных системах показал, что
хрена - H2O2» установлено, что зависимость на-
максимальная скорость реакции пероксидазного
чальной скорости реакции пероксидазного окис-
окисления о-дианизидина пероксидом водорода
ления о-дианизидина от начальной концентра-
была выше в среде, приготовленной на воде с
ции пероксида водорода в средах с разным содер-
природным содержанием дейтерия. Константа
жанием дейтерия (50 ppm и 150 ppm) имеет общий
Михаэлиса, полученная в координатах Лайнуиве-
линейный характер при малых концентрациях
ра-Берка, была выше на 26% для ферментатив-
перекиси водорода (от 0.01 до 0.1 мМ) и указывает
ной реакции, протекающей в обедненном дейте-
в данном диапазоне концентраций окислителя на
рием буфере. В координатах Иди-Хофсти дан-
первый порядок ферментативной реакции. При
ный показатель был больше на 20% в среде со
дальнейшем увеличении концентрации субстрата
сниженной концентрацией дейтерия, что указы-
окислителя (от 0.25 до 1 мМ) происходит выход
вает на меньшее сродство субстрата с ферментом
БИОФИЗИКА том 65
№ 2
2020
232
КОЗИН и др.
0.05
140
150 ppm
150 ppm
50 ppm
120
0.04
50 ppm
100
0.03
80
60
0.02
40
0.01
20
31
11
9
29
29
69
89
00
500
1000
1500 2000 2500 3000 3500 4000
[H O ]
1
,
ммоль
1
V0/[H O ]22
2
2
Рис. 2. Зависимости начальной скорости перокси-
Рис. 3. Зависимости начальной скорости перокси-
дазного окисления о-дианизидина от начальной кон-
дазного окисления о-дианизидина от начальной кон-
центрации пероксида водорода в координатах Лай-
центрации пероксида водорода в координатах Иди-
нуивера-Берка в среде с пониженным содержанием
Хофсти в среде с пониженным содержанием дейтерия
дейтерия (pH 7,5).
(pH 7.5).
в данной модельной системе, когда содержание
При оценке собственной триптофановой флуо-
дейтерия в три раза меньше естественного.
ресценции пероксидазы хрена и бычьего сыворо-
точного альбумина установлено, что интенсив-
Результаты исследования хемилюминесцент-
ность флуоресценции альбумина была примерно в
ной реакции пероксидазного окисления люми-
десять раз выше, чем у пероксидазы. Данные отли-
нола пероксидом водорода в модельной системе
чия вызваны различиями как в количестве трипто-
«люминол - пероксидаза хрена - H2O2» с различ-
фана в молекулах этих белков, так и в их микро-
ным содержанием дейтерия представлены в таб-
окружении. Белок альбумин имеет два триптофа-
лице. Интегральный показатель свечения, а так-
новых остатка, один из них расположен
же тангенс угла наклона кривой нарастания были
интрамолекулярно, а другой - на поверхности мо-
достоверно меньше (p < 0.05, рис. 4) в реакцион-
лекулы. Взаимодействие поверхностного трипто-
ной среде, приготовленной на воде с концентра-
фана альбумина с молекулами растворителя при-
цией дейтерия 50 ppm.
водит к смещению максимума длины волны ис-
пускания в длинноволновую область. Несмотря на
Данные кинетические параметры отражают
то что в ферменте единственный триптофановой
интенсивность свечения, развиваемого в ходе пе-
роксидазного окисления люминола. Интенсив-
остаток расположен внутри гидрофобной части
ность хемилюминесценции данной реакции про-
молекулы, его спектр флуоресценции также имеет
порциональна скорости генерации радикалов
длинноволновый максимум. Это вызвано ван-дер-
люминола. Таким образом, уменьшение интен-
ваальсовым взаимодействием между триптофаном
сивности хемилюминесценции при окислении
и гемом фермента. Снижение концентрации дей-
люминола пероксидазой хрена в среде, приготов-
терия в растворителе не вызвало заметного сдвига
ленной на обедненной дейтерием воде, можно
максимума эмиссии в коротковолновую или длин-
объяснить снижением активности фермента в
новолновую область спектра. При нахождении
данных условиях реакции.
белков в растворителе с концентрацией дейтерия
Показатели активности пероксидазы хрена в средах с разным содержанием дейтерия
kM (Л. - Б.),
kM (Ид. - Х.),
Vmax (Л. - Б.),
Vmax (Ид. - Х.),
Светосумма,
2H среды, ppm
tgα ∙ 10-4
мМ
мМ
нмоль/с
нмоль/с
усл. ед.
150
0.026
0.035
131
136
3637 ± 49
53.0 ± 1.5
50
0.033
0.042
111
115
2557 ± 124*
18.7 ± 0.6*
Примечание. * - p < 0.05 к группе 150 ppm, данные представлены в виде M ± m, «Л. - Б.» - координаты Лайнуивера-Берка,
«Ид. - Х.» - координаты Иди-Хофсти.
БИОФИЗИКА том 65
№ 2
2020
ИЗМЕНЕНИЕ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ПЕРОКСИДАЗЫ
233
9
8
7
6
5
4
3
150 ppm
50 ppm
2
1
00
50
100
150
200
250
300
350
400
450
Время, с
Рис. 4. Кинетические кривые хемилюминесцентной реакции окисления люминола пероксидазой хрена в среде с
пониженным содержанием дейтерия.
(а)
900
800
50 ppm, ПХ
700
150 ppm
, ПХ
150 pp , БСА
m
600
50 ppm, БСА
500
400
300
200
100
0
310
320
330
340
350
360
370
380 390
400
410
420
430
440
450
Длина волны, нм
(б)
900
50 ppm, ПХ
800
150 ppm
, ПХ
700
50 pp , БСА
m
600
150 ppm, БСА
500
400
300
200
100
0
310
320
330
340
350
360
370
380 390
400
410
420
430
440
450
Длина волны, нм
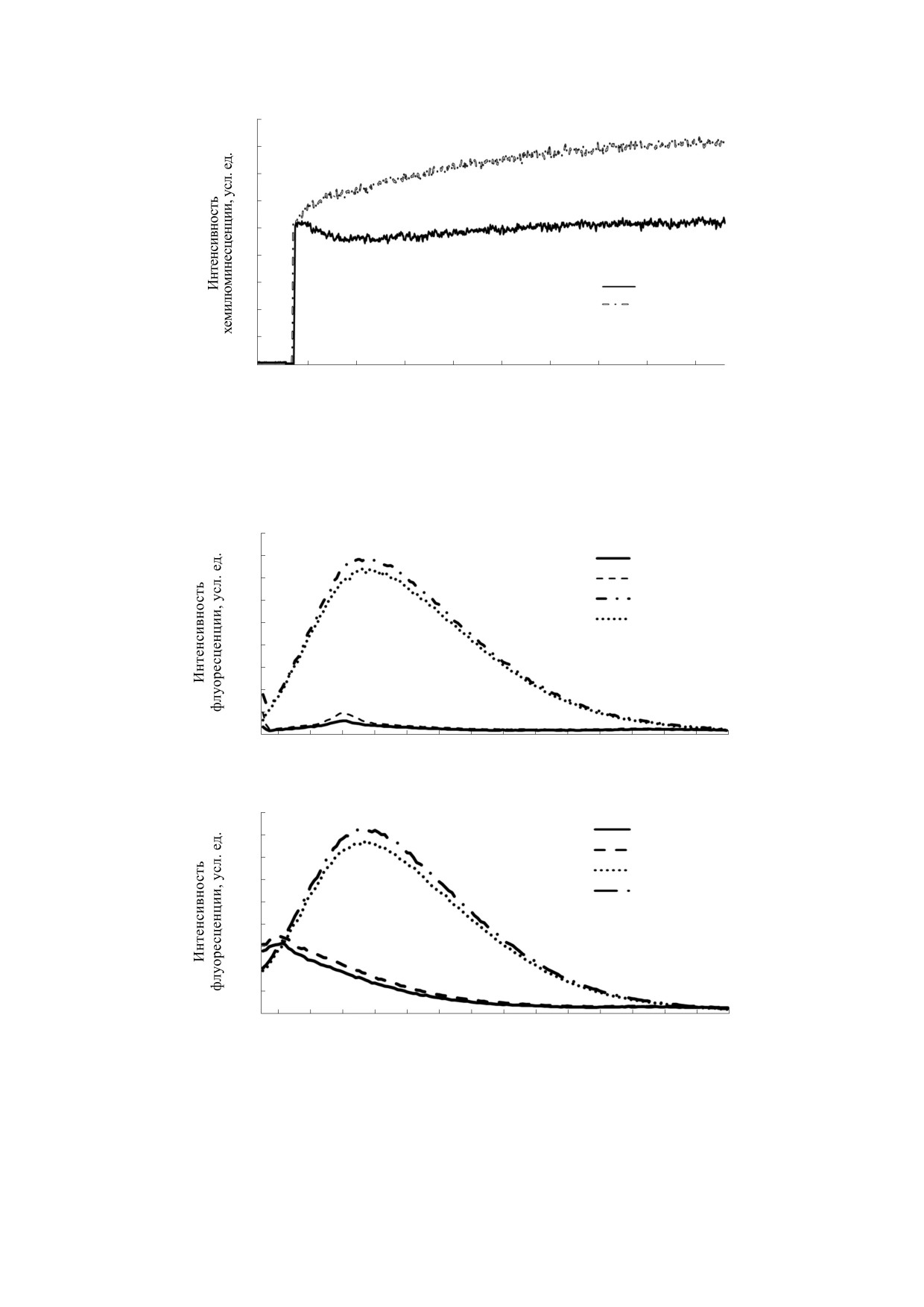
Рис. 5. Интенсивность флуоресценции бычьего сывороточного альбумина и пероксидазы хрена в среде с понижен-
ным содержанием дейтерия (50 ppm): (а) - триптофановая флуоресценция (297 нм), (б) - триптофановая и тирозино-
вая флуоресценция (280 нм).
БИОФИЗИКА том 65
№ 2
2020
234
КОЗИН и др.
15
50 ppm, ПХ
150 ppm
, ПХ
10
50 pp , БСА
m
150 ppm, БСА
5
0
197
202 206 210 215 219 224 228 232
237 241 246
250 254 259
Длина волны, нм
5
10
15
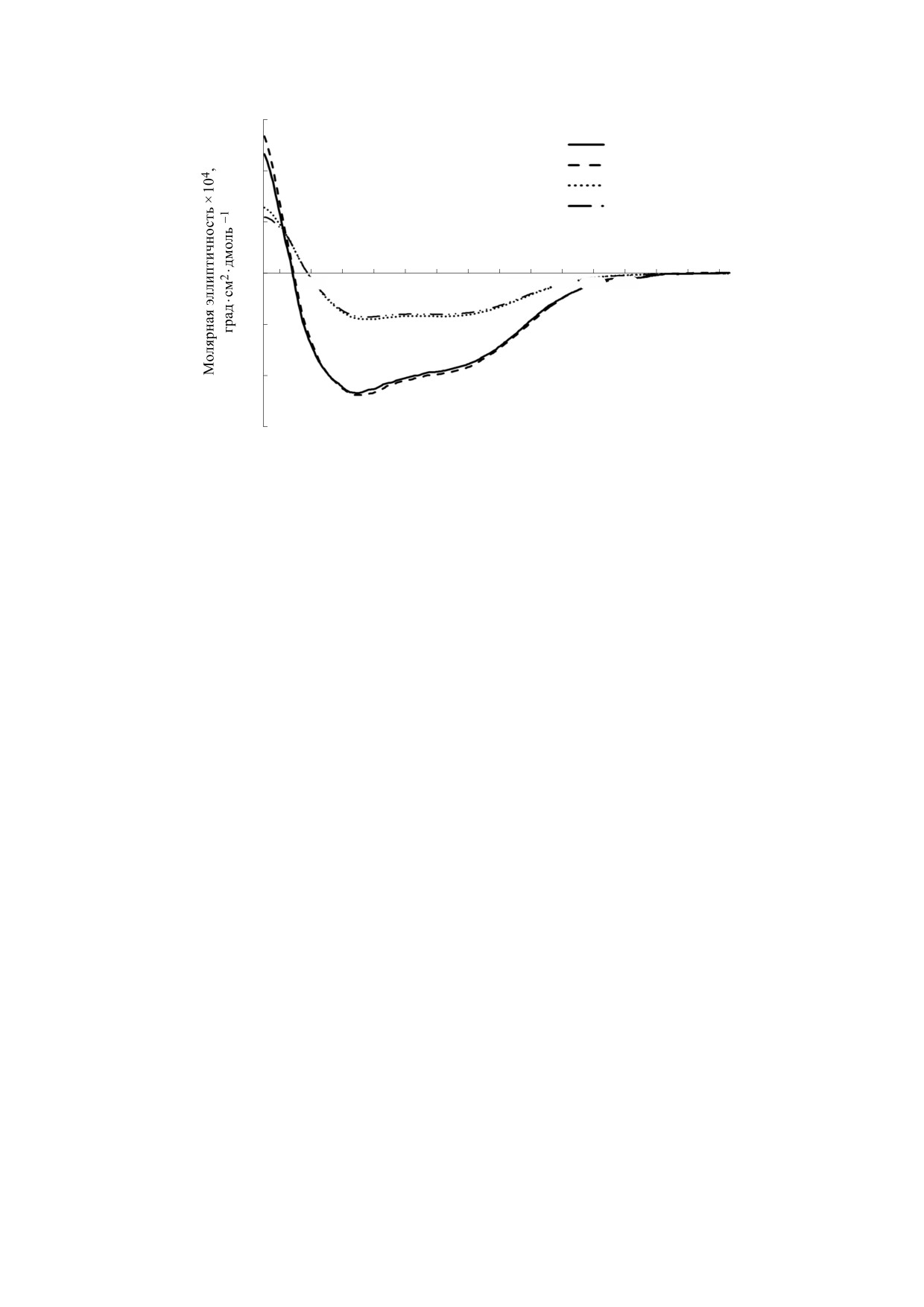
Рис. 6. Спектры кругового дихроизма (дальний ультрафиолетовый диапазон) пероксидазы хрена и бычьего сыворо-
точного альбумина в среде с пониженным содержанием дейтерия.
50 ppm наблюдалось снижение интенсивности
дой и формой характерны для глобулярных бел-
флуоресценции в обоих образцах (рис. 5а).
ков с высокоупорядоченной вторичной структу-
рой. Известно, что эллиптичность при 220 нм яв-
Особенности собственной триптофановой и
ляется мерой упорядоченности структуры белка.
тирозиновой флуоресценции могут быть обу-
Амплитуда спектра пероксидазы в данной точке
словлены тем, что количество тирозина в альбу-
была в два с половиной раза больше, чем у альбу-
мине составляет девятнадцать против семи в мо-
мина, что говорит о большом содержании β-слоев
лекуле пероксидазы хрена. При возбуждении све-
во вторичной структуре альбумина (рис. 6). Необ-
том с длиной волны
280 нм интенсивность
ходимо отметить, что уменьшение концентрации
флуоресценции альбумина была примерно в два с
дейтерия в растворителе не оказало влияния на
половиной раза выше, чем в пероксидазе. Для
вторичную структуру обоих белков.
альбумина интенсивность флуоресценции при
длине возбуждения 280 и 297 нм практически не
Известно, что у альбумина основными туши-
отличалась (разница не превышала 5%). Это мо-
телями триптофановой флуоресценции являются
жет означать, что основной вклад в совместную
молекулы растворителя (воды), а также тирози-
флуоресценцию альбумина вносят остатки трип-
новые остатки за счет переноса энергии по ди-
тофана. В пероксидазе происходило резкое уве-
поль-дипольному механизму. В то же время у мо-
личение интенсивности флуоресценции при
лекулы пероксидазы хрена основным акцептором
280 нм. Таким образом, основной вклад в сов-
энергии триптофана и тирозина является просте-
местную флуоресценцию фермента вносят тиро-
тическая группа (гем). Также безизлучательный
зиновые остатки. Максимум испускания для аль-
перенос энергии с этих хромофоров возможен за
бумина составил 335 нм, а для пероксидазы -
счет их ферстеровского взаимодействия между
310 нм. Коротковолновый максимум флуорес-
собой.
ценции у молекулы пероксидазы хрена связан,
Можно предположить, что тушение собствен-
возможно, с гидрофобным окружением тирози-
ной тирозиновой и триптофановой флуоресцен-
новых остатков. Среда с пониженным содержа-
ции в среде с пониженным содержанием дейте-
нием дейтерия не повлияла на положение макси-
рия происходит по одному из вышеуказанных ме-
мумов в спектрах опытных белков, но при этом
ханизмов. Однако спектрометрия кругового
вызвала снижение интенсивности флуоресцен-
дихроизма не показала заметного изменения во
ции (рис. 5б).
взаимном расположении молекулярных структур
Исследование спектров кругового дихроизма
«гем-триптофан» в пероксидазе и «триптофан-
показало, что в далекой УФ-области для обоих
тирозин» в обоих белках. Также не наблюдался
белков имеются два минимума в области 207-220
сдвиг максимумов спектров испускания в обоих
нм. При этом для пероксидазы кривая пересекает
белках при изменении концентрации дейтерия в
нулевую линию в точке 199 нм, а для альбумина
растворителе, что указывает на постоянное окру-
эта точка равна 201 нм. Спектры с такой амплиту-
жение хромофоров. Известно, что атомы водоро-
БИОФИЗИКА том 65
№ 2
2020
ИЗМЕНЕНИЕ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ПЕРОКСИДАЗЫ
235
да, связанные с атомами, имеющими свободную
ФИНАНСИРОВАНИЕ РАБОТЫ
пару электронов, как правило, претерпевают
Исследование выполнено при финансовой
быстрый обмен с другими атомами водорода. По-
поддержке Российского фонда фундаментальных
мещение биополимеров в среду с измененным по
исследований (проект № 19-44-233005) и Госу-
дейтерию изотопным составом приводит к изме-
дарственного задания ЮНЦ РАН (№ АААА-А19-
нению соотношения 2H/1H в их составе. Так, в
119040390083-6).
водных растворах белков изотопный обмен
2H/1H происходит быстро в атомах водорода, свя-
КОНФЛИКТ ИНТЕРЕСОВ
занных с атомами азота, серы или кислорода, в то
Авторы заявляют об отсутствии конфликта
время как атомы водорода, связанные с углеро-
интересов.
дом практически не подвержены изотопному об-
мену. Изотопное замещение дейтерия на протий
протекает с минимальной скоростью в экраниро-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ванных гидрофобных участках молекулы, а также
Настоящая работа не содержит описания ка-
в составе пептидных групп, испытывающих сфе-
ких-либо исследований с использованием людей
рическое затруднение. Напротив, 2H/1H-обмен
и животных в качестве объектов.
происходит с высокой интенсивностью в функ-
циональных группах, активно взаимодействую-
СПИСОК ЛИТЕРАТУРЫ
щих с растворителем. Вероятно, при растворении
исследуемых белков в среде с пониженным со-
1.
H. L. Schmidt, R. J. Robins, and R. A. Werner, Iso-
topes in Environmental and Health Studies 51 (1), 155
держанием дейтерия происходит локальное заме-
(2015).
щение атомов дейтерия на протий в поверхност-
ной структуре белка, контактирующей с гидрат-
2.
M. I. Bykov, S. S. Dzhimak, A. A. Basov, et al., Voprosy
Pitaniia 84 (4), 89 (2015).
ной оболочкой. Такое замещение приводит к
уменьшению энергии водородной связи между
3.
D. I. Nikitin, M. N. Oranskaya, and V. I. Lobyshev,
функциональными группами аминокислотных
Biophysics 48 (4), 636 (2003).
остатков с молекулами воды. Возможно, в резуль-
4.
А. А. Киркина, В. И. Лобышев, О. Д. Лопина и др.,
тате ослабления водородных связей с молекулами
Биофизика 59 (2), 399 (2014).
растворителя амплитуда колебаний боковых
5.
A. A. Samkov, S. S. Dzhimak, M. G. Barishev, et al.,
групп аминокислот, смотрящих в гидрофильную
Biophysics 60 (1), 107 (2015).
область, увеличивается. В литературе имеются
6.
V. I. Lobyshev and L. P. Kalinichenko, Isotopic effects of
данные, что в белках тушение собственной флуо-
D2O in biological systems (Nauka, M., 1978).
ресценции может происходить за счет функцио-
7.
A. Basov, L. Fedulova, E. Vasilevskaya, and S. Dzhi-
нальных групп соседних аминокислотных остат-
mak, Molecules
24
(22),
4101
(2019). DOI:
ков [34]. Можно предположить, что усиление по-
10.3390/molecules24224101.
движности соседних аминокислотных радикалов,
8.
А. В. Косенков, М. В. Гуляев, В. И. Лобышев и др.,
окружающих тирозиновые и триптофановые
Биофизика 63 (5), 1021 (2018).
остатки, находящиеся вблизи поверхности белка,
9.
S. Rodin, P. Rebellato, A. Lundin, et al., Sci. Rep. 8
приводит к возрастанию вероятности переноса
(1), e16249 (2018). DOI: 10.1038/s41598-018-34704-0.
энергии с хромофоров на функциональные груп-
10.
A. A. Kravtsov, S. V. Kozin, and E. R. Vasilevskaya,
пы соседних акцепторов.
J. Pharmacy & Nutrition Sci. 8 (2), 42 (2018). DOI:
10.6000/1927-5951.2018.08.02.3.
Таким образом, проведенные оптические ис-
следования структуры пероксидазы хрена и бы-
11.
A. Basov, L. Fedulova, M. Baryshev, et al., Nutrients
чьего сывороточного альбумина показали, что
11 (8), 1903 (2019). DOI: 10.3390/nu11081903.
среда с пониженным содержанием дейтерия не
12.
С. В. Козин, А. А. Кравцов, А. А. Елкина и др.,
оказывает влияния на вторичную структуру дан-
Биофизика 64 (2), 362 (2019).
ных белков и не вызывает конформационных из-
13.
A. A. Basov, A. A. Elkina, A. A. Samkov, et al., Iranian
менений в структуре фермента, затрагивающих
Biomed. J.
23
(2),
129
(2019).
DOI:
его активный центр. Возможные локальные из-
10.29252/.23.2.129.
менения в поверхностной структуре белка, вы-
14.
A. Rasooli, F. Fatemi, R. Hajihosseini, et al., Pharma-
званные изотопным замещением дейтерия на
ceut.
Biol.
57
(1),
125
(2019).
DOI:
протий, вероятно, не могут стать причиной
10.1080/13880209.2018.1563622.
уменьшения ферментативной активности, на-
15.
K. Yavari and L. Kooshesh, Nutrition and Cancer 71
блюдаемой нами в двух исследованных модель-
(6),
1019
(2019). DOI:
10.1080/01635581.2019.
ных системах.
1595048.
БИОФИЗИКА том 65
№ 2
2020
236
КОЗИН и др.
16. I. M. Chernukha, L. V. Fedulova, E. A. Kotenkova,
26. О. В. Лебедева, Н. Н. Угарова и И. В. Березин,
et al., Voprosy Pitaniia 85 (5), 36 (2016).
Биохимия 42, 1372 (1977).
17. S. S. Dzhimak, А. А. Basov, А. А. Elkina, et al., Jundis-
27. N. V. Yaglova, D. A. Tsomartova, S. S. Obernikhin,
hapur J. Natural Pharmaceut. Products 13 (2), e69557
et al., Biol. Bull.
46
(1),
74
(2019). DOI:
(2018). DOI: 10.5812/jjnpp.69557.
10.1134/S1062359018060122.
18. A. A. Basov, S. V. Kozin, I. M. Bikov, et al., Biol. Bull.
28. Д. Ю. Измайлов, Е. В. Проскурина, С. А. Шишка-
46 (6), 531 (2019). DOI: 10.1134/S1062359019060049.
нов и др., Биофизика 62 (4), (2017).
19. О. Ю. Зрелов, А. В. Сыроешкин, Е. В. Успенская
29. В. В. Рогожин, Г. Д. Кутузова и Н. Н. Угарова,
и др., Хим.-фармацевт. журн. 49 (6), 51 (2015).
Биоорган. химия 26 (2), 156 (2000).
20. В. В. Гончарук, В. Б. Лапшин, Т. Н. Бурдейная
30. Ю. А. Владимров и Е. В. Проскурина, Успехи биол.
и др., Химия и технология воды 33 (1), 15 (2011).
химии 49, 341 (2009).
21. A. V. Syroeshkin, N. V. Antipova, A. V. Zlatska, et al.,
31. А. М. Поляничко, Н. В. Михайлов, Н. М. Романов
J. Trace Elements Med. Biol. 50, 629 (2018).
и др., Цитология 58 (9), 707 (2016).
22. X. Zhang, M. Gaetani, A. Chernobrovkin, et al., Mol.
32. L. M. Danilenko, Research Res. Pharmacol. 4 (1), 81
Cell Proteomics
18
(12)
2373
(2019). DOI:
(2018).
10.1074/mcp.RA119.001455.
33. О. В. Степаненко, И. М. Кузнецова, К. К. Турове-
23. М. Г. Баpышев, C. Н. Болотин и C. C. Джимак, На-
ров и др, Цитология 47 (11), 988 (2005).
ука Кубани 3, 18 (2010).
34. N. V. Yaglova, S. S. Obernikhin, D. A. Tsomartova,
24. М. Г. Баpышев, C. Н. Болотин, В. Ю. Фролов и дp.,
et al., Bull. Experim. Biol. Med. 165 (4), 508 (2018).
Экол. веcтн. науч. центpов ЧЭC, № 1, 13 (2013).
DOI: 10.1007/s10517-018-4205-8.
25. I. S. Petriev, S. N. Bolotin, V. Y. Frolov, et al., Bull.
35. J. A. Ross, W. R. Laws, and K. W. Rousslang, Topics in
Rus. Acad. Sci. 82 (7), 807 (2018).
fluorescence in spectroscopy (Springer US, 2002).
Change of Functional Activity of Horseradish Peroxidase and Bovine Serum Albumin
in Media with Various Isotopic 2H/1H Composition
S.V. Kozin*, **, A.A. Kravtsov*, **, K.K. Turoverov***, A.V. Fonin***, E.V. Chihirzhina***,
V.V. Malyshko**, ****, A.V. Moiseev*****, and A.V. Churkina*
*Kuban State University, Stavropolskaya ul. 149, Krasnodar, 350040 Russia
**Southern Scientific Center, Russian Academy of Sciences, prosp.Chekhova 41, Rostov-on-Don, 344006 Russia
***Institute of Cytology, Russian Academy of Sciences, Tikhoretsky prosp. 4, St. Petersburg, 194064 Russia
****Kuban State Medical University, Ministry of Health of the Russian Federation, ul. Sedina 4, Krasnodar, 350063 Russia
*****Kuban State Agrarian University, ul. Kalinina 13, Krasnodar, 350004 Russia
Experiments have revealed that the medium with reduced deuterium content has no effect on the secondary
structure of horseradish peroxidase and bovine serum albumin and no conformational changes occur in the
structure of these proteins. The addition of these proteins into the buffer solution prepared on deuterium-de-
pleted water led to a decrease in the intensity of intrinsic tryptophan fluorescence, while the circular dichro-
ism spectra remained virtually unchanged. At lower deuterium content in the reaction medium, there was a
decrease in the activity of the peroxidase oxidation reaction of o-dianisidine and luminol with hydrogen per-
oxide.
Keywords: deuterium, protium, isotopic metabolism, horseradish peroxidase, bovine serum albumin, intrinsic
tryptophan fluorescence, circular dichroism spectroscopy, reaction kinetics
БИОФИЗИКА том 65
№ 2
2020