БИОФИЗИКА, 2020, том 65, № 2, с. 250-258
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ИССЛЕДОВАНИИ ИЗМЕНЕНИЙ КОНФОРМАЦИИ ГЕМА
И ГЛОБИНА ПРИ ИЗМЕНЕНИИ ТЕМПЕРАТУРЫ
И НОРМОБАРИЧЕСКОЙ ГИПОКСИИ
© 2020 г. О.В. Слатинская, О.Г. Лунева, Л.И. Деев,
, Г.В. Максимов
С.Н. Орлов
Биологический факультет Московского государственного университета имени М.В. Ломоносова,
119892, Москва, Ленинские горы, 1/12
E-mail: gmaksimov@mail.ru, slatolya@mail.ru
Поступила в редакцию 29.11.2019 г.
После доработки 29.11.2019 г.
Принята к публикации 31.01.2020 г.
С помощью метода спектроскопии комбинационного рассеяния в диапазоне 1000-3000 см-1 иссле-
дованы изменения конформации гема и глобина гемоглобина эритроцитов человека при различных
температурах и содержании кислорода. Показано, что при гипоксии меняется конформация гемо-
глобина за счет увеличения вклада пиррольных колец гемопорфирина и валентных колебаний
групп винилов, а также выявлены изменения вклада валентных симметричных и ассиметричных
колебаний СН2- и СН3-радикалов аминокислот гистидина (2850, 2860, 2900 см-1) и лизина (2880,
2860 см-1). Обсуждаются механизмы связывания кислорода гемоглобином, локализованным в при-
мембранной области и цитоплазме клетки.
Ключевые слова: гемоглобин, эритроцит, комбинационное рассеяние, рамановская спектроскопия,
гипоксия.
DOI: 10.31857/S0006302920020052
но, эти изменения лежат в основе механизма не
Известно, что одной из причин развития пато-
только изменения структурной целостности мем-
логии в тканях является гипоксия, которая зави-
браны, выброса аденозинтрифосфата, но и изме-
сит от ряда факторов - скорости кровотока, диа-
нения упорядоченности молекул Гб в цитоплазме
метра сосудов, взаимодействия эритроцитов с
клетки [6, 7].
клетками эндотелия, а также свойствами гемо-
глобина (Гб) [1]. В частности, скорость кровотока
Очевидно, что для понимания развития гипо-
зависит от деформируемости эритроцитов и вы-
ксии на клеточном уровне необходимо исследо-
хода аденозинтрифосфата, стимулирующего пу-
вать изменения конформации гема и глобина ге-
ринергические рецепторы и каскад реакций в эн-
моглобина при переносе O2 в эритроцит. Одним
дотелиальных клетках сосудов, сопровождаю-
из методов, позволяющих оценить одновремен-
щийся выходом вазорелаксантов [2]. Ключевым
ное изменение конформации гема и структуры
звеном регуляции внутриклеточных процессов в
глобина Гб, является метод спектроскопии ком-
самом эритроците является Гб, который в ком-
бинационного рассеяния (КР), используемый
плексе с цитоплазматическим доменом белка по-
как для исследования деформации метиновых
лосы 3 фиксирует О2 в мембране [3, 4]. Так как ге-
групп порфиринового макроцикла гема, так и для
моглобин является единственным О2-связываю-
оценки вклада валентных колебаний СН-групп
аминокислот гемоглобина и белков плазматиче-
щим белком в эритроцитах, то обратимая
ской мембраны эритроцита (табл. 1) [8-11].
ассоциация дезоксигенированного Гб с последу-
ющими звеньями внутриклеточной сигнализа-
В работе исследовали изменения конформа-
ции может рассматриваться как механизм запус-
ции гема и его ближайшего белкового окружения
ка O2-зависимых процессов в эритроците [5].
в глобине при нормобарической гипоксии и воз-
действии температуры.
Важно, что при гипоксии было обнаружено изме-
нение содержания других ассоциированных с
мембраной цитоплазматических белков. Возмож-
МАТЕРИАЛЫ И МЕТОДЫ
Сокращения: Гб — гемоглобин, КР — комбинационное
Объектом исследования служили раствор гемо-
рассеяние.
глобина, суспензия эритроцитов и тени эритро-
250
ИССЛЕДОВАНИИ ИЗМЕНЕНИЙ КОНФОРМАЦИИ ГЕМА
251
Таблица 1. Полосы спектра КР гемопорфирина гемоглобина при возбуждении лазером 532 нм и соответствие
полос с колебаниями связей порфирина
Частотный сдвиг, см-1
Тип симметрии колебаний
Причина изменения
v30,
Редокс-состояние железа (Fe2+),
1172
симметричные колебания
присутствие лиганда
пиррольных полуколец
v4, A1g,
Редокс-состояние железа (Fe2+),
1375
симметричные колебания
присутствие лиганда
пиррольных полуколец
Спиновое состояние железа (Fe3+),
1548-1552
A2g
диаметр гемоглобина
v19, А2g асимметричные колебания
Низкоспиновое состояние железа (Fe3+),
1580-1588
метиновых мостиков между
диаметр гемоглобина
пирролами
2850
A1g
Симметричное растяжение CH
2880
A1g
Асимметричное растяжение CH
2930 (оксигемоглобин)
Симметричное СН3 — растяжение,
также С-Н-колебания от СН-боковой цепи
A1g
свободной аминокислотной группы.
2940
(дезоксигемоглобин)
Зависят от изменения внешнего воздействия
или температуры
Примечание. Таблица составлена на основании данных работ [11, 12-16].
цитов, выделенные из крови здоровых доноров
12000 g в течение 30 мин при температуре 4°С. Со-
(n = 10, возраст 20-40 лет). Кровь забирали нато-
держание теней оценивали по концентрации
щак из локтевой вены в вакуумные пробирки Vac-
мембранных белков методом Лоури [17], оно со-
uette (Greiner Bio-One, Австрия). В качестве анти-
ставило 4.9 ± 0.4 мг/мл.
коагулянта использовали гепарин (20-50 Ед/мл
Вытеснение кислорода из суспензии эритроци-
крови). После забора кровь хранили при темпера-
тов и раствора гемоглобина проводили газовой
туре 4°С. Осаждение форменных элементов кро-
смесью, содержащей азот и 0.04% СО2 (ООО
ви проводили центрифугированием при 1500 g в
течение 10 мин при температуре 4°С на лабора-
«ПГС-сервис», Россия). Вытеснение проводили
торной центрифуге Laborfuge 400R (Thermo Sci-
путем продувки газовой смесью через газовую
entific, США). Плазму и лейкоциты удаляли, оса-
фазу над пробой в течение 20 мин (скорость пото-
док трехкратно отмывали буфером А следующего
ка газовой смеси 0.1 л/мин [18] при постоянном
состава (145мМ NaCl, 5мМ KCl, 1мМ раствора
перемешивании и комнатной температуре. Ис-
CaCl2, 4мM Na2HPO4, 1 мM NaH2PO4, 1мМ
пользуемые в работе параметры вытеснения кис-
MgSO4, 5 мМ глюкозы, рН 7.0). Выделенную сус-
лорода позволяют получить пробы суспензии
эритроцитов и раствора гемоглобина в состоянии
пензию эритроцитов (Ht = 40%) хранили при тем-
нормобарической гипоксии, поскольку после
пературе 4°С и использовали в течение трех часов.
вытеснения в пробах присутствовал главным об-
Для выделения гемоглобина к суспензии эритро-
разом дезоксигемоглобин (определяли путем ре-
цитов добавляли фосфатный буфер
(4 мM
гистрации и анализа спектров КР, методику см.
Na2HPO4, 1 мM NaH2PO4, рН 7.4) в десятикрат-
ниже). Контрольные пробы суспензии эритроци-
ном объеме, после чего суспензию тщательно пе-
тов и раствора гемоглобина (нормоксия) были
ремешивали и центрифугировали при 6000 g в те-
приготовлены в таких же условиях, но вместо га-
чение 10 мин при температуре 4°С. Супернатант
зовой смеси без кислорода использовали воздух.
отделяли и хранили при 4°С. Концентрацию ге-
Образцы помещали в стеклянные гематокритные
моглобина в растворе определяли по оптической
капилляры с диаметром поперечного сечения
плотности, измеренной на спектрофотометре Hi-
1 мм (ООО «Агат-Мед», Россия). Все манипуля-
tachi 557 (Hitachi, Япония) при длине волны
ции при заполнении капилляров осуществляли в
415 нм.
герметичном боксе при постоянной подаче газо-
вой смеси (азот с 0.04% СО2). Для нормализации
Тени эритроцитов получали трехкратной от-
мывкой осадка после гемолиза эритроцитов при
избыточного давления гипоксической смеси в
БИОФИЗИКА том 65
№ 2
2020
252
СЛАТИНСКАЯ и др.
боксе применяли воздушный клапан с порогом
(характеризует изменение полярности окруже-
срабатывания около 1 атм. Продувку предвари-
ния аминокислот).
тельно помещенных в бокс гематокритных ка-
Для регистрации ζ-потенциала суспензии эрит-
пилляров проводили в течение 2 мин. Контроль
роцитов, который характеризует изменение по-
парциального давления кислорода в газовой сме-
верхностного заряда клетки [20], использовали
си внутри бокса осуществляли при помощи элек-
Zetasizer Nano ZS (Malvern Instruments Ltd., Вели-
трода КЕ-25 (Figaro Engineering Inc., Япония).
кобритания). Для этого 1 мл суспензии эритроци-
После заполнения капилляры герметично запаи-
тов (Нt = 40%) помещали в пластиковую кювету с
вались и хранились при температуре 4°С не
золотыми электродами для регистрации ζ-потен-
более 3 ч.
циала и тщательно перемешивали во избежание
Исследование конформации гема и глобина ге-
образования пузырей воздуха или скопления
моглобина проводили методом спектроскопии
эритроцитов в одной из частей кюветы. Измере-
комбинационного рассеяния. Спектры КР реги-
ния проводили в термостатируемой ячейке при
стрировали с помощью конфокального микро-
температуре 25 и 36°С, время адаптации образца к
скоп-спектрометра NTEGRA-SPECTRA (NT-
температуре - 60 с, количество снятых измере-
MDT, Зеленоград, Россия) в диапазоне 1000-
ний - 100. Для обработки результатов использо-
3000 см-1, с шагом измерения 0.8 см-1, регистра-
вали программное обеспечение Malvern, постав-
ляемое в комплекте с прибором, и программу MS
тор
- ССD-детектор с пельтье-охлаждением
Excel.
‒50°С (объектив 5× с апертурой 0.15, решетка
600 штр./мм), мощность лазера на образце 3 мВт,
длина волны возбуждения 532 нм, время реги-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
страции одного спектра - 15 с, количество накоп-
лений сигнала - 3. Изменение температуры про-
В ходе исследования установлено, что спектры
водили в диапазоне 22-36°С в ячейке прибора,
КР гемоглобина в растворе и в суспензии эритро-
время адаптации образца к температуре - 5 мин.
цитов имеют характерные полосы в области
Спектры КР обрабатывали в программе Ori-
1000-3000 см-1 (рис. 1). В отсутствие гемоглоби-
gin2017 (OriginLab Corp., США). Обработка сиг-
на в спектре КР теней эритроцитов были выявле-
нала включала в себя вычитание базовой линии и
ны только полосы в области 2800-3100 см-1, обу-
сглаживание спектров. Лазер с длиной волны воз-
словленные валентными колебаниями связей
буждающего света 532 нм был выбран для мини-
СН-групп аминокислот (рис. 1 и 2а, табл. 1) [16,
мизации вклада в спектр КР сигналов от липидов
21]. Вероятно, полосы КР-спектра в области
и белков мембраны эритроцитов [11, 16, 17].
2800-3100 см-1 обусловлены валентными сим-
Для оценки вклада различных групп молекулы
метричными и ассиметричными колебаниями
гемоглобина использовали величины соотноше-
СН2- и СН3-радикалов аминокислот гистидина
ний интенсивностей полос спектра КР (табл. 1)
[8, 11, 18, 19]:
(2850, 2860, 2900 см-1) и лизина (2880, 2860 см-1)
[16, 22-25].
•I1375/I1127 - вклад боковых -СН3-групп коле-
баний полуколец пиррола в гемопорфирине, вы-
На наш взгляд, перенос молекулы кислорода
раженных при изменении конформации глобина
из внешней среды в эритроцит осуществляется в
в непосредственной близости от гема, характери-
несколько этапов: сначала кислород проникает в
зует выраженность симметричных и ассиметрич-
липидный бислой плазматической мембраны, за-
ных колебаний пиррольных полуколец (измене-
тем координируется в гемопорфириновом цикле
ние величины соотношения характеризует изме-
дезоксигемоглобина, фиксированным в белке
нение конформации гемоглобина из T
полосы 3, и, наконец, оксигемоглобин десорби-
(дезоксигемоглобин) в R (оксигемоглобин);
рует с молекулой кислорода в клетку, где осу-
ществляются белок-белковые взаимодействия,
•I1580/I1550 - вклад колебаний метиновых мо-
меняющие способность гема фиксировать моле-
стиков между пирролами в гемопорфирине, вы-
кулу кислорода. Таким образом, в ходе этого про-
раженных при деформации макроцикла (характе-
цесса должна сначала меняться конформация ге-
ризует сродство Гб к лигандам, в частности к кис-
ма, а затем конформация глобина.
лороду);
Для проверки данного предположения кон-
•I2850/I2880 - вклад симметричных колебаний
тролировали изменения конформации гема при
к несимметричным колебаниям метиленовых
вытеснении кислорода из среды инкубации с вы-
групп аминокислот;
деленным гемоглобином и суспензией эритроци-
тов, регистрируя КР-спектр в области 1000-
•I2930/I2850 - вклад колебаний симметричных
1800 см-1. Были выявлены характерные различия
концевых метиленовых групп к симметричным
колебаниям метиленовых групп аминокислот
в изменениях амплитуды полос 1355 и 1375 см-1 в
БИОФИЗИКА том 65
№ 2
2020
ИССЛЕДОВАНИИ ИЗМЕНЕНИЙ КОНФОРМАЦИИ ГЕМА
253
(а)
1552 1585
Суспензия эритроцитов
5.0
Раствор гемоглобина
Разностный спектр
4.0
1375
1355
3.0
1127
2.0
2880 2930
2850
2960
1.0
0.0
1000
1200
1400
1600
2800
2900
3000
Частотный сдвиг, см-1
(б)
1552 1585
Суспензия эритроцитов
Раствор гемоглобина
5.0
Разностный спектр
2880
4.0
13551375
2850
2930
3.0
1127
2960
2.0
1.0
0.0
1000
1200
1400
1600
2800
2900
3000
Частотный сдвиг, см-1
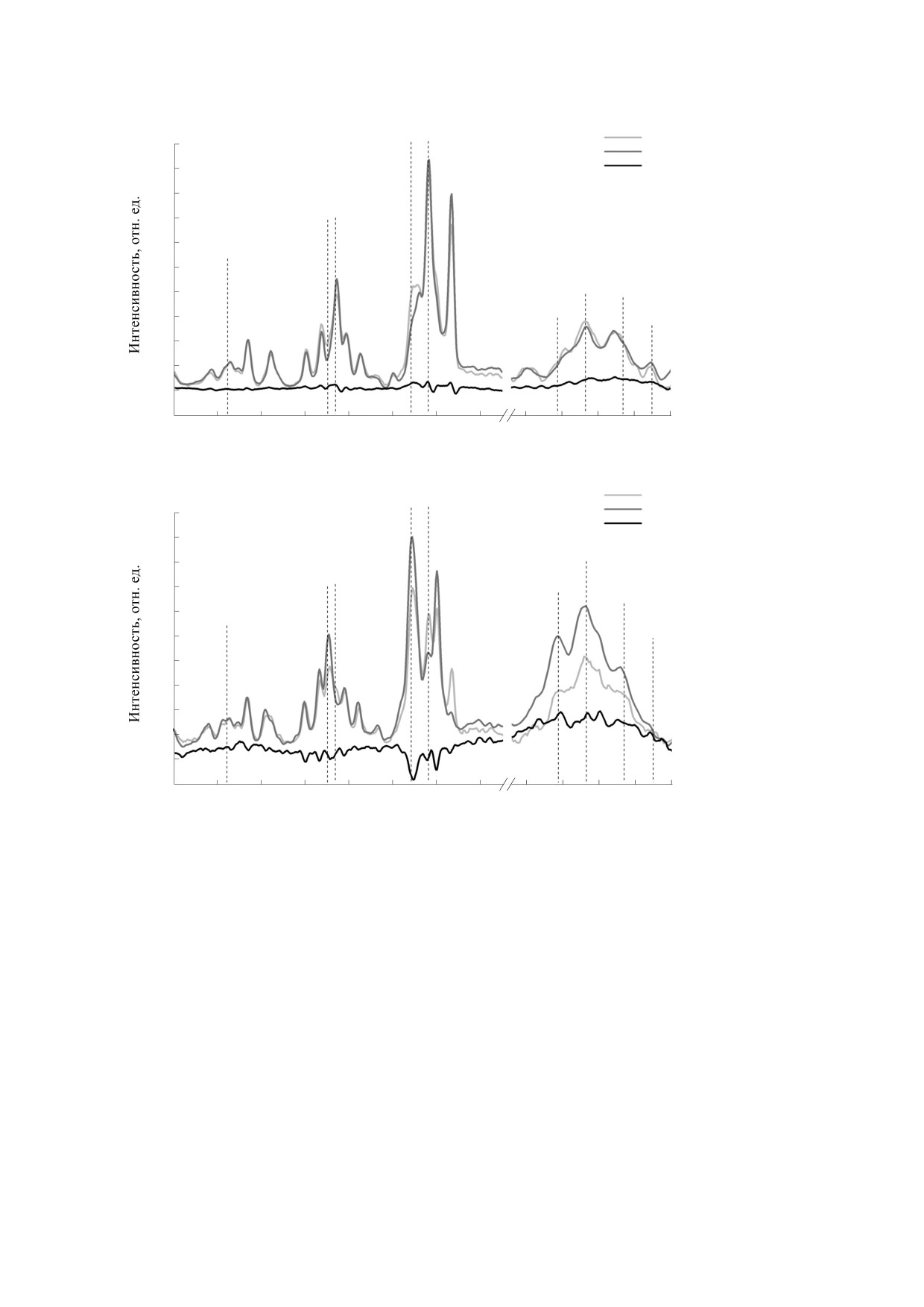
Рис. 1. Спектры КР гема и глобина в состоянии нормоксии (а) и гипоксии (б) суспензии эритроцитов и раствора Гб,
область 1000-3000 см-1. Спектры нормированы на полосу 1220 см-1 (в соответствии с работой [9]).
области 1300-1400 см-1, 1552 и 1580 см-1 - в об-
В области 2800-3000 см-1 КР-спектра (об-
ласть валентных колебаний СН-связей амино-
ласти 1500-1650 см-1 (рис. 3) [13, 22]. Так, при ги-
кислот глобина) были выявлены изменения вкла-
поксии изменения в области 1500-1650 см-1 для
да полос 2850 и 2880 см-1, более выраженные для
выделенного Гб были более выражены, чем у Гб в
выделенного гемоглобина (на 13.20 ± 0.23%), чем
эритроцитах (на 14.20 ± 0.52%). В то же время в
для гемоглобина в клетке [12, 21] (рис. 2 и 3;
области 1300-1400 см-1 у выделенного Гб интен-
табл. 1). Известно, что при гипоксии изменения в
сивность спектра КР на 16.03 ± 0.45% выше, чем у
области КР-спектра от 200 до 500 см-1 обусловле-
Гб в эритроцитах. Важно, что в области 1300-
ны связью Fe-His, что также подтверждается на-
1450 см-1 при гипоксии у Гб в клетке наблюдает-
шими данными по изменениям вклада гистидина
ся сдвиг ряда полос КР-спектра, что характерно
в области 2800-3000 см-1 [25, 27]. Отметим, что
для изменения длины сопряжения двойных свя-
зей пиррольных колец гемопорфирина гема.
при нормоксии и гипоксии полосы 2850 см-1 и
БИОФИЗИКА том 65
№ 2
2020
254
СЛАТИНСКАЯ и др.
(а)
Суспензия эритроцитов (гипоксия)
Суспензия эритроцитов (нормоксия)
Раствор гемоглобина (гипоксия)
2880
Раствор гемоглобина (нормоксия)
1400
2900
2930
Тени эритроцитов
2855
1200
(б)
2845
22°С
-30
36°С
1000
*
2968
*
800
2942
-20
600
400
-15
200
0
-10
Нормоксия Гипоксия
2800
2840
2880
2920
2960
3000
Частотный сдвиг, см-1
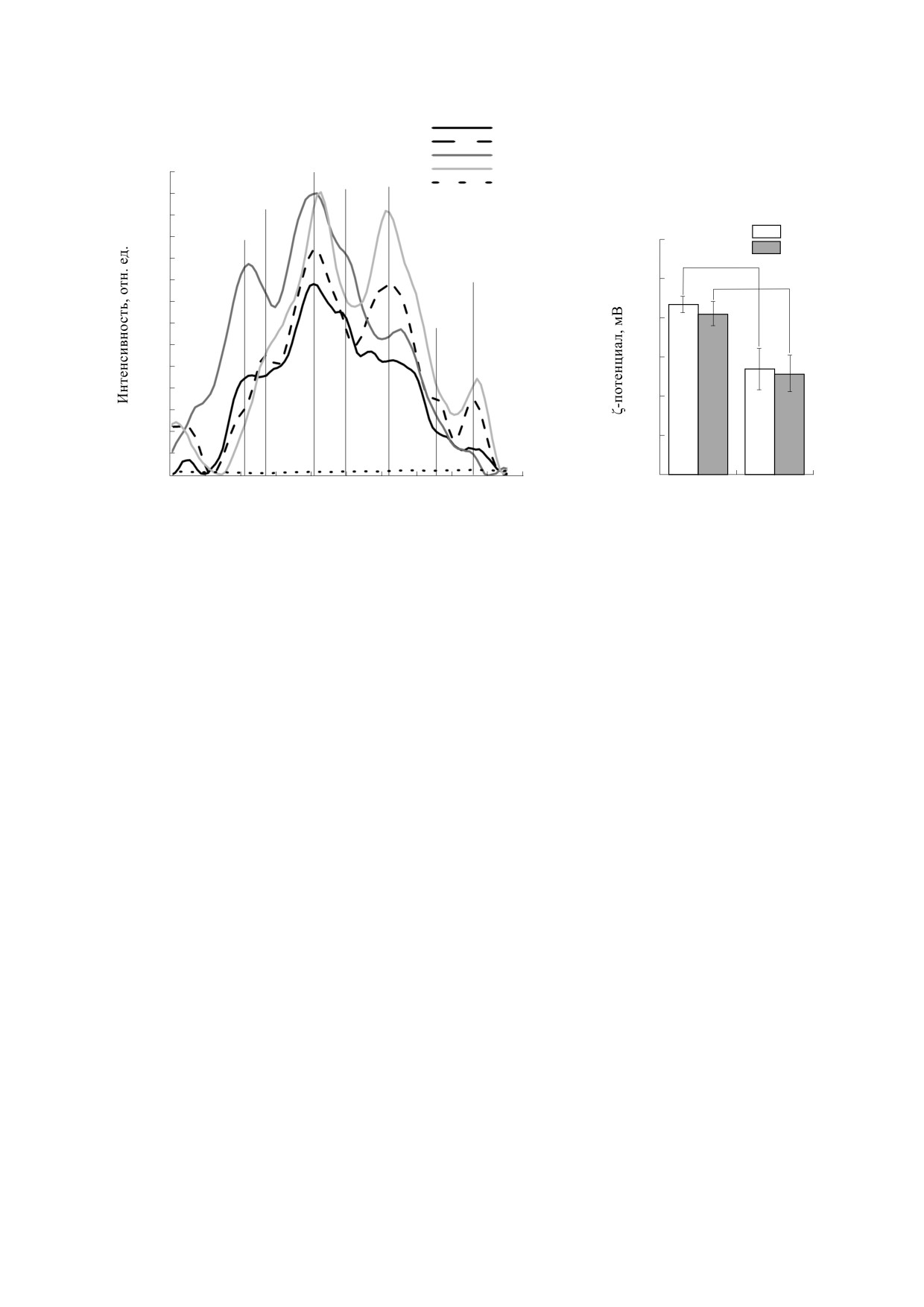
Рис. 2. (а) - Область спектра КР валентных колебаний в суспензии эритроцитов, растворе Гб и тенях эритроцитов в
состоянии нормоксии и гипоксии в области 1000-3000 см-1, спектры не нормированы; (б) - ζ-потенциал мембраны
эритроцита в условиях нормоксии и гипоксии (* - р ≤ 0.05).
колец гема (снижение на 32.86 ± 0.45 %), которые
2930 см-1 выделенного Гб смещены в более высо-
не обнаружены в суспензии эритроцитов.
кочастотную область по сравнению с Гб в клет-
ках, что может быть обусловлено изменением
При гипоксии (снижении доли комплексов
конформации глобина за счет увеличения упоря-
оксигемоглобина в пробе) гем меняет свою кон-
доченности расположения молекул в клетке по
формацию за счет вклада пиррольных колец (уве-
сравнению с раствором [21].
личение I1375/I1172, на 21.07 ± 0.18%) и валентных
колебаний групп винилов (увеличение I1580/I1550
В данной работе изменения конформации гло-
на 20.26 ± 0.17%) в суспензии эритроцитов и вы-
бина инициировали за счет увеличения темпера-
деленного Гб (на17.60 ± 0.68% и 15.08 ± 0.53% со-
туры раствора с гемоглобином или суспензией
ответственно). Отметим, что изменения в гемо-
эритроцитов. Известно, что в температурном
вой части Гб более выражены для суспензии
диапазоне 22-36°С отсутствуют фазовые перехо-
эритроцитов, чем для выделенного гемоглобина,
ды липидов в плазматической мембране эритро-
что, вероятно, свидетельствует об эффекте боль-
цита [15, 19]. В связи с этим возможно, что изме-
шей упорядоченности молекул гемоглобина в
нения спектра КР суспензии эритроцитов в
клетке, чем в растворе. Также в глобине гемогло-
области 2800-3000 см-1 будут связаны исключи-
бина клетки при гипоксии возрастает вклад по-
тельно с изменением белков, в первую очередь ге-
лярного окружения аминокислот (увеличение со-
моглобина [18, 27] (табл. 2, рис. 4). При увеличе-
отношения I2930/I2850), но не меняется плотность
нии температуры на фоне нормоксии (рис. 5) вы-
упаковки белка (I2850/I2880) [11]. В аналогичных
явлены существенные различия в изменении
условиях у глобина выделенного Гб меняется как
конформации гема и глобина в зависимости от
плотность упаковки, так и полярность окружения
упаковки молекул Гб (суспензия эритроцитов
глобина.
или раствор гемоглобина): вклад пиррольных ко-
лец и винильных групп снижается в эритроците, а
в глобине существенно увеличивается плотность
ЗАКЛЮЧЕНИЕ
упаковки белка и снижается полярность окруже-
ния. Так, нами показано, что увеличение темпе-
В данной работе исследовали молекулярный
ратуры существенно меняет величину соотноше-
механизм изменения конформации гема и глоби-
ния I1375/I1172 КР-спектра Гб в растворе, что соот-
на в эритроците, который чувствителен к измене-
ветствует изменению конформации пиррольных ниям парциального давления O2 и определяет
БИОФИЗИКА том 65
№ 2
2020
ИССЛЕДОВАНИИ ИЗМЕНЕНИЙ КОНФОРМАЦИИ ГЕМА
255
(а)
1552 1585
Гипоксия
Нормоксия
5.0
Разностный спектр
2880
4.0
13551375
2850
2930
3.0
1127
2960
2.0
1.0
0.0
1000
1200
1400
1600
2800
2900
3000
Частотный сдвиг, см-1
(б)
Гипоксия
1552 1585
Нормоксия
5.0
Разностный спектр
2880
4.0
13551375
2850
2930
3.0
1127
2960
2.0
1.0
0.0
1000
1200
1400
1600
2800
2900
3000
Частотный сдвиг, см-1
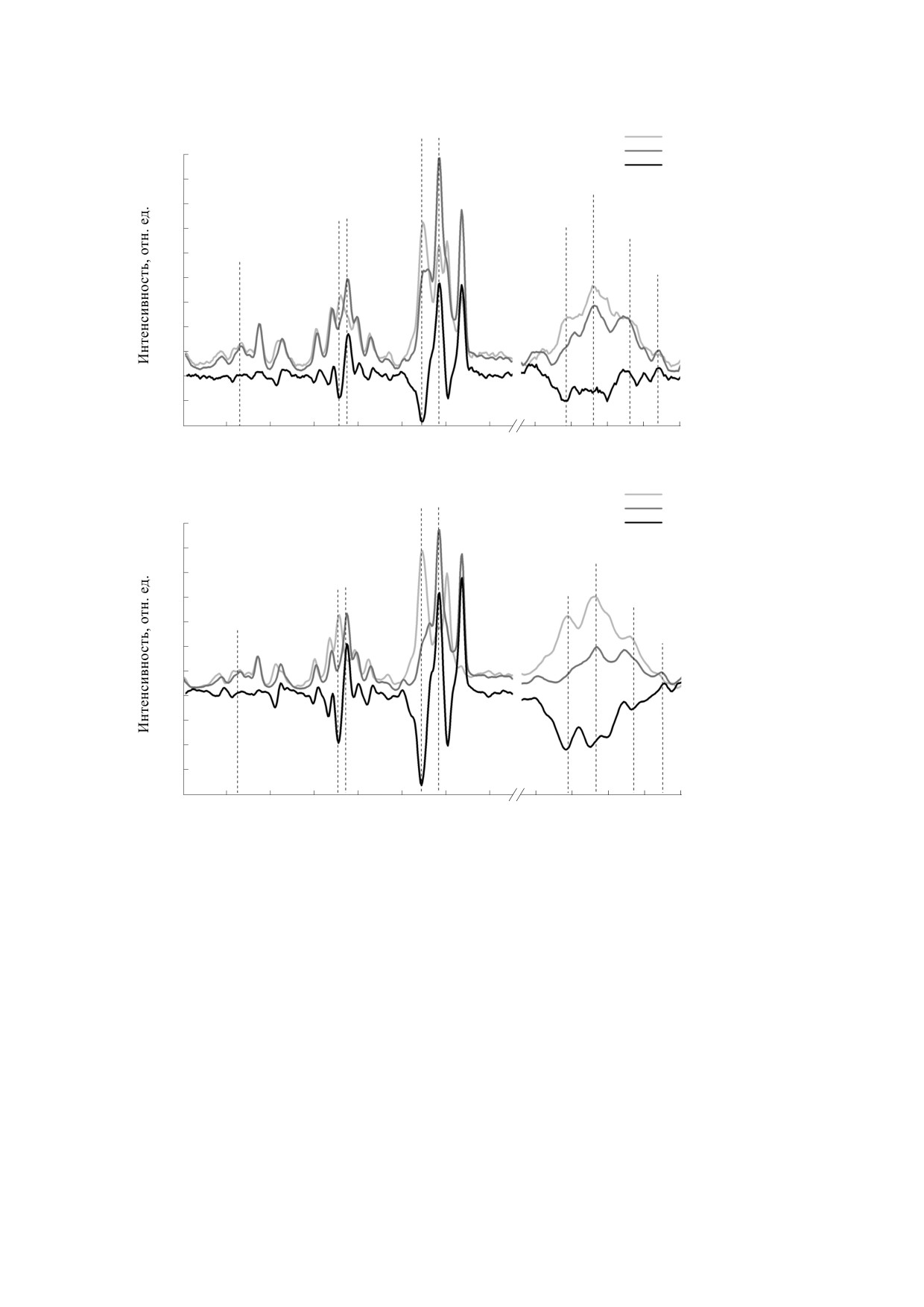
Рис. 3. Спектры КР суспензии эритроцитов (а) и раствора гемоглобина (б) в условиях нормоксии и гипоксии и их
разностный спектр. Спектры нормированы на максимум полосы 1220 см-1 (в соответствии с работой [9]).
формирование комплекса Гб с белком полосы 3, а
[27]. Важно, что при гипоксии (снижение числа
также олигомеризацию гемоглобина в цитоплаз-
комплексов гема с О2) меняется конформация ге-
ме. Известно, что Гб связывается с мембранами
мопорфирина за счет увеличения вклада пир-
эритроцитов с большим сродством, чем оксиге-
рольных колец гемопорфирина и валентных ко-
моглобин, при этом N-конец белка полосы 3 ло-
лебаний групп винилов [9, 28]. Нами выявлены
кализуется в центральной полости тетрамера Гб,
изменения вклада расположенных близко к гему
которая недоступна при оксигенации Гб. Извест-
аминокислот гистидина и лизина в глобине: сме-
но, что NH2-терминальный участок белка
щение полосы 2930 см-1 до 2940 см-1, вероятно,
полосы 3 имеет анионный сегмент и может вхо-
за счет изменения конформации глобина и уве-
дить в катионную центральную полость дезокси-
личения вклада лизина [21]. Таким образом, со-
гемоглобина, которая значительно сужается при
стояние гипоксии характеризуется изменением
связывании O2 (это снижает сродство O2 к Гб)
конформации и способности гемопорфирина Гб
БИОФИЗИКА том 65
№ 2
2020
256
СЛАТИНСКАЯ и др.
Таблица 2. Изменение конформации гема и глобина при различном парциальном давлении О2
Температура
22°С
22-36°С
Соотношение
Суспензия
Суспензия
Выделенный Гб
Выделенный Гб
эритроцитов
эритроцитов
При гипоксии вклад
При гипоксии вклад
Колебания пирролов в
Колебания пирролов в
пирролов возрастает,
пирролов снижается,
I1375/I1127
отсутствие О2 менее
отсутствие О2 менее
при нормоксии не
при гипоксии
выражена
выражена
меняется
неизменно
При гипоксии вклад
При гипоксии вклад
валентных колебаний
валентных колебаний
Колебания винильных
Колебания винильных
винильных групп
винильных групп не
I1580/I1550
групп в отсутствие О2
групп в отсутствие О2
возрастает, при
меняется, при
менее выражена
менее выражена
нормоксии не
нормоксии
меняется
увеличивается
Вклад валентных
Вклад валентных
Вклад валентных
колебаний СН-
колебаний СН-
колебаний СН-
радикалов
радикалов
Вклад валентных
радикалов аминокислот
аминокислот при
аминокислот
колебаний СН-
I2850/I2880
более выражен,
дезоксигемоглобине
более выражен,
радикалов аминокислот
снижается плотность
не меняется, при
снижается плотность
не меняется
упаковки белка при
оксигемоглобине
упаковки белка при
отсутствии О2
снижается плотность
отсутствии О2
упаковки белка
Полярность
окружения при
Снижается в
Снижается в состоянии
нормоксии
Полярность окружения
I2930/I2850
состоянии гипоксии
гипоксии
снижается, при
не меняется
гипоксии
увеличивается
связывать О2. При увеличении температуры
Все это происходит в плазматической мембра-
должны наблюдаться изменения конформации
не эритроцита, и изменение конформации гема и
глобина при связывании кислорода может отра-
белков клетки, в первую очередь глобина. В клет-
жаться на величине поверхностного заряда мем-
ке (но не в выделенном Гб) при изменении темпе-
браны [20]. Действительно, ζ-потенциал в усло-
ратуры на фоне гипоксии увеличивается вклад
виях нормоксии составляет -20.8 ± 0.5 мВ и
колебания винильных групп и пиррольных колец
16.7 ± 1.3 мВ в условиях гипоксии (рис. 2б). Та-
гема. Отметим, что зависимые от температуры из-
ким образом, в условиях гипоксии происходит
менения конформации глобина при гипоксии,
увеличение поверхностного потенциала мембра-
вероятно, возможны за счет полярного окруже-
ны, что может быть обусловлено взаимодействи-
ния аминокислот (I2930/I2850) [11]. Мы связываем
ем дезоксигемоглобина с мембраной через белок
это с изменениями структуры белков мембраны и
полосы 3 и возможными структурными измене-
цитоплазмы, так как при этих температурах фазо-
ниями мембраны.
вые переходы в липидах мембраны клетки не вы-
явлены [17]. Вероятно, при связывании кислоро-
Другим элементом внутриклеточной сигналь-
да изменения конформации гема и расположения
ной системы эритроцитов является обусловлен-
близлежащих к гему аминокислот Гб (например,
ное гипоксией изменение сродства к мембране не
гистидина и лизина) меняют локализацию ани-
только Гб, но и целого ряда цитоплазматических
онного сегмента белка полосы 3 вследствие изме-
белков [7, 18]. В зависимости от упорядоченности
нения расположения аминокислот или увеличе-
молекул Гб в цитоплазме по сравнению с выде-
ния плотности отрицательного заряда в цен-
ленным в раствор гемоглобином меняется как
тральной полости Гб.
конформация гема (за счет валентных колебаний
БИОФИЗИКА том 65
№ 2
2020
ИССЛЕДОВАНИИ ИЗМЕНЕНИЙ КОНФОРМАЦИИ ГЕМА
257
*
9.0
8.0
Нормоксия, 22°С
7.0
Нормоксия, 36°С
Гипоксия, 22°С
6.0
Гипоксия, 36°С
5.0
*
4.0
2.0
*
*
*
1.0
I
1375
/I
1172
I
1580
/I
1550
I
2850
/I
2880
I
2930
/I
2850
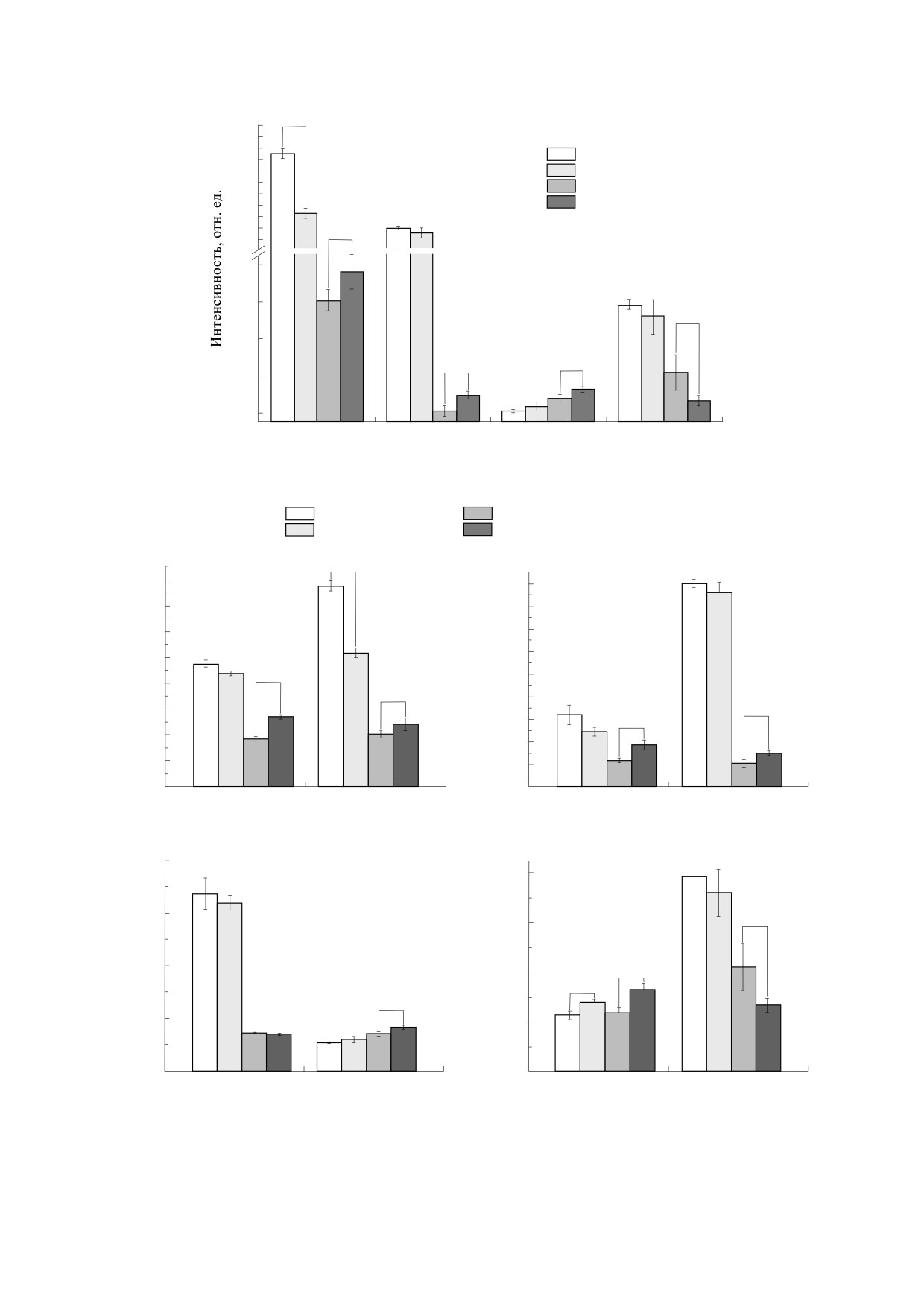
Рис. 4. Соотношения интенсивностей полос спектра КР раствора Гб при нормоксии (* - р ≤ 0.05).
Нормоксия, 22°С
Гипоксия, 22°С
Нормоксия, 36°С
Гипоксия, 36°С
I
/I
1375
1172
I
/
I
1580
1550
*
8.0
4.5
7.0
4.0
3.5
6.0
3.0
5.0
*
2.5
4.0
*
2.0
3.0
*
1.5
*
2.0
1.0
1.0
0.5
0.0
0.0
Суспензия
Суспензия
Гемоглобин
Гемоглобин
эритроцитов
эритроцитов
I
/I
I
/
I
2850
2880
2930
2850
4.0
2.0
3.0
1.5
*
2.0
1.0
*
*
*
1.0
0.5
0.0
0.0
Суспензия
Суспензия
Гемоглобин
Гемоглобин
эритроцитов
эритроцитов
Рис. 5. Соотношения интенсивностей полос спектра КР в области гема (вверху) и глобина (снизу) для суспензии
эритроцитов и раствора Гб в условиях нормоксии при температурах 22 и 36°C (* - p ≤ 0.05). Пояснения в тексте.
БИОФИЗИКА том 65
№ 2
2020
258
СЛАТИНСКАЯ и др.
пиррольных колец, связей винильных групп), так
10.
G. V. Maksimov, N. V. Maksimova, A. A. Churin,
и глобина (за счет плотности его упаковки).
et al., Biochemistry (Moscow) 66 (3), 295 (2001)
11.
S. C. Goheen, L. J. Lis, O. Kucuk, et al., J. Raman
Spectroscopy 24 (9), 275 (1993)
КОНФЛИКТ ИНТЕРЕСОВ
12.
N. Parthasarathi, C. Hansen, S. Yamaguchi, et al., J.
Авторы заявляют об отсутствии конфликта
Am. Chem. Soc. 109 (13), 3865 (1987)
интересов.
13.
B. R. Wood, P. Caspers, G. J. Puppels, et al., Anal.
Bioanal. Chem. 387 (5), 1691 (2007)
14.
S. Nagatomo, M. Nagai, Y. Mizutani, et al., Biophys. J.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
89 (2), 1203 (2005)
Все процедуры, выполненные в исследовании
15.
S. Choi, T. G. Spiro, K. C. Langry, et al., J. Am. Chem.
с участием людей, соответствовали этическим
Soc. 104 (16), 4345 (1982)
стандартам Хельсинкской декларации 1964 г. и ее
16.
N. K. Howell, G. Arteaga, S. Nakai, et al., J. Agricult.
последующим изменениям. От участников иссле-
Food Chem. 47 (3), 924 (1999)
дования было получено информированное доб-
17.
H. Lowry, N. J. Rosebrough, A. L. Farr, et al., J. Biol.
ровольное согласие.
Chem. 193, 265 (1951)
18.
S. V. Sidorenko, R. H. Ziganshin, O. G. Luneva, et al.,
J. Proteomics 184, 25 (2018)
СПИСОК ЛИТЕРАТУРЫ
19.
I. P. Torres Filho, J. Terner, R. N. Pittman, et al., J.
1. D. Holly and B. Glenn, Am. J. Physiol. Heart Circ.
Appl. Physiol. 104 (6), 1809 (2008)
Physiol. 293, 2193 (2007)
20.
I. A. Tikhomirova, A. V. Murav’ev, L. A. Mikhailichen-
2. M. R. Hardeman, P. T. Goedhart, and S. K. Shin, in
ko, et al., Human Physiol. 32(6), 748 (2006)
Handbook of Hemorheology and Hemodynamics (IOS
21.
K. M. Marzec, D. Perez-Guaita, M. De Veij, et al.,
Press Ebooks, 2007), pp. 242-266.
ChemPhysChem 15 (18), 3963 (2014)
3. J. A. Walder, R. Chatterjee, T. L. Steck, et al., J. Biol.
Chem. 259 (16), 10238 (1984).
22.
B. R. Wood, L. Hammer, and D. McNaughton, Vibra-
tional Spectroscopy 38 (1-2), 78 (2005)
4. R. A. Reithmeier, J. R. Casey, A. C. Kalli, et al. Bio-
chim. Biophys. Acta - Biomembranes 1858 (7), 1507
23.
J. Surmacki, R. Musial, R. Kordek, et al., Mol. Cancer
(2016
12 (1), 48 (2013)
5. R. R. Tuck, J. D. Schmelzer, and P. A. Low, Brain 107
24.
M. Nagai, N. Mizusawa, T. Kitagawa, et al., Biophys.
(3), 935 (1984)
Rev. 10 (2), 271 (2018)
6. O.G. Luneva, S. V. Sidorenko, O. O. Ponomarchuk,
25.
J. M. Friedman, T. W. Scott, R. A. Stepnoski, et al.,
et al., Cell. Physiol. Biochem. 39 (1), 81 (2016)
J. Biol. Chem. 258 (17), 10564 (1983)
7. S. V. Sidorenko, O. G. Luneva, T. S. Novozhilova,
26.
S. Nagatomo, M. Nagai, and T. Kitagawa, J. Am.
et al., Biochemistry, Suppl. Ser. A 12 (2), 114 (2018)
Chem. Soc. 133 (26), 10101 (2011)
8. N. A. Brazhe, S. Abdali, A. R. Brazhe, et al., Biophys.
27.
С. Н. Орлов, Бюл. сибирской медицины 18 (2), 234
J. 97 (12), 3206 (2009)
(2019)
9. B. R. Wood and D. McNaughton, Biopolymers 67 (4-
28. A. A. Semenova, A. P. Semenov, E. A. Gudilina, et al.,
5), 1691 (2002)
Mendeleev Communications 26 (3), 177 (2016)
Study of Conformational Changes in Heme and Globin in Temperature Variation
and Normobarical Hypoxia
O.V. Slatinskaya, O.G. Luneva, L.I. Deev,
, and G.V. Maksimov
S.N. Orlov
Faculty of Biology, Lomonosov Moscow State University, Leninskie Gory 1/12, Moscow, 119892 Russia
Combined dynamic light scattering and Raman spectroscopy approach in the 1000-3000 cm-1 spectral range
was applied in the study of conformational and structure changes in the heme group and globin of the hemo-
globin protein in human red blood cells at various temperatures and oxygen content. It is shown that in hy-
poxia, the conformation of hemoglobin changes as the contribution of the pyrrole rings of hematoporphyrin
and vibrational motions of the molecules in the vinyl groups increase. Also, we revealed modification in the
contribution of symmetric and asymmetric vibrations of the CH2/CH3 radicals of histidine (2850, 2860,
2900 cm-1) and lysine (2880, 2860 cm-1) amino acids. Mechanisms of binding of oxygen by hemoglobin, lo-
calized in the submembrane region and cytoplasm of cells are discussed.
Keywords: hemoglobin, red blood cells, combined dynamic light scattering, Raman spectroscopy, hypoxia
БИОФИЗИКА том 65
№ 2
2020