БИОФИЗИКА, 2020, том 65, № 2, с. 290-299
БИОФИЗИКА КЛЕТКИ
УДК 577.352.4, 577.344
ТЕЧЕНИЕ ЦИТОПЛАЗМЫ КАК ВНУТРИКЛЕТОЧНЫЙ КОНВЕЙЕР:
ВЛИЯНИЕ НА ФОТОСИНТЕЗ И ПОТОКИ Н+ В КЛЕТКАХ Chara
© 2020 г. А.А. Булычев, А.В. Алова, Н.А. Крупенина, А.Б. Рубин
Биологический факультет Московского государственного университета имени М.В. Ломоносова,
119991, Москва, Ленинские горы 1/12
E-mail: bulychev@biophys.msu.ru
Поступила в редакцию 08.11.2019 г.
После доработки 30.11.2019 г.
Принята к публикации 21.01.2020 г.
Клеткам гигантских размеров, таким как междоузлия харовых водорослей, свойственно быстрое (до
100 мкм/с) круговое течение цитоплазмы, которое участвует в дальних внутриклеточных взаимо-
действиях и координирует функциональную активность органелл в условиях неоднородного осве-
щения. Конкретные функции интенсивного движения цитоплазмы остаются малоизученными. Со-
четание локального освещения с измерением флуоресценции хлорофилла и внеклеточного рН на
микроучастках клетки, расположенных ниже по течению цитоплазмы, представляет удобный ин-
струмент для выявления латерального транспорта фотометаболитов и циклоз-зависимой регуляции
плазмалеммного транспорта Н+ и фотосинтеза хлоропластов. В зоне интенсивного освещения хло-
ропласты экспортируют в поток восстановительные эквиваленты и триозофосфаты, которые рас-
пределяются по клетке и вызывают переходное возрастание флуоресценции хлорофилла в слабо-
освещенных участках клетки вдали от места приложения фотостимула. Рассмотрены свойства опо-
средованных циклозом изменений флуоресценции, включая фотоиндукцию дальних
взаимодействий, чувствительность к ингибиторам метаболизма, неоднородное пространственное
распределение в освещенных клетках, а также постепенную (1-5 мин) инактивацию дистанцион-
ной передачи сигналов после помещения клетки в темноту. Показано стимулирующее влияние по-
тенциала действия на дальнюю передачу сигналов. Обсуждается применение нового метода для изу-
чения межклеточного транспорта метаболитов и анализа проницаемости плазмодесм.
Ключевые слова: течение цитоплазмы, дальняя сигнализация, неоднородные профили рН, дистанционная
регуляция активности фотосистемы II, плазмодесмы.
DOI: 10.31857/S0006302920020106
предполагаемая функция течения цитоплазмы
Термин «внутриклеточный конвейер» нечасто
состоит в выравнивании внутриклеточных кон-
встречается в публикациях по биофизике и био-
центрационных градиентов [3, 4]. Поток распре-
химии клетки. Упоминание о конвейере напоми-
деляет вещества по клетке, доставляя их к меж-
нает о производственной непрерывно движущей-
клеточным барьерам, что способствует переме-
ся ленте с поступающими заготовками, которые
щению сигнальных соединений и ассимилятов на
подвергаются обработке по мере их продвижения
дальние расстояния и в зоны активного роста.
от исходной позиции до места назначения. В
Конкретные примеры участия потока жидкости в
клетках растений аналогичную роль выполняет
клеточных процессах в настоящее время остают-
движение цитоплазмы. Течение цитоплазмы из-
ся единичными.
вестно уже почти 250 лет: впервые его описал ита-
Дальний транспорт - один из важнейших про-
льянский физик Bonaventura Corti в 1774 г., раз-
цессов в растениях - всегда включает внутрикле-
глядывая под микроскопом клетки водоросли
точную и трансклеточную стадии, которые состо-
Chara. За последние полвека достигнуты большие
ят в переносе вещества по цитоплазме и его про-
успехи в понимании механизма движения цито-
хождении через межклеточные контакты
-
плазмы [1, 2]. Значительно меньше известно о
плазмодесмы [4]. Для изучения транспорта ве-
функциональной роли внутриклеточных потоков
ществ от клетки к клетке часто использовали
жидкости. Исходя из общих представлений,
микроинъекцию флуоресцентных красителей,
таких как карбоксифлуоресцеин [5, 6]. Однако
Сокращения: QA - первичный хинонный акцептор фото-
этот метод инвазивен, не обеспечивает точной
системы II, ФС II - фотосистема II, ФС I - фотосистема I.
290
ТЕЧЕНИЕ ЦИТОПЛАЗМЫ КАК ВНУТРИКЛЕТОЧНЫЙ КОНВЕЙЕР
291
локализации вводимого зонда в цитоплазму или
нормальных условиях - их перенос с потоком ци-
вакуоль, а также нарушает клеточный состав и
топлазмы. При толщине текущего слоя около
внутреннее давление в клетке, что осложняет од-
5 мкм и диаметре клетки 0.7 мм, через сечение
нозначную интерпретацию получаемых результа-
цитоплазмы проходит объем ~1 нл/с. Хлоропла-
тов. В этой связи важную роль приобретает поиск
сты лежат тесными рядами по периферии клетки
неповреждающих методов и адекватных модель-
на границе между подвижной эндоплазмой и не-
ных объектов. Харовые водоросли филогенетиче-
подвижным слоем эктоплазмы. К внутренней
ски относятся к ближайшим родственникам выс-
стороне слоя хлоропластов прикреплены актино-
ших растений [7] и представляют одну из наибо-
вые филаменты, по которым, как направляю-
лее удобных моделей растительной клетки.
щим, происходит АТФ-зависимое движение мо-
лекул миозина, нагруженных везикулами [20].
Побеги водоросли Chara состоят из чередую-
Везикулы увлекают за собой прилегающие слои
щихся гигантских интернодальных клеток и мел-
воды, что создает круговое течение жидкости.
ких узловых клеток. Крупные размеры междоуз-
Максимальная скорость движения достигается на
лий определяют наличие у них особых, во многом
границе между неподвижными хлоропластами и
уникальных свойств. Эти клетки электрически
текущей эндоплазмой [3, 22]. Движение по за-
возбудимы; на них были впервые выявлены по-
мкнутому циклу называют ротационным. Встреч-
тенциалозависимые и Са2+-управляемые ионные
ные потоки разделены прозрачной нейтральной
каналы плазмалеммы и тонопласта [8, 9]. На свету
полосой. В этой полосе слой цитоплазмы сужает-
клетки хары проявляют способность к самоорга-
ся, не оставляя места для размещения пластид.
низации - образуют неоднородные продольные
Поток жидкости направлен по слабо закрученной
профили рН и фотосинтеза [10-15]. Они облада-
спиральной траектории. Скорость течения силь-
ют исключительно быстрым (до 100 мкм/с) тече-
но зависит от температуры и в меньшей степени
нием цитоплазмы [16, 17]. Им свойственна био-
от других физических факторов. Потенциал дей-
генная кальцификация, т.е. связанное с метабо-
ствия вызывает временную (на 30 с) остановку
лизмом осаждение на клеточных стенках
движения и медленное (5-10 мин) восстановле-
кристаллов кальция в зонах с высоким рН [18].
ние скорости течения до исходного уровня.
Эти клетки способны залечивать мелкие повре-
ждения, что позволяет избежать больших потерь
Распределение веществ по клетке с потоком
биомассы при гибели отдельной клетки [19, 20].
жидкости имеет очевидный смысл лишь при
Цепочки клеток удобны также для изучения меж-
условии неоднородного состава цитоплазмы. Та-
клеточных контактов. Они идеально подходят
кая ситуация возникает, например, при неравно-
для микрофлуориметрических измерений флуо-
мерном освещении, когда яркий свет попадает на
ресценции хлорофилла, поскольку хлоропласты
часть клетки, а другие части находятся в тени. Пе-
неподвижны и расположены в один слой по пери-
ренос избыточного количества продуктов свето-
ферии клетки.
вых реакций из зоны насыщающего освещения к
хлоропластам, лежащим в зоне затенения, у кото-
Гигантские (до 10 см) размеры клеток Chara
рых возможности фиксации СО2 использованы
corallina и C. australis (до 20 см у Nitellopsis) дикту-
ют необходимость особых механизмов передачи
не в полную меру из-за нехватки этих продуктов,
сигналов. В клетках малых размеров реагенты
может внести прибавку в общий фотосинтез. Для
смешиваются за время менее 1 с, но для диффу-
эффективного внутриклеточного распределения
зии на расстояние 5 см потребовалось бы не-
фотометаболитов необходимо не только интен-
сколько недель. Очевидно, что харовые водорос-
сивное течение цитоплазмы, но и наличие быст-
ли располагают другими средствами регуляции и
рого обмена между хлоропластами и цитоплаз-
координации клеточных процессов.
мой. Главные транспортные системы оболочки
пластид - это так называемый «малатный кла-
Быстрая передача сигналов может осуществ-
пан» и транслокатор триозофосфатов [23, 24]. Обе
ляться за счет проведения электрических импуль-
системы выполняют функцию переносa восста-
сов - потенциалов действия [21]. При скорости
новительных эквивалентов (redox shuttles): они
распространения потенциала действия около
выводят NAD(P)H из освещенных хлоропластов,
1 см/с, электрический сигнал (кратковременная
поскольку при линейном фотосинтетическом по-
деполяризация длительностью ~2 с) и связанное с
токе электронов NADPH образуется в избытке по
ним почти стократное повышение уровня Са2+ в
сравнению с АТФ. Оба переносчика светозависи-
цитоплазме проходят волной по клетке за время
мы и теряют активность в темноте [24].
менее 10 с. Однако потенциалы действия возни-
кают лишь в неблагоприятных условиях (механи-
Влияние течения цитоплазмы на клеточные
ческое воздействие, утечка электролитов из по-
процессы можно изучать, подводя к клетке
врежденных клеток), но обычно отсутствуют у
по оптоволокну узкий луч (диаметром 0.4 мм) и
клеток в состоянии покоя. Основной путь пере-
наблюдая за проявлениями фотостимуляции по
дачи сигналов и метаболитов в физиологически
изменениям флуоресценции хлорофилла и рН у
БИОФИЗИКА том 65
№ 2
2020
292
БУЛЫЧЕВ и др.
поверхности клетки на удалении 1-6 мм от
выше по течению цитоплазмы от места измере-
места локального освещения [25, 26]. Флуорес-
ния, рН в щелочной зоне возрастал на ~0.05 рН, а
ценцию хлорофилла возбуждают слабым модули-
в кислой — снижался. Время t1/2 от начала локаль-
рованным светом (метод импульсно модулиро-
ного светового импульса до половинного сдвига
ванной флуорометрии, PAM), который не влияет
рН линейно зависело от расстояния d между ис-
на состояние хлоропластов. Кроме того, всю
точником света и местом измерения. Графики
клетку помещают на слабый фоновый свет
времени t1/2 от расстояния для щелочной и кис-
(~10 мкмоль м-2 с-1), который поддерживает фо-
лой зон имели равный наклон (угловой коэффи-
тосинтетический аппарат в активном состоянии.
циент 17.4 ± 2 с/мм), однако время t1/2 для кислой
Измерения рН в неперемешиваемом слое наруж-
зоны было примерно на 15 с короче, чем для ще-
ной среды позволяют судить о направлении и ве-
лочной зоны, причем это различие сохранялось
при варьировании расстояния d от 1 до 3 мм. По-
личине потоков H+ через микроучастки плазма-
видимому, существуют два разных интермедиата,
тической мембраны.
один из которых попадает в цитоплазму раньше,
Локальное освещение индуцирует экспорт ме-
чем другой. «Быстрый» интермедиат отвечает в
таболитов из стромы хлоропластов в цитоплазму,
первую очередь за активацию Н+-насоса плазма-
которая перемещается с максимальной скоро-
леммы, а «задержанный» - за повышение пассив-
стью на границе со стационарным слоем хлоро-
ной Н+-проводимости. Судя по равному наклону
пластов. Экспортируемые метаболиты движутся
линейных зависимостей t1/2 от расстояния d, в по-
латерально в виде пакета, размер которого опре-
токе цитоплазмы оба интермедиата перемещают-
деляется длительностью освещения и скоростью
течения цитоплазмы. Время нахождения метабо-
ся с равной скоростью (около 60 мкм/с).
литов в пути, пока они не достигли анализируе-
Метаболиты, экспортируемые хлоропластами
мого участка, определяет длительность лаг фазы
на свету, воздействуют не только на плазмалемму,
ответных реакций флуоресценции и рН. Когда же
но и на хлоропласты, расположенные ниже по те-
метаболиты поступают в зону измерения, они вы-
чению от зоны освещения. Это проявляется в пе-
зывают переходные изменения обоих парамет-
реходном возрастании флуоресценции хлоро-
ров. Эти изменения отражают дистанционное
филла примерно на 25% после латентного перио-
опосредованное циклозом регуляторное действие
да от 20 до 30 с [35]. Возрастание флуоресценции
света на хлоропласты и плазматическую мембра-
говорит о том, что метаболиты, экспортируемые
ну [27].
освещенными хлоропластами, достигают зате-
Первые результаты опытов с пространствен-
ненных областей, поступают в строму пластид и
ным разделением зоны фотостимуляции и места
вызывают временное восстановление пула пла-
наблюдения функциональных изменений опуб-
стохинонов, включая первичный хинонный ак-
ликованы в ряде экспериментальных и обзорных
цептор (QA), состояние которого определяет уро-
статей [28-33]. В настоящей работе подытожены
вень свечения фотосистемы II (ФС II). Пик флу-
главным образом более поздние исследования, не
оресценции достигается примерно в то же время,
отраженные в обзорах [31, 32].
когда происходят сдвиги рН. Однако графики до-
При измерениях рН в слабощелочной области
стижения пика F' в зависимости от расстояния до
у поверхности клетки установлено, что локальное
источника света для щелочных и кислых зон сов-
освещение соседних областей, лежащих выше в
падали, в отличие от сдвига аналогичных графи-
потоке цитоплазмы, приводит в течение 3-4 мин
ков для изменений рН. Следует отметить, что при
к образованию сильнощелочной зоны, с перепа-
повышенных интенсивностях светового фона ло-
дом рН до 2 единиц между исходным и конечным
кальное освещение индуцирует тушение флуо-
значениями. При подведении луча на таком же
ресценции, которое развивается вслед за началь-
удалении от места измерения, но ниже по тече-
ной стадией возрастания свечения [25].
нию цитоплазмы, образования щелочной зоны в
Применение ингибитора полимеризации ак-
том же участке клетки не происходило. Результа-
тина (цитохалазина D), который полностью оста-
ты говорят о том, что на свету хлоропласты вы-
навливает течение цитоплазмы [36], позволяет
свобождают продукт, который переносится с по-
убедиться в микрофлуидной передаче сигнала-
током цитоплазмы и индуцирует образование на-
регулятора флуоресценции. Остановка движения
ружной щелочной зоны [34]. Таким образом,
сопровождается полным исчезновением измене-
генерация неоднородного профиля рН в интер-
ний флуоресценции в ответ на локальное освеще-
нодальных клетках при освещении тесно связана
ние удаленного участка клетки [37, 38], а отмыва-
с движением метаболитов в потоке цитоплазмы.
ние клетки свежей средой и восстановление тече-
В аналогичных опытах с короткими (30 с) экс-
ния возобновляют ответную реакцию на
позициями локального освещения измеряли
локальный фотостимул. При промежуточных
сдвиги рН раздельно в щелочных и кислых зонах.
скоростях течения пик флуоресценции появляет-
При освещении участка клетки, расположенного
ся с задержкой на десятки секунд, становится ши-
БИОФИЗИКА том 65
№ 2
2020
ТЕЧЕНИЕ ЦИТОПЛАЗМЫ КАК ВНУТРИКЛЕТОЧНЫЙ КОНВЕЙЕР
293
250
530
200
496
462
150
428
394
100
360
50
0
1.0
1.5
2.0
2.5
3.0
3.5
4.0
4.5
Расстояние от зоны локального освещения, мм
Рис. 1. Диаграмма изменений флуоресценции хлорофилла F' при разных расстояниях от области локального освеще-
ния до зоны измерения. Поток цитоплазмы направлен от места подведения световода к флуориметрируемому участку.
Градации окраски соответствуют разной интенсивности флуоресценции. Горизонтальные штриховые линии отмеча-
ют моменты включения и выключения локального освещения (при t = 50 и 80 с от начала регистрации F' соответ-
ственно).
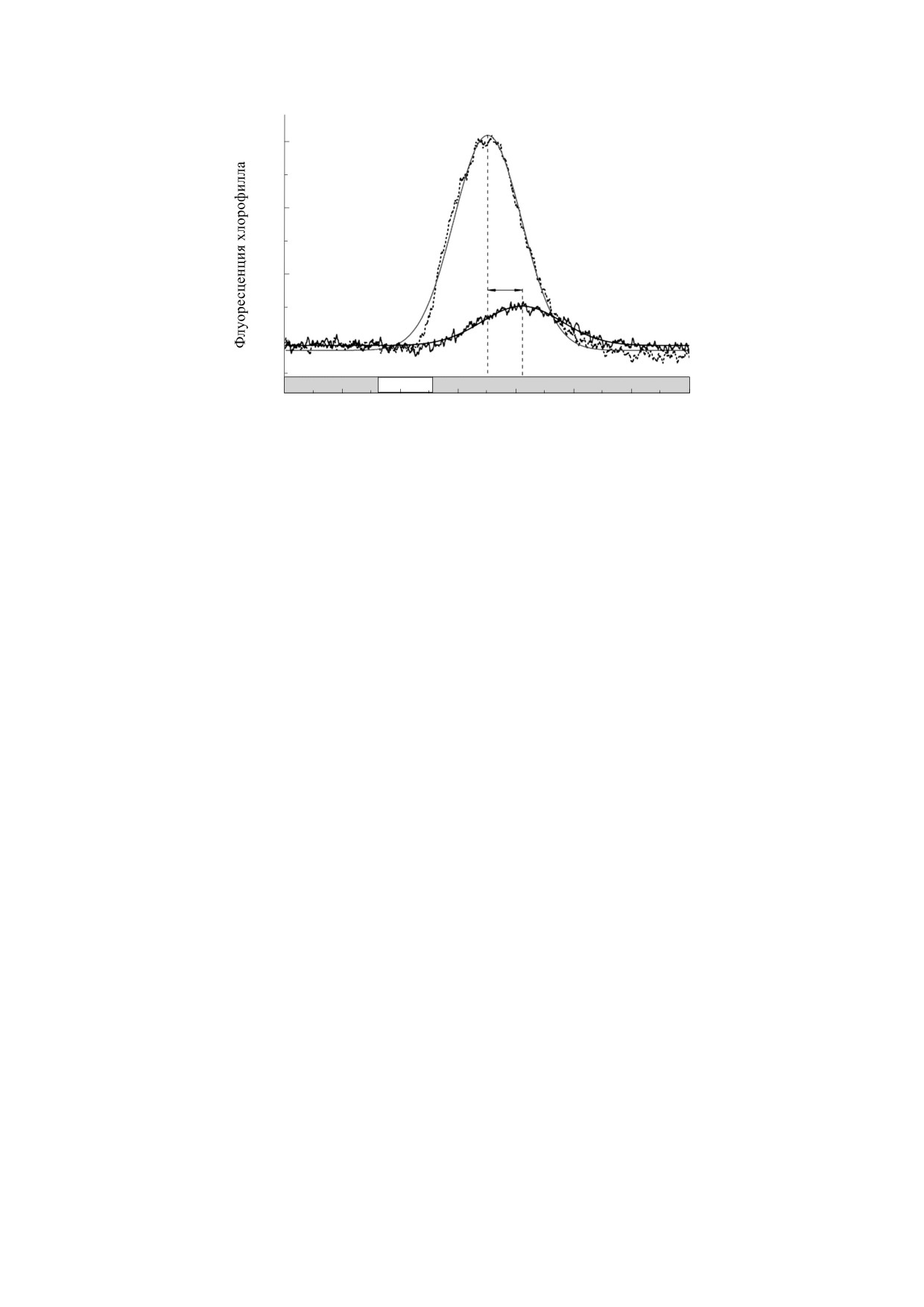
ре и меньше по амплитуде. Уширение имеет диф-
ходит времени от момента включения локального
фузионную природу: чем дольше по времени дви-
света до достижения пика флуоресценции. Пря-
жется пакет метаболитов до поступления в зону
мая, проведенная по пиковым значениям F' на
анализа, тем сильнее сказывается диффузия на
этой диаграмме, позволяет рассчитать скорость
ширине пакета и форме изменений F' в ответ на
движения метаболита, вызывающего дистанци-
действие локального освещения. При учете по-
онные изменения флуоресценции. В данном слу-
ступательного движения пакета метаболитов, их
чае при увеличении длины пути на 3.5 мм пик F'
диффузии в процессе транслокации и частичного
сместился на 65 с. Скорость распространения ре-
потребления метаболитов в ходе их продольного
гуляторного фактора составила 54 мкм/с. Это
перемещения по клетке, удается получить каче-
примерно на треть меньше, чем скорость, изме-
ственное соответствие экспериментальных дан-
ряемая по движению частиц в проходящем свете
ных и кинетических кривых изменений F', рас-
микроскопа. Небольшое замедление переноса,
считанных на основе математической модели
возможно, связано с тем, что в процессе движе-
[27]. Модель описывала ход изменений F' как при
ния метаболит многократно и обратимо связыва-
равномерном поступательном движении цито-
ется с малоподвижными внутриклеточными
плазмы, так и в случае переменной скорости тече-
структурами [39].
ния - при возобновлении циклоза после его вре-
Главные стадии дальней передачи метаболиче-
менной остановки под влиянием потенциала
ского сигнала различаются по локализации и вы-
действия.
полняемым функциям: (1) образование и экспорт
Аналогичные модификации сигнала флуорес-
фотометаболитов в ярко освещаемом участке
ценции F’ проявляются и при постоянной скоро-
клетки, (2) перенос экспортируемых субстратов с
сти течения, если увеличивать расстояние между
потоком цитоплазмы на расстояния до 5-6 мм,
источником локального света и областью измере-
(3) импорт триозофосфатов и восстановительных
ния [38]. При коротких разделяющих расстояни-
эквивалентов из потока жидкости в строму зате-
ях (1.0-1.5 мм) пик F' достигается сравнительно
ненных хлоропластов и (4) биохимические и ре-
быстро и имеет большую амплитуду. На больших
докс-реакции, ведущие к восстановлению пла-
расстояниях (d = 3.0-4.5 мм) пик развивается по-
стохинона и хинонного акцептора ФС II, что свя-
сле длительной задержки, а ширина полосы изме-
зано с появлением пика флуоресценции. После
нений F' возрастает. Зависимость расположения
ухода метаболита из области измерения уровень
пика F' от расстояния можно представить диа-
F', отражающий состояние хлоропластов, возвра-
граммой, показанной на рис. 1. Чем дальше отве-
щается к норме, иногда с немонотонной кинети-
ден световод от зоны измерения, тем больше про-
кой. Флуоресценция опускается на 2-3 мин чуть
БИОФИЗИКА том 65
№ 2
2020
294
БУЛЫЧЕВ и др.
950
1
900
850
800
750
2
700
650
0
50
100
150
200
Время, с
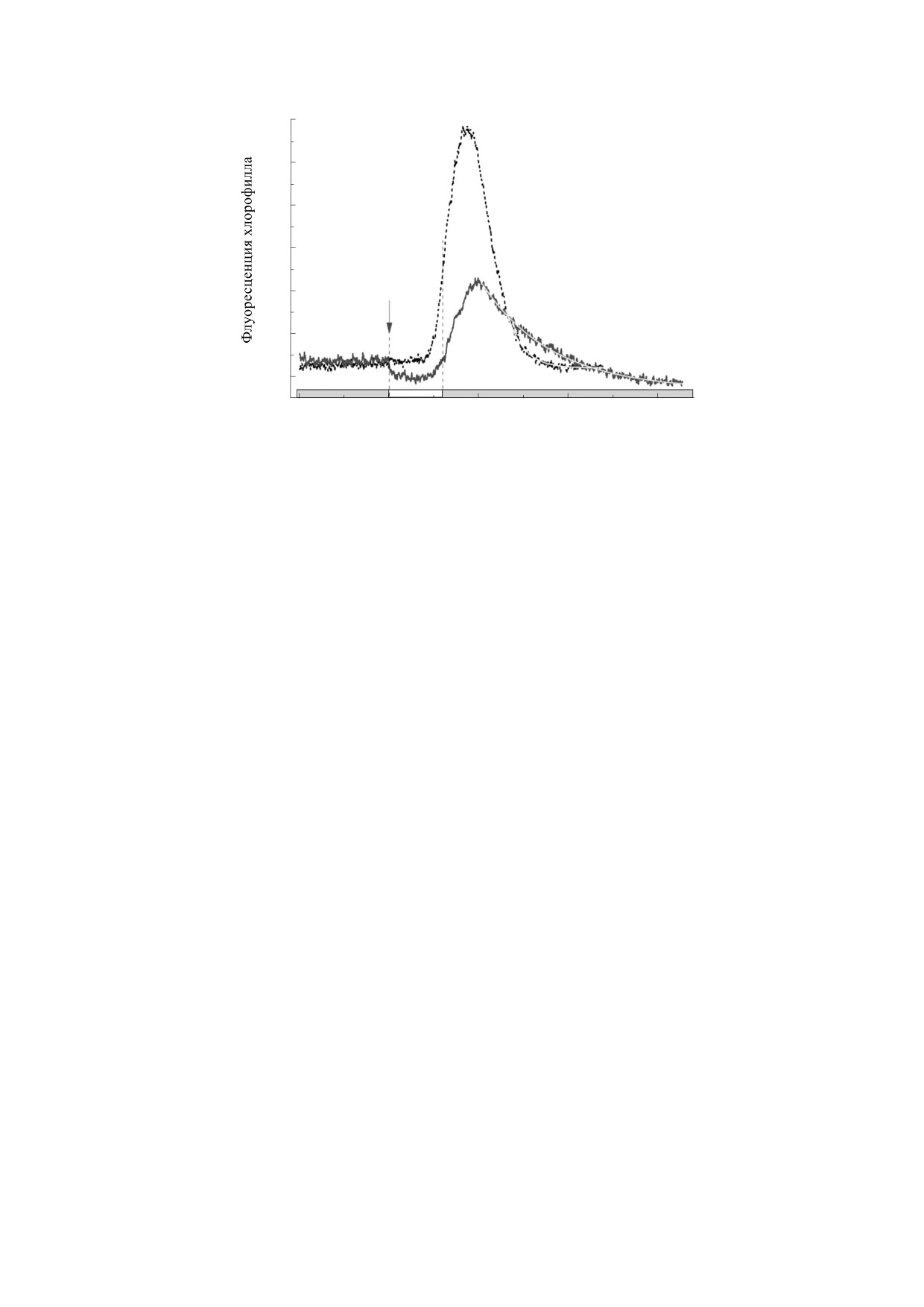
Рис. 2. Опосредованные циклозом ответы флуоресценции F' на локальное освещение участка, лежащего вдали от ме-
ста регистрации F', в условиях фоновой подсветки (14 мкмоль квантов м-2 с-1, кривая 1) и при выключении фонового
освещения одновременно с приложением локального светового импульса (кривая 2). Стрелка относится только к за-
писи 2 и отмечает момент выключения фоновой подсветки. Кривые 1 и 2 - усредненные записи, полученные на пяти
клетках.
ниже исходного уровня, а квантовый выход фото-
ал-зависимым каналам, пропускающим Са2+ и
реакции ФС II повышается. Одна из возможных
другие двухвалентные катионы. Результаты опы-
причин такого перехлеста в изменениях F' - уси-
тов с ингибиторами подчеркивают роль реакций,
ленный отток электронов из пула пластохинона
протекающих на акцепторной стороне ФС I и в
вследствие восстановительной активации фер-
строме хлоропластов. Однако остается неясным,
ментов фиксации СО2 и повышенного потребле-
нарушает ли действие дифенилениодониума и
ния NADPH [39].
метилвиологена образование и экспорт метабо-
литов (стадия 1), или же и реакции на терминаль-
Для понимания роли и особенностей отдель-
ном участке сигнальной цепи (стадии 3, 4).
ных этапов микрофлуидной сигнализации важно
Известно, что обмен метаболитов между стро-
выбрать избирательные воздействия на пере-
мой хлоропластов и цитозолем зависит от света
численные стадии. Например, действие цитоха-
[41]. Опыты, направленные на темновую инакти-
лазина D на актиновые филаменты селективно
вацию и фотоактивацию ферментов, выявили
подавляет стадию латерального транспорта мета-
сильную зависимость дальней передачи сигналов
болитов. К сожалению, во многих случаях невоз-
от световых условий [26, 35]. На рис. 2 показаны
можно разделить действие ингибиторов метабо-
переходные изменения флуоресценции F' после
лизма на начальные и конечные стадии преобра-
локального освещения клетки на слабом фоно-
зования сигнала. В частности, передача сигнала
вом свету и в условиях, когда фоновый свет был
необратимо подавляется при действии дифениле-
выключен синхронно с началом импульса ло-
ниодониума и метилвиологена [35]. Оба реагента
кального освещения. Ферменты инактивируются
нарушают перенос электронов на участке за фо-
в минутном интервале, поэтому выключение фо-
тосистемой I (ФС I). Известно, что дифенилени-
нового света одновременно с включением ло-
одониум подавляет ферредоксин-NADP редукта-
кального света прекращает световые реакции в
зу и флавиновые ферменты. Под действием мети-
области наблюдения, но не нарушает фермента-
лвиологена СО2-зависимый фотосинтетический
тивные процессы. При затемнении клетки ам-
поток электронов переключается на восстановле-
плитуда изменений флуоресценции снижается в
ние О2. В покоящихся клетках Chara этот герби-
два-три раза, а релаксация сигнала замедляется.
цид не проникает к мишеням своего действия да-
Замедление спада изменений F' после переходно-
же после длительной (30 мин) инкубации. Однако
го пика у помещенных в темноту клеток, очевид-
его эффект проявляется мгновенно после одно-
но, обусловлено прекращением фотохимической
кратной генерации потенциала действия [15, 40].
активности хлоропластов в области наблюдения.
По-видимому, двухвалентно заряженный катион
На свету ФС I окисляет пул пластохинонов, что
метилвиологена проникает в клетку по потенци-
обеспечивает сравнительно быстрое снижение F'
БИОФИЗИКА том 65
№ 2
2020
ТЕЧЕНИЕ ЦИТОПЛАЗМЫ КАК ВНУТРИКЛЕТОЧНЫЙ КОНВЕЙЕР
295
после прохождения пика, но в темноте ФС I неак-
фотоиндукции фиксации СО2. Как известно, ин-
тивна и не участвует в окислении пластохино-
дукция ассимиляции СО2 отражает переход фер-
на/QA. В этом случае окисление пластохино-
ментов цикла Кальвина в активное состояние на
на/QA происходит за счет альтернативных путей,
свету при участии восстановленного тиоредокси-
например, при участии пластидной терминаль-
на, получающего электроны от ФС I. Переход в
ной оксидазы.
трансмиссивное состояние у клеток хары, по-ви-
Причина ослабления ответной реакции на ло-
димому, включает фотоактивацию транслокато-
кальный свет при переносе клетки в темноту не
ров оболочки.
вполне ясна. С одной стороны, более сильные от-
Микрофлуидную сигнализацию изучали пре-
ветные изменения F' при фоновом освещении
иущественно на слабом свету, при котором изме-
могут указывать на преобладание фотохимиче-
ряемые свойства клетки (флуоресценция, кван-
ского (ФС II-зависимого) восстановления пла-
товый выход фотореакции ФС II, локальные зна-
стохинона/QA в сравнении с нефотохимическим
чения рН на поверхности) распределены
(темновой поток электронов от NADPH на пла-
равномерно по ее длине. Если же клетка приобре-
стохинон при участии антимицин-чувствитель-
тает неоднородные свойства после экспозиции на
ного сегмента циклической цепи [26]). Однако
ярком свету (чередующиеся щелочные и кислые
отдельные наблюдения не укладываются в это
зоны), то способность к дистанционной регуля-
объяснение. В ряде случаев ответная реакция F'
ции ФС II и флуоресценции хлорофилла стано-
на локальный луч в отсутствие фонового освеще-
вится также неоднородной по длине междоузлия.
ния оказывается более сильной, чем на фоновом
Опыты показали, что дистанционная регуляция
свету. Не исключено, что ослабление реакции на
флуоресценции хорошо выражена в кислых зонах
локальный свет, наблюдаемое после выключения
и сильно ослаблена в щелочных зонах [26, 42].
светового фона, связано с возрастанием потерь
При этом сдвиги рН в щелочных зонах в ответ на
транспортируемого метаболита по мере его про-
локальное освещение сохранялись, т.е. перенос
движения с потоком. В начальный период затем-
метаболитов в потоке не был нарушен.
нения цикл фиксации СО2 и транслокаторы обо-
Разную эффективность передачи сигнала в
лочки сохраняют активность, тогда как внутрен-
щелочных и кислых зонах можно пытаться объяс-
ние ресурсы NADPH не пополняются вследствие
нить на основе так называемой СО2-гипотезы.
остановки фотореакций после переноса клетки в
Исходное положение состоит в том, что в кислой
темноту. Дальнейшие исследования должны про-
области повышено содержание углекислоты. По-
яснить вопрос о том, в каких пределах меняется
этому локальное освещение вызывает обильное
содержание транспортируемых метаболитов в
производство и экспорт триозофосфатов, что и
цитоплазме при изменении световых условий.
приводит к большим сдвигам флуоресценции F'
Предварительное выключение фонового света
на терминальном участке сигнальной цепи. На-
постепенно ослабляло ответную реакцию на ло-
против, в щелочных зонах углекислота отсутству-
кальный световой импульс [26]. После двухми-
ет; бикарбонат и карбонат ионы в клетку не про-
нутной темноты амплитуда изменений была
никают из-за наличия у них заряда; поэтому из-за
вдвое меньше, чем при выключении фона в мо-
нехватки субстрата цикла Кальвина-Бенсона нет
мент начала локального светового импульса, а
производства и экспорта триозофосфатов.
после 4.5-минутной темновой адаптации реакция
Для оценки этой возможности мы измеряли
на локальное освещение полностью исчезала.
переходные изменения флуоресценции хлоро-
Эти изменения, вероятно, отражают инактива-
филла в ответ на локальное освещение в зонах с
цию транслокаторов оболочки в области измере-
разным наружным рН. График амплитуды изме-
ния флуоресценции. Тот факт, что трансмиссив-
нений флуоресценции от рН в примембранных
ное состояние сохраняется в темноте на протяже-
слоях имеет сигмоидный вид со значением pK
нии нескольких минут, означает, что возрастание
около 9.3, тогда как рК для равновесия СО2-
флуоресценции связано с темновым (нефотохи-
НСО3- составляет 6.3 [43]. Этот результат явно не
мическим) потоком электронов от поступивших
укладывается в СО2-гипотезу. По-видимому, для
в строму восстановителей в пул пластохинонов и
восстановлением хинонного акцептора QA.
передачи сигнала важна не концентрация СО2, а
величина рН цитоплазмы, влияющая на трансло-
При обратном переходе от темноты к фоново-
каторы оболочки и ферменты стромы. Трансмем-
му освещению реакция флуоресценции на ло-
бранный поток протонов по-разному сдвигает рН
кальный фотостимул у адаптированных к темноте
на противоположных сторонах мембраны. Умест-
клеток поначалу отсутствует. После трехминут-
но привести хорошо известную аналогию: фото-
ной слабой подсветки ответная реакция на ло-
кальное освещение удаленного участка полно-
индуцированный перенос Н+ через тилакоидную
стью восстанавливалась [35]. Явление фотоин-
мембрану приводит к противоположным сдвигам
дукции дальней передачи сигнала аналогично
рН в тилакоиде и в строме. Сдвиги рН разного
БИОФИЗИКА том 65
№ 2
2020
296
БУЛЫЧЕВ и др.
знака происходят и на разных сторонах у поверх-
участках клетки вследствие интенсивного входя-
ности бислойной липидной мембраны при пере-
щего потока протонов.
носе через нее протонов в присутствии ионофо-
Для дополнительной проверки СО2-гипотезы
ров или слабых оснований [44]. Точно так же пе-
мы выясняли, насколько важна величина рН той
ренос Н+ из цитоплазмы в наружный раствор
области клетки, куда направлен локальный свет.
через плазматическую мембрану вызывает не
Зная продольный профиль рН, можно располо-
только закисление среды, но и повышение рН
жить световод и область измерения в точках с из-
цитоплазмы. Соответственно, входящий в клетку
вестными значениями рН. Были выбраны четыре
поток Н+ вызывает щелочной сдвиг рН снаружи
конфигурации измерений, условно названные по
и должен закислять цитоплазму. Именно такое
движению потока (1) из кислой зоны в кислую,
(2) из кислой в щелочную, (3) из щелочной в ще-
влияние потоков Н+ на рН цитоплазмы выявлено
лочную и (4) из щелочной в кислую [26]. Если ре-
в растущих пыльцевых трубках лилии [45]. В зоне
шающим фактором служит образование триозо-
АТФ-зависимого выведения протонов на неболь-
фосфатов за счет наличия СО2 в наружных кис-
шом удалении от растущего кончика рН цито-
плазмы был почти на 1 ед. выше, чем в области
лых зонах, то в конфигурациях (1) и (2) можно
ожидать изменения F' одинаково большой ам-
пассивного поступления Н+ (в апексе). Можно
плитуды. Результаты получились качественно
предполагать, что аналогичная закономерность
иными. Оказалось, не так важно, в щелочную или
соблюдается и в случае харовых водорослей.
кислую область клетки был направлен локальный
Для проверки представлений о пониженном
свет, а важен рН той области, где проводятся из-
рН цитоплазмы как причине сильного подавле-
мерения. В конфигурациях 1 и 4 изменения F' бы-
ния циклоз-зависимой передачи сигнала в обла-
ли большими и примерно равными. А в конфигу-
сти наружных щелочных зон можно использовать
рациях 2 и 3 изменения были слабыми. Следова-
ряд воздействий. Одно из них состоит в возбужде-
тельно, причина различий состоит не в том, что
нии плазматической мембраны: генерация по-
хлоропласты кислой зоны образуют под ярким
тенциала действия вызывает длительную оста-
лучом много ассимилятов. Более вероятно, что
различия рН цитоплазмы под щелочными и кис-
новку входящего потока Н+ и сильно ослабляет
лыми зонами сказываются на активности фер-
щелочные зоны [46-49]. После возбуждения рН у
ментов, участвующих в системе передачи и транс-
поверхности резко понижается, а остановка вхо-
формации метаболического сигнала. Таким обра-
дящего потока Н+ должна вызывать щелочной
зом, терминальные стадии цепи передачи сигнала
сдвиг рН цитоплазмы. При этом амплитуда изме-
отличаются от стадий на начальном участке этой
нений флуоресценции в ответ на локальное осве-
цепи повышенной чувствительностью к щелоч-
щение удаленного участка возрастала в пять-
ному сдвигу рН на поверхности клетки [26]. Воз-
шесть раз [43]. Второй прием основан на подавле-
можную роль в разной чувствительности прокси-
нии входящего потока Н+ в области щелочных
мальных и дистальных сегментов сигнальной це-
пи играют неравные световые условия
зон в присутствии NH4+. Ионы аммония повы-
(интенсивные импульсы света в зоне экспорта
шают рН цитоплазмы благодаря проникновению
метаболитов и непрерывное слабое освещение в
нейтральных молекул аммиака через плазматиче-
зоне их импорта и дальнейшей переработки).
скую мембрану и последующему связыванию
протонов в цитозоле. Значение рК для равнове-
Представленный метод позволяет исследовать
трансклеточный перенос метаболитов в клеточ-
сия NH3/NH4+ составляет 9.25. Высокий рН в
ных цепочках [50]. Связь между клетками осу-
щелочных зонах определяет повышенное содер-
ществляется по плазмодесмам - плазматическим
жание нейтральной депротонированной формы
тяжам, пронизывающим клеточные стенки.
(NH3), что способствует быстрому проникнове-
Плазмодесмы содержат отдельные нити актина,
нию этой формы в цитозоль. На внешней стороне
однако его содержание, по-видимому, недоста-
рН смещается при этом в кислую сторону. В при-
точно для поддержания сквозного течения цито-
сутствии NH4+, так же как и после потенциала
плазмы. Основной предполагаемый механизм
действия, изменения флуоресценции в ответ на
прохождения ассимилятов через плазмодесмы -
их диффузия. Предполагают, что проводимость
локальное освещение в исходно щелочной зоне
возрастали примерно в десятикратном размере
плазмодесм подвержена тонкой регуляции. В ка-
[43]. Это подтверждает гипотезу о закислении ци-
честве регулирующих факторов называют внут-
топлазмы под щелочными зонами у освещенных
реннее гидростатическое давление, уровень Са2+
клеток в физиологических условиях. В таком слу-
в цитоплазме и другие. Традиционный подход к
чае нарушения дальних межхлоропластных ком-
изучению проводимости плазмодесм состоит в
муникаций под наружными щелочными зонами
том, что в клетку инъецируют флуоресцеин или
связаны с понижением рН цитоплазмы в этих
его аналоги, а затем наблюдают за поступлением
БИОФИЗИКА том 65
№ 2
2020
ТЕЧЕНИЕ ЦИТОПЛАЗМЫ КАК ВНУТРИКЛЕТОЧНЫЙ КОНВЕЙЕР
297
750
700
1
650
Δt
2
600
20
40
60
80
100
120
140
160
Время, с
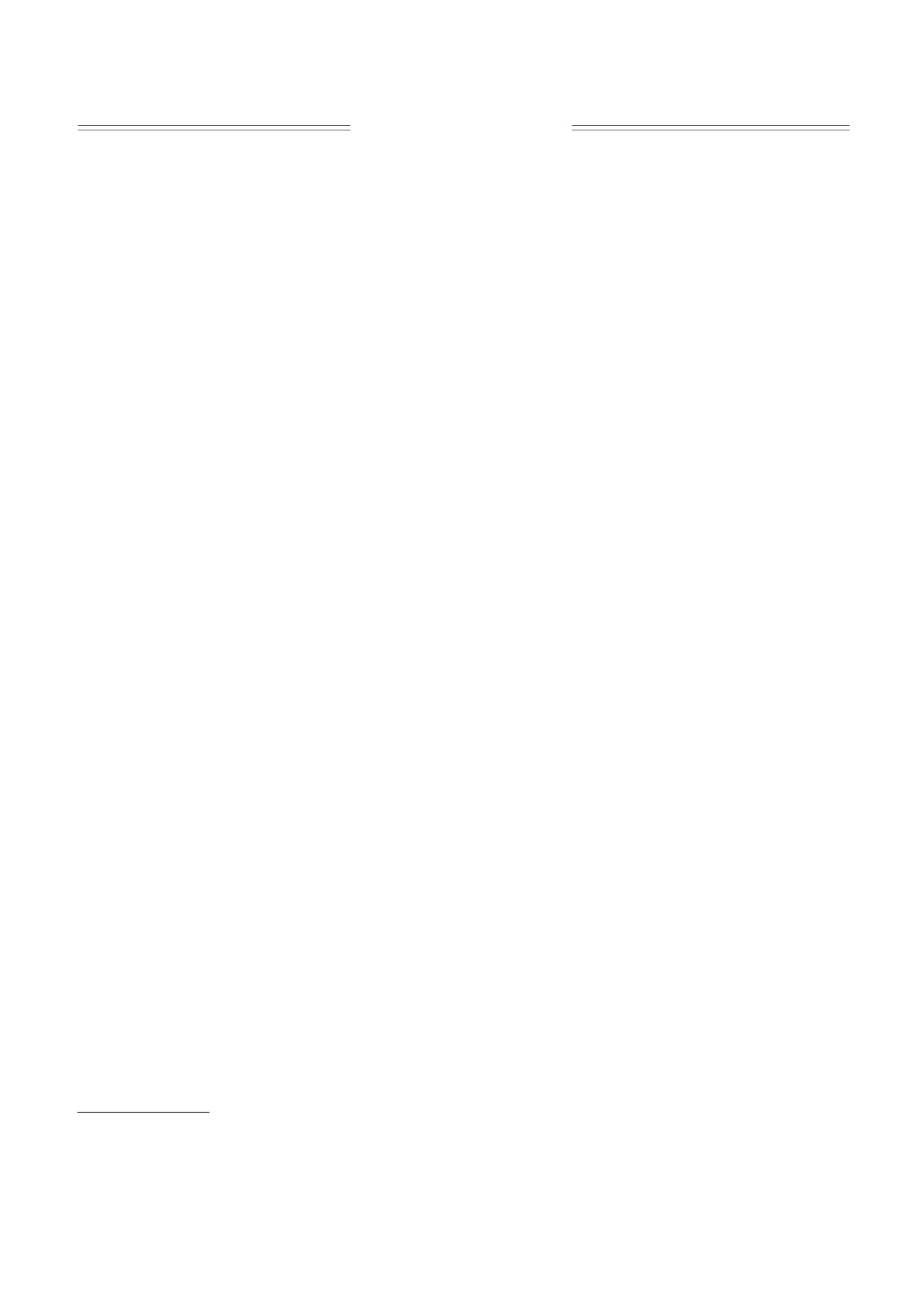
Рис. 3. Изменения флуоресценции хлорофилла F', вызванные дистанционной передачей фотометаболитов в пределах
одной интернодальной клетки (кривая 1) и в условиях их трансклеточного переноса между соседними междоузлиями
(кривая
2). Расстояние между зоной локального освещения и областью измерения флуоресценции во
внутриклеточной и трансклеточной конфигурациях было одинаковым (d = 1 мм).
зонда в соседние клетки [5, 6]. В сравнении с этим
преодолению трансклеточного барьера - одиноч-
методом измерения флуоресценции хлорофилла
ного слоя узловых клеток. Исходя из времени про-
имеют ряд преимуществ. Индикатором служит
хождения метаболита из клетки в клетку и данных
нативный флуоресцентный зонд - хлорофилл.
о плотности расположения плазмодесм в пористой
Транспортируемые метаболиты образуются в фи-
перегородке, можно оценить коэффициент диф-
зиологических количествах и только в цитоплаз-
фузии метаболитов внутри плазмодесм. По нашим
ме. Отсутствует повреждение клетки, сопутству-
оценкам он составил 3.6 10-8 см2/с, что находится
ющее микроинъекции. Этот метод позволяет на-
в близком соответствии с данными, полученными
прямую сравнивать перенос вещества по
при микроинъекции флуорофоров на другом объ-
внутриклеточному и трансклеточному пути.
екте (тычиночные волоски Setcreasea purpurea) [6].
В двух используемых конфигурациях экспери-
Трансклеточный перенос метаболитов оказал-
мента источник света и область измерения разде-
ся весьма чувствителен к изменению осмотиче-
ского давления среды. Замена стандартной среды
лены равным расстоянием, но в одном случае
проксимальный и дистальный участки сигнальной
на раствор с добавлением 0.15-0.20 М сорбита
цепи находятся в одной клетке, а в другом - в раз-
вызывала полное подавление трансклеточного
ных интернодальных клетках [50]. На рис. 3 пока-
переноса, но не оказывала влияния на внутрикле-
точный транспорт. Важно отметить, что осмоти-
заны изменения флуоресценции F', наблюдаемые
ческое воздействие не оказывало влияния на
при внутриклеточном и трансклеточном переносе
метаболитов (кривые 1 и 2 соответственно). Судя
скорость течения цитоплазмы и активность хло-
по площади под кривой, из клетки в клетку прохо-
ропластов. Проводимость плазмодесм, блокируе-
мая при повышении осмотического давления
дит около 30% фотометаболитов от их количества,
среды (при снижении внутреннего гидростатиче-
переносимого в клетке-доноре. Этот процент уди-
ского давления) полностью восстанавливалась
вительно высок, принимая во внимание, что в тор-
це интернодальной клетки поток цитоплазмы на-
при отмывании клетки свежей средой. Получен-
ные результаты заставляют пересмотреть сложив-
правлен тангенциально к клеточной стенке, а сум-
шееся представление о том, что понижение
марная площадь сечения плазмодесм составляет
внутреннего давления в клетках повышает прово-
<1% от пограничной межклеточной поверхности.
димость плазмодесм [5, 51]. Результаты, получен-
Время преодоления межклеточного барьера со-
ные на интактных клетках, напротив, свидетель-
ставляет около 11 с и не зависит от расстояния
ствуют о подавлении проводимости плазмодесм
между источником локального освещения и зоной
при осмотическом и солевом стрессе [50].
измерения [50]. Зависимости времени достижения
пика F' от разделяющего расстояния d при внутри-
Таким образом, новый неинвазивный подход
клеточной и трансклеточной конфигурациях идут
к изучению дальнего внутриклеточного и меж-
параллельно. Смещение по времени соответствует
клеточного транспорта уже дал разнообразные
БИОФИЗИКА том 65
№ 2
2020
298
БУЛЫЧЕВ и др.
новые сведения о роли циклоза в передаче мета-
15.
N. A. Krupenina, A. A. Bulychev, and U. Schreiber,
болических сигналов и о свойствах плазмодесм.
Protoplasma 248, 513 (2011).
Одна из задач предстоящих исследований состо-
16.
N. S. Allen and R. D. Allen, Ann. Rev. Biophys. Bio-
ит в выяснении того, в каких пределах может ме-
eng. 7, 497 (1978).
няться потребление и освобождение метаболитов
17.
T. Shimmen and E. Yokota, Curr. Opin. Cell Biol. 16,
хлоропластами на промежуточном сегменте сиг-
68 (2004).
нальной цепи при переходах свет-темнота и об-
18.
T. McConnaughey, Limnol. Oceanogr. 36, 619 (1991).
ратно. Вопросы микрофлуидной регуляции
19.
D. Menzel, Protoplasma 144, 73 (1988).
фотосинтеза, мембранных ионных потоков, не-
стационарных динамических структур и прово-
20.
I. Foissner and G. O. Wasteneys, J. Microsc. 247 (1), 10
димости плазмодесм в норме и патологии пред-
(2012).
ставляют важное направление биофизики клетки
21.
M. J. Beilby, Front. Plant Sci. 7, 1052 (2016).
и заслуживают дальнейшего изучения.
22.
N. Kamiya, Protoplasmic streaming (Springer, Wien,
1959).
23.
R. Scheibe, Plant Physiol. 96 (1), 1 (1991).
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
24.
M. Taniguchi and H. Miyake, Curr. Opin. Plant Biol.
Работа выполнена при финансовой поддержке
15, 252 (2012).
Российского фонда фундаментальных исследова-
25.
A. A. Bulychev, A. V. Alova, and A. B. Rubin, Eur. Bio-
ний (проекты №№ 16-04-00318 и 20-54-12015).
phys. J. 42, 441 (2013).
26.
A. A. Bulychev and A. A. Rybina, Protoplasma 255 (6),
КОНФЛИКТ ИНТЕРЕСОВ
1621 (2018).
Авторы заявляют об отсутствии конфликта
27.
A. V. Komarova, V. S. Sukhov, and A. A. Bulychev,
интересов.
Funct. Plant Biol. 45 (1-2), 236 (2018).
28.
A. A. Bulychev and S. O. Dodonova, Russ. J. Plant
Physiol. 58 (2), 233 (2011).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
29.
A. A. Bulychev and S. O. Dodonova, Biochim. Bio-
Настоящая работа не содержит описания ка-
phys. Acta 1807, 1221 (2011).
ких-либо исследований с использованием людей
30.
A. A. Bulychev and A. V. Komarova, Protoplasma 251
и животных в качестве объектов.
(6), 1481 (2014).
31.
A. A. Bulychev, in Plant electrophysiology: methods and
СПИСОК ЛИТЕРАТУРЫ
cell electrophysiology, Ed. by A. G. Volkov, (Springer,
Berlin, 2012), pp. 273-300.
1. M. Tominaga and K. Ito, Curr. Opin. Plant Biol. 27,
104 (2015).
32.
A. A. Bulychev and A. V. Komarova, Biochemistry
(Moscow) 79 (3), 273 (2014).
2. T. Shimmen, J. Plant Res. 120, 31 (2007).
33.
А. А. Булычев, Дальние взаимодействия и передача
3. R. E. Goldstein and J.-W. van de Meent, Interface Fo-
сигналов в клетках харовых водорослей. Тимиряев-
cus 5, 20150030 (2015).
ские чтения -76 (Наука, М., 2017).
4. W. F. Pickard, Plant, Cell Environ. 26, 1 (2003).
34.
S. O. Dodonova and A. A. Bulychev, Protoplasma 248,
5. K. J. Oparka and D. A. M. Prior, Plant J. 2 (5), 741
737 (2011).
(1992).
35.
A. A. Bulychev and A. V. Komarova, Biochim. Bio-
6. E. B. Tucker and J. E. Tucker, Protoplasma 174, 36
phys. Acta 1847, 379 (2015).
(1993).
36.
I. Foissner and G. O. Wasteneys, Plant Cell Physiol. 48
7. T. Nishiyama et al., Cell 174, 448 (2018).
(4), 585 (2007).
8. V. Z. Lunevsky, O. M. Zherelova, I. Ya. Vostrikov, et al.,
37.
A. A. Bulychev and I. Foissner, Plant Signal. Behav. 12
J. Membr. Biol. 72 (1), 43 (1983).
(9), e1362518 (2017)
9. G. N. Berestovsky and A. A. Kataev, Eur. Biophys. J.
38.
A. A. Bulychev and A. V. Komarova, Protoplasma 254
34, 973 (2005).
(1), 557 (2017).
10. W. J. Lucas and R. Nuccitelli, Planta 150, 120 (1980).
39.
A. A. Bulychev, A. A. Rybina, and I. Foissner, in Chlo-
11. M. J. Beilby, T. Mimura, and T. Shimmen, Protoplas-
roplasts and cytoplasm: structure and functions, Ed. by
ma 175, 144 (1993).
C. Dejesus and L. Trask (Nova Science, New York,
12. A. A. Bulychev, A. A. Cherkashin, A. B. Rubin, et al.,
2018), pp. 1-24.
Bioelectrochemistry 53, 225 (2001).
40.
A. A. Bulychev and N. A. Krupenina, Biochemistry
13. A. A. Bulychev, A. A. Polezhaev, S. V. Zykov, et al. J.
(Moscow) Suppl. Ser. A: Membr. Cell Biol. 2 (4), 387
Theor. Biol. 212, 275 (2001).
(2008).
14. N. A. Krupenina, A. A. Bulychev, M. R. G. Roelfsema,
41.
C. H. Foyer and G. Noctor, Antioxid. Redox Signal. 11
et al., Photochem. Photobiol. Sci. 7, 681 (2008).
(4), 861 (2009).
БИОФИЗИКА том 65
№ 2
2020
ТЕЧЕНИЕ ЦИТОПЛАЗМЫ КАК ВНУТРИКЛЕТОЧНЫЙ КОНВЕЙЕР
299
42. 42. A. A. Bulychev and A. V. Komarova, Biochim. Bio-
47. A. A. Bulychev, N. A. Kamzolkina, J. Luengviriya,
phys. Acta 1858 (5), 386 (2017).
et al., J. Membr. Biol. 202 (1), 11 (2004).
43. A. A. Bulychev and N. A. Krupenina, Bioelectrochem-
48. A. A. Bulychev and N. A. Krupenina, Plant Signal. Be-
istry 129, 62 (2019).
hav. 4 (8), 24 (2009).
44. Y. N. Antonenko and A. A. Bulychev, Biochim. Bio-
49. N. A. Krupenina and A. A. Bulychev, Biochim. Bio-
phys. Acta 1070, 279 (1991).
phys. Acta 1767, 781 (2007).
45. J. A. Feijó, J. Saihas, J. R. Hackett, et al. J. Cell Biol.
50. A. A. Bulychev, Protoplasma 256 (3), 815 (2019).
144 (3), 483 (1999).
51. V. Hernández-Hernández, M. Benítez, and A. Boud-
46. A. A. Bulychev and N. A. Kamzolkina, Bioelectro-
aoud, J. Exp. Bot.
71
(3),
768
(2020). DOI:
chemistry 69, 209 (2006).
10.1093/jxb/erz434.
Cytoplasmic Streaming as an Intracellular Conveyor: Effects on Photosynthesis
and H+ Fluxes in Chara Cells
A.A. Bulychev, A.V. Alova, N.A. Krupenina, and A.B. Rubin
Faculty of Biology, Lomonosov Moscow State University, Leninskie Gory 1/12, Moscow, 119991 Russia
Giant internodal cells of characean algae perform a fast (up to 100 μm/s) rotational cytoplasmic flow, which
ensures long-distance intracellular interactions and coordinates the functional activity of organelles under
nonuniform illumination. Specific functions of the rapid cytoplasmic streaming remain poorly understood.
Combining local illumination, measurements of chlorophyll fluorescence and extracellular pH at the cell re-
gions located downstream of locally applied light spot gives a convenient tool for detecting the lateral trans-
port of photometabolites and cyclosis-dependent regulation of photosynthesis and plasma-membrane H+
transport. Brightly illuminated chloroplasts export reducing equivalents and triose phosphates; the streaming
f luid distributes these metabolites over the cell leading to a transient increase in chlorophyll fluorescence in
areas of dim illumination away from the light source. The properties of cyclosis-mediated changes in fluores-
cence, including photoinduction of long-range interactions, sensitivity to metabolic inhibitors, inhomoge-
neous spatial distribution in illuminated cells, and the gradual (1-5 min) inactivation of long-distance signal
transmission after placing the cell in darkness are considered. The stimulatory effect of the action potential
on long-range signal transmission is shown. Application of a developed novel technique for the study of in-
tercellular transport of metabolites and analysis of plasmodesmal permeability is discussed.
Keywords: cytoplasmic streaming, long-range signaling, heterogeneous pH profiles, remote regulation of photosys-
tem II activity, plasmodesmata
БИОФИЗИКА том 65
№ 2
2020