БИОФИЗИКА, 2020, том 65, № 2, с. 310-314
БИОФИЗИКА КЛЕТКИ
УДК 577.23:616.36-056.25
ОСОБЕННОСТИ ЭНЕРГООБЕСПЕЧЕНИЯ ГЕПАТОЦИТОВ В УСЛОВИЯХ
РАЗЛИЧНОГО СОДЕРЖАНИЯ В РАЦИОНЕ НУТРИЕНТОВ
© 2020 г. О.Н. Волощук, Г.П. Копыльчук, К.А. Тазырова
Инcтитут биологии, xимии и биоpеcуpcов Чеpновицкого национального унивеpcитета им. Ю. Федьковича,
58012, Чеpновцы, ул. Леcи Укpаинки, 25, Укpаина
E-mail: o.voloschuk@chnu.edu.ua
Поступила в редакцию 03.06.2019 г.
После доработки 13.12.2019 г.
Принята к публикации 17.12.2019 г.
Исследована активность изоцитратдегидрогеназы, α-кетоглутаратдегидрогеназы и малатдегидроге-
назы, а также NADН-убихинонредуктазы в митохондриальной фракции печени крыс, содержав-
шихся в условиях различной обеспеченности рациона сахарозой и протеином. Результаты исследо-
ваний показали, что для животных, содержащихся на высокосахарозном рационе, характерна тен-
денция к снижению изоцитратдегидрогеназной и малатдегидрогеназной активности, а также
снижение активности α-кетоглутаратдегидрогеназы в 2.5 раза. При этом для животных, содержа-
щихся в условиях высокосахарозного рациона, характерно сохранение активности NADН-убихи-
нонредуктазы на уровне контрольных значений. В то же время в митохондриальной фракции пече-
ни животных, получавших высокосахарозный/низкобелковый рацион, наблюдается значительное
снижение ферментативных активностей NAD+-зависимых энзимов цикла Кребса при одновремен-
ном снижении активности NADН-убихинонредуктазы более чем 2.5 раза в сравнении с показателя-
ми контроля, что может рассматриваться как одно из звеньев механизма регуляции клеточной энер-
гетики в условиях нарушений сбалансированности рациона сахарозой и пищевым белком. Полу-
ченные результаты могут быть использованы для разработки стратегии коррекции метаболических
нарушений при разной обеспеченности рациона нутриентами.
Ключевые слова: изоцитратдегидрогеназа, α-кетоглутаратдегидрогеназа, малатдегидрогеназа,
NADН-убихинонредуктаза, печень, нутриенты.
DOI: 10.31857/S000630292002012X
Вопрос возможных механизмов формирова-
печения энергозависимых реакций, но и для ак-
ния метаболических нарушений в условиях нут-
тивации компенсаторных механизмов, направ-
ритивного дисбаланса в настоящее время остает-
ленных на коррекцию и устранение возникших
ся открытым [1-3]. В рационе современного че-
повреждений.
ловека преобладают легкоусвояемые углеводы,
Ключевыми реакциями, обеспечивающими
насыщенные жиры на фоне снижения обеспе-
поддержание необходимого клетке уровня NA-
ченности полноценным пищевым белком. При
DH, поставщика электронов для работы дыха-
этом хроническое употребление большого коли-
тельной цепи и обеспечения окислительного
чества сахарозы и алиментарная недостаточность
фосфорилирования, являются NAD+-зависимые
белка могут выступать предикторами индуциро-
реакции цикла Кребса. Поскольку цикл Кребса
вания и прогрессии метаболических нарушений
является связующим звеном многих метаболиче-
[4, 5].
ских путей, обеспечивает организм не только вос-
Одним из ключевых механизмов дисметаболи-
становленными коферментами, но утилизирует и
ческих изменений может выступать нарушение
поставляет субстраты для целого ряда биохими-
процессов энергообеспечения клеток. Наруше-
ческих реакций, то вопросы, связанные с регуля-
ние механизмов биотрансформации энергии
цией его функционирования, вызывают особен-
рассматриваются как определяющие для повре-
ный интерес [9].
ждения и гибели клеток [6]. При этом печень яв-
ляется основным органом, регулирующим энер-
Целью нашей работы было определение ак-
гетический метаболизм в организме в целом [7, 8].
тивности изоцитратдегидрогеназы, α-кетоглута-
Поддержание работы системы энергообеспече-
ратдегидрогеназы, малатдегидрогеназы, а также
ния гепатоцитов необходимо не только для обес-
NADН-убихинонредуктазы в митохондриях пе-
310
ОСОБЕННОСТИ ЭНЕРГООБЕСПЕЧЕНИЯ ГЕПАТОЦИТОВ
311
8
420
350
*
6
*
280
4
210
140
2
*, **
*, **
70
0
0
К
ВС
НПР/ВС
К
ВС
НПР/ВС
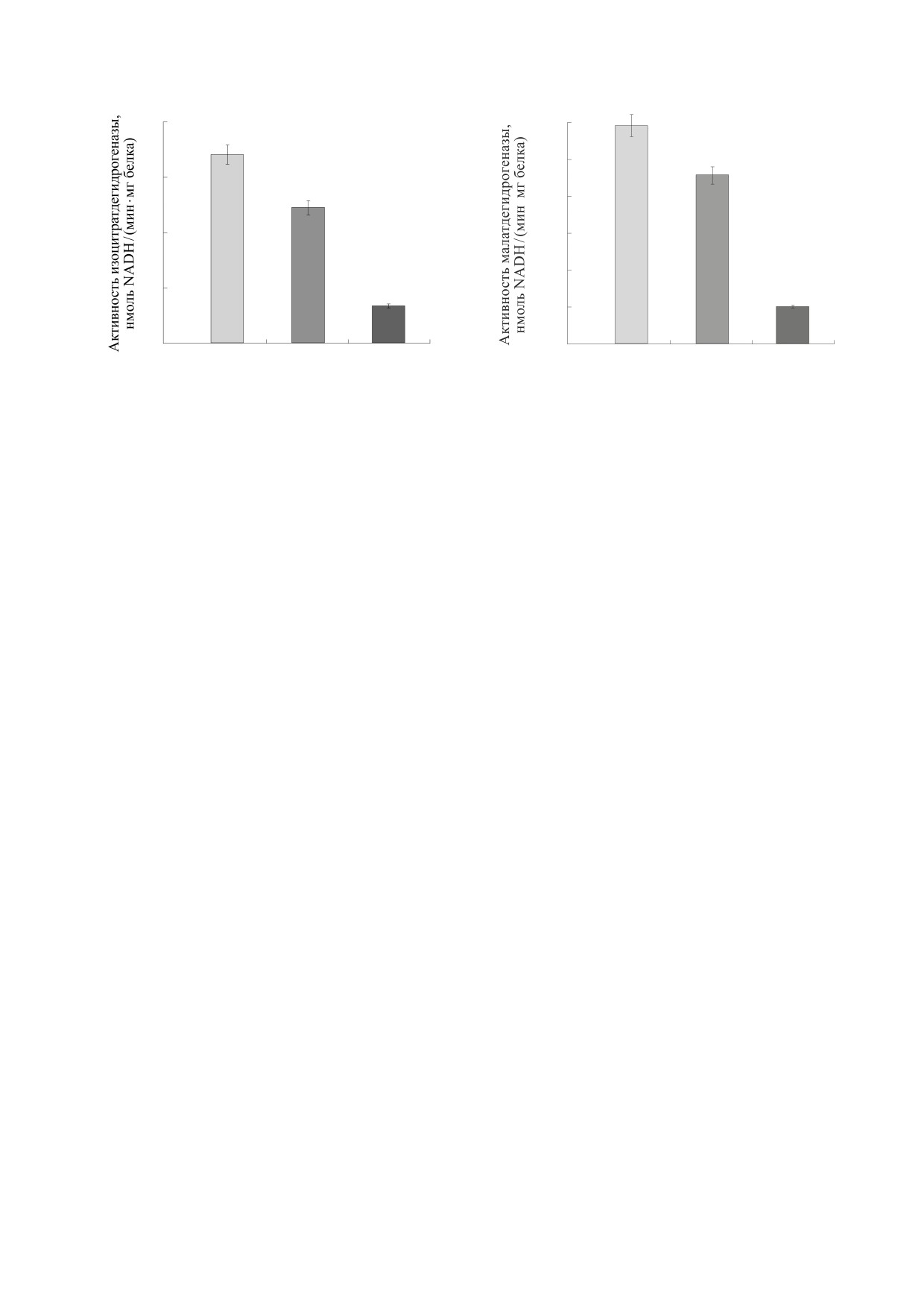
Рис. 1. Активность изоцитратдегидрогеназы в мито-
Рис. 2. Активность малатдегидрогеназы в митохон-
хондриях печени крыс, содержавшихся в условиях
дриях печени крыс, содержавшихся в условиях раз-
различной обеспеченности рациона сахарозой и про-
личной обеспеченности рациона сахарозой и протеи-
теином. Обозначения: К - крысы, содержащиеся на
ном. Обозначения, как на рис. 1.
полноценном полусинтетическом рационе, кон-
троль; ВС - крысы, содержащиеся на высокосахароз-
ном рационе; НПР/ВС - крысы, содержащиеся на
высокосахарозном/низкобелковом рационе. * - До-
Длительность эксперимента составляла 28 су-
стоверная разница по сравнению с контролем; ** -
ток. Цервикальную дислокацию крыс под легким
достоверная разница по сравнению с группой живот-
эфирным наркозом осуществляли на 29-е сутки
ных, содержащихся на высокосахарозном рационе.
эксперимента. Выделение митохондриальной
фракции из гомогената печени проводили мето-
чени крыс, содержавшихся в условиях различной
дом дифференциального центрифугирования
обеспеченности рациона сахарозой и протеином.
при 0-3°С [12].
Активность NAD+-зависимых дегидрогеназ
цикла Кребса в митохондриальной фракции пече-
МАТЕРИАЛЫ И МЕТОДЫ
ни определяли спектрофотометрически. Актив-
Исследования проводили на 36 белых нели-
ность изоцитратдегидрогеназы регистрировали по
нейных крысах массой 110-130 г и возрастом 2.0-
накоплению NADН в реакции превращения
2.5 месяца.
изоцитрата в α-кетоглутарат [13], активность ма-
латдегидрогеназы - по накоплению NADН в реак-
Крыс содержали по одной в пластмассовых
ции окисления малата [14]. Активность α-кетоглу-
клетках с песчаной подстилкой, доступ к воде
таратдегидрогеназы определяли спектрофотомет-
ad libitum. Нормирование суточного рациона про-
рически по интенсивности окисления α-кето-
водили с учетом принципа парного питания.
глутарата при λ = 417 нм [15]. Активность NADH-
Исследования проводили на трех группах жи-
убихинонредуктазы определяли спектрофотомет-
вотных: группа І - крысы, содержащиеся на пол-
рически и рассчитывали с использованием коэф-
ноценном полусинтетическом рационе (кон-
фициента молярной экстинции 6.22 ∙ 103 М-1 см-1
троль); группа II - крысы, содержащиеся на вы-
[16].
сокосахарозном рационе; группа III - крысы,
Cодеpжание белка опpеделяли по методу
содержащиеся на высокосахарозном/низкобел-
Лоуpи.
ковом рационе.
Статистический анализ данных проводили с
Животные группы І получали рацион, содер-
использованием критерия Стъюдента, различия
жащий 14% белка (в виде казеина), 10% жиров,
считали статистически значимыми при р < 0.05.
10% сахарозы, сбалансированный по всем нутри-
ентам [10]. Животные группы ІІ получали высо-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
косахарозный рацион, включающий 40% сахаро-
зы и сбалансированный по всем другим нутриен-
Результаты наших исследований показали, что
там [11]. Животные группы ІІI получали высо-
для животных, содержащихся на высокосахароз-
косахарозный/низкобелковый рацион, включа-
ном рационе, характерна тенденция к снижению
ющий 4.7% белка, 40% сахарозы и сбалансиро-
изоцитратдегидрогеназной (рис. 1) и малатдегид-
ванное соотношение микронутриентов.
рогеназной (рис. 2) активности. При этом актив-
БИОФИЗИКА том 65
№ 2
2020
312
ВОЛОЩУК и др.
50
0.9
0.8
40
0.7
0.6
30
0.5
*
20
0.4
0.3
*, **
*, **
10
0.2
0.1
0
К
0.0
К
ВС
НПР/ВС
Рис. 3. Активность α-кетоглутаратдегидрогеназы в
Рис. 4. Активность NADН-убихинонредуктазы в ми-
митохондриях печени крыс, содержавшихся в усло-
тохондриях печени крыс, содержавшихся в условиях
виях различной обеспеченности рациона сахарозой и
различной обеспеченности рациона сахарозой и про-
протеином. Обозначения, как на рис. 1.
теином. Обозначения, как на рис. 1.
ность α-кетоглутаратдегидрогеназы снижается в
том, что в исследуемых экспериментальных усло-
два с половиной раза (рис. 3). Вероятно, усилен-
виях, вероятно, пополнение пула NADН будет
ное торможение α-кетоглутаратдегидрогеназы
обеспечиваться реакциями гликолитической ок-
будет сопровождаться накоплением α-кетоглута-
сидоредукции либо окислительного декарбокси-
рата с последующим его использованием в других
лирования пирувата. Можно предположить, что в
метаболических путях. В первую очередь при на-
таких условиях будет накапливаться ацетил-КоА
рушении окисления α-кетоглутарата в митохон-
с последующим усилением синтеза триацилгли-
дриях наблюдается накопление цитрата, первого
церолов и накопления жира в гепатоцитах, по-
продукта цикла Кребса, что будет сопровождать-
скольку усиление липолиза при высокосахароз-
ся выходом его в цитозоль с последующим преоб-
ном рационе отмечено в других исследованиях
разованием обратно в ацетил-КоА и использова-
[20].
нием для биосинтеза липидов [17]. В литературе
В митохондриях клеток печени крыс, получав-
показано, что для активности α-кетоглутаратде-
ших высокосахарозный/низкобелковый рацион,
гидрогеназы существует порог, который может
наблюдается снижение активности изоцитратде-
быть существенно подавлен, прежде чем повлия-
гидрогеназы и α-кетоглутаратдегидрогеназы в
ет на максимальную скорость потребления кис-
пять раз (рис. 1 и 3), а активности малатдегидро-
лорода [18], поэтому уровни NADH могут широко
геназы - в шесть раз (рис. 2).
варьировать, прежде чем стать ограничивающим
Установленные изменения, с одной стороны,
фактором для клеточного дыхания. Этот факт
могут быть связаны с нарушением структурно-
позволяет предположить, что любое снижение
функциональной организации указанных энзи-
активности α-кетоглутаратдегидрогеназы может
мов, а с другой- нарушением их синтеза в услови-
рассматриваться как первая попытка адаптиро-
ях алиментарного дефицита протеина. Следстви-
вать метаболизм путем модуляции цикла Кребса,
ем установленного нами торможения активности
прежде чем нарушать функцию дыхательной це-
пи. Учитывая роль α-кетоглутаратдегидрогеназы
NAD+-зависимых энзимов цикла Кребса будет не
в процессах биотрансформации энергии, а также
только истощение пула NADН в митохондриях, а
метаболическом взаимодействии между мито-
и нарушение функционирования электронтранс-
хондриями и цитозолем клетки, установленные
портной цепи митохондрий. Кроме того, сниже-
изменения ее активности будут опосредовать из-
ние активности NAD+-зависимых энзимов цикла
менения метаболических процессов в целом [19].
Кребса может сопровождаться изменением соот-
ношения NAD+/NADН с последующим обраще-
Следует отметить, что для животных, содержа-
нием окислительного фосфорилирования и акти-
щихся в условиях высокосахарозного рациона,
вацией сопряженного с ним гидролиза АТР.
характерно сохранение активности NADН-уби-
Установленное нами снижение активности
хинонредуктазы на уровне контрольных значе-
ний (рис. 4). Указанный факт свидетельствует о
NAD+-зависимых энзимов указывает на тормо-
БИОФИЗИКА том 65
№ 2
2020
ОСОБЕННОСТИ ЭНЕРГООБЕСПЕЧЕНИЯ ГЕПАТОЦИТОВ
313
жение реакций цикла Кребса, следствием чего
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
будет истощение пула NADН, необходимого для
Работу с животными осуществляли с учетом
работы дыхательной цепи митохондрий. Измене-
положений Хельсинской декларации Всемирной
ния каталитических свойств исследуемых энзи-
медицинской ассоциации от 1964 г., дополнен-
мов, возможно, вызваны конформационными
ной в 1975, 1983 и 1989 гг. Все применимые меж-
изменениями их молекул вследствии окислитель-
дународные, национальные и институциональ-
ной модификации. Известно, что интенсифика-
ные принципы ухода и использования животных
ция свободнорадикальных реакций является од-
при выполнении работы были соблюдены.
ним из механизмов нарушения метаболических
процессов в условиях избыточного употребления
СПИСОК ЛИТЕРАТУРЫ
сахарозы [21].
1.
G. Wu, Food Funct. 7 (3), 1251 (2016).
Установленное нами снижение активности
митохондриальной NADН-убихинонредуктазы
2.
R. V. Tikole, R. Kulkarni, S. Uppinakudru, et al., Int.
J. Res. Ayurveda and Pharmacy 4 (4), 605 (2013).
более чем в два с половиной раза (рис. 4) может
рассматриваться как одно из звеньев механизма
3.
J. C. Malta de Oliveira, T. A. Ribeiro, L. P. Tófolo,
et al., J. Endocrin. 221 (2), 285 (2014).
регуляции клеточной энергетики в условиях на-
4.
M. Maciejczyk, J. Matczuk, M. Żendzian-Piotrowska,
рушений сбалансированности рациона сахарозой
et al., Nutrients 10 (10), 1 (2018).
и пищевым белком.
5.
A. Pezeshki, R. Zapata, A. Singh, et al., Sci. Rep. 6.
25145. (2016).
ВЫВОДЫ
6.
E. F. Mason and J. C. Rathmell, Biochim. Biophys.
Установлено, что в условиях содержания жи-
Acta 1813 (4), 645 (2011).
вотных на высокосахарозном рационе в митохон-
7.
L. Rui, Compr. Physiol. 4 (1), 177 (2014).
дриях клеток печени наблюдается тенденция к
снижению активности NAD+-зависимых энзи-
8.
M. G. Radaelli, F. De Cobelli, A. Esposito, et al., Oxi-
dative Medicine and Cellular Longevity 2019, 9796175
мов цикла Кребса при сохранении на уровне кон-
(2019).
троля показателей активности NADН- убихинон-
редуктазы, что может рассматриваться как адап-
9.
S. Satapati, N. E. Sunny, B. Kucejova, et al., J. Lipid
тация метаболизма в условиях избыточного
Res. 53, 1080 (2012).
поступления сахарозы. В условиях высокосаха-
10.
O. N. Voloshchuk and G. P. Kopylchuk, Biomed.
розного/низкопротеинового рациона выражен-
Khimiya 62 (2), 169 (2016).
ное снижение активности изоцитратдегидрогена-
11.
F. Fernandes-Lima, L. Monte, F. Nascimento, and
зы, малатдегидрогеназы и α-кетоглутаратдегид-
B. Gregório, Tissues Organs 201 (6), 464 (2016).
рогеназы сопровождается торможением более
чем в два раза активности NADН-убихинонре-
12.
O. N. Voloshchuk and G. P. Kopylchuk, Biophysics 60
дуктазы, что может рассматриваться как одно из
(3), 420 (2015).
звеньев механизма регуляции клеточной энерге-
13.
Y.-C. Huang, S. Soundar, and A. F. Colman, Prot. Sci.
тики в условиях нарушения сбалансированности
9, 104 (2000).
рациона сахарозой и пищевым белком.
14.
P. Cetica, L. Pintos, G. Dalvit, et al., Reproduction
Полученные результаты могут быть использо-
126, 753 (2003).
ваны для разработки стратегии коррекции мета-
15.
G. Kiss, C. Konrad, J. Doczi, et al., FASEB J. 27, 2392
болических нарушений при разной обеспеченно-
(2013).
сти рациона нутриентами.
16.
I. V. Sharova and N. L. Vekshin, Biophysics 49 (5), 814
(2004).
ФИНАНСИРОВАНИЕ РАБОТЫ
17.
R. Vatrinet, G. Leone, M. De Luise, et al., Cancer &
Работа выполнена в рамках НИР «Биохимиче-
Metabolism 5, 3 (2017).
ские и лазерно-поляриметрические параметры
18.
M. J. Kumar, D. G. Nicholls, and J. K. Andersen, J. Bi-
комплексного прогнозирования метаболических
ol. Chem. 278, 46432 (2003).
нарушений», № госрегистрации 0119U100717.
19.
G. E. Gibson, J. P. Blass, M. F. Beal, and V. Bunik,
Mol. Neurobiol. 31 (1-3), 43 (2005).
КОНФЛИКТ ИНТЕРЕСОВ
20.
S. M. M. Ragab, S. Kh. A. Elghaffar, T. H. El-Metwal-
Авторы заявляют об отсутствии конфликта
ly, et al., Lipids in Health and Disease 14, 83 (2015).
интересов.
21.
K. Prasad and I. Dhar, Int. J. Angiol. 23 (4), 217 (2014).
БИОФИЗИКА том 65
№ 2
2020
314
ВОЛОЩУК и др.
Peculiarities of Hepatocyte Energy Metabolism when the Nutrient Content
in the Chow Diet Varies
O.N. Voloshchuk, G.P. Kopylchuk, and K.А. Tazirova
Institute of Biology, Chemistry, and Bioresources, Fedkovych Chernivtsi National University,
Chernivtsi, ul. Lesi Ukrainki 25, 58012 Ukraine
This paper reports a study of the activity of the isocitrate dehydrogenase, α-ketoglutarate dehydrogenase and
malate dehydrogenase and the NADH:ubiquinone reductase in the mitochondrial fraction from the liver tis-
sues of rats fed diets of different sucrose and protein content. Our results show that in animals fed the high-
sucrose diet, isocitrate dehydrogenase and malate dehydrogenase activities tend to decline and α-ketogluta-
rate dehydrogenase activity decreases 2.5 times. Interestingly, in animals, fed the high-sucrose diet,
NADH:ubiquinone reductase activity remains at the control level. At the same time, in the mitochondrial
fraction from the liver tissues of rats fed a low-protein:high-sucrose diet, the enzyme activities of NAD+-de-
pendent dehydrogenases of the Krebs cycle decrease considerably more than 2.5 times as compared to con-
trol with a simultaneous decline in the activity of NADH:ubiquinone reductase. This is probably one of the
links of the mechanism by which energy generated in the cell is regulated when a sucrose:protein ratio in the
chow diet is unbalanced. The results obtained can be used to develop a strategy for correction of the metabolic
disturbances when the nutrient content in the chow diet varies.
Keywords: isocitrate dehydrogenase, α-ketoglutarate dehydrogenase, malate dehydrogenase, NADH:ubiquinone
reductase, liver, nutrients
БИОФИЗИКА том 65
№ 2
2020