БИОФИЗИКА, 2020, том 65, № 2, с. 315-319
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ФУНКЦИОНАЛЬНАЯ АКТИВНОСТЬ МИТОХОНДРИЙ В ВОДНОЙ СРЕДЕ
С УМЕНЬШЕННЫМ СОДЕРЖАНИЕМ ДЕЙТЕРИЯ
© 2020 г. Н.В. Лобышева*, С.В. Нестеров** ***, Ю.А. Скоробогатова*, В.И. Лобышев****
*Научно-исследовательский институт физико-химической биологии имени А.Н.Белозерского Московского
государственного университета имени М.В. Ломоносова, 119992, Москва, Ленинские горы, 1/40
**Институт цитохимии и молекулярной фармакологии, 115409, Москва, 6-я Радиальная ул., 24/14
***Московский физико-технический институт, 141701, Долгопрудный Московской обл., Институтский пер., 9
****Физический факультет Московского государственного университета имени М.В. Ломоносова,
119991, Москва, Ленинские горы, 1/2
E-mail: lobyshev@yandex.ru
Поступила в редакцию 10.01.2020 г.
После доработки 10.01.2020 г.
Принята к публикации 24.01.2020 г.
Исследована эффективность фосфорилирования в образцах изолированных митохондрий печени
крыс в инкубационных средах с переменным изотопным составом по дейтерию - 6, 60, 90, 120,
150 ppm, а также 0.1, 1 и 2%. В средах с пониженным содержанием дейтерия (до 60 ppm)
наблюдается монотонное снижение коэффициента АДФ/О, а его величина при 6 ppm такая же, как
при 60 ppm. Исследована также генерация супероксид аниона комплексами I, II и III дыхательной
цепи митохондрий. При всех исследованных режимах функционирования митохондрий с исполь-
зованием ингибиторов дыхательной цепи генерация супероксид аниона не зависела от концентра-
ции дейтерия в среде инкубации.
Ключевые слова: митохондрии, электрон-транспортный перенос, ингибиторы, супероксид-анион,
перекись водорода, фосфорилирование, дейтерий воды, изотопные эффекты.
DOI: 10.31857/S0006302920020131
Давно установлено, что дыхание интакт-
зоны, где D/H = 0.0178 ат. % (178 ppm) [3].
ных митохондрий, субмитохондриальных ча-
Считая, что величина изотопного эффекта в
стиц и изолированных комплексов электрон-
дыхании митохондрий будет линейно зави-
ного транспорта ингибируется в D2O [1, 2].
сеть от концентрации дейтерия в водной сре-
Наиболее сильные изотопные эффекты в
де, трудно ожидать значимых эффектов при
концентрированной тяжелой воде, составля-
природных вариациях дейтерия и даже если
ющие около 50%, наблюдаются в процессах,
дейтерий в воде будет полностью отсутство-
связанных с фосфорилированием, т. е. в ци-
вать. Тем не менее еще в 30-х годах XX века
тохромном участке. Известно, что природная
были обнаружены значительные изотопные
вода содержит в среднем около 0.015% (или
эффекты в живых организмах в воде, содер-
150 ppm) атомов дейтерия. В природе эта ве-
жащей повышенное содержание дейтерия до
личина варьирует в различных источниках в
0.06% [4]. Активирующее влияние талой во-
результате фракционирования изотопов дей-
ды из снега на живые организмы, обуслов-
терия при фазовых переходах воды, а также
ленное пониженной концентрацией дейте-
при ее адсорбции. При равновесии в тройной
рия, было впервые показано в работах [5, 6],
точке воды меньше всего дейтерия будет в па-
где было доказано также, что наблюдаемые
ровой фазе и больше всего - в твердой, но эти
эффекты связаны именно с пониженной
эффекты относительно малы. Наиболее
концентрацией дейтерия. Обзор ранних ра-
обедненная дейтерием вода отмечается в
бот и работ автора на эту тему можно прочи-
осадках Южного полюса, где отношение
тать в [7], более поздних работ в [8]. До сего-
D/H = 0.0089 ат. % (89 ppm), а наиболее обо-
дняшнего времени адекватное объяснение
гащенная - в закрытых бассейнах аридной
эффектов, сопровождающих вариации изо-
315
316
ЛОБЫШЕВА и др.
топного состава воды в области малых кон-
в препарате митохондрий, а также использовани-
центраций дейтерия, отсутствует. При этом
ем невысокой (ниже насыщения ферментов)
концентрации фосфата и АДФ, что ограничивало
стоит отметить гипотезу «изотопного резо-
скорость фосфорилирования.
нанса», включающую в рассмотрение основ-
ные изотопы биомакромолекул - углерод,
Длительность одной записи полярограммы со-
ставляла 8 мин. За это время митохондрии не
дейтерий, кислород и азот [9]. По-видимому,
успевали получить заметных окислительных по-
невозможно выделить лишь одну органеллу
вреждений, о чем свидетельствовало постоянство
либо какой-либо один процесс, ответствен-
скорости дыхания при фосфорилировании в кон-
ный за наблюдаемые неожиданно большие
трольных экспериментах. Сразу после выделения
эффекты в живых организмах при относи-
митохондрий начинали снимать первую серию от
тельно небольшом изменении содержания
6 ppm дейтерия до больших концентраций. После
дейтерия в водной среде, однако митохон-
завершения первой серии эксперимента, измере-
дрии, являющиеся основным поставщиком
ния проводили повторно в том же порядке. Время
энергии в виде АТФ и генератором активных
между записями соответствующих полярограмм
форм кислорода, являются явными претен-
первой и второй серий составляло около двух ча-
дентами на объяснение наблюдаемых
сов. Измерения на митохондриях одной крысы
повторялись дважды. Всего было поставлено два
эффектов.
эксперимента, т. е. проведено четыре измерения
для каждой концентрации дейтерия.
МАТЕРИАЛЫ И МЕТОДЫ
Образование H2O2 измеряли с использовани-
ем красителя Ampex Red, как описано ранее [11].
В экспериментах использовали самок крыс
К инкубационной среде митохондрий, содержа-
линии Wistar массой около 200 г. Использовали
щей 120 мМ KCl, 10 мМ НЕРЕS-трис, 2 мМ
митохондрии, выделенные из печени самок крыс
K2HPO4 при pH 7.4, добавляли 10 мкM Amplex
по стандартной методике [10]. В течение экспери-
мента митохондрии хранили в густой суспензии
Red и 5 ед./мл пероксидазы хрена. Интенсив-
(концентрация белка примерно 150 мг/мл) на
ность флюоресценции регистрировали прибором
льду в пробирках типа «Эппендорф» с небольшим
FluoroMax (Horiba Jobin Yvon GmbH, Германия)
количеством среды промывки (210 мМ маннито-
на длине волны 600 нм при длине волны возбуж-
ла, 40 мМ сахарозы, 5 мМ HEPES, 0.5 мМ ЭДТА,
дения 530 нм. Для калибровки использовали
рН 7.4). Среда измерения (320 мОсм, pH 7.4) со-
стандартные растворы перекиси водорода. В экс-
держала 285 мМ маннитола, 13 мМ KCl, 3 мМ
перименте проводили последовательное ингиби-
HEPES, 0.25 мМ ЭДТА, 1 мМ MgCl2. Стабилиза-
рование комплексов дыхательной цепи митохон-
дрий: вначале добавляли 1 мкM ротенона (инги-
цию температуры 30°С осуществляли с помощью
битор комплекса I), затем добавляли 1 мкM
термостата F25 (JULABO GmbH, Германия) с
антимицина (ингибитор N-центра комплекса III
точностью 0.1°С. Скорость дыхания митохон-
дыхательной цепи), затем добавляли 1 мкM мик-
дрий измеряли полярографическим методом в
сотиазола (ингибитор P-центра комплекса III ды-
ячейке объемом 600 мл с использованием кисло-
хательной цепи).
родного электрода Кларка (Strathkelvin Mitocell
MT200, Oxygen Meter 782; Cole-Parmer, США). В
Для приготовления растворов инкубационной
ячейку добавляли 3 мкл суспензии митохондрий.
среды использовали воду ОАО «Алмаз» (Москва) с
Фосфорилирование измеряли в условиях работы
удельной электропроводностью 3.61 мкСм/см, со-
сукцинатдегидрогеназы (комплекса II), в присут-
держащую изотопы дейтерия (D = 4 ppm) и тяжело-
ствии 0.5 мкМ ротенона и 3 мМ янтарной кисло-
го кислорода (18O = 849 ppm и 17О = 170 ppm). С уче-
ты в ячейке полярографа. Для запуска фосфори-
том разбавления суспензии митохондрий исследо-
лирования добавляли 160 мкМ АДФ и 250 мкМ
вали при пониженных концентрациях дейтерия (6,
фосфата.
60, 90 и 120 ppm). Содержание дейтерия в обычной
воде принимали за 150 ppm. Повышенное содержа-
Параметр АДФ/О, характеризующий эффек-
ние дейтерия обеспечивали добавлением необходи-
тивность работы дыхательной цепи, рассчитыва-
ли как отношение молярного количества добав-
мого количества тяжелой воды (D2O с концентра-
ленного АДФ к количеству атомарного кислоро-
цией 99.6%) до величин 1000 ppm, 10000 ppm (1%),
да, поглощенного суспензией митохондрий за
20000 ppm (2%).
время полного фосфорилирования добавленного
АДФ. Максимальное теоретическое значение
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
этого параметра в условиях работы комплекса II
равно двум. Более низкое значение АДФ/О в на-
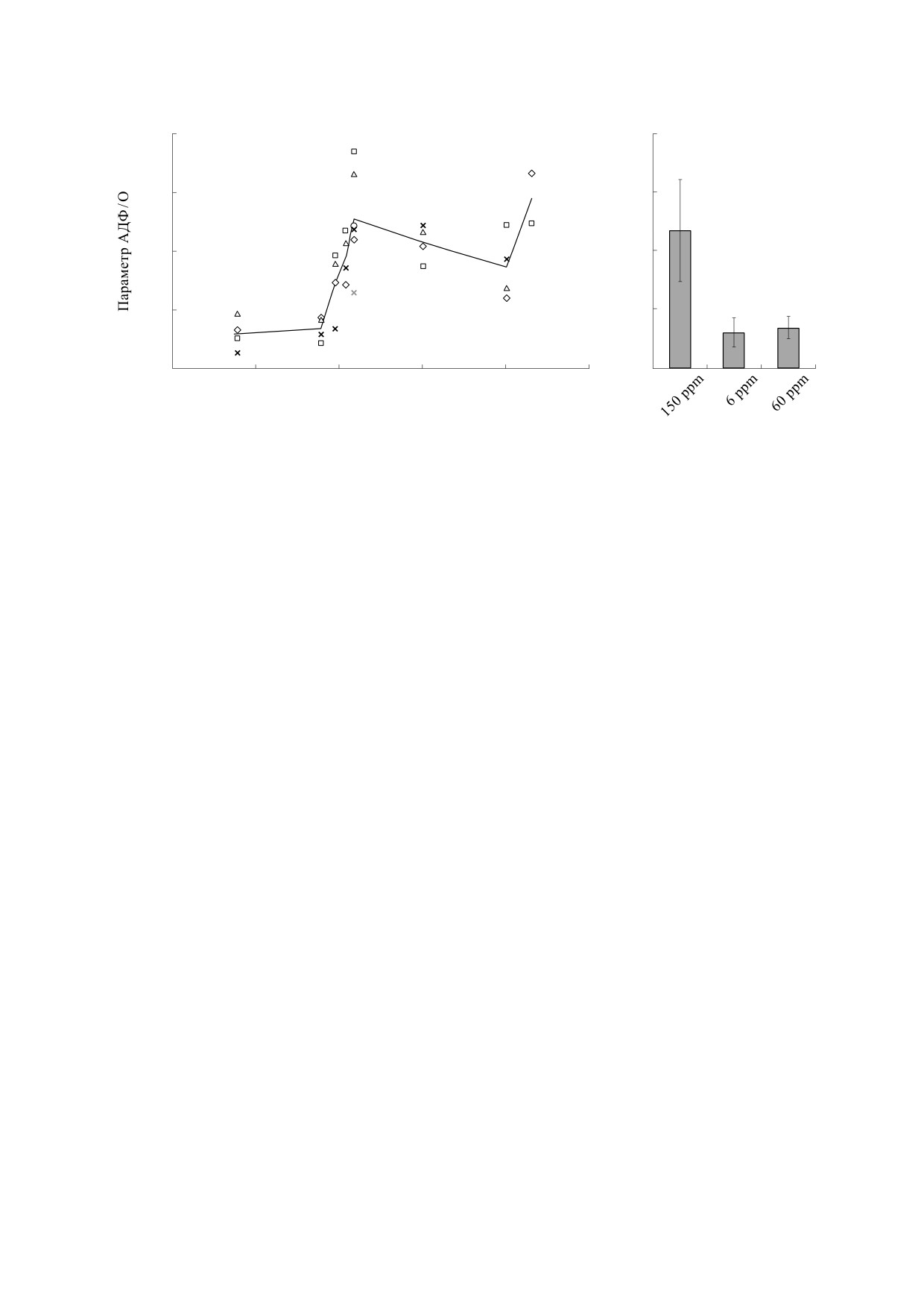
Результаты измерения фосфорилирования
ших экспериментах может быть связано с нали-
АДФ суспензией митохондрий представлены на
чием жирных кислот (природных разобщителей)
рис. 1. Видно, что как уменьшение, так и увеличе-
БИОФИЗИКА том 65
№ 2
2020
ФУНКЦИОНАЛЬНАЯ АКТИВНОСТЬ МИТОХОНДРИЙ
317
(а)
(б)
1.15
1.15
АДФ/O
1.05
1.05
0.95
0.95
0.85
0.85
0.75
0.75
1
10
100
1000
10000
100000
Cодержание дейтерия в среде, ppm
Рис. 1. (а) - Параметр АДФ/О, характеризующий эффективность фосфорилирования. Разными символами обозна-
чены разные серии экспериментов. Линия иллюстрирует зависимость средних значений. (б) - Гистограмма, иллю-
стрирующая количественное сопоставление экспериментальных данных. Границы погрешностей характеризуют
стандартное отклонение (N = 4 при 6 и 60 ppm и N = 6 при 150ppm). При 6 и 60 ppm отличие от контроля удовлетворяет
уровню значимости 0,05, при 10000 ppm - уровню значимости 0,1.
ние содержания в воде относительно его есте-
HEPES. Ранее было показано, что именно в таких
ственного содержания приводит к значимому
условиях наблюдается формирование фракции
уменьшению эффективности фосфорилирова-
неравновесных мембрано-связанных ионов во-
ния. В ряду понижающихся концентраций дейте-
дорода, которая используется для синтеза АТФ
рия 150-120-90-60 ppm наблюдается монотон-
[12]. Эта фракция ионов водорода существенно
ное усиление ингибирования. Эффективность
зависит от структурной организации воды у по-
фосфорилирования при 6 ppm минимальна и не
верхности мембраны, а значит, может быть наи-
отличается от таковой при 60 ppm. С увеличением
более чувствительна к изотопному эффекту.
концентрации дейтерия от его природного содер-
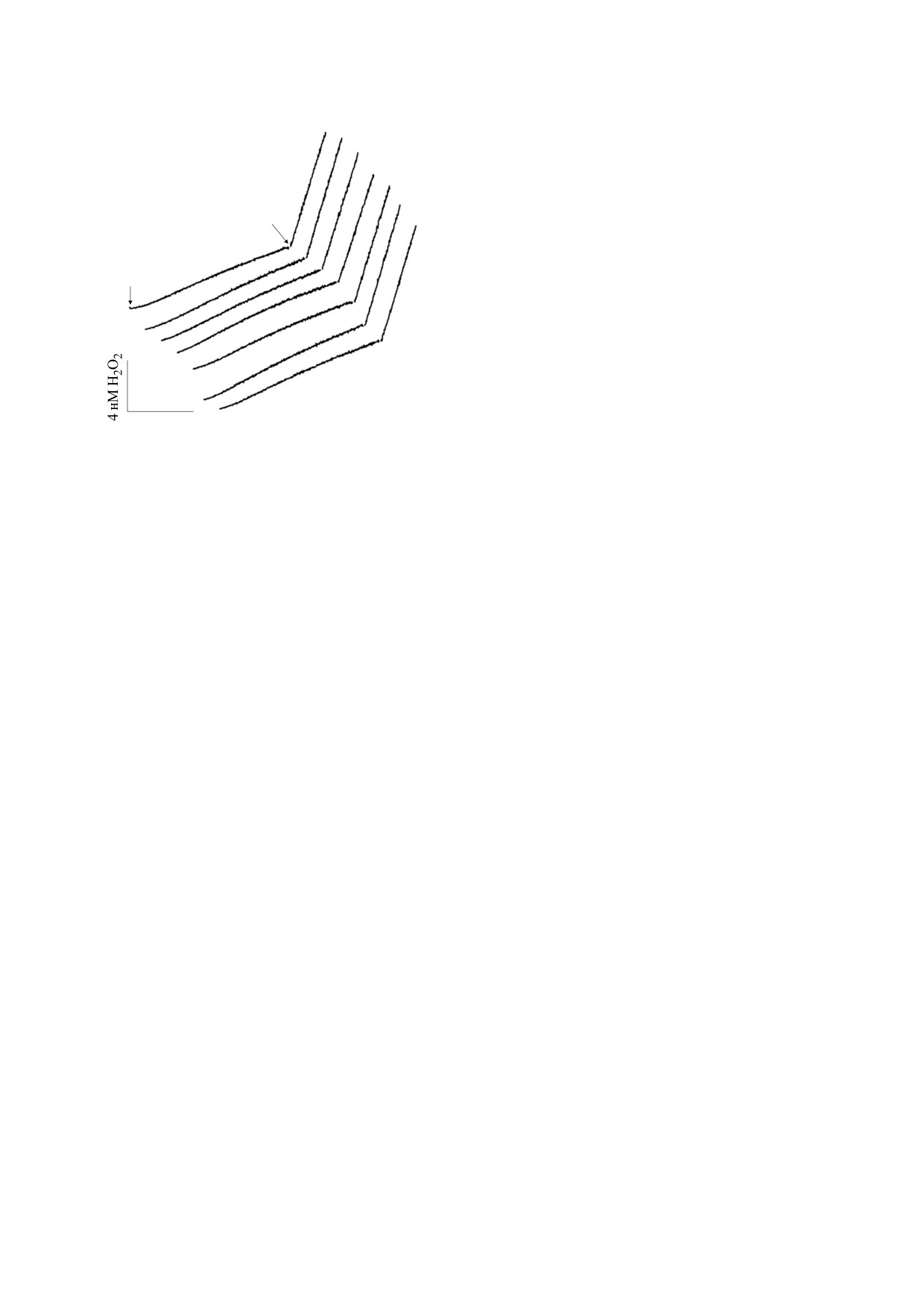
Характерные примеры результатов измерений
жания до 1% эффективность фосфорилирования
продукции перекиси водорода в присутствии ин-
также уменьшается, но в меньшей степени. При
гибиторов представлены на рис. 2. В дыхательной
дальнейшем увеличении концентрации дейтерия
цепи митохондрий известны три источника, ге-
до 2% наблюдается активация фосфорилирова-
нерирующие супероксид-анион: комплекс I, про-
ния, достигающая значения в обычной воде. Из-
дуцирующий супероксид-анион в процессе
мерение скорости поглощения кислорода дало
обратного электронного переноса с комплекса II;
среднее значение 22.5 мкмоль О2/мин, но боль-
Р-центр комплекса III, активно продуцирующий
шой разброс (связанный со временем, прошед-
супероксид-анион в случае блокады N-центра
шим после выделения митохондрий) при каждой
Q-цикла; комплекс II, продуцирующий суперок-
концентрации дейтерия в образцах не позволил
сид-анион на флавиновом центре при прямой (с
обнаружить наличие изотопных эффектов в среде
флавина на коэнзим Q) и обратной (с коэнзима Q
в интервале использованных концентраций.
на флавин) реакциях переноса электрона [13-15].
Различие в параметре АДФ/О на фоне отсутствия
Экспериментально фиксировали скорость обра-
достоверных отличий в скорости фосфорилиро-
зования перекиси водорода, в которую суперок-
вания и значении дыхательного контроля (соот-
сид анион быстро превращался в митохондриях
ношение скоростей дыхания при фосфорилиро-
благодаря работе супероксиддисмутазы. На рис. 2
вании и в его отсутствие) вызвано тем, что разли-
видно, что скорость генерации не имеет суще-
чия в потреблении кислорода в образцах с разной
ственных отличий в образцах с различными
концентрацией дейтерия были существенны в ос-
концентрациями дейтерия в среде: как при гене-
новном при низких концентрациях АДФ, дости-
рации супероксид-аниона комплексом I, так и
жимых к концу процесса фосфорилирования.
комплексом III (индуцировалось добавление ан-
Необходимо отметить, что измерения эффек-
тимицина А - ингибитора N-центра комплекса
тивности фосфорилирования проводились в
III). Ингибитор P-центра комплекса III миксоти-
условиях невысокой концентрации фосфата и от-
азол практически полностью устранял вызван-
носительно низкой концентрации буфера
ную антимицином А генерацию супероксид-ани-
БИОФИЗИКА том 65
№ 2
2020
318
ЛОБЫШЕВА и др.
активация максимальной скорости генерации
2 %
1 %
0.1 %
Н2О2 изолированными митохондриями печени
150 ppm
крыс при использовании воды с содержанием
90 ppm
дейтерия 52 ppm без использования ингибиторов
Ротенон 1 мкМ
60 ppm
дыхательной цепи. Следует отметить, что наши
Антимицин А 1 мкМ
6 ppm
эксперименты (рис. 2) проводились в условиях
окисления сукцината и наличия АТФ, что гаран-
тировало высокий мембранный потенциал, слу-
Сукцинат2мМ
АТФ2мМ
жащий важным фактором генерации АФК, в осо-
бенности при реакции обратного переноса элек-
тронов с комплекса II на комплекс I. Однако в
опытах, в которых ротенон присутствовал с само-
го начала эксперимента, нам также не удалось
увидеть изотопных эффектов. Сравнение полу-
ченных в настоящей работе и литературных ре-
зультатов дает возможность предположить, что
изотопный эффект дейтерия в генерации переки-
2 мин
си водорода может проявляться в условиях пря-
мого электронного переноса на комплексе I (c
(образующейся из суперок-
Рис. 2. Продукция Н2О2
NADH на убихинон), однако это предположение
сид-аниона) образцами выделенных митохондрий
требует дополнительной проверки. Стоит отме-
при различных концентрациях дейтерия. Первая
часть графиков (около 5 мин) соответствует генера-
тить, что кроме комплексов дыхательной цепи
ции супероксид-аниона в процессе обратного элек-
источником супероксид-аниона в митохондриях
тронного транспорта на комплексе I. Вторая часть
могут выступать некоторые ферменты цикла
графиков (в присутствии ротенона и антимицина А)
Кребса. Нельзя исключать влияния дейтерия на
соответствует генерации супероксид-аниона ком-
плексом III.
их функционирование.
Известна еще одна работа [16], в которой
она, однако в этом режиме различий в генерации
опытной группе крыс предоставляли для питья
супероксид-аниона между средами с разными
воду с содержанием дейтерия 46 ppm в течение
концентрациями дейтерия также не наблюдалось
28 суток и затем анализировали продукцию пере-
(данные не приведены). Помимо этого ингиби-
киси водорода изолированными митохондриями
торный анализ был проведен при работе ком-
в среде с нормальным содержанием дейтерия и
плекса II при низких концентрациях сукцината
пониженным до 46 ppm. Было показано, что ми-
(100 мкМ) в присутствии ротенона (ингибитора,
тохондрии печени крыс, адаптированных к об-
эффективно блокирующего реакцию как прямо-
легченной по дейтерию воде, в этой же воде про-
го, так и обратного переноса электронов в ком-
дуцируют на 35% большее количество Н2О2 , чем
плексе I). В условиях неполного насыщения ком-
митохондрии крыс, выросших в нормальных
плекса II скорость синтеза супероксид-аниона
условиях и тестируемых в обычной воде. Каче-
была выше, чем при 2 мМ сукцината, однако от-
ственно этот эффект наблюдается как с добавле-
личий между образцами с различной концентра-
нием сукцината, так и без добавления субстрата
цией дейтерия также не наблюдалось (данные не
за счет внутренних метаболитов. Важным резуль-
приведены). Полученные результаты по измере-
татом, на который авторы не обратили должного
нию скорости синтеза супероксид-аниона в об-
внимания, является то, что митохондрии печени
разцах изолированных митохондрий полностью
крыс, адаптированные к облегченной воде, но те-
согласуются с литературой, однако в средах изме-
стируемые в обычной воде, показали такие же ре-
рения с изотопным составом среды 6, 60, 90, 120,
зультаты, как и в контроле. Это означает, что изо-
150 ppm, а также 0.1 и 1%, генерация перекиси во-
топные эффекты облегченной воды обусловлены
дорода оказалась одинаковой с высокой точно-
действием воды как растворителя и не затрагива-
стью (расхождение не более наблюдаемого между
ют существенно системы живой клетки в процес-
контрольными экспериментами). Таким обра-
се долговременной адаптации животных к воде с
зом, можно заключить, что в условиях экспери-
облегченным изотопным составом. Этот резуль-
мента изменение концентрации дейтерия не ока-
тат косвенно подтверждается недавней работой
зывало влияния на продукцию супероксид-анио-
[18], в которой новейшими методами «окс-ред
на комплексами I, II и III дыхательной цепи.
протеомики» (Ox-Red Proteomics) при анализе
Полученные результаты по генерации переки-
2935 белков выявлена роль митохондриальных
си водорода отличаются от опубликованных ра-
белков в изменении окислительно-восстанови-
нее [16], где была показана примерно двукратная
тельного статуса клеточных культур при помеще-
БИОФИЗИКА том 65
№ 2
2020
ФУНКЦИОНАЛЬНАЯ АКТИВНОСТЬ МИТОХОНДРИЙ
319
нии их в среду с облегченным изотопным соста-
3. В. И. Ферронский и В. А. Поляков, Изотопия
вом по дейтерию.
гидросферы Земли (Изд-во «Научный мир», М.,
2009).
4. T. C. Barnes, Science 79 (2050), 370 (1934).
ФИНАНСИРОВАНИЕ РАБОТЫ
5. Б. Н. Родимов, Сельское хоз-во Сибири, № 7б, 66
Часть работы (измерение дыхания митохон-
(1961).
дрий) выполнена при поддержке гранта РФФИ
6. И. В. Торопцев, Б. Н. Родимов, А. М. Маршунина
19-04-00835\19.
и др., в сб. Вопросы радиобиологии и гематологии
(Изд-во Томского ун-та, Томск, 1966), сс. 118-126.
7. В. И. Лобышев, Актуальные вопросы биологиче-
БЛАГОДАРНОСТИ
ской физики и химии 3 (3), 511 (2018).
Авторы благодарят Л.С. Ягужинского за полез-
8. A. Basov, L. Fedulova, M. Baryshev, and S. Dzhimak,
ные обсуждения.
Nutrients 11, 1903 (2019).
9. X. Xie and R. A. Zubarev, Sci. Rep. 5, 9215 (2015).
КОНФЛИКТ ИНТЕРЕСОВ
10. D. Johnson and H. Lardy, in Methods in Enzymology,
ed. by R. W. Estbrook and M. E. Pullman (N.-Y., Acad.
Авторы заявляют об отсутствии конфликта
Press, 1967), v. 10, pp. 94-96.
интересов.
11. A. A. Selin, N. V. Lobysheva, O. N. Vorontsova, et al.,
Bull. Exp. Biol. Med. 153 (1), 44 (2012).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
12. С. А. Еремеев и Л. С. Ягужинский, Биохимия 80
(5), 682 (2015).
Все проведенные процедуры по содержанию и
13. M. D. Brand, Exp. Gerontol. 45, 466 (2010).
использованию животных соответствовали стан-
дартам Международной ассоциации по оценке и
14. F. L. Muller, Y. Liu, H. Van Remmen, J. Biol. Chem.
аккредитации работ с лабораторными животны-
279, 49064 (2004).
ми (AAALAC).
15. C. L. Quinlan, A. L. Orr, I. V. Perevoshchikova, et al.,
J. Biol. Chem. 287, 27255 (2012).
16. И. А. Помыткин и О. Е. Колесова, Бюл. эксперим.
СПИСОК ЛИТЕРАТУРЫ
биологии и медицины 142 (11), 514 (2006).
1. S. A. Margolis, H. Baum, and G. Lenaz, Biochem.
17. С. С. Джимак, А. А. Басов, Н. Н. Волченко и др.,
Biophys. Res. Commun. 25 (1), 133 (1966).
Докл. РАН 476 (5), 584 (2017).
2. В. И. Лобышев и Л. П. Калиниченко, Изотопные
18. X. Zhang, M. Gaetani, A. Chernobrovkin, and
эффекты D2 O в биологических системах (Наука,
R. A. Zubarev, Mol. Cell. Proteomics 18 (12), 2373
М., 1978).
(2019).
Functional Activity of Mitochondria in Deuterium Depleted Water
N.V. Lobysheva*, S.V. Nesterov**, ***, Yu.A. Skorobogatova*, and V.I. Lobyshev****
*Belozersky Research Institute for Physico-Chemical Biology, Lomonosov Moscow State University,
Leninskie Gory 1/40, Moscow, 119992 Russia
**Institute of Cytochemistry and Molecular Pharmacology, 6-ya Radialnaya ul. 24/14, Moscow, 115409 Russia
***Moscow Institute of Physics and Technology, Institutskii per. 9, Dolgoprudny, Moscow Region, 141701 Russia
****Faculty of Physics, Lomonosov Moscow State University, Leninskie Gory 1/2, Moscow, 119991 Russia
The efficiency of phosphorylation in samples of isolated rat liver mitochondria in isotopically different incu-
bation media at deuterium content of 6, 60, 90, 120, 150 ppm, and 0.1, 1, and 2% was studied. In environ-
ments with the lowest deuterium content down to 60 ppm, there was a monotonic decline in the ADP/O ra-
tio, and its value at 6 ppm was equivalent to that seen at 60 ppm. The generation of superoxide anion by com-
plexes I, II and III of the mitochondrial respiratory transport chain was also investigated. In all studied modes
of mitochondrial operation using electron chain inhibitors the generation of superoxide anion did not depend
on the deuterium concentration in the incubation medium.
Keywords: mitochondria, electron transport, inhibitors, superoxide anion, hydrogen peroxide, phosphorylation,
water deuterium, isotopic effects
БИОФИЗИКА том 65
№ 2
2020