БИОФИЗИКА, 2020, том 65, № 2, с. 320-325
БИОФИЗИКА КЛЕТКИ
УДК 57.085.23, 616.155.392.8
ИССЛЕДОВАНИЕ МАКРОФАГАЛЬНОЙ ДИФФЕРЕНЦИРОВКИ КЛЕТОК
ОСТРОГО МИЕЛОИДНОГО ЛЕЙКОЗА
В МНОГОКЛЕТОЧНЫХ АГРЕГАТАХ
© 2020 г. М.И. Кобякова*, Я.В. Евстратова*, А.С. Сенотов*, А.И. Ломовский*,
В.В. Новикова*, К.С. Краснов**, И.С. Фадеева*, В.С. Акатов*, Р.С. Фадеев*
*Институт теоретической и экспериментальной биофизики РАН,
142290, Пущино Московской обл., Институтская ул., 3
**Тульский государственный университет, 300012, Тула, просп. Ленина, 92
E-mail: ritaaaaa49@gmail.com
Поступила в редакцию 29.11.2019 г.
После доработки 29.11.2019 г.
Принята к публикации 31.0 1.2020 г.
Главной причиной недостаточной эффективности терапии острого миелоидного лейкоза является
возникновение устойчивости лейкозными клетками к действию химиотерапевтических препара-
тов. Факторы микроокружения играют одну из ключевых ролей в формировании фенотипа лекар-
ственной устойчивости лейкозных клеток. Выяснение механизмов лекарственной устойчивости,
опосредованной условиями микроокружения, важно для идентификации новых фармакологиче-
ских мишеней консервативной терапии направленного действия. Нами было проведено исследова-
ние роли дифференцировки в макрофагальном направлении в повышении лекарственной устойчи-
вости клеток острого миелоидного лейкоза в многоклеточных агрегатах. Показано, что в многокле-
точных агрегатах не происходит созревания в макрофагальном направлении. Эти данные
указывают на участие других механизмов в повышении лекарственной устойчивости в многокле-
точных агрегатах клеток острого миелоидного лейкоза.
Ключевые слова: острый миелоидный лейкоз, лекарственная устойчивость, многоклеточные агрегаты,
межклеточная адгезия, дифференцировка.
DOI: 10.31857/S0006302920020143
обнаружено [5, 6], что не только контакты с эле-
Острый миелоидный лейкоз - злокачествен-
ментами стромы костного мозга могут способ-
ная опухоль гемопоэтической системы, которая
ствовать формированию первичной лекарствен-
характеризуется накоплением аномальных (лей-
ной устойчивости у лейкозных клеток; контакты
козных) бластных клеток, главным образом, в
только между лейкозными клетками (гомотипи-
костном мозге и нарушением нормального гемо-
ческие взаимодействия), которые возникают при
поэза и иммунитета [1]. Эффективность консер-
образовании многоклеточных агрегатов, также
вативной терапии острого миелоидного лейкоза
могут приводить к выраженному повышению
колеблется от 20 до 45% [2]. Одной из основных
устойчивости к индукции клеточной гибели. Вы-
причин недостаточной эффективности терапии
яснение механизмов лекарственной устойчиво-
острых форм миелоидного лейкоза является воз-
сти, опосредованной условиями микроокруже-
никновение первичной лекарственной устойчи-
ния, важно для выявления новых фармакологи-
вости у лейкозных клеток. Главной причиной
ческих мишеней консервативной терапии
возникновения данного типа устойчивости счи-
направленного действия. Одной из возможных
тается взаимодействие клеток лейкоза с элемен-
причин повышения лекарственной устойчивости
тами их микроокружения в патологически изме-
в многоклеточных агрегатах может являться со-
ненном костном мозге, например, с мезенхи-
зревание (дифференцировка) клеток острого ми-
мальными стромальными клетками или
елоидного лейкоза в макрофагальном направле-
внеклеточным матриксом [3, 4]. Ранее нами было
нии [7-9]. Так, повышение лекарственной устой-
чивости при созревании в макрофагальном
Сокращения: CD - кластеры дифференцировки, ЛПС -
направлении может быть связано с увеличением
липополисахарид, ФНО - фактор некроза опухоли, ИЛ -
интерлейкин.
экспрессии антиапоптотического белка FLIP, ко-
320
ИССЛЕДОВАНИЕ МАКРОФАГАЛЬНОЙ ДИФФЕРЕНЦИРОВКИ КЛЕТОК
321
торый является ингибитором активации
США), FITC Mouse Anti-Human CD163 (BD Bio-
каспазы 8, увеличением экспрессии антиапопто-
science, США), FITC Anti-Human CD68 (BD Bio-
тического белка XIAP, а также с активацией тран-
science, США), контрольные клетки окрашивали
скрипционного фактора NF-κB и PI3K/Akt сиг-
APC Mouse IgG1, k isotype Ctrl (Biolegend, США)
нального каскада [10-12].
или FITC Mouse IgG1, k isotype Ctrl (Biolegend,
В связи с этим в данном исследовании нами
США) соответственно. Окрашивание проводили
при комнатной температуре в темноте в течение
было проведено изучение степени созревания
30 мин. После окрашивания клетки фиксировали
(дифференцировки) в макрофагальном направ-
2%-м раствором параформальдегида (Panreac,
лении клеток острого миелоидного лейкоза в
Испания). Определение проводили с помощью
многоклеточных агрегатах.
проточного цитометра Accuri C6 (BD Bioscience,
США).
МАТЕРИАЛЫ И МЕТОДЫ
Оценка относительного количества митохон-
Клеточные культуры. В качестве объекта иссле-
дрий и лизосом. Для оценки относительного коли-
дования в работе использовали клетки острого
чества митохондрий и лизосом у клеток ТНР-1
миелоидного лейкоза человека ТНР-1, получен-
после 24 и 120 ч культивирования клетки окраши-
ные из Всероссийской коллекции клеточных
вали 100 нМ MitoTracker Green FM (Thermo Fisher
культур (Институт цитологии РАН, Санкт-Пе-
Scientific, Германия) и 75 нМ LysoTracker Green
тербург). Клетки ТНР-1 культивировали в среде
DND-26 (Thermo Fisher Scientific, Германия) со-
RPMI 1640/F12 с добавлением 20% эмбриональ-
ответственно. Инкубировали в течение 30 мин в
ной телячьей сыворотки, 80 мкг/мл гентамицина,
условиях СО2-инкубатора. Определение прово-
24 мкг/мл флуконазола при 37°С в условиях 5%-
дили с помощью проточного цитометра
го содержания СО2 в воздухе.
Accuri C6.
Для формирования многоклеточных агрегатов
Анализ фагоцитарной активности клеток. Для
клетки высевали по 5 · 103 клеток в лунку в 100 мкл
определения фагоцитарной активности клеток
полной ростовой среды в 96-луночные планше-
ТНР-1 после 24 и 120 ч культивирования к клет-
ты, покрытые 1.5%-м раствором агарозы (Panre-
кам добавляли 1 мг/мл pHrodo Green E. coli (Ther-
ac, Испания) и культивировали в течение пяти су-
mo Fisher Scientific, Германия), инкубировали в
ток (120 ч). В контрольных условиях клетки THP-
течение 2 ч в условиях СО2-инкубатора. В каче-
1 высевали по 5 · 103 клеток в лунку в 100 мкл пол-
стве контроля неспецифического окрашивания
ной ростовой среды в 96-луночные планшеты и
клетки инкубировали с 10 мкг/мл цитохалазина Д
культивировали в течение 24 ч. Через 24 ч культи-
(Sigma, США), в течение 30 мин в условиях СО2-
вирования многоклеточные агрегаты отсутство-
инкубатора, затем добавляли 1 мг/мл pHrodo
вали.
Green E. coli и инкубировали в течение 2 ч. Опре-
Макрофагоподобные клетки получали с помо-
деление проводили с помощью проточного цито-
щью обработки форболовым эфиром форбол-12-
метра Accuri C6.
миристат-13-ацетатом, известным индуктором
Оценка внутриклеточной продукции NO. Для
макрофагальной дифференцировки. Для этого
оценки внутриклеточной продукции NO после 24
клетки THP-1 культивировали в среде
и 120 ч культивирования клетки окрашивали
DMEM/F12 с добавлением 10% эмбриональной
5 мкМ DAF-FM DA (Thermo Fisher Scientific, Гер-
телячьей сыворотки в присутствии 200 нМ фор-
мания), инкубировали в течение 40 мин в услови-
бол-12-миристат-13-ацетата (Sigma, США) в те-
ях СО2-инкубатора. Далее клетки отмывали в
чении 96 ч. Затем клетки трижды отмывали сре-
полной ростовой среде (300 g, 5 мин) и инкубиро-
дой DMEM/F12 и использовали для эксперимен-
вали в ней в течение 30 мин в условиях СО2-инку-
тов. Для открепления клеток от поверхности
культуральных флаконов использовали Accutase
батора. Для определения индуцибельной продук-
(Sigma, США).
ции NO клетки прединкубировали с 10 мкг/мл
липополисахарида (ЛПС) в течение 24 ч. Опреде-
Иммунофенотипирование клеток. Для исследо-
ление проводили с помощью проточного цито-
вания экспрессии моноцитарно-макрофагаль-
метра Accuri C6.
ных маркеров (кластеров дифференцировки -
CD) на поверхности клеток ТНР-1 через 24 и
Анализ индуцированной липополисахаридами
120 ч инкубации клетки собирали с 96-луночных
секреции цитокинов. Для определения ЛПС-инду-
планшетов, отмывали в Cell Staining Buffer (Bio-
цированной секреции фактора некроза опухоли
legend, США), при 300 g в течение 5 мин. Окра-
(ФНО-α), интерлейкинов ИЛ-1β и ИЛ-6 клетка-
шивание проводили с использованием панели
ми ТНР-1, клетки инкубировали с 10 мкг/мл ЛПС
моноклональных антител APC Anti-human CD11b
из E. coli O111:B4 (Sigma, США) в течение 24 ч.
(Biolegend, США), FITC Anti-human CD14 (Sig-
После инкубации клетки собирали с 96-луночных
ma, США), FITC Anti-human PTPRC (Sigma,
планшетов, центрифугировали (300 g, 5 мин), для
БИОФИЗИКА том 65
№ 2
2020
322
КОБЯКОВА и др.
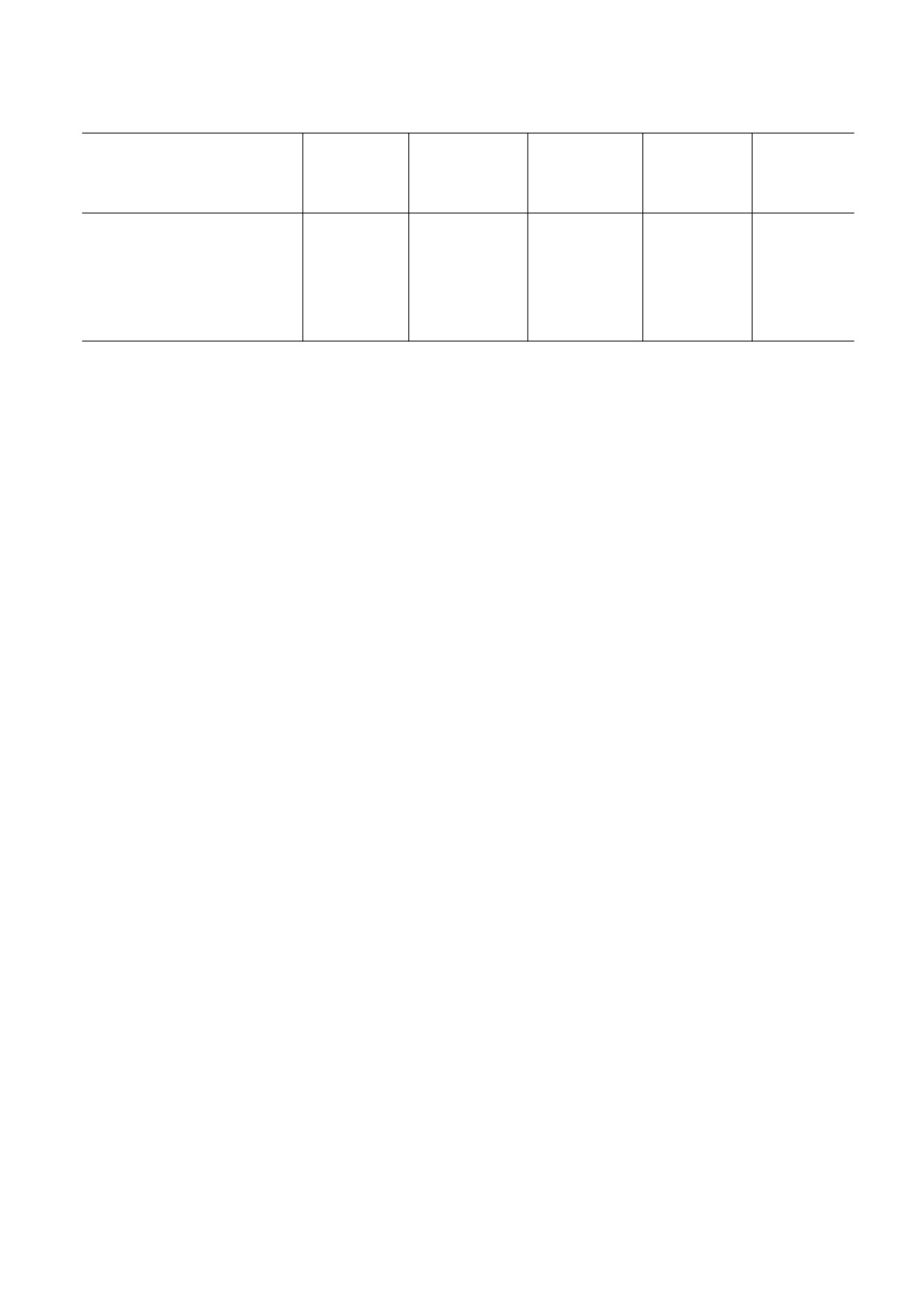
Анализ экспрессии моноцитарно-макрофагальных маркеров у клеток ТНР-1
Интегрин
Рецептор для
Корецептор для
Макросиалин
Маркеры
альфа-М
PTPRC (CD45)
гаптоглобина
ЛПС (СD14)
(CD68)
(CD11b)
(CD163)
Контроль
-
-
96.0 ± 3.0%
71.0 ± 3.0%
-
Многоклеточный агрегат
24.0 ± 1.0%
-
97.0 ± 1.0%
97.0 ± 1.0%
-
Клетки, обработанные форбол-
7.1 ± 0.1%
95.1 ± 0.3%
99.0 ± 0.4%
6.0 ± 2.0%
-
12-миристат-13-ацетатом
анализа использовали надосадочную жидкость.
точных агрегатах выявлено достоверное (P < 0.05)
Оценку секреции ФНО-α, ИЛ-1β и ИЛ-6 прово-
увеличение ИЛ-1β (рис. 1а), но не ИЛ-6 (рис. 1б)
дили с помощью коммерческих наборов для им-
и ФНО-α (рис. 1в) относительно контрольных
муноферментного анализа «Интерлейкин-1бета-
клеток. У клеток THP-1, обработанных форболо-
ИФА-БЕСТ», «Интерлейкин-6-ИФА-БЕСТ» и
вым эфиром, показана высокая ЛПС-индуциро-
«Альфа-ФНО-ИФА-БЕСТ» («Вектор Бест», Рос-
ванная секреция всех представленных цитокинов
сия) согласно указаниям производителя. Оптиче-
(pис. 1).
скую плотность определяли при длине волны
Также было показано, что у клеток THP-1 в
450 нм, используя планшетный ридер Imark (Bio-
многоклеточных агрегатах происходит повыше-
Rad, США).
ние ЛПС-индуцированной продукции внутри-
Статистический анализ. Результаты представ-
клеточного оксида азота, что не характерно для
ляли в виде среднего ± стандартное отклонение
клеток THP-1, обработанных форболовым эфи-
(M ± SD). Опыты проводили не менее чем в трех
ром (рис. 2).
повторах (n ≥ 3). Статистическую значимость от-
Далее мы показали, что у клеток ТНР-1 в мно-
личия определяли с использованием дисперсион-
гоклеточных агрегатах относительное количество
ного анализа (ANOVA).
митохондрий достоверно выше (рис. 3а), чем у
клеток ТНР-1 в контроле (P ≤ 0.005) и у клеток
ТНР-1, обработанных форболовым эфиром
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
(P < 0.05). В то же время относительное количе-
Для оценки созревания клеток THP-1 в макро-
ство лизосом у клеток ТНР-1 в многоклеточных
фагальном направлении проводили анализ экс-
агрегатах не отличалось от относительного коли-
прессии клеточных маркеров CD11b, CD14,
чества лизосом у контрольных клеток и было
CD45, CD68, CD163; оценивали относительное
меньше, чем у клеток ТНР-1, обработанных фор-
количество митохондрий, лизосом и продукцию
боловым эфиром (рис. 3б).
внутриклеточного оксида азота (NO); определяли
Также было проведено исследование фагоци-
фагоцитарную активность, а также ЛПС-индуци-
тарной активности клеток THP-1 в многоклеточ-
рованную секрецию ФНО-α, ИЛ-1β и ИЛ-6.
ных агрегатах. Было показано, что относительное
Сравнение проводили относительно клеток
фагоцитарное число клеток ТНР-1 в многокле-
ТНР-1, обработанных форболовым эфиром (фор-
точных агрегатах не отличалось от фагоцитарного
бол-12-миристат-13-ацетатом).
числа клеток в контроле и было ниже, чем у кле-
Показано, что для клеток THP-1 характерна
ток THP-1, обработанных форболовым эфиром
конститутивная экспрессия PTPRC (CD45) и
(рис. 4а). Однако фагоцитарный индекс клеток
макросиалина (CD68). В то же время в многокле-
ТНР-1 в многоклеточных агрегатах не отличался
точных агрегатах появлялось 24 ± 1% интегрин
от фагоцитарного индекса клеток в контроле и
альфа-М (CD11b)-положительных клеток и число
клеток THP-1, обработанных форболовым эфи-
макросиалин (CD68)-клеток составляло 97 ± 1%,
ром (рис. 4б).
что достоверно отличается от контроля (P ≤ 0.001)
(таблица). Для клеток THP-1, обработанных фор-
боловым эфиром, характерна экспрессия практи-
ЗАКЛЮЧЕНИЕ
чески у всех клеток корецептора для ЛПС (СD14)
Нами было показано, что в многоклеточных
и практически полное отсутствие клеток, несу-
агрегатах, образованных клетками ТНР-1, на-
щих маркер CD68.
блюдается
появление
альфа-М-интегрин
При оценке ЛПС-индуцированной секреции
(CD11b)-положительных клеток и увеличивается
ИЛ-1β, ИЛ-6 и ФНО-α для клеток в многокле-
число макросиалин (CD68)-положительных кле-
БИОФИЗИКА том 65
№ 2
2020
ИССЛЕДОВАНИЕ МАКРОФАГАЛЬНОЙ ДИФФЕРЕНЦИРОВКИ КЛЕТОК
323
(а)
400
ЛПС ( )
ЛПС ( )
300
200
*
100
0
Контрольные
Многоклеточные
Клетки,
условия
агрегаты
обработанные РМА
(б)
8000
ЛПС ( )
ЛПС ( )
00
60
00
40
00
20
0
Контрольные
Многоклеточные
Клетки,
условия
агрегаты
обработанные РМА
(в)
700
ЛПС ( )
ЛПС ( )
600
500
400
300
200
100
0
Контрольные
Многоклеточные
Клетки,
условия
агрегаты
обработанные РМА
Рис. 1. ЛПС-индуцированная секреция ИЛ-1β (а), ИЛ-6 (б) и ФНО-α (в) клеток THP-1 в многоклеточных агрегатах.
ток, отсутствие ЛПС-индуцированной секреции
ботанных форболовым эфиром, стандартным
ИЛ-6 и ФНО-α, увеличение ЛПС-индуцирован-
агентом макрофагальной дифференцировки.
ной продукции внутриклеточного оксида азота,
Таким образом, полученные данные указывают
увеличение относительного количества митохон-
на то, что у клеток ТНР-1 в многоклеточных агрега-
дрий, что не характерно для клеток THP-1, обра-
тах не происходит созревания в макрофагальном на-
БИОФИЗИКА том 65
№ 2
2020
324
КОБЯКОВА и др.
MFI
5e+5
ЛПС ( )
ЛПС ( )
4e+5
3e+5
2e+5
1e+5
0
Контрольные
Многоклеточные
Клетки,
условия
агрегаты
обработанные РМА
Рис. 2. Продукция внутриклеточного NO клетками ТНР-1 в многоклеточных агрегатах.
(а)
(б)
MFI
MFI
3e+6
3e+6
*
3e+6
3e+6
2e+6
2e+6
2e+6
2e+6
1e+6
1e+6
5e+5
5e+5
0
0
Контрольные условия
Мног
оклеточные агрегаты
Клетки, обработанные РМА
Рис. 3. Относительное количество митохондрий (а) и лизосом (б) у клеток ТНР-1 в многоклеточных агрегатах.
(а)
(б)
3e+5
70
60
e+
3
5
50
e+
2
5
40
2e+5
30
1e+5
20
5e+4
10
0
0
Контрольные условия
Мног
оклеточные агрегаты
Клетки, обработанные РМА
Рис. 4. Фагоцитарная активность клеток ТНР-1 в многоклеточных агрегатах: относительное фагоцитарное число (а)
и фагоцитарный индекс (б).
БИОФИЗИКА том 65
№ 2
2020
ИССЛЕДОВАНИЕ МАКРОФАГАЛЬНОЙ ДИФФЕРЕНЦИРОВКИ КЛЕТОК
325
правлении и повышение лекарственной устойчиво-
3. S. Maier, C. Dahlstroem, C. Haefliger, andA. Plum,
сти связано с другими механизмами.
Am. Pharmacogenom. J. 5, 223 (2005).
4. S. T. Taylor, J. A. Hickman, and C. Dive, J. Natl. Can-
cer Inst. 92, 18 (2000).
КОНФЛИКТ ИНТЕРЕСОВ
5. С. Г. Захаров, А. К. Голенков, Т. А. Митина и др.,
Авторы заявляют об отсутствии конфликта
Альманах клин. медицины 31, 11 (2014).
интересов.
6. Р. С. Фадеев, М. Е. Соловьева, Д. А. Слядовский
и др., Биол. мембраны: Журн. мембранной и кле-
точной биологии 32 (2), 125 (2015).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
7. Я. В. Евстратова, М. И. Кобякова, В. В Новикова и
Настоящая работа не содержит описания ка-
др., Биофизика 64 (5), 729 (2019).
ких-либо исследований с использованием людей
8. T. Oda, K. Hirota, K. Nishi, and R. Nohara, Am.
и животных в качестве объектов.
Physiol. Cell Physiol. J. 291 (1), 104 (2006).
9. M. Daigneault, J. A. Preston, H. M. Marriott, et al.,
PLoS One 5 (1), e8668 (2010).
СПИСОК ЛИТЕРАТУРЫ
10. L. J. Pagliari, H. Perlman, H. Liu, and R. M. Pope,
1. R. Hoffman, B. Furie, P. McGlave, et al., Hematology:
Mol. Cell. Biol. 20, 8855 (2000).
Basic Principles and Practice, 4th ed. (Churchill Living-
11. Y. Ma, V. Temkin, H. Liu, R. M. Pope, J. Biol. Chem.
stone Elsevier., 2005).
280 (51), 41827 (2005).
2. G. Marcucci, T. Haferlach, and H. Döhner, Clin.
12. H. Liu, H. Perlman, L. J. Pagliari, and R. M. Pope, J.
Oncol. J. 29 (5), 475 (2011).
Exp. Med. 194, 113 (2001).
The Study of Macrophage Differentiation of Acute Myeloid Leukemia Cells
in Multicellular Aggregates
M.I. Kobyakova*, Ya.V. Evstratova*, A.S. Senotov*, A.I. Lomovsky*, V.V. Novikova*,
K.S. Krasnov**, I.S. Fadeeva*, V.S. Akatov*, and R.S. Fadeev*
*Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Tula State University, prosp. Lenina 92, Tula, 300012 Russia
The main reason of insufficient efficacy in treatment of acute myeloid leukemia is the emergence of leukemic
cells resistant to the action of chemotherapeutic drugs. Microenvironment factors play one of the key roles in
the formation of the phenotype of drug resistance of leukemia cells. Elucidating mechanisms of drug resis-
tance mediated by microenvironment conditions is important in order to identify new pharmacological tar-
gets for conservative directed therapy. We have studied the role of differentiation in the macrophage direction
in increasing the drug resistance of acute myeloid leukemia cells in multicellular aggregates. It was shown that
in multicellular aggregates no maturation occurs in the macrophage direction. These data indicate that other
mechanisms contribute to an increased drug resistance in multicellular aggregates of acute myeloid leukemia
cells.
Keywords: acute myeloid leukemia, drug resistance, multicellular aggregates, intercellular adhesion, differentiation
БИОФИЗИКА том 65
№ 2
2020