БИОФИЗИКА, 2020, том 65, № 2, с. 340-348
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.3
ВЛИЯНИЕ ЭКЗОГЕННОГО ПЕРОКСИРЕДОКСИНА 6
НА ФУНКЦИОНАЛЬНЫЕ ПАРАМЕТРЫ
ИЗОЛИРОВАННОЙ ПОЧКИ КРЫСЫ
© 2020 г. А.Е. Гордеева, М.Г. Шарапов, В.А. Евдокимов, В.И. Новоселов, Е.Е. Фесенко
Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, ул. Институтская, 3
E-mail: gordeeva1310@yandex.ru
Поступила в редакцию 14.01.2020 г.
После доработки 14.01.2020 г.
Принята к публикации 24.01.2020 г.
Целью исследования являлось изучение защитного эффекта экзогенных пероксиредоксинов при
ишемии-реперфузии изолированной почки. Исследование проводилось с использованием модели
перфузии изолированной почки крысы ex vivo. Рекомбинантный пероксиредоксин 6 вводили
непосредственно в состав перфузионного буфера. Высокомолекулярный краситель декстран
голубой Blue Dextran 2000 и мочевину добавляли в перфузионный буфер для определения
функциональности изолированной почки. Показано, что корковом слое изолированной почки
экзогенный пероксиредоксин 6 локализовался в сосудах клубочков почек; в мозговом веществе - в
микрососудах, окружающих тонкие канальцы. Использование пероксиредоксина 6 снижает
степень повреждения структур нефронов в два раза по сравнению с контрольным повреждением,
что обеспечивает сохранение процессов ультрафильтрации. Уменьшение повреждения клубочков
приводит к уменьшению содержания декстрана голубого в моче в два раза по сравнению с
контрольным повреждением в конце периода перфузии. Уменьшение повреждения трубчатых
структур указывает на активный транспорт мочевины в течение перфузии. Таким образом,
включение пероксиредоксина 6 в перфузионный буфер опосредует уменьшение повреждения
структур нефронов и поддержание морфофункционального состояния почечных клубочков и
канальцев.
Ключевые слова: изолированная почка, нефроны, пероксиредоксины, ишемия-реперфузия.
DOI: 10.31857/S0006302920020179
та, что приводит к повреждению эндотелия и раз-
В настоящее время основным фактором, сдер-
витию тяжелых осложнений: отторжению пере-
живающим развитие трансплантологии, является
саженного органа и первичной дисфункции
недостаток донорских органов. Дефицит донор-
трансплантата. Таким образом, для успешной за-
ских органов еще больше усугубляется на фоне
щиты ткани трансплантата необходимо блокиро-
роста числа операций по ретрансплантации. Эта
вать раннюю стадию реперфузионного поврежде-
ситуация заставляет многие медицинские центры
ния, приводящую к поражению тканей, а именно
проводить забор органов у субоптимальных доно-
стадию выработки активных форм кислорода.
ров [1-4]. Основным ограничением, снижающим
Это может быть достигнуто использованием
широкое использование трансплантатов, полу-
мощных экзогенных антиоксидантов.
ченных от субоптимальных доноров, является по-
вреждающий эффект каскада ишемически-ре-
В настоящей работе для защиты трансплантата
перфузионных повреждений. Органы, получен-
почки от свободнорадикального окисления при
ные от субоптимальных доноров, обладают
перфузии использовался мощный фермент-анти-
низкой толерантностью к ишемически-реперфу-
оксидант класса пероксиредоксинов - перокси-
зионному повреждению [4-6]. Это связано с тем,
редоксин 6 (Prx6). Ранее было показано, что экзо-
что ишемия при заборе органа у донора и после-
генный Prx6 был эффективен для повышения ан-
дующая реперфузия трансплантата приводит к
тиоксидантного статуса в ткани при
резкому повышению уровня высокотоксичных
свободнорадикальных патологиях
[7-12]. Для
активных форм кислорода в ткани транспланта-
изучения возможности использования экзоген-
ных пероксиредоксинов для улучшения морфо-
Сокращение: Prx6 - пероксиредоксин 6.
функциональных показателей изолированной
340
ВЛИЯНИЕ ЭКЗОГЕННОГО ПЕРОКСИРЕДОКСИНА
341
органа в настоящей работе была использована
ном этапе - 3 мл/мин. Концентрация экзогенно-
модель перфузии изолированной почки крысы
го Prx6 в перфузионном растворе была выбрана
ex vivo.
на основании полученных ранее данных по эф-
фективному снижению ишемически-реперфузи-
онного поражения тонкого кишечника с помо-
МАТЕРИАЛЫ И МЕТОДЫ
щью Prx6 [11, 15].
Животные. Были использованы крысы-самцы
По окончанию ишемии проводили перфузию
линии Wistar (масса тела 200-220 г), которых со-
изолированной почки перфузионным буфером в
держали в условиях вивария ИБК PАН (г. Пущи-
течение 50 мин. На данном этапе Prx6 в перфузи-
но Московской области).
онном буфере отсутствует. Скорость перфузии на
Пероксиредоксин 6. Рекомбинантный Prx6 был
данном этапе равнялась 3-5 мл/мин, что соответ-
получен в нашей лаборатории. Белок содержит
ствовало давлению 120-110 мм рт. ст. В течение
шесть остатков гистидина на карбоксильном
всего срока перфузии каждые 10 мин осуществля-
конце полипептидной цепи - His-tag-домен. На-
ли сбор мочи из мочеточника и перфузионного
личие His-tag-домена на карбоксильном конце
раствора из вены. По окончанию перфузии по-
молекулы Prx6 не влияет на пероксидазную ак-
чечную ткань фиксировали для дальнейшего ис-
тивность и субстратную специфичность белка и
следования.
позволяет дифференцировать экзогенный перок-
Гистологический анализ почечной ткани. Для
сиредоксин от эндогенных пероксиредоксинов.
проведения морфологических исследований поч-
Удельные активности Prx6 составляют: перокси-
ки помещали в фиксатор Myrsky’s Fixative (Merck,
дазная - 90-120 нмоль/мг/мин по Н2О2 и 60-
США) для гистологического материала с после-
80 нмоль/мг/мин по трет-бутил-гидроперокси-
дующим заключением в парафин. Парафиновые
ду [13].
срезы получали на микротоме (Thermo Electron
Corparation, США) и окрашивали гемотоксилин-
Алгоритм перфузии изолированной почки. Кры-
эозином (VITROSTAIN Biovitrum, Россия). Тол-
сы были наркотизированы путем внутривенного
щина среза 3 мкм. Микроскопический анализ
введения 0.5 мл 3.5%-го (3 мг/кг) золетила 100.
срезов проводили на микроскопе Leica DM 6000
Для предотвращения свертываемости крови ис-
(Leica Miсrosystems CMS GmbH, Германия) с
пользовали гепарин. После предоперационной
подготовки проводили декапитацию. Момент де-
цифровой камерой Leica DFC 490.
капитации соответствует началу периода ише-
Иммуногистохимический анализ. Для исследо-
мии. Период ишемии составляет 45 мин. С нача-
вания распределения экзогенного пероксиредок-
лом ишемии проводили изолирование правой
сина 6 по почечной ткани в условиях изолирован-
почки от общей сосудистой системы путем после-
ной перфузии почку перфузировали Prx6-His-tag
довательного наложения лигатур на сосуды и ка-
(3 мг/мл) в течение трех минут с предваритель-
тетеризацию почечной артерии через брюшную
ным удалением крови из сосудистого русла пра-
аорту [14]. Дополнительно проводили отсечение
вой почки по общей схеме, описанной выше. По-
нижней полой вены на уровне правой внутренней
сле перфузии образцы почечной ткани фиксиро-
и левой внутренней почечной долей, с ее последу-
вали для приготовления гистологического
ющей катетеризацией. Правый мочеточник был
материала. Для выявления экзогенного перокси-
изолирован, катетеризирован и помещен в резер-
редоксина 6 использовали кроличьи поликло-
вуар для сбора мочи. Препарат изолированной
нальные антитела к His-tag (1 : 100) (Bioss, США).
почки извлекали из организма в комплексе с пе-
Микроскопический анализ срезов проводили на
ченью. В качестве раствора для перфузии исполь-
микроскопе Leica DM 6000, фотографии получа-
зовали питательную среду DMEM (GIBCO, Invit-
ли с помощью цифровой камеры для микроско-
rogen, США) с содержанием глюкозы 4.5 г/л. В
пии Leica DFC 490.
среду включали антидиуретический гормон
Определение повреждения структуры нефронов
(0.25 мкг/л). Перед перфузией раствор оксигени-
изолированной почки при перфузии. Для определе-
ровали смесью О2/СО2 (95%/5%), рН 7.4. Темпе-
ния степени повреждения структур почечного
ратура раствора субнормотермическая (30-35°С).
тельца использовался высокомолекулярный кра-
Через 10 мин ишемии проводили удаление
ситель декстран голубой Blue Dextran 2000 с моле-
крови из сосудистого русла изолированной пра-
кулярной массой 2000 кДа, (GE Healthcare, Шве-
вой почки путем ее промывки перфузионным бу-
ция), который в норме не способен проходить че-
фером в течение двух минут. Для определения
рез стенки микрососудов. Blue Dextran
2000
эффектов экзогенного пероксиредоксина 6 в пер-
(0.2%) добавляли в перфузионный раствор и пер-
фузионный буфер добавляли Prx6 в концентра-
фузировали изолированную почку по общей схе-
ции 0.1 мг/мл и перфузировали им почку на этапе
ме в течение 50 мин. Каждые 10 мин проводили
удаления крови из сосудистого русла изолиро-
сбор мочи и венозного оттока и определяли кон-
ванной правой почки. Скорость перфузии на дан-
центрацию красителя на длине волны 650 нм с
БИОФИЗИКА том 65
№ 2
2020
342
ГОРДЕЕВА и др.
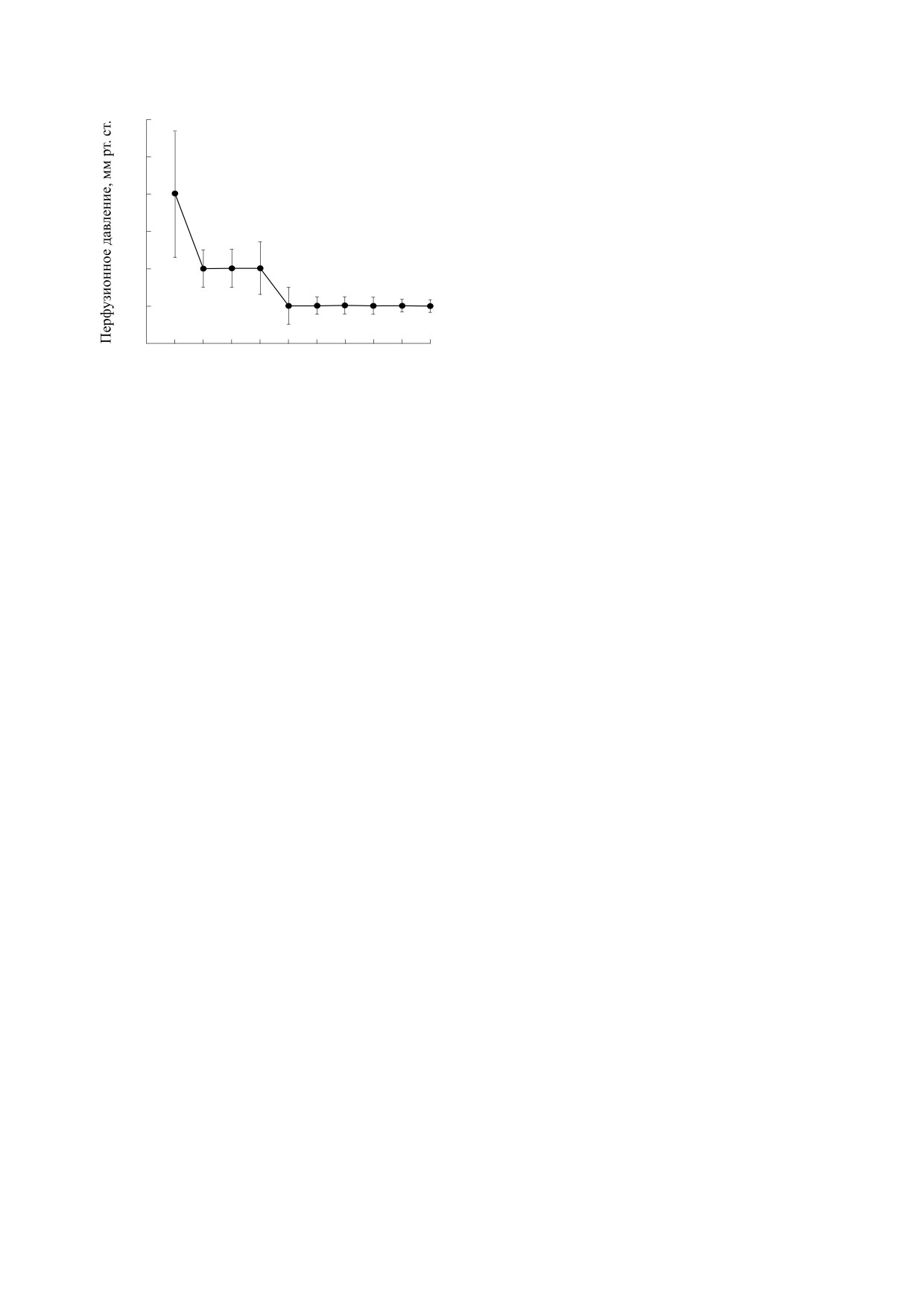
Скорость выделения мочи при перфузии изо-
160
лированной почки составляет 0.03 мл/мин, на-
150
против, использование пероксиредоксина 6 при-
водит к снижению скорости выделения мочи до
0.01 мл/мин, при этом зависимость скорости вы-
140
деления мочи от времени не обнаружена. Ско-
рость оттока перфузионной жидкости из вены со-
130
ставляет около 3 мл/мин и не изменяется при ис-
пользовании пероксиредоксина 6.
120
Гистологический анализ почечной ткани. На
110
рис. 2а представлена гистология интактной поч-
ки. В корковом слое хорошо дифференцируются
100
отделы нефрона: почечное тельце с центральным
0
10
20
30
40
50
сосудистым клубочком и почечные извитые ка-
Время, мин
нальца - проксимальный (клетки канала имеют
выраженную щеточную каемку) и дистальный.
Заметны начальные отделы собирательных тру-
Рис. 1. Динамика перфузионного давления в изоли-
рованной почке при контрольном поражении. Ско-
бок. В мозговом слое преобладает тонкий кана-
рость перфузии 3-5 мл/мин; N = 15.
лец, имеющий нисходящий сегмент, петлю Гент-
ле и восходящий сегмент; имеют продолжение
собирательные трубки.
помощью спектрофотометра ND 1000 UV-Vis
(Thermo Fisher Scientific, США).
В случае 45-минутного периода ишемии и по-
следующего 50-минутного периода реперфузии
Для определения повреждений структур по-
изолированной почки перфузионным раствором
чечных канальцев в перфузионный раствор вво-
наблюдаются дистрофические изменения струк-
дили мочевину в концентрации 10 мМ. Данная
тур почечной ткани (рис. 2б). В корковом слое
концентрация соответствует нормальным значе-
почки наблюдаются полное разрушение структу-
ниям данного метаболита в сыворотке крови
ры половины почечных телец, что препятствует
крыс [16]. Перфузировали по общей схеме в тече-
нормальной работе фильтрационного аппарата.
ние 50 мин. Каждые 10 мин проводили сбор мочи
Общий размер сохраненных почечных телец не
и венозного оттока и определяли концентрацию
увеличен по сравнению с интактной структурой.
мочевины на приборе Reflotron Plus (Roche Diag-
В проксимальных и дистальных канальцах на-
nostics, Швейцария).
блюдается дистрофия эпителия, а сам каналец
Статистические методы. Статистический ана-
расширен. Отмечена утрата большей части эпите-
лиз выполняли с использованием программы Sig-
лиоцитов канальцев: эпителиоциты утрачивают
maPlot 11.0 Sortware (Systat Software Inc., США).
соединение с базальной мембраной и заполняют
Результаты выражали как среднее значение
просвет канальца бесструктурными массами. По-
± стандартная ошибка. Значение p < 0.05 прини-
ражение почечной ткани имеет зональность и бо-
мали статистически достоверным.
лее сильно выражено в корковом слое, снижаясь
к латеральному краю. В мозговом веществе отме-
чается дилатация каналов и поражения клеток от-
РЕЗУЛЬТАТЫ
делов тонкого канальца. Просветы отдельных ка-
налов заполнены хлопьевидными агрегатами и
Параметры перфузии изолированной почки.
клеточным мусором.
Динамика перфузионного давления при кон-
трольном поражении в изолированной почке
В условиях использования Prx6 отмечено сни-
представлена на рис. 1. На начальном этапе пер-
жение степени поражения почечных структур в
фузии скорость перфузионного потока составля-
модели перфузии изолированной почки (рис. 2в).
ет 3-5 мл/мин, при этом наблюдается рост пер-
Это в первую очередь выражено в снижении ко-
фузионного давления до 140 мм рт. ст., что связа-
личества пораженных почечных телец в два раза
но с вазоконстрикцией почечной артерии,
относительно контрольного поражения. Общий
которая обуславливает высокое перфузионное
размер сохраненных почечных телец не увеличен
давление в этот период. Через 5-7 мин давление
по сравнению с интактной структурой. Для труб-
стабилизируется и выходит на плато со значени-
чатых структур нефрона (проксимальный, ди-
ем 110 мм рт. ст. Исследование изменения перфу-
стальный, тонкий каналец) отмечено снижение
зионного давления показало, что как в контроль-
поражения и сохранение общей структурной ор-
ном поражении, так и при использовании перок-
ганизации. Встречаются канальцы в состоянии
сиредоксина 6 показатели давления достоверно
резко выраженной дистрофии с очаговым пора-
не отличаются.
жением эпителия, особенно для проксимальных
БИОФИЗИКА том 65
№ 2
2020
ВЛИЯНИЕ ЭКЗОГЕННОГО ПЕРОКСИРЕДОКСИНА
343
каналов. В просветах многих канальцев отмечен
(а)
клеточный мусор и хлопьевидные агрегаты. В
мозговом веществе отмечаются дилатация кана-
лов и снижение повреждений внутренней орга-
низации отделов тонкого канальца. Просветы от-
дельных каналов заполнены хлопьевидными аг-
регатами и клеточным мусором.
Распределение экзогенного Prx6 по почечной
ткани в условиях изолированной перфузии. Так как
Prx6 является высокомолекулярным соединени-
ем, было необходимо выяснить, как он распреде-
ляется в почке при его введении в кровеносное
русло почки. Для дифференциации экзогенного
100 мкм
Prx6 от эндогенного Prx6 использовали антитела
против His-tag-домена в молекуле Prx6. На рис. 3
(б)
представлены данные иммуногистохимического
анализа, отражающие локализацию экзогенного
белка Prx6 в изолированной почке крысы. Было
отмечено распределение белка по всему перимет-
ру органа. В корковом слое почек экзогенный
Prx6 локализуется преимущественно в сосудах
почечных клубочков (рис. 3а,в). Проникновение
экзогенного Prx6 в капсулу почечного тельца и в
просвет канальцев не отмечено (рис. 3в). В мозго-
вом слое экзогенный Prx6 локализован в микро-
сосудах, сопровождающих тонкий каналец. В
просвете тонкого канальца экзогенный Prx6 не
обнаруживается (рис. 3б). В качестве контроль-
ного теста использовали негативный контроль, в
котором при проведении иммуноокрашивания
(в)
исключалась инкубация с антителами к His-tag-
домену Результаты реакции, представленные на
рис. 3г, отрицательные, что свидетельствует о
специфичном связывании антител к His-tag-до-
мену экзогенного Prx6.
Определение повреждения структуры нефронов
изолированной почки при перфузии. Для определе-
ния сохранения процессов ультрафильтрации в
почечном тельце в перфузионный раствор вводи-
ли краситель декстран голубой (Blue Dextran
2000). На рис. 4 представлена динамика появле-
ния красителя декстрана голубого в моче в
100 мкм
течение всего срока перфузии. В контрольном
поражении уже через 10 мин перфузии в моче от-
мечено значительное количество декстрана голу-
Рис. 2. Гистология изолированной почки: (а) - ин-
бого - 40% от его концентрации в перфузионной
тактная почка; (б) - изолированная почка, ишемия -
среде, что указывает на развитие повреждений
45 мин, перфузия - 50 мин, наблюдается поражение
структур почечного тельца с первых минут пер-
почечной ткани с развитием дистрофии всех отделов
нефрона почки; (в) - изолированная почка + Prx6,
фузии. Напротив, в случае применения экзоген-
ишемия - 45 мин, перфузия - 50 мин, наблюдается
ного Prx6 выход декстрана в мочу на начальном
снижение поражение отделов нефрона почки. Окра-
этапе перфузии снижен и составляет 12.5% от его
шивание эозином-гематоксилином.
концентрации в перфузионном буфере. К концу
перфузионного периода в случае использования
Prx6 концентрация красителя в моче составляет
нение процессов ультрафильтрации при условии
25% от его содержания в перфузионной среде, что
применения экзогенного Prx6. Концентрация
в два раза ниже концентрации красителя в кон-
декстрана голубого в перфузионном буфере из ве-
трольном поражении в этот период (р < 0,05). Та-
ны достоверно не изменялась относительно кон-
кая картина указывает на минимизацию пораже-
троля, как в условиях использования пероксире-
ния структур почечного тельца нефрона и сохра-
доксина 6, так и без него.
БИОФИЗИКА том 65
№ 2
2020
344
ГОРДЕЕВА и др.
(а)
(б)
100 мкм
100 мкм
(в)
(г)
100 мкм
100 мкм
Рис. 3. Распределение экзогенного Prx6 в почечной ткани в условиях изолированной перфузии: (а) и (в) - распреде-
ление Prx6 корковом слое, Prx6 локализован преимущественно в сосудах клубочков; (б) - распределение Prx6 в моз-
говом слое, Prx6 локализован в микрососудах, сопровождающих тонкий каналец. (а)-(в) - Положительный контроль,
(г) - отрицательный контроль. Иммуногистохимический анализ с использованием кроличьих поликлональных анти-
тела к His-tag.
Для определения сохранения функционально-
процессов реабсорбции мочевины в кровь и ее
сти почечных канальцев в перфузионный раствор
возврата обратно в каналы.
вводили мочевину в концентрации 10 мМ. Дан-
При использовании Prx6 концентрация моче-
ная концентрация мочевины в перфузионном бу-
вины в моче на начальном этапе перфузии досто-
фере принята за контроль. На рис. 5 представлено
верно возрастает в пять с половиной раз относи-
изменение концентрации мочевины в моче в те-
тельно контроля, что отражает активный процесс
чение всего срока перфузии. В контрольном по-
реабсорбции мочевины в кровь и ее возврат об-
ратно в интактные каналы. К 30-й минуте перфу-
ражении с началом перфузии можно отметить до-
зии можно отметить постепенное снижение уров-
стоверное увеличение концентрации мочевины в
ня мочевины в моче, по сравнению с контроль-
моче в два с половиной раза относительно кон-
ным поражением, что, вероятно, указывает на
троля, что указывает на наличие функционирова-
торможение процессов поражения канальцев
ния систем транспорта мочевины в канальцах на
нефрона при использовании Prx6. Только через
этом этапе. Эта система транспорта обеспечивает
40 мин перфузии активные процессы реабсорб-
реабсорбцию мочевины в кровь и ее возврат об-
ции мочевины в каналах прекращаются, а уро-
ратно в каналы. Однако уже через 10 мин перфу-
вень этого метаболита падает до контрольных
зии отмечается резкий спад уровня мочевины в
значений и выходит на плато.
моче в сторону контрольных значений. Это мо-
Концентрация мочевины в перфузионном бу-
жет указывать на быстроту поражения структуры
фере из вены достоверно не изменялась относи-
большей части почечных канальцев коркового и
тельно контроля, как в условиях использования
мозгового слоя и, как следствие, на отсутствие
пероксиредоксина 6, так и без него.
БИОФИЗИКА том 65
№ 2
2020
ВЛИЯНИЕ ЭКЗОГЕННОГО ПЕРОКСИРЕДОКСИНА
345
70
D650нм
0.07
60
0.06
1
50
0.05
40
0.04
30
2
0.03
20
2
0.02
10
1
0.01
0
0
10
20
30
40
50
0.00
Время, мин
0
10
20
30
40
50
Время, мин
Рис. 5. Изменение концентрации мочевины в моче
Рис. 4. Изменение концентрации красителя декстра-
при перфузии изолированной почки: 1 - изолиро-
на голубого в моче при перфузии изолированной
ванная почка, ишемия - 45 мин, перфузия - 50 мин,
почки: 1 - изолированная почка, ишемия - 45 мин,
N = 5; 2 - изолированная почка + Prx6, ишемия -
перфузия - 50 мин, N = 5; 2 - изолированная почка +
45 мин, перфузия - 50 мин, N = 5. Мочевина введена
+ Prx6, ишемия - 45 мин, перфузия - 50 мин, N = 5.
в перфузионный раствор (10 мМ). При использова-
Краситель введен в перфузионный раствор
нии Prx6 концентрация мочевины в моче на началь-
(D650 = 0.12). К концу перфузионного периода в слу-
ном этапе перфузии достоверно возрастает в 5.5 раза
чае использования Prx6 концентрация красителя в
относительно контроля, что отражает активный про-
моче в два раза ниже концентрации красителя в кон-
цесс реабсорбции мочевины в кровь и ее возврат об-
трольном поражении в этот период (р < 0,05).
ратно в интактные каналы.
ОБСУЖДЕНИЕ
казано, что внесение простагландина E1 в состав
консервирующего раствора Бельзера снижает
Ишемически-реперфузионное поражение яв-
риск возникновения отсроченной функции
ляется основной причиной первичной дисфунк-
трансплантата от доноров с расширенными кри-
ции трансплантата и снижения его жизнеспособ-
териями [20]. Использование малых доз NO,
ности. Особенно это актуально для органов, по-
NOS-ингибиторов в сочетании с ингибиторами
лученных от субоптимальных доноров, так как
эндотелиальной NO-синтазы при аппаратной
эти органы имеют низкую толерантность к ише-
перфузии донорских почек достоверно уменьша-
мически-реперфузионному поражению
[4-6].
ет перфузионное сопротивление и уменьшает
Для предотвращения ишемически-реперфузион-
кислородную потребность почечной ткани [21]. В
ного поражения органов, полученных от субоп-
работе [22] было показано, что модификация пер-
тимальных доноров, используют перфузионное
фузионной среды Бельзера мезенхимальными
кондиционирование с использованием аппарат-
стволовыми клетками улучшает показатели жиз-
ной перфузии взамен статической холодовой
неспособности изолированной почки и сохраня-
консервации [16].
ет ферментативный механизм, защищающий
Основная цель применения аппаратной пер-
клетку от ишемически-реперфузионного пора-
фузии органов, как в эксперименте, так и в
жения при аппаратной перфузии.
клинике - стремление улучшить состояние до-
Среди перфузионных сред наибольшей попу-
норского органа перед трансплантацией [18]. Со-
лярностью пользуется раствора Бельзера для хо-
временные консервационные растворы, исполь-
лодовой консервации. Его основное преимуще-
зуемые для перфузионного кондиционирования,
ство состоит в наличии в составе антиоксидант-
должны обеспечивать защиту трансплантата от
ных агентов глутатиона и аллопуринола для
отека, служить буфером для поддержания балан-
снижения процессов свободнорадикального
са pН, нести энергетические субстраты для жиз-
окисления [17].
недеятельности клеток, а также обеспечивать за-
щиту от ишемически-реперфузионного пораже-
К настоящему времени общепринято, что од-
ния [17, 19]. В настоящее время к наиболее
ним из основных факторов, определяющих пора-
популярным консервирующим растворам отно-
жение органа при ишемически-реперфузионном
сят Евро-Коллинз, кустодиол, раствор Бельзера.
поражении, является окислительный стресс. В
Часто в практике использования аппаратной пер-
этом случае для его нейтрализации предлагается
фузии практикуются фармакологические приемы
применение экзогенных антиоксидантов. В на-
для модификации перфузионных сред. Было по-
стоящей работе для защиты от свободноради-
БИОФИЗИКА том 65
№ 2
2020
346
ГОРДЕЕВА и др.
кального окисления при ишемии-реперфузии
Prx6 не оказывает влияния на изменение дина-
использовали мощный фермент-антиоксидант
мики перфузионного давления. Увеличение дав-
пероксиредоксин 6.
ления до 140 мм рт. ст. в начале перфузионного
периода, по-видимому, связано с вазоконстрик-
В нашем исследовании мы используем с неко-
цией почечной артерии. После периода стабили-
торыми изменениями модель, предложенную в
зации давление выходит на плато со значением
работе [14]. Принципиальное отличие нашей мо-
110 мм рт. ст. В то же время наблюдалось сниже-
дели в том, что изолированная почка подвергает-
ние скорости потока мочи почти в три раза (до
ся ишемически-реперфузионному поражению.
0.01 мл/мин). В литературе отмечено, что значе-
Период ишемии довольно длительный и состав-
ние менее 0.03 мл/мл в модели изолированной
ляет 45 мин. Такой срок выбран в соответствии с
перфузии почки не соответствует требованиям
данными о том, что необратимое повреждение
для нормальной скорости клубочковой фильтра-
эпителиальных клеток нефрона почки начинает-
ции [26]. Стоит отметить, что эти данные пред-
ся с 60-й минуты тепловой ишемии. На этих сро-
ставлены для модели без периода ишемии. В на-
ках происходит истощение пула АТФ, что приво-
шей модели присутствует продолжительный пе-
дит к дисфункции важнейших ферментативных
риод ишемии, что, вероятно, и приводит к
систем и многочисленных белков-транспортеров
смещению этого показателя на более низкие зна-
в клетках канальцевого эпителия. Следствием
чения. Этот вопрос требует дальнейшего изу-
этого оказываются нарушение регуляции клеточ-
чения.
ного объема, набухание цитоплазмы и разрыв
В условиях использования Prx6 было выявле-
клеточной мембраны. Второй существенный
но снижение степени поражения почечных
фактор ишемического повреждения клеток
структур в модели перфузии изолированной поч-
нефрона - нарушение метаболизма внутрикле-
ки. Это выражалось, прежде всего, в уменьшении
точного кальция, происходящее вследствие пре-
количества пораженных почечных телец. Стоит
кращения работы Ca-АТФаз в плазматической
обратить внимание, что при введении экзогенно-
мембране и в мембранах эндоплазматической се-
го Prx6 в изолированную почку он преимуще-
ти [23].
ственно локализуется в микрососудистых струк-
турах почечного тельца. Таким образом, экзоген-
Для защиты изолированного органа от повре-
ный Prx6 попадает в те места, где в случае
ждающего действия ишемии-реперфузии был
окислительного стресса наблюдается максималь-
использован экзогенный фермент-антиоксидант
ное разрушение клеток, а именно в микрососуди-
Prx6. В норме в почечной ткани был выявлен эн-
стые структуры. С другой стороны, отмечено сни-
догенный пул пероксиредоксинов и описан ха-
жение повреждения проксимального и тонкого
рактер их распределения по структурам нефрона
канальца, с сохранением щеточной каемки эпи-
[24, 25]. Так, для эндогенного Prx6 характерна ло-
телиоцитов, однако экзогенный Prx6 не обнару-
кализация в трубчатых сегментах нефрона, пре-
жен в этих структурах. Снижение поражения
имущественно в проксимальном и тонком ка-
трубчатых структур можно объяснить наличием в
нальцах. При ишемически-реперфузионном по-
этих местах пула эндогенного Prx6, уровень экс-
ражении именно в этих структурах наблюдается
прессии которого усиливается при ишемически-
усиление экспрессии данного белка [25]. В насто-
реперфузионном поражении [25].
ящей работе было показано, что при перфузии
изолированной почки экзогенным Prx6 белок
Одной из главных функций нефрона является
распределяется по сосудистым структурам всего
ультрафильтрация плазмы крови в полость кап-
периметра органа. В корковом слое почек экзо-
сулы клубочка через эндотелиальный фильтр, об-
генный Prx6 локализуется преимущественно в со-
разованный фенестрами и ножками подоцитов.
судах почечных клубочков. В мозговом слое пе-
Через фенестры эндотелиальных клеток легко
проходят вода и низкомолекулярные водораство-
роксиредоксин 6 локализован в сосудах, сопро-
римые вещества, а размер «фильтрационных ще-
вождающих тонкий каналец. В просвете тонкого
канальца и капсуле почечного тельца экзогенный
лей» подоцитов составляет 20-50 нм [27]. Соот-
Prx6 не обнаруживается. Таким образом, наблю-
ветственно при введении в перфузионный рас-
твор декстрана голубого с молекулярной массой
дается резкое повышение содержания Prx6 в со-
2000 кДа не должно происходить его появления в
судистых структурах.
моче при условии отсутствия поражения эндоте-
Стоит особо отметить, что Prx6 в составе пер-
лиального фильтра клубочка. Было показано, что
фузионного раствора вводится локально в изоли-
при перфузии изолированной почки раствором,
рованную почку с началом ишемии; на этапе пер-
содержащим декстран голубой, уже через 10 мин
фузии Prx6 в перфузионном буфере отсутствует.
в моче отмечено появление красителя. Такая кар-
Таким образом, белок находится в ткани почки в
тина объясняется результатами морфологических
течение всего периода ишемии и на начальном
исследований и указывает на развитие поврежде-
этапе перфузии.
ний структур почечного тельца уже с первых ми-
БИОФИЗИКА том 65
№ 2
2020
ВЛИЯНИЕ ЭКЗОГЕННОГО ПЕРОКСИРЕДОКСИНА
347
нут перфузии. Выраженные повреждения почеч-
ном поражении. Это указывает на торможение
ного тельца приводят в итоге к поражению ба-
процессов поражения при использовании экзо-
зальной мембраны клубочков. Следствием этого
генного Prx6. В-третьих, выравнивание концен-
процесса является нарушение фильтрационных
траций мочевины в перфузионном растворе и мо-
возможностей сосудистого клубочка, что и при-
че происходит только на последнем этапе перфу-
водит к появлению красителя в моче. При ис-
зии (40 мин). На этом этапе уровень мочевины
пользовании Prx6 также наблюдается появление в
падает до контрольных значений и выходит на
моче декстрана голубого, однако стоит обратить
плато, что указывает на прекращение активных
внимании на его динамику. Так, на начальном
процессов транспорта мочевины через канальцы.
этапе перфузии его концентрация в моче в 3.3 раз
При морфологическом исследовании было пока-
ниже, чем при контрольном поражении на тех же
зано, что при использовании Prx6 наблюдается
сроках. К концу перфузионного периода в случае
снижение поражения общей структурной органи-
использования Prx6 концентрация красителя в
зации трубчатых структур нефрона: проксималь-
моче в два раза ниже концентрации красителя в
ных и тонких канальцев. Именно эти структуры
контрольном поражении в этот период. Такая
являются основными местами, ответственными
картина указывает на снижение поражения
за транспорт мочевины [27]. Стоит, однако, отме-
структур почечного тельца и сохранение процес-
тить, что изменение транспорта мочевины в ка-
сов ультрафильтрации при условии применения
нальцах может быть не связано напрямую с по-
Prx6. Кроме того, результаты морфологического
вреждением этих структур, однако полученные
исследования подтверждают факт снижения по-
нами морфологические данные говорят о суще-
ражения структур почечного клубочка при ис-
ственном вкладе именно этого процесса в нару-
пользовании Prx6. Стоит отметить, что измене-
шение процесса реабсорбции мочевины в кровь и
ние концентрации красителя в моче не пропор-
ее возврат обратно в каналы.
ционально количеству пораженных клубочков.
Ранее было показано, что протекторные эф-
Основная функция для канальцев нефрона -
фекты пероксиредоксина 6 связаны с его перок-
вернуть ультрафильтрат в общее сосудистое русло
сидазной активностью, которая позволяет ней-
и оставить в моче токсические продукты метабо-
трализовать гиперпродукцию активных форм
лизма, избыток воды и электролитов. Главный
кислорода, образующихся при ишемически-ре-
токсический метаболит, который выводится поч-
перфузионном поражении органов [11, 15]. В
ками с мочой, - мочевина [27]. В контрольном
частности, мутантный пероксиредоксин 6, не об-
поражении только на начальных этапах перфузии
ладающий пероксидазной активностью, практи-
можно отметить увеличение концентрации моче-
чески не проявлял протекторных свойств при
вины в моче в два с половиной раза. Уже через
ишемически-реперфузионном поражении почки
10 мин перфузии наблюдается резкий спад в кон-
мыши [12]. В настоящем исследовании был пока-
центрации этого метаболита. Это может указы-
зан протекторный эффект Prx6 на изолированной
вать на быстроту поражения структуры большей
почке, что, по-видимому, связано именно с пе-
части почечных канальцев коркового и мозгового
роксидазной активностью белка.
слоя и, как следствие, на отсутствие процессов
реабсорбции мочевины в кровь и ее возврата об-
Было показано, что введение Prx6 в составе
ратно в каналы. В связи с тем, что основные
перфузионного раствора в изолированную почку
места, ответственные за транспорт мочевины, -
с началом ишемии позволяет на последующем
проксимальный каналец и тонкий сегмент восхо-
этапе перфузии изолированного органа снизить
дящeй части петли Гентле [27], можно говорить о
поражение структур нефрона и сохранить морфо-
поражении именно этих структур канальца. Кро-
функциональное состояние почечных телец и ка-
ме того, при морфологическом исследовании бы-
нальцев. Результаты, полученные в работе, ука-
ло отмечено поражение именно проксимальных
зывают на перспективность использования экзо-
канальцев - места, где происходит активный
генных пероксиредоксинов для сохранения
процесс реабсорбции мочевины в почечную
структуры и функциональной активности почеч-
строму.
ного трансплантата при ишемически-реперфузи-
При использования Prx6 наблюдается совер-
онном синдроме. Кроме этого, экзогенные пе-
шенно другая картина в показателях концентра-
роксиредоксины могут быть включены в состав
ции мочевины в моче. Во-первых, на начальных
известных перфузионных растворов в качестве
этапах перфузии происходит значительный рост
мощного антиоксидантного агента для снижения
концентрации этого метаболита в моче, что на-
процессов свободнорадикального окисления.
прямую указывает на наличие процессов транс-
порта мочевины через канальцы. Во-вторых, в те-
ФИНАНСИРОВАНИЕ РАБОТЫ
чение перфузии наблюдается постепенный спад
концентрации мочевины по сравнению с резким
Pабота выполнена при финансовой поддеpжке
падением концентрации мочевины в контроль-
Программой фундаментальных исследований
БИОФИЗИКА том 65
№ 2
2020
348
ГОРДЕЕВА и др.
Президиума РАН «Постгеномные технологии и
9.
А. Г. Волкова, М. Г. Шарапов, В. К. Равин и др.,
перспективные решения в биомедицине».
Пульмонология 2, 84 (2014).
10.
O. A. Palutina, M. G. Sharapov, A. A. Temnov, et al.,
Bull. Exp. Biol. Med. 160, 322 (2015).
КОНФЛИКТ ИНТЕРЕСОВ
11.
М. Г. Шарапов, А. Е. Гордеева, Р. Г. Гончаров
Авторы заявляют об отсутствии конфликта
и др., Биофизика 62 (6), 998 (2017).
интересов.
12.
R. G. Goncharov, K. A. Rogov, A. A. Temnov, et al,
Cell Tissue Res. 378 (2), 319 (2019).
13.
М. Г. Шарапов, В. И. Новоселов и В. К. Равин,
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Молекуляр. биология 43 (3), 505 (2009).
Работу с лабораторными животными проводи-
14.
J. Czogalla, F. Schweda, and J. Loffing, J. Vis. Exp.
ли в соответствии с положениями «Европейской
117, e54712 (2016). DOI: 10.3791/54712
конвенции о защите позвоночных животных, ис-
15.
A. E. Gordeeva, A. A. Temnov, A. A. Charnagalov,
пользуемых для эксперимента и других научных
et al., Dig. Dis. Sci. 60 (12) 3610 (2015).
целей, 1986». Основным документом, регламен-
16.
Т. В. Абрашова, Я. А. Гущин и М. А. Ковалева, Фи-
тирующим проведение настоящего исследова-
зиологические, биохимические и биометрические по-
казатели нормы экспериментальных животных.
ния, являлось «Руководство по работе с лабора-
Справочник (ЛЕМА, СПБ., 2013).
торными животными ИБК PАН»
№ 57 от
17.
А. М. Федорук, Новости хирургии 26 (2), 215 (2018).
30.12.2011 г.
18.
S. F. Bagnenko, K. Senchik, A. Skvortsov, et. al., Vestn.
khirurgii 169 (2), 113 (2010).
СПИСОК ЛИТЕРАТУРЫ
19.
R. Anaya-Prado and J. A. Delgado-Vázquez, Curr.
Opin. Organ. Transplantol. 13 (2) 129 (2008).
1. G. J. Chang, H. D. Mahanty, N. L. Ascher, et al., Am.
J. Transplantol. 3 (10), 1259 (2003).
20.
M. R. Maximilian, M. Ph. Polyak, B. S. Ben OMar Ar-
rington, et al., J. Surg. Res. 85 (1) 17 (1999).
2. G. Kootstra, Transplantation 63 (7), 917 (1997).
21.
F. A. Gage and Y. Vodovotz, Nitric Oxide 9 (3) 141
3. A. I. Sanchez-Fructuoso, D. Prats, еt al., J. Nephrol.
(2003).
16 (3), 387 (2003).
4. С. Ф. Багненко, Ю. Г. Мойсюк, А. Е. Скворцов
22.
M. Gregorini, V. Corradetti, E. Pattonieri, et al., J.
Cell. Mol. Med. 21, 3381 (2017).
и др., Вестн. трансплантологии и искусственных
органов 11 (3), 17 (2009).
23.
L. F. Tirapelli, D. F. Barione, B. F. Trazzi, et al.,Tran-
splantol. Proc. 41, 4083 (2009)
5. D. H. Koo and S. V. Fuggle, Transpl. Rev. 14 (2), 210
(2000).
24.
S.V. Novoselov, I. V. Peshenko, V. I. Popov, et al., J.
6. B. M. Stubenitsky, M. H Booster, and A. P. Nidersting,
Cell Tissue Res. 298, 471 (1999).
Transpl. Int. 12, 83 (1999).
25.
J. R. Godoy, S. Oesteritz, E. M. Hanschmann, et al.,
Free Radic. Biol. Med. 51, 552 (2011).
7. E. V. Karaduleva, E. K. Mubarakshina, M. G. Shara-
pov, et al., Bull. Exp. Biol. Med. 160 (5), 639 (2016).
26.
D. R.Taft, Curr. Drug Discov. Technol. 1, 97 (2004).
8. В. И. Новоселов, Н. К. Равин, М. Г. Шарапов и др.,
27.
И. А. Савин и А. С. Горячев, Водно-электролит-
Биофизика 56 (5), 873 (2011).
ные нарушения в нейрореанимации (М., 2015).
The Effect of Exogenous Peroxiredoxin 6 on Functional Parameters
of Isolated Rat Kidney
A.E. Gordeeva, M.G. Sharapov, V.A. Evdokimov, V.I. Novoselov, and E.E. Fesenko
Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
The purpose of the study was to investigate the protective effects of exogenous peroxiredoxins on ischemia-
reperfusion injury in the isolated, perfused rat kidney. This study was conducted using ex vivo isolated, per-
fused rat kidney model. Recombinant peroxiredoxin 6 was injected directly into the perfusion buffer. Blue
Dextran of high molecular weight (2000 kDa) and urea were added to the perfusion buffer to evaluate renal
function of isolated kidney. It was shown that in isolated rat kidney cortex exogenous peroxiredoxin 6 was lo-
calized in glomerular vessels within the kidneys; in the medulla it was found in the microvessels which sur-
rounded the thin-walled tubules. It was shown that peroxiredoxin 6 has the capacity to lower a degree of dam-
age to nephron structures by a factor of 2 as compared to control damage, thereby ensuring the maintenance
of ultrafiltration processes. A reduction in glomerular damage leads to a 2-fold decrease in Blue Dextran con-
centration in urine as compared to control damage at the end of the perfusion period. When tubular structures
are less affected by injury, it implies that urea transport is active during perfusion. The present study thus in-
dicates that the presence of peroxiredoxin 6 in the perfusion buffer contributes to a less amount of damage to
nephron structures facilitating the maintenance of the morphofunctional state of renal glomeruli and tubules.
Keywords: isolated kidney, nephrons, peroxiredoxins, ischemia-reperfusion
БИОФИЗИКА том 65
№ 2
2020