БИОФИЗИКА, 2020, том 65, № 2, с. 349-359
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.15
ЗАЩИТНЫЙ ЭФФЕКТ ХИМЕРНОГО ФЕРМЕНТА-АНТИОКСИДАНТА
PSH ПРИ ИШЕМИЧЕСКИ-РЕПЕРФУЗИОННОМ ПОРАЖЕНИИ ПОЧЕК
© 2020 г. Р.Г. Гончаров*, **, Г.И. Фильков**, А.В. Трофименко**, В.В. Бояринцев**,
В.И. Новоселов*, **, М.Г. Шарапов*, **
*Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, ул. Институтская, 3
**Московский физико-технический институт,
141700, Долгопрудный Московской области, Институтский пер., 9
E-mail: sharapov.mg@yandex.ru
Поступила в редакцию 27.11.2019 г.
После доработки 03.02.2020 г.
Принята к публикации 05.02.2020 г.
Наиболее опасным этапом ишемически-реперфузионного поражения является стремительный
рост концентрации свободных радикалов и активных форм кислорода на стадии реперфузии. Лави-
нообразный рост уровня активных форм кислорода и вторичных продуктов свободнорадикального
окисления биологических макромолекул приводит к развитию окислительного стресса. Примене-
ние экзогенных антиоксидантов позволяет снизить концентрацию активных форм кислорода в по-
раженных тканях, подавить или скорректировать течение окислительного стресса, тем самым суще-
ственно снизить тяжесть ишемически-реперфузионного поражения. Среди большого списка пато-
логий, вызванных ишемией-реперфузией, одной из наиболее социально значимых является
ишемическая острая почечная недостаточность. На животной модели билатерального ишемиче-
ски-реперфузионного поражения почек был показан нефропротекторный эффект химерного фер-
мента-антиоксиданта PSH, состоящего из пероксиредоксина 6 человека и Mn-содержащей су-
пероксиддисмутазы Escherichia coli. Благодаря наличию супероксиддисмутазной и пероксидазной
активностей рекомбинантный химерный белок PSH способен нейтрализовать максимально широ-
кий спектр активных форм кислорода. С помощью гистологических, биохимических и молекуляр-
но-биологических методов показано, что предварительное введение химерного белка PSH перед
ишемией-реперфузией способствует существенному снижению степени поражения тканей почек
и приводит к быстрой нормализации их структурно-функционального состояния. Кроме того, вве-
дение фермента PSH увеличивает более чем в 1,5 раза выживаемость экспериментальных животных.
Применение рекомбинантного химерного фермента PSH может быть эффективным подходом в
предупреждении и лечении ишемически-реперфузионных поражений почек, а также для сохране-
ния изолированной почки при трансплантации.
Ключевые слова: пероксиредоксин, супероксиддисмутаза, химерные ферменты, окислительный стресс,
ишемия-реперфузия, почки.
DOI: 10.31857/S0006302920020180
ность и др. [1, 2]. Кроме этого, многие лечебно-
В настоящее время хорошо известно, что ише-
диагностические вмешательства связаны с И-Р-
мически-реперфузионные (И-Р) поражения яв-
повреждением. В частности, при трансплантаци-
ляются основным фактором развития многих па-
онной хирургии органы подвергаются частично-
тологических состояний организма, которые свя-
му или полному прекращению кровотока (ише-
заны с нарушением нормального кровотока. К
мии) различной продолжительности, с последую-
ним относятся такие заболевания, как шоковое
щим восстановлением кровотока - реперфузией.
поражение органов, ишемический инсульт, ин-
В ходе И-Р происходит развитие сложных взаи-
фаркт миокарда, острая почечная недостаточ-
мосвязанных патобиохимических процессов. На
сегодняшний день хорошо известно, что ключе-
Сокращения: И-Р - ишемия-реперфузия, АФК - актив- вую роль в патогенезе И-Р-поражений играет
ные формы кислорода, PSH - Prx6-MnSOD-His-tag, хи-
окислительный стресс, который вызван гипер-
мерный белок, состоящий из пероксиредоксина 6 челове-
ка и Mn-содержащей супероксиддисмутазы, ПЦР - поли-
продукцией активных форм кислорода (АФК),
меразная цепная реакция, МДА - малоновый диальдегид.
способных повреждать структурно-функцио-
349
350
ГОНЧАРОВ и др.
нальную целостность всех метаболически актив-
представлять интерес при разработке нового
ных тканей [3, 4]. В современной терапии И-Р-
класса терапевтического препаратов антиокси-
повреждений существует несколько подходов.
дантного действия, для предупреждения/лечения
Во-первых, это использование ишемического
патологий, вызванных окислительным стрессом.
прекондиционирования, вызванного кратковре-
менным пережатием питающих сосудов, или
МЕТОДЫ ИССЛЕДОВАНИЯ
фармакологических препаратов, вызывающих
гипоксию, разобщение дыхания в митохондриях
Получение ферментов. Генно-инженерная
и др. [5]. Ишемическое прекондиционирование
конструкция, кодирующая фермент PSH, была
способствует росту уровня АФК и компенсатор-
получена и экспрессирована ранее в клетках
ному росту уровня эндогенных антиоксидантов в
E. coli BL21(DE3) [18]. Рекомбинантный белок
тканях благодаря стимуляции различных тран-
PSH содержит на карбоксильном конце His-tag,
скрипционных факторов HIFs, NRF-2 и др., спо-
поэтому очистку фермента проводили с помо-
собных регулировать уровень экспрессии фер-
щью аффинной хроматографии на Ni-NTA-ага-
ментов-антиоксидантов [6, 7]. Несомненно, ише-
розе (Thermo Fisher Scientific, США), в соответ-
мическое прекондиционирование обладает
ствии с рекомендациями производителя [18].
рядом преимуществ, однако его клиническое ис-
Согласно гель-электрофорезу в 10%-м полиакри-
пользование ограничено из-за сложности про-
ламидном геле в присутствии додецилсульфата
гноза оптимального времени ишемического пре-
натрия, чистота полученного химерного фермен-
кондиционирования для достижения эффектив-
та PSH составляла не менее 95%.
ной защиты органа от И-Р-повреждения [8]. В
Определение пероксидазной активности. Пе-
этой связи более перспективным подходом в ле-
роксидазную активность фермента в отношении
чении И-Р-поражений является применение эк-
пероксида водорода (H2O2) и трет-бутилгидро-
зогенных антиоксидантов, которые нейтрализу-
пероксида (t-BOOH) определяли по методике,
ют АФК и тем самым подавляют первопричину
подробно описанной нами ранее [19]. Перокси-
И-Р-поражения. В антиоксидантной терапии И-Р-
дазная активность рекомбинантного Prx6 в соста-
поражений особую роль могут играть ферменты-
ве PSH составила 200 ± 30 нмоль/мин/мг (в отно-
антиоксиданты, так как их эффективность значи-
шении H2O2) и 90 ± 15 нмоль/мин/мг (в отноше-
тельно превышает таковую для низкомолекуляр-
нии t-BOOH).
ных антиоксидантов [9]. Среди известных фер-
Определение активности супероксиддисмутазы.
ментов-антиоксидантов особый интерес пред-
Определение супероскиддисмутазной активно-
ставляют пероксиредоксины, которые способны
сти Mn-содержащей супероксиддисмутазы
нейтрализовать широкий спектр АФК как орга-
(E. coli) в составе химерного фермента PSH про-
нической, так и неорганической природы, поэто-
водили с помощью готового набора реактивов -
му применение этих ферментов представляется
Superoxide Dismutase Assay Kit (Calbiochem,
наиболее перспективным подходом в предупре-
США), в соответствии с инструкцией производи-
ждении и лечении заболеваний, вызванных И-Р-
теля. Активность Mn-содержащей супероксид-
поражениями. Так, нами была показана высокая
дисмутазы (E. coli) в составе PSH составила
терапевтическая эффективность рекомбинант-
17 ед./мл.
ного Prx6 при лечении травм кожи [10], ожогов
верхних дыхательных путей [11], И-Р-поражении
Животные. Использовали мышей-самцов ли-
кишечника [12] и почек [13], а также был обнару-
нии BALB/c восьминедельного возраста с массой
жен радиопротекторный эффект этого фермента
тела 25-30 г (виварий ИБК РАН, Пущино). Жи-
[14, 15]. Важно отметить, что среди семейства пе-
вотным обеспечивали свободный и неограничен-
роксиредоксинов Prx6 характеризуется наиболее
ный доступ к питьевой воде и корму, однако в те-
широким спектром нейтрализуемых гидроперок-
чение 24 ч до хирургического вмешательства жи-
сидов, а также обладает активностью фосфолипа-
вотные голодали, но получали воду.
зы А2 (aiPLA), которая играет важную роль в меж-
Модель ишемически-реперфузионного пораже-
клеточной сигнализации [16, 17]. Для расшире-
ния почек мыши. Анестезию проводили путем вве-
ния спектра нейтрализуемых АФК и усиления
дения смеси Zoletil-100 (Virbac Sante Animale,
терапевтических свойств на основе Prx6 человека
Франция) и Rometar-20 (Bioveta, Чехия) внутри-
и Mn-содержащей супероксиддисмутазы E. coli
мышечно в 0,9% растворе NaCl в концентрациях
был создан химерный белок PSH (Prx6-MnSOD-
40 и 7 мкг соответственно на 1 г веса мыши. Дей-
His-tag), проявляющий две антиоксидантные ак-
ствие анестезии длилось в течение полутора-двух
тивности - супероксиддисмутазную и перокси-
часов. Операцию на животных проводили соглас-
дазную [18]. В настоящей работе проведено ис-
но процедуре, описанной ранее [20], с небольши-
следование нефропротекторных свойств химер-
ми модификациями. После начала действия ане-
ного белка PSH на модели билатеральной И-Р
стезии животным делали небольшие латеральные
почек мыши. Полученные результаты могут
надрезы кожных и мышечных слоев с двух сторон
БИОФИЗИКА том 65
№ 2
2020
ЗАЩИТНЫЙ ЭФФЕКТ ХИМЕРНОГО ФЕРМЕНТА-АНТИОКСИДАНТА PSH
351
тела, открывая тем самым доступ к почечным ар-
США). В работе использовали 5%-й концентри-
териям и венам. Далее с помощью кровоостанав-
рующий и 10%-й разделяющий полиакриламид-
ливающих зажимов проводили одновременное
ные гели. Белки, разделенные в полиакриламид-
пережатие левых и правых почечных артерий и
ном геле, переносили на нитроцеллюлозную
вен, что приводило к блокированию притока и
мембрану с размером пор 0.45 мкм Hybond-C
оттока крови к тканям почек, т. е. ишемии. Внеш-
(Amersham, США) с помощью прибора для полу-
ним признаком начала ишемии является измене-
сухого переноса TRANS-BLOT SD (Bio-Rad,
ние цвета почки с бледно-розового до темно-пур-
США). Были использованы следующие первич-
пурного. Ишемия длилась в течение 30 мин, по-
ные антитела: моноклональные антитела кролика
сле чего снимали зажимы для восстановления
против His-tag (1:1000, #12698, Cell Signaling tech-
притока и оттока крови (стадия реперфузии).
nology, США); моноклональные антитела кроли-
Внешним признаком начала реперфузии являет-
ка против Caspase 3 (1:1000, 9H19L2, Thermo Fish-
ся изменение цвета почек с темно-пурпурного
er Scientific, США); антитела кролика против Ac-
до бледно-красного. Латеральные разрезы заши-
tin-β
(1
: 1000, #4967, Cell Signaling, США).
вали и обрабатывали антисептиком. После опера-
Использовали вторичные антитела против имму-
ции животные были обеспечены кормом и водой
ноглобулинов кролика, коньюгированые с пе-
ad libitum. Спустя 24 и 72 ч животных умерщвляли
роксидазой хрена (1:1000, P-GAR Iss, IMTEK,
декапитацией и проводили забор почек, которые
Россия). Все процедуры в процессе иммуноблот-
делили на три равные части согласно схеме, опи-
тинга проводили в соответствии с рекомендация-
санной в работе [21].
ми производителей. Белки выявляли, используя
диаминобензидин (Amresco, США), денситомет-
Для проверки терапевтического действия рас-
рический анализ осуществляли, применяя про-
твор рекомбинантного PSH вводили через хво-
стовую вену в конечной концентрации 20 мкг/г
nih.gov). Данные были нормированы относитель-
массы мыши за 15 мин до начала ишемии. Подбор
но β-актина.
способа введения и концентрации раствора белка
осуществляли на основе предыдущих исследова-
Анализ уровня экспрессии генов в почечной тка-
ний [13-15, 22].
ни. Уровень экспрессии генов определяли мето-
дом полимеразной цепной реакции (ПЦР) в ре-
Гистологический анализ почечной ткани. Ткани
альном времени с этапом обратной траскрипции.
почки фиксировали в 10%-м растворе формаль-
Общую РНК из образцов ткани получали с помо-
дегида, затем образцы дегидратировали в повы-
щью реактива ExtractRNA («Евроген», Россия).
шающемся градиенте этанола и заключали в па-
Качество РНК оценивали элетрофоретически в
рафин. С помощью микротома (Thermo Electron
2%-м агарозном геле. Концентрацию РНК опре-
Corparation, США) готовили парафиновые срезы
деляли с помощью спектрофотометра NanoDrop
толщиной 3 мкм. Полученные срезы окрашивали
1000с (Thermo Fisher Scientific, США). Для обрат-
гематоксилин-эозином (Biovitrum, Россия). Ги-
ной транскрипции использовали по 2 мкг общей
стологический анализ проводили с использова-
РНК, обратную траскриптазу MMLV и стандарт-
нием микроскопа Leica DM6000 (Leica, Герма-
ный олигонуклеотид dT15 («Евроген», Россия).
ния). Для каждого гистологического образца про-
водили анализ
15-20 полей трех различных
Полученную кДНК использовали для ПЦР с ген-
срезов при увеличении 200-500×.
специфическими олигонуклеотидами (табл. 1).
Электрофорез и иммуноблоттинг. Для оценки
ПЦР в реальном времени проводили с помо-
времени циркуляции экзогенного PSH в крови
щью аплификатора DTlite («ДНК-Технология»,
животного 1 мг PSH вводили внутривенно трем
Россия) с использованием набора qPCRmix-HS
самцам мышей BALB/c с последующим отбором
SYBR («Евроген», Россия), где в качестве флуо-
крови (~ 50 мкл) из хвостовой вены через 10, 60,
ресцентного интеркалирующего красителя ис-
120 и 240 мин для анализа изменения содержании
пользуется SYBR Green II. Режим ПЦР: (1) - «го-
PSH в системном кровотоке. Экзогенный реком-
рячий старт» при 95ºC, 5 мин; (2) - денатурация
бинантный PSH содержит метку His-tag на C-кон-
при 95ºC, 15 с; (3) отжиг праймеров и синтез ДНК
це, которая позволяет специфически отслежи-
при 60ºC, 30 с. Этапы (2) и (3) повторяли 40 раз.
вать присутствие рекомбинантного белка. Для
Определение значений порогового цикла - Ct -
определения уровня индукции каспазы-3 в тка-
проводили с помощью программного обеспече-
нях почек проводили отбор ~ 40 мг ткани у кон-
ния DTmaster (ДНК-Технология, Россия). Нор-
трольных и опытных животных до И-Р-пораже-
мирование проводили относительно гена цитос-
ния и спустя 24-72 ч после И-Р-поражения. Об-
келетного бета-актина (Actb). Расчет ΔΔCt прово-
разцы белков почек и сыворотки крови
дили по формуле ΔΔCt = ΔCt (Контроль) - ΔCt
проводили в денатурирующих условиях (в при-
(опыт); каждое значение ΔCt рассчитывали по
сутствии SDS) по стандартной методике Лэммли
формуле ΔCt = Ct (исследуемый ген) - Ct (Actb)
на оборудовании Mini Vertical Unit (Amersham,
[23].
БИОФИЗИКА том 65
№ 2
2020
352
ГОНЧАРОВ и др.
Таблица 1. Ген-специфические олигонуклеотиды для ПЦР в реальном времени
№
Наименование
Последовательность олигонуклеотида 5' - 3' (F+R)
Размер, п.н.
# GenBank
CCTTCCTTCTTGGGTATGGAATCC
1
bAct
115
NM_007393.4
CACCAGACAGCACTGTGTTGGCA
AAGGAGCAGCTTTGTGTGTG
2
CASP3
145
NM_009810
GAAGAGTTTCGGCTTTCCAG
GAACCTGAGGGTGCCCAG
3
eNOS
71
NM_021838.2
TCCGATTCAACAGTGTCTCCT
GCTACACTTCCAACGCAACA
4
iNOS
115
NM_012611.3
CATGGTGAACACGTTCTTGG
TAGTCCTTCCTACCCCAATTTCC
5
IL-6
76
NM_031168
TTGGTCCTTAGCCACTCCTTC
GTGTTCCAGGACACAACAAG
6
IL-18
74
NM_008360.1
CTTCCTTTTGGCAAGCAAGA
CCACGCTCAGCTTGTGAGGGAT
7
NF-κB
106
NM_008689
GGCCAAGTGCAGAGGTGTCTGAT
CTCGCTGGAAAAAGAAGTG
8
KIM-1
240
NM_010902
CCGTCCAGGAGTTCAGAGG
Определение уровня малонового диальдегида в
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
тканях почек. Определение уровня малонового
Оценка времени циркуляции рекомбинантного
диальдегида (МДА) проводили по стандартной
PSH в кровотоке животных. Для доказательства
методике с использованием тиобарбитуровой
того, что терапевтический эффект PSH при И-Р-
кислоты. К 20-30 мг ткани почек последователь-
поражении почки определялся его присутствием
но добавляли 450 мкл 1% H3PO4 и 150 мкл 0,8%
в органах животного, с помощью иммуноблот-
тиобарбитуровой кислоты и гомогенизировали с
тинга была проведена оценка изменения содер-
использованием тефлонового пестика. Затем
жания рекомбинантного фермента PSH в сыво-
смесь нагревали на кипящей водяной бане в тече-
ротке крови животных после внутривенного вве-
ние 45 мин. После охлаждения добавляли 380 мкл
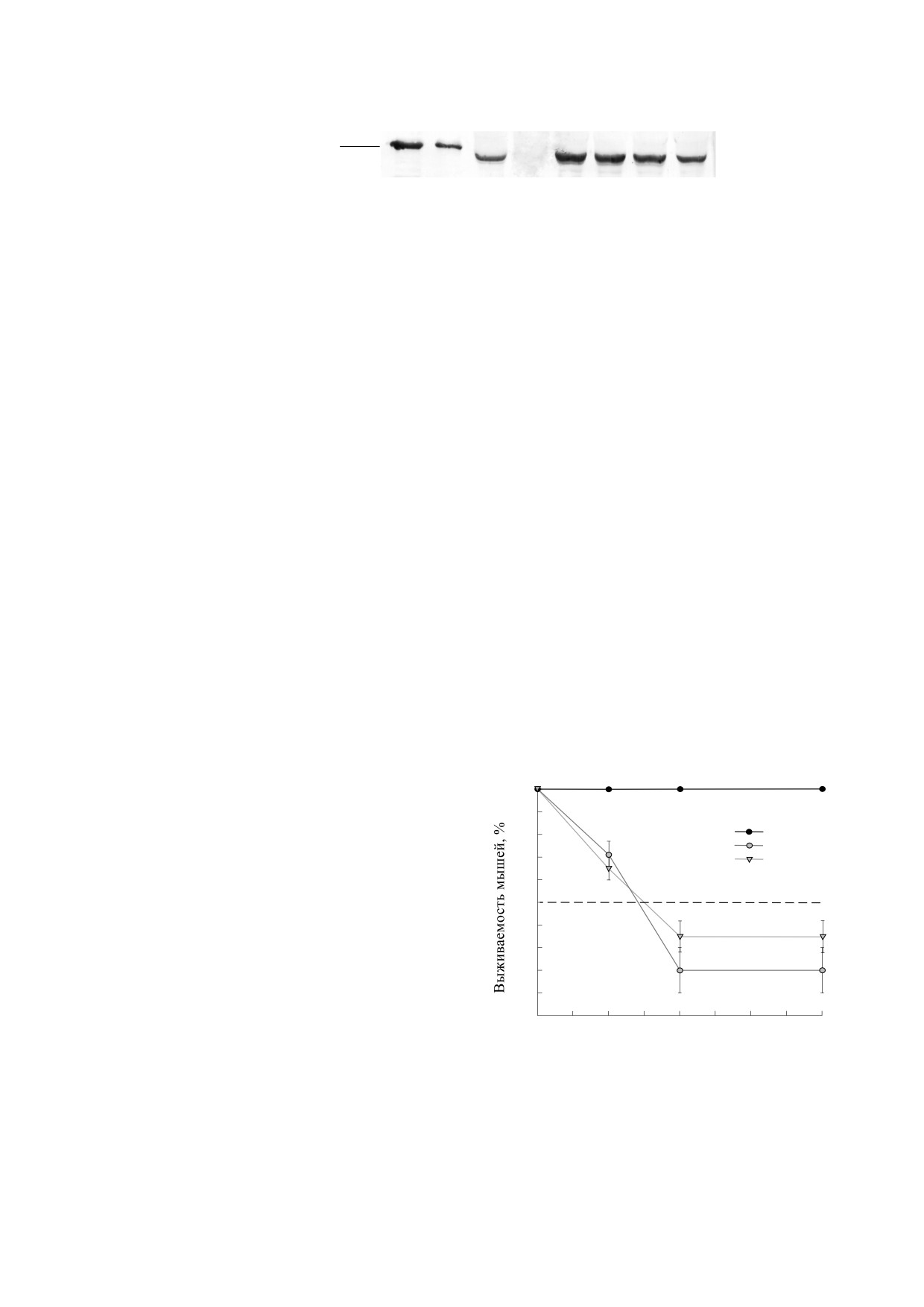
дения (рис. 1).
н-бутанола и тщательно перемешивали. Отделяли
Результаты показали, что в первый час после
слой н-бутанола путем центрифугирования. Оп-
внутривенного введения PSH в крови животного
тическую плотность водной фракции определяли
присутствует более 80% от исходного количества
с помощью прибора Multiskan (Labsystem Plus,
вводимого белка. С течением времени количество
Финляндия), длина волны 546 нм.
экзогенного фермента PSH в сыворотке крови
Биохимический анализ крови. Отбор крови осу-
животных снижается и через три часа уменьшает-
ществляли у контрольных и опытных животных,
ся примерно в 1,6 раза. Таким образом, экзоген-
который проводили до И-Р-поражения и спустя
ный рекомбинантный фермент PSH присутствует
24-72 ч после И-Р-поражения почек. Биохими-
в крови животного в течение всего ишемического
ческий анализ крови проводили на биохимиче-
периода (30 мин) в количестве не менее 80-90%,
ском экспресс-анализаторе Reflotron Plus (Roche
а при последующей реперфузии, по крайней мере
Diagnostics, Швейцария) в соответствии с ин-
в течение первых четырех часов реперфузионного
струкцией производителя.
периода значительная часть введенного фермента
циркулирует в периферической крови. Ранее бы-
Статистическая обработка. Статистический
ло показано, что начальным периодом поврежде-
анализ выполняли c использованием программы
ния почек при И-Р-поражении являются первые
SigmaPlot 11 (Systat Software Inc, США). Результа-
четыре-шесть часов [24], а своего пика степень
ты выражали как среднее значение ± стандартное
повреждений достигает спустя 24 ч после И-Р,
отклонение. Внутригрупповые статистические
что является хорошим критерием для оценки за-
различия определяли с помощью одностороннего
щитных свойств рекомбинантного фермента.
анализа ANOVA, а статистическую значимость
между отдельными экспериментальными группа-
Выживаемость животных после ишемически-ре-
ми - с помощью непарного t-критерия Стьюден-
перфузионного поражения и предварительного вве-
та. Значение P < 0.05 принимали как статистиче-
дения PSH. На первом этапе работы была иссле-
ски достоверное различие.
дована выживаемость животных в течение пяти
БИОФИЗИКА том 65
№ 2
2020
ЗАЩИТНЫЙ ЭФФЕКТ ХИМЕРНОГО ФЕРМЕНТА-АНТИОКСИДАНТА PSH
353
1
2
3
4
5
6
7
8
М, кДа
55
Время после внутривенного введения PSH, мин:
10
60
120
240
Содержание вводимого PSH, %:
100
87
81
54
Рис. 1. Иммуноблоттинг сыворотки крови мышей после внутривенного введения PSH: 1, 2 - чистый препарат реком-
бинантного PSH (500 и 100 нг соответственно); 3, 4 - плазма крови контрольных животных с добавленным к ней пре-
парата рекомбинантного PSH; 5 - плазма крови контрольных животных, не получавших инъекцию рекомбинантного
PSH; 5-8 - пробы плазмы крови мыши спустя 10, 60, 120 и 240 мин после внутривенного введения 1 мг PSH.
суток после И-Р-поражения обеих почек и пред-
но без клеточной деструкции отмечены и в эпите-
варительного введения PSH за 15 мин до начала
лии прямых канальцев.
тридцатиминутной ишемии (рис. 2).
Введение фермента PSH за 15 мин до тридца-
Показано, что спустя 72-120 ч в группе с И-Р и
тиминутной ишемии и последующая 24-часовая
без предварительного введения рекомбинантного
реперфузия также приводят к полнокровию ка-
фермента антиоксиданта выживаемости живот-
пиллярных петель клубочков и интерстиции по-
ных составила 20% (рис. 2). В группе с предвари-
чечной ткани. Однако целостность клубочков
тельным введением PSH процент выживаемости
нефрона не нарушена, хотя отмечается увеличе-
за тот же период увеличился в 1,7 раза по сравне-
ние в размерах. Наблюдаются дистрофические и
нию с И-Р-группой. Полученные результаты де-
деструктивные изменения эпителия извитых и
монстрируют, что критическим периодом для вы-
прямых канальцев (рис. 3в). Через 72 ч сохраняет-
живания животных являются первые 72 ч после
ся полнокровие капиллярных петель клубочков и
И-Р-поражения обеих почек.
интерстиция, однако дистрофия извитых и пря-
Морфологический анализ почек после ишемиче-
мых канальцев ниже, чем двумя сутками ранее. В
ски-реперфузионного поражения и предваритель-
просвете извитых канальцев наблюдается скоп-
ного введения PSH. Для оценки морфологических
ление белковых масс, а выстилающий их эпите-
изменений в почечной ткани после И-Р и предва-
лий уплощен с выраженной гидропической дис-
рительного введения (за 15 мин) рекомбинантно-
трофией и умеренной деструкцией эпителиаль-
го фермента PSH перед тридцатиминутной ише-
ных клеток (рис. 3е). Суммарные результаты
мией и последующей реперфузии (24-72 ч) был
гистологического анализа почечной ткани после
проведен гистологический анализ тканей (рис. 3).
И-Р и предварительного введения PSH перед И-Р
представлены в табл. 2.
Гистологический анализ срезов ткани почек
контрольной группы показал, что тридцатими-
нутная ишемия и последующая 24-часовая репер-
Контроль
фузия почек мышей приводят к полнокровию ин-
100
терстиция и капиллярных петель клубочков. Це-
лостность клубочков нефрона не нарушена,
Контроль
80
однако наблюдается увеличение их размеров. В
И-Р
эпителии почечных канальцев, обнаружены вы-
И-Р + PSH
раженные дистрофические повреждения, с разру-
60
шением апикальных отделов эпителиоцитов. В
некоторых извитых канальцах отмечен некроз и
десквамация клеток канальцевого эпителия.
40
#И-Р + PSH
Просвет канальцев при этом был заполнен белко-
вым детритом (рис. 3б). Через 72 ч после восста-
20
новления кровотока в почках сохранялось уме-
#И-Р
ренное полнокровие капиллярных петель клу-
бочков. В эпителии извитых канальцев выявлена
024
48
72
96
120
баллонная дистрофия с деструкцией апикальных
Время, ч
отделов клеток. Отчетливая эозинофилия цито-
плазмы эпителиальных клеток, вероятно, связана
с массовой денатурацией белков. Расширенные
Рис. 2. Выживаемость мышей в течение пяти суток
после тридцатиминутной ишемии обеих почек и по-
просветы извитых канальцев почек были обу-
следующей реперфузии, а также после предваритель-
словлены деструктивными изменениями клеток
ного введения рекомбинантного фермента PSH за
эпителия (рис. 3д). Дистрофические изменения,
15 мин до ишемии.
БИОФИЗИКА том 65
№ 2
2020
354
ГОНЧАРОВ и др.
(а)
(б)
(в)
(г)
(д)
(е)
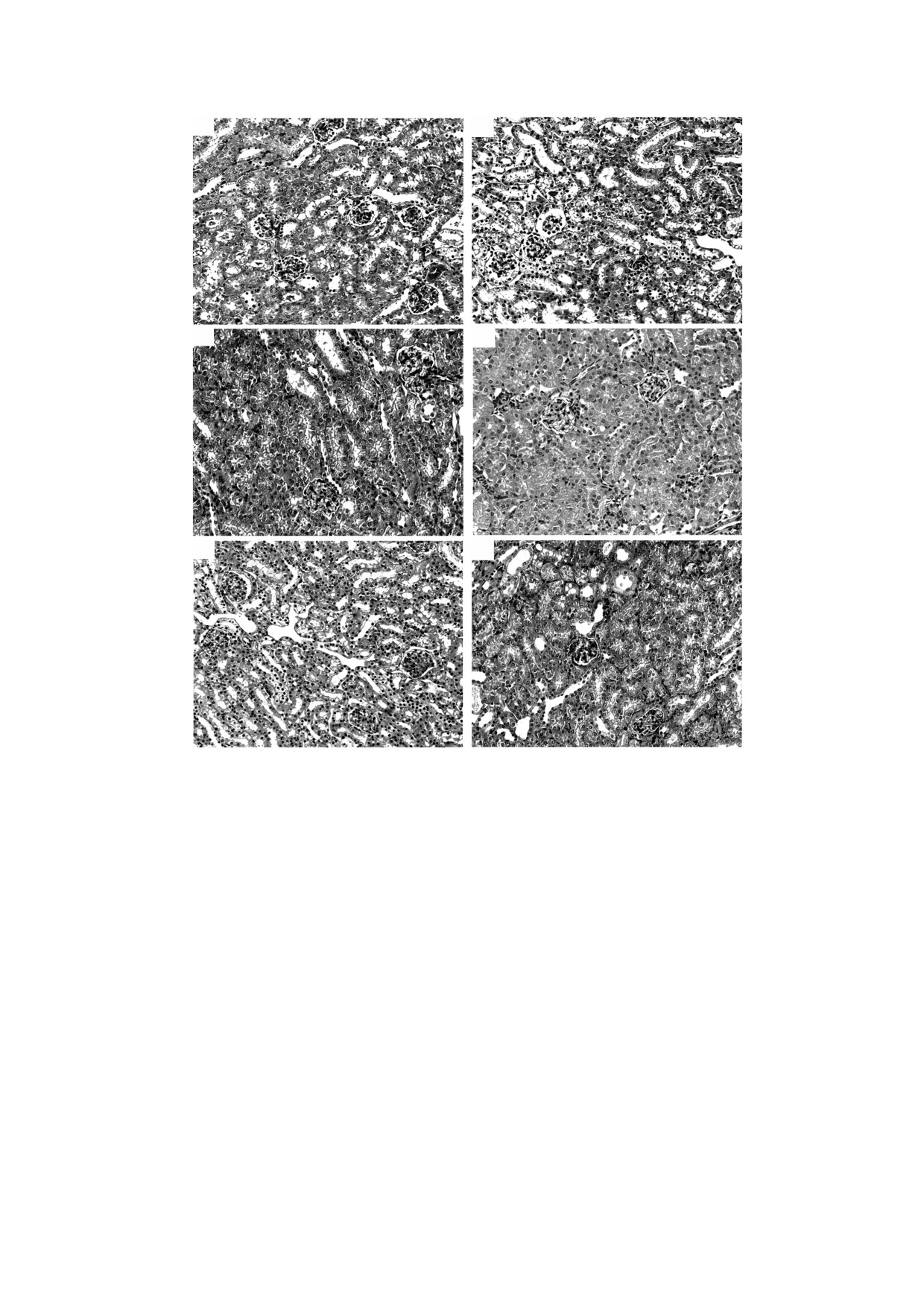
Рис.
3. Структура коркового слоя почки мыши после ишемии-реперфузии и предварительного введения
рекомбинантного PSH. (а) - Интактный контроль; (б) - 30-минутная ишемия, реперфузия - 24 ч, без лечения; (в) -
внутривенное введение PSH (е) за 15 мин до 30-минутной ишемии, реперфузия - 24 ч; (г) и (д) - 30-минутная
ишемия, реперфузия - 72 ч, без лечения; (е) - внутривенное введение PSH (е) за 15 мин до 30-минутной ишемии,
реперфузия - 72 ч. Окраска: гемотоксилин-эозин; n = 10 для каждой из групп.
На основании гистологического анализа кор-
ции мочевины и креатинина в крови [25]. Данные
кового слоя почки спустя 24 и 72 ч после И-Р
показатели являются важными критериями
можно заключить, что использование рекомби-
оценки терапевтической эффективности предва-
нантного фермента PSH за 15 мин до тридцати-
рительного введения рекомбинантного PSH пе-
минутной ишемии по сравнению с контрольной
ред И-Р. Оценку уровней мочевины и креатинина
группой И-Р без лечения снижает поражение по-
в крови животных проводили в течение трех по-
чечной ткани, способствуя ее более быстрому
следующих суток после И-Р (табл. 3. и 4).
восстановлению у выживших животных.
Спустя 24 ч после И-Р наблюдается увеличе-
Биохимический анализ крови животных после
ние концентрации мочевины в крови примерно в
ишемически-реперфузионного поражения и предва-
пять раз, а креатинина - более чем в шесть раз по
рительного введения PSH. Важным параметром
сравнению с интактной группой (табл. 3 и 4).
нормальной работы почек является их экскретор-
Аналогичный результат с использованием похо-
ная функция. Общепринятыми биохимическими
жей животной модели был получен в работах дру-
маркерами, позволяющими оценить нормальное
гих авторов [26, 27]. В группе с предварительным
функционирование почки, являются концентра-
введением PSH концентрация мочевины в крови
БИОФИЗИКА том 65
№ 2
2020
ЗАЩИТНЫЙ ЭФФЕКТ ХИМЕРНОГО ФЕРМЕНТА-АНТИОКСИДАНТА PSH
355
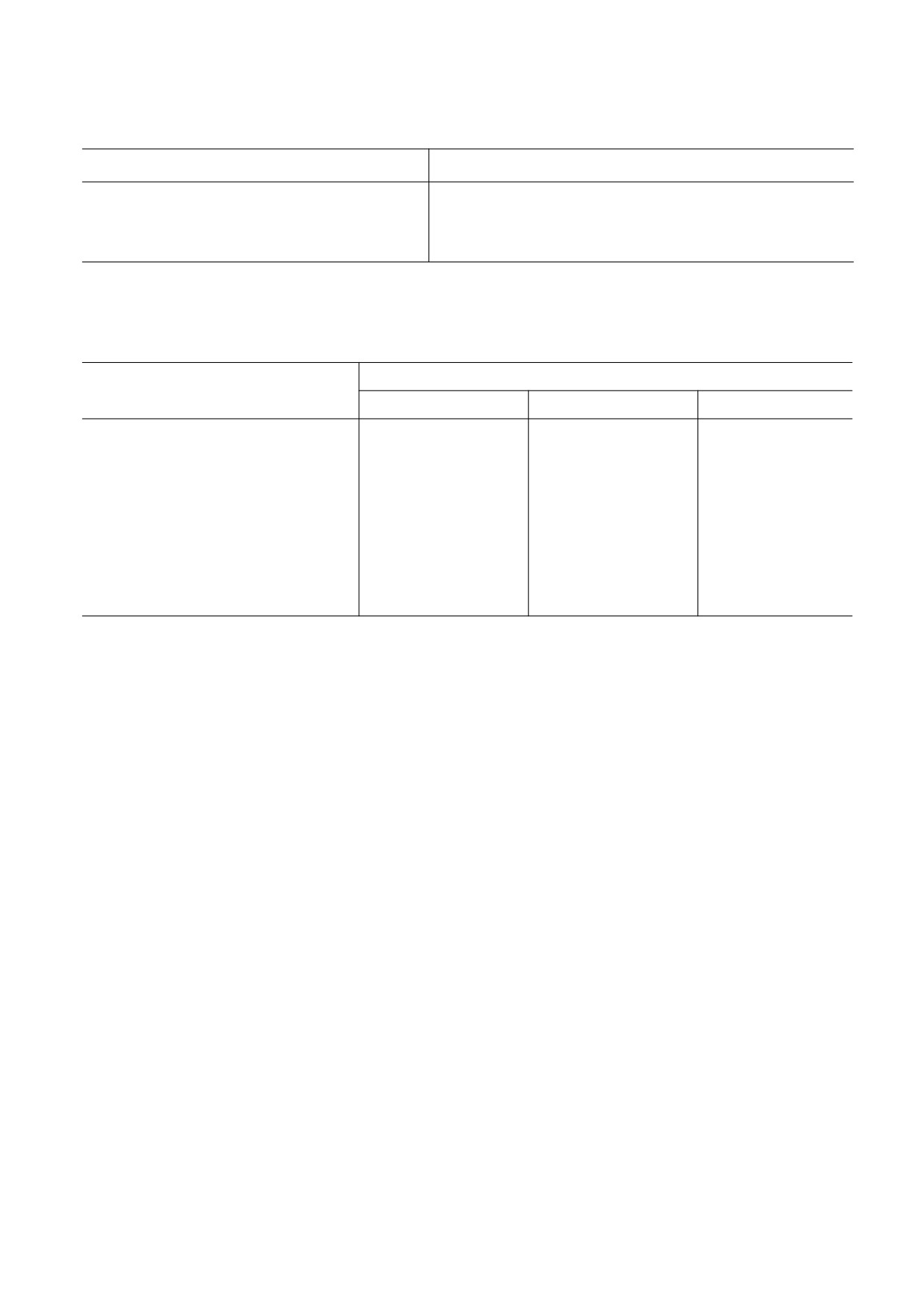
Таблица 2. Оценка морфометрических параметров тканей почек после И-Р и предварительного введения
химерного фермента-антиоксиданта PSH перед И-Р
Контроль
И-Р
PSH
Параметр
24 ч
72 ч
24 ч
72 ч
24 ч
72 ч
Расширение капсулы Боумена
-
-
+
+
+
++
Полнокровие интерстиция
-
-
++
++
++
++
Интерстициальный инфильтрат
-
-
+
+
+
+
Застой в кровеносных сосудах
-
-
++
++
++
+
Дистрофия извитых канальцев
-
-
++
++
++
+
Дистрофия прямых канальцев
-
-
++
++
++
+
Расширение извитых канальцев
-
-
+
+
+
++
Десквамация клеток эпителия
-
-
++
++
++
+
Разрушение эпителиоцитов
-
-
++
++
++
+
Примечание. Гистологические изменения оценивались по шкале: (-) - нормальные, (+) - легкие изменения, (++) - средние
изменения, (+++) - заметные изменения; n = 10 для каждой из групп.
Таблица 3. Концентрация мочевины в крови животных в течениe трех суток после И-Р-поражения обеих почек
Концентрация мочевины, мг/дл
Группа животных
24 ч
48 ч
72 ч
Контроль
57 ± 9
54 ± 7
56 ± 8
И-Р
290 ± 40*
140 ± 10*
90 ± 10
И-Р + PSH
220 ± 30*
120 ± 10*
70 ± 10
Примечание. n = 50 для каждой из групп, *- p < 0.05 относительно интактного контроля.
Таблица 4. Концентрация креатинина в крови мыши в течениe трех суток после И-Р поражения обеих почек
Концентрация креатинина, мг/дл
Группа животных
24 ч
48 ч
72 ч
Контроль
0.28 ± 0.02
0.28 ± 0.02
0.28 ± 0.02
И-Р
1.8 ± 0.3*
1.1 ± 0.3*
0.7 ± 0.2*
И-Р + PSH
1.55 ± 0.2*
0.7 ± 0.2*
0.6 ± 0.1*
Примечание. n = 50 для каждой из групп, *- p < 0.05 относительно интактного контроля.
примерно на 25%, а креатинина - на 15-20% ни-
Уровень малонового диальдегида в ткани почки
же, чем в контрольной группой без лечения. Спу-
после ишемически-реперфузионного поражения и
стя 48 ч после И-Р во всех группах отмечается за-
предварительного введения PSH. Известно, что
при окислительном стрессе под действием АФК
метное снижение концентрации мочевины и кре-
происходит модификация/повреждение всех
атинина в крови животных на 40-50%. Через 72 ч
биологических макромолекул, в том числе пере-
количество мочевины в крови выживших живот-
кисное окисление липидов мембран клеток. Од-
ных во всех группах стабилизируется на значени-
ним из конечных продуктов перекисного окисле-
ях чуть выше физиологической нормы. Таким об-
ния липидов является малоновый диальдегид [4].
разом, предварительное введение рекомбинант-
Был проведен анализ содержания МДА в тканях
ного PSH за
15 мин до тридцатиминутной
почек животных спустя 24 ч после И-Р и предва-
ишемии способствует сохранению экскреторной
рительного введения PSH (табл. 5).
функцию почек на протяжении трех суток репер-
Показано, что И-Р-поражение приводит к де-
фузионного периода у выживших животных.
сятикратному увеличению концентрации МДА в
БИОФИЗИКА том 65
№ 2
2020
356
ГОНЧАРОВ и др.
Таблица 5. Содержание малонового диальдегида в тканях почек животных после И-Р и предварительного
введения фермента PSH перед И-Р
Группа животных
Концентрация МДА в ткани почки, нмоль/г
Контроль
197 ± 40
И-Р
2000 ± 300*
И-Р + PSH
600 ± 100*#
Примечание. n = 5 для каждой из групп, *- p < 0.05 относительно интактного контроля, # - И-Р.
Таблица 6. Изменение уровня экспрессии генов спустя 24 ч после И-Р-поражения относительно интактных
животных
Изменение уровня экспрессии относительно контроля
Ген
Контроль
И-Р
И-Р + PSH
AP-1
1.0
7.5 ± 0.8
3.5 ± 0.8*#
Casp-3
1.0
4.5 ± 0.7
3.0 ± 0.5*
NRF-2
1.0
7.5 ± 0.8
2.5 ± 0.5*#
NF-κB
1.0
5.5 ± 0.7
3.5 ± 0.7*
IL-6
1.0
2.5 ± 0.8
2.5 ± 0.5*
IL-18
1.0
7.0 ± 1.0
0.7 ± 0.3#
iNOS
1.0
14.0 ± 3.0
3.0 ± 0.5*#
eNOS
1.0
22.0 ± 4.0
3.0 ± 1.0*#
KIM-1
1.0
106 ± 30
75 ± 15*
Примечание. n = 5 для каждой из групп, *- p < 0.05 относительно интактного контроля, # - И-Р.
почечной ткани в первые сутки реперфузионного
ется общепризнанным чувствительным марке-
периода, в то время как предварительное введе-
ром почечного повреждения [28]. Действительно,
ние PSH снижает образование МДА в почечной
анализ изменения уровня экспрессии KIM-1 в
ткани в 3.0-3.5 раза. Таким образом, внутривен-
группах с И-Р показал его значительный рост бо-
ное введение PSH за 15 мин до тридцатиминут-
лее чем в 100 раз, что указывает на повреждения в
ной ишемии снижает уровень перекисного окис-
ткани почки спустя 24 ч после тридцатиминутной
ления липидов в почечной ткани, что, вероятно,
ишемии. В группе с предварительным введением
связано с подавлением процессов окислительно-
PSH уровень KIM-1 на 20-30% ниже, чем в кон-
го стресса в пораженных тканях почки.
трольной группе И-Р без предварительной инъ-
екции фермента. Это доказывает, что предвари-
Оценка экспрессии генов в тканях почек после
тельное введение PSH перед И-Р-поражением
ишемически-реперфузионного поражения и предва-
способно уменьшать повреждение почек.
рительного введения PSH. Для понимания моле-
кулярных механизмов защитного действия экзо-
Транскрипционный фактор NRF2 является
генного PSH был проведен анализ изменения
основным транскрипционным фактором, кото-
уровня экспрессии некоторых маркерных генов
рый регулирует уровень экспрессии генов анти-
(табл. 1). В табл. 6 представлены данные по изме-
оксидантного ответа, тем самым он играет ключе-
нению уровня экспрессии некоторых маркерных
вую роль в поддержании редокс гомеостаза тка-
генов в тканях почек спустя сутки после И-Р и
ней. Кроме того, NRF2 взаимодействует с
предварительном введении PSH. Необходимо от-
другими редокс-чувствительными транскрипци-
метить, что в табл. 6 представлены данные по ге-
онными факторами NF-κB и AP-1, тем самым
нам, уровень которых достоверно изменялся.
оказывая влияние на их транскрипционную ак-
Также важно отметить, что спустя 48-72 ч после
тивность и клеточные процессы, которые они ре-
И-Р значения экспрессии генов нормализуются,
гулируют [29]. Как отмечалось ранее, И-Р сопро-
приближаясь к значениям у интактных животных
вождается лавинообразным ростом уровня АФК
(данные не показаны).
в пораженных тканях, что индуцирует активацию
Молекула почечного повреждения-1 (KIM-1),
NRF2 [30]. При И-Р-поражении обеих почек мы-
гликопротеин клеточной мембраны I типа, явля- шей в контрольной группе наблюдается рост экс-
БИОФИЗИКА том 65
№ 2
2020
ЗАЩИТНЫЙ ЭФФЕКТ ХИМЕРНОГО ФЕРМЕНТА-АНТИОКСИДАНТА PSH
357
прессии NRF2 (в семь с половиной раз). Актива-
дит регуляция сосудистого тонуса
[35]. При
ция транскрипционного фактора NRF-2 при И-
предварительном введении рекомбинантного
Р-поражении почек свидетельствует об увеличе-
фермента PSH не наблюдается такого резкого ро-
нии уровня экспрессии генов, кодирующих фер-
ста iNOS и eNOS, хотя и отмечается их повыше-
менты антиоксиданты, за счет взаимодействия с
ние относительно контрольной группы примерно
цис-регуляторным элементом ARE (antioxidant
в три раза. Снижение активации iNOS и eNOS
responsive element). Предварительное введение
может быть связано с подавлением активности
PSH перед И-Р уменьшает уровень индукции
NF-κB под действием PSH [36].
NRF-2 примерно на 30% в сравнении с контроль-
Исследование уровня экспрессии транскрип-
ной группой, что доказывет нормализацию окис-
ционного фактора AP-1 (регулирующего апоптоз
лительно-восстановительного гомеостаза тканей
клеток) в почечной ткани показало, что в группе
по сравнению с контрольной группой И-Р без ле-
с И-Р наблюдается увеличение уровня экспрес-
чения.
сии более чем в семь раз. В тех же группах наряду
Одним из ключевых транскрипционных фак-
с повышенным уровнем AP-1, наблюдается уве-
торов, участвующих в поддержании нормального
личение уровня эффекторной каспазы-3 (Casp-3)
гомеостаза в клетке в стрессовых условиях явля-
примерно в 3.5-4.0 раза. Это увеличение может
ется транскрипционный фактор NF-κB [31]. Уро-
быть связано с тем, что в почечной ткани наблю-
вень экспрессии транскрипционного фактора
дается повышение гибели клеток по апоптотиче-
NF-κB при И-Р-поражении повышен более чем в
скому/некротическому пути. В группах с предва-
пять раз, что свидетельствует о запуске процессов
рительным введением PSH уровень экспрессии
регенерации клеток. На фоне повышенных зна-
AP-1 и Casp-3 увеличен примерно в 3.0-3.5 раза,
чений NF-κB можно отметить заметное увеличе-
что на 30-40% ниже, чем в группе с И-Р без пред-
ние уровня экспрессии генов IL-6 (в два с поло-
варительного PSH.
виной раза) и IL-18 (в семь раз), что, вероятно,
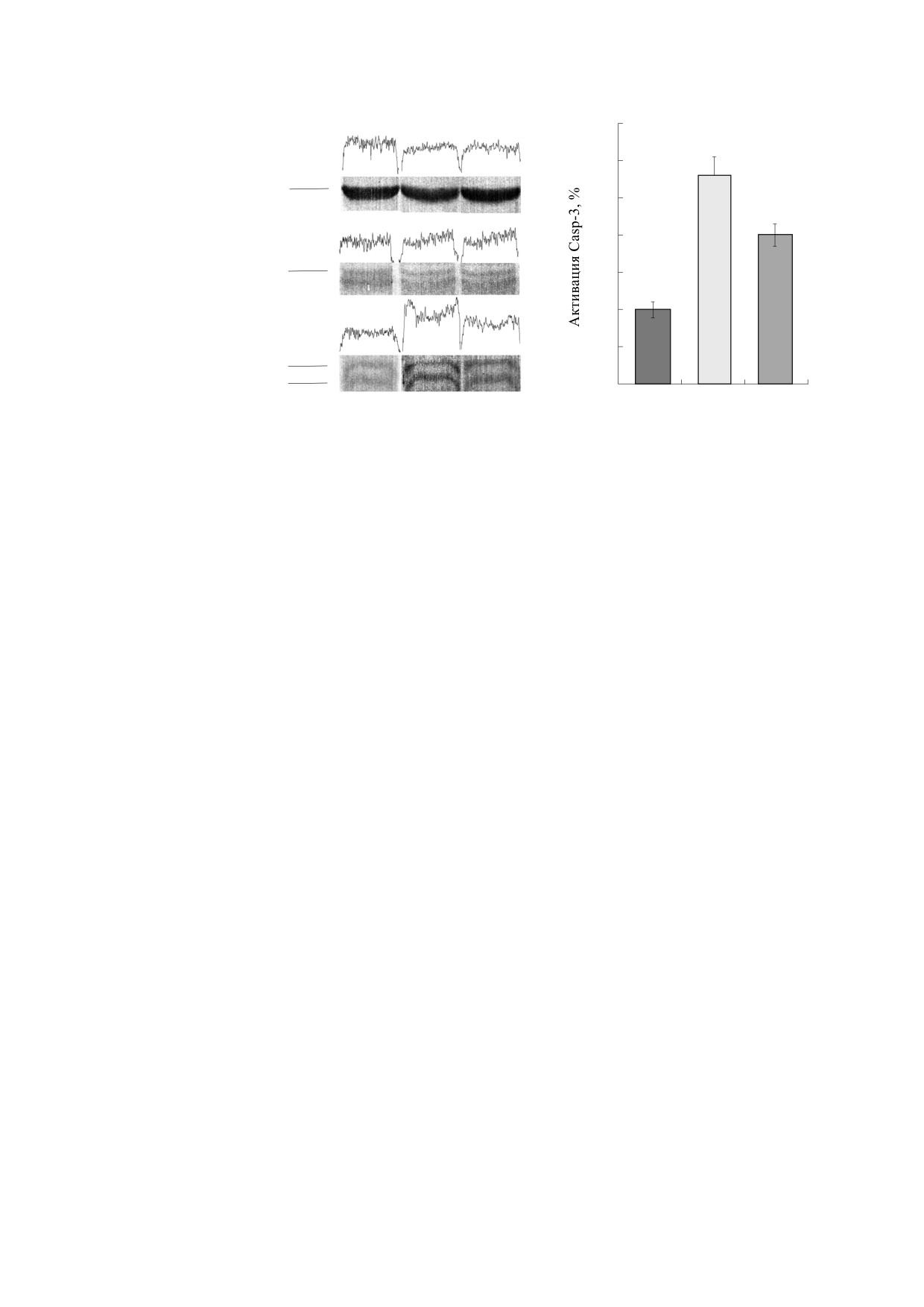
Для подтверждения того, что повышение
свидетельствует о стимуляции иммунного ответа.
уровня экспрессии каспазы-3, действительно,
Предварительное введение ферментов PSH
связано с ее индукцией в клетках почечной ткани
уменьшает уровень NF-κB более, чем на 30% в
и запуском апоптоза при И-Р поражении, был
сравнении с контрольной И-Р группой без лече-
проведен иммуноблоттинг тканей почек спустя
ния. Снижение уровня экспрессии NF-κB после
24 ч после И-Р и предварительного введения PSH
введения PSH, возможно, связано со снижением
перед И-Р (рис. 4.)
уровня АФК в клетках почки. Было показано, что
Показано, что в группе с И-Р без предвари-
некоторые антиоксиданты (L-цистеин, N-аце-
тельного введения PSH наблюдается повышен-
тилцистеин, тиолы, витамин Е и его производ-
ный уровень активации каспазы-3 (примерно в
ные) способны блокировать активацию NF-κB
2.5-3.0 раза по сравнению с интактной группой).
[32], возможно, что PSH благодаря супероксид-
Эти результаты указывают на увеличение апопто-
дисмутазной и пероксидазной активности оказы-
тической гибели клеток в почечной ткани. Пред-
вает аналогичное действие. Интересно отметить,
варительное введение PSH перед И-Р подавляет
что введение PSH перед И-Р вызывает подавле-
активацию каспазы-3 в клетках ткани примерно
ние экспрессии NF-κB и IL-18, но при этом спо-
на 30%, что приводит к снижению гибели клеток
собствует росту уровня IL-6 по сравнению с И-Р-
и сохранению структурной целостности почеч-
группой. Известно, что IL-6 может оказывать не
ной ткани.
только провоспалительный эффект, но также мо-
жет стимулировать регенеративные процессы в
клетке [33].
ЗАКЛЮЧЕНИЕ
Уровень экспрессии генов синтаз оксида азота
Полученные данные свидетельствуют о том,
(индуцибельной iNOS и эндотелиальной eNOS)
что предварительное введение рекомбинантного
при И-Р-поражении существенно увеличен:
химерного фермента антиоксиданта PSH за
iNOS в 14 раз, а eNOS - в 22 раза, что приводит к
адаптивному росту уровня NO в крови [34]. В ряде
15 мин до тридцатиминутной ишемии способно
работ отмечена важная роль оксида азота (NO) в
уменьшить степень И-Р-поражения почки. Это
уменьшении сосудистого тромбообразования во
приводит к снижению смертности животных и
время реперфузионного периода. Кроме того, NO
сохранению морфофизиологических параметров
препятствует миграции и слипанию моноцитов в
тканей почек. Нефропротекторный эффект PSH
сосудах, регулирует канальцево-клубочковую об-
обусловлен наличием пероксидазной и суперок-
ратную связь в почках, что приводит к изменению
сиддисмутазной активностей, которые позволя-
соотношения тонуса приносящих и выносящих
ют химерному ферменту антиоксиданту нейтра-
артериол клубочка, экскреции натрия и регуля-
лизовать окислительный стресс, развивающийся
ции уровня ангиотензина, который является важ-
при И-Р-поражении. Кроме того, терапевтиче-
ным элементом в ренин-ангиотензин-альдосте-
ский эффект может быть обусловлен участием
роновой системе, посредством которого происхо-
PSH в сигнально-регуляторных путях клетки [15,
БИОФИЗИКА том 65
№ 2
2020
358
ГОНЧАРОВ и др.
1
2
3
350
#И-Р
М, кДа
300
Actβ
48
250
#PSH
200
Неактивная Casp-3
34
150
100
50
19
Активная Casp-3
17
0
1
2
3
Рис. 4. Иммуноблоттинг почечной ткани для Actβ и Casp-3 после тридцатиминутной ишемии и предварительного вве-
дения фермента PSH за 15 мин перед тридцатиминутной ишемией с последующей 24-часовой реперфузией: 1 - интакт-
ные мыши; 2 - ишемия - 30 мин, реперфузия - 24 ч, без лечения; 3 - внутривенное введение PSH. Данные нормализо-
ваны по Actβ. Уровень активации Casp-3 определялся отношением pro-Casp-3 (35 кДа) к расщепленной Casp-3 (17-
19 кДа). n = 5 для каждой из групп, # - p < 0.05.
37]. Полученные данные коррелируют с данными
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
о протекторной роли PSH в условиях окислитель-
Работу с лабораторными животными проводи-
ного стресса на моделях ретроградной перфузии
ли в соответствии с международно-правовыми
изолированного сердца [38].
нормами, указанными в Европейской конвенции
ETS №123 «О защите позвоночных животных, ис-
Применение химерных антиоксидантных
пользуемых для экспериментов или в иных науч-
ферментов, в частности PSH, может быть пер-
ных целях» [40], и «Руководством по работе с ла-
спективным подходом в предупреждении и лече-
бораторными животными ИБК РАН» № 57 от
нии ишемически-реперфузионных поражений
30.12.2011 г.
[39]. Известно, что длительное применение бел-
ковых препаратов может привести к иммунологи-
ческим реакциям, поэтому на практике наиболее
СПИСОК ЛИТЕРАТУРЫ
вероятно кратковременное применение реком-
1. S. Cadenas, Free Radic. Biol. Med. 117 (11), 76 (2017).
бинантного фермента PSH при острой фазе И-Р-
2. S. Uchino, J. A. Kellum, R. Bellomo, et al., JAMA 294
поражений. Мы предполагаем, что наиболее пер-
(7), 813 (2005).
спективным подходом может быть использова-
3. D. N. Granger and P. R. Kvietys, Redox Biol. 6, 524
ние PSH в составе перфузионных сред для сохра-
(2015).
нения изолированной почки при транспланта-
4. E. Y. Plotnikov, A. V. Kazachenko, M. Y. Vyssokikh,
ции, что требует проведения дополнительных
et al., Kidney Int. 72 (12), 1493 (2007).
исследований.
5. Y. E. Yoon, K. S. Lee, K. H. Choo, et al, PLoS One 10
(4), 1 (2015).
6. И. В. Зарубина, А. В. Горяинов и П. Д. Шабанов,
ФИНАНСИРОВАНИЕ РАБОТЫ
Обзоры по клинической фармакологии и лекар-
ственной терапии 8 (2), 3 (2010).
Работа выполнена при финансовой поддержке
7. M. Scortegagna, K. Ding, Y. Oktay, et al., Nature Ge-
Российского фонда фундаментальных исследова-
netics 35 (4), 331 (2003).
ний (гранты №№ 17-04-00356-a, 19-04-00080-a) и
8. P. P. Kapitsinou and V. H. Haase, Am. J. Physiol. Re-
программы Президиума РАН «Молекулярная и кле-
nal Physiol. 309 (10), 821 (2015).
точная биология и постгеномные технологии».
9. Е. Б. Меньщикова, В. З. Ланкин, Н. К. Зенков и др,
Окислительный стресс. Прооксиданты и антиокси-
данты (Слово, М., 2006).
КОНФЛИКТ ИНТЕРЕСОВ
10. В. И. Новоселов, В. К. Равин, М. Г. Шарапов и др,
Биофизика 56 (5), 873 (2011).
Авторы заявляют об отсутствии конфликта
11. A. G. Volkova, M. G. Sharapov, V. K. Ravin, et al, Rus-
интересов.
sian Pulmonology 6 (2), 84 (2017).
БИОФИЗИКА том 65
№ 2
2020
ЗАЩИТНЫЙ ЭФФЕКТ ХИМЕРНОГО ФЕРМЕНТА-АНТИОКСИДАНТА PSH
359
12. A. E. Gordeeva, A. A. Temnov, A. A. Charnagalov,
27. T. M. Yu, K. Palanisamy, K. T. Sun, et al., Sci. Rep. 6
et al., Digestive Dis. Sci. 60 (12), 3610 (2015).
(7), 1 (2015).
13. R. G. Goncharov, K. A. Rogov, A. A. Temnov, et al,
28. J. V. Bonventre, Trans. Am. Clin. Climatol. Ass. 125,
Cell Tissue Res. 378 (2), 319 (2019).
293 (2014).
14. M. G. Sharapov, V. I. Novoselov, E. E. Fesenko, et al,
29. Е. Б. Меньщикова, В. О. Ткачёв и Н. К. Зенков,
Free Radic. Res. 51 (2), 148 (2017).
Молекуляр. биология 44 (3), 389 (2010).
15. M. G. Sharapov, V. I. Novoselov, and S. V. Gudkov,
30. M. A. Aminzadeh, S. B. Nicholas, and K. C. Norris,
Antioxidants 8 (1), 15 (2019).
Nephrol. Dialysis Transpl. 28 (8), 2038 (2013).
16. Y. Manevich, T. Shuvaeva, C. Dodia, et al, Arch. Bio-
31. B. Pires, R. Silva, G. Ferreira, et al., Genes 9 (1), 24
chem. Biophys. 485 (2), 139 (2009).
(2018).
17. I. V. Peshenko and H. Shichi, Free Radic. Biol. Med.
32. Y. Yamamoto, M. J. Yin, and R. B. Gaynor, J. Biol.
31 (3), 292 (2001).
Chem. 274 (38), 27307 ( 1999).
18. M. G. Sharapov, V. I. Novoselov, and V. K. Ravin, Bio-
33. J. Scheller, A. Chalaris, D. Schmidt-Arras, et al., Bio-
chemistry 81, 420 (2016).
chim. Biophys. Acta 1813 (5), 878 (2011).
19. M. G. Sharapov, V. I. Novoselov, and V. K. Ravin, Mol.
34. E. G. Shesely, N. Maeda, H. S. Kim, et al., Proc. Natl.
Biol. (Moscow) 43 (3), 465 (2009).
Acad. Sci. USA 93 (97), 13176 (1996).
20. Q. Wei and Z. Dong, Am. J. Physiol. Renal Physiol.
35. T. Ishimura, F. Fujisawa, S. Isotani, et al., Transplant.
303 (11), 1487 (2012).
Int. 15, 635 (2002).
21. S. Kuure, Kidney Development 886, 147 (2012).
36. T. Wang, X. Zhang, and J. J. Li, Immunopharmacol.
22. M. G. Sharapov, V. I. Novoselov, N. V. Penkov, et al.,
Int. 2 (11), 1509 (2002).
Free Radic. Biol. Med. 134, 76 (2019).
37. M. G. Sharapov, V. K. Ravin, and V. I. Novoselov, Mol.
23. T. D. Schmittgen and K. J. Livak, Nature Protocols 3
Biol. (Moscow) 48 (4), 600 (2014).
(6), 1101 (2008).
38. Е. В. Карадулева, Э. К. Мубаракшина, М. Г. Шара-
24. P. Williams, H. Lopez, D. Britt, et al, J. Pharmacol.
пов и др., Бюл. эксп. биол. мед. 160 (11), 584 (2015).
Toxicol. Methods 37 (1), 1 (1997).
39. A. V. Maksimenko and A. V. Vavaev, Heart Int. 7 (3), 14
25. S. Gowda, P. B. Desai, S. S. Kullkarni, et al., North
(2012).
Am. J. Med. Sci. 2 (4), 170 (210).
40. European convention for the protection of vertebrate
26. E. E. Hesketh, A. Czopek, and M. Clay, Visual. Exp. J.,
animals used for experimental and other scientific pur-
15 (88), 1 (2014).
poses, Cets 170, 123 (1986).
Protective Effect of Chimeric PSH Antioxidant Enzyme
in Renal Ischemia-Reperfusion Injury
R.G. Goncharov*, **, G.I. Filkov**, A.V. Trofimenko**, V.V. Boyarintsev**,
V.I. Novoselov*, **, and M.G. Sharapov*, **
*Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Moscow Institute of Physics and Technology, Institutskiy per. 9, Dolgoprudny, Moscow Region, 141700 Russia
The most dangerous stage of ischemia-reperfusion injury is a rapid increase in the concentration of free rad-
icals and reactive oxygen species at the reperfusion stage. An avalanche-like increase in the level of reactive
oxygen species and secondary products of free radical oxidation of biological macromolecules leads to the de-
velopment of oxidative stress. The use of exogenous antioxidants can reduce the concentration of reactive ox-
ygen species in the affected tissues, suppress or correct the course of oxidative stress, thereby significantly re-
ducing the severity of ischemia-reperfusion injury. A comprehensive list of pathologies associated with isch-
emia-reperfusion includes ischemic acute renal failure which is one of the most important social problems.
An animal model of bilateral ischemia-reperfusion renal injury was used to show the nephroprotective effect
of the chimeric antioxidant enzyme PSH which included human peroxiredoxin 6 and the Escherichia coli
Mn-containing superoxide dismutase. Because of the presence of superoxide dismutase and peroxidase ac-
tivities, the recombinant chimeric protein PSH is able to neutralize as wide a range of reactive oxygen species
as possible. Using histological, biochemical, and molecular biological methods, it has been shown that the
preliminary administration of the PSH chimeric protein before ischemia-reperfusion significantly reduces
the degree of renal tissue injury leading to a quick normalization of their structural and functional state. In
addition, the introduction of the PSH enzyme increases the survival of experimental animals by a factor of
more than 1.5. The use of the recombinant chimeric PSH enzyme can be an effective approach in the pre-
vention and treatment of renal ischemia-reperfusion injury, as well as for maintaining an isolated kidney
during transplantation.
Keywords: peroxiredoxin, superoxide dismutase, chimeric enzymes, oxidative stress, ischemia-reperfusion, kidney
БИОФИЗИКА том 65
№ 2
2020