БИОФИЗИКА, 2020, том 65, № 3, с. 439-444
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
СВЯЗЬ ХИРАЛЬНЫХ ИЕРАРХИЧЕСКИХ СТРУКТУР БЕЛКОВ
С ИХ ФУНКЦИЯМИ
© 2020 г. Е.В. Малышко, О.Е. Багрова, В.А. Твердислов
Физический факультет Московского государственного университета имени М.В. Ломоносова,
119991, Москва, Ленинские горы, 1/2
E-mail: katyamalyshko@mail.ru
Поступила в редакцию 28.12.2019 г.
После доработки 28.12.2019 г.
Принята к публикации 10.02.2020 г.
Впервые исследованы особенности распределения вторичных структур и суперспиралей coiled coil
с учетом знака хиральности в полипептидных цепях белков, входящих в восемь функциональных
классов: белки вирусов, шапероны, оксидоредуктазы, гидролазы, структурные белки, белки экзо- и
эндоцитоза и белки транспорта электронов. Выявлены общие для всех исследуемых классов
закономерности, а также характерные для каждого класса особенности строения.
Ключевые слова: хиральность, белки, вторичная структура, α-спираль, β-лист, суперспираль.
DOI: 10.31857/S0006302920030023
Выяснение физических принципов формиро-
ния вторичных структур с точностью в пределах
вания уникальных структур биомакромолекул и
от 50 до 60% [1]. Анализ наличия вторичных
механизмов их функционирования на протяже-
структур в белках встречается в значимой работе
нии десятилетий остается актуальной проблемой
Н.Г. Есиповой и соавт. [2]. Однако в предыдущих
молекулярной биофизики. Фундаментальные
исследованиях не было получено распределение
вопросы относительно механизмов внутримоле-
структур по цепи, а только их количественное со-
кулярного и надмолекулярного структурообразо-
держание в белке в целом. Кроме того, не учиты-
вания, работы макромолекул как молекулярных
вался знак хиральности вторичных структур бел-
машин остаются в значительной степени невыяс-
ков. В работах А.А. Замятнина было замечено, что
ненными.
многие молекулы олигопептидов равной длины
выполняют одинаковую функцию [3]. Возможно,
Настоящая работа посвящена выявлению
что для более высоких, нежели первичные, струк-
закономерностей в распределении вторичных
турных уровней организации белков «хиральные»
структур, образующих динамичный каркас бел-
закономерности их строения будут более явно от-
ковых молекул. Исследования по выявлению за-
ражать их функции.
кономерностей и соответствий между «хираль-
Ранее нами было выдвинуто и обосновано
ным» строением белка и его функциями могут
положение относительно закономерной регуляр-
позволить глубже понять тонкие механизмы кон-
ности хиральных соответствий во внутри- и над-
формационных подвижек в глобулах белков при
молекулярных структурах, а также в сетях био-
их функционировании, в частности, посредством
синтеза и метаболизма. Показано, что система
анализа структуры их полипептидной цепи. В ос-
хиральных соответствий молекулярных структур
нове данной работы лежит анализ знака хираль-
составляет своего рода периодическую таблицу
ности исследуемых структур. А само явление
молекулярной биологии. В макромолекулярных
хиральности, как мы считаем, играет одну из
системах впервые были выделены как хиральные
ключевых ролей в фолдинге белка, т.е. в сворачи-
инварианты знакопеременные иерархии хи-
вании полипептидной цепи.
ральных структур в последовательностях от
Попытки прогнозирования вторичных струк-
«нижнего» ассиметричного атома углерода в sp3-
тур белков по известной первичной структуре
гибридизации до суперспиралей и надмолекуляр-
проводились еще во второй половине прошлого
ных структур [4-7]. Последовательность смены
столетия. В частности, в 1970-х годах П. Чоу и Г.
знака хиральности в структурно-функциональ-
Фасман сумели разработать метод прогнозирова-
ной иерархии белковых структур стартует с лево-
439
440
МАЛЫШКО и др.
Нерегулярная
структура
31%
α-Спираль
53%
β-Лист
12%
3
-Спираль
10
4%
Рис. 1. Количественное содержание вторичных структур в исследованных белках.
го энантиомера: L-D-L-D. Белки, как из-
В настоящей работе были рассмотрены восемь
вестно, - линейные полимеры, сложенные из
функциональных классов белков в соответствии с
остатков L-аминокислот [8]. Образуя вторичную
классификацией PDB: белки вирусов (всего иссле-
структуру, полипептидная цепь может уклады-
довано 109 белковых цепей, из которых уникаль-
ваться в правую α-спираль или в складчатый
ных - 26), шапероны (40 цепей, уникальных - 15),
β-слой. Встречаются и другие регулярные струк-
изомеразы (39 цепей, уникальных - 17), оксидоре-
туры, но значительно реже. Элемент третичной
дуктазы (141 цепь, уникальных - 42), гидролазы
структуры белков - суперспираль coiled coil -
(90 цепей, уникальных - 41), структурные (29 це-
представлен взаимодействующими α-спиралями.
пей, уникальных - 22), белки экзо- и эндоцитоза
Практически во всех случаях, когда визуально
(9 цепей, уникальных - 6) и белки транспорта
наблюдается внутримолекулярное тесное пере-
электронов (8 цепей, уникальных - 5). Таким об-
крытие α-спиралей, выявлена однозначная
разом, суммарно проанализированы 174 уникаль-
тенденция их свивания в левую суперспираль.
ные белковые структуры, рассмотрено 465 цепей,
Четвертичная структура белков представлена
состоящих из более 145 тысяч аминокислотных
надмолекулярными структурами, сформирован-
остатков.
ными преимущественно при правой укладке ле-
В результате анализа было выявлено, что 31%
вых суперспиралей.
аминокислотных остатков не образует регуляр-
Тот факт, что цепи белка построены из L-ами-
ные вторичные структуры, 57% остатков входят в
нокислот, не означает полное отсутствие D-ами-
спирали, 53% из которых приходится на α-спира-
нокислот в биологических системах. L-амино-
ли и 4% - на спирали 310, 12% остатков образуют
кислоты отбираются транспортной РНК для син-
β-листы. Полученное распределение приведено
теза первичной цепи белка в рибосомах. В то же
на рис. 1.
время D-аминокислоты, как известно, отвечают
Данный результат можно сравнить со значе-
за регуляторные - гормональные, морфогенети-
ниями из исследований П. Чоу и Г. Фасмана [1].
ческие и другие - процессы [9].
Согласно результатам их работы, на α-спирали
должно приходиться 38% аминокислотных остат-
ков, 20% - на β-структуры и 42% - на так называ-
РАСПРЕДЕЛЕНИЕ ВТОРИЧНЫХ СТРУКТУР
емые спонтанные кольца. В работе [11] указано,
ПО ПОЛИПЕПТИДНОЙ ЦЕПИ БЕЛКОВ
что от 32 до 38% всех аминокислотных остатков
глобулярных белков входят в состав α-спиралей.
На данном этапе исследования мы проводили
Заметные расхождения можно объяснить выбо-
анализ распределения вторичных структур в по-
ром белков. В нашей работе результаты основаны
липептидных цепях. Подборку белков проводили
на анализе выбранных восьми функциональных
с использованием электронной базы данных Pro-
классов белков, а количественное содержание тех
tein Data Bank (PDB) [10]. Структура молекул в
или иных вторичных структур связано с функци-
электронном ресурсе представлена в виде тексто-
ей белка.
вого файла определенного формата (.pdb). Для
обработки этих файлов был разработан специаль-
Также следует отметить, что все исследован-
ный алгоритм и реализован в виде программы на
ные спирали были правозакрученными, что в
языке С++.
очередной раз подтверждает концепцию о зако-
БИОФИЗИКА том 65
№ 3
2020
СВЯЗЬ ХИРАЛЬНЫХ ИЕРАРХИЧЕСКИХ СТРУКТУР БЕЛКОВ С ИХ ФУНКЦИЯМИ
441
Белки вирусов
Шапероны
N
N
(26 уникальных цепей)
(15 уникальных цепей)
1.0
1.0
0.8
0.8
0.6
0.6
0.4
0.4
0.2
0.2
0.0
0.0
0
20
40
60
80
100
0
20
40
60
80
100
x
x
Изомеразы
Оксидоредуктазы
N
N
(17 уникальных цепей)
(42 уникальные цепи)
1.0
1.0
0.8
0.8
0.6
0.6
0.4
0.4
0.2
0.2
0.0
0.0
0
20
40
60
80
100
0
20
40
60
80
100
x
x
Гидролазы
Структурные белки
N
N
(41 уникальная цепь)
(22 уникальные цепи)
1.0
1.0
0.8
0.8
0.6
0.6
0.4
0.4
0.2
0.2
0.0
0.0
0
20
40
60
80
100
0
20
40
60
80
100
x
xx
Белки экзо- и эндоцитоза
Белки транспорта электронов
N
N
(6 уникальных цепей)
(5 уникальных цепей)
1.0
1.0
0.8
0.8
0.6
0.6
0.4
0.4
0.2
0.2
0.0
0.0
0
20
40
60
80
100
0
20
40
60
80
100
x
x
0
α
β
310
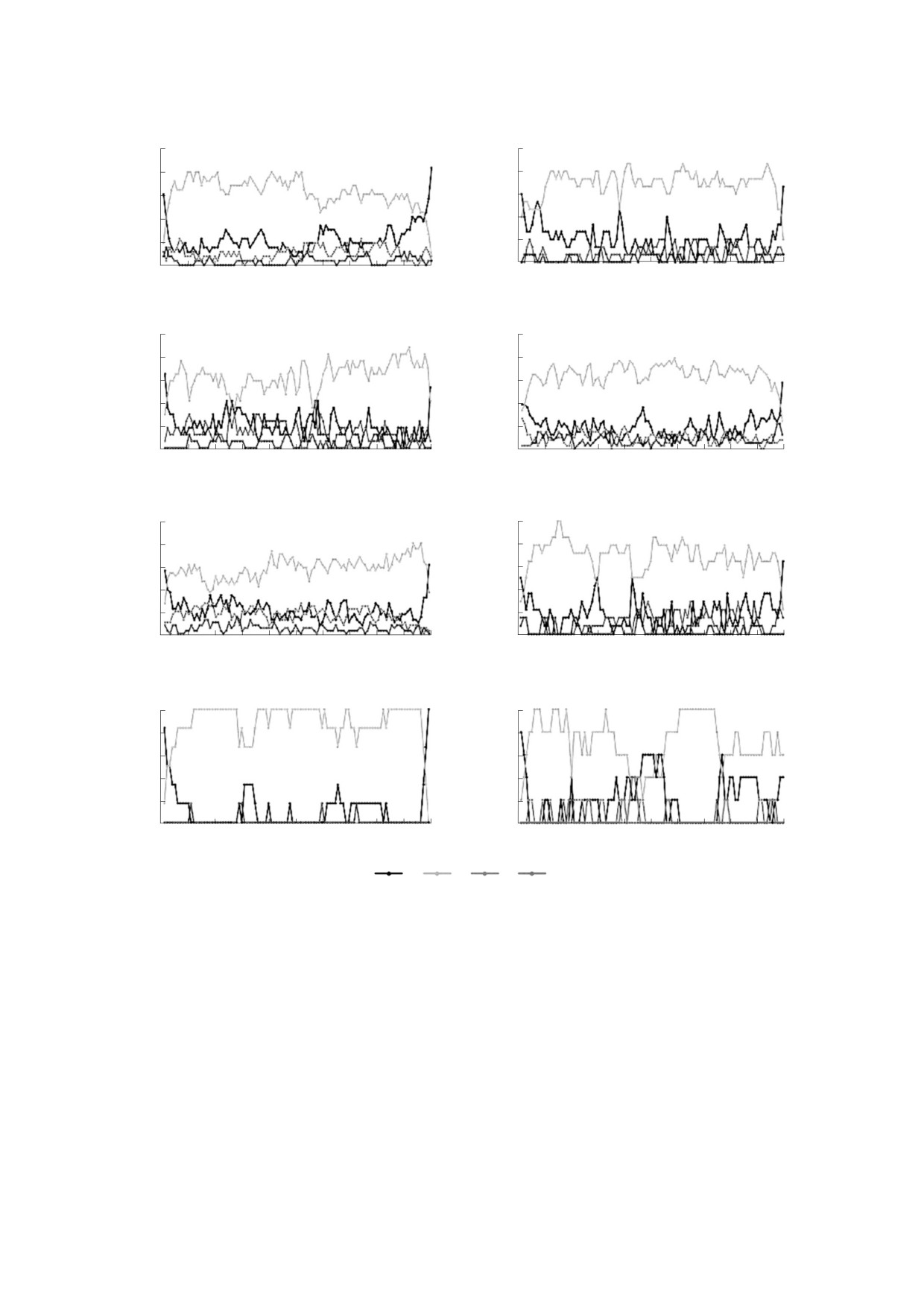
Рис. 2. Распределения вторичных структур по полипептидной цепи. По оси абсцисс отложены нормированные
координаты, по оси ординат - количество структур, нормированное на общее число цепей.
номерной смене знака хиральности. Однако в ра-
Результаты анализа представлены в виде гра-
боте [2] было показано, что в исследованных
фиков распределения вторичных структур по це-
группой образцах в состав правозакрученных
пям (рис. 2).
спиралей входят лишь 55.7% аминокислотных
Общая длина каждой цепи нормирована и
остатков. В первую очередь, это можно объяснить
представляет собой горизонтальную ось длиной в
наличием в рассмотренных исследователями бел-
100 ячеек-координат (x). Вертикальная ось отра-
ках левых спиралей типа полипролин II, харак-
жает общее количество вторичных структур, нор-
терных для исследованных функциональных
мированных на общее число рассматриваемых
классов.
цепей, приходящееся на данную координату (N).
БИОФИЗИКА том 65
№ 3
2020
442
МАЛЫШКО и др.
На основе представленных диаграмм выявле-
специфике результата могут быть подобны
но общее свойство, замеченное у белков исследо-
предыдущим.
ванных групп: преобладание нерегулярных
В структурных белках выявлено низкое содер-
участков в начале и в конце цепей, что согласует-
жание β-листов, спиралей 310 и нерегулярных
ся с упрощенным представлением о белковой
структур. Здесь содержание α-спиралей имеет не-
глобуле как о гидрофобном ядре в гидрофильной
сколько минимумов, естественно, совпадающих
оболочке.
с максимумами содержания нерегулярных струк-
Обнаружены закономерности для структур
тур. Большое количество спиралей обеспечивает
каждого из рассмотренных классов. У вирусных
жесткую структуру всей молекулы, что, безуслов-
белков обнаружено высокое содержание α-спира-
но, важно для структурных белков, отвечающих
лей на протяжении всей первичной цепи белка.
за механическую прочность клетки. Несколько
Исследованные белки являются молекулами,
максимумов по нерегулярным структурам могут
имеющими палочкообразную форму. Обилие
обеспечивать механическую подвижность моле-
распределенных по первичной цепи α-спиралей
кулы в определенных местах
- каркасные
может объяснять палочковидную структуру мно-
функции.
гих молекул, что обуславливает их прочность для
В белках экзо- и эндоцитоза отмечено полное
формирования жесткого капсида.
отсутствие β-листов. Спирали 310 располагаются
В начале цепей шаперонов отмечено высокое
у концов α-спиралей, а α-спирали образуют це-
лые плато. Такое распределение структур может
содержание нерегулярных структур, которое поз-
же постепенно уменьшается, но в то же время
обеспечивать локальную жесткость молекул как
есть несколько заметных максимумов на протя-
элементов механических конструкций, необхо-
жении всей цепи. Интересно, что в исследован-
димую для формирования везикул.
ных цепях присутствует не слишком большое ко-
У белков транспорта электронов β-листы при-
личество β-листов, что абсолютно не характерно
сутствуют только в цепи одного белка (sulerythrin,
для данного класса. Это связано с тем, что в базе
a rubrerythrin-like protein, PDB ID: 1J30). Максиму-
данных хранится информация о субъединице, ко-
мам содержания α-спиралей соответствует нуле-
торая не образует характерную для данного клас-
вое содержание других структур. Как и в белках
са структуру «бочонка».
экзо- и эндоцитоза, здесь можно заметить плато
α-спиралей, но нерегулярных структур становит-
В исследованных изомеразах выявлено высо-
ся больше, что, возможно, делает молекулу не та-
кое содержание и α-спиралей, и β-листов. При
кой жесткой.
этом во второй половине цепи α-спиралей стано-
Необходимо заметить, что во всех исследован-
вится еще больше по сравнению с первой. Воз-
ных классах максимумы вероятности появления
можно, скопление α-спиралей в последней чет-
спиралей 310 на данном участке полипептидной
верти соответствует формированию активного
центра: жесткие спирали могут образовать струк-
цепи совпадают с минимумами вероятностей по-
туру, которая будет избирательно специфична к
явления α-спиралей. Это наблюдение согласует-
субстрату, определяя четкую комплементарность.
ся с литературными данными [11], согласно кото-
рым спирали 310 часто располагаются на концах
В оксидоредуктазах вероятно появление как
α-спиралей.
регулярных вторичных структур, таких как α-спи-
рали, β-листы, спирали 310, так и нерегулярных
структур вдоль всей цепи. Четких тенденций в
РАСПРЕДЕЛЕНИЕ СУПЕРСПИРАЛЕЙ
распределении не обнаружено, за исключением
COILED COIL ПО ПОЛИПЕПТИДНОЙ
наличия заметного максимума скопления нерегу-
ЦЕПИ БЕЛКОВ
лярных структур в середине цепи. Возможно, от-
Подборку белков для анализа распределения
сутствие четких закономерностей связано со спе-
суперспиралей coiled coil по полипептидной цепи
цифичностью взаимодействия фермента и суб-
проводили с использованием электронной базы
страта, когда включается кофермент. Возможно,
данных Protein Data Bank и CC+database [12]. Ре-
что для специфики данного типа ферментов, свя-
зультаты представлены на рис. 3.
занных с переносом электрона или протона, важ-
В вирусных белках отмечено высокое содержа-
на не столько локальная жесткая структура,
ние суперспиралей coiled coil вдоль всей цепи. В
сколько химический набор аминокислотных
образовании суперспиралей участвуют α-спира-
остатков молекулы в определенных местах цепи.
ли, расположенные на разных полипептидных
В гидролазах, так же как и в оксидоредуктазах,
цепях. Большое количество α-спиралей и супер-
не выявлены закономерности в распределении
спиралей coiled coil может отражать особенности
вторичных структур по цепи. Однако содержание
взаимодействия с инфицированной клеткой. В
α-спиралей постепенно увеличивается от одного
шаперонах суперспирали coiled coil распределены
конца молекулы к другому. Соображения о
доменами на протяжении всей цепи, что может
БИОФИЗИКА том 65
№ 3
2020
СВЯЗЬ ХИРАЛЬНЫХ ИЕРАРХИЧЕСКИХ СТРУКТУР БЕЛКОВ С ИХ ФУНКЦИЯМИ
443
Белки вирусов
Шапероны
N
N
(максимальное значение N = 0.54)
(максимальное значение N = 0.44)
1.0
1.0
0.8
0.8
0.6
0.6
0.4
0.4
0.2
0.2
0.0
0.0
0
20
40
60
80
100
0
20
40
60
80
100
x
x
Изомеразы
Оксидоредуктазы
N
N
(максимальное значение N = 0.41)
(максимальное значение N = 0.26)
1.0
1.0
0.8
0.8
0.6
0.6
0.4
0.4
0.2
0.2
0.0
0.0
0
20
40
60
80
100
0
20
40
60
80
100
x
x
Гидролазы
Структурные белки
N
N
(максимальное значение N = 0.32)
(максимальное значение N = 0.55)
1.0
1.0
0.8
0.8
0.6
0.6
0.4
0.4
0.2
0.2
0.0
0.0
0
20
40
60
80
100
0
20
40
60
80
100
x
x
Белки экзо- и эндоцитоза
Белки транспорта электронов
N
N
(максимальное значение N = 0.75)
(максимальное значение N = 0.60)
1.0
1.0
0.8
0.8
0.6
0.6
0.4
0.4
0.2
0.2
0.0
0.0
0
20
40
60
80
100
0
20
40
60
80
100
x
x
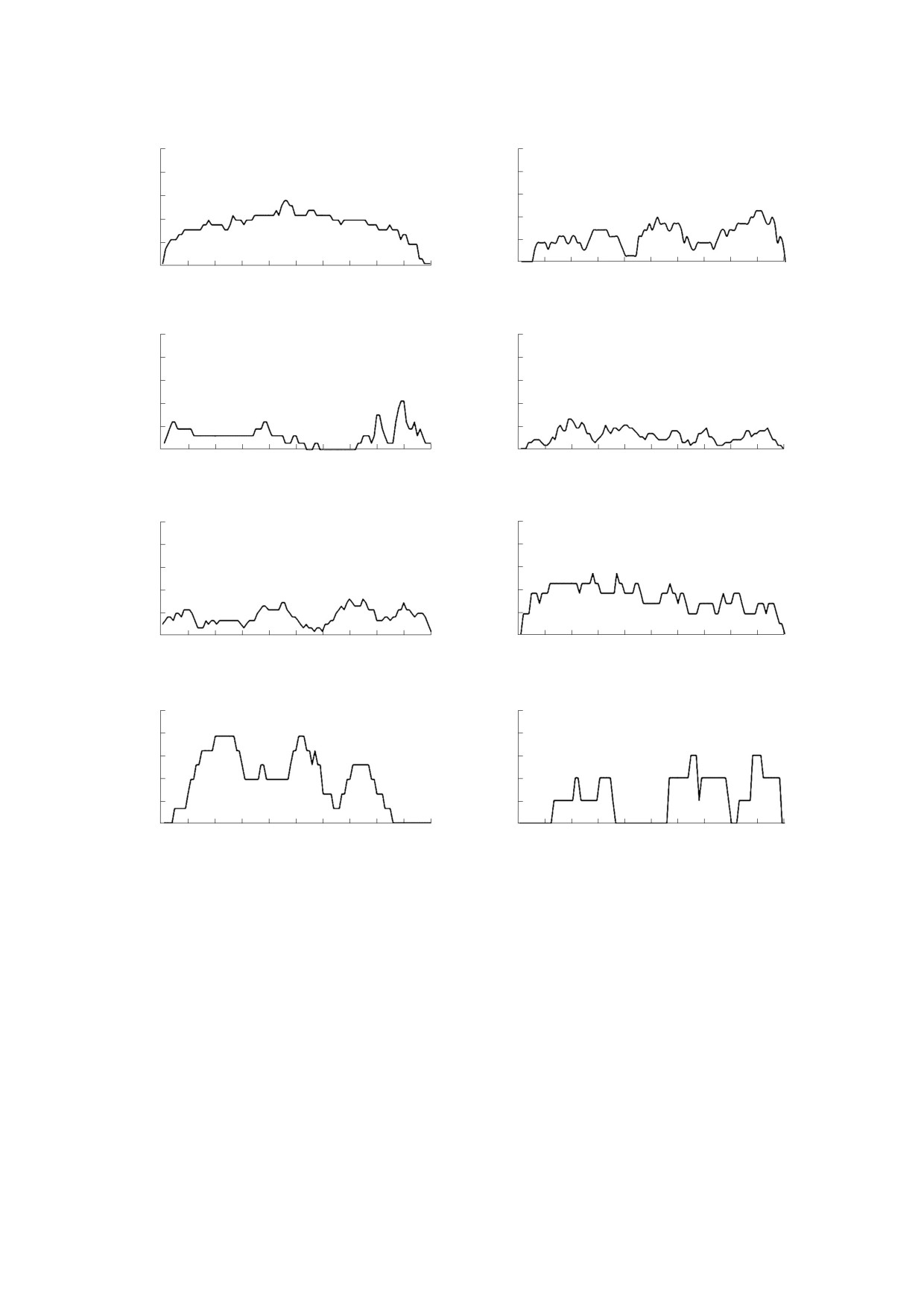
Рис. 3. Распределения суперспиралей coiled coil по полипептидной цепи. По оси абсцисс отложены нормированные
координаты, по оси ординат - количество структур, нормированное на общее число рассматриваемых цепей.
обеспечивать фрагментарную локальную жест-
лое количество суперспиралей coiled coil может
кость молекул, по существу, имеющих функции и
свидетельствовать о том, что оксидоредуктазам
особенности «конструкций-трансформеров». Су-
важнее обладать определенным химическим со-
перспирали в изомеразах в первой половине рас-
ставом для ферментативной активности, чем
пределены равномерно, затем наблюдается про-
иметь особую, характерную для всего класса, гео-
должительный минимум, точнее, полное отсут-
метрию. В гидролазах суперспирали coiled coil
ствие в каждой из рассматриваемых цепей. В
распределены доменами на протяжении всей це-
месте заметного скопления α-спиралей выявле-
пи, что пока нам сложно охарактеризовать ка-
ны максимумы вероятности появления су-
ким-то специфическим качеством. Для струк-
перспиралей coiled coil, что может указывать на
турных белков характерно равномерное распреде-
их привязку к активному центру у одного из кон-
ление суперспиралей coiled coil по всей цепи,
цов. У оксидоредуктаз, как мы уже говорили, ма-
однако вероятность появления такой структуры
БИОФИЗИКА том 65
№ 3
2020
444
МАЛЫШКО и др.
постепенно снижается ближе к одному из кон-
ФИНАНСИРОВАНИЕ РАБОТЫ
цов. Coiled coil у белков экзо- и эндоцитоза распо-
Исследование выполнено при частичной фи-
ложены тремя крупными доменами и вовсе отсут-
нансовой поддержке Российского научного фон-
ствуют у обоих концов молекул. В белках транс-
да (проект № 19-74-00082).
порта электронов суперспиралей мало по обоим
концам, но в середине располагается заметный
максимум.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта
Таким образом, в настоящей работе выявлены
интересов.
некоторые закономерности и особенности в рас-
пределении вторичных структур и суперспиралей
coiled coil по полипептидным цепям белков вы-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
бранных функциональных классов: белки виру-
Настоящая работа не содержит описания ка-
сов, шапероны, оксидоредуктазы, гидролазы,
ких-либо исследований с использованием людей
структурные белки, белки экзо- и эндоцитоза и
и животных в качестве объектов.
белки транспорта электронов. Полученные дан-
ные относительно распределения в белковых гло-
булах упомянутых выше жестких молекулярных
СПИСОК ЛИТЕРАТУРЫ
конструкций, по всей вероятности, могут непо-
1. P. Y. Chou and G. D. Fasman, Adv. Enzymol. Relat.
средственно коснуться развития концепции «бе-
Areas Mol. Biol. 47, 45 (1978).
лок-машина», причем не только в представлени-
2. A. A. Adzhubei, F. Eisenmenger, V. G. Tumanyan, et al.,
ях о «рычагах», «шарнирах» и «балках», но и в но-
J. Biomol. Structure & Dynamics 5 (3), 689 (1987).
вых соображениях о машинах как о хиральных
3. А. А. Замятнин, Актуальные вопросы биологической
образованиях и о вентильных спиральных кон-
физики и химии 3 (1), 225 (2018).
струкциях в них [7]. В целом речь идет о тех самых
4. V. A. Tverdislov, arXiv:1211, 4272 (2012).
«выделенных механических степенях свободы» в
5. В.А. Твердислов, Биофизика 58 (1), 159 (2013).
молекулярных машинах, которые были постули-
6. В. А. Твердислов, Е. В. Малышко, С. А. Ильченко
рованы в работах Л.А. Блюменфельда, Д.С. Чер-
и др., Биофизика 62 (3), 421 (2017).
навского и их коллег и которые изменяют физи-
7. В. А. Твердислов и Е. В. Малышко, Успехи физ.
ческий смысл термодинамических систем, пре-
наук 189, 375 (2019).
образующих энергию и вещество: с ними
8. А. В. Финкельштейн и О. Б. Птицын, Физика бел-
происходит переход от молекулярных статисти-
ка: курс лекций с цветными и стереоскопическими
ческих систем к макроскопическим конструкци-
иллюстрациями и задачами. 3е изд., испр. и доп.
ям [13, 14]. Заметим, что наши обсуждения, каса-
(КДУ, М., 2012).
ющиеся специфики отдельных классов белков,
9. В. А. Твердислов, А. Э. Сидорова и Л. В. Яковенко,
Биофизика 57 (1), 146 (2012).
имеют сугубо предварительный характер и будут,
несомненно, уточняться.
11. А. С. Иванов, Биомед. химия 57 (1), 31 (2011).
В заключение мы хотели бы также отметить,
что выявление закономерностей и соответствий
13. Ю. И. Хургин, Д. С. Чернавский и С. Э. Шноль,
между строением белка и его функциями в буду-
Молекуляр. биология 1, 419 (1967).
щем может способствовать созданию новых био-
14. Л. А. Блюменфельд, Решаемые и нерешаемые про-
нических материалов, а также разработке более
блемы биологической физики (Едиториал УРСС,
эффективных лекарственных препаратов.
М., 2002).
The Relationship between Protein Chiral Hierarchical Structures and Functions
E.V. Malyshko, O.E. Bagrova, and V.A. Tverdislov
Faculty of Physics, Lomonosov Moscow State University, Leninskie Gory 1/2, Moscow, 119991 Russia
For the first time, the particular characteristics of distributions of secondary structures and coiled-coil super-
helix structures were explored while taking into account the sign of chirality in polypeptide chains of proteins
belonging to eight functional classes: viral proteins, chaperones, oxidoreductases, hydrolases, structural pro-
teins, proteins involved in exocytosis and endocytosis and electron transport proteins. The protein structure
patterns, which are common for all studied classes and typical of each class, are identifined.
Keywords: chirality, proteins, secondary structure, α-helix, β-sheet, superhelix
БИОФИЗИКА том 65
№ 3
2020