БИОФИЗИКА, 2020, том 65, № 3, с. 464-478
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.322
МНОГОФУНКЦИОНАЛЬНЫЕ БЕЛКИ
© 2020 г. А.Б. Узденский
Академия биологии и биотехнологии им. Д. И. Ивановского Южного федерального университета,
344090, Ростов-на-Дону, просп. Стачки, 194/1
E-mail: auzd@yandex.ru
Поступила в редакцию 30.11.2019 г.
После доработки 30.11.2019 г.
Принята к публикации 03.02.2020 г.
Удивительно небольшое количество генов человека (19-20 тысяч) не согласуется с намного боль-
шим числом белков и количеством их функций. Один из факторов функционального разнообразия
- многофункциональность белков. Важным подвидом таких белков являются moonlighting белки, у
которых одна полипептидная цепь в разных условиях выполняет две и более функций. Часто это
изобильные белки домашнего хозяйства - гликолитические, рибосомные и т.д. В обзоре рассмот-
рены структуры и функции нескольких таких белков - рибосомного белка rpS3, цитохрома с, гли-
церальдегид-6-фосфатдегидрогеназы, факторов транскрипции STAT3, β-катенина и p53. Важную
роль в переключении их функций играют нарушение баланса процессов синтеза, использования и
деградации, изменение внутриклеточной локализации, посттрансляционные модификации. Отме-
чена существенная роль внутренне неупорядоченных участков в формировании межмолекулярных
комплексов с другими белками и нуклеиновыми кислотами. Обсуждается вопрос о возникновении
многофункциональных белков в ходе эволюции.
Ключевые слова: многофункциональные белки, цитохром с, GAPDH, β-катенин, STAT3, p53.
DOI: 10.31857/S0006302920030059
биологии. Сначала предполагали, что у человека
Молекулярная биология двадцатого столетия
порядка миллиона генов. Потом эту оценку сни-
базировалась на ряде классических постулатов,
таких как «В ДНК содержится информация о
зили до 40-100 тысяч. Но секвенирование гено-
мов человека и других организмов в начале
структуре всех белков и РНК организма». К ним
также относилось утверждение Бидла и Тэйтума
XXI века привело к ошеломляющему открытию: у
(1941): «Один ген - один фермент» [1], которое
человека всего около 20 тысяч генов, кодирую-
позднее трансформировалось в постулат «Один
щих белки [3]. Это величина того же порядка, что
ген - один белок», а после уточнения - «Один ци-
у примитивной нематоды Caenorhabditis elegans.
строн - одна полипептидная цепь». Другой важ-
Откуда же берется сложность организма? В чем,
нейший постулат сформулирован Анфинсеном
если не в генах, причина отличия человека от чер-
[2]: «Первичная структура белка, т.е. последова-
вя? Вероятно, дело не столько в генах, сколько в
тельность аминокислот, которая однозначно опре-
белках. Действительно, количество белков значи-
деляется последовательностью нуклеотидов в
тельно больше числа генов. Тут нет никакого од-
ДНК, однозначно определяет его пространствен-
нозначного соответствия. Точное количество
ную структуру и функциональную активность».
белков неизвестно. В базе данных Uni-
ProtKB/Swiss-Prot на 2014 г. зафиксировано око-
Но факты, полученные в последнее время, по-
ло 500 тысяч белковых аминокислотных последо-
казали, что эти положения не вполне соответ-
вательностей [4]. В банке данных Protein Data
ствуют современному состоянию молекулярной
Bank представлены более 150 тысяч трехмерных
Сокращения: MLP - moonlighting proteins, Apaf-1 - Apop-
структур белков [5]. Количество структурных
totic protease-activating factor 1, GAPDH - глицеральдегид-
протеоформ, т.е. локальных вариаций исходной
6-фосфатдегидрогеназа, STAT3 - signal transducer and acti- аминокислотной последовательности, которые
vator of transcription 3, DBD - DNA-binding domain (домен,
определяются в тканях с помощью масс-спектро-
связывающийся со специфическими участками ДНК),
метрии, жидкостной хроматографии, двухмерно-
TAD - transactivation domain (трансактивационный домен),
p53RE - p53-response element, TET - tetramerization domain
го или капиллярного электрофореза и других ме-
(домен, ответственный за тетрамеризацию), IDR - intri-
scally disordered regions (внутренне неупорядоченные
тодов, составляет несколько миллионов [6, 7]. А
участки).
число идентифицированных полиморфизмов в
464
МНОГОФУНКЦИОНАЛЬНЫЕ БЕЛКИ
465
человеческом геноме превышает 150 миллионов
форм показывает, что в результате экспрессии
большинства генов реализуется одна основная
[7]. Несомненно, что информация о всех клеточных
белковая изоформа, которая оптимально соот-
белках содержится в геноме. Но почему количество
ветствует биологическому предназначению, бо-
белков в разы превышает количество генов?
лее консервативна и не имеет нарушений в функ-
Основными источниками разнообразия про-
циональных доменах. Альтернативный сплай-
теоформ являются: альтернативный сплайсинг
синг ткане- и видоспецифичен: в других тканях
мРНК, аминокислотные замены в белках в ре-
или в других организмах могут преобладать аль-
зультате однонуклеотидного полиморфизма
тернативные сплайсоформы, но обычно их коли-
(SNP - single nucleotide polymorphism) и кова-
чество ограничено. Хотя многие пре-мРНК могут
лентные посттрансляционные модификации. В
подвергаться альтернативному сплайсингу, боль-
случае посттрансляционных модификаций к бел-
шинство возможных сплайсоформ в клетках не
кам присоединяются небольшие молекулярные
образуется и не транслируется [9]. Например, ген
группы - метильные, ацетильные, фосфатные и
белка-предшественника амилоида (APP - amy-
т. п. или большие полимерные цепи - липидные,
loid precursor protein) содержит 18 экзонов. Одна-
углеводные (гликозилирование), белковые
ко из множества возможных комбинаций в клет-
(убиквитинирование), нуклеотидные (поли-
ках встречаются только три похожие альтерна-
АДФ-рибозилирование). От белков также могут
тивные изоформы: APP695, APP751 и APP770, из
отщепляться небольшие ингибирующие пепти-
которых в мозге преобладает APP695 [10]. По всей
ды. Все же, несмотря на огромное разнообразие
видимости, альтернативный сплайсинг играет
протеоформ, количество канонических белков,
ограниченную роль в сложности клеточного про-
которые встречаются чаще альтернативных
теома, в его белковом разнообразии.
форм, и которые наиболее похожи на ортологи-
ческие формы белков у других организмов [7],
значительно превосходит число генов. В каждой
МНОГОФУНКЦИОНАЛЬНЫЕ БЕЛКИ
клетке есть свой набор белков, состав и количе-
ство которых (белковый профиль) динамичны и
Многофункциональность белков обеспечива-
определяются сложнейшей сетью сигнальных
ется их структурой, доменной организацией. Пе-
каскадов, реагирующих на внешние воздействия,
реключение функций может происходить при
связывании аллостерических регуляторов, пост-
меняющих метаболизм и гомеостаз.
трансляционных модификациях, изменении
Белковое разнообразие можно условно разде-
внутриклеточной локализации и микроокруже-
лить на разнообразие структур и разнообразие
ния, при внешних воздействиях и т.д. Это в разы
функций. Различные белковые структуры, на-
увеличивает функциональную предопределен-
пример, разные сплайсоформы, могут, хотя и с
ность, задаваемую генами. В базе данных Multi-
разной эффективностью, выполнять одну и ту же
taskProtDBII на декабрь 2018 г. собраны данные о
функцию. С другой стороны, один белок может в
почти 700 многофункциональных белках (табл. 1)
разных условиях выполнять разные функции.
[11, 12].
Тем не менее большое число структурных протео-
форм не означает такое же большое число выпол-
Схематично белки можно разделить на две ка-
няемых ими функций. Многие протеоформы не
тегории:
активны и ликвидируются в клетке. Замены ами-
1.
«Ферменты», в активном центре которых
нокислот могут носить безразличный характер и
осуществляются биохимические или биофизиче-
не влиять на активность белка, хотя во многих
ские процессы, т.е. разрыв или образование хи-
случаях они приводят к нарушениям функций и
мических связей в результате перестройки элек-
гибели клетки [7].
тронных оболочек атомов; переноса заряженных
Важнейший механизм белкового разнообра-
частиц (электронов, протонов, ионов) или фраг-
зия и происхождения новых белков - альтерна-
ментов молекул и т.д.
тивный сплайсинг, при котором из пре-мРНК
2.
«Платформы», у которых поверхностные
вырезаются значительные фрагменты - интро-
участки распознают комплементарные поверхно-
ны, а оставшиеся фрагменты - экзоны - сшива-
сти других молекул при сборке надмолекулярных
ются и после дополнительного процессинга фор-
комплексов. Процессы сборки включают поиск и
мируют зрелую мРНК. В среднем, в каждом гене
сближение взаимодействующих молекул за счет
содержится четыре-пять экзонов, иногда их боль-
дальнодействующих сил (электростатических,
ше десятка, и разные их комбинации могут в
ван-дер-ваальсовых); причаливание (докинг),
принципе дать начало новым белкам [8]. Количе-
связывание комплементарных поверхностей с
ство сплайсоформ, т.е. РНК-транскриптов, в
участием электростатических, ван-дер-ваальсо-
клетках человека оценивалось в 80-200 тысяч,
вых, водородных и гидрофобных взаимодей-
т.е. от четырех до десяти на каждый ген [9]. Одна-
ствий; конформационную подстройку и акти-
ко изучение реально существующих сплайсо-
вацию комплекса. На распознавании и взаимо-
БИОФИЗИКА том 65
№ 3
2020
466
УЗДЕНСКИЙ
Таблица 1. Базы данных о moonlighting-белках
Число MLP белков (на
URL
Базы данных MLP
декабрь 2018)
MultitaskProtDB-II (мультифункциональные
694
белки, включая MLP)
MoonProt
361
MoonDB v2.0
351
действии
«платформ» основана самосборка
ются тем набором белков, который они модифи-
белковых комплексов и комплексов белков с нук-
цируют.
леиновыми кислотами (рибосомы, нуклеосомы,
Мы рассмотрим белки, функции которых не
транскрипционные и репарационные комплексы
опосредуются другими белками. Они непосред-
и т.п.). В зависимости от прочности взаимодей-
ственно трансформируют субстраты или осу-
ствия такие комплексы могут быть стабильными
ществляют молекулярное узнавание при сборке
или короткоживущими.
надмолекулярных комплексов. Их функции пе-
С физиологической точки зрения, многие сиг-
реключаются при изменении условий.
нальные белки, такие как протеинкиназы, фос-
фатазы, ацетилтрансферазы или деацетилазы,
MOONLIGHTING PROTEINS
многофункциональны. Осуществляя посттранс-
ляционные модификации (фосфорилирование,
В последние годы привлекают внимание
метилирование, ацетилирование и т.п.), они ак-
moonlighting proteins (MLP, от термина moonlight-
тивируют или ингибируют разные белки, вклю-
ing - работа по совместительству). MLP - под-
чают, выключают или переключают их функции
группа многофункциональных белков, у которых
и тем самым регулируют разнообразные кле-
одна полипептидная цепь, кодируемая одним ге-
точные процессы. Более высокий уровень регуля-
ном, может образовывать разные пространствен-
ции - факторы транскрипции, регулирующие
ные структуры и в разных условиях выполнять
экспрессию целых комплексов функционально
две и более биохимических или биофизических
связанных белков. Они осуществляют сложные,
функций. У них каждая функция регулируется
комплексные реакции клеток: изменение функ-
независимо от других, а инактивация одной не
циональной активности, переключение метабо-
влияет на другие [13-18]. Функционально MLP -
лизма, деление, апоптоз и т.д. Физиологические
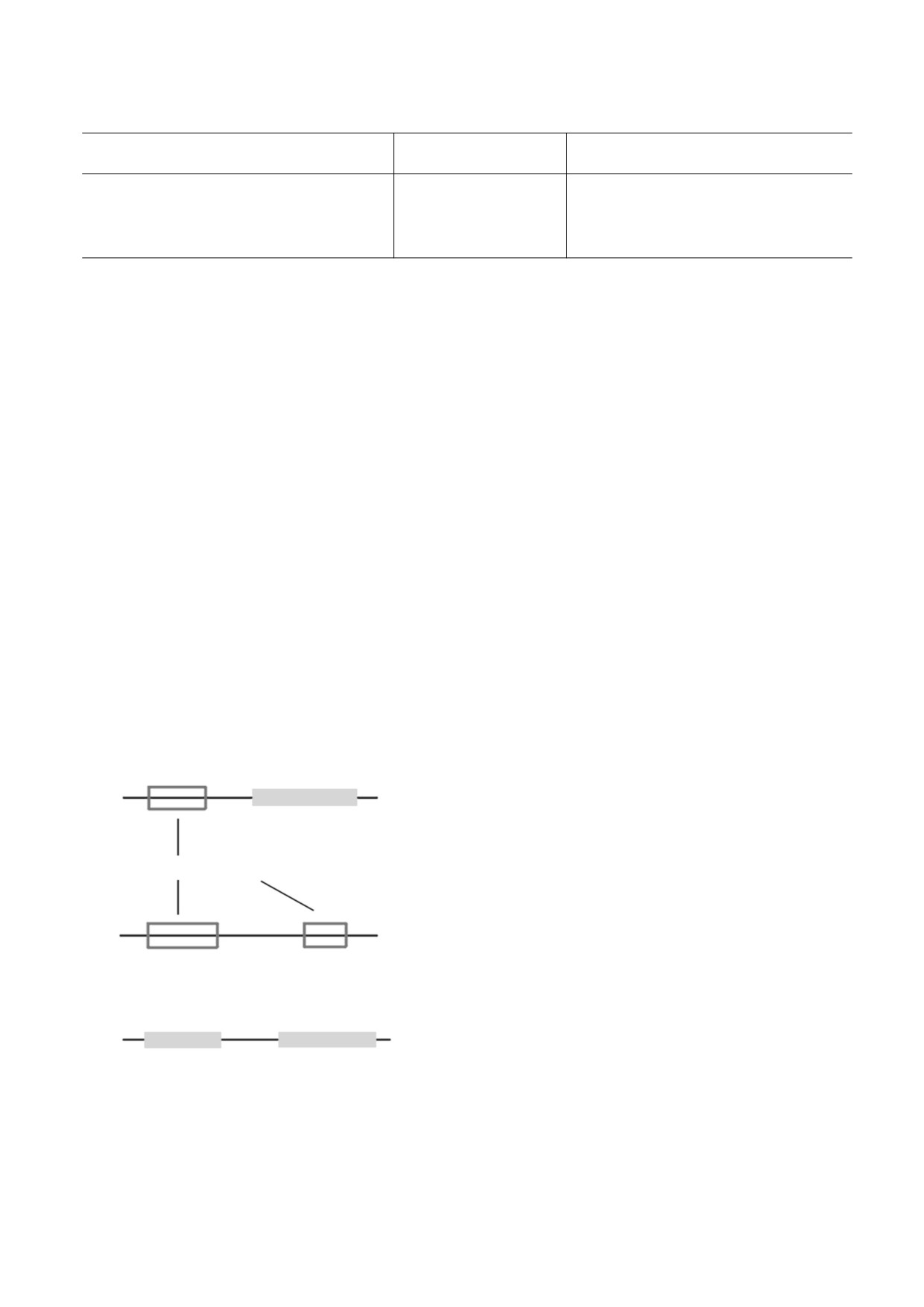
комбинация доменов типа
«фермент» и/или
функции таких регуляторных белков опосреду-
участков распознавания типа
«платформа»
(рис. 1).
Таких MLP уже найдено несколько сотен на
Ф
П
всех ступенях эволюционного дерева от бактерий
ФП
до высших организмов, причем многие из них
Участок
весьма консервативны [11, 12]. Функции MLP
распознавания
разнообразны. Часто это изобильные белки до-
машнего хозяйства, экспрессирующиеся в клет-
Активные центры
ках в больших количествах, как, например, неко-
торые компоненты гликолиза, цикла Кребса, ша-
пероны, белки рибосом, факторы транскрипции,
компоненты цитоскелета, рецепторы клеточной
ФФ
поверхности, белки клеточной адгезии и т.д. [13-
Ф1
Ф2
17]. Так, семь из десяти белков гликолиза, семь из
восьми белков цикла Кребса, ряд белков рибосом
(rpS3, rpL10A, rpL13a и др.) - это MLP. Информа-
ция о более 350 MLP представлена в базах данных
П1
П2
MultitaskProtDB-II, MoonProt и MoonDB v2.0
ПП
(табл. 1) [11, 12]. Примеры разных MLP приведе-
ны в табл. 2. Рассмотрим некоторые из них.
Рис. 1. Комбинации доменов типа фермент (Ф) и/или
Рибосомный белок rpS3. Более десятка рибо-
участков распознавания типа платформа (П) в MLP-
сомных белков, участвуют также в других белко-
белках: (а) - белок типа «фермент»-«платформа»,
(б) - белок типа «фермент»-«фермент», (в) - белок
вых комплексах в клеточном ядре и задействова-
типа «платформа»-«платформа».
ны в репарации ДНК и регуляции транскрипции.
БИОФИЗИКА том 65
№ 3
2020
МНОГОФУНКЦИОНАЛЬНЫЕ БЕЛКИ
467
Таблица 2. Некоторые примеры MLP-белков
Белок
Функция 1
Функции 2 +
Тип
ε-Кристаллин
Структурный
Лактатдегидрогеназа (гликолиз)
ПФ
компонент
хрусталика
τ-Кристаллин
Структурный
Энолаза (гликолиз)
ПФ
компонент
хрусталика
Лактатдегидрогеназа
Гликолиз
ssDNA-связывающийся белок
ФП
Глицеральдегид-3-
Гликолиз
15-20 разных функций, в т.ч. трансферриновый рецептор,
ФФ,
фосфатдегидрогеназа
опосредующий поглощение Fe, тимидингидроксилаза,
ФП
контроль везикулярного транспорта, экспорт тРНК из ядра,
ssDNA-связывающийся белок и др. У бактерий - адгезин,
токсин, инвазин
Аконитаза
Цикл Кребса
Гомеостаз Fe: при недостатке Fe активирует экспрессию генов
ФФ,
(цитрат →
регулирующих поглощение Fe; поддерживает стабильность
ФП
изоцитрат)
мтДНК
Цитохром с
Переносчик
В цитозоле в комплексе с Apaf-1, dATP и прокаспазой 9
ФП
электронов в
инициирует апоптоз
митохондриях
rpS3
Белок малой
Фосфорилируется PKCδ, приобретает эндонуклеазную
ПФ,
субъединицы
активность и участвует в репарации ДНК; связываясь
ПП
рибосомы
с NF-κB, участвует в регуляции экспрессии генов
STAT3
Фактор
Активатор электронного транспорта в митохондриях
ПП
транскрипции
β-Катенин
Клеточная
Фактор транскрипции
ПП
адгезия
p53
Фактор
Регулирует клеточный цикл и репарацию ДНК;
ПП
транскрипции
в митохондриях стимулирует апоптоз
Примечание. Типы MLP-белков: ПФ - «платформа»-«фермент», ФП - «фермент»-«платформа», ФФ -
«фермент»-«фермент», ПП - «платформа»-«платформа».
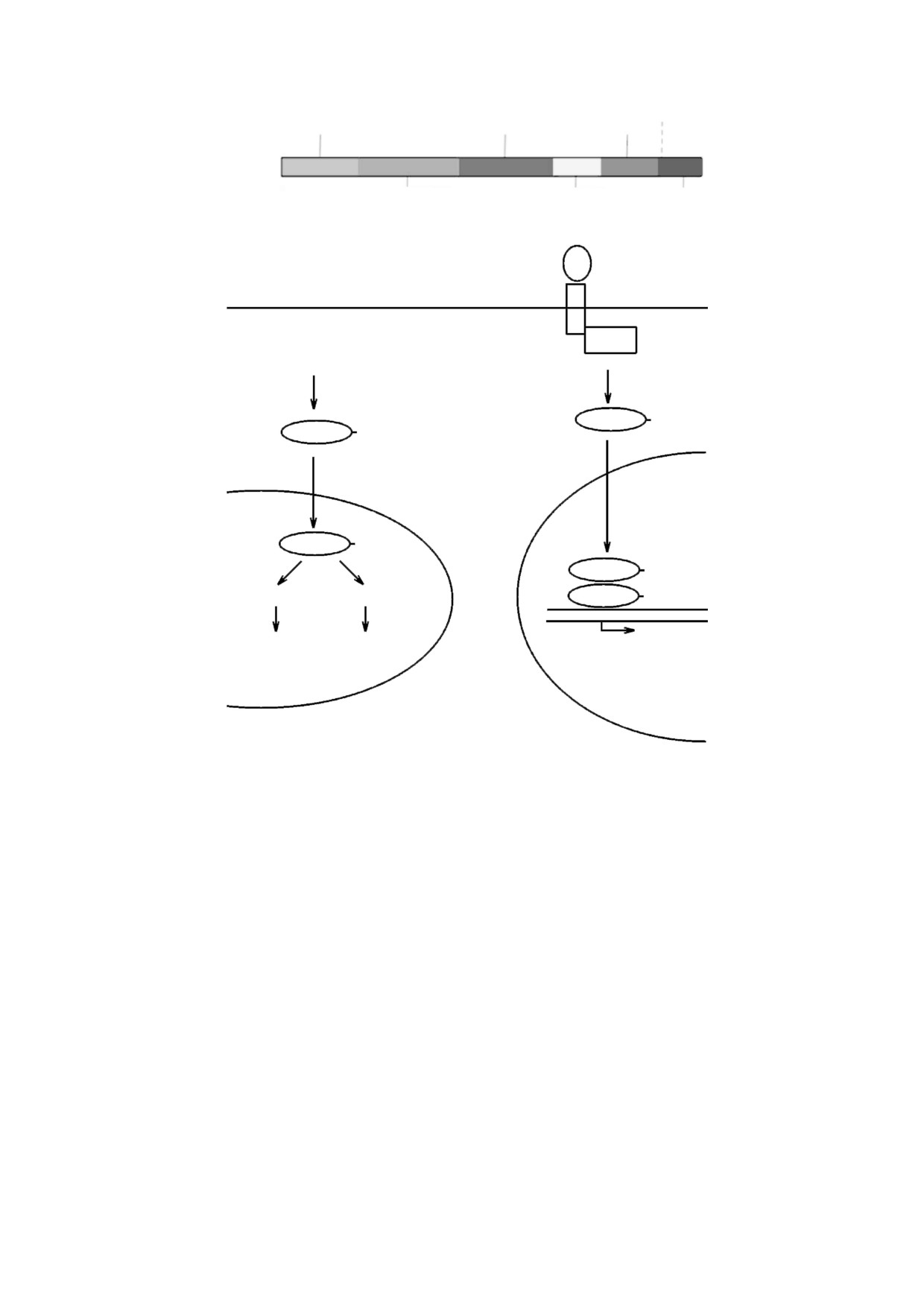
Так, белок rpS3, входящий в состав малой субъ-
мен КН может связывать p53 и стимулировать
единицы рибосомы 40S, может выполнять ряд до-
апоптоз. Сверхэкспрессия rpS3 приводит к кон-
полнительных функций [19-21]. После синтеза в
денсации ДНК, деградации белков PARP и ламин
цитоплазме он с помощью импортина-α перено-
A/C, а также к экспрессии проапоптозных каспаз
сится в ядро. Большая его часть идет на синтез
3, 8 и 9 [21]. Также rpS3 может связываться с бак-
малой субъединицы рибосомы, но некоторое ко-
териальными белками NleH1 и NLeH2, регулируя
личество участвует в реализации транскрипцион-
ответ клетки на микробный патогенез [29]. Белок
ной функции фактора NF-κB. Белок rpS3 усили-
rpS3 проявляет MLP-функции скорее по типу
вает аффинность к промоторам субъединицы p65
«платформа»-«платформа» или
«платформа»-
белка NF-κB , которая связывается с доменом KH
«платформа»-«платформа», чем по типу «фер-
(рис. 2) и направляет NF-κB к контролируемым
мент»-«платформа».
им генам. С-концевой домен rpS3 (рис. 2) участ-
Другие рибосомные белки также проявляют
вует в репарации ДНК [21]. Разные функции rpS3
MLP-свойства. Так, при рибосомном стрессе, ко-
обусловлены фосфорилированием ряда амино-
гда в клетке нарушен синтез рибосом, белки ри-
кислот и связыванием различных белков с его до-
босом rpL5, rpL11 и другие подавляют активность
менами. После фосфорилирования серина 209 и
убиквитинлигазы MDM2, которая инициирует
треонинов 42 и 221 протеинкиназами IKKβ, ERK
протеасомную деградацию белка p53. Это приво-
и PKCδ соответственно (рис. 2) rpS3 участвует в
дит к стабилизации и активации p53 и стимуля-
распознавании повреждений ДНК и, благодаря
ции апоптоза. В последнее время такое свойство
эндонуклеазной активности, вносит вклад в экс-
обнаружено уже у четырнадцати рибосомных
цизионную репарацию. При избытке rpS3 его до-
белков. Предполагается, что это связано с выра-
БИОФИЗИКА том 65
№ 3
2020
468
УЗДЕНСКИЙ
Importin-a
p65
N
Апоптоз
KH
Репарация ДНК
C
S6
T42
T70
S209
T221
(PKCδ)
(ERK)
(PKB/Akt)
(IKKβ)
(PKCδ)
Рис. 2. Структурная схема и места посттрансляционных модификаций рибосомного белка rpS3. Указаны сайты фос-
форилирования серина S6 и треонина Т221 протеинкиназой PKCδ, серина S209 - киназой IKKβ, треонина T42 - ки-
назой ERK и треонина Т70 - киназами PKB/Akt.
ботавшейся в ходе эволюции реакции организмов
митохондриях он переносит электроны, а после
на нестабильность генома. В эукариотических
перемещения в цитозоль стимулирует апоптоз
клетках гены, кодирующие различные рибосом-
[23, 24]. В эукариотических клетках после синтеза
ные белки, разбросаны по разным хромосомам.
в цитозоле апоцитохром с переносится в межмем-
Но в рибосомы эти белки должны поступать в
бранное пространство митохондрий. Там два его
одинаковом количестве. При геномной неста-
цистеиновых остатка связывают гем, создавая
бильности возможен дисбаланс, нарушающий
цитохром с, который диффундирует по поверхно-
сборку функционирующих рибосом. Таким обра-
сти внутренней митохондриальной мембраны и
зом, влияя на способность белков MDM2 и p53
переносит электроны от цитохрома c1 комплекса
регулировать апоптоз, организм избавляется от
III к цитохромоксидазе в комплексе IV благодаря
клеток с нестабильностью генома [22].
окислительно-восстановительным превращени-
ям гемового железа:
Цитохром с. Цитохром с - древний белок, рас-
пространенный на всех уровнях эволюционного
Fe3+ + e─ Fe2+.
дерева от микроорганизмов до эукариот. Он игра-
ет важнейшую роль в биоэнергетике клетки. В
Митохондриальный цитохром с имеет консер-
вативную трехмерную структуру. Его простота,
стабильность и доступность позволила тщательно
изучить на атомном уровне процессы электрон-
(а)
ного транспорта с его участием. Но его moonlight-
Цитохром с
Апоптосома
ing-свойства и структурные перестройки в разных
ситуациях пока изучены не так детально. Цито-
хром с имеет сравнительно гибкую структуру,
легко перестраивающуюся при разных молеку-
лярных взаимодействиях и изменении локализа-
ции. Выявлен ряд структурных модификаций ци-
тохрома с в разных условиях. Он также может
подвергаться разным посттрансляционным мо-
дификациям: фосфорилированию, нитрозилиро-
ванию, и др. Показано, что кроме нативной кон-
формации цитохром с может переходить в альтер-
нативную, частично развернутую форму, в
которой он не переносит электроны, а вовлекает-
ся в moonlighting-функции [23].
Если цитохром с выходит из митохондрий в
цитозоль через разрывы или мегаканалы в наруж-
ной митохондриальной мембране, образованные
(б)
белками Bax и Bak, он инициирует образование
WD1
WD2
Цит. с
апоптосомы - мультибелкового комплекса, сти-
мулирующего апоптоз [23-25]. За счет электро-
статических взаимодействий он связывается с
двумя «пропеллерными» доменами цитозольного
мономерного белка Apaf-1 (Apoptotic protease-ac-
tivating factor 1). Это приводит к изменению кон-
формации Apaf-1, ведущему к замене связанного
ADP на dATP, и образуется апоптосома - ста-
Рис. 3. Структура апоптосомы, образованной семью
бильный гептамерный комплекс из семи субъ-
белками Apaf-1 со встроенными цитохромами с (а).
единиц «Apaf-1-dATP-цитохром с» (рис. 3) [23-
Комплементарное связывание цитохрома с доменами
WD1 и WD2 белка Apaf-1 (согласно работе [24]).
26]. Апоптосома отщепляет от прокаспазы 9 ин-
БИОФИЗИКА том 65
№ 3
2020
МНОГОФУНКЦИОНАЛЬНЫЕ БЕЛКИ
469
гибиторный фрагмент. Получившаяся каспаза 9
формами восстанавливается, и индол передается
активирует каспазу 3, запускающую дальнейшие
в β-субъединицу [29].
апоптотические процессы. Интересно, что такая
Еще один бифункциональный фермент - глю-
структура апоптосомы - позднее эволюционное
козамин-6-фосфатсинтаза. В ее N-домене (i) из
приобретение. У нематоды C. elegans апоптосомы
глутамина высвобождается NH3, и это вызывает
состоят из четырех белков CED-4, гомологов
конформационный переход с открыванием 18-
Apaf-1, а у дрозофилы - из восьми белков Dronc.
ангстремного туннеля, по которому NH3 перено-
Эти апоптосомы не содержат цитохрома с, кото-
сится в С-домен (ii) на фруктозо-6-фосфат, в ре-
рый присутствует только в апоптосомах позво-
ночных животных [25, 27]. Недавно показано, что
зультате чего синтезируется глюкозамин-6-фос-
фат [29].
при повреждении ДНК цитохром с может транс-
лоцироваться в ядро, где он препятствует сборке
Метаморфные белки. Так называемые мета-
нуклеосом, что снижает выживаемость клеток.
морфные белки в физиологических условиях мо-
Правда, молекулярные механизмы этой трансло-
гут обратимо переключаться между фиксирован-
кации и структурные превращения цитохрома с
ными конформациями. Это возможно, если по-
пока не выяснены [23].
тенциальный барьер для перехода не очень
большой и глубина потенциальных ям не сильно
Таким образом, цитохром с представляет со-
различается, в отличие от необратимого перехода
бой MLP типа «фермент»-«платформа».
в более глубокую потенциальную яму, ловушку,
Бифункциональные белки. У бифункциональ-
характерную для стабильной конформации не-
ных белков, кодируемых одним геном, обычно
правильно свернутого белка (misfolding trap).
имеются два активных центра в разделенных по-
Между этими формами устанавливается динами-
липептидной цепью доменах, которые выполня-
ческое равновесие. Структурные переходы облег-
ют разные функции. Это MLP типа «фермент»-
чаются наличием гибкого участка в середине по-
«фермент». Часто они катализируют последова-
липептидной цепи.
тельные реакции одного метаболического пути с
Хорошо изученный пример метаморфного
переносом между ними субстрата или интермеди-
белка - сверочный белок Mad2, который контро-
ата (substrate channeling) для того, чтобы сокра-
лирует правильность сборки митотического вере-
тить его путь, предотвратить взаимодействие с
тена и инициирует остановку митоза [33]. В отсут-
внешними метаболитами и утечку в среду. При
ствие лигандов неактивная открытая (O-Mad2) и
этом каталитический акт в центре А стимулирует
активная закрытая (C-Mad2) конформации этого
перенос интермедиата и вызывает открывание
белка находятся в динамическом равновесии.
«ворот» для интермедиата в центре Б и/или его
Центральное ядро Mad2 сохраняет свою структу-
активацию. Линкер, соединяющий домены, иг-
ру, а фрагменты на С- и N-концах подвергаются
рает важную роль в стабилизации конформации
значительной структурной перестройке. Переход
одного из доменов и передаче сигнала об актива-
между открытой и закрытой конформациями
ции одного домена к другому [28-32]. В механиз-
обеспечивает правильное прикрепление микро-
ме «ворот» часто участвуют ароматические ами-
трубочек к кинетохорам, что необходимо для точ-
нокислоты, благодаря их способности к ротации.
ного расхождения хромосом во время митоза [33].
Их небольшой поворот может вызвать суще-
Глицеральдегид-3-фосфатдегидрогеназа. Пора-
ственное перемещение боковых цепей и конфор-
зительный пример MLP - гликолитический фер-
мационный переход, увеличивающий ширину
мент
глицеральдегид-3-фосфатдегидрогеназа
«ворот» [29, 30].
(GAPDH). Этот многофункциональный белок
называют «квинтэссенцией MLP». Кроме глико-
Примером такого бифункционального белка
лиза, он участвует в выполнении до двадцати раз-
является триптофансинтаза. В ней домен α рас-
щепляет индол-3-глицеролфосфат на индол и
ных функций. Многообразие его функций опре-
D-глицеральдегид-3-фосфат. После конформа-
деляется олигомеризацией, межмолекулярными
ционного перехода и перемещения индола по
взаимодействиями, различным микроокружени-
25-ангстремному туннелю домен β катализирует
ем в разных клеточных компартментах и пост-
соединение индола и серина в триптофан. В сере-
трансляционными модификациями [34-40]. Так,
дине туннеля, в домене β, стенки туннеля содер-
на клеточной поверхности GAPDH образует ком-
жат Tyr279 и Phe280. Повороты их ароматических
плекс с трансферриновым рецептором, который
колец обусловливают динамическое равновесие
опосредует поглощение железа клетками [38].
между альтернативными конформациями, от-
Связывание GAPDH с клеточной мембраной
крывающими или закрывающими туннель. Свя-
способствует слиянию мембран и эндоцитозу.
зывание субстрата с α-субъединицей приводит к
Цитоплазматическая GAPDH участвует в пу-
закрыванию туннеля, а после расщепления суб-
зырьковом транспорте от эндоплазматического
страта равновесие между открытой и закрытой
ретикулума к цистернам комплекса Гольджи. Она
БИОФИЗИКА том 65
№ 3
2020
470
УЗДЕНСКИЙ
Связывание РНК,
Метаболизм
Ядерный
фосфатидилсерина,
гема.
экспорт
глутатиона
Апоптоз
2-
2-
P
Ac
N Ac
Ac
P
Ac
N Tyr41
Lys117
Cys149 Lys160
Lys227 Thr237 Lys251
C
NAD+-связывающий
Каталитический
домен
домен
Рис. 4. Структура, функции и пост-трансляционные модификации глицеральдегид-3-фосфатдегидрогеназы. Обозна-
чены аминокислоты, подвергающиеся фосфорилированию (P2-), ацетилированию (Ac) и нитрозилированию (N).
также регулирует стабильность мРНК. В ядре
редокс-сенсоров в клетке и регуляторов клеточ-
GAPDH участвует в поддержании целостности
ного гомеостаза [39, 40]. Его окисление повышает
ДНК, регуляции экспрессии генов, экспорте
способность GAPDH связываться с тРНК и ДНК
тРНК из ядра, а также в регуляции апоптоза [34-
[41], а нитрозилирование оксидом азота регули-
37]. Это позволяет рассматривать GAPDH как
рует метаболизм гема, клеточный ответ на окис-
центральный регулятор клеточного метаболизма
лительный стресс и апоптоз [38]. Ацетилирова-
и информационный центр [34-36, 39, 40].
ние лизина 160 влияет на экспрессию ряда генов,
GAPDH - вездесущий и изобильный белок,
кодирующих проапоптотические белки p53,
высококонсервативный на протяжении всей эво-
PUMA и Bax. Фосфорилирование GAPDH влияет
на везикулярный транспорт, синаптическую пе-
люционной лестницы. В соматических клетках
редачу [34, 35]. Однако точные биофизические и
он кодируется единственным геном; альтерна-
тивных транскриптов не обнаружено. GAPDH
биохимические механизмы такого разнообразия
состоит из 335 аминокислот и имеет массу 37 кДа.
функций пока выяснены не полностью.
Его кофермент - NAD+. В структуре GAPDH вы-
В настоящее время проведены более ста иссле-
деляют NAD+-связывающий домен из 150 амино-
дований трехмерной структуры GAPDH из раз-
ных организмов от микробов до человека, как от-
кислот и каталитический домен (аминокислоты
дельно, так и вместе с разными субстратами, ин-
151-335) (рис. 4). NAD+-связывающий домен
термедиатами, продуктами, ингибиторами и т.д.
участвует в стабилизации мРНК и регуляции
GAPDH обычно присутствует как гомотетрамер
трансляции. Мембранные функции GAPDH ос-
или, точнее, как димер из двух димеров, состоя-
нованы на связывании фосфатидилсерина в пре-
щий из четырех одинаковых субъединиц [37]. В
делах NAD+-связывающего домена на внутрен-
трехмерной структуре тетрамера GAPDH выделя-
ней стороне клеточной мембраны (аминокисло-
ются две поперечные бороздки длиной 70 Å, ко-
ты 70-94). Связанная с мембраной GAPDH
торые охватывают участки связывания субстрата
катализирует слияние мембран, а также регули-
и кофактора NAD+. Предполагается, что эти об-
рует поглощение, транспорт и метаболизм Fe2+.
ласти могут связывать нуклеиновые кислоты, так
GAPDH также связывает глютатион (аминокис-
как в них находится много положительно заря-
лоты 67-77). Каталитический домен участвует в
женных остатков лизина и аргинина. Узкий цен-
экспорте тРНК из ядра (аминокислоты 258-270)
тральный канал (4 × 10 Å) хорошо связывает не-
[37, 38, 41].
большие молекулы. Несмотря на обилие струк-
Экспрессия GAPDH в клетках динамична и
турных данных, еще многое необходимо
чувствительна к условиям внутри клетки - уров-
выяснить для понимания биофизических и био-
ню Ca2+, гипоксии, концентрации железа, стадии
химических механизмов реакций, опосредован-
ных GAPDH. В гликолизе GAPDH фосфорили-
клеточного цикла и т.д. [37]. Функциональная ак-
рует D-глицеральдегид-3-фосфат и переводит его
тивность GAPDH существенно регулируется.
в 1,3-бисфосфоглицерат (BPG). Предполагается,
Имеется много данных о роли посттрансляцион-
что это происходит в два этапа. Сначала осу-
ных модификаций, таких как ацетилирование ли-
ществляется нуклеофильная атака на D-глице-
зинов 117, 160, 227 и 251, фосфорилирование трео-
ральдегид-3-фосфат цистеином С152 GAPDH с
нина 237 и тирозина 41, нитрозилирование цисте-
ина 149 и др. (рис. 4) в множественности функций
переносом гидрида на NAD+. При этом Н179
GAPDH. Например, цистеин 149 весьма чувстви-
является основным катализатором. Затем проис-
телен к окислению, что делает GAPDH одним из
ходит нуклеофильная атака неорганического
БИОФИЗИКА том 65
№ 3
2020
МНОГОФУНКЦИОНАЛЬНЫЕ БЕЛКИ
471
фосфата на карбонильную группу тиоэфира с по-
вующий в димеризации и даже тетрамеризации
STAT3, которая усиливает его транскрипцион-
следующим ее фосфорилированием [37]. Меха-
ную активность; суперспиральный домен CDD
низмы других moonlighting-функций GAPDH
(аминокислоты 138-320), связывающийся с раз-
еще предстоит выяснить. Пока неизвестно, как
личными регуляторными белками; домен DBD
осуществляется переключение функций и изме-
(DNA-binding domain), связывающийся со спе-
нение локализации GAPDH в клетках. Напри-
цифическими участками ДНК (аминокислоты
мер, она не содержит сигнала ядерной локализа-
321-493); линкерный домен LD (аминокислоты
ции NSL, но обнаруживается в ядре. Оказалось,
494-582); SH2 домен (аминокислоты 583-687),
что протеинкиназа AMPK, фосфорилируя серин
связывающий STAT3 c фосфорилированными ре-
122, индуцирует переход GAPDH в ядро, а фос-
форилирование треонина 237 протеинкиназой
цепторами. Фосфорилирование тирозина в
STAT3 киназами JAK и Src приводит к его диме-
Akt предотвращает это перемещение. Но меха-
ризации и переносу в ядро. C-концевой трансак-
низмы этих процессов пока неясны [37].
тивационный домен TAD (transactivation domain,
аминокислоты 688-770; у STAT3β укорочен до
ФАКТОРЫ ТРАНСКРИПЦИИ
705-й аминокислоты). Он внутренне неупорядо-
чен и по-разному сворачивается при взаимодей-
Факторы транскрипции управляют целым
ствии с разными партнерами при формировании
комплексом клеточных реакций, инициируя экс-
транскрипционных комплексов [45, 46]. При вза-
прессию множества белков, выполняющих или
имодействии с ДНК белок STAT3 димеризуется
регулирующих данную функцию. Среди них вы-
так, что домены DBD охватывают ДНК. Также
деляются несколько мастер-регуляторов, ко-
эти домены могут связываться с импортином или
торые, в отличие от сравнительно узконаправ-
экспортином для импорта STAT3 в ядро или экс-
ленных факторов транскрипции, как например
порта его в цитоплазму. Таким образом, STAT3 -
Nrf-2, регулирующий экспрессию группы анти-
moonlighting-белок типа
«платформа»-«плат-
оксидатных генов, обладают невероятно широ-
форма».
ким спектром действия. К ним относятся такие
β-Катенин. β-Катенин - высококонсерватив-
белки, как c-Myc и p53, которые регулируют экс-
ный белок из 781 аминокислот - имеет интерес-
прессию до 10-15% всех генов [42, 43]. Но кроме
ную структуру [47-49]. Его центральная область
регуляции экспрессии генов многие факторы
содержит несколько повторов из примерно
транскрипции могут выполнять и другие функ-
40 аминокислот (например, у человека - двена-
ции, являясь moonlighting-белками. Рассмотрим
дцать повторов), которые образуют жесткий
несколько важных примеров.
удлиненный домен ARM (от слова armadillo -
Белок STAT3. Белок STAT3 (Signal transducer
броненосец). Из-за сложной формы отдельных
and activator of transcription 3) играет ключевую
повторов домен ARM имеет небольшую кривизну
роль в клеточном росте и выживании. Это фактор
(рис. 6). Его внутренняя поверхность может свя-
транскрипции, но перемещаясь в митохондрии,
зывать различные белки и нуклеиновые кислоты.
он регулирует окислительное фосфорилирование
N-концевой и C-концевой фрагменты β-катени-
[44, 45]. Связывание интерлейкинов 6 или 10 с ре-
на внутренне неупорядочены. В растворе они не
цептором цитокинов на поверхности клетки ак-
имеют определенной структуры. Но они играют
тивирует цитоплазматическую киназу JAK, кото-
решающую роль в связывании β-катенина с дру-
рая фосфорилирует тирозин в STAT3. Это иници-
гими белками и ДНК. N-концевой фрагмент со-
ирует димеризацию STAT3 и перемещение его в
держит консервативный короткий линейный мо-
клеточное ядро, где он как фактор транскрипции
тив (SLiM - short linear motif), который после
контролирует экспрессию ряда генов [45]. Если
фосфорилирования связывается с убиквитинли-
же под влиянием внутриклеточных сигнальных
газой β-TrСР, стимулирующей его протеасомную
путей цитоплазматические протеинкиназы фос-
деградацию. С-концевая область при взаимодей-
форилируют сериновые остатки в STAT3, то он
ствии с ДНК является сильным активатором
перемещается в митохондрии, где активирует пе-
транскрипции. Этот сегмент не полностью не-
ренос электронов от комплексов I и II на ком-
упорядочен: его участок на C-конце образует ста-
плекс III, что повышает интенсивность окисли-
бильную спираль (HelixC), которая располагается
тельного фосфорилирования (рис. 5б). Так, с по-
вблизи домена ARM. Хотя эта спираль не необхо-
мощью STAT3 различные сигнальные пути могут
дима для участия β-катенина в клеточной адге-
регулировать биоэнергетические процессы в ми-
зии, она важна для регуляции транскрипции
тохондриях [44].
[48, 49].
Известны две изоформы STAT3α и STAT3β с
После синтеза β-катенин встраивается в плаз-
молекулярной массой 770 и 705 Да соответствен-
матическую мембрану, где вместе с винкулином,
но. Основные домены в STAT3α (рис. 5а): N-кон-
α-катенином и катенином p120 образует плат-
цевой домен NTD (аминокислоты 1-137), участ-
форму для связывания цитоплазматического
БИОФИЗИКА том 65
№ 3
2020
472
УЗДЕНСКИЙ
(а)
NTD
DBD
SH2
1
321
583
770
STAT3α
138
494
688
CDD
LD
TAD
(б)
IL
Клеточная мембрана
Рецептор
цитокинов
Внутриклеточные
Jak
протеинкиназы
STAT3
Tyr-P
STAT3
Ser-P
STAT3
Ser-P
STAT3
Tyr-P
Комплекс I Комплекс II
STAT3
Tyr-P
Окислительное
Экспрессия
фосфорилирование
генов
Митохондрия
Ядро
Рис. 5. Структура и функции STAT3. (a) - Схема основных структурных доменов STAT3: NTD - N-концевой домен,
CDD - суперспиральный домен, DBD - ДНК-связывающий домен, LD - линкерный домен, SH2 - SH2-домен,
TAD - трансактиваторный домен. (б) - Альтернативные функции STAT3. При активации интерлейкинами
цитокинового рецептора на клеточной мембране белок JAK фосфорилирует тирозин в STAT3. Это вызывает
димеризацию STAT3, транслокацию в ядро и стимуляцию экспрессии генов. Если цитоплазматические
протеинкиназы фосфорилируют серин в STAT3, то он транслоцируется в митохондрии, где активирует транспорт
электронов от комплексов I и II на комплекс III, повышая скорость окислительного фосфорилирования.
фрагмента кадгерина, участвующего в межкле-
пути Wnt, белки с-Myc, COX и т.п. [47]. Таким об-
точной адгезии, с внутриклеточным актиновым
разом, β-катенин - MLP типа «платформа»-
цитоскелетом. Свободный β-катенин в цитоплаз-
«платформа».
ме практически отсутствует. Он связывается с
Белок p53. Белок p53 исключительно важен и
мультиферментным комплексом белков APC,
интересен Он экспрессируется во всех клетках
axin1, GSK3 и CK1, в котором протеинкиназы
организма и регулирует основные клеточные
GSK3 и CK1 фосфорилируют его, после чего β-
функции, включая метаболизм, клеточный цикл,
катенин убиквитинируется лигазой β-TrCP и де-
репарацию ДНК, выживаемость и апоптоз [50-
градирует. Но под влиянием внеклеточного сиг-
52]. В качестве фактора транскрипции он регули-
нала Wnt, APC-комплекс распадается, и в цито-
рует экспрессию сотен генов [43, 53]. В клетках с
плазме появляется свободный β-катенин. Он
нерепарируемыми повреждениями ДНК p53 сти-
транслоцируется в ядро, где как фактор тран-
скрипции регулирует экспрессию различных ге-
мулирует апоптоз [54-57]. Это позволяет устра-
нов, которые кодируют компоненты сигнального
нять злокачественные клетки и защищать орга-
БИОФИЗИКА том 65
№ 3
2020
МНОГОФУНКЦИОНАЛЬНЫЕ БЕЛКИ
473
α-Катенин
Axin/APC
Кадгерин
ARM
3
4
5
6
7
8
1
2
9 10 11 12
667
Экспрессия генов
Спираль С
691
С
683
N
Трансактивационный
С-концевой домен
Неупорядоченный
N-концевой домен
Рис. 6. Структура β-катенина человека с двенадцатью повторами (ARM-домен), внутренне неупорядоченными N-доменом
и трансактивационным C-доменом.
низм от раковых опухолей. Поэтому его называют
транскрипцию целой группы генов, содержащих
супрессором опухолей и стражем генома. Мута-
в регуляторной области специальную нуклеотид-
ции гена TP53, инактивирующие p53, найдены в
ную последовательность p53RE (p53-response ele-
половине случаев рака человека. Однако р53 не
ment). Уже известно более 600 таких р53RE [53].
только регулирует экспрессию генов, но также,
Результатом активации р53 является остановка
независимо от транскрипции, регулирует мито-
клеточного цикла и репликации ДНК, репарация
хондриальные функции и индуцирует апоптоз в
повреждений ДНК, а при сильном стрессовом
клетках с митохондриальной недостаточностью
сигнале - запуск апоптоза [57, 58, 64]. Белок p53
[58-60]. Этот древний консервативный белок
также обнаруживается в клеточных ядрышках,
найден у организмов на ранних эволюционных
являющихся «фабриками рибосом». Нарушение
стадиях у простейших и губок, намного раньше,
синтеза рибосом в ядрышке повышает уровень
чем возникли раковые опухоли. Поэтому предпо-
р53, что передает сигнал о повреждении клетки в
лагается, что истинная роль белков семейства р53
системы, контролирующие клеточный метабо-
заключается в поддержании целостности генома
лизм, гомеостаз и выживание [66, 67].
при неблагоприятных воздействиях на организм
Белок р53 состоит из одной полипептидной
[61, 62].
цепи из 393 аминокислот. В клетках он образует
тетрамер из двух одинаковых димеров. Как у мно-
Обычно уровень белка р53 в цитоплазме под-
гих факторов транскрипции, в первичной струк-
держивается на низком уровне. После синтеза в
туре p53 можно выделить ряд функциональных
цитоплазме он транспортируется в ядро, где свя-
модулей (рис. 7). На N-конце располагается тран-
зывается с ДНК. Несвязанный р53 образует ком-
сактивационный домен TAD (transactivation do-
плекс с MDM2, который моноубиквитинирует
main), подразделяющийся на два субдомена
его и транспортирует обратно в цитоплазму, где
TAD1 и TAD2 (аминокислоты 1-43 и 44-63). За
он дополнительно убиквитинируется и быстро
ними следует богатый пролином участок PRR
деградирует в протеасомах [63]. При активации
(proline-rich region, аминокислоты 64-92), ДНК-
онкогенов, радиационном повреждении ДНК
связывающий домен DBD (аминокислоты 102-
или окислительном стрессе p53 фосфорилируется
292), который распознает p53RE и связывается с
протеинкиназами JNK, p38, ERK и т.п. [57], что
ним, сигнал ядерной локализации NLS (nuclear
предотвращает его взаимодействие с MDM2, пре-
localization sequence); домен TET (tetramerization
пятствует деградации и значительно повышает
domain, аминокислоты 320-355), ответственный
его уровень в ядре [51, 62, 64, 65]. Белок р53 тетра-
за тетрамеризацию p53, и C-концевой домен
меризуется, связывается с ДНК и стимулирует
(аминокислоты 356-393). Домены DBD и TET
N
C
TAD1 TAD2 PRR
DBD
TET CTD
1-43
44-63
64-92
102-292
320-355
356-393
Рис. 7. Схема основных структурных доменов p53: TAD1 и TAD2 - внутренне неупорядоченные трансактиваторные
домены, PRR - богатый пролином домен, DBD - ДНК-связывающий домен, NLS - сигнал ядерной локализации, TET -
домен, ответственный за тетрамеризацию, CTD - внутренне неупорядоченный С-концевой домен.
БИОФИЗИКА том 65
№ 3
2020
474
УЗДЕНСКИЙ
Нуклеосома
Нуклеосома
ДНК
Гистон
CTD
Гистон
CTD
DBD
p53
DBD
p53
TAD
TAD
Энхансер
Рис. 8. Предполагаемое взаимодействие p53 с нуклеосомой: «качение» нуклеосомы и взаимодействие с положительно
заряженными доменами белков, связывающихся с ДНК.
высококонсервативны, тогда как внутренне не-
одномерной [68, 75-77]. (Источник энергии и ме-
упорядоченные домены TAD и C-концевой до-
ханизм выбора направления движения p53 и дру-
мен более изменчивы, что позволяет белку р53
гих белков по ДНК неизвестны. При диффузии
гибко взаимодействовать со многими партнерами
направление движения определяется градиентом
[53, 68-71].
концентрации, который отсутствует в случае от-
Домены DBD в тетрамерах p53 при взаимодей-
дельных молекул). Еще одна проблема: неясно,
ствии с p53RE сгибают ДНК, причем по-разному
как белки, перемещающиеся по хромосоме
в участках с разными последовательностями нук-
(РНК-полимеразы, факторы транскрипции, ре-
леотидов [72]. При этом ДНК частично расплета-
парационные комплексы), преодолевают нукле-
ется, что облегчает связывание белков.
осомы, на которые намотана ДНК. Можно пред-
положить, что тогда как положительно заряжен-
Домен TAD (TAD1+TAD2) из 63 аминокислот
ный C-концевой домен стабилизирует р53 на
несет значительный отрицательный заряд благо-
ДНК, отрицательно заряженный TAD за счет
даря 17 остаткам глутаминовой и аспарагиновой
электростатического отталкивания может сдви-
аминокислот. Он внутренне неупорядочен. Его
гать нуклеосому, несущую на поверхности отри-
конформация определяется взаимодействием с
цательно заряженную ДНК. Это будет вызывать
ДНК или другими белками. Известно, что p53 че-
«качение» нуклеосомы по ДНК и освобождение
ловека может взаимодействовать более, чем с
участков для транскрипции или репарации. Из-
1000 различных белков, включая коактиваторы,
вестно, что p53 часто связывается с p53RE, распо-
энхансеры и другие регуляторы транскрипции, а
ложенными на нуклеосомах, вероятно из-за того,
также белки, осуществляющие посттрансляцион-
что сгибание ДНК на нуклеосоме повышает срод-
ные модификации - протеинкиназы, ацетил-
ство к p53 [53, 78, 79]. При этом между отрица-
трансферазы и т.п. [73].
тельно заряженными ДНК и TAD могут встраи-
C-концевой домен из 29 аминокислот также
ваться положительно заряженные участки взаи-
внутренне неупорядочен. В отличие от отрица-
модействующих с ДНК белков, таких как РНК
тельного TAD, он содержит семь положительно
полимеразы, белки репарационных комплексов,
заряженных аминокислотных остатков (шесть
коактиваторы или энхансеры транскрипции
остатков лизина и один - аргинина). Это позво-
(рис. 8).
ляет ему неспецифически взаимодействовать с
отрицательно заряженными фосфатами ДНК не-
Способность некоторых факторов транскрип-
зависимо от ее формы - с изогнутыми участками,
ции, таких как р53 или c-Myc, неспецифически
сверхспиральными, намотанными на нуклеосо-
регулировать экспрессию многих сотен генов ка-
мы и т.п. [69]. C-концевой домен играет важную
жется загадочной. Предполагается, что регуляция
роль в активации, клеточной локализации и де-
множества генов может быть обусловлена не
градации р53 [62]. Предполагается, что благодаря
только специфическим связыванием p53 с p53RE
сравнительно непрочному и неспецифическому
в промоторах определенных генов, но и его свя-
электростатическому связыванию положительно
зыванием с рядом сильных энхансеров, что повы-
заряженного C-концевого домена с отрицательно
шает его общую транскрипционную активность
заряженной ДНК, р53 может скользить вдоль мо-
[53]. Тем не менее активация экспрессии разных
лекулы ДНК в поисках нужного сайта, где доме-
групп генов факторами транскрипции в опреде-
ны DBD, также несущие положительные заряды,
ленной степени специфична [80]. Каковы струк-
более прочно и специфично связываются с p53RE
турные основы специфического связывания p53 с
[74]. Это облегчает проблему навигации фактора
теми или иными p53RE? Еще вопрос: каким об-
транскрипции, заменяя трехмерную диффузию
разом p53 по-разному реагирует на различные
БИОФИЗИКА том 65
№ 3
2020
МНОГОФУНКЦИОНАЛЬНЫЕ БЕЛКИ
475
стимулы? Возможно, это обеспечивается внут-
ской смерти клеток [64-67]. Но p53 может индуци-
ренне неупорядоченными участками (IDR, intri-
ровать апоптоз не только транскрипционным пу-
scally disordered regions), которые могут взаимо-
тем, но и независимо от транскрипции. Цитоплаз-
действовать с разнообразными белками. Наличие
матический p53 непосредственно связывается c
IDR очень характерно для разных факторов тран-
наружной митохондриальной мембраной, ингиби-
скрипции [81]. У p53 таким участком является
рует антиапоптотические белки Bcl-2 и Bcl-XL, ак-
TAD, способный взаимодействовать со множе-
тивирует проапоптотические белки Bax и Bid и
ством белков, что обеспечивает его чувствитель-
стимулирует Bax/Bak-опосредованное формиро-
ность к разным стимулам и способность активи-
вание мегапор в наружной митохондриальной
мембране, через которые цитохром с, SMAC/Diab-
ровать экспрессию различных генов [53]. Благо-
lo, AIF и другие проапоптотические белки выходят
даря жесткому линкерному пролиновому участку
в цитозоль и вызывают апоптоз [54,58-60].
PRR, TAD высовывается наружу из центрального
комплекса DBD/ДНК и таким образом может
Таким образом, р53 - многофункциональный
взаимодействовать с разнообразными коактива-
moonlighting-белок, который действует как фак-
торными и энхансерными белками [70]. Сродство
тор транскрипции, функции которого опосредо-
к разным партнерам p53 регулируется посттранс-
ваны экспрессией множества белков, и как проа-
ляционными модификациями, особенно фосфо-
поптотический агент, непосредственно влияю-
рилированием и ацетилированием TAD [70]. Так-
щий на митохондрии.
же предполагается, что разная экспрессия р53-
регулируемых групп генов, которые контролиру-
ЗАКЛЮЧЕНИЕ
ют разные клеточные процессы, обусловлена ло-
кальными различиями в структуре хроматина: то-
Многофункциональность белков - не единич-
пологией ДНК, расположением p53RE, метили-
ное явление. Она характерна для сотен белков, и
рованием ДНК в промоторах, сближением
это существенно расширяет функциональное
далеких энхансеров, доступностью промоторов
разнообразие, которое, казалось бы, ограничено
малым числом генов. Почему и как появились
генов для RNAPII и т.п. [53]. В частности, селек-
moonlighting и более сложные многофункцио-
тивность действия p53 может быть связана со
нальные белки - волнующий вопрос, на кото-
способностью по-разному изгибать ДНК в местах
рый, как и на другие эволюционные проблемы,
с разными последовательностями нуклеотидов
пока нет ответа. Согласно одному из предположе-
[72, 74].
ний, «безразличные» мутации, затрагивающие
Разные посттрансляционные модификации ре-
поверхностные участки белков, которые не кри-
гулируют активность p53, у которого 36 аминокис-
тичны для выполнения их канонической функ-
лот могут подвергаться фосфорилированию, мети-
ции, могут приводить к появлению новых функ-
лированию, ацетилированию, гликозилированию
ций. Имеется немало примеров, когда точечные
и т.д. [82]. Как отмечалось выше, фосфорилирова-
мутации, затрагивающие одну-две аминокисло-
ние серинов 18 и 20 в TAD препятствует связыва-
ты, могут существенно изменить свойства по-
нию MDM2, ведущему к деградации p53 [57]. Аце-
верхности, изменяя тем самым участие данного
тилирование различных лизинов дифференциаль-
белка в надмолекулярном комплексе или его кле-
но усиливает транскрипционную активность p53,
точную локализацию. Такие мутации могут быть
приводя к экспрессии разных групп генов и раз-
одним из механизмов возникновения MLP. Даль-
ным клеточным ответам. Так, неацетилированный
ше следует дупликация гена, амплификация и от-
белок p53 стимулирует экспрессию MDM2 и дру-
бор, если эти мутации приводят к полезным свой-
гих белков, препятствующих его чрезмерной акти-
ствам [14]. Вероятность появления новых функ-
вации. При повреждении ДНК p53 ацетилируется
ций выше у изобильных белков, которых много в
ацетилтрансферазой CBP/p300 и вместе с белками
клетке, и чаще их столкновения с белками-парт-
Tip 60 и MOF стимулирует экспрессию белков p21
нерами. Возможно, именно поэтому многие бел-
и GADD45, вызывающих остановку клеточного
ки домашнего хозяйства, такие как белки глико-
цикла и индуцирующих репарацию ДНК [82]. При
лиза, рибосом, молекулярных моторов и т.п., об-
сильных, нерепарируемых повреждениях ДНК,
ладают moonlighting-функциями [83, 84]. Они
вызванных такими вредными факторами, как ги-
найдены как у бактерий и дрожжей, так и у выс-
поксия, эксайтотоксичность, окислительный
ших организмов [83-87]. Была высказана мысль о
стресс, ионизирующее излучение или нарушение
том, что широкая распространенность moonlight-
функции ядрышка, увеличивается экспрессия p53.
ing белков в природе представляет собой резерву-
ар функций для адаптации к изменяющейся среде
При этом ацетилируются почти все лизиновые
остатки, и p53 начинает стимулировать экспрес-
[87].
сию генов, кодирующих апоптотические белки:
Важным фактором этого процесса является
каспазы 6, Apaf-1, HtrA2, Bax, Bid, NOXA, PUMA,
несбалансированность синтеза и использования
Fas, DR4, DR5 и т.п. Это приводит к апоптотиче-
таких белков. Так, в случае рибосомных белков
БИОФИЗИКА том 65
№ 3
2020
476
УЗДЕНСКИЙ
возможно, что перепроизводство некоторых из
650 тысяч видов сетевых межбелковых взаимо-
них могло приводить к появлению в цитоплазме
действий [89,
95]. Вышеупомянутые факторы
избыточных свободных белков, не встроившихся
транскрипции STAT3, β-катенин и p53 тоже со-
в рибосомы. Такие белки, как рассмотренный
держат IDR. Неупорядоченными могут быть и це-
выше белок rpS3, пробрели способность исполь-
лые белки, такие как кальмодулин или шаперо-
зоваться для других процессов, таких как участие
ны. IDR более лабильны и чаще мутируют, поэто-
в репарации ДНК и регуляции экспрессии генов.
му они более изменчивы и могут играть важную
Ярким и более сложным примером нарушения
роль в эволюционном происхождения MLP бел-
баланса процессов синтеза, использования и про-
ков [96-98]. Как оказалось, в их взаимодействиях
теолиза является β-катенин: белок, не встроив-
существенную роль играют консервативные ко-
шийся в мембранный адгезионный комплекс, де-
роткие линейные последовательности (SLiM) из
градирует. Но приход внеклеточного сигнала Wnt
на поверхностные рецепторы предотвращает де-
трех-десяти аминокислот [96-98]. Белковые вза-
градацию β-катенина. Он переносится в ядро, где
имодействия в таких последовательностях срав-
регулирует экспрессию генов. Важным регулято-
нительно слабые, со сродством в микромолярном
ром изменения внутриклеточной локализации
диапазоне. Поэтому они кратковременны и обра-
белков и, соответственно, переключения его
тимы. Они легко модулируются посттрансляци-
функций являются посттрансляционные моди-
онными модификациями, которые переключают
фикации. Это показано на примере белка STAT3,
структуру и функции белка. При этом определя-
который после фосфорилирования тирозинов
ющую роль во взаимодействиях и изменениях
направляется в ядро, где служит фактором тран-
конформации MLP и переключении их функций
скрипции, а после фосфорилирования серинов
играют их белковые или нуклеиновые партнеры,
цитоплазматическими протеинкиназами переме-
находящиеся в зоне взаимодействия.
щается в митохондрии, где активирует электрон-
транспортные процессы. Таким образом, источ-
Таким образом, хотя число генов весьма огра-
ником информации в клетке является не только
ничено, у многих белков, кодируемых одним ге-
зафиксированная в нуклеотидной последова-
ном, развилась способность выполнять две и
тельности ДНК информация о структуре белков,
больше различных функций, реализующихся в
которая сообщает, какие белки будут синтезиро-
зависимости от контекста: клеточной локализа-
ваться, но и информационные сигналы, приходя-
ции, микроокружения, образования комплексов
щие извне: изменение физико-химического со-
с другими белками, посттрансляционных моди-
стояния среды (температура, ионный и газовый
фикаций и т.д. Наличие многофункциональных
состав, рН, свободные радикалы, контакты с со-
белков порождает целый ряд вопросов: об их пер-
седними клетками и т.д.), а также сигнальные мо-
вичной и третичной структуре, о связи структуры
лекулы, поступающие от других клеток и запуска-
с функциями, о механизмах структурно-функци-
ющие внутриклеточные сигнальные каскады.
онального переключения, о фолдинге белков из
Они регулируют экспрессию генов и определяют
нескольких доменов и их рефолдинге при изме-
динамику и количество синтезируемых белков.
нении клеточной локализации, о самосборке бел-
Классические представления о роли перифе-
ковых и нуклеопротеиновых комплексов, о роли
рических аминокислотных последовательностей,
MLP в системе управления клеткой, о появлении
не входящих в активный центр и его ближайшее
и преобразованиях MLP в процессе эволюции,
окружение, в последнее время расширяются. Пе-
и т.д.
риферия белковой глобулы не только является
комплементарной поверхностью при сборке над-
ФИНАНСИРОВАНИЕ РАБОТЫ
молекулярных комплексов или встраивании бел-
ка в мембрану, но участвует в более широком кру-
Работа выполнена при финансовой поддержке
ге межмолекулярных взаимодействий. Разрабо-
Министерства науки и высшего образования РФ
танные в последние годы компьютерные методы
(№ БАЗ 0110/20-5-14АБ).
поиска, выявления и предсказания многофунк-
циональных белков [88, 89] показали, что в бел-
КОНФЛИКТ ИНТЕРЕСОВ
ковых взаимодействиях, участвующих в образо-
вании надмолекулярных комплексов и формиро-
Автор заявляет об отсутствии конфликта инте-
вании сигнальных и метаболических цепочек и
ресов.
сетей, важную роль играют внутренне неупорядо-
ченные участки белков (IDR). IDR широко рас-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
пространены у многих сигнальных белков и фак-
торов транскрипции [81, 90-95]. Часто они рас-
Настоящая работа не содержит описания ка-
полагаются на N- или C-концах полипептидной
ких-либо исследований с использованием людей
цепи. На сегодняшний день обнаружено более
и животных в качестве объектов.
БИОФИЗИКА том 65
№ 3
2020
МНОГОФУНКЦИОНАЛЬНЫЕ БЕЛКИ
477
СПИСОК ЛИТЕРАТУРЫ
30. F. M. Raushel, J. B. Thoden, and H. M. Holden, Ac-
counts Chem. Res. 36, 539 (2003).
1. G. W. Beadle and E. L.Tatum, Proc. Natl. Acad. Sci.
USA 27, 499 (1941).
31. N. K. Nagradova, FEBS Lett. 487, 327 (2001).
2. C. B. Anfinsen, Fed. Proc. 16, 783 (1957).
32. N. Nagradova, IUBMB Life 55, 459 (2003).
3. F. Moraes and A. Góes, Biochem. Mol. Biol. Educ. 44,
33. S. C. Goodchild, P. M. G. Curmi, and L. J. Brown,
215 (2016).
Biophys Rev. 3, 143 ( 2011).
4. UniProt Consortium. UniProt: a hub for protein infor-
34. M. A. Sirover, Biochim. Biophys. Acta - Gen. Subj.
mation. Nucl. Acids Res. 43 (Database issue), D204
1810, 741 (2011).
(2015).
35. M. A. Sirover, Cancer Metastas. Rev. 37, 665 (2018).
5. S. K. Burley, H. M. Berman, G. J. Kleywegt, et al.,
36. H. He, M. Lee, L. L. Zheng, et al., Biosci. Rep. 33,
Methods Mol. Biol. 1607, 627 (2017).
e00018 (2013).
6. F. E. Regnier and J. H. Kim, Anal. Chem. 90, 361
37. M. R. White and E. D. Garcin, Subcell. Biochem. 83,
(2018).
413 (2017).
7. O. I. Kiseleva, A. V. Lisitsa, and E. V. Poverennaya,
38. V. M. Boradia, M. Raje, and C. I. Raje, Biochem. Soc.
Mol. Biol. (Moskow) 52, 394 (2018).
Transact. 42, 1796 (2014).
8. S. Y. Chen, C. Li, X. Jia, and S. J. Lai, Int. J. Mol. Sci.
39. M. Schneider, J. Knuesting, O. Birkholz, et al., BMC
20, E3834 (2019).
Plant Biol. 18, 184 (2018).
9. M. L. Tress, F. Abascal, and A. Valencia, Trends Bio-
40. T. Hildebrandt, J. Knuesting, C. Berndt, et al., Biol.
chem. Sci. 42, 98 (2017).
Chem. 396, 523 (2015).
10. K. V. Nguyen, Biomol. Concepts 6, 11 (2015).
41. M. A. Sirover, J. Biochem. Cell Biol. 57, 20 (2014).
11. Multitasking Proteins DataBase (moonlighting pro-
42. P. S. Knoepfler, Cancer Res. 67, 5061 2007.
43. M. Fisher, Oncogen 36, 3943 (2017).
12. M. Mani, C. Chen, V. Amblee, et al., Nucl. Acids Res.
44. M. G. Myers, Science 323, 723 (2009).
43, D277 (2015).
13. C. J. Jeffery, Philos. Trans. R. Soc. Lond. B. Biol. Sci.
45. A. Subramaniam, M. K. Shanmugam, E. Perumal,
373, 1738 (2018).
et al., Biochim. Biophys. Acta 1835, 46 (2013).
14. C. J. Jeffery, J. Proteomics 134, 19 (2016).
46. J. Sgrignani, M. Garofalo, M. Matkovic, et al., Int. J.
Mol.
Sci.
19,
E1591
(2018).
DOI:
15. K. W. Min, S. H. Lee, and S. J. Baek, Cancer Lett. 370,
10.3390/ijms19061591
108 (2016).
47. B. T. MacDonald, K. Tamai, and X. He, Dev. Cell 17,
16. S. D. Copley, Bioessays 34, 578, (2012).
9 (2009).
17. B. Henderson and A. C. Martin, Biochem. Soc. Trans.
48. Y. Xing, K. Takemaru, J. Liu, et al., Structure 16, 478
42, 1671 (2014).
(2008).
18. C. E. Chapple and C. Brun. Oncotarget 6, 16812
(2015).
49. C. J. Gottardi and M. Peifer, Structure 16, 336 (2008).
19. F. Wan, D. E. Anderson, R. A. Barnitz, et al., Cell 131,
50. M. Napoli and E. R. Flores. Br. J. Cancer 116, 149
9279 (2007).
(2017).
20. 20. B. Pertschy, Microb. Cell 4, 140 (2017).
51. V. Marcel, F. Nguyen Van Long, and J. J. Diaz, Can-
cers (Basel) 10, E152 (2018).
21. X. Gao and P. R. Hardwidge, Front. Microbiol. 2, 137
(2011).
52. F. M. Simabuco, M. G. Morale, I. C. B. Pavan, et al.,
Oncotarget 9, 23780 (2018).
22. T. H. Kim, P. Leslie, and Y. Zhang, Oncotarget 5, 860
(2014).
53. K. D. Sullivan, M. D. Galbraith, Z. Andrysik, and
J. M. Espinosa, Cell Death Differ. 25, 133 (2018).
23. D. Alvarez-Paggi, L. Hannibal, M. Castro, et al.,
Chem. Rev. 117, 13382 (2017).
54. B. J. Aubrey, G. L. Kelly, A. Janic, et al., Cell Death
Differ. 25, 104 (2018).
24. M. Zhou, Y. Li, Q. Hu, et al., Genes Dev. 29, 2349
(2015).
55. S. Nicolai, A. Rossi, N. Di Daniele, et al., Aging (NY)
25. L. Dorstyn, C. W. Akey, and S. Kumar, Cell Death Dif-
7, 1050 (2015).
fer. 25, 1194 (2018).
56. L. J. Hofseth, S. P. Hussain, and C. C. Harris, Trends
26. Y. P. Ow, D. R. Green, Z. Hao, and T. W. Mak, Nat.
Pharmacol. Sci. 25, 177 (2004).
Rev. Mol. Cell. Biol. 9, 532 (2008).
57. C. Culmsee and M. P. Mattson, Biochem. Biophys.
27. A. Oberst, C. Bender, and D. R. Green, Cell Death
Res. Commun. 331, 761 (2005).
Differ. 15, 1139 (2008).
58. C. Wan, X. Ma, S. Shi, et al., Toxicol. Appl. Pharma-
28. H-X. Zhou, S. T. Wlodek, and J. A. McCammon,
col. 281, 294 (2014).
Proc. Natl. Acad. Sci. USA 95, 9280 (1998).
59. D. B. Wang, C. Kinoshita, Y. Kinoshita, and
29. H.-X. Zhou and J. A. McCammon, Trends Biochem.
R. S. Morrison, Biochim. Biophys. Acta 1842, 1186
Sci. 35, 179.10.007 (2010).
(2014).
БИОФИЗИКА том 65
№ 3
2020
478
УЗДЕНСКИЙ
60. Q. Dai, T. T. Luo, S. C. Luo, et al., J. Bioenerg.
78. N. E. Lidor, Y. Field, Y. Lubling, et al., Genome Res.
Biomembr. 48, 337 (2016)
20, 1361 (2010).
61. E. Åberg, F. Saccoccia, M. Grabherr, et al., BMC Evol.
79. F. Cui and V. B. Zhurkin, Nucl. Acids Res. 42, 836
(2014).
Biol. 17, 177 (2017).
80. Y. Pan, C. J. Tsai, B. Ma, and R. Nussinov, Trends
62. A. C. Joerger and A. R. Fersht, Annu. Rev. Biochem.
Genet. 26, 75 (2010).
85, 375 (2016).
81. J. Liu, N. B. Perumal, C. J. Oldfield, et al., Biochemis-
63. V. Gottifredi and C. Prives, Science 292, 1851 (2001).
try 45, 6873 (2006).
64. P. Bonini, S. Cicconi, A. Cardinale, et al., J. Neurosci.
82. J. P. Kruse and W. Gu, Cell 137, 609 (2009).
Res. 75, 83 (2004).
83. S. D. Copley, Biochem. Soc. Trans. 42, 1684 (2014).
65. S. Rashi-Elkeles, R. Elkon, S. Shavit, et al., Mol. On-
84. W. Lu, V.I. Gelfand. Trends Cell Biol. 27, 505 (2017).
col. 5, 336 (2011).
85. B. Henderson, Biochem. Soc. Trans. 42, 1720 (2014).
66. R. Parlato and G. Kreiner, J. Mol. Med. (Berl.) 91, 541
86. C. Gancedo, C. L. Flores, and J. M. Gancedo, Bio-
(2013).
chem. Soc. Trans. 42, 1715 (2014).
67. S. J. Woods, K. M. Hannan, R. B. Pearson, and
87. M. A. Fares, Biochem. Soc. Trans. 42, 1709. (2014).
R. D. Hannan, Biochim. Biophys. Acta - Gene Regu-
88. C. E. Chapple, B. Robisson, L. Spinelli, et al., Nat.
latory Mechanisms 1849, 821 (2015).
Commun. 6, 7412 (2015).
68. M. Kitayner, H. Rozenberg, N. Kessler, et al., Mol.
89. G. Hu, Z. Wu, V. N. Uversky, and L. Kurgan, Int. J.
Cell. 22, 741 (2006).
Mol. Sci. 18, 2761 (2017).
69. E. Fadda and M. G. Nixon, Phys. Chem. Chem. Phys.
90. L. M. Iakoucheva, C. J. Brown, J. D. Lawson, et al., J.
19, 21287 (2017).
Mol. Biol. 323, 573 (2002)
70. A. C. Joerger and A. R. Fersht, Cold Spring Harb. Per-
91. R. van der Lee, M. Buljan, B. Lang, et al., Chem. Rev.
spect. Biol. 2, a000919 (2010). DOI: 10.1101/cshper-
114, 6589 (2014).
spect.a000919.
92. N. S. Latysheva, T. Flock, R. J. Weatheritt, et al., Prot.
71. A. C. Joerger and A. R. Fersht, Annu. Rev. Biochem.
Sci. 24, 909 (2015).
77, 557 (2008).
93. A. Balcerak, A. Trebinska-Stryjewska, R. Konopinski,
72. Y. Pan and R. Nussinov, J. Biol. Chem. 282, 691(2007).
et al., Open Biol.
9,190096
(2019).
DOI:
73. Y. S. Tan, Y. Mhoumad, and C. S. Verma. J. Mol. Cell
10.1098/rsob.190096
Biol. 11, 306 (2019).
94. E. A. Lemke, J. Mol. Biol. 428 (10, Pt A), 2011 (2016).
74. Y. Pan and R. Nussino, J. Mol. Recognit. 23, 232
95. N. N. Sluchanko and D. M. Bustos. Prog. Mol. Biol.
(2010).
Transl. Sci. 166, 19 (2019).
75. K. McKinney, M. Mattia, V. Gottifredi, and C. Prives,
96. A. Zanzoni, D. M. Ribeiro, and C. Brun, Cell Mol.
Mol. Cell. 16, 413 (2004).
Life Sci. 76, 4407 (2019).
76. A. Tafvizi, F. Huang, A. R. Fersht, et al., Proc. Natl.
97. R. J. Weatheritt, N. E. Davey, and T. J. Gibson, Nucl.
Acad. Sci. USA 108, 563 (2011).
Acids Res. 40, 7123 (2012).
77. A. Murata, Y. Itoh, E. Mano, et al., Biophys. J. 112,
98. K. Van Roey, B. Uyar, R. J. Weatheritt, et al., Chem.
2301 (2017).
Rev. 114, 6733 (2014).
Multifunctional Proteins
А.B. Uzdensky
Ivanovsky Academy of Biology and Biotechnologies, Southern Federal University,
prosp. Stachki 194/1, Rostov-on-Don, 344090 Russia
A surprisingly small number of human genes (19-20 thousand) are not consistent with a much larger number
of proteins and the number of their functions. One of the factors of functional diversity is protein multifunc-
tionality. Important subgroups of such proteins are moonlighting proteins, in which single polypeptide chain
serves two or more functions under different conditions. They are often abundant housekeeping proteins: ri-
bosomal proteins and other glycolytic enzymes. This review article deals with the aspect of structures and
functions of some of these proteins such as ribosomal protein S3, cytochrome c, glyceraldehyde-6-phosphate
dehydrogenase, and STAT3, β-catenin and p53 proteins as transcription factors. Shifting balance of protein
synthesis, utilization and degradation, protein localization-dependent changes, post-translational modifica-
tions play important role in switching protein functions. It was shown that the internal intrinsically disordered
protein regions are significant in the formation of intermolecular complexes with other proteins and nucleic
acids. The appearance of multifunctional proteins during evolution is discussed.
Keywords: multifunctional proteins; cytochrome c; GAPDH; β-catenin; STAT3; p53
БИОФИЗИКА том 65
№ 3
2020