БИОФИЗИКА, 2020, том 65, № 3, с. 486-492
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 535.8 + 547.8/963
ИССЛЕДОВАНИЕ МОЛЕКУЛЯРНЫХ МЕХАНИЗМОВ
ВЗАИМОДЕЙСТВИЯ ТЕРАГЕРЦОВОГО ИЗЛУЧЕНИЯ
С БИОПОЛИМЕРАМИ НА ПРИМЕРЕ БЫЧЬЕГО
СЫВОРОТОЧНОГО АЛЬБУМИНА
© 2020 г. Е.Ф. Немова*, ***, О.П. Черкасова*, Н.А. Николаев*, **, Г.Г. Дульцева***
*Институт лазерной физики СО РАН, 630090, Новосибирск, просп. Лаврентьева, 13/3
E-mail: endy.endy@gmail.com
**Институт автоматики и электрометрии СО РАН, 630090, Новосибирск, просп. Академика Коптюга, 1
***Институт химической кинетики и горения им. В.В. Воеводского СО РАН,
630090, Новосибирск, ул. Институтская, 3
Поступила в редакцию 29.11.2019 г.
После доработки 29.11.2019 г.
Принята к публикации 17.02.2020 г.
Методом ЭПР-спектроскопии в присутствии спиновой ловушки и спинового зонда исследовано
влияние терагерцового излучения на функциональную активность бычьего сывороточного альбу-
мина. Применение рН-чувствительной имидазолиновой спиновой ловушки позволило зафиксиро-
вать изменение прочности связывания альбумина с оксидом азота. При помощи спинового зонда,
образующегося непосредственно в водном растворе альбумина из предшественника - дигидропи-
разиндиоксида, - показано, что под воздействием терагерцового облучения изменяются интенсив-
ность и ширина линий в спектре ЭПР спинового зонда, что свидетельствует об изменении числа и
подвижности парамагнитных центров. Наблюдаемые изменения соотнесены со структурными ха-
рактеристиками реакционных центров бычьего сывороточного альбумина - функциональных
групп аминокислот, входящих в состав белка.
Ключевые слова: терагерцовое излучение, бычий сывороточный альбумин, ЭПР-спектроскопия, спино-
вая ловушка, спиновый зонд, конформация.
DOI: 10.31857/S0006302920030072
на фибробласты [7]. Интерес к изучению биоло-
Терагерцовое излучение охватывает спек-
гических эффектов терагерцового излучения свя-
тральный диапазон от 0.1 до 10 ТГц, располагаясь
зан с тем, что у многих биологических полимеров
между микроволновой и инфракрасной областя-
частоты колебательно-вращательных переходов
ми [1]. Это излучение поглощается водой, и одни
из первых примеров биомедицинских примене-
лежат в этой спектральной области. Энергии
ний этого излучения были связаны со слежением
кванта терагерцового излучения недостаточно
за изменениями содержания воды в биологиче-
для разрыва даже слабых водородных связей, по-
ских объектах [2]. Проводились исследования
этому не приходится ожидать прямого химиче-
биологических эффектов терагерцового излуче-
ского действия излучения в этом диапазоне.
ния на клеточном уровне [3] и на уровне организ-
Энергетически область терагерцового излучения
ма [4]. Так, например, сообщалось об обнаруже-
соответствует коллективным колебательно-вра-
нии влияния терагерцового излучения на измене-
щательным переходам, и именно в изменениях
ние числа мутаций у дрозофил после
конформаций сложных молекул могут быть при-
предварительной обработки гамма-излучением
чины экспериментально наблюдавшегося влия-
[5]. Было обнаружено влияние терагерцового из-
ния терагерцового излучения на биообъекты, хо-
лучения на ДНК человеческих лейкоцитов [6] и
тя детальные молекулярные механизмы такого
влияния остаются малоизученными. Механизмы
Сокращения: БСА
- бычий сывороточный альбумин, влияния терагерцового излучения необходимо
ДПДО - 1,4-дигидропиразиндиоксид, ЭПР - электрон-
изучать на всех уровнях организации биологиче-
ный парамагнитный резонанс, ПМИО - 1,2,2,5,5-пента-
метил-3-имидазолин-3-оксид.
ской материи: от молекул до клеток и целого ор-
486
ИССЛЕДОВАНИЕ МОЛЕКУЛЯРНЫХ МЕХАНИЗМОВ
487
ганизма. Так, было исследовано изменение от-
= 100 фс
2
клика в терагерцовой области в зависимости от
F=80МГц
степени окисления для цитохрома с [8], изучалось
1
связывание белков с лигандами [9, 10], влияние
на гибкость структуры белка c рассмотрением
3
коллективных структурных переходов [11], а так-
же влияние на динамику сольватации пептидов
[12].
Данная работа базируется на результатах
0.2
1.5
ТГц
предыдущих исследований влияния терагерцово-
= 20 мВт
Р
Объект
го излучения на конформации пептидов [13, 14].
t = 60 мин
В этих работах было обнаружено влияние облуче-
ния белковых препаратов на последующую ад-
сорбцию кислорода на реакционных центрах мо-
лекулы белка. Было высказано предположение,
что одной из причин такого действия излучения
может быть вызванное облучением изменение
конформации белковой молекулы, приведшее к
изменению стерических условий для доступа мо-
лекулы кислорода к реакционным центрам. В на-
ПК
стоящей работе сделана попытка изучить молеку-
лярный механизм влияния терагерцового излуче-
ния на транспортные свойства бычьего
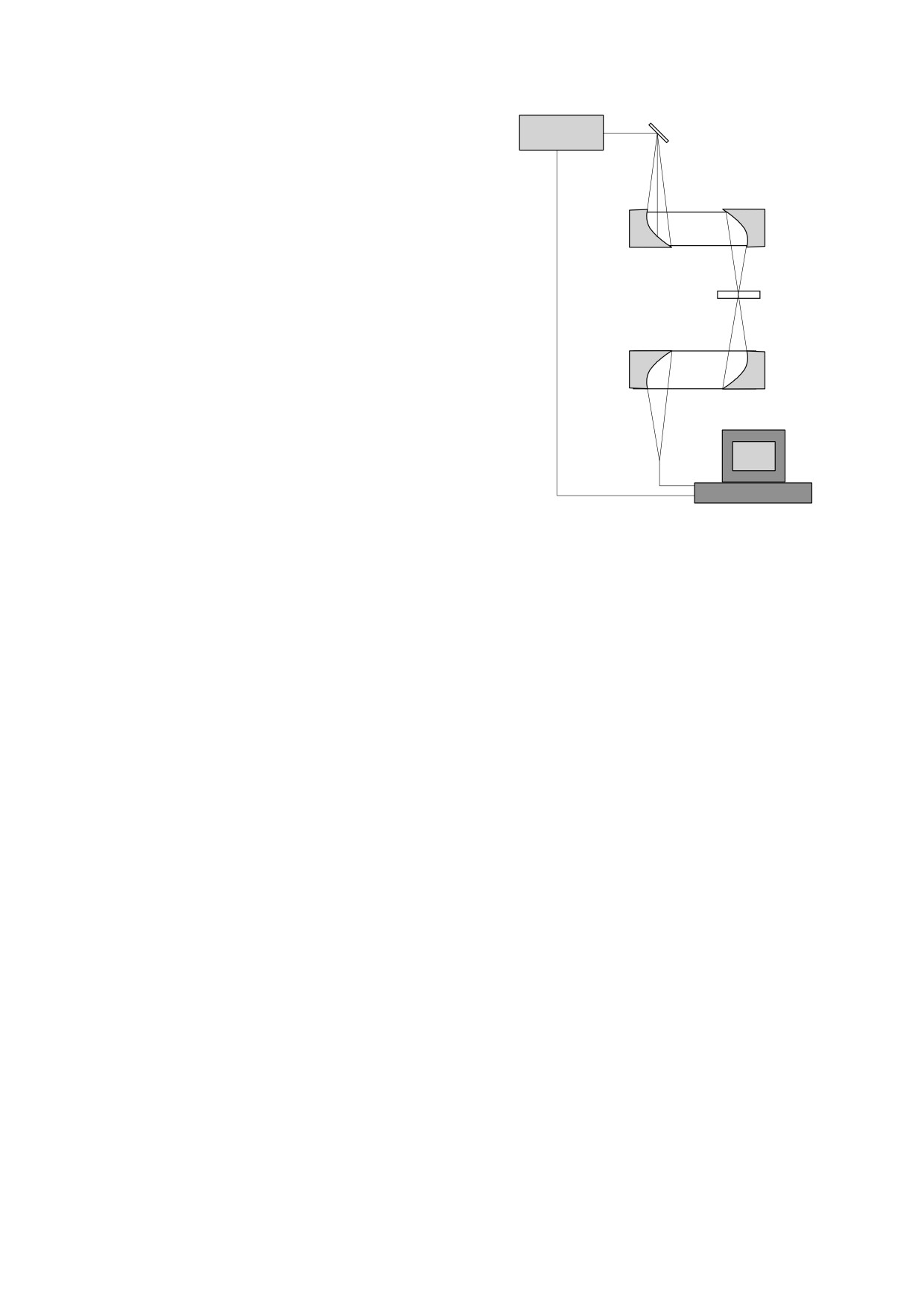
Рис. 1. Схема установки для облучения пленочных
образцов бычьего сывороточного альбумина: 1 -
сывороточного альбумина (БСА) - водораство-
фемтосекундный волоконный лазер, 2 - кристалл
римого глобулярного белка, структура и свойства
InSb для генерации терагерцового излучения, 3 -
которого хорошо изучены.
оптическая схема терагерцового спектрометра.
Альбумины выполняют в организме в основ-
ном транспортные функции: перенос липидов,
ского кварца. Нанесенную каплю распределяли
билирубина, жирных кислот, аминокислот,
покровным стеклом по поверхности подложки,
ионов металлов [15]. Альбумины в крови также
затем образец высушивали в токе воздуха при ат-
связываются с лекарственными веществами и
мосферном давлении и комнатной температуре.
осуществляют их перенос к органам. При выпол-
Относительная влажность воздуха при нанесении
нении белком транспортной функции важна воз-
и сушке образца поддерживалась на уровне не
можность обратимой адсорбции, так как перено-
выше 40%. Образцы хранили в эксикаторе над
симый компонент должен связаться с белком до-
обезвоженным силикагелем. Толщина получен-
статочно прочно, чтобы переместиться с белком
ных пленок составляет 1-3 мкм, как было показа-
по кровотоку, но затем должна осуществиться де-
но эллипсометрическими измерениями [16].
сорбция переносимого компонента в органе-ми-
шени. Для адсорбции, помимо размерного соот-
Облучение пленочных образцов проводили на
ветствия реагирующего фрагмента биомолекулы
установке, схема которой приведена на рис. 1.
и лиганда, важна трехмерная структура адсорбци-
Подробнее установка была описана ранее [17].
онного центра, поэтому ясно, что изменения
Источник терагерцового излучения работает в
конформации молекулы белка могут приводить к
импульсном режиме. Длительность импульса -
существенным изменениям биологической ак-
2-3 пс, частота следования ~ 80 МГц, спектр из-
тивности. В данной работе исследовано влияние
лучения 0.2-1.5 ТГц, пиковая мощность 20 мВт.
терагерцового излучения на изменение прочно-
Длительность облучения исследуемого объекта
сти связывания БСА с оксидом азота.
составляла 60 мин. Все образцы готовили парами:
экспериментальный и контрольный. Контроль-
МАТЕРИАЛЫ И МЕТОДЫ
ный образец находился в тех же условиях, что и
В работе изучали пленочные препараты лио-
экспериментальный, но его не облучали. В пред-
филизированного БСА (Sigma-Aldrich, США),
варительных опытах было показано при помощи
приготовленные нанесением 50 мкл водного рас-
контроля температуры пленки в процессе облуче-
твора белка с концентрацией 1 мг/мл на предва-
ния, а также при помощи нагревания контроль-
рительно очищенную подложку из кристалличе-
ных образцов до заданной температуры, что вли-
БИОФИЗИКА том 65
№ 3
2020
488
НЕМОВА и др.
(а)
(б)
10000
10000
8000
8000
6000
6000
4000
4000
2000
2000
0
0
2000
2000
4000
4000
6000
6000
8000
8000
10000
10000
3380
3400
3420
3440
3460
3480
3380
3400
3420
3440
3460
3480
Магнитная индукция, Гс
Магнитная индукция, Гс
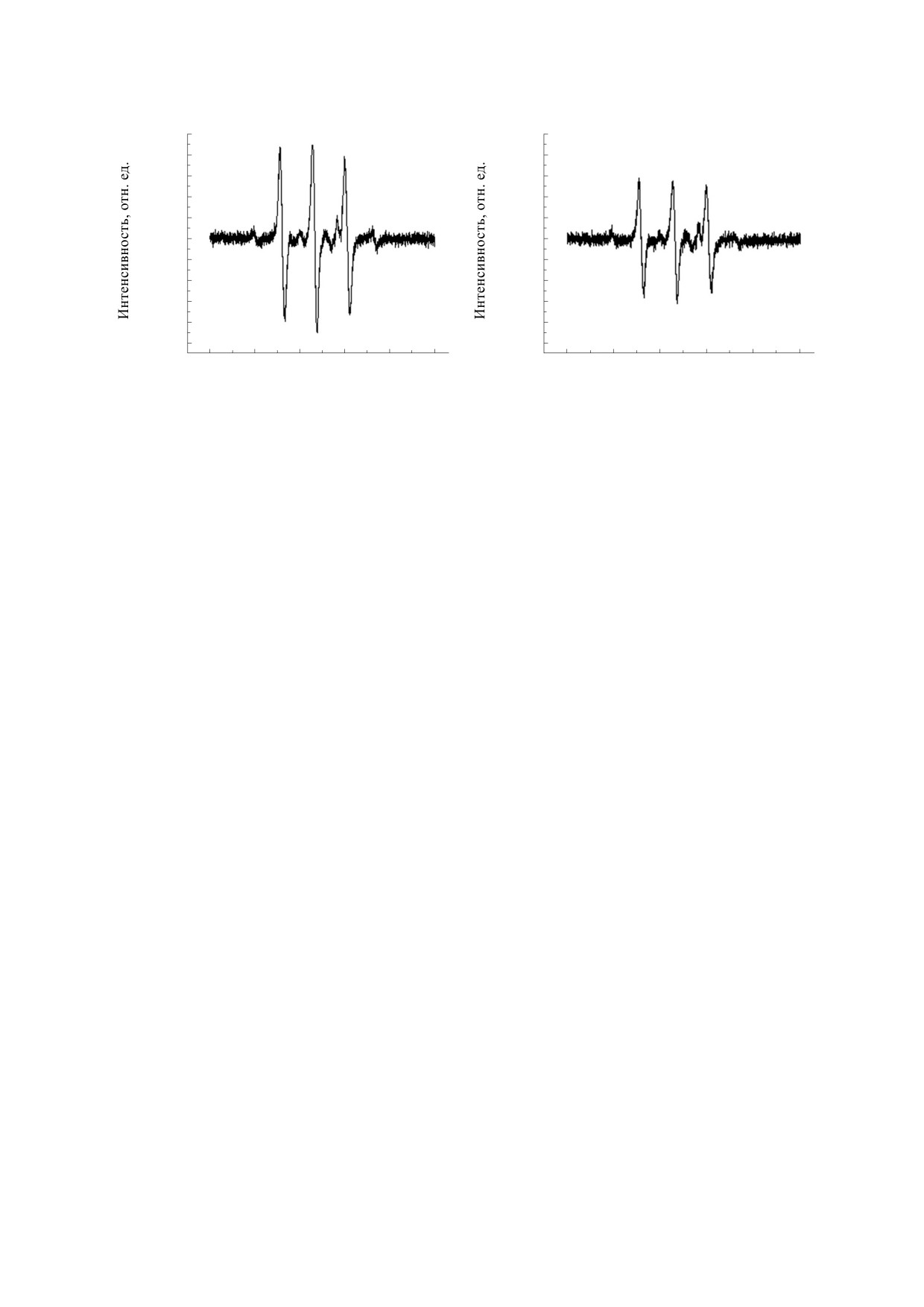
Рис. 2. Спектры ЭПР нитроксильного радикала, образовавшегося из дигидропиразиндиоксида в присутствии
облученного (а) и необлученного (б) бычьего сывороточного альбумина.
яние облучения на химические свойства пленки
ции составляла 0.3-1.0 Гс, частота модуляции
не связано с ее нагревом [16].
100 кГц, усиление 1 ⋅ 104-5.6 ⋅ 105, постоянная
времени 0.2 с, развертка 100 Гс/200 с, микровол-
В качестве предшественника спинового зонда
новая частота 9.6 ГГц. Константы сверхтонкого
использовали органическое соединение класса
расщепления определяли с точностью не менее
динитронов, синтезированное в Новосибирском
0.02 Гс. Количественные измерения интенсивно-
институте органической химии (НИОХ СО
сти сигнала ЭПР проводили при помощи внеш-
РАН),
- 1,4-дигидропиразиндиоксид (ДПДО)
него стандарта - кристалла дифенилпикрилгид-
[18]. Концентрация соединения в растворе для
разида, прикрепленного к внешней стороне
исследования методом электронного парамаг-
плоской кварцевой ампулы для ЭПР-спектроско-
нитного резонанса (ЭПР) составляла 7 мМ. Для
пии водных растворов.
оценки адсорбции кислорода на реакционных
центрах молекулы БСА и для определения ло-
Расчет структуры реакционных центров и
кальных изменений рН вблизи центров адсорб-
оценку выигрыша энергии при адсорбции кисло-
ции оксида азота применяли имидазолиновый
рода и оксида азота на функциональных центрах
нитрон - 1,2,2,5,5-пентаметил-3-имидазолин-3-
БСА проводили при помощи программы CS
оксид (ПМИО), также синтезированный в НИОХ
Chem 3D Pro, версия 5.0 (Cambridge Soft Corpora-
СО РАН [18]. Перед использованием это соедине-
tion, Великобритания). В программе используют-
ние очищали возгонкой при пониженном давле-
ся расчетные методы MNDO, AM1, PM3, а также
нии. Концентрация ПМИО в растворе для иссле-
MM2 [19].
дования методом ЭПР составляла 2 мМ.
Оксид азота (II) получали по реакции нитрита
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
натрия с хлоридом железа (II) в присутствии со-
ляной кислоты (все реактивы - квалификации
Образование парамагнитных центров в присут-
«х.ч.»). Реакцию проводили в круглодонной трех-
ствии предшественника спинового зонда (1,4-ди-
гидропиразиндиоксида). Было обнаружено, что
горлой колбе, соединенной с буферной емкостью
диамагнитное соединение ДПДО в водных рас-
для получения равномерного потока газа. После
творах альбумина частично превращается в нит-
обработки пленочного препарата альбумина в по-
роксильный радикал, который легко зарегистри-
токе газообразного оксида азота пленку смывали
ровать методом ЭПР-спектроскопии. Этот сиг-
дистиллированной водой (500 мкл) в стандарт-
нал представляет собой триплет с константой
ную ампулу для ЭПР-спектроскопии водных рас-
сверхтонкого расщепления aN = 14.7 Гс (рис. 2).
творов, приливали раствор спиновой ловушки и
При помощи внешнего стандарта интенсивности
производили запись спектров ЭПР.
было проведено сравнение интенсивностей сиг-
Спектры ЭПР записывали на приборе Bruker
налов ЭПР нитроксильного радикала, образовав-
ЕМХ (Bruker, Германия). Микроволновая мощ-
шегося из ДПДО в растворе альбумина, облучен-
ность не превышала 10 мВт. Амплитуда модуля-
ного терагерцовым излучением, и в растворе не-
БИОФИЗИКА том 65
№ 3
2020
ИССЛЕДОВАНИЕ МОЛЕКУЛЯРНЫХ МЕХАНИЗМОВ
489
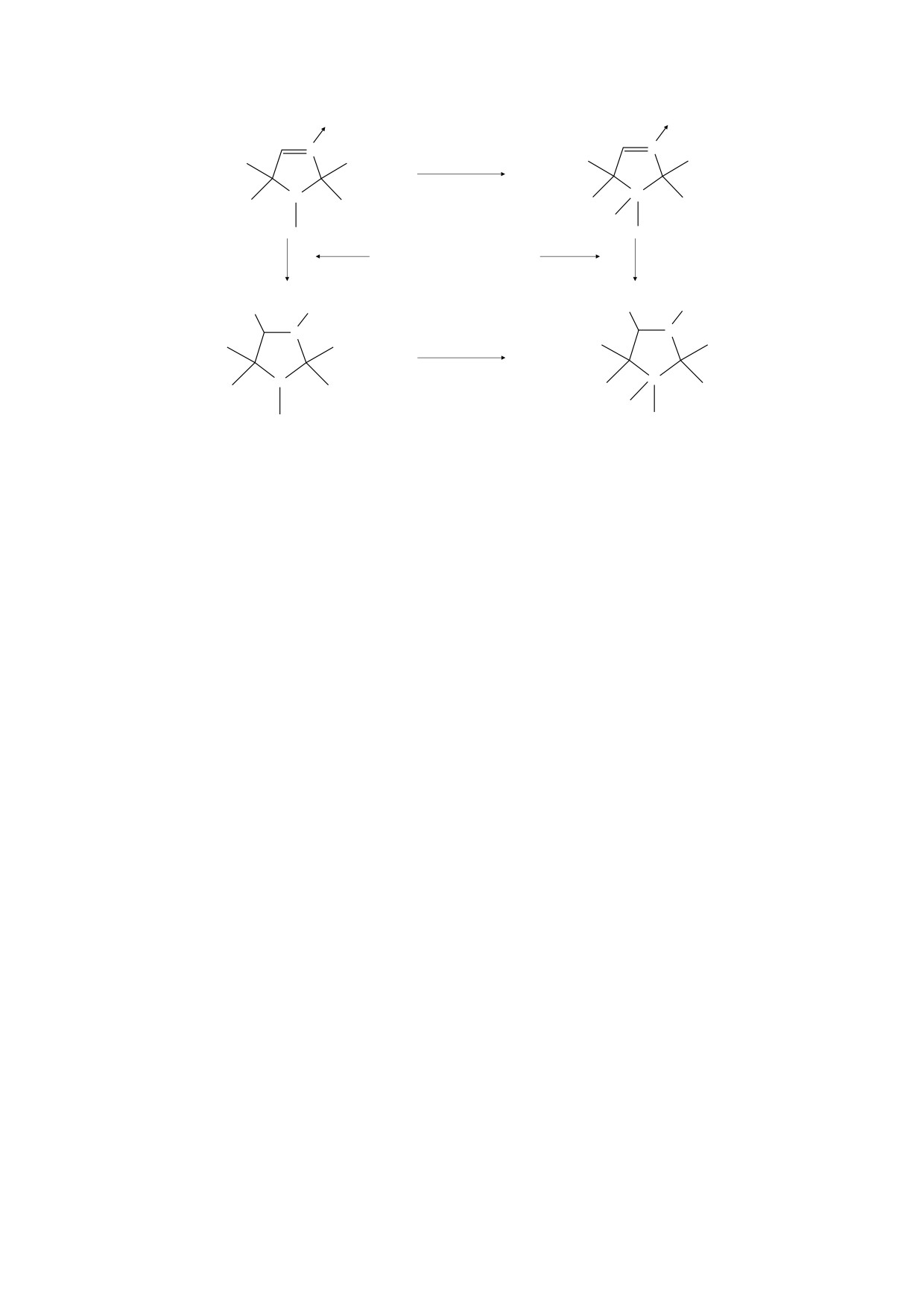
O
O
N
N
H+
Протонирование
+
N
N
H
Спиновое улавливание
R*
R*
R
O*
R
O*
N
N
Протонирование
Iпр
Iр
+
H+
N
N
H
Рис. 3. Схема протонирования и спинового улавливания для спиновой ловушки 1,2,2,5,5-пентаметил-3-имидазолин-
3-оксида.
облученного альбумина. Сравнение показало, что
[20]. Таким образом, терагерцовое излучение вы-
интенсивность сигнала в первом случае пример-
зывает некоторое изменение конформации моле-
но в 1.6 раза больше, чем во втором. Это означает,
кулы альбумина, а это приводит к увеличению
что число возникающих парамагнитных центров
адсорбции кислорода на реакционных центрах
больше в случае облученного альбумина. Было
белка. Следует отметить, что зависимость окис-
также отмечено, что ширина линий в спектре
лительных свойств от облучения в терагерцовом
ЭПР ДПДО в присутствии облученного БСА
диапазоне для альбуминов ранее не была опи-
(2.14 ± 0.02 Гс) больше, чем в случае необлученно-
сана.
го (1.81 ± 0.02 Гс). Как видим, различие составляет
Взаимодействие бычьего сывороточного альбу-
около 15%. Ширина линии в спектре ЭПР связа-
мина с оксидом азота (II). Оксид азота NO контро-
на с подвижностью парамагнитного центра: если
лирует многие функции в различных клетках ор-
подвижность велика, то происходит сужение ли-
ганизма, кроме того, было установлено, что это
нии. Таким образом, видно, что парамагнитные
соединение играет роль внутриклеточного мес-
центры, возникающие в присутствии облученно-
сенджера. Обзор результатов изучения многооб-
го альбумина, менее подвижны по сравнению с
разных биологических функций оксида азота
необлученным.
представлен, например, в работах [21, 22]. Одним
В предположении, что образованию парамаг-
из свойств NO является его способность образо-
нитных центров способствует адсорбция кисло-
вывать комплекс с альбумином. Для изучения
рода на группах альбумина, было проведено мо-
связывания БСА с оксидом азота NO пленочные
делирование энергетики процесса адсорбции при
препараты альбумина обрабатывали потоком га-
помощи программы CS Chem 3D Pro. При моде-
зообразного оксида азота, выделяющегося в от-
лировании искали положения атомов, отвечаю-
дельном реакционном сосуде при взаимодей-
щие локальным минимумам потенциальной
ствии хлорида железа (II) с нитритом натрия в
энергии. Было показано, что наибольший выиг-
присутствии соляной кислоты. Оксид азота -
рыш энергии дает адсорбция кислорода на сульф-
парамагнитная молекула, во многих реакциях ве-
гидрильных группах, а также на пирролидиновом
дущая себе как свободный радикал. Для исследо-
цикле, который является частью пролинового
вания описанной реакционной системы была
фрагмента структуры белка. Эти группы полярны
использована спиновая ловушка класса имидазо-
и участвуют в образовании водородных связей,
лин-оксидов (ПМИО), обладающая чувствитель-
стабилизирующих пространственное строение
ностью к рН среды. Это свойство позволяет
молекулы альбумина. Ранее было показано, что в
использовать ловушку для измерения рН в мик-
результате облучения альбумина терагерцовым
роокружении радикального центра. Чувствитель-
излучением изменяется число альфа-спиралей, в
ность спиновой ловушки к кислотности среды
образовании которых решающая роль принадле-
определяется наличием в ее молекуле аминного
жит как раз пролиновому фрагменту, который
атома азота, способного к протонированию. Бы-
обеспечивает резкий изгиб полипептидной цепи
ло показано, что ловушка эффективно улавливает
БИОФИЗИКА том 65
№ 3
2020
490
НЕМОВА и др.
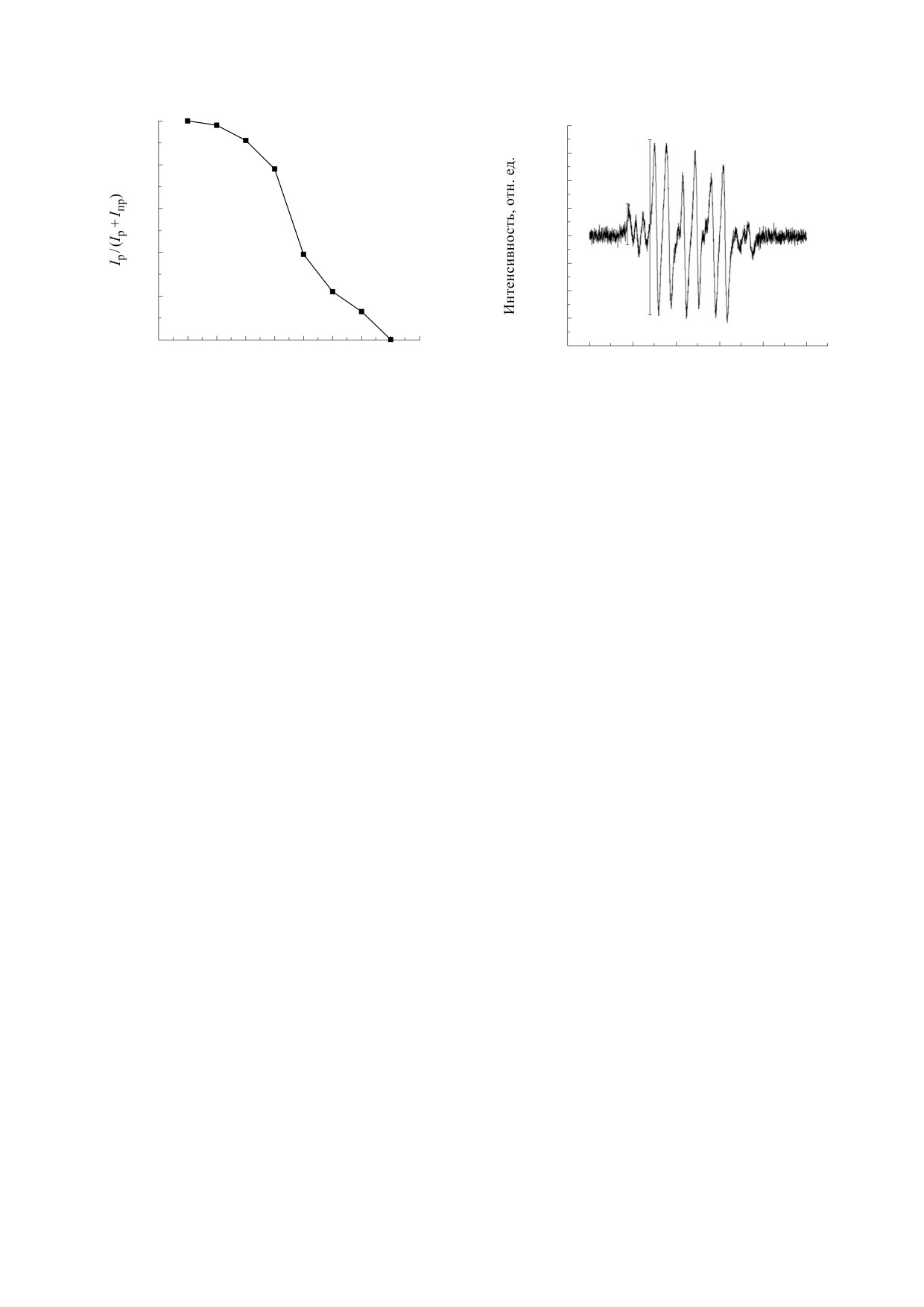
1.0
Iр
I /Iрпр
8000
6000
0.8
4000
I
пр
0.6
2000
0
0.4
2000
4000
0.2
6000
0.0
8000
2.5
3.0
3.5
4.0
4.5
5.0
5.5
6.0
6.5
7.0
3380
3400
3420
3440
3460
3480
pH
Магнитная индукция, Гс
Рис. 5. Спектр ЭПР, содержащий сигналы от прото-
Рис. 4. Кривая титрования спиновой ловушки
нированной и непротонированной форм спинового
1,2,2,5,5-пентаметил-3-имидазолин-3-оксида.
аддукта.
короткоживущие свободные радикалы как в про-
творе создает кислую среду, что приводит к про-
тонированной форме, так и в непротонирован-
тонированию ловушки. Таким образом, чем
ной. Схема процессов протонирования и спино-
сильнее наблюдаемое закисление, тем выше кон-
вого улавливания приведена на рис. 3. Параметры
центрация диоксида азота в растворе. В случае
спектров ЭПР протонированных и непротониро-
облученного альбумина конверсия NO → NO2
ванных спиновых аддуктов различаются, причем
идет быстрее, а значит, под действием терагерцо-
в области рН от 3 до 6 в спектрах ЭПР наблюдают-
вого излучения связывание оксида азота с альбу-
ся оба аддукта. По отношению интенсивности Ip
мином ослабевает.
сигнала, соответствующего протонированному
Таким образом, на основании полученных ре-
спиновому аддукту, к сумме интенсивностей сиг-
зультатов можно предположить, что вызываемые
налов протонированного Ip и непротонирован-
терагерцовым излучением колебательно-враща-
ного Inp аддуктов Ip/(Ip + Inp) удалось построить
тельные переходы в молекуле БСА частично сни-
кривую титрования для ловушки в водном рас-
мают стерические затруднения для адсорбции
творе, в котором кислотность среды формирова-
кислорода на функциональных группах БСА, со-
ли добавками соляной кислоты и едкого натра и
держащих азот и серу, облегчая тем самым ад-
измеряли лабораторным рН-метром. Полученная
сорбционное взаимодействие с кислородом. Вто-
кривая титрования приведена на рис. 4. Измерив
ричная и третичная структуры взаимозависимы
в спектре ЭПР спинового аддукта ловушки
от адсорбции кислорода, поскольку обусловлены
ПМИО величину Ip/(Ip + Inp), можно при помо-
водородными связями, которые участвуют и в ад-
щи кривой титрования оценить величину рН.
сорбционных взаимодействиях [23]. Для реализа-
ции экспериментально обнаруженного уменьше-
Пример спектра, содержащего сигналы одно-
ния связывания оксида азота с реакционными
временно протонированного и непротонирован-
центрами БСА под действием терагерцового об-
ного спиновых аддуктов, показан на рис.
5.
лучения должен быть облегчен доступ оксида азо-
Были получены отношения интенсивностей
та к окислительным центрам, на которых адсор-
Ip/(Ip + Inp) для облученного БСА 0.27 ± 0.02 (что
бирован кислород. Моделирование показало, что
приблизительно соответствует рН 5.3) и для необ-
для этого необходим конформационный переход
лученного - 0.17 ± 0.03 (рН ~ 5.6). Таким образом,
с участием азотсодержащих гетероциклов и
при помощи кривой титрования было установле-
тиольных групп.
но, что взаимодействие облученного альбумина с
оксидом азота приводит к более сильному ло-
Для того чтобы понять природу конформаци-
кальному закислению, чем необлученного. Обра-
онного перехода, вызываемого в молекуле БСА
зование кислоты в растворе происходит за счет
терагерцовым излучением, результаты квантово-
присутствия диоксида азота, который является
химического исследования были дополнены мо-
продуктом окисления NO кислородом воздуха и
делированием пространственной структуры пу-
кислородом, адсорбированным на группах альбу-
тем последовательного «отключения» функцио-
мина. Присутствие диоксида азота в водном рас-
нальных групп, участвующих в ее формировании.
БИОФИЗИКА том 65
№ 3
2020
ИССЛЕДОВАНИЕ МОЛЕКУЛЯРНЫХ МЕХАНИЗМОВ
491
Это позволило определить группы, вовлеченные
СПИСОК ЛИТЕРАТУРЫ
в наблюдаемый конформационный переход.
1. Y.-S. Lee, Principles of Terahertz Science and Technolo-
Ключевым структурным звеном, обеспечиваю-
gy (Springer-Verlag, USA, 2009).
щим конформационный переход, оказался про-
линовый фрагмент. По-видимому, терагерцовое
2. M. Van Exter, C. Fattinger, and D. Grischkowsky, Opt.
излучение возбуждает вращательные моды в пет-
Lett. 14, 1128 (1989).
лях, связанных с пролиновыми звеньями БСА
3. В. И. Федоров, Д. С. Сердюков, О. П. Черкасова
[23]. Для экспериментального подтверждения по-
и др., Оптич. журн. 84 (8), 9 (2017).
лученных результатов предлагается подобрать ли-
ганды для селективного связывания функцио-
4. I. Ilina, D. S. Sitnikov, and M. B. Agranat, High Tem-
нальных групп в этих петлях и исследовать влия-
perature 56 (5), 789 (2018).
ние такого связывания на конформационный
5. В. И. Федоров, А. С. Погодин, Т. Д. Дубатолова
переход.
и др., Биофизика 46 (2), 298 (2001).
6. A. A. Angeluts, A. B. Gapeyev, M. N. Esaulkov, et al.,
ВЫВОДЫ
Quantum Electronics 44 (3), 247 (2014).
Показано, что облучение пленочных препара-
7. G. J. Wilmink, B. D. Rivest, C. C. Roth, et al., Lasers
тов альбумина терагерцовым излучением приво-
Surg. Med. 44, 152 (2011).
дит к увеличению адсорбции кислорода на реак-
ционных центрах альбумина и ослаблению свя-
8. J.-Y. Chen, J. R. Knab, J. Cerne, et al., Phys. Rev. E 72
зывания альбумина с оксидом азота. При помощи
(4), 040901 (2005).
квантовохимического моделирования были вы-
9. J. Chen, J. Knab, S. Ye, et al., Appl. Phys. Lett. 90,
явлены участки первичной структуры альбумина,
243901 (2007).
обеспечивающие эффективную адсорбцию кис-
лорода: -SH, -S-S-, =NH, атом азота пирроли-
10. О. П. Черкасова, В. И. Федоров, Е. Ф. Немова и
А. С. Погодин, Оптика и спектроскопия 107 (4),
динового гетероцикла. Моделирование про-
566 (2009).
странственной структуры показало, что причи-
ной наблюдаемых явлений может быть
11. B. Born, S. J. Kim, S. Ebbinghaus, et al., Faraday Dis-
конформационный переход с участием пролино-
cuss. 141, 161 (2009).
вого фрагмента.
12. B. Born, H. Weinga¨rtner, E. Bru¨ndermann, et al., J.
Am. Chem. Soc. 131, 3752 (2009).
БЛАГОДАРНОСТИ
13. E. F. Nemova, O. P. Cherkasova, and V. I. Fedorov,
Авторы благодарят Центр коллективного
Proc. SPIE 7993, 799325-1 (2010).
пользования «Спектроскопия и оптика» Инсти-
14. O. P. Cherkasova, V. I. Fedorov, E. F. Nemova, et al.,
тута автоматики и электрометрии СО РАН за
Proc. SPIE 6727, 672721-1 (2007).
предоставленный источник терагерцового излу-
15. А. Farrugia, Transfusion Med. Rev. 24 (1), 53 (2010).
чения.
16. А. В. Капралова и А. С. Погодин, Вестн. НГУ. Сер.
Физика 5 (4), 182 (2010).
ФИНАНСИРОВАНИЕ РАБОТЫ
17. В. Д. Анцыгин, А. А. Мамрашев, Н. А. Николаев
Исследования выполнены в рамках государ-
и др., Автометрия 46 (3), 110 (2010).
ственной программы Министерства науки и выс-
шего образования Российской Федерации
18. G. G. Dultseva, G. I. Skubnevskaya, A. Ya. Tikhonov,
(АААА-А17- 117030310290-5).
et al., J. Phys. Chem., 100 (44), 17523 (1996).
19. F. N. Dultsev and G. G. Dultseva, Chem. Engineer.
Sci. 1 (2), 17 (2013).
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта
20. V. M. Govorun, V. E. Tretiakov, N. N. Tulyakov, et al.,
Int. J. Infrared Millimeter Waves 12 (12), 1469 (1991).
интересов.
21. A. C. Pereira, M. Paulo, A. V. Araujo, et al., Braz. J.
Med. Biol. Res. 44 (9), 947 (2011).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
22. А. Ф. Ванин. Успехи физ. наук, 170 (4), 455 (2000).
Настоящая работа не содержит описания ка-
ких-либо исследований с использованием людей
23. В. И. Федоров, Н. Я. Вайсман, Е. Ф. Немова и др.
и животных в качестве объектов.
Биофизика 58 (6), 1043 (2013).
БИОФИЗИКА том 65
№ 3
2020
492
НЕМОВА и др.
Investigation of the Molecular Mechanisms of the Interaction between Terahertz
Radiation and Biopolymers: A Case Study on Bovine Serum Albumin
E.F. Nemova*, ***, O.P. Cherkasova*, N.A. Nikolaev*, **, and G.G. Dultseva***
*Institute of Laser Physics, Siberian Branch of the Russian Academy of Sciences,
prosp. Lavrentyeva 13/3, Novosibirsk, 630090 Russia
**Institute of Automation and Electrometry, Siberian Branch of the Russian Academy of Sciences
, prosp. Akademika Koptyuga 1, Novosibirsk, 630090 Russia
***Voevodsky Institute of Chemical Kinetics and Combustion, Siberian Branch of the Russian Academy of Sciences,
Institutskaya ul. 3, Novosibirsk, 630090 Russia
Electron paramagnetic resonance spin trapping and spin probing techniques were used to investigate the ef-
fect of terahertz radiation on the functional activity of bovine serum albumin. Using a pH-sensitive imidaz-
oline spin trap it was possible to detect changes in the binding strength of nitrogen oxide to albumin. With the
help of a spin probe formed directly in the aqueous solution of albumin from a dihydropyrazine dioxide pre-
cursor it was shown that terahertz radiation causes changes in the signal intensity and widths of EPR spectral
lines of the spin probe, which is the evidence of changes in the number and mobility of paramagnetic centers.
The observed changes were compared to the structural characteristics of reaction centers in bovine serum al-
bumin—functional groups of amino acids incorporated into the protein.
Keywords: terahertz radiation, bovine serum albumin, EPR spectroscopy, spin trap, spin probe, conformation
БИОФИЗИКА том 65
№ 3
2020