БИОФИЗИКА, 2020, том 65, № 3, с. 493-503
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 678+544.34;544.45;544.47;577.15;577.34
МАГНИТНО-ИЗОТОПНЫЕ ЭФФЕКТЫ МАГНИЯ И ЦИНКА
В ФЕРМЕНТАТИВНЫХ РЕАКЦИЯХ ГИДРОЛИЗА АТФ,
КАТАЛИЗИРУЕМЫХ МОЛЕКУЛЯРНЫМИ МОТОРАМИ
© 2020 г. В.К. Кольтовер*, Р.Д. Лабынцева**, В.К. Карандашев***
*Институт проблем химической физики РАН,
142432, Черноголовка Московской области, просп. Академика Семенова, 1
**Институт биохимии им. А.В. Палладина НАН Украины, 01030, Киев, ул. Леонтовича, 9, Украина
***Институт проблем технологии микроэлектроники и особо чистых материалов РАН,
142432, Черноголовка Московской области, ул. Академика Осипьяна, 6
E-mail: koltover@icp.ac.ru
Поступила в редакцию 30.11.2019 г.
После доработки 04.03.2020 г.
Принята к публикации 06.03.2020 г.
Изучено влияние различных изотопов магния и цинка на ферментативную активность субфрагмен-
та-1 миозина. В реакционной среде с магнитным изотопом магния (25Mg) скорость ферментативно-
го гидролиза АТФ вдвое выше, чем в среде с немагнитными изотопами (24Mg или 26Mg). Аналогич-
ный магнитно-изотопный эффект обнаружен в экспериментах с изотопами цинка в качестве ко-
фактора фермента. Скорость ферментативного гидролиза АТФ c магнитным изотопом цинка (67Zn)
на 40-50% выше, чем с немагнитными изотопами (64Zn или 68Zn). Магнитно-изотопные эффекты
наблюдаются при физиологической концентрации (5 мМ) хлоридов магния и цинка. Каталитиче-
ский эффект магнитного изотопа магния выявлен также в экспериментах с Mg-зависимой АТФазой
плазматических мембран миометрия. Магнитно-изотопный эффект свидетельствует о том, что в хе-
момеханическом процессе, катализируемом «молекулярным мотором» за счет энергии гидролиза
АТФ, имеется лимитирующая стадия, зависимая от электронного спинового состояния, и что ядер-
ный спин изотопа ускоряет эту стадию. Обсуждаются механизмы ядерного спинового катализа.
Ключевые слова: ядерный спиновый катализ, миозин, АТФазная активность, биомолекулярные моторы,
бионадежность, магнитно-изотопный эффект, магний, цинк.
DOI: 10.31857/S0006302920030084
па - немагнитные (I = 0). Известно также, что
Клетки и ткани состоят из атомов химических
магнитные изотопы создают внутренние магнит-
элементов, многие их которых имеют два типа
ные поля, которые на расстояниях порядка дли-
стабильных изотопов - магнитные и немагнит-
ны химической связи могут превышать в 10-
ные. Например, магний имеет три стабильных
100 раз магнитное поле Земли (≈0.05 мТ) [1].
изотопа, 24Mg, 25Mg и 26Mg, с относительным со-
Недавно, в экспериментах с живыми клетка-
держанием 78.7, 10.1 и 11.2% соответственно. Изо-
ми, обогащенными магнитным изотопом магния,
топ 25Mg - магнитный, так как его атомное ядро
были обнаружены магнитно-изотопные эффекты
имеет ядерный спин (I = 5/2), создающий маг-
(МИЭ). Например, активность антиоксидантно-
нитное поле; изотопы 24Mg и 26Mg - немагнит-
го фермента супероксиддисмутазы в клетках
ные, так как их ядра не имеют ядерного спина
E. coli, выросших на среде, обогащенной 25Mg, на
(I = 0) и соответственно не создают магнитное
40% ниже, чем в клетках, выросших на среде, обо-
поле. Другой распространенный в живой природе
гащенной немагнитным изотопом магния [2].
элемент, цинк, имеет пять стабильных изотопов -
Клетки дрожжей S. cerevisiae, обогащенные маг-
64Zn, 66Zn, 67Zn, 68Zn и 70Zn с относительным со-
нитным изотопом магния, восстанавливаются
держанием соответственно 48.6, 27.9, 4.1, 18.8 и
после облучения коротковолновым ультрафиоле-
0.6%. Из них 67Zn - магнитный изотоп (имеет
товым светом или ионизирующей радиацией в
ядерный спин, I = 5/2); остальные четыре изото-
два раза быстрее, чем клетки, обогащенные не-
магнитным изотопом магния [3]. В работах на-
Сокращениe: МИЭ - магнитно-изотопные эффекты.
шей группы был впервые обнаружен МИЭ маг-
493
494
КОЛЬТОВЕР и др.
ния в реакции гидролиза АТФ, катализируемой
Sn, Sb, Te, Cs, Ba, La, Ce, Pr, Nd, Sm, Eu, Gd, Tb,
одним из важнейших «молекулярных моторов»
Dy, Ho, Er, Tm, Yb, Lu, Hf, Ta, W, Re, Os, Ir, Pt, Au,
биоэнергетики - миозином [4, 5].
Hg, Tl, Pb, Bi, Th и U определяли методом масс-
спектрометрии с индуктивно связанной плазмой
В настоящей работе представлены результаты
с использованием спектрометра X-Series II (Ther-
наших экспериментов, в которых изучалась
mo Scientific, США) по методикам, описанным
АТФ-гидролазная активность биомолекулярных
ранее [7]. Определение Li, B, Al, P, V, Mn, Cu, Zn,
моторов в присутствии, в качестве кофактора
Sr и Ba двумя независимыми методами позволяло
фермента, различных изотопов магния и цинка. В
контролировать правильность проведения анализа
экспериментах с миозином обнаружены значи-
в каждом образце [7].
тельные по величине эффекты ускорения фер-
ментативного гидролиза магнитными изотопами
Биохимические эксперименты были выполне-
ны в отделе биохимии мышц Института биохи-
магния и цинка, по сравнению с немагнитными
мии им. А.В. Палладина НАН Украины (Киев,
изотопами того же элемента (ядерный спиновый
Украина). Субфрагмент-1 миозина получали из
катализ). Небольшой каталитический эффект
гладкой мышцы (миометрия) свиней по стан-
магнитного изотопа магния выявлен также в экс-
периментах с Mg-АТФазой, изолированной из
дартной методике [8, 9]. Субфрагмент-1 миозина
плазматических мембран миометрия.
считается достаточной функциональной едини-
цей миозина, поскольку сохраняет все его натив-
ные свойства, а именно каталитическую АТФ-
МАТЕРИАЛЫ И МЕТОДЫ
гидролазную активность и способность взаимо-
действовать с актином [8-10]. Mg2+-зависимая
В работе использовали оксиды магния 24MgO,
АТФаза плазматической мембраны («базальная
25MgO и 26MgO с изотопным обогащением 99.9,
Са2+-независимая Mg2+-АТРаза») была получена
98.8 и 97.7 атом. % и оксиды цинка 64ZnO, 67ZnO,
из гладкой мышцы по методике, описанной в ра-
ботах [11, 12]. АТФ-гидролазную активность фер-
и 68ZnO, с изотопным обогащением 99.3, 94.2 и
ментов измеряли при температуре 37°C по коли-
98.9 атом. % соответственно производства ФГУП
«Электрохимприбор» (Россия). Из этих оксидов
честву неорганического фосфата (Pi), отщеплен-
ного при гидролизе АТФ [13]. В основе этого
были приготовлены растворы хлоридов, 24MgCl2,
метода («метод Фиске-Суббароу») лежит реак-
25MgCl2, 26MgCl2, 64ZnCl2, 67ZnCl2, 68ZnCl2, с ис-
ция неорганического фосфата с молибдатом ам-
пользованием концентрированной HCl аналити-
мония в присутствии аскорбиновой кислоты как
ческой чистоты по стандартной методике [6].
восстановителя, в результате которой образуется
Хлориды магния и цинка природного изотопного
окрашенный комплекс в количестве, пропорцио-
состава (MgCl2, ZnCl2) и другие реактивы, ис-
нальном количеству Pi, образованного при гидро-
пользованные в настоящей работе, были произ-
лизе АТФ [13]. Экспериментальные данные ана-
ведены компаниями Sigma-Aldrich (США), Perkin
лизировали с использованием стандартных мето-
Elmer (США) и Merck (Германия).
дов дисперсионного анализа (ANOVA) и
программ MS Office и Statistica 4.5.
Концентрации магния и цинка в исходных
растворах измеряли методом атомно-эмиссион-
ной спектроскопии с индуктивно связанной
РЕЗУЛЬТАТЫ
плазмой, после чего все растворы выравнивали
Результаты анализа изотопного состава реак-
по концентрации ионов соответственно магния и
ционных сред для измерений гидролиза АТФ
цинка. Изотопные составы растворов магния и
представлены в табл. 1 (эксперименты с различ-
цинка, а также их элементный состав определяли
методами масс-спектрометрии с индуктивно свя-
ными изотопами магния) и табл. 2 (эксперимен-
занной плазмой и атомно-эмиссионной спектро-
ты с различными изотопами цинка). Результаты
свидетельствуют о высокой степени изотопного
скопии с индуктивно связанной плазмой в
обогащения реакционных сред соответственны-
Аналитическом центре Института проблем тех-
нологии микроэлектроники и особочистых мате-
ми изотопами магния (24Mg, 25Mg или 26Mg) и
риалов РАН (Черноголовка Московской обла-
цинка (64Zn, 67Zn или 68Zn).
сти). Содержание примесных элементов Li, B,
Результаты измерений АТФ-гидролазной ак-
Na, Mg, Al, P, S, K, Ca, V, Mn, Fe, Cu, Zn, Sr и Ba
тивности субфрагмента-1 миозина в средах с раз-
определяли методом атомно-эмиссионной
личными изотопами магния представлены на
спектроскопии с индуктивно связанной плазмой
рис. 1а. Активность определяли в стандартной ре-
с использованием спектрометра iCAP-6500 Duо
акционной среде, содержавшей 5 мМ (физиоло-
(Thermo Scientific, США). Содержание Li, B, Be,
гическая концентрация) хлорида магния, а имен-
Al, P, Sc, Ti, V, Cr, Mn, Co, Ni, Cu, Zn, Ga, Ge, As,
Se, Br, Rb, Sr, Y, Zr, Nb, Mo, Ru, Rh, Pd, Ag, Cd, In,
но: 24MgCl2, 25MgCl2, 26MgCl2 или MgCl2 природ-
БИОФИЗИКА том 65
№ 3
2020
МАГНИТНО-ИЗОТОПНЫЕ ЭФФЕКТЫ МАГНИЯ И ЦИНКА
495
Таблица 1. Изотопный состав магния в реакционных средах для измерений гидролиза АТФ
Изотопное обогащение, %
Изотоп
24MgCl
25MgCl2
26MgCl2
MgCl2
2
24Mg
99.7 ± 0.1
0.17 ± 0.02
0.16 ± 0.03
79.2 ± 0.4
1.3 ± 0.1
98.2 ± 0.2
0.46 ± 0.1
10.1 ± 0.1
25Mg
1.1 ± 0.1
0.22 ± 0.1
98.7 ± 0.3
10.7 ± 0.2
26Mg
Примечание. Растворы содержали 20 мМ трис-НСl (pH 7.2), 0,01 мМ CaCl2, 100 мМ KCl, 3 мМ АТФ и 5 мМ хлорида
магния, соответственно, природного изотопного состава (MgCl2), 24MgCl2, 25MgCl2 и 26MgCl2. Представлены средние
значения ± среднее квадратичное отклонение (m ± SD); число независимых измерений в каждом растворе n = 5.
Таблица 2. Изотопный состав цинка в реакционных средах для измерений гидролиза АТФ Ф
Изотопное обогащение, %
Изотоп
64ZnCl
2
67ZnCl2
68ZnCl2
64Zn
99.2 ± 0.1
0.74 ± 0.02
0.48 ± 0.02
66Zn
0.54 ± 0.04
1.6 ± 0.02
0.42.2 ± 0.02
67Zn
0.063 ± 0.009
93.9 ± 0.1
0.27 ± 0.01
0.20 ± 0.01
3.7 ± 0.03
98.8 ± 0.1
68Zn
0.006 ± 0.001
0.045 ± 0.003
0.027 ± 0.004
70Zn
Примечание. Растворы содержали 20 мМ трис-НСl (pH 7.2), 0,01 мМ CaCl2, 100 мМ KCl, 3 мМ АТФ и 5 мМ хлорида цинка,
соответственно, 64ZnCl2, 67ZnCl2 и 68ZnCl2. Представлены средние значения ± среднее квадратичное отклонение (m ± SD);
число независимых измерений в каждом растворе n = 5.
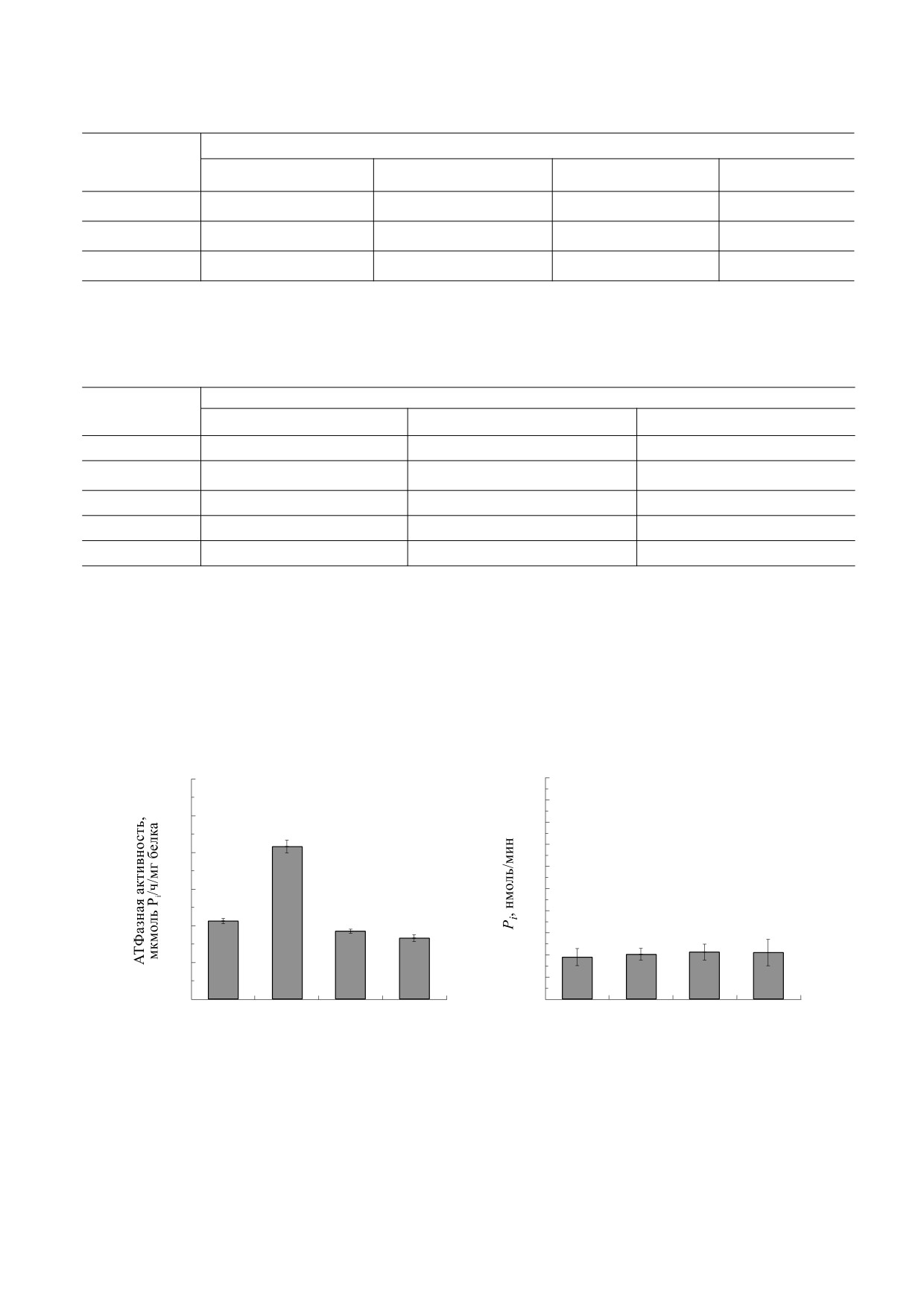
ного изотопного состава. Были выполнены три
этих препаратов выполняли от трех до восьми по-
независимые серии экспериментов с разными
второв с каждым изотопом магния и магнием
препаратами миозина, выделенными в разное
природного изотопного состава. Во всех экспери-
время из трех разных животных. С каждым из
ментальных сериях наблюдался один и тот же
(а)
(б)
120
100
100
80
80
60
60
40
40
20
20
0
0
25
26
25
26
24MgCl
2
MgCl
2
MgCl
2
MgCl2
24MgCl2
MgCl
2
MgCl
2
MgCl2
Рис. 1. (а) - АТФазная активность (m ± SD) субфрагмента-1 миозина (мкмоль Pi/ч/мг белка) в реакционных средах с
различными изотопами магния. Растворы содержали 20 мМ трис-НСl (pH 7.2), 0.01 мМ CaCl2, 100 мМ KCl, 3 мМ АТФ,
субфрагмент-1 миозина (20 мкг белка/мл) и 5 мМ хлорида магния, соответственно 24MgCl2, 25MgCl2, 26MgCl2 и MgCl2
природного изотопного состава. Различия между средними значениями в экспериментах с магнитным изотопом 25Mg
и средними значениями в экспериментах с немагнитными изотопами магния статистически достоверны при P < 0.01.
(б) - Неферментативный гидролиз АТФ в водных растворах с 24MgCl2, 25MgCl2, 26MgCl2 и MgCl2 природного
изотопного состава. По данным работы [4].
БИОФИЗИКА том 65
№ 3
2020
496
КОЛЬТОВЕР и др.
260
160
140
220
120
180
100
140
80
100
0
6
60
40
20
20
5/0
4/1
3/2
2/3
1/4
0/5
0
Mg
64Zn
67Zn
68Zn
Соотношение
24
Mg
и
25
Mg
Рис. 3. АТФазная активность субфрагмента-1 миози-
Рис. 2. АТФазная активность субфрагмента-1 миози-
на в реакционных средах, содержащих различные
на как функция доли содержания магнитного изото-
изотопы цинка. Растворы содержали 20 мМ трис-НСl
па магния, 25Mg, в реакционном растворе. Данные
(pH 7.2), 0.01 мМ CaCl2, 100 мМ KCl, 3 мМ АТФ, суб-
(m ± SD) представлены в процентах к активности при
фрагмент-1 миозина (20 мкг белка/мл) и 5 мМ хлори-
5 мМ 24MgCl2, принятой за 100%.
да цинка, соответственно
64ZnCl2,
67ZnCl2 или
68ZnCl2. Данные (m ± SD, n = 3) представлены в про-
центах к ферментативной активности в присутствии
магнитно-изотопный эффект, а именно: актив-
5 мМ MgCl2 природного изотопного состава, приня-
ность фермента в присутствии магнитного изото-
той за 100%. Различия между средними значениями в
па (25Mg) была в два-два с половиной раза выше,
экспериментах с магнитным изотопом, 67Zn, и сред-
чем активность фермента в присутствии немаг-
ними значениями в экспериментах с немагнитными
изотопами цинка статистически достоверны при
нитного изотопа (24Mg или 26Mg). При этом не
P < 0.05.
было обнаружено существенных различий актив-
ности фермента в экспериментах с немагнитны-
ми изотопами магния. Важно отметить, что МИЭ
изотоп цинка) или 5 мМ 64ZnCl2, или 68ZnCl2 (не-
не наблюдается при неферментативном (спон-
магнитный изотоп цинка). Были выполнены две
танном) гидролизе АТФ. В реакционных средах
независимые серии экспериментов с фермента-
того же состава, содержавших все компоненты за
тивными препаратами, изолированными из двух
исключением фермента, величина скорости гид-
разных животных, не менее трех повторов с каж-
ролиза АТФ была одинаковой с 24MgCl2, 25Mg-
дым изотопом цинка в экспериментах с каждым
ферментативным препаратом. Результаты пред-
Cl2, 26MgCl2 и MgCl2 природного изотопного со-
става (рис. 1б). МИЭ наблюдается только при
ставлены на рис. 3. Известно, что ион Zn2+ в ка-
честве кофактора миозина менее эффективен,
ферментативном гидролизе АТФ.
чем Mg2+ [14, 15]. Действительно, активность
На следующем рисунке представлены резуль-
фермента в присутствии немагнитных ионов
таты измерений АТФ-гидролазной активности
цинка оказалась ниже, чем в присутствии ионов
того же фермента в реакционных средах, содер-
магния (рис. 3). В экспериментах с различными
жавших 25MgCl2 и 24MgCl2 в различных соотно-
немагнитными изотопами цинка различий в ско-
рости гидролиза АТФ нет. Однако с магнитным
шениях, т.е. доля магнитного изотопа (25Mg) в
растворе варьировала от 0 до 5 мМ, а доля немаг-
изотопом цинка (67Zn), скорость гидролиза АТФ
на 50-70% выше по сравнению со скоростью гид-
нитного (24Mg) соответственно от 5 до 0 мМ.
ролиза АТФ в присутствии немагнитных изото-
Можно видеть, что имеет место практически
пов цинка. Таким образом, в экспериментах с
линейный рост скорости гидролиза АТФ с ростом
изотопами цинка также обнаружен эффект уско-
доли содержания магнитного изотопа в реакци-
рения ферментативного гидролиза АТФ, анало-
онном растворе (рис. 2).
гичный МИЭ, ранее обнаруженному нами в экс-
В следующих экспериментах было изучено
периментах с изотопами магния.
влияние различных изотопов цинка на АТФ-гид-
ролазную активность субфрагмента-1 миозина.
Кроме экспериментов с миозином были вы-
Была использована стандартная реакционная
полнены эксперименты с Mg2+-зависимой АТФ-
среда, но содержавшая хлорид цинка вместо хло-
гидролазой плазматических мембран миометрия.
рида магния, а именно: 5 мМ 67ZnCl2 (магнитный
Этот фермент, так называемая «базальная Mg2+-
БИОФИЗИКА том 65
№ 3
2020
МАГНИТНО-ИЗОТОПНЫЕ ЭФФЕКТЫ МАГНИЯ И ЦИНКА
497
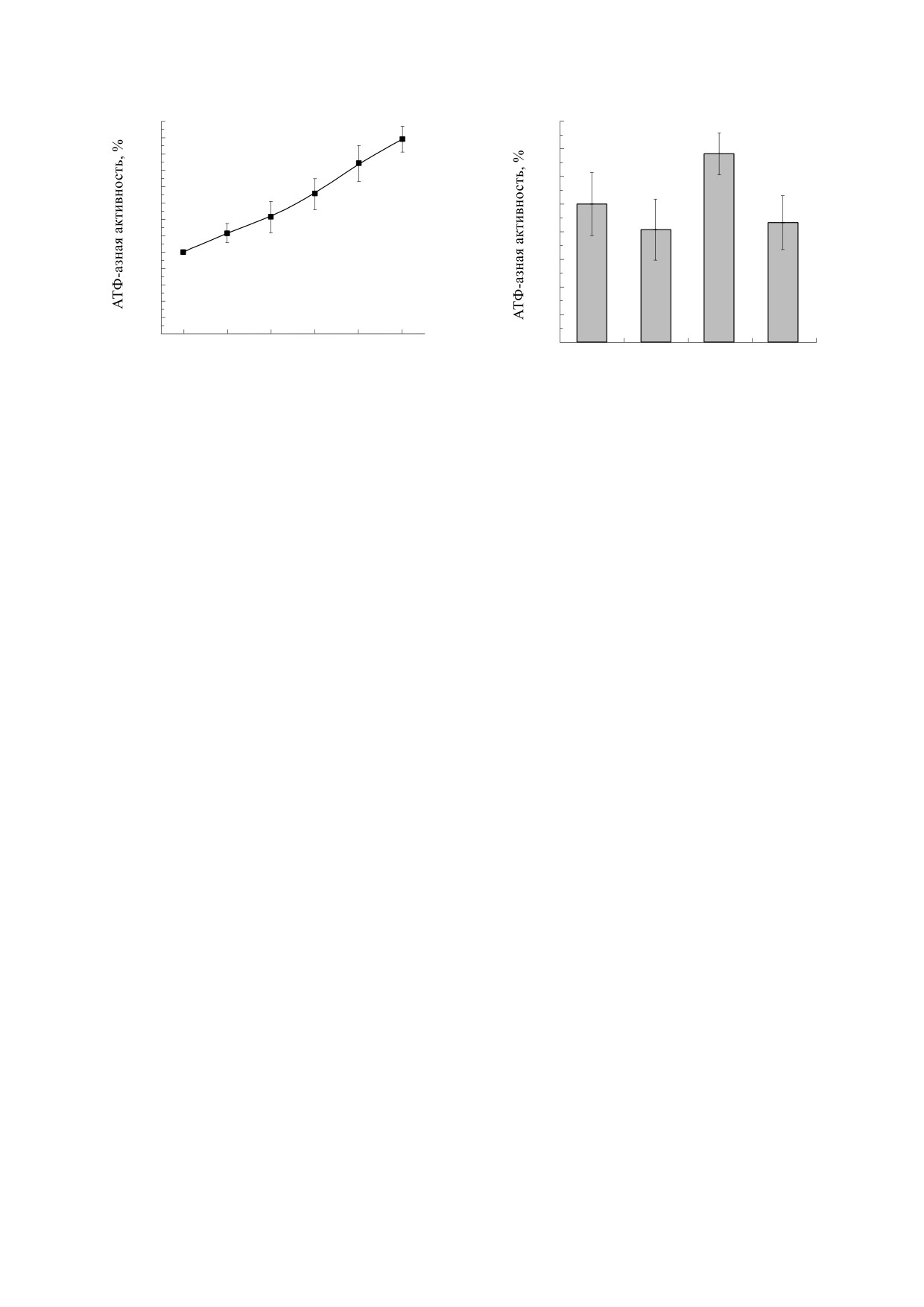
ние железа (Fe) в растворе с магнитным изотопом
25
магния (25Mg) почти в четыре раза больше, чем в
20
растворе с немагнитным изотопом (24Mg), но в
два с половиной раза меньше, чем в растворе с
другим немагнитным изотопом (26Mg). Между
15
тем активность фермента в растворе с немагнит-
ным изотопом 24Mg и в растворе с другим немаг-
0
1
нитным изотопом 26Mg практически одна и та же
и вдвое ниже, чем активность фермента в раство-
5
ре с магнитным изотопом магния. Аналогичным
образом исключается возможность влияния дру-
гих примесных элементов. Кроме того, следует
0
25
26
принять во внимание, что не только исходные ок-
MgCl
24MgCl2
MgCl
MgCl
2
2
2
сиды магния и цинка, но и другие реактивы, не-
обходимые для проведения экспериментов, так-
-зависимой АТФазы плазма-
Рис. 4. Активность Mg2+
же содержат примеси, которые вводятся в экспе-
тических мембран миометрия (мкмоль Pi/ч/мг белка)
риментальные среды, причем в количествах,
в реакционных средах с различными изотопами маг-
ния. Растворы содержали 50 мМ трис-HCl (pH 7.4),
значительно превышающих количества тех же
25 мМ NaCl, 125 мМ KCl, 0.1 мМ CaCl2, 0.1 мМ ЭГТА,
примесей, вводимые с гораздо меньшими добав-
10 мкг/мл белка, 3 мМ АТФ, 5 мМ хлорида магния,
ками магния и цинка.
соответственно природного изотопного состава,
24MgCl2, 25MgCl2 или 26MgCl2. Различия между сред-
ними значениями в экспериментах с магнитным изо-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
топом магния и в экспериментах с немагнитными
Таким образом, в наших экспериментах обна-
изотопами магния (m ± SD, n = 4) статистически до-
стоверны при P = 0.05.
ружены магнитно-изотопные эффекты. А имен-
но, ферментативный гидролиз АТФ, катализиру-
емый миозином, изолированным из миометрия,
АТРаза» или «Са2+-независимая Mg2+-АТРаза»,
и ферментативный гидролиз АТФ, катализируе-
мый Mg-зависимой АТФазой плазматических
играет важную роль в регулировании концентра-
мембран миоцитов, ускоряются ядерным спином
ции протонов вовне и внутриклеточном про-
магнитного изотопа. Имеет место ядерный спи-
странстве, а также в регулировании концентра-
новый катализ. Ранее аналогичный каталитиче-
ции ионов Са2+ в цитоплазме гладкомышечных
клеток [11, 12]. Были выполнены три независи-
ский эффект ядерного спина изотопа 25Mg, не-
большой, но статистически достоверный, был об-
мые серии экспериментов с препаратами этого
наружен в экспериментах по влиянию различных
фермента, выделенными из трех разных живот-
изотопов магния на гидролиз АТФ, катализируе-
ных. Типичные результаты представлены на
рис. 4. Скорость ферментативного гидролиза
мый H+-ATФазой (комплекс MF0F1), выделен-
АТФ в реакционной среде, содержащей магнит-
ной из митохондрий дрожжей и встроенной в ли-
ный изотоп 25Mg, в среднем на 15-20% выше, чем
посомы [16]. Не удалось, однако, обнаружить
в средах с немагнитными изотопами. Таким обра-
магнитно-изотопные эффекты в экспериментах
зом, и в этих экспериментах выявлен каталитиче-
по изучению влияния различных изотопов маг-
ский эффект магнитного изотопа магния.
ния на АТФ-зависимые реакции, катализируе-
мые креатин-фосфаткиназой [17] и люциферазой
Можно было бы предположить, что причиной
[17]. Складывается впечатление, что ядерный
обнаруженных магнитно-изотопных эффектов
спиновый катализ наблюдается в работе только
служит разное содержание примесей каких-либо
тех ферментов, которые выполняют функцию
посторонних элементов, поступающих в реакци-
молекулярного мотора, т.е. используют химиче-
онную среду с различными изотопами магния
скую энергию АТФ для выполнения механиче-
или, соответственно, цинка. Однако такое пред-
ской работы или полностью, как миозин, или хо-
положение исключается данными элементного
анализа сред, содержащих различные изотопы
тя бы частично, как митохондриальная H+-
ATФаза и Mg-зависимая АТФаза плазматических
магния (табл. 3) и цинка (табл. 4). Согласно дан-
мембран.
ным атомной эмиссионной спектрометрии и
масс-спектрометрии, элементный состав реакци-
В химической и молекулярной физике маг-
онных сред был одинаков при содержании при-
нитно-изотопные эффекты давно известны [19-
месных элементов не более нескольких микромо-
21]. В химии МИЭ проявляются в том, что ско-
лей на литр, независимо от типа изотопа магния
рость и выход продуктов реакции с участием сво-
или соответственно цинка. Например, содержа-
бодных радикалов и/или ион-радикальных пар
БИОФИЗИКА том 65
№ 3
2020
498
КОЛЬТОВЕР и др.
Таблица 3. Результаты анализа элементного состава реакционных сред с хлоридами различных изотопов магния
Предел
Элементный состав, мг/л
Элемент
определения (DL),
природный Mg
24Mg
25Mg
26Mg
мг/л
Li
0.00008
0.00027
0.00015
0.00017
0.00010
Be
0.00008
< DL
< DL
< DL
< DL
B
0.03
< DL
< DL
< DL
< DL
Na
0.3
158
149
135
137
Mg
0.1
154
159
142
139
Al
0.02
0.045
0.030
0.049
0.065
Si
0.3
0.17
0.17
0.15
0.13
P
0.5
224
229
227
230
S
2
< DL
< DL
< DL
< DL
K
0.3
6360
6247
6280
6313
Ca
0.7
2.0
2.0
2.4
2.1
Sc
0.001
< DL
< DL
< DL
< DL
Ti
0.02
< DL
< DL
< DL
< DL
V
0.002
< DL
< DL
< DL
< DL
Cr
0.02
< DL
< DL
< DL
< DL
Mn
0.003
0.029
0.031
0.037
0.080
Fe
0.1
< DL
< DL
< DL
< DL
Co
0.003
< DL
< DL
< DL
< DL
Ni
0.007
< DL
< DL
< DL
< DL
Cu
0.003
0.0056
0.0039
0.0067
0.011
Zn
0.009
0.065
0.050
0.070
0.063
Ga
0.001
< DL
< DL
< DL
< DL
Ge
0.002
< DL
< DL
< DL
< DL
As
0.002
< DL
< DL
< DL
< DL
Se
0.009
< DL
< DL
< DL
< DL
Br
0.3
2.2
2.4
2.6
2.6
Rb
0.0003
0.0860
0.0936
0.0950
0.0969
Sr
0.002
< DL
0.0029
0.0046
< DL
Y
0.0001
< DL
< DL
< DL
< DL
Zr
0.0001
0.0031
0.0013
0.0022
0.0028
Nb
0.0004
< DL
< DL
< DL
< DL
Mo
0.0003
0.0079
0.0093
0.0136
0.0168
Ru
0.0002
< DL
< DL
< DL
< DL
Rh
0.0002
< DL
< DL
< DL
< DL
Pd
0.0004
< DL
< DL
< DL
< DL
Ag
0.0002
0.00078
0.00068
0.00075
0.00109
Cd
0.0003
0.0037
0.0040
0.0043
0.0040
In
0.0001
< DL
< DL
< DL
< DL
Sn
0.0002
0.00081
0.00027
0.00063
0.00100
Sb
0.0002
< DL
< DL
< DL
< DL
Te
0.0002
< DL
< DL
< DL
< DL
Cs
0.00004
< ПО
0.00006
0.00008
0.0001
Ba
0.001
0.0040
0.0045
0.0045
0.0043
La
0.0002
< DL
< DL
< DL
< DL
Ce
0.0008
< DL
< DL
< DL
< DL
БИОФИЗИКА том 65
№ 3
2020
МАГНИТНО-ИЗОТОПНЫЕ ЭФФЕКТЫ МАГНИЯ И ЦИНКА
499
Таблица 3. Окончание
Предел
Элементный состав, мг/л
Элемент
определения (DL),
природный Mg
24Mg
25Mg
26Mg
мг/л
Pr
0.00002
< DL
< DL
< DL
< DL
Nd
0.0003
< DL
< DL
< DL
< DL
Sm
0.00002
< DL
< DL
< DL
< DL
Eu
0.000007
< DL
< DL
< DL
< DL
Gd
0.00001
< DL
< DL
< DL
< DL
Tb
0.00001
< DL
< DL
< DL
< DL
Dy
0.00001
< DL
< DL
< DL
< DL
Ho
0.00001
< DL
< DL
< DL
< DL
Er
0.00001
< DL
< DL
< DL
< DL
Tm
0.00001
< DL
< DL
< DL
< DL
Yb
0.00001
< DL
< DL
< DL
< DL
Lu
0.00001
< DL
< DL
< DL
< DL
Hf
0.0001
0.00120
0.00078
0.00062
0.00062
Ta
0.0002
< DL
< DL
< DL
< DL
W
0.0003
< DL
< DL
< DL
< DL
Re
0.00001
< DL
< DL
< DL
< DL
Os
0.00002
< DL
< DL
< DL
< DL
Ir
0.00001
< ПО
< ПО
< ПО
< ПО
Pt
0.00003
< DL
< DL
< DL
0.00067
Au
0.0001
< DL
< DL
< DL
< DL
Hg
0.0003
< DL
< DL
< DL
< DL
Tl
0.00001
0.0088
0.0091
0.0091
0.0094
Pb
0.0008
0.038
0.037
0.039
0.039
Bi
0.00003
0.00006
< DL
< DL
0.00004
Th
0.00002
0.00060
0.00036
0.00027
0.00025
U
0.00002
< DL
< DL
< DL
< DL
существенно изменяются в зависимости от того,
[20]. Известно, однако, что
реакция гидролиза
содержат ли исходные реагенты магнитный или
АТФ с образованием АДФ и Pi следует кислотно-
немагнитный изотоп одного и того же элемента.
основному механизму [22]. Соответственно, воз-
МИЭ - прямое следствие закона сохранения мо-
никновение ион-радикальной пары в качестве
мента импульса, в данном случае - электронного
интермедиата в этой реакции маловероятно. Дей-
углового момента. Суммарный электронный
ствительно, МИЭ не наблюдается в нефермента-
спин (S) продуктов химической реакции должен
тивном гидролизе АТФ. Иная ситуация, однако,
быть равен суммарному электронному спину
может иметь место в случае гидролиза ATФ, ката-
исходных реагентов. В физике аналогичный спи-
лизируемого молекулярным мотором. Доказано
новый запрет возникает, например, при синглет-
экспериментально, что гидролиз АТФ иницииру-
триплетных переходах в молекулах и твердом
ет электронно-конформационные взаимодей-
теле.
ствия в активном центре фермента. Благодаря
Магнитно-изотопный эффект однозначно
энергии, освобождаемой при гидролизе АТФ,
свидетельствует о том, что в изучаемом процессе
имеет место конформационное возбуждение, по
имеется «узкое место» - лимитирующая стадия,
существу, деформация макромолекулы [23, 24].
зависимая от электронного спинового состояния,
Более того, при гидролизе АТФ, катализируемом
и что ядерный спин магнитного изотопа ускоряет
миозином, цикл генерации механического на-
эту стадию. В химии для объяснения МИЭ обыч-
пряжения макромолекулы состоит, согласно
но предполагается существование радикальной
квантово-механическим расчетам, из нескольких
пары или ион-радикальной пары в качестве про-
стадий [25]. На первой стадии γ-фосфат АТФ ста-
межуточного продукта («узкого места») реакции
билизируется в состоянии диссоциированного
БИОФИЗИКА том 65
№ 3
2020
500
КОЛЬТОВЕР и др.
Таблица 4. Результаты анализа элементного состава реакционных сред с хлоридами различных изотопов цинка
Предел определения
Элементный состав, мг/л
Элемент
(DL), мг/л
64Zn
67Zn
68Zn
Li
0,001
< DL
< DL
< DL
Be
0,0002
< DL
< DL
< DL
B
0,02
0,52
0,70
0,60
Na
0,3
0,57
1,0
0,77
Mg
0,05
< DL
0,069
< DL
Al
0,06
0,22
0,27
0,23
Si
0,6
< DL
< DL
< DL
P
0,6
< DL
< DL
< DL
S
2
< DL
< DL
< DL
K
0,1
< DL
< DL
< DL
Ca
0,3
< DL
< DL
< DL
Sc
0,008
< DL
< DL
< DL
Ti
0,01
< DL
< DL
< DL
V
0,003
< DL
< DL
< DL
Cr
0,01
< DL
< DL
< DL
Mn
0,003
< DL
< DL
< DL
Fe
0,09
< DL
< DL
< DL
Co
0,003
< DL
< DL
< DL
Ni
0,02
0,14
< DL
< DL
Cu
0,02
0,047
0,098
0,099
Ga
0,0004
< DL
< DL
< DL
As
0,06
< DL
< DL
< DL
Se
0,009
< DL
< DL
< DL
Rb
0,003
< DL
< DL
< DL
Sr
0,001
< DL
< DL
< DL
Y
0,001
< DL
< DL
< DL
Zr
0,002
< DL
< DL
< DL
Nb
0,001
< DL
< DL
< DL
Mo
0,000
< DL
< DL
< DL
Rh
0,001
< DL
< DL
< DL
Pd
0,001
< DL
< DL
< DL
Ag
0,002
< DL
< DL
< DL
Cd
0,001
< DL
< DL
< DL
Sn
0,004
< DL
< DL
< DL
Sb
0,001
< DL
< DL
< DL
Te
0,001
< DL
< DL
< DL
Cs
0,0002
< DL
< DL
< DL
Ba
0,001
0,0051
0,0025
0,010
La
0,0003
< DL
< DL
< DL
Ce
0,0003
< DL
< DL
< DL
Pr
0,0002
< DL
< DL
< DL
Nd
0,0007
< DL
< DL
< DL
Sm
0,0002
< DL
< DL
< DL
Eu
0,0001
< DL
< DL
< DL
Gd
0,0002
< DL
< DL
< DL
БИОФИЗИКА том 65
№ 3
2020
МАГНИТНО-ИЗОТОПНЫЕ ЭФФЕКТЫ МАГНИЯ И ЦИНКА
501
Таблица 4. Окончание
Предел определения
Элементный состав, мг/л
Элемент
(DL), мг/л
64Zn
67Zn
68Zn
Tb
0,0001
< DL
< DL
< DL
Dy
0,0001
< DL
< DL
< DL
Ho
0,0001
< DL
< DL
< DL
Er
0,0001
< DL
< DL
< DL
Tm
0,0001
< DL
< DL
< DL
Yb
0,0001
< DL
< DL
< DL
Lu
0,0001
< DL
< DL
< DL
Hf
0,0001
< DL
< DL
< DL
Ta
0,0003
< DL
< DL
< DL
W
0,0003
< DL
< DL
< DL
Re
0,00003
< DL
< DL
< DL
Ir
0,0001
< DL
< DL
< DL
Pt
0,0006
< DL
< DL
< DL
Au
0,0002
< DL
< DL
< DL
Hg
0,0009
< DL
< DL
< DL
Tl
0,0001
< DL
< DL
< DL
Pb
0,002
0,0024
0,019
0,0082
Bi
0,0001
< DL
< DL
< DL
Th
0,0003
< DL
< DL
< DL
U
0,0001
< DL
< DL
< DL
при этом спиновый запрет, ядерный спин изото-
метафосфата (PγO3-). При этом продукты гидро-
лиза, АДФ и Pi, остаются в активном центре фер-
па 25Mg (67Zn) затрудняет нежелательную обрат-
ную реакцию синтеза АТФ, способствуя, таким
мента в близком контакте и освобождаются толь-
образом, прямой реакции гидролиза АТФ. Гипо-
ко после того, как миозин связывается с фила-
теза о ключевой роли виртуальной ион-радикаль-
ментами актина. Это согласуется с хорошо
ной пары в синтезе АТФ при окислительном фос-
известным фактом обратимости реакции гидро-
форилировании была высказана около 50 лет то-
лиза АТФ миозином. До тех пор, пока продукты
му назад [26].
гидролиза остаются связанными миозином и в
Возможно иное, альтернативное, объяснение
близком контакте, они могут снова образовать
ядерного спинового катализа в реакциях гидро-
АТФ [25]. Можно предположить, что в условиях
лиза АТФ, катализируемых «молекулярными мо-
электронно-конформационного возбуждения
торами» [21]. Можно предположить, что энергия,
макромолекулы в активном центре фермента
выделяемая при гидролизе АТФ (~0.54 эВ), недо-
имеет место перенос электронной плотности на
статочно велика для электронно-конформацион-
АДФ или Mg2+, например, от OH--группы свя-
ного перехода макромолекулы в синглетное воз-
занной молекулы воды или от NH2-группы Glu-
бужденное состояние. Этой энергии достаточно
459 с образованием соответственной ион-ради-
для перехода в более низкое триплетное состоя-
кальной пары. Затем следует нуклеофильная ата-
ние (S = 1), но такой переход из основного состо-
ка неорганического фосфата окси-анионом аде-
яния (S = 0) запрещен законом сохранения спи-
нозиндифосфата с образованием АТФ. Стабиль-
на. Магнитный изотоп (25Mg или соответственно
ное спиновое состояние продукта, АТФ-Mg (в
67Zn) изменяет ситуацию, а именно: ядерный
экспериментах с цинком соответственно АТФ-
спин изотопа устраняет спиновый запрет. Таким
Zn), должно быть синглетным (электронный
образом, обеспечивая необходимую спиновую
спин S = 0). Между тем ядерный спин 25Mg (67Zn)
конверсию электронно-конформационного со-
через сверхтонкое взаимодействие с неспарен-
стояния макромолекулы в триплетное состояние
ным электроном ион-радикальной пары спосо-
(когерентные бозоны), магнитный изотоп уско-
бен конвертировать эту пару, связанную миози-
ряет хемомеханический цикл ферментативной
ном, в триплетное состояние (S = 1). Создавая
реакции [21]. Подобный механизм был предло-
БИОФИЗИКА том 65
№ 3
2020
502
КОЛЬТОВЕР и др.
жен в физике твердого тела для объяснения влия-
Детальные механизмы ядерного спинового ка-
ния магнитных полей на подвижность дислока-
тализа в молекулярных моторах являются задачей
ций [27].
дальнейших исследований.
Рассмотрим еще одно возможное объяснение
Данная статья подготовлена на основе докла-
каталитического эффекта ядерного спина изото-
да, сделанного на VI Съезде биофизиков России
(Сочи, 2019) [30].
пов 25Mg/67Zn. Гидролиз АТФ, катализируемый
молекулярным мотором, сопровождается значи-
тельной конформационной перестройкой макро-
БЛАГОДАРНОСТИ
молекулы. При этом имеют место процессы де-
Авторы благодарят Т.А. Веклич за выполнен-
гидратации и регидратации электрически заря-
ные эксперименты с АТФазой плазматической
женных аминокислотных групп. Между тем
мембраны миометрия. Авторы глубоко призна-
существуют два изомера молекул воды, различа-
тельны академику НАН Украины С.А. Костерину
ющиеся по взаимной ориентации ядерных спи-
(зав. отделом биохимии мышц, ИБХ НАН) и его
нов водорода, а именно: орто-H2O с параллель-
коллегам за плодотворное сотрудничество.
ной ориентацией протонных спинов и пара-H2O
с антипараллельной ориентацией протонных
спинов. Согласно квантовой статистике, при
ФИНАНСИРОВАНИЕ РАБОТЫ
комнатной температуре орто-H2O составляет
Работа выполнена при финансовой поддержке
75% общего объема [28]. Имеются основания по-
Министерства науки и высшего образования
лагать, что по сравнению с молекулами пара-H2O
Российской Федерации (тема AAAA-А19-
молекулы орто-H2O имеют преимущественное
119092390041-5).
сродство к L-аминокислотам [29]. Если так, то
перемещение преимущественно связанных моле-
КОНФЛИКТ ИНТЕРЕСОВ
кул орто-H2O при конформационном превраще-
Авторы заявляют об отсутствии конфликта
нии макромолекулы затруднено, а спин-враща-
интересов.
тельные взаимодействия протонов слишком сла-
бы, чтобы обеспечить должную эффективность
орто-пара-переходов. Опять-таки, магнитный
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
изотоп 25Mg (или соответственно 67Zn) способен
Эксперименты с животными выполняли в
существенно улучшить ситуацию, а именно -
полном соответствии с Европейской конвенцией
устранить проблему спинового запрета, обеспе-
о защите животных, используемых для научных
чив таким образом необходимую скорость кон-
экспериментов и в других научных целях (Stras-
версии изомеров воды.
bourg, 18.III.1986).
В «молекулярных моторах», работающих на
немагнитном изотопе магния, функцию спино-
СПИСОК ЛИТЕРАТУРЫ
вого катализа могут выполнять в принципе ядер-
1. Encyclopedia of nuclear magnetic resonance, ed. by
ные спины водорода (1H, I = 1/2) и фосфора (31P,
D. M. Grant and R. K. Harris (Wiley, Chichester,
I = 1/2). Относительно высокая каталитическая
1996).
активность магнитных изотопов магния и цинка
обусловлена, очевидно, тем, что ядерные спины
2. Л. В. Авдеева и В. К. Кольтовер, Вестн. МГУ, сер. 2
(химия), 57 (3), 145 (2016).
25Mg (I = 5/2) и 67Zn (I = 5/2) в пять раз больше,
3. L. V. Avdeeva, T. A. Evstyukhina, V. K. Koltover, et al.,
чем ядерные спины 1H и 31P, и создают соответ-
Nucl. Phys. At. Energy 20 (3), 271 (2019).
ственно более сильные локальные магнитные по-
4. В. К. Кольтовер, Р. Д. Лабынцева, В. К. Каранда-
ля (константа сверхтонкого взаимодействия ≈21
шев и С. О. Костерин, Биофизика 61 (2), 239
мТл) в активном центре фермента.
(2016).
5. V. K. Koltover, R. D. Labyntseva, and S. O. Kosterin,
ВЫВОДЫ
in: Myosin: Biosynthesis, Classes and Function, ed. by D.
Broadbent (Nova Science Publ., N.-Y., 2018), pp. 135-
В экспериментах с важнейшим молекулярным
158.
мотором биоэнергетики - миозином - обнару-
6. Ю. В. Карякин и И. И. Ангелов, Чистые химиче-
жены значительные по величине эффекты уско-
ские вещества (Химия, М., 1974).
рения ферментативного гидролиза АТФ магнит-
ными изотопами магния и цинка. Эффект ядер-
7. V. K. Karandashev, A. N. Turanov, T. A. Orlova, et al.,
ного спинового катализа выявлен также в
Inorg. Mater. 44, 1491 (2008).
экспериментах с Mg-зависимой АТФазой плаз-
8. S. A. Burgess, S. Yu, M. L. Walker, et al., J. Mol. Biol.
матической мембраны миометрия.
372, 1165 (2007).
БИОФИЗИКА том 65
№ 3
2020
МАГНИТНО-ИЗОТОПНЫЕ ЭФФЕКТЫ МАГНИЯ И ЦИНКА
503
9. Р. Д. Лабынцева, А. А. Бевза, О. В. Бевза и др., Укр.
20. A. L. Buchachenko and R. G. Lawler, Acc. Chem. Res.
биохим. ж. 84, 34 (2012).
50 (4) 877 (2017).
10. A. H. Iwane, K. Kitamura, M. Tokunaga, et al., Bio-
21. V. K. Koltover, J. Mol. Liquids 235, 44 (2017).
chem. Biophys. Res. Commun. 230, 46 (1997).
22. D. L. Nelson and M. M. Cox, Lehninger Principles of
11. Т. А. Веклич, A. A. Шкрабак, Н. Н. Слигченко и
Biochemistry (Freeman, N.-Y., 1996).
др., Биохимия 79, 532 (2014).
23. М. В. Волькенштейн, Общая биофизика (Наука,
12. Т. А. Веклич, Ю. Ю. Мазур и С. А. Костерин, Укр.
М., 1978).
биохим. ж. 87, 5 (2015).
24. Д. С. Чернавский и Н. М. Чернавская, «Белок-ма-
13. P. S. Chen, T. Y. Toribara Jr., and H. Warner, Analуt.
шина». Биологические макромолекулярные кон-
Chem. 28 1756 (1956).
струкции (Янус-К, М., 1999).
14. R. D. Labyntseva, T. V. Ulianenko, and S. O. Kosterin,
25. F. A. Kiani and S. Fischer, Proc. Natl. Acad. Sci. USA
Ukr. Biochem. J. 70, 71 (1998).
111 (29) 2947 (2014).
15. A. A. Bevza, R. D. Labyntseva, O. V. Bevza, et al., Ukr.
26. Л. А. Блюменфельд и В. К. Кольтовер, Молекуляр.
Biochem. J. 82, 22 (2010).
биология 6 (1), 161 (1972).
16. V. K. Koltover, P. Graber, V. K. Karandashev, et al., in:
27. M. V. Badylevich, V. V. Kveder, V. I. Orlov, and
Abstr. Book of 11th Int. Conf. “Biocatalysis: Fundamentals
Yu. A. Osipyan, Phys. Stat. Sol. (c) 2 (6), 1869 (2005).
and Applications” (Innovations and High Technologies
MSU Ltd, Moscow, 2017), pp. 50-51.
28. V. I. Tikhonov and A. A. Volkov, Science 296, 2363
17. D. Crotty, G. Silkstone, S. Poddar, et al., Proc. Natl.
(2001).
Acad. Sci. USA 109, 1437 (2012).
29. Y. Scolnik, I. Portnaya, U. Cogan, et al., Phys. Chem.-
18. Д. А. Смирнова, В. К. Кольтовер, С. В. Носенко и
Chem. Phys. 8 (3), 333 (2006).
др., Вестн. МГУ. Сер. 2 (Химия), 59, 266 (2018).
30. В. К. Кольтовер, Р. Д. Лабыгцева, В. К. Каранда-
19. Я. Б. Зельдович, А. Л. Бучаченко и Е. Л. Франке-
шев и др., в сб: Тез. докл. VI Съезда биофизиков
вич, Успехи физ. наук 155 (1) (1988).
России (Сочи, 2019), т. 2, сс. 208-209.
Magnetic-Isotope Effects of Magnesium and Zinc in the Enzymatic ATP Hydrolysis
Reactions Driven by the Molecular Motors
V.K. Koltover*, R.D. Labyntseva**, and V.K. Karandashev***
*Institute of Problems of Chemical Physics, Russian Academy of Sciences,
prosp. Akademika Semenova 1, Chernogolovka, Moscow Region, 142432 Russia
**Palladin Institute of Biochemistry, National Academy of Sciences of Ukraine, ul. Leontovicha 9, Kiev, 01030 Ukraine
***Institute of Microelectronics Technology and High Purity Materials, Russian Academy of Sciences,
ul. Akademika Osipyana 6, Chernogolovka, Moscow Region, 142432 Russia
The effects of different isotopes of magnesium and zinc on the enzyme activity of myosin subfragment-1 have
been explored. The rate of the enzymatic ATP hydrolysis in the reaction media enriched with the magnetic
isotope, 25Mg, is twice as high as it is in the reaction media enriched with the nonmagnetic isotopes, 24Mg or
26Mg. A similar effect of nuclear spin catalysis has been detected in the experiments with isotopes of zinc as
a cofactor of the enzyme. The rate of the enzymatic ATP hydrolysis with the magnetic 67Zn increases by 40-
50 percent compared to that with the nonmagnetic 64Zn or 68Zn. The magnetic-isotope effects are observed
at the physiological concentration of magnesium and zinc chlorides (5 mM). The catalytic effect of the mag-
netic magnesium isotope 25Mg has been revealed in the experiments with the Mg-dependent ATPase of plas-
ma membranes from the myometrium. The observation of the magnetic isotope effects indicates that there is
a spin-selective rate-limiting step in the chemo-mechanical process driven by the “molecular motor” which
uses energy from ATP hydrolysis and that nuclear spin catalysis causes acceleration of this stage. Some pos-
sible mechanisms of the nuclear spin catalysis are discussed.
Keywords: nuclear spin catalysis, myosin, ATPase activity, biomolecular motors, bioreliability, magnetic-isotope
effect, magnesium, zinc
БИОФИЗИКА том 65
№ 3
2020