БИОФИЗИКА, 2020, том 65, № 3, с. 504-511
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.323.5;577.31;577.356;577.113.7
УЛЬТРАЗВУКОВОЕ РАСЩЕПЛЕНИЕ ДНК: АНАЛИЗ СТРУКТУРНО-
ДИНАМИЧЕСКИХ ХАРАКТЕРИСТИК РЕГУЛЯТОРНЫХ УЧАСТКОВ
ГЕНОМА И ОШИБОК СЕКВЕНИРОВАНИЯ
© 2020 г. И.А. Ильичева*, М.В. Ходыков*, Л.А. Панченко**,
Р.В. Полозов***, Ю.Д. Нечипуренко*
*Инcтитут молекуляpной биологии им. В.А. Энгельгаpдта PАН, 119991, Моcква, ул. Вавилова, 32
**Биологический факультет Московского государственного университета имени М.В. Ломоносова
, 119991, Москва, Ленинские горы, 1/12
***Инcтитут теоpетичеcкой и экcпеpиментальной биофизики PАН,
142290, Пущино Московской области, ул. Институтская, 3
E-mail: imb_irina@rambler.ru, nech99@mail.ru
Поступила в редакцию 27.02.2020 г.
После доработки 27.02.2020 г.
Принята к публикации 28.02.2020 г.
Приведен краткий обзор одной из сторон многогранной научной деятельности выдающегося
ученого-экспериментатора С.Л. Гроховского - открытия им нового физико-химического явления
специфичности ультразвукового расщепления межнуклеотидных связей в двухспиральной В-ДНК.
Это явление позволило связать эффекты расщепления с конформационно-динамическими
характеристиками нуклеотидных последовательностей в В-ДНК и дало возможность проводить
биоинформатический анализ геномов на новой основе. Функциональные участки ДНК обладают
определенными конформационно-динамическими характеристиками, что позволяет ставить и
решать задачи эпигенетики и канцерогенеза.
Ключевые слова: ультразвуковое расщепление ДНК, конформационно-динамические характеристики
ДНК, специфичность расщепления ДНК, эпигенетика, биоинформатический анализ генома.
DOI: 10.31857/S0006302920030096
Посвящается памяти Сергея Львовича Гроховского
Жизнь человека есть самодвижущийся круг, который из бесконечно малого
расходится во все стороны, в новые и все большие круги, не имеющие конца.
Р.У. Эмерсон
В 2018 г. ушел из жизни удивительный человек
В 2006 г. виртуозное владение экспериментом
и выдающийся экспериментатор - Сергей Льво-
позволило Сергею Львовичу при облучении
вич Гроховский. Талантливый химик-синтетик,
двойной спирали ДНК ультразвуком обнаружить
он синтезировал большое число различных ли-
зависимость частоты расщепления межнуклео-
гандов, специфично связывающихся с ДНК. Эти
тидных связей от нуклеотидной последователь-
работы широко известны. Они дали основание
ности [6].
для построения моделей связывания противоопу-
Ранее считалось, что позиции ультразвукового
холевых соединений и других лекарственных
расщепления межнуклеотидных связей в двой-
средств с ДНК [1-3]. Гроховский также довел до
ной спирали ДНК расположены вдоль ДНК слу-
совершенства методы ультразвукового футприн-
чайно и не зависят от нуклеотидной последова-
тинга ДНК. Две последние его работы [4, 5] - яр-
тельности. Точность определения нуклеотидных
кое тому свидетельство. Они были опубликованы
последовательностей геномов методами NGS
уже после того, как автора не стало.
(next generation sequencing - секвенирование но-
Сокращения: Ключевые слова: ультразвуковое расщепление ДНК, конформационно-динамические характеристики ДНК,
специфичность расщепления ДНК, эпигенетика, биоинформатический анализ генома.
504
УЛЬТРАЗВУКОВОЕ РАСЩЕПЛЕНИЕ ДНК
505
вого поколения) существенно зависит от спра-
1
2
3 4
5 6
ведливости этого предположения. Гроховский
провел детальное исследование процесса ультра-
звукового расщепления ДНК. Он облучал ре-
7
8
9 10 1112
стриктные фрагменты плазмид ультразвуком с
частотой 22 и 44 кГц. Разработанная им схема
131415161718
эксперимента включала два этапа: а) предвари-
тельную пришивку на
3'-конец рестриктного
фрагмента плазмидной ДНК одного (любого из
четырех возможных) дополнительного нуклеоти-
да, который был мечен по фосфору (33P); б) ана-
лиз полученных фрагментов расщепления при
помощи электрофореза в полиакриламидном ге-
ле. Полученный результат был неожиданным и
противоречил принятым представлениям о слу-
чайности позиций разрывов межнуклеотидных
связей. Электрофорез меченых по 3'-концу фраг-
ментов ДНК плазмид фиксировал в полиакрила-
мидном геле полосы почернения разной интен-
сивности. Каждая из полос отвечала фрагменту
известной нуклеотидной последовательности
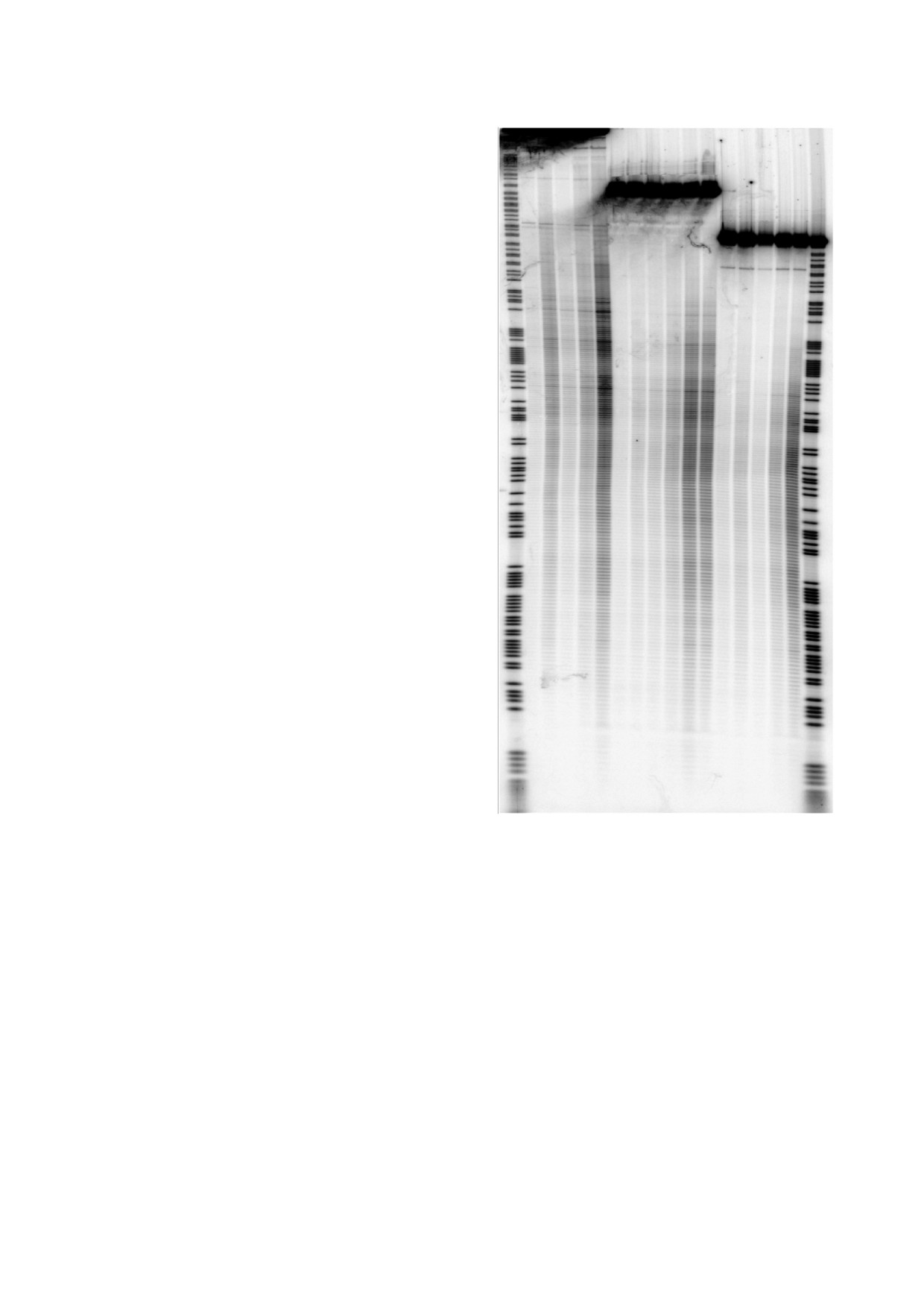
(рис. 1).
Методики, которые были разработаны для вы-
явления влияния нуклеотидной последователь-
ности на частоту расщепления плазмидных ДНК,
детально описаны в работах [7-11]. Оцифровка
интенсивностей полос на гелях позволила полу-
чить значения относительных частот расщепле-
ния динуклеотидов (R) и тетрануклеотидов (T) и
провести статистический анализ позиций рас-
щепления [7, 8]. Здесь мы приводим значения
этих величин в таблице и на рис. 2 соответствен-
но. Эти данные показывают различия частот уль-
тразвуковых разрывов в зависимости от типа ди-
нуклеотида и его ближайшего окружения (нук-
леотидного контекста).
Мы проанализировали различные версии объ-
яснения явления зависимости частот ультразву-
кового расщепления ди- и тетрануклеотидов от
последовательности нуклеотидов при облучении
раствора двуспиральной ДНК. Многие физиче-
Рис. 1. Результат расщепления фрагмента ДНК в
ские свойства двойной спирали ДНК зависят от
6%-м денатурирующем полиакриламидном геле по-
ее нуклеотидной последовательности. Термоди-
сле обработки ультразвуком c частотой 22 кГц: до-
намическая стабильность дуплексов ДНК описы-
рожки 1, 18 - химическое расщепление по пуринам;
вается в рамках модели «ближайших соседей».
дорожки 2, 7 и 13 - облучение фрагментов в течение
Согласно этой модели значения свободных энер-
2 мин; дорожки 3, 8 и 14 - облучение фрагментов в те-
чение 2 мин в присутствии 50% глицерола; дорожки
гий стэкинга дуплексов динуклеотидов CpG и
4, 9 и 15 - облучение фрагментов в течение 4 мин; до-
GpC очень близки. Однако частоты расщепления
рожки 5, 10 и 16 - облучение фрагментов в течение
этих динуклеотидов существенно различаются.
8 мин; дорожки 6, 11 и 17 - облучение фрагментов в
Другая версия - влияние резких изгибов оси
течение 16 мин; дорожка 12 - облучение фрагментов
двойной спирали (например, появление кинков)
в течение 16 мин в присутствии 0.5 М тиомочевины.
также не объясняет эти отличия. Такие изгибы
наиболее часто встречаются на участках с высо-
жденной ДНК, которая содержит одноцепочеч-
ким содержанием АТ-пар, тогда как частоты рас-
ные разрывы («ники»). Эти разрывы вызывают
щепления ДНК на этих участках близки средним
значениям. В этой связи важно также отметить,
резкие изгибы оси спирали. В этом случае харак-
что совершенно иной характер ультразвукового
терная для регулярной двухспиральной ДНК спе-
расщепления наблюдается при облучении повре-
цифичность расщепления отсутствует [12].
БИОФИЗИКА том 65
№ 3
2020
506
ИЛЬИЧЕВА и др.
Относительные частоты ультразвукового
расщепле-
конформационными движениями вокруг связей
ния динуклеотидов
С3'-O3' и O3'-P и с движениями оснований во-
круг гликозидной связи. Низкоэнергетические
Динуклеотид
N
R
d
области (S, high-anti) совпадают у трех дезоксири-
бонуклеотидов (dA, dG, dT) и отличаются от низ-
AA
1636
0.919
0.129
коэнергетической области dC, которая смещена в
сторону (N, anti). Именно после дезоксицитиди-
AC
1076
0.913
0.128
на ультразвуковой разрыв межнуклеотидных свя-
зей происходит наиболее часто. Мы предположи-
AG
1028
0.900
0.124
ли, что частоты разрыва межнуклеотидной связи
зависят от времени пребывания дезоксирибозы в
AT
1374
0.904
0.119
N-области псевдовращения.
CA
1265
1.160
0.209
Ультразвуковое расщепление ДНК имеет ме-
ханохимическую природу. Физическая модель,
CC
1141
1.007
0.144
которая описывает динамику растяжения фраг-
мента ДНК, оказавшегося в потоке жидкости с
CG
1230
1.444
0.334
высоким градиентом скоростей в результате кол-
лапса кавитационных пузырьков, возникающих
CT
1077
1.130
0.198
при ультразвуковом облучении, была построена в
работе [13]. У фрагмента ДНК, оказавшегося
GA
1153
0.970
0.133
вблизи схлопывающегося кавитационного пу-
зыpька, глобальная оcь двойной спирали ориен-
GC
1317
0.954
0.146
тируется вдоль потока. Вероятность механохими-
ческого расщепления связи C3′-O3′ зависит от
GG
1168
0.922
0.145
степени ее растяжения в потоке. Поэтому важ-
ным фактором в процессе расщепления является
GT
1101
0.952
0.126
ориентация этой связи по отношению к глобаль-
ной оси спиpали ДНК.
TA
1065
0.973
0.12
Предложенная модель дает качественное опи-
сание расщепления ДНК. Однако количествен-
TC
1173
0.912
0.131
ное описание механизма расщепления ДНК - все
еще нерешенная задача. Трудности ее решения
TG
1305
0.979
0.126
заключаются в том, что мы не знаем в полной ме-
ре систему определяющих параметров (их тип и
TT
1672
0.932
0.127
число), характеризующих процесс расщепления.
Как известно, нахождение системы определяю-
Примечание. Использованы обозначения: N
- объем
щих параметров представляет очень важный этап
выборки; R - среднее значение; d - стандартное отклонение
постановки задачи.
выборочного среднего.
Важно отметить, что частоты расщепления ас-
симетричных комплементарных ди- и тетранук-
леотидов различны. Например, значение R для
Мы проанализировали литературные данные,
динуклеотида CpA равно 1.13, а для комплемен-
включающие ЯМР-исследования малых фраг-
тарного ему динуклеотида TpG оно равно 0.90;
ментов ДНК, рентгеноструктурные работы и
значение T для тетрануклеотида ApCpGpA равно
конформационные расчеты ДНК [8]. Связь ча-
1.54, а для комплементарного ему тетрануклеоти-
стот ультразвукового расщепления разных ди- и
да TpCpGpT - 1.26. Это означает, что величины
тетрануклеотидов с особенностями их локальной
относительных частот расщепления динуклеоти-
конформационной динамики удалось обнару-
дов позволяют охарактеризовать каждую из ком-
жить при анализе данных ЯМР и соотнесении их
плементарных цепей в отдельности [8].
с особенностями карт потенциальной энергии
Далее нами был проведен анализ фрагмента-
нуклеозидов и нуклеотидов [8]. Конформации
ции геномных ДНК разными методами (ультра-
цикла β-D-дезоксирибозы в двойной спирали В-
звук, небулизация, Коварис). Основой механиз-
ДНК находятся в динамическом равновесии. По-
ма расщепления ДНК всеми этими методами яв-
зиции атомов кольца по отношению к его сред-
ляется механохимическая реакция. Библиотеки
ней плоскости постоянно меняются. Эти кон-
фрагментов для NGS-секвенирования доступны,
формационные движения, называемые псевдо-
и мы воспользовались ими, чтобы определить ча-
вращением (переходы N⇔S между двумя
стоты разных позиций расщепления ДНК [14].
низкоэнергетическими областями), сопряжены с
Частоты встречаемости каждого из четырех нук-
БИОФИЗИКА том 65
№ 3
2020
УЛЬТРАЗВУКОВОЕ РАСЩЕПЛЕНИЕ ДНК
507
(а)
A
R
C
1.1
G
T
1.0
0.9
0.8
AANC
AANC
CANC
CANT
GANC
GANC
TANC
TANT
0.7
AANA
AANG
CANA
CANG
GANA
GANG
TANA
TANG
R
(б)
A
2.0
C
G
T
1.5
1.0
ACNC
ACNT
CANC
CANT
GCNC
GCNT
TCNC
TCNT
ACNA
ACNG
CCNA
CCNG
GANA
GCNG
TCNA
TCNG
A
(в)
C
R
G
T
1.0
0.9
0.8
AGNC
AGNC
CGNC
CGNT
GGNC
GGNC
TGNC
TGNT
AGNA
AGNG
CGNA
CGNG
GGNA
GGNG
TGNA
TGNG
(г)
A
R
C
1.1
G
T
1.0
0.9
ATNC
ATNT
CTNC
CTNT
GTNC
GTNT
TTNC
TTNT
0.8
ATNA
ATNG
CTNA
CTNG
GTNA
GTNG
TTNA
TTNG
Рис. 2. Средние значения относительных частот ультразвукового расщепления рестриктных фрагментов плазмидных
ДНК. R - частота расщепления, по оси абсцисс представлены тетрануклеотиды.
леотидов на участке в 200 пар (± 100 пар) с цен-
ментов можно наложить на нуклеотидную после-
тром в позиции фрагментации показаны на
довательность референсного генома и таким об-
рис. 3. Нуклеотидные последовательности фраг-
разом оценить частоты разрывов в ди- и тетра-
БИОФИЗИКА том 65
№ 3
2020
508
ИЛЬИЧЕВА и др.
0.30
T
A
0.25
C
0.20
G
0
20
40
60
80
100
120
140
160
180
200
Номер нуклеотидной пары
Рис. 3. Частоты встречаемости каждого из четырех дезоксирибонуклеотидов (A, C, G и T) на участке в
200 нуклеотидных пар (± 100 нуклеотидных пар) с центром в позиции расщепления.
нуклеотидах при фрагментации геномной ДНК.
тильной группы в 5-м положении кольца цитозина
Нами проведено сравнение относительных ча-
играет важную роль в эпигенетике. Мы предположи-
стот расщепления 16 динуклеотидов, полученных
ли, что метилированные динуклеотиды CpG расщеп-
на основании данных NGS-фрагментации геном-
ляются чаще, чем неметилированные [15]. Это пред-
ных ДНК этими тремя методами, с относитель-
положение было подтверждено в работах [16, 17], где
ными частотами, полученными в результате ана-
проведен анализ относительных частот встречаемо-
лиза данных ультразвукового расщепления плаз-
сти метилированного и неметилированного CpG-ди-
мидных ДНК (рис. 4) [14, 15].
нуклеотидов в позициях расщепления геномных
ДНК. Для этого были использованы данные бисуль-
В геномной ДНК расщепление показывает при-
фитного секвенирования. Оказалось, что частота рас-
мерно такую же зависимость от последовательности
щепления метилированных CpG примерно в полтора
нуклеотидов, что и в плазмидных ДНК. Единствен-
раза выше неметилированных.
ный динуклеотид, частота расщепления которого в
геномной ДНК значительно выше, чем в плазмидных
Величины R и T характеризуют структурно-
ДНК, - это динуклеотид CpG. Возможно, это связа-
конформационную динамику локального участка
но с тем, что в геномных ДНК определенная часть
ДНК, далее мы будем называть их характеристи-
CpG-динуклеотидов метилирована. Наличие ме-
ками СКД. Мы полагаем, что структурно-кон-
1.8
УЗ, плазмиды
УЗ,NGS
1.6
Небулизация,NGS
Коварис,
NGS
1.4
1.2
1.0
0.8
0.6
AA AC AG AT CA CC CG CT GA GC GG GT TA TC TG TT
Рис. 4. Значения средних частот расщепления 16 динуклеотидов, полученных на основании данных NGS-
фрагментации геномных ДНК тремя методами, в которых используется ультразвуковое облучение, и значения
относительных частот ультразвукового облучения плазмидных ДНК.
БИОФИЗИКА том 65
№ 3
2020
УЛЬТРАЗВУКОВОЕ РАСЩЕПЛЕНИЕ ДНК
509
(а)
1.06
1 02
R
0.98
0.94
50
45
40
35
30
25
20
15
10
5
1
5
10
(б)
0.04
0.02
0.00
ΔR
0.02
0.04
50
45
40
35
30
25
20
15
10
5
1
5
10
1.08
(в)
1 04
T
.00
1
0.96
50
45
40
35
30
25
20
15
10
5
1
5
10
0.06
(г)
0.0
4
0.02
ΔT
0.00
0.02
0.04
50
45
40
35
30
25
20
15
10
5
1
5
10
(д)
0.06
0.0
4
0.02
S
0.00
0.02
0.04
50
45
40
35
30
25
20
15
10
5
1
5
10
0.08
(е)
0.04
0.00
ΔS
0.04
0.08
50
45
40
35
30
25
20
15
10
5
1
5
10
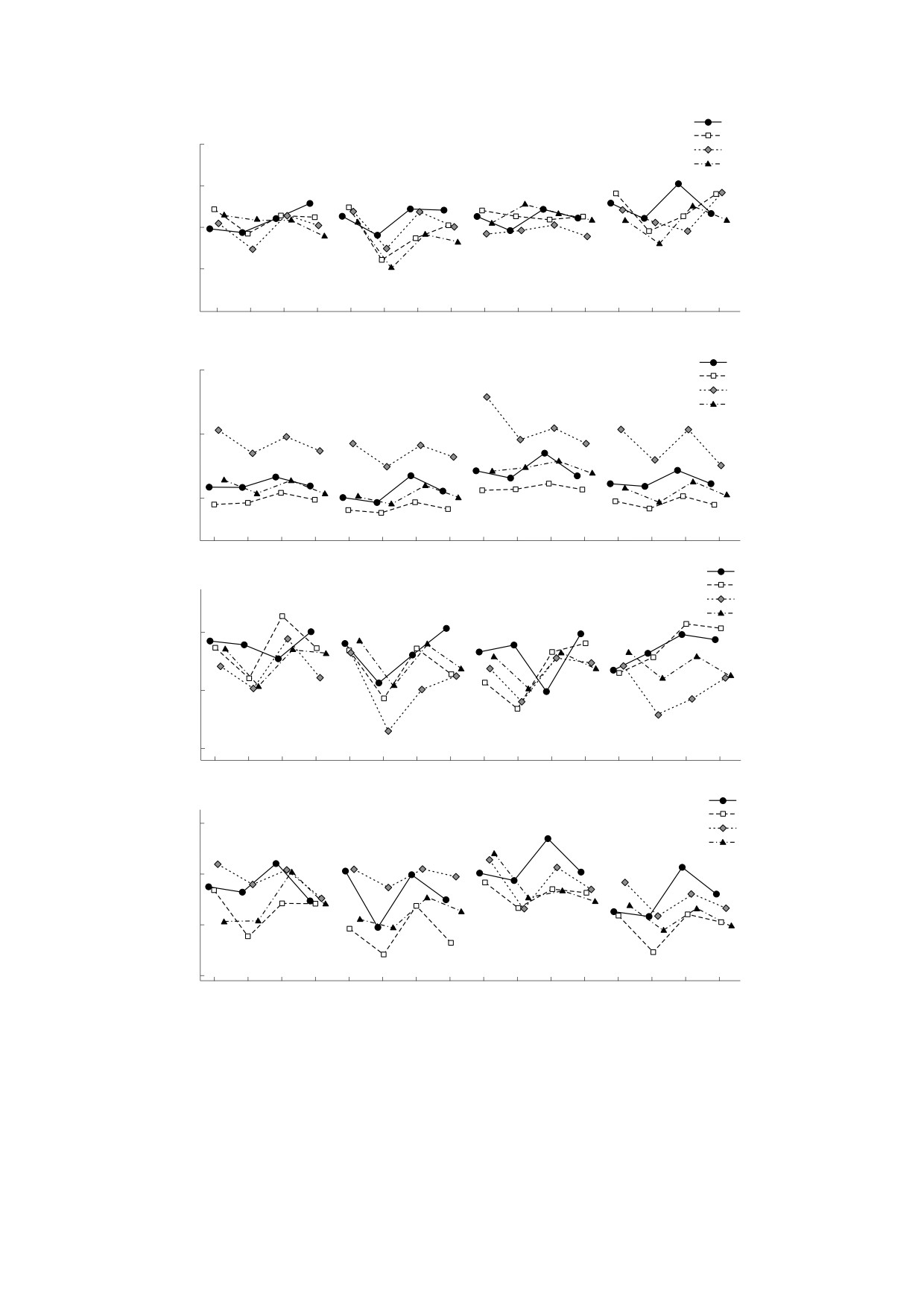
Рис. 5. Профили СКД-характеристик промоторов генома человека: (а) - профили величины R в кодирующей
(сплошная линия) и некодирующей (пунктирная линия) цепях; (б) - разность величин R для кодирующей и
некодирующей цепей; (в) - профили величины T в кодирующей (сплошная линия) и некодирующей (пунктирная
линия) цепях; (г) - разность значений T для кодирующей и некодирующей цепей; (д) - профили величины S в
кодирующей (сплошная линия) и некодирующей (пунктирная линия) цепях; (е) - разность величин S кодирующей и
некодирующей цепей.
БИОФИЗИКА том 65
№ 3
2020
510
ИЛЬИЧЕВА и др.
формационная динамика участков геномных
бокс, с которым непосредственно связывается
ДНК является важным фактором регуляции экс-
регуляторный белок TBP - окрестности пози-
прессии генов. Для проверки этого предположе-
ции (-30) относительно начала транскрипции.
ния мы воспользовались базой EPD (New
Для всех организмов характер изменений струк-
section of the Eukaryotic Promoter Database,
турных и физико-химических параметров на
этом участке схож. Значения механических и
тидные последовательности различных организ-
структурных характеристик указывают на рас-
мов. Вначале мы проанализировали профили по-
ширение малой бороздки и увеличение жестко-
следовательностей нуклеотидов в промоторах,
сти двойной спирали на изгиб в сторону малой
рассматриваемые как их текстовые характеристи-
ки, и обнаружили в них существенные различия
бороздки. Детальное описание особенностей
[18]. Затем мы построили так называемые «обоб-
профилей для каждой из характеристик дано в
щенные профили» изменений шести механиче-
работе [18]. На рис. 5 приведены профили харак-
ских и структурных параметров (энергии стэкин-
теристик R, T, S промоторов человека. Позиции
га, параметров Roll и Slide, изменения энергии
от -32 до -24 пар оснований относительно нача-
дуплексов при отклонении от от равновесных
ла транскрипции, т.е. позиции ТАТА-бокса от-
значений, а также энергии изгиба двойной спира-
личаются малыми значениями R и T, что может
ли в сторону узкого желоба). Эти параметры
свидетельствовать об уменьшении интенсивно-
характеризуют локальные особенности струк-
сти конформационных движений в цепях ДНК
туры ДНК (использовалась база данных
на этом участке. Профиль характеристики S ука-
«обоб-
зывает на периодические изменения интенсив-
щенные профили» мы называем профили, полу-
ченные суммированием профилей индивидуаль-
ностей конформационных движений в обеих
ных промоторов, которые представлены в базе
комплементарных цепях, которые происходят в
организмов определенного вида. Также мы по-
противофазе вплоть до позиции -3 пары основа-
строили «обобщенные профили» частот расщеп-
ний. В позиции ТАТА-бокса различие в ампли-
ления ди- и тетрануклеотидов - СКД-характери-
тудах колебаний значений S у комплементарных
стики R и T, и ввели параметр S = (Т - R)/T,
цепей наибольшее. Итак, СКД-характеристики
величина которого характеризует влияние бли-
нуклеотидной последовательности геномов ука-
жайших соседей динуклеотида (контекст) на его
зывают на характерные структурные и конфор-
механохимическое расщепление. Поскольку мы
мационные особенности двойной спирали в
связываем интенсивность механохимического
промоторных областях.
расщепления с конформационными движения-
ми, то полагаем, что при S < 0 контекст ослабляет
В последнее время появились многочислен-
их интенсивность, а при S > 0 усиливает. Профи-
ные указания на ошибки в результатах секвени-
ли СКД-характеристик ДНК строили как для ко-
рования геномов [19, 20]. Большинство из них
дирующей цепи, так и для комплементарной це-
связано с неточной оценкой встречаемости GC-
пи. Все они представлены в работе [18]. Эти про-
пар оснований. Заметное увеличение частот ме-
фили позволили сделать следующий важный
ханохимического расщепления после дезоксици-
вывод: несмотря на различия нуклеотидных по-
следовательностей промоторов у разных организ-
тидина в двойной спирали может быть одним из
мов, при рассмотрении их, как текстов, механи-
источников погрешностей получаемых нуклео-
ческие, структурные и конформационные харак-
тидных последовательностей. Разработка мето-
теристики двойной спирали ДНК на этих
дов, которые могли бы учитывать частоты встре-
участках сходны. Эти характеристики позволяют
чаемости нуклеотидов на 5'-концах фрагментов
выделить промоторы среди других участков нук-
(«ридов»), используемых при NGS-секвенирова-
леотидных последовательностей ДНК. Наиболее
нии, и проводить на их основе корректировку ре-
заметны особенности профилей в окрестности
зультатов - это еще одно направление, которое
начала транскрипции, которая может захваты-
стало возможным благодаря открытию С.Л. Гро-
вать от шести до восьми нуклеотидных пар. Все
ховским явления специфичного к нуклеотидной
характеристики на этом участке меняются скач-
кообразно на каждом шаге, что свидетельствует о
последовательности механохимического расщеп-
потере регулярности двойной спирали на этом
ления ДНК.
участке. Отсутствие строгой регулярности облег-
Открытие, сделанное Гроховским, дает но-
чает перестройки структуры при связывании ре-
вые возможности развития и разработки методов
гуляторных белков и формировании «открытого
изучения особенностей структуры и конформа-
комплекса», необходимого для транскрипции.
ционной динамики ДНК (см., например, работу
Другим участком, выделяющимся на профи-
[21]), которые влияют на генную экспрессию и,
лях СКД характеристик последовательностей
тем самым, определяют такие процессы, как кан-
промоторов, является так называемый ТАТА-
церогенез и эпигенез.
БИОФИЗИКА том 65
№ 3
2020
УЛЬТРАЗВУКОВОЕ РАСЩЕПЛЕНИЕ ДНК
511
БЛАГОДАРНОСТИ
6.
С. Л. Гроховский, Молекуляр. биология 40 (2), 317
(2006).
Авторы считают своим приятным долгом по-
7.
С. Л. Гроховский, И. А. Ильичева, Д. Ю. Нечипу-
благодарить Д.Ю. Нечипуренко и Л.А. Урошлева
ренко и др., Биофизика 53 (3), 417 (2008).
за полезные обсуждения.
8.
S. L. Grokhovsky, I. A. Il’icheva, D. Yu. Nechipuren-
ko, et al., Biophys. J. 100 (1), 117 (2011).
ФИНАНСИРОВАНИЕ РАБОТЫ
9.
Ю. Д. Нечипуренко, М. В. Головкин, Д. Ю. Нечи-
Работа поддержана Программой фундаменталь-
пуренко и др., Журн. структур. химии 50 (5), 1040
(2009).
ных исследований государственных Академий наук
на
2013-2020 годы (темы
№№ 01201363818 и
10.
S. L. Grokhovsky, I. A. Il’icheva, D. Yu. Nechipuren-
ko, et al., in Gel Electrophoresis - Principles and Basics,
01201363820) и Программой по молекулярной и кле-
ed. by S. Magdeldin (InTech, 2012).
точной биологии Президиума РАН № 01201456592,
11.
S. L. Grokhovsky, I. A. Il’icheva, D. Yu. Nechipuren-
а также Российским фондом фундаментальных ис-
ko, et al., in Advances in Engineering Research, ed. by
следований (проект № 18-07-00354а).
V. M. Petrova (Nova Science Publishers, 2014), v. 8,
pp. 213-236.
КОНФЛИКТ ИНТЕРЕСОВ
12.
I. A. Il'icheva, D. Y. Nechipurenko, and S. L. Grok-
Авторы заявляют об отсутствии конфликта
hovsky, J. Biomol. Structure and Dynamics 27 (3), 391
интересов.
(2009).
13.
Д. Ю. Нечипуpенко, И. А. Ильичева, М. В. Xоды-
ков и др., Биофизика 59 (6), 1061 (2014).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
14.
M. S. Poptsova, I. A. Il'icheva, D. Y. Nechipurenko,
Настоящая работа не содержит описания ка-
L. A. Panchenko, et al., Sci. Rep. 4, 4532 (2014).
ких-либо исследований с использованием людей
15.
Ю. Д. Нечипуренко, И. А. Ильичева, М. С. Попцо-
и животных в качестве объектов.
ва и С. Л. Гроховский, Актуальные вопросы био-
логической физики и химии 2 (1), 339 (2017).
16.
Ю. Д. Нечипуренко, И. А. Ильичева, Э. Т. Абдул-
СПИСОК ЛИТЕРАТУРЫ
лаев и др., Актуальные вопросы биологической
1. G. V. Gursky, et al., Cold Spring Harbor Symp. Quant.
физики и химии 3 (4), 884 (2018).
Biol. 47, 367 (1983).
17.
L. A. Uroshlev, E. T. Abdullaev, I. R. Umarova, et al.,
2. А. С. Заседателев, А. Л. Жузе, К. Циммер,
Sci Rep. (2020) (in press).
С. Л. Гроховский и др., Докл. АН СССР 231 (4),
18.
I. A. Il’icheva, M. V. Khodikov, M. S. Poptsova, et al.,
1006 (1976).
BMC Genomics 17 (1), 973 (2016).
3. S. L. Grokhovsky, A. N. Surovaya, G. Burckhardt,
19.
Y. Benjamini and T. P. Speed, Nucleic acids research,
et al., FEBS Lett. 439 (3), 346 (1998).
40 (10), e72 (2012).
4. С. Л. Гроховский, Молекуляр. биология 52 (4), 705
20.
J. R. Wang, B. Quach, and T. S. Furey, BMC Bioinfor-
(2018).
matics 18 (1), 357 (2017).
5. С. Л. Гроховский, Молекуляр. биология 52 (5), 846
21.
D. Semyonov, Yu. Nechipurenko, Bioessays (2020) (in
(2018).
press).
Ultrasonic DNA Cleavage: Analysis of Conformational-Dynamic Features of Regulatory
Regions in the Genome and Sequencing Errors
I.А. Il’icheva*, M. V. Khodikov*, L.A. Panchenko**, R.V. Polozov***, and Yu.D. Nechipurenko*
*Engelhardt Institute of Molecular Biology, Russian Academy of Sciences, ul. Vavilova 32, Moscow, 119991 Russia
**Faculty of Biology, Lomonosov Moscow State University, Leninskie Gory 1/12, Moscow, 119991 Russia
***Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
The article is dedicated in memory of Dr. Sergei Lvovich Grokhovsky, a distinguished scientist and an experiment-
er. This paper contains a brief review of one aspect of the multifaceted scientific activity of Dr. S.L. Grokhovsky
whose work contributed immensely to the understanding of a new physicochemical event such as the specificity of
ultrasound-induced cleavage of internucleotide bonds in double-stranded B-DNA. His discovery has afforded a
view of the cleavage effects within the conformational and dynamic characteristics of nucleotide sequences in B-
DNA and an opportunity to conduct bioinformatical analysis of genomes on a new plane. Functional DNA re-
gions are characterized by distinct conformational-dynamic features. We demonstrate the effectiveness of this ap-
proach for the analysis of correlation of these conformational and dynamic features with the epigenetic develop-
ment and carcinogenesis.
Keywords: ultrasonic DNA cleavage, conformational-dynamic characteristics of DNA, specificity of DNA cleav-
age, epigenetics, bioinformatics analysis of genome data
БИОФИЗИКА том 65
№ 3
2020