БИОФИЗИКА, 2020, том 65, № 3, с. 512-523
БИОФИЗИКА КЛЕТКИ
УДК 577.344.3
ВЛИЯНИЕ ПРИРОДЫ РАСТВОРИТЕЛЯ И ОСВЕЩЕНИЯ
НА ИЗОМЕРИЗАЦИЮ И ОКИСЛИТЕЛЬНУЮ
ДЕСТРУКЦИЮ АСТАКСАНТИНА
© 2020 г. Е.А. Куликов*, И.С. Куликова*, Р.Г. Василов*, А.А. Селищева*, **
*Национальный исследовательский центр «Курчатовский институт», 123182, Москва, пл. Академика Курчатова, 1
**Московский государственный университет имени М.В. Ломоносова, 119991, Москва, Ленинские горы, 1
Поступила в редакцию 29.11.2019 г.
После доработки 29.11.2019 г.
Принята к публикации 17.02.2020 г.
Астаксантин и его эфиры, относящиеся ко «вторичным» каротиноидам, синтезируются при
действии стресса в клетках Нaematococcus рluvialis, которые из вегетативного состояния переходят в
состояние гематоцист. Стрессовые факторы могут влиять не только на скорость и направление
синтеза, но и на конформационные изменения в молекуле пигментов, вызывая переход trans-
изомеров в cis-изомеры. Целью данного исследования является оценка эффективности действия
разных факторов (полярности среды и света) на процесс изомеризации trans-изомеров в cis-
изомеры астаксантина. При изучении действия этих факторов на процесс образования 9-cis- и 13-
cis-изомеров из растворов all-trans-астаксантина при 50°С показали, что растворители средней
полярности более эффективно стабилизируют cis-изомеры, чем сильно полярные, в то время как
аполярные растворители не способствуют стабилизации cis-изомеров. Наличие π-связей в
молекуле растворителя также положительно сказывается на процессе изомеризации. При изучении
влияния показателя преломления различных растворителей на поляризуемость астаксантина
выявили разные зависимости для полярных и аполярных растворителей. Предположили, что
растворители средней полярности облегчают процесс trans-cis-изомеризации астаксантина
благодаря снижению энергии крутильного момента и стабилизации молекулы в cis-конформации
за счет снижения отталкивания диполей метильных групп в полиеновой цепи и иононовом кольце.
Облучение светом растворов астаксантина при 25°С приводило к большему образованию cis-
изомеров в начальный период времени (четыре часа) по сравнению с облучением в течение шести и
более часов. При более длительном освещении происходил распад астаксантина с образованием
продуктов деструкции и окисления.
Ключевые слова: астаксантин, trans- и cis-изомеры, полярность, показатель преломления, метод
ВЭЖХ.
DOI: 10.31857/S0006302920030102
мер, в человеческой крови до 30% от всего астак-
Астаксантин относится к ксантофиллам и со-
сантина может приходится на долю cis-изомеров
держит две гидроксильные и две карбонильные
группы в молекуле. Как и другие каротиноиды,
[1]. Также известно, что cis-изомеры лучше сор-
астаксантин имеет длинную полиеновую угле-
бируются плазмой крови, чем all-trans-изомеры
[2]. Как и другие представители каротиноидов,
родную цепь, поэтому молекула может существо-
вать в виде большого количества геометрических
астаксантин обладает антиоксидантными свой-
(рис. 1) и оптических изомеров. В природе астак-
ствами [3, 4], причем известно, что cis-изомеры
сантин представлен в основном all-trans-изоме-
обладают более высокой антиоксидантной актив-
ром, когда углероды при всех двойных связях рас-
ностью [5], а значит, могут оказывать более высо-
полагаются в trans-положении относительно друг
кий антиоксидантный эффект на весь организм.
друга. В то же время cis-изомеры астаксантина
Было показано, что реакция изомеризации об-
могут накапливаться в телах животных, напри-
ратима [6], поэтому менее стабильные cis-изоме-
Сокращениe: ВЭЖХ - высокоэффективная жидкостная
ры со временем переходят в свою более устойчи-
хроматография.
вую all-trans-конфигурацию. Известно, что
512
ВЛИЯНИЕ ПРИРОДЫ РАСТВОРИТЕЛЯ И ОСВЕЩЕНИЯ
513
(а)
О
ОН
3'
13'
9'
9
13
3
1'
НО
О
(б)
(в)
9
3
13
3
НО
НО
О
О
О
3'
О
ОН
3'
ОН
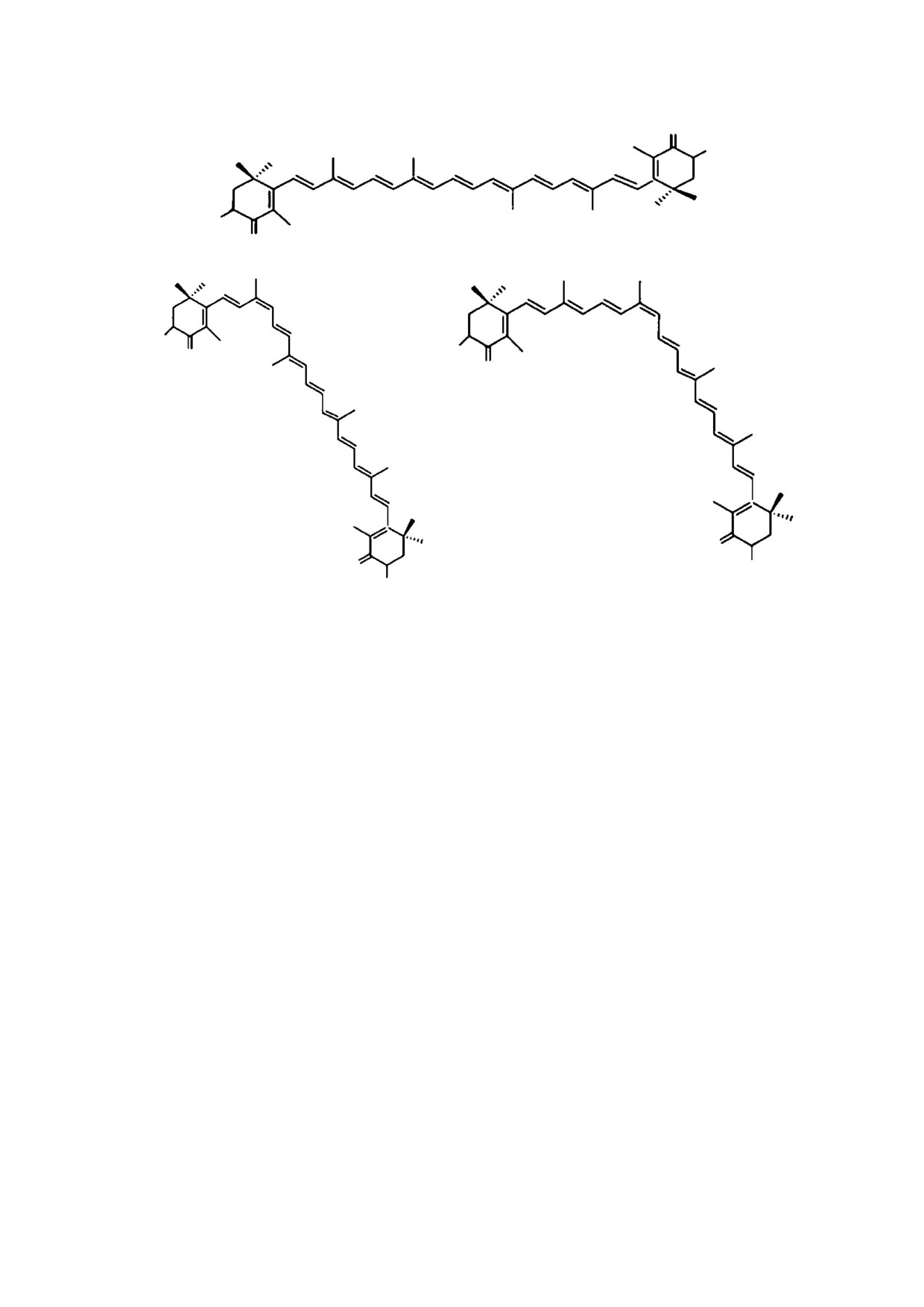
Рис. 1. Геометрические изомеры астаксантина: (а) - all-trans-изомер, (б) - 9Z-изомер, (в) - 13Z-изомер.
изомеризация астаксантина активируется под
МАТЕРИАЛЫ И МЕТОДЫ
действием многих факторов: растворителей, тем-
Используемые реактивы. В работе были ис-
пературы, ионов металлов, рН реакционной
пользованы астаксантин, гексан для ВЭЖХ, аце-
среды [6-9]. Несмотря на многочисленность ис-
тонитрил для ВЭЖХ, метанол для ВЭЖХ, этил-
следований, небольшое число используемых рас-
ацетат для ВЭЖХ (все - производства компании
Sigma-Aldrich, США); ацетон, хлороформ, ди-
творителей не позволило сформулировать зако-
хлорметан, тетрахлорметан, толуол, бензол, бута-
номерности процесса. Кроме того, практически
нол-1, тетрагидрофуран, диметилсульфоксид,
отсутствуют систематические исследования по
изопропанол, этанол, пиридин, диоксан (все -
влиянию света на процесс изомеризации, хотя
квалификации
«х.ч.», производства компании
астаксантин и его эфиры синтезируется микрово-
«Химмед», Россия). Деионизованную воду с
дорослями именно под действием интенсивного
удельным сопротивлением 18.2 MОм/cm получа-
облучения, что делает необходимым исследова-
ли с помощью очистительной системы Milli-Q In-
tegral 10 (Millipore, США).
ния такого типа. Ранее было показано, что интен-
сивное освещение эфиров астаксантина вызыва-
Идентификация all-trans- и cis-изомеров астак-
сантина методом высокоэффективной жидкостной
ет окислительную деструкцию и образование
хроматографии с масс-детекцией и детекцией в ви-
апо- и эпокси-производных астаксантина [10, 11].
димой области. Разделение изомеров свободного
На примере других каротиноидов, например зе-
астаксантина оценивали методом высокоэффек-
аксантина, было показано, что свет вызывает
тивной жидкостной хроматографии (ВЭЖХ) на
изомеризацию каротиноидов [12].
жидкостном хроматографе Agilent 1200 series (Ag-
ilent Technologies, США) с диодноматричным де-
Целью данного исследования является оценка
тектором на обратно-фазовой колонке Exlipse
эффективности действия разных факторов (по-
XDB-С18 (250×4.6 мм, размер частиц 5 мкм). Де-
лярности среды, строения молекулы растворите-
текцию осуществляли при длине волны 480 нм. В
ля и влияние света) на процесс изомеризации
качестве подвижной фазы использовали систему:
trans-изомеров в cis-изомеры астаксантина.
МeOH : CH2Cl2 : CH3CN : H2O - 82.5 : 5 : 5.5 : 7.
БИОФИЗИКА том 65
№ 3
2020
514
КУЛИКОВ и др.
Режим - изократический на протяжении всего
2
(
n
−
1)
−1
4
−1
анализа, скорость потока 800 мкл/мин, объем
Δν
(
см
)
=
-5.5×10
× Δα ×
M
W
×
,
2
вводимой пробы 40 мкл, температура 30°С.
n
+
2
(
)
ВЭЖХ с масс-детекцией проводили в режиме
где Δα - разница между поляризуемостью в воз-
положительных ионов в диапазоне масс-ионов
бужденном и основном состоянии, MW - молеку-
0-1000 m/z.
лярная масса, n - показатель преломления среды,
Образование cis-изомеров астаксантина в при-
Δν - дисперсионный сдвиг растворителя.
сутствии органических растворителей при 50°С.
Используя собственные и литературные дан-
Стоковый раствор свободного астаксантина в ме-
ные, мы получили линейную зависимость макси-
таноле (0,01 мг/мл) объемом 1,5 мл разделяли на
мума поглощения астаксантина в см-1 (ν) от по-
15 образцов по 100 мкл и упаривали на концен-
казателя преломления (n) растворителя:
траторе. Упаренный образец растворяли в 1,5 мл
органического растворителя и инкубировали в
ν = ν0 +p ∙ f(n2),
термостате при постоянной температуре 50°С в
полной темноте в течение 4 ч. Детектировали со-
где ν0 - значение максимума поглощения хромо-
держание образовавшихся cis-изомеров методом
фора в состоянии вакуума, р - наклон кривой.
ВЭЖХ каждый час.
На рис. 2 изображены полученные зависимо-
сти для астаксантина в различных растворителях,
Все пробы, вводимые в хроматографическую ко-
лонку, были растворены в метаноле. Для расчета
разбитых на две группы: полярные (ε > 1.15n2) и
концентраций all-trans-, 9-cis- и 13-cis-изомеров в
неполярные (ε ≤ 1.15n2) [16], где ε - диэлектриче-
исследуемых образцах использовали соответственно
ская проницаемость среды.
коэффициенты экстинкции
125000 л/(моль · см),
Как видно из представленного рисунка, дан-
247660 л/(моль · см) и 190512 л/(моль · см) [13].
ные по зависимости для полярных и неполярных
Образование cis-изомеров и деструкция астаксанти-
растворителей отличаются показателем ν0, кото-
на под действием синего света при температуре 25С.
рые равны соответственно 23.799 и 22.964 для не-
Стоковый раствор свободного астаксантина в мета-
полярных и полярных растворителей и углом на-
ноле (0.01 мг/мл) объемом 2 мл разделяли на два об-
клона p (-11.383 против -8.847).
разца по 1 мл. Контрольный образец находился без
При разделении всех растворителей на две
доступа света в холодильнике (5°С) на протяжении
группы - неполярные и полярные, согласно кри-
четырех суток, опытный образец освещали синим
терию ε > 1.15n2 для полярных и ε ≤ 1.15n2 для не-
спектром излучения (450-500 нм) с интенсивностью
полярных - коэффициент корреляции оказался
500 мкмоль · м-2 · с-1 при комнатной температуре
выше (-0.9596 и -0.9742), чем при объединении
(25°С) в течение четырех суток. На спектрофотометре
всех растворителей в одну группу (-0.941), что
UV-Vis Cary 50 (Varian, США) раз в сутки измеряли
видно из табл. 2.
оптическую плотность исследуемых растворов, а про-
Это означает, что взаимодействие между моле-
цесс изомеризации trans → cis изучали методом ВЭЖХ.
кулой астаксантина и растворителем различается
в растворителях разной полярности, поэтому не-
обходимо рассматривать его поведение отдельно
РЕЗУЛЬТАТЫ
в двух группах. Вероятно, такая зависимость свя-
Зависимость спектра поглощения раствора
зана с тем фактором, что при поглощении энер-
астаксантина от полярности растворителя. При ис-
гии молекула хромофора становится диполем,
следовании спектров поглощения астаксантина в
который по-разному взаимодействует с неполяр-
органических растворителях отметили, что про-
ными и полярными растворителями [17].
исходит сдвиг максимума поглощения для астак-
Идентификация all-trans- и cis-изомеров астак-
сантина от 478 нм к 490 нм, при переходе от рас-
сантина методом высокоэффективной жидкостной
творителей с меньшим показателем преломления
хроматографии с детекцией в видимой области и
n (ацетон, метанол) к растворителям с большим
масс-детектором. Как уже отмечалось выше, all-
значением (пиридин, бензол, ДМСО) (табл. 1).
trans-изомеры астаксантина способны при повы-
Эти результаты хорошо согласуются с литератур-
шении температуры или при облучении образо-
ными данными [14], поскольку энергетический
вывать cis-изомеры. Идентификация all-trans- и
переход электронов на S2 очень чувствителен к n.
cis-изомеров проводилась методом ВЭЖХ по из-
вестной методике [6]. Для анализа использовался
Корреляция между максимумом поглоще-
раствор астаксантина в метаноле, содержащий
ния хромофора в растворителе и показателем
10% cis-изомеров. Он был получен инкубацией
преломления этого растворителя выражается
метанольного раствора астаксантина в течение
уравнением [15]:
4 ч при 50°С. На рис. 3 представлена хромато-
БИОФИЗИКА том 65
№ 3
2020
ВЛИЯНИЕ ПРИРОДЫ РАСТВОРИТЕЛЯ И ОСВЕЩЕНИЯ
515
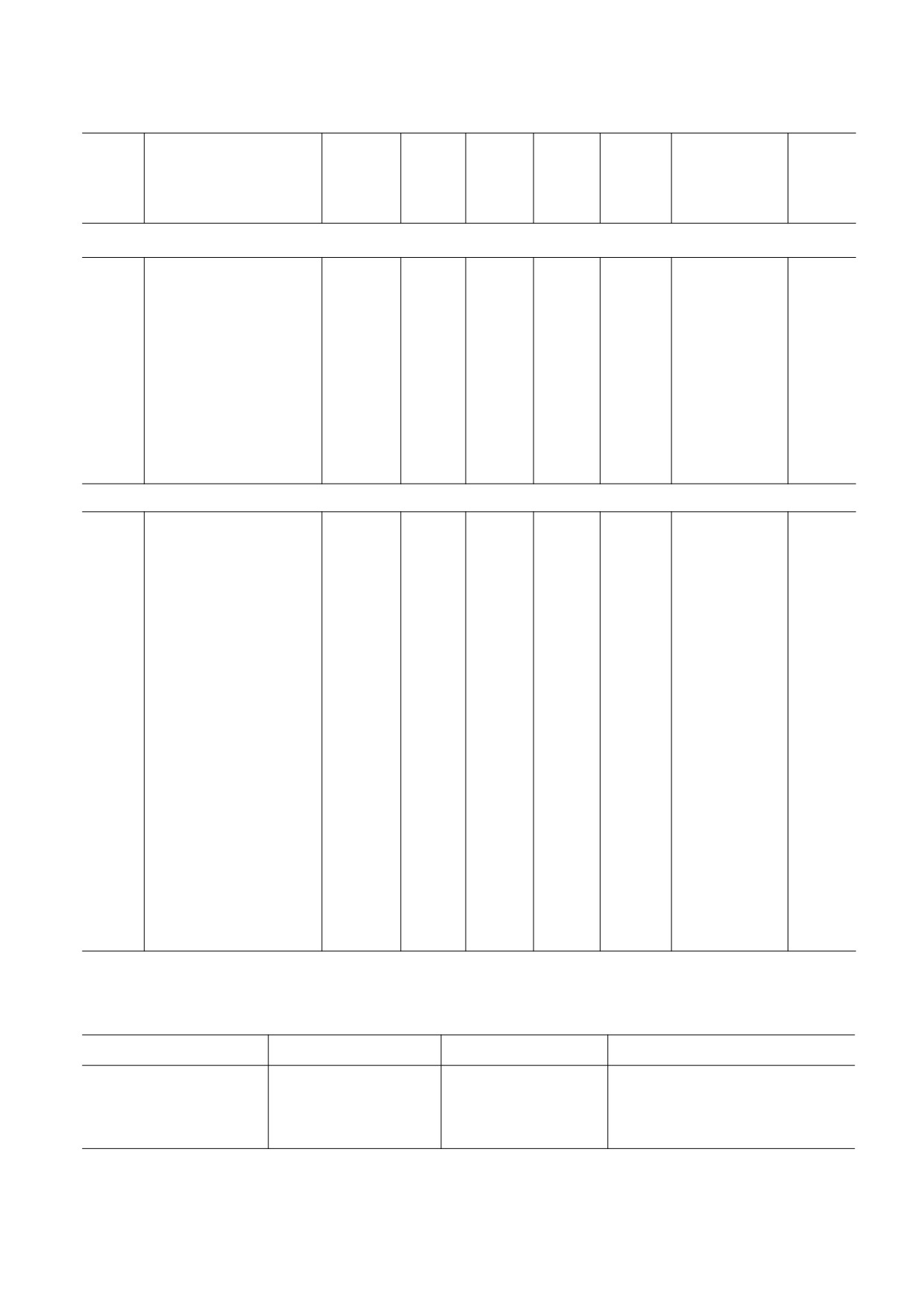
Таблица 1. Физико-химические параметры органических растворителей
Число
n2 - 1
№
νаст ∙ 103,
неподеленных
Число
Растворитель
n
----
ε
μ, Дебай
точки
см-1
электронных
π-связей
n2 + 2
пар
Неполярные растворители
1
н-Гексан*
21.19
1.365
0.223
1.88
0.00
0
0
2
Петролейный эфир*
21.1416
1.428
0.257
1.88
0.00
0
0
3
Циклогексан*
20.92
1.429
0.258
2.02
0.00
0
0
4
Диоксан
20.75
1.42
0.253
2.21
0.00
4
0
5
Тетрахлорметан
20.62
1.46
0.274
2.24
0.00
12
0
6
Бензол
20.49
1.501
0.295
2.23
0.00
0
3
7
Толуол*
20.408
1.497
0.293
2.378
0.37
0
3
8
CS2*
19.76
1.624
0.353
2.64
0.00
4
2
Полярные растворители
9
Метанол
21.14
1.329
0.203
32.66
1.71
2
0
10
Ацетонитрил
21.1
1.345
0.212
38.00
3.94
1
2
11
Ацетон
21.05
1.359
0.220
20.70
2.85
2
1
12
EtAc
21.05
1.37
0.226
27.8
1.78
4
1
13
Этанол
21.01
1.362
0.222
24.55
1.68
2
0
14
Изо-пропанол
20.92
1.384
0.234
18.30
1.68
2
0
15
Бутанол-1
20.92
1.40
0.242
17.80
1.68
2
0
16
Дихлорметан
20.58
1.424
0.255
9.08
1.55
6
0
17
Хлороформ
20.45
1.446
0.267
4.72
1.06
9
0
18
Пиридин
20.33
1.509
0.299
12.3
2.20
1
3
19
ДМСО
20.33
1.479
0.284
46.45
3.96
4
2
20
Бензиловый спирт
20.32
1,54
0.315
13.0
1.71
2
3
21
Хлорбензол*
20.28
1.525
0.306
5.61
1.69
3
3
22
Иодметан*
20.16
1.53
0.309
7.0
1.64
3
0
23
Этиловый эфир
20.16
1.56
0.323
6.1
2.14
4
5
коричной кислоты*
Примечание. Знаком * помечены данные из работы [14]; νаст - положение максимума поглощения, выраженное в см-1.
Таблица 2. Значения основных параметров уравнения ν = ν0 + p ∙ f(n2) для растворов астаксантина
Растворители
ν0
-p, см-1
Коэффициент корреляции r
Неполярные
23.799
11.383
-0.9596
Полярные
22.964
8.847
-0.9742
Сумма всех растворителей
23.161
9.4423
-0.941
БИОФИЗИКА том 65
№ 3
2020
516
КУЛИКОВ и др.
21.4
1
21.2
10
2
13
9
21.0
3
1112
20.8
14
154
5
20.6
6
16
20.4
22
17
20
7
18
19
23
20.2
21
20.0
8
19.8
19.6
0.20
0.25
0.30
0.35
2
Поляризуемость растворителя, (n2- 1)/(n
+ 2)
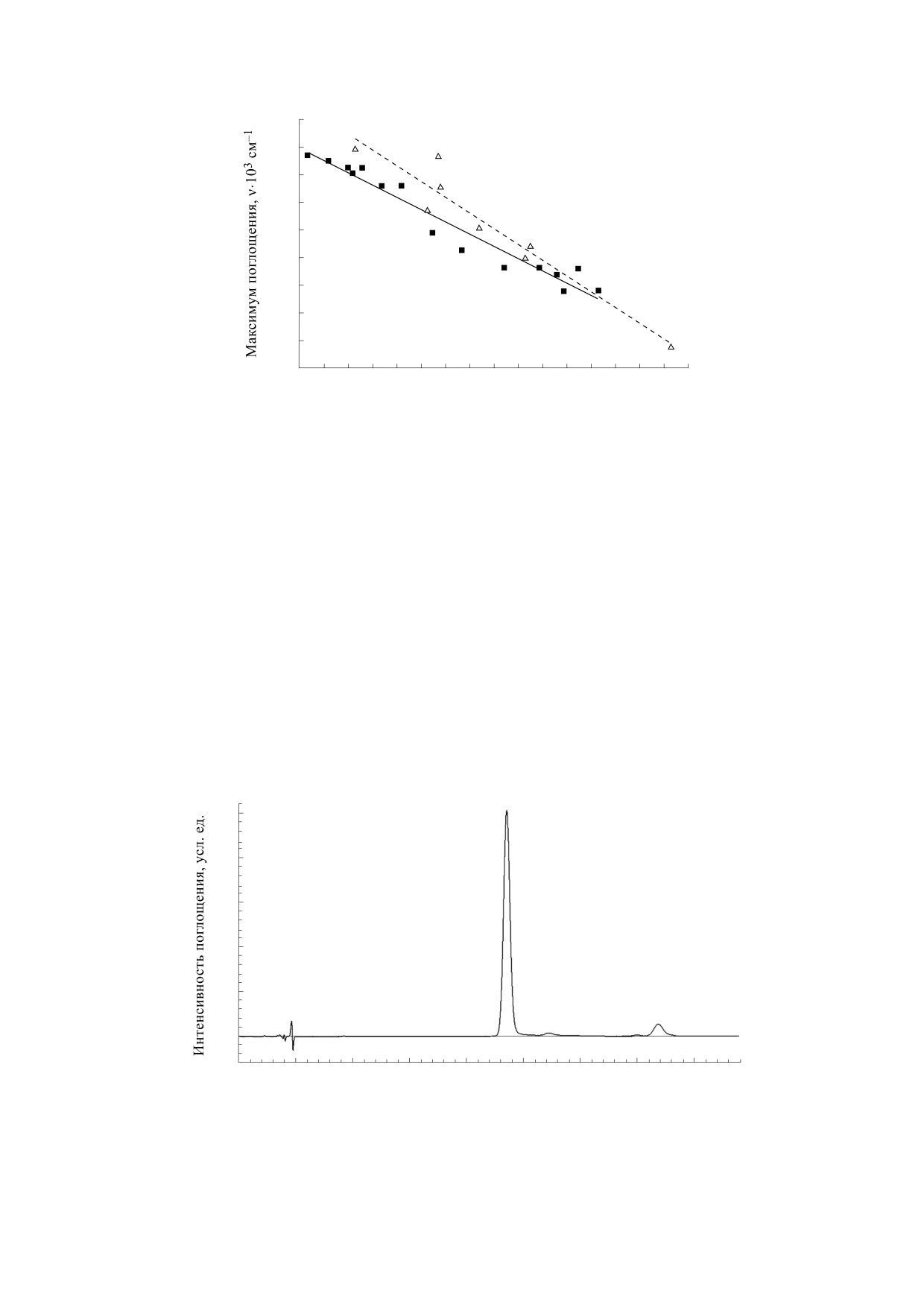
Рис. 2. Зависимости максимумов поглощения растворов астаксантина в различных органических растворителях от
поляризуемости растворителя. Точки на рисунке соответствуют номерам в табл. 1. Обозначения: треугольники -
неполярные растворители, пунктирная линия - тренд для неполярных растворителей; квадраты - полярные
растворители, сплошная линия - тренд для полярных растворителей.
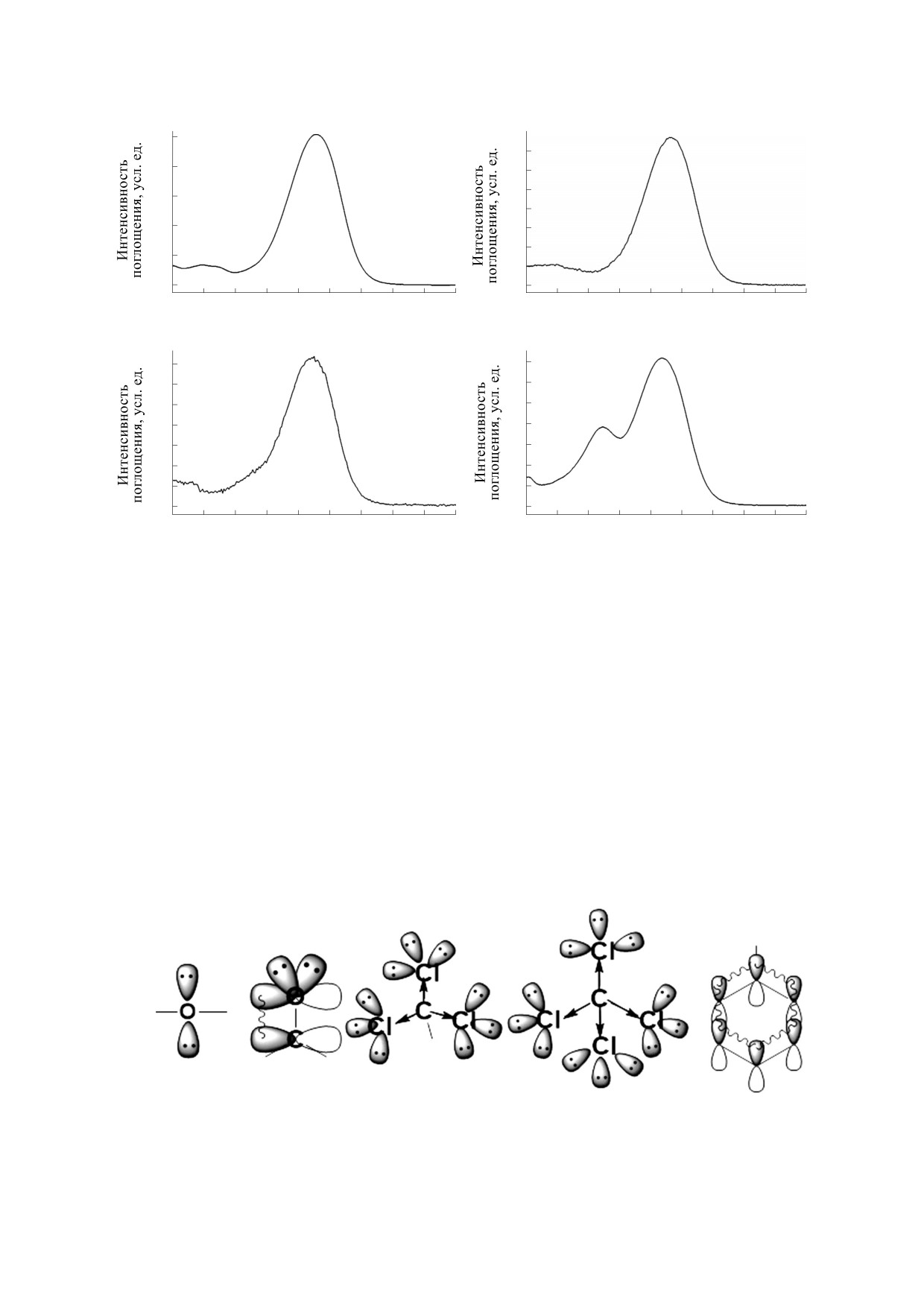
грамма данного образца. Как видно из рисунка,
соответствует неизвестному нам изомеру
смесь изомеров удалось разделить на четыре пи-
(рис. 4б). Пики 3 и 4 были идентифицированы
ка, каждый пик соответствует определенному
как 9-cis- (рис. 4в) и 13-cis-изомеры (рис. 4г) соот-
изомеру (all-trans - пик 1, 9-cis - пик 3, 13-cis -
ветственно по характерному сдвигу максимума
пик 4). Пик 2 идентифицировать не удалось.
поглощения в область меньших длин волн
Для качественного подтверждения изомеров
(для 13-cis-изомера - 468 нм, для 9-cis-изомера -
для каждого пика были сняты спектры в видимой
472 нм), а также по появлению второго максиму-
области (рис. 4). Как видно из рис. 4а, максимум
ма поглощения для 13-cis-изомера (370 нм).
поглощения для пика 1 соответствует известным
значениям all-trans-изомера и равен 480 нм [6].
Методом масс-спектрометрии установили,
Спектр поглощения пика 2 аналогичен пику 1,
что пики 1-4 имеют один и тот же масс-ион, рав-
но, поскольку в 100%-м чистом all-trans-изомере
ный 597.3, что соответствует свободной форме
он не наблюдается, был сделан вывод, что пик 2
астаксантина. Это подтверждает вывод о том, что
1
250
200
150
100
50
4
2
3
0
0.0
2.5
5.0
7.5
10.0
12.5
15.0
17.5
20.0
Время, мин
Рис. 3. Хроматограмма раствора астаксантина в метаноле, содержащего 10% cis-изомеров: 1 - all-trans-астаксантин,
2 - неизвестный cis-астаксантин, 3 - 9-cis-астаксантин, 4 - 13-cis-астаксантин.
БИОФИЗИКА том 65
№ 3
2020
ВЛИЯНИЕ ПРИРОДЫ РАСТВОРИТЕЛЯ И ОСВЕЩЕНИЯ
517
(а)
(б)
250
3.5
200
3.0
2.5
150
2.0
100
1.5
1.0
50
0.5
0
0.0
300
400
500
600
700
300
400
500
600
700
Длина волны, нм
Длина волны, нм
(в)
(г)
1.4
14
1.2
12
1.0
10
0.8
8
0.6
6
0.4
4
0.2
2
0.0
0
300
400
500
600
700
300
400
500
600
700
Длина волны, нм
Длина волны, нм
Рис. 4. Спектры поглощения пиков 1-4 хроматограммы, представленной на рис. 3: (а) - all-trans-астаксантин, (б) -
неизвестный изомер астаксантина, (в) - 9-cis-астаксантин, (г) - 13-cis-астаксантин.
пики 1-4 являются изомерами одного и того же
рых изображены электронные облака неподелен-
вещества.
ных электронных пар и волнистыми линиями -
π-связи. Температура 50°С была выбрана потому,
Образование cis-изомеров астаксантина в при-
что скорость изомеризации растет с повышением
сутствии органических растворителей при 50С.
температуры [7], однако параллельно с этим про-
Далее исследовали процесс изомеризации all-
текает и термическая деструкция астаксантина:
trans-астаксантина при 50°С в течение 4 ч в рас-
при значениях выше 50°С его молекула начинает
творе четырнадцати органических растворите-
разрушаться.
лей, отличающихся друг от друга показателем
преломления, диэлектрической проницаемо-
Предварительно исследовали состояние кри-
стью, дипольным моментом и количеством непо-
сталлического астаксантина при нагревании до
деленных электронных пар и π-связей (табл. 1).
50°С в течение 4 ч, при котором не наблюдалось
Дополнительно для некоторых растворителей на
появления cis-изомеров. В отличие от кристалли-
рис. 5 приведены структурные формулы, на кото- ческого состояния, растворенный астаксантин
СН3
НС3
Н
Н
НС3
СН3
Рис. 5. Примеры структур некоторых растворителей (слева направо: метанол, ацетон, хлороформ, тетрахлорметан,
толуол).
БИОФИЗИКА том 65
№ 3
2020
518
КУЛИКОВ и др.
тенсивность как all-trans-изомера, так и cis-изо-
9.00
17
меров, что объясняется деструкцией молекулы.
8.00
Это предположение подтверждается появлением
продуктов распада в образце, поглощающих в об-
15 14
7.00
ласти 200-250 нм. Поскольку в других используе-
20
18
мых нами растворителях не наблюдается подоб-
12
6.00
13
ной деструкции астаксантина, зависимость со-
держания cis-изомеров от ε изучалась без учета
9
5.00
ацетона и не была учтена при расчете коэффици-
10
ента корреляции.
4.00
19
Поскольку в ходе изомеризации образуются
сразу несколько cis-изомеров (преимущественно
3.00
9-cis- и 13-cis-изомеры), то для правильного отра-
2.000.0
жения эффекта растворителя на стабильность
10.0
20.0
30.0
40.0
50.0
изомеров использовалась их сумма. Этот момент
Диэлектрическая проницаемость
имеет большое значение, поскольку в некоторых
растворителях (например, в диметилсульфоксиде
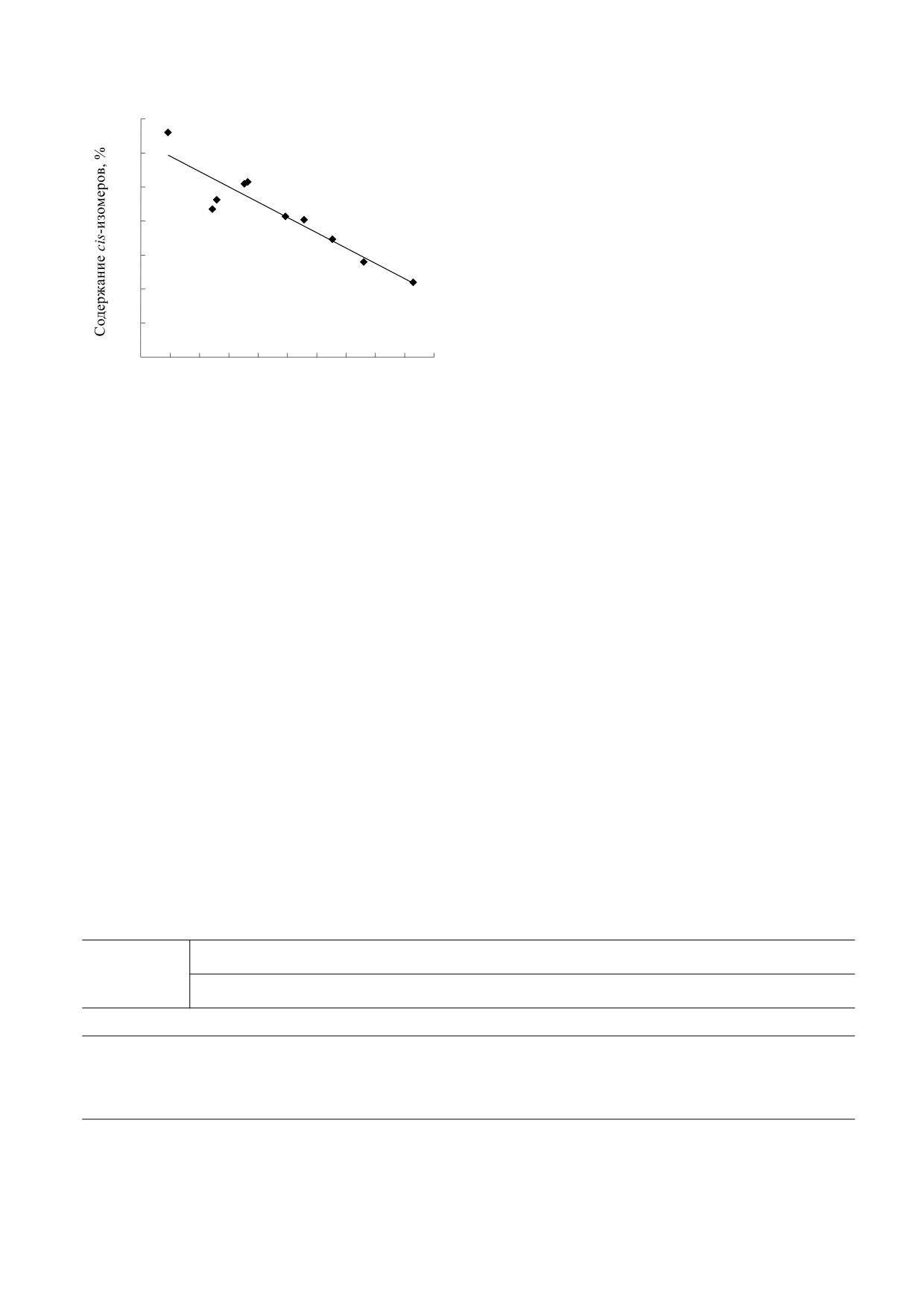
Рис. 6. Зависимость содержания cis-изомеров астак-
и ацетонитриле) содержание 9-cis-изомера рав-
сантина в анализируемой пробе от диэлектрической
няется 0.3%, а в ацетоне - достигает почти 3%.
проницаемости растворителя при инкубации в те-
чение 4 ч при 50°С. Нумерация образцов соответ-
Образование cis-изомеров и деструкция астак-
ствует нумерации в табл. 1. Коэффициент корреля-
сантина под действием синего света при температу-
ции r = -0.97.
ре 25С. Другим фактором для инициации про-
цесса изомеризации стало облучение синим све-
подвергается изомеризации, но в каждом раство-
том (λ = 450-500 нм). Свет именно такого
рителе содержание cis-изомеров различается
диапазона был выбран потому, что максимум по-
между собой.
глощения астаксантина в большинстве органиче-
ских растворителей попадает в эту область. Ме-
Итак, процесс изомеризации происходит
танол был выбран в качестве растворителя для
только в растворе, причем эффект стабилизации
данного анализа, поскольку способствует стаби-
растворителями отличается для полярных и апо-
лизации cis-изомеров, не вызывает деструкции
лярных растворителей. Поэтому далее проанали-
астаксантина и устойчив к облучению в отличие
зировали наличие корреляции между накопле-
от, например, хлороформа, в котором астаксан-
нием cis-изомеров в реакционной среде после
тин обесцвечивался всего за несколько часов об-
инкубации при 50°С и диэлектрической прони-
лучения.
цаемостью растворителя отдельно для полярных
растворителей. Точки на рисунке 6 соответствуют
Метанольный раствор астаксантина непре-
среднему значению после трех повторов и указа-
рывно облучался в течение четырех суток синим
ны согласно порядковому номеру растворителя
светом при комнатной температуре (25°С). Мето-
в таблице 1. Оказалось, что зависимость между
дом ВЭЖХ каждый час изучали состав облучен-
этими показателями имеет достаточно высокий
ного образца, усредненные результаты по трем
коэффициент корреляции, который составил
повторам представлены в табл. 3. Как можно ви-
r = -0.97.
деть из представленных данных, содержание изо-
Стоит отметить, что при проведении экспери-
меров при облучении в течение первых пяти ча-
мента в ацетоне значительно уменьшилась ин-
сов резко увеличивалось, а затем выходило на
Таблица 3. Зависимость содержания cis-изомеров в метанольном образце астаксантина от времени облучения
Время облучения, ч
Изомеры
астаксантина
0
1
2
3
4
5
6
7
24
48
72
96
Содержание изомеров в зависимости от времени облучения, %
All-trans-
100
89.46
89.78
90.65
90.65
91.71
91.56
89.64
88.53
87.86
86.23
85.75
9-cis-
0
0.31
0.55
0.67
0.85
1.15
1.09
1.13
1.14
1.17
1.2
1.21
13-cis-
0
1.71
2.44
2.87
3.04
3.04
3.90
2.76
2.60
2.53
2.27
2.08
Примечание. Значения усреднены по трем опытам.
БИОФИЗИКА том 65
№ 3
2020
ВЛИЯНИЕ ПРИРОДЫ РАСТВОРИТЕЛЯ И ОСВЕЩЕНИЯ
519
6.0
5.0
4.0
3.0
2.0
1.0
0.0
0 часов 1 час
2 часа
3 часа
4 часа 5 часов 6 часов 7 часов 1 сутки 2 суток 3 суток 4 суток
Время облучения
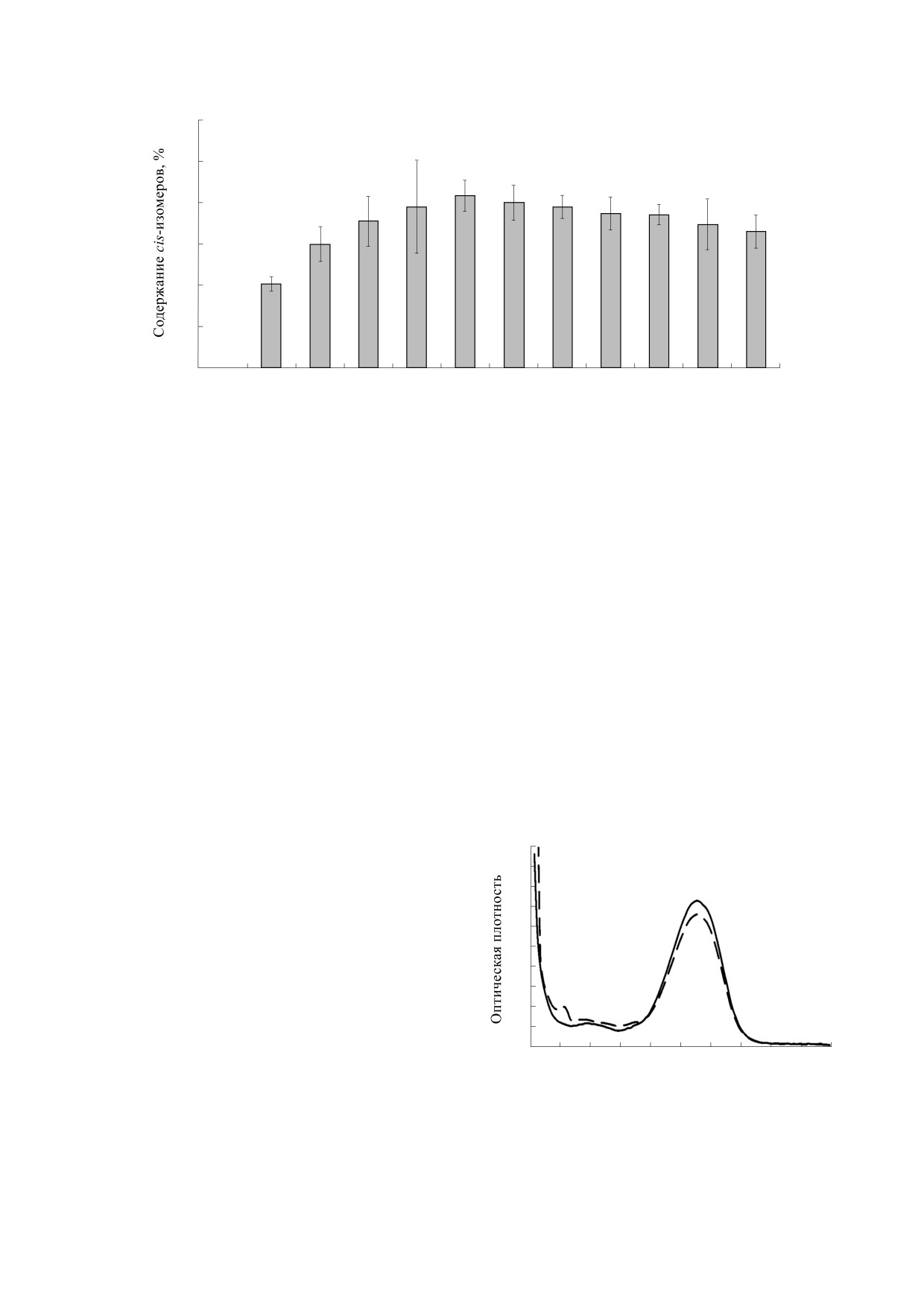
Рис. 7. Суммарное содержание cis-изомеров астаксантина в образце в зависимости от времени его облучения.
плато, и начинало снижаться. После облучения в
Подобную зависимость можно наблюдать и
течение семи часов было обнаружено достовер-
для максимума поглощения растворов каротино-
ное падение содержания 13-cis-изомеров, и сле-
идов. Однако в случае каротиноидов эта зависи-
дующее измерение было проведено на 24-й час с
мость отличается от других хромофоров за счет
момента облучения, а затем измерялось каждые
иононового кольца, а также карбонильных групп,
24 часа. Как видно из табл. 3, содержание 13-cis-
которые также оказываются сопряженными с
изомеров продолжало уменьшаться до конца экс-
главной цепью. Для учета сопряженных связей в
перимента. Исходя из этого, можно сделать вы-
вод, что при длительном облучении происходит
концевых циклах принято использовать показа-
разрушение молекулы астаксантина.
тель Neff [19], который равняется 0.3N по сравне-
Суммарное содержание обоих cis-изомеров
нию с обычным сопряжением. Такое значение
повторяет динамику содержания 13-cis-изомера
связано с уменьшением перекрывания p-орбита-
(рис. 7).
лей для сопряженных двойных связей полиено-
вой цепи и кольца, расположенного вне плоско-
Концентрация all-trans-астаксантина начина-
ет падать уже после первого часа, это означает,
сти цепи из-за стерических факторов. Хотя конъ-
что астаксантин медленно разрушается под дей-
югированный концевой цикл вносит вклад в
ствием света. Продукты деградации видны на
длину цепи конъюгации, он расширяет ее на эк-
спектрах поглощения облученных растворов
вивалент только 0.3 связи C=C.
(рис. 8). Рост оптической плотности в синей об-
ласти является подтверждением того, что полие-
новая цепь разрушилась до более коротких про-
2.0
дуктов распада (апо- и эпокси-соединения). Уве-
1.8
личение поглощения в области
250-260 нм
1.6
соответствует максимуму поглощения апо-9-
1.4
астаксантинона [11]. Полученные данные говорят
1.2
о том, что при облучении светом в течение четы-
рех часов уже образуется этот продукт де-
1.0
струкции.
0.8
0.6
0.4
ОБСУЖДЕНИЕ
0.2
Зависимость электронного переноса S0→S2 от
0.0
200
300
400
500
600
700
структуры каротиноида. Ранее в работе [18] была
Длина волны, нм
продемонстрирована систематическая зависи-
мость измеренного времени жизни состояния S1
Рис. 8. Спектры поглощения раствора астаксантина
от длины конъюгации для толуольных растворов
в метаноле до облучения (сплошная линия) и после
β-каротина.
облучения в течение 4 ч (прерывистая линия).
БИОФИЗИКА том 65
№ 3
2020
520
КУЛИКОВ и др.
разом, возникающее диполь-дипольное отталки-
21500
вание положительно заряженных метильных
21000
N=9
групп вызывают вращающий момент, благодаря
чему cis-изомер стремится вернуться в исходное
20500
N=10
β-Каротин
all-trans состояние. Этого взаимодействия не на-
20000
Nэфф=9.6
блюдается для 13-cis-изомера, поскольку метиль-
Астаксантин
ная группа при С13 и С13' располагается с другой
N=11
19500
Nэфф = 10.2
стороны полиеновой цепи. Этим объясняется тот
факт, что содержание 13-cis-изомера значительно
19000
N=12
выше, чем 9-cis-изомера.
18500
N=13
Известно, что для инициации процесса изоме-
18000
ризации необходимо преодолеть энергетический
0.075
0.085
0.095
0.105
0.115
барьер для крутильных колебаний вокруг двой-
эфф
1/N
ной связи. Чтобы преодолеть этот барьер, моле-
кулу астаксантина облучают светом. В таком слу-
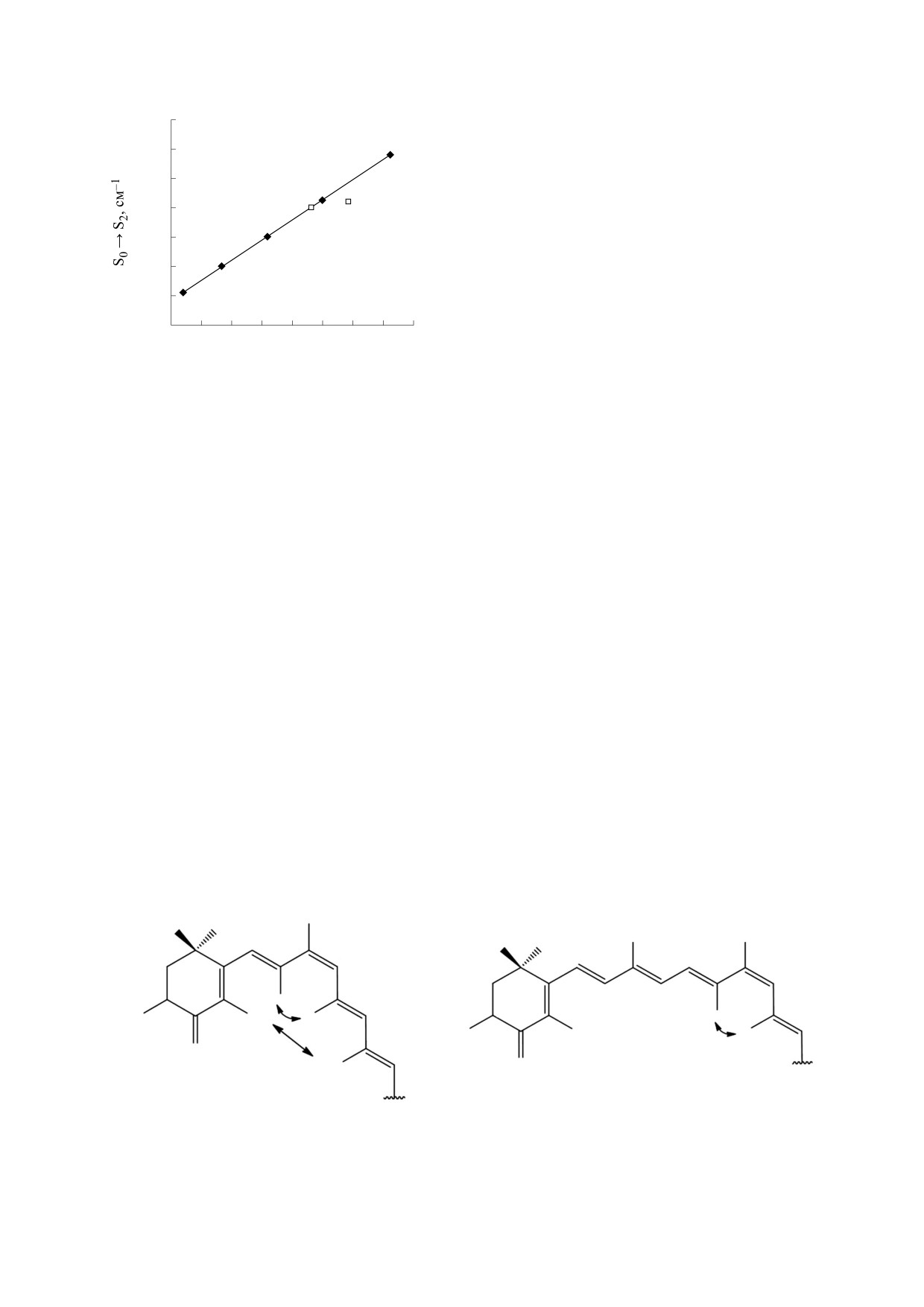
Рис. 9. Зависимость электронного переноса S0→S2 см-1
чае образуется радикальный аддукт, а двойная
от обратного числа сопряженных двойных связей (N)
связь по свойствам становится близка к одинар-
для линейных каротиноидов в гексане [19].
ной, атомы углерода находятся в sp3-гибридиза-
ции, благодаря чему появляется способность к
Таким образом, с учетом всех двойных связей
вращению вокруг центральной связи. При погло-
астаксантина, получается, что молекула содержит
щении энергии в виде света или тепла электроны
девять С=С-связей полиеновой цепи, две С=С- и
переходят в возбужденное состояние π→π*. Если
две С=О-связи в иононовом кольце. С учетом
не происходит флуоресценции, то энергия воз-
этого Neff = 9.0 + 0.6 + 0.6 = 10.2. Это значение
бужденного электрона может переходить в коле-
полностью соответствует зависимости максиму-
бательную и вращательную энергию. Вращение
ма поглощения от длины сопряжения (рис. 9). На
вокруг центральной связи может стать таким, что
рис. 9 добавлены собственные данные к имею-
возбужденные cis-trans-состояния могут перехо-
щимся в работе [19].
дить друг в друга. Поскольку энергия возбужден-
ного состояния cis-изомера выше, чем возбуж-
Стабилизация органическими растворителями
денного trans-изомера, то молекула больше вре-
cis-изомеров астаксантина. При пространствен-
мени находится в виде cis-изомера.
ном рассмотрении строения cis-изомеров астак-
сантина (рис. 10) видно, что метильные группы
При использовании растворителей с пример-
при пятом и тринадцатом атомах углерода, кото-
но одинаковой диэлектрической проницаемо-
рые образуют диполи с зарядом δ+, при опреде-
стью (точки 4-6), содержание cis-изомеров астак-
ленном изгибе молекулы могут быть расположе-
сантина выше в том растворителе, который со-
ны близко друг к другу, из-за чего возникают
держит сопряженную π-электронную систему
сильные электронные отталкивания.
(бензол). Мы предполагаем, что π-электроны
Это отталкивание особенно важно для 9-cis-
растворителя взаимодействуют с возбужденными
изомера, поскольку при повороте молекулы во-
π*-электронами подвергающейся изомеризации
круг двойной С9=С10 связи метильная группа
двойной связи. В результате такого взаимодей-
при С13 оказывается близко расположена по от-
ствия происходит стабилизация cis-изомера
ношению к метильной группе при С5. Таким об-
(рис. 11).
СН3
НС3
СН3
СН3
СН3
7
НС3
СН3
1
8
7
9
10
2
6
8
10
12
1
9
11
13
2
6
3
5
11
4
Н
3
5
НО
СН3
Н
12
Н
4
НО
СН3
Н
13
О
НС3
О
9-cis-изомер
13-cis-изомер
Рис. 10. Структура cis-изомеров астаксантина.
БИОФИЗИКА том 65
№ 3
2020
ВЛИЯНИЕ ПРИРОДЫ РАСТВОРИТЕЛЯ И ОСВЕЩЕНИЯ
521
СН3
СН3
НС3
СН3
11
13
7
1
9
2
6
8
10
12
3
5
4
НО
О
СН3
СН3
СН3
НС3
СН3
О
ОН
Рис. 11. Стабилизация cis-изомера астаксантина растворителем с π-системой на примере бензола. Волнистой линией
указаны π-связи в бензоле и их сопряжение с π-электронами астаксантина в месте протекания изомеризации.
Также наблюдается определенная зависимость
метаноле методом ВЭЖХ было показано, что как
содержания cis-изомеров от диэлектрической
первые, так и вторые образцы не содержат cis-
проницаемости растворителя. В неполярных рас-
изомеров. Это означает, что изомеризация не
творителях cis-изомеров значительно меньше,
протекает (либо протекает очень медленно) в
чем в полярных. Вероятно, это связано с отсут-
кристаллическом виде, т.е. растворитель выпол-
ствием диполь-дипольных взаимодействий меж-
няет роль стабилизатора в процессе изомери-
ду астаксантином, который после возбуждения
зации.
получает дипольный момент, и неполярным рас-
творителем, не имеющим дипольный момент
Можно предположить, что молекулы раство-
(для растворителей 4-6 μ = 0). В полярных же
рителя взаимодействуют с диполями метильных
растворителях содержание cis-изомеров оказа-
групп астаксантина при сопряженной полиено-
лось выше, причем с увеличением полярности
вой цепи. Кроме того, в случае 9-cis-изомера мо-
это значение линейно падает. Это означает, что
лекулы растворителя взаимодействуют с С5- и
процесс изомеризации в очень полярных и очень
С13-метильными группами и снимают напряже-
неполярных растворителях протекает хуже, чем в
ние, благодаря чему в растворе появляется стери-
растворителях со средней полярностью.
чески затрудненный 9-cis-изомер. Также, судя по
Как видно из представленных данных, cis-изо-
всему, растворитель взаимодействует с делокали-
меры в небольших количествах присутствуют во
зованными π-электронами астаксантина, стаби-
всех растворителях. Чтобы проверить, как будет
лизируя радикальный аддукт, благодаря чему по-
происходить изомеризация без влияния окружа-
является больше времени для вращения вокруг
ющей среды, были проведены опыты на кристал-
лах астаксантина, которые облучали либо подвер-
центральной связи. По всей видимости, если в
гали термической обработке при Т = 50°С в тече-
растворителе присутствует π-система, то она до-
ние четырех часов. После их растворения в
полнительно стабилизирует cis-изомеры.
БИОФИЗИКА том 65
№ 3
2020
522
КУЛИКОВ и др.
Процесс фотоизомеризации и деструкции астак-
скорости образования cis-изомеров, поэтому их
сантина. При длительном облучении астаксанти-
содержание начинает снижаться.
на светом с длиной волны в диапазоне 450-
500 нм, что соответствует максимальному пере-
ФИНАНСИРОВАНИЕ РАБОТЫ
крыванию с областью поглощения молекулы, на-
блюдается рост cis-изомеров астаксантина. Стоит
Источник финансирования: НИР согласно
заметить, что содержание образующихся изоме-
Приказу № 1363 от 25 июня 2019 г. по НИЦ «Кур-
ров резко увеличивается в первые два часа, а за-
чатовский институт».
тем это значение растет очень медленно (рис. 7).
На пятом часу облучения было зафиксировано
КОНФЛИКТ ИНТЕРЕСОВ
самое высокое значение для суммы 9-cis- и 13-cis-
изомеров. После пятого часа содержание cis-изо-
Авторы заявляют об отсутствии конфликта
меров начинает уменьшаться.
интересов.
Подобную зависимость можно объяснить тем
фактором, что в растворе протекают одновремен-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
но две реакции: фотоизомеризация астаксантина
Настоящая работа не содержит описания ка-
(trans→cis) и разрушение его молекулы. В первые
ких-либо исследований с использованием людей
часы скорость реакции фотоизомеризации очень
и животных в качестве объектов.
высока, а деструкция практически не происхо-
дит, поскольку астаксантин дезактивирует обра-
зующиеся свободные радикалы, поэтому мы на-
СПИСОК ЛИТЕРАТУРЫ
блюдаем рост cis-изомеров. Затем скорость пер-
1. G. N. Coral-Hinostroza, Т. Ytrestoyl, В. Ruyter, and
вой реакции начинает падать, в то же время
В. Bjerkeng, Comp. Biochem. Physiol. Part C: Toxicol-
антиоксидантная активность астаксантина начи-
ogy & Pharmacology 139 (1-3), 99 (2004).
нается снижаться. Чем дольше происходит облу-
чение, тем быстрее деградируют молекулы астак-
2. M. Osterlie, B. Bjerkeng, and S. Liaaen-Jensen, J. Nu-
сантина, а после пятого часа скорость реакции
tritional Biochem. 11 (10), 482 (2000).
разрушения становится выше скорости реакции
3. Y. M. Naguib, J. Agricult. Food Chem. 48 (4), 1150
фотоизомеризации. Эти выводы подтверждает и
(2000).
тот факт, что концентрация all-trans-астаксанти-
4. M. Kobayashi, T. Kakizono, N. Nishio, et al., Appl.
на начинает падать уже после первого часа, в то
Microbiol. Biotechnol. 48 (3), 351 (1997).
время как наблюдается увеличение поглощения в
5. X. Liu and T. Osawa, Biochem. Biophys. Res. Com-
области 250-260 нм, что соответствует максиму-
mun. 357 (1), 187 (2007).
му поглощения апо-9-астаксантинона [11]. Рост
оптической плотности в синей области является
6. J. P. Yuan and F. Chen, J. Agricult. Food Chem. 47 (9),
подтверждением того, что полиеновая цепь раз-
3656 (1999).
рушилась до более коротких продуктов распада
7. Food chemistry J. P. Yuan and F. Chen, Food Chem.
(апо- и эпоксисоединения).
73 (2), 131 (2001).
8. J. Lerfall and S. Birkeland, Int. J. Food Sci. Tech. 49,
294 (2014).
ЗАКЛЮЧЕНИЕ
9. S. Yang, Q. Zhou, L. Yang, et al., J. Oleo Sci. 64 (3),
243 (2015).
Был изучен процесс фотоизомеризации астак-
10. W. J. De Bruijn, Y. Weesepoel, J. P. Vincken, and
сантина, а также изомеризации при нагревании
H. Gruppen, Food Chem. 194, 1108 (2016).
до 50°С в присутствии различных органических
растворителей. Показано, что растворители ста-
11. Y. Weesepoel, H. Gruppen, W. de Bruijn, and
билизируют cis-изомеры астаксантина, причем в
J. P. Vincken, J. Agricult. Food Chem. 62 (42), 10254
растворителях со значением диэлектрической
(2014).
проницаемости от 4 до 30 процесс изомеризации
12. J. Milanowska and W. I. Gruszecki, J. Photochem.
протекает лучше, чем в сильнополярных и непо-
Photobiol. B: Biology 80 (3), 178 (2005).
лярных. Растворители с сопряженной π-элек-
13. L. Zhao, F. Chen, G. Zhao, et al., J. Agricult. Food
тронной системой также увеличивают содержа-
Chem. 53 (24), 9620 (2005).
ние cis-изомеров. В кристаллическом состоянии
14. M. Buchwald and W. P. Jencks, Biochemistry 7 (2), 834
астаксантин не образует cis-изомеров ни при на-
(1968).
гревании, ни при облучении. В случае фотоизо-
меризации протекают два процесса: образование
15. Н. Г. Бахшиев, О. П. Гирин и И. В. Питерская,
cis-изомеров и деструкция молекулы. Показано,
Оптика и спектроскопия 16 (5), 821 (1964).
что после пяти часов облучения синим светом
16. I. Renge and E. Sild, J. Photochem. Photobiol. A:
скорость реакции разрушения становится выше
Chemistry 218 (1), 156 (2011).
БИОФИЗИКА том 65
№ 3
2020
ВЛИЯНИЕ ПРИРОДЫ РАСТВОРИТЕЛЯ И ОСВЕЩЕНИЯ
523
17. Г. Г. Мартинович, Л. А. Сазанов и С. Н. Черенке-
18. M. R. Wasielewski and L. D. Kispert, Chem. Phys.
вич, Клеточная биоэнергетика: Физико-химические
Lett. 128 (3), 238 (1986).
и молекулярные основы: Учебное пособие (ЛЕНАНД,
19. M. J. Llansola-Portoles, A. A. Pascal, and B. Robert, J.
М., 2017).
Roy. Soc. Interface 14 (135), 20170504 (2017).
Effects of Solvent Nature and Light on Isomerization
and Oxidative Destruction of Astaxanthin
E.A. Kulikov*, I.S. Kulikova*, R.G. Vasilov*, and A.A. Selishcheva*, **
*National Research Center “Kurchatov Institute”, pl. Akademika Kurchatova, Moscow, 123182 Russia
**Lomonosov Moscow State University, Leninskie Gory 1, Moscow, 119991 Russia
Astaxanthin and its esters are referred to as “secondary” carotenoids and synthesized under stress conditions
in the cells of Haematococcus pluvialis, transformed from vegetative cells to hematocysts. Stress factors can
affect not only the rate and direction of synthesis, but also the conformational changes in the pigment mole-
cule, that cause trans-isomers to convert to cis-isomers. The aim of this study is to assess the efficiency of dif-
ferent factors (medium polarity and light) which have impact on the process of trans-cis astaxanthin isomer-
ization. While studying the effect of these factors on the formation of 9-cis- and 13-cis-isomers from all-trans
astaxanthin solutions at 50°C, it was shown that medium polarity solvents more effectively stabilize cis-iso-
mers than highly polar solvents. Apolar solvents do not contribute to stabilization of cis-isomers. The pres-
ence of π-bonds in the solvent molecule also has a positive effect on the isomerization process. When studying
the effects of the refractive index of different solvents on polarizability of astaxanthin, there were differences
in the dependencies for polar and apolar solvents. Solvents of medium polarity were supposed to facilitate the
process of trans-cis astaxanthin isomerization due to a reduction in the energy of the rotating moment and
stabilization of the cis-conformation molecule as a result of reduced dipole-dipole repulsion force between
methyl groups in the polyene chain and ionone ring. Exposure of astaxanthin solutions to light at 25°С in-
duced formation of cis-isomers the quantity of which was higher within the first 4 hours of exposure as com-
pared to that after exposure for 6 and more hours. Exposure of astaxanthin to irradiance for longer period
caused the decay of astaxanthin and the formation of degradation and oxidation products.
Keywords: astaxanthin, trans- and cis-isomers, polarity, refractive index, HPLC method
БИОФИЗИКА том 65
№ 3
2020