БИОФИЗИКА, 2020, том 65, № 3, с. 534-542
БИОФИЗИКА КЛЕТКИ
УДК 577.3
МЕТГЕМОГЛОБИН, АКТИВНОСТЬ КАТАЛАЗЫ
И СУПЕРОКСИДДИСМУТАЗЫ В ЯДЕРНЫХ ЭРИТРОЦИТАХ
Scorpaena porcus (Linnaeus, 1758) В УСЛОВИЯХ ЭКСПЕРИМЕНТАЛЬНОЙ
ГИПОКСИИ (in vitro)
© 2020 г. А.А. Солдатов*, **, А.Ю. Андреева*, ***, Т.А. Кухарева*, Т.И. Андреенко*, **
*Институт биологии южных морей им. А.О. Ковалевского РАН,
299011, Севастополь, просп. Нахимова, 2
E-mail: alekssoldatov@yandex.ru
**Севастопольский государственный университет, 299053, Севастополь, Университетская ул., 33
***Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН,
194223, Санкт-Петербург, просп. Тореза, 44
Поступила в редакцию 15.07.2019 г.
После доработки 15.07.2019 г.
Принята к публикации 22.03.2020 г.
Изучено влияние гипоксии на ядерные эритроциты морского ерша (Scorpaena porcus) в условиях
in vitro. Глубокая гипоксия (концентрация кислорода менее 1 мг O2 л-1, норма - 7-8 мг O2 л-1) при-
водит к переходу части гемоглобина в ферри-форму (метгемоглобин). Максимальное увеличение
концентрации метгемоглобина составляет 32%. Накопление метгемоглобина в эритроцитах сопро-
вождается повышением активности каталазы, супероксиддисмутазы и снижением содержания ак-
тивных форм кислорода в цитоплазме клеток. Показано, что образование метгемоглобина не вызы-
вает повреждений цитоплазматических мембран эритроцитов. Процент лизиса клеток красной кро-
ви в дезоксигенированных суспензиях (менее
1,0 мг О2 л-1) количественно совпадает с
контрольными величинами.
Ключевые слова: гипоксия, эксперименты in vitro, ядерные эритроциты, метгемоглобин, каталаза, су-
пероксиддисмутаза.
DOI: 10.31857/S0006302920030138
моглобина или следствием токсической нагрузки
Эритроциты - узкоспециализированные клет-
(нитрит, анилин, нитробензол и др.) [1]. Процесс
ки, адаптированные к транспорту газов, прежде
автоокисления протекает медленно и в основном
всего кислорода. Основу их сухого остатка со-
затрагивает дезокси-форму гемоглобина, что
ставляет гемоглобин (Hb). В норме процесс деок-
приводит к образованию супероксиданиона. В
сигенации оксигемоглобина (HbO2) сопровожда-
нем можно выделить следующие этапы [2]:
ется отрывом кислорода с сохранением железа
в геме в двухвалентном состоянии (ферро-форма)
(Fe2+ )HbO2 → (Fe2+)Hb + O2,
[1]:
)HbX,
(Fe2+)Hb + X → (Fe2+
(Fe2+)HbO2 → (Fe2+)Hb + O2.
(Fe2+)HbX + O2 → (Fe2+)HbX + ∙О2-,
Однако в ряде случаев это сопровождается об-
где Х - нуклеофил (соединение, образующее связь с
разованием супероксиданиона (∙О2-) и приводит
Hb по донорно-акцепторному механизму).
к окислению железа - гем переходит в ферри-со-
Окислению гемоглобина препятствует анти-
стояние [1]. Это соединение именуется метгемо-
оксидантный молекулярный комплекс эритро-
глобином (MtHb) и кислород не связывает. Чаще
цита - глутатион, аскорбиновая кислота, токофе-
всего это связано с процессом автоокисления ге-
рол [3]. Однако скорость реакции MtHb с этими
соединениями незначительна. Существует спе-
Сокращения: Hb - гемоглобин, HbO2 - оксигемоглобин,
цифический ферментативный механизм восста-
MtHb - метгемоглобин, NADH - никотинамидаденинди-
новления MtHb. Ключевая роль в нем принадле-
нуклеотид (восстановленный), CAT - каталаза, SOD - су-
жит NADH-диафоразе, которая переносит элек-
пероксиддисмутаза, АФК - активные формы кислорода.
534
МЕТГЕМОГЛОБИН, АКТИВНОСТЬ КАТАЛАЗЫ И СУПЕРОКСИДДИСМУТАЗЫ
535
трон с NADH на цитохром b5, а затем на MtHb [4]:
ональных характеристик клеток красной крови
(проточная цитометрия).
NADH + cytb5(Fe3+) → cytb5(Fe2+) +
МАТЕРИАЛЫ И МЕТОДЫ
+ MtHb → cytb5(Fe3+) + Hb.
Материал. В работе использовали взрослых
Это приводит практически к 100%-му восста-
особей морского ерша (Scorpaena porcus Linnaeus,
новлению окисленного пигмента. В норме кон-
1758) в состоянии относительного физиологиче-
центрация его в крови человека не превышает 1%.
ского покоя (III-IV стадия зрелости гонад): дли-
Ядерные эритроциты рыб имеют тот же, что и
на тела - 14-17 см, масса тела - 85-115 г. Рыбу от-
эритроциты высших позвоночных, антиокси-
лавливали при помощи ставного невода и достав-
дантный комплекс [5, 6]. В них выявлена NADH-
ляли в лабораторию в пластиковых баках
диафораза [7, 8]. Активность некоторых фермен-
объемом 60 л с принудительной аэрацией. Транс-
тов (пероксидазы, супероксиддисмутазы) и кон-
портировка длилась не более трех часов. Концен-
центрация восстановителей (глутатиона) превы-
трация кислорода в воде в момент отлова рыбы
шает таковую у человека [9, 10]. Вместе с тем
составляла 7-8 мг л-1.
устойчивость респираторных пигментов рыб к
окислению существенно ниже. Уровень MtHb в
После отлова особей рассаживали в аквари-
крови в норме может превышать 10% [11, 12].
умы с естественным протоком. В данных услови-
Особый интерес представляют случаи спон-
ях рыбу выдерживали в течение одной недели для
танного роста MtHb без видимых случаев токси-
снятия состояния стресса, вызванного отловом и
ческой метгемоглобинемии. К ним можно отне-
транспортировкой. Особей кормили фаршем из
малоценных видов рыб. Суточный пищевой ра-
сти процессы адаптации рыб к условиям гипер-
термии (30-40°С) [2, 13] и гипоксии [14, 15]. В
цион составлял 6-7% от массы тела. В работе ис-
случае с гипоксией эта реакция достаточно пара-
пользовали только подвижные активно питаю-
доксальна, так как она наблюдается при более
щиеся экземпляры. Перед отбором проб крови
низком уровне окислительной нагрузки на клет-
рыб анестезировали, применяя уретан, который
ки красной крови. Она отмечена не только у рыб:
растворяли в воде аквариума [22]. Данное соеди-
Colossoma macropomum
[14], Megalobrama am-
нение оказывает мягкое действие на организм
blycephala [15], но и у высших позвоночных [16],
рыб, не вызывая заметных изменений дыхатель-
включая человека [17]. Показано, что частично
ной и сердечной ритмики.
деоксигенированный гемоглобин легче подверга-
Эксперименты in vitro. Кровь для проведения
ется окислению и переходит в мет-форму [18].
экспериментов in vitro получали у особей скорпе-
Гипоксия вызывает у рыб также еще ряд неод-
ны из хвостовой артерии путем отсечения хвосто-
нозначных реакций: рост активности каталазы
вого стебля. В качестве антикоагулянта применя-
(CAT) и супероксиддисмутазы (SOD), что допус-
ли гепарин (Richter, Венгрия). Концентрация ге-
кает дисмутацию ∙О2-. Это отмечается на уровне
моглобина в полученных образцах находилась в
пределах 54-61 г ⋅ л-1, а величина гематокрита из-
различных соматических тканей, включая эрит-
менялась в диапазоне 24-28%. Концентрацию ге-
роциты крови [19-21]. Поскольку большинство
моглобина определяли при помощи гемиглобин-
гидробионтов лишь перманентно сталкиваются с
цианидного метода, используя стандартный на-
условиями внешней гипоксии, предложено рас-
бор реактивов (ООО
«Агат-мед», Россия).
сматривать факт роста активности CAT и SOD,
Величину гематокрита определяли центрифуги-
как подготовку к последующей реоксигенации
рованием образцов крови (800 g, 15 мин) в специ-
[20]. Можно также допустить наличие связи меж-
альном гематокритном роторе (центрифуга
ду ростом содержания MtHb в крови и увеличени-
MPW-310, Польша). Применяли специальные ка-
ем активности CAT и SOD, так как повышение
пилляры, стенки которых предварительно были
содержания ферри-формы в крови может сопро-
обработаны гепарином.
вождаться освобождением ∙О2-.
Клетки осаждали центрифугированием (800 g,
Представленная выше информация получена
15 мин, центрифуга CM-50, Elmi, Латвия). Плаз-
в основном в условиях in situ или экспериментов
му и поверхностный слой клеток (фракция лей-
in vivo. Это допускает изучение не только влияния
коцитов) удаляли. Эритроциты отмывали трижды
гипоксии, но и ряда других факторов, комбина-
от плазмы в среде следующего состава: 128 мМ
цию которых иногда трудно учесть. В настоящей
NaCl, 3 мМ KC1, 1.5 мМ CaCl2, 1.5 мМ MgCl2,
работе мы исследуем влияние эксперименталь-
15 мМ трис, 2.2 мМ D-глюкозы (рН 7.8) [23].
ной гипоксии в условиях in vitro - на клеточных
взвесях. При этом акцент делается на количе-
Полученную эритроцитарную массу ресуспен-
ственном учете уровня MtHb в крови, активности
зировали в среде аналогичного состава, но с раз-
CAT и SOD в эритроцитах, а также ряде функци-
ной концентрацией кислорода. Исследовали диа-
БИОФИЗИКА том 65
№ 3
2020
536
СОЛДАТОВ и др.
пазон 0-5 мг О2×л-1. Кислород из инкубацион-
бе составляла 1 мг ⋅ мл-1. Окрашивание суспен-
ной среды удаляли при барботаже газообразным
зии клеток проводили в течение 30 мин в темноте.
азотом. Контроль за концентрацией кислорода
осуществляли при помощи оксиметра ELWRO N
Для анализа смертности клеток суспензию
5123 (Польша). Продолжительность инкубации
эритроцитов плотностью 106 кл.×мл-1 окраши-
клеток составила 4 ч. В работе применяли вакуум-
вали двумя красителями: SYBR Green I (макси-
ные пробирки VacuetteTM объемом 6.0 мл.
мум флуоресценции 533 нм) и йодид пропидия
После проведения экспериментов эритроциты
(максимум флуоресценции 617 нм). SYBR Green I
осаждали центрифугированием (800 g, 15 мин,
является прижизненным ДНК-красителем, окра-
центрифуга CM-50). Часть клеток использовали
шивающим и живые и мертвые клетки; йодид
для проточной цитометрии. Остальные лизиро-
пропидия - маркер повреждений мембран кле-
вали охлажденным бидистиллятом с соответству-
ток. Финальная концентрация красителей в про-
ющей концентрацией кислорода. Соотношение
бе составляла 10 мкг ⋅ мл-1 для SYBR Green I и
объемов воды и эритроцитарной массы подбира-
2 мкг ⋅ мл-1 для йодида пропидия. Окрашивание
ли исходя из значений гематокрита. Концентра-
проводили в течение 40 мин в темноте при ком-
ция гемоглобина в гемолизатах составляла 45-
натной температуре.
52 г ⋅ л-1. Гемолизаты использовали при спек-
Анализ флуоресценции проводили на проточ-
тральном анализе и определении активности
ном цитометре FC500 (Beckman Coulter, США).
СОД и КАТ.
Флуоресценцию дихлорофлуоресцеина и SYBR
Спектральный анализ растворов гемоглобина.
Green I регистрировали в канале FL1 (зеленая об-
Гемолизаты взвешивали в 0.35 М фосфатном бу-
ласть спектра), йодида пропидия - в канале FL3
фере, рН 7.3. Спектры полученных растворов ге-
(красная область спектра). Анализ получаемых
моглобина снимали при помощи двухлучевого
данных вели в программе Flowing software 5.1.
спектрофотометра Lambda
35 (PerkinElmer,
Статистическая обработка. Статистическая об-
США). Расчет относительного содержания окси-
работка и графическое оформление полученных
(HbO2), дезокси- (Hb) и мет-форм (MtHb) гемо-
результатов проведены с применением стандарт-
глобина проводили по следующим уравнениям
ного пакета Grapher (версия 7). Результаты пред-
[24]:
ставлены в виде M ± SE. Достоверность различий
оценивали при помощи t-критерия Стьюдента. О
[HbO2] = (1.013 A576 - 0.3269 A630 -
нормальности распределения судили по крите-
- 0.7353 A560) ∙ 10-4,
рию Пирсона.
[Hb] = (1.373 A560 - 0.747 A576 - 0.737 A630) ∙ 10-4,
РЕЗУЛЬТАТЫ
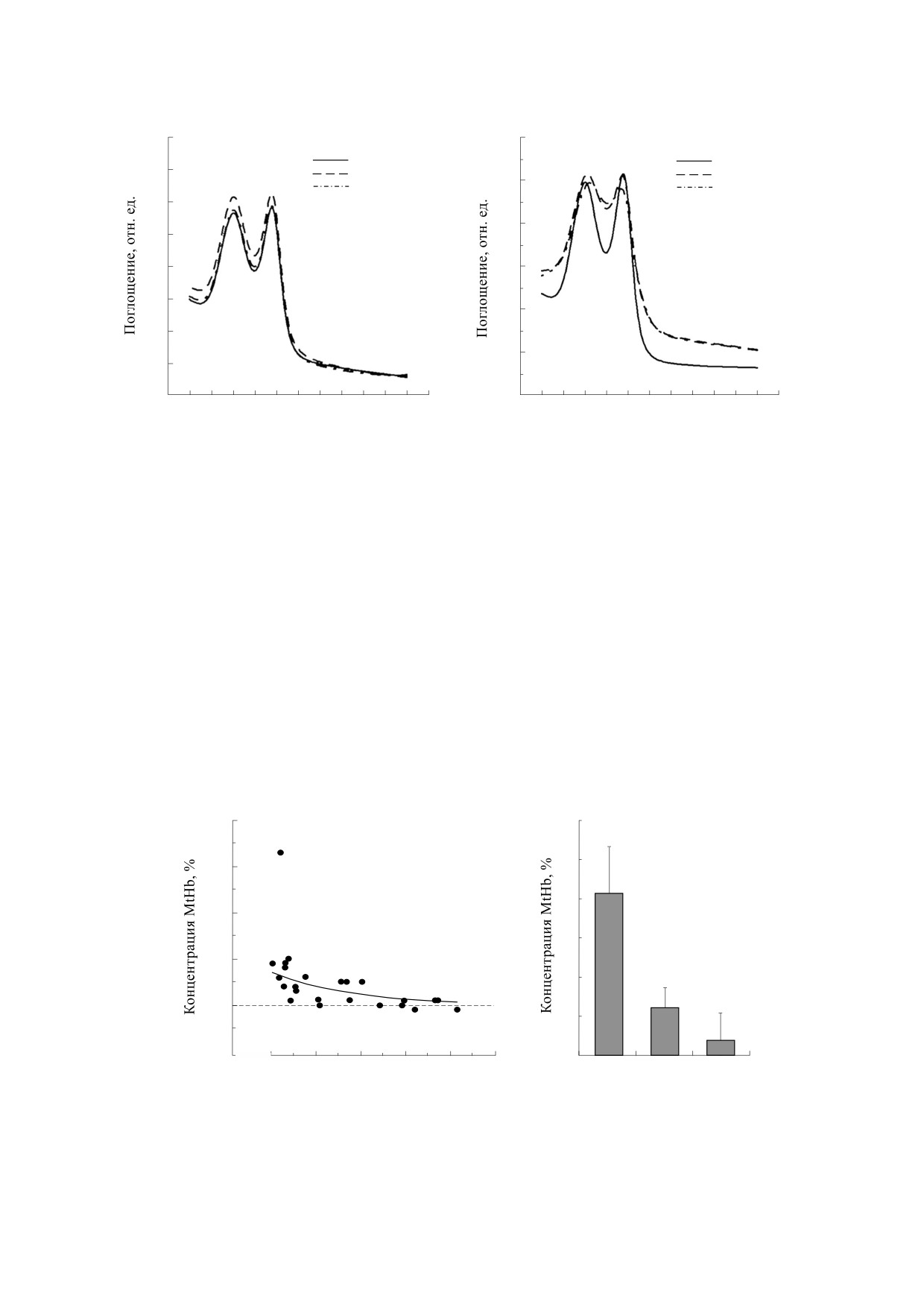
Гемоглобин. Анализ спектров поглощения ге-
[MtHb] = (2.985 A630 - 0.194 A576 - 0.4023 A560) ∙ 10-4.
молизатов скорпены позволил оценить функцио-
Активности супероксиддисмутазы и каталазы.
нальное состояние гемоглобина данного вида при
Активность SOD (КФ 1.15.1.1) определяли по сте-
различных кислородных режимах инкубацион-
пени ингибирования восстановления нитросине-
ной среды. Понижение концентрации кислорода
го тетразолия в присутствии НАДН2 и феназин-
с 7-8 до 2-3 мг ⋅ л-1 не вызывало заметных изме-
метасульфата. Активность CAT (КФ 1.11.1.6) из-
нений положения максимумов и величин экс-
меряли по реакции Н2О2 с молибдатом аммония
тинкций относительно контрольных значений
(рис. 1а). При более низких концентрациях кис-
и образованию желтоокрашенного комплекса.
Состав инкубационных сред и особенности лабо-
лорода (0.2-2.0 мг ⋅ л-1) отмечали заметное уве-
раторного регламента показаны ранее в работе
личение значений экстинкции при 560 и 630 нм,
[25].
что отражало рост содержания в растворе дезок-
си- и ферри-формы гемоглобина соответственно
Проточная цитометрия. Эритроциты после
(рис. 1б).
эксперимента ресуспензировали в инкубацион-
ной среде следующего состава: 128 мМ NaCl,
На основании представленных выше спектров
3 мМ KC1, 1.5 мМ CaCl2, 1,5 мМ MgCl2, 15 мМ
поглощения были рассчитаны величины содер-
трис, 2.2 мМ D-глюкозы (рН 7.8) [23]. Плотность
жания MtHb в гемолизатах (рис. 2а). Как видно,
при понижении концентрации кислорода уро-
клеток составляла 106 кл. ⋅ мл-1. Для оценки сум-
вень данного соединения относительно кон-
марного содержания в эритроцитах активных
трольных значений равномерно повышался.
форм кислорода (перекисей) использовали флуо-
Максимальные значения были зарегистрированы
рохром дихлорофлуоресцеин. Краситель раство-
ряли в диметилсульфоксиде и хранили при -
при концентрации О2 менее 1 мг ⋅ л-1. У отдель-
20°С. Финальная концентрация красителя в про-
ных особей уровень ферри-формы повышался до
БИОФИЗИКА том 65
№ 3
2020
МЕТГЕМОГЛОБИН, АКТИВНОСТЬ КАТАЛАЗЫ И СУПЕРОКСИДДИСМУТАЗЫ
537
(а)
(б)
1.2
0.7
Нормоксия
Нормоксия
3.76 мг О ·л
-1
-1
2
1.56 мг О ·л
2
-1
0.6
-1
2.93 мг О ·л
0.17 мг О ·л
2
2
1.0
0.5
0.8
0.4
0.3
0.6
0.2
0.4
0.1
480
520
560
600
640
680
720
480
520
560
600
640
680
720
Длина волны, нм
Длина волны, нм
Рис. 1. Спектры поглощения гемолизатов в зависимости от содержания кислорода: (а) - нормоксия и гипоксия до
2.5 мг О2 ⋅ л-1; (б) - нормоксия и гипоксия после 2.5 мг О2 ⋅ л-1.
32%. Ранжирование полученных значений на три
эритроцитах усиливалась реакция дисмутации,
группы: более 2 мг О2 ⋅ л-1, 1-2 мг О2 ⋅ л-1 и менее
направленная на нейтрализацию •O2-.
1 мг О2 ⋅ л-1, позволило рассчитать средние вели-
Достаточно высокий уровень корреляции об-
чины и провести статистическое сравнение меж-
наружен и между уровнем MtHb, с одной сторо-
ду ними (рис. 2б). Различия достигали 4-16 раз
ны, и активностью SOD и CAT - с другой (рис. 4).
(p < 0.01).
В первом случае значения R2 составили 0.738, а во
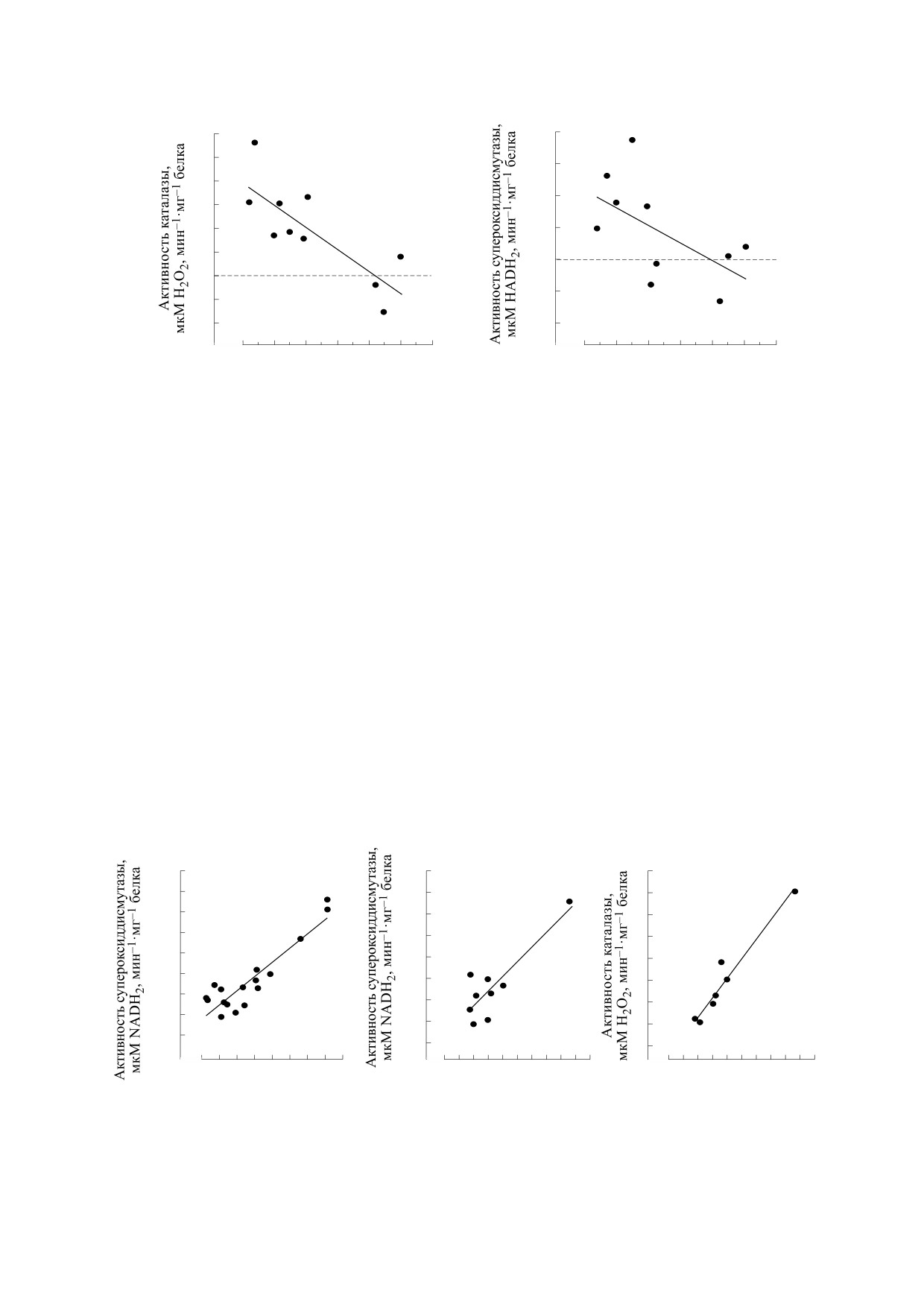
Антиоксидантный ферментный комплекс. Рост
втором - 0.967. Это свидетельствует о том, что
содержания MtHb в условиях экстремально низ-
рост активности указанных ферментов в значи-
ких концентраций кислорода был сопряжен с
тельной степени был связан с продукцией •O−,
увеличением активности CAT и SOD (рис. 3). Ко-
который образуется при переходе гемоглобина в
эффициент детерминации (R2) между активно-
ферри-форму. Эффективность этого процесса
стью данных ферментов превышал 0.8 (рис. 4).
можно оценить по содержанию активных форм
Это означает, что они работали в связке, т.е. в
кислорода в эритроцитах и, прежде всего, уровню
(а)
(б)
40
12
10
30
8
20
6
10
R2 = 0.418
4
0
2
-10
0
0
1
2
3
4
5
<1
1-2
>2
Концентрация О , мг·л2-1
Концентрация О , мг·л2-1
Рис. 2. Влияние гипоксии на концентрацию MtHb в гемолизатах: (а) - полигон распределения, (б) - после
ранжирования.
БИОФИЗИКА том 65
№ 3
2020
538
СОЛДАТОВ и др.
(а)
(б)
6
800
4
400
R2 = 0.584
2
R2 = 0.802
0
0
-2
-400
0
1
2
3
4
5
6
0
1
2
3
4
5
6
Концентрация О , мг·л2-1
Концентрация О , мг·л2-1
Рис. 3. Активность каталазы (а) и супероксиддисмутазы (б) в ядерных эритроцитах в условиях гипоксии.
гидроперекиси в клетках. Для этих целей мы при-
гипоксии (менее 1 мг ⋅ л-1) - 88.6 ± 4.5%. Разли-
меняли дихлорофлуоресцеин. Из рис. 5 следует,
чия не были статистически выражены.
что снижение концентрации кислорода в инкуба-
ционной среде не сопровождалось ростом Н2О2,
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
напротив, уровень данного соединения суще-
ственно понижался.
Из представленных выше результатов следует
обратить внимание на следующие моменты:
Эритроциты. Оценку состояния эритроцитов
во взвесях проводили путем подсчета соотноше-
- при концентрациях кислорода в инкубаци-
ния живых и мертвых клеток. Для этих целей при-
онной среде менее 1 мг ⋅ л-1 значительно повы-
меняли двойное окрашивание суспензии флуоро-
шалась доля MtHb, что коррелировало с ростом
хромами SYBR Green I и йодидом пропидия. Пер-
активности SOD и CAT и не сопровождалось уве-
вый является прижизненным маркером ДНК
личением уровня активных форм кислорода в
окрашивающим и живые и мертвые клетки, а вто-
эритроцитах;
рой только имеющие повреждение мембран. Ре-
- при экстремальных формах гипоксии сохра-
зультаты представлены на рис. 6. Как видно, ги-
нялась целостность цитоплазматических мем-
поксия не вызывала заметного снижения числа
бран эритроцитов; соотношение живых и мерт-
живых клеток в суспензии. В условиях
вых клеток в суспензии оставалось на уровне кон-
нормоксии их доля составляла 94.0 ± 5.7%, а при
трольных значений (нормоксия).
(а)
(б)
(в)
1200
1200
16
1000
1000
12
R2 = 0.967
R2 = 0.738
R2 = 0.8 30
800
800
8
600
600
4
400
400
0
0
4
8
12
16
-10
0
10
20
30
40
-10
0
10
20
30
40
Активность каталазы,
Концентрация MtHb, %
Концентрация MtHb, %
мкМ Н О , мин–1·мг–1 белка22
Рис. 4. Корреляционные отношения для систем «SOD↔CAT» (а), «SOD↔MetHb» (б) и «CAT↔MetHb» (в).
БИОФИЗИКА том 65
№ 3
2020
МЕТГЕМОГЛОБИН, АКТИВНОСТЬ КАТАЛАЗЫ И СУПЕРОКСИДДИСМУТАЗЫ
539
(а)
(б)
160
Нормоксия
120
Гипоксия
R2 = 0.48
80
40
0
0.0
0.8
1.6
2.4
3.2
4.0
Концентрация О , мг·л2-1
Флуоресценция дихлорфлуоресцеина
Рис. 5. Содержание активных форм кислорода в эритроцитах в условиях нормоксии и гипоксии по уровню гидропе-
рекисей (дихлорофлуоресцеина) в клетках: (а) - данные проточной цитометрии, (б) - полигон распределения.
Метгемоглобин. Случаи перехода гемоглобина
следует, что любые изменения, влекущие за со-
в мет-форму в условиях гипоксии отмечены во
бой снижение низкоспинового состояния Fe2+ в
многих работах, выполненных на низших и выс-
HbO2-комплексе, могут стать причиной отрыва
ших позвоночных [14-17]. Реакция достаточно
электрона от железа и приводить к его окисле-
парадоксальна, так как наблюдается при низком
нию. Роль акцептора электрона при этом может
уровне окислительной нагрузки. При этом отме-
выполнять молекула кислорода, что приводит к
чается, что деоксигенированный гемоглобин лег-
образованию ∙О2-. В условиях гипоксии доля дез-
че подвергается окислению [2, 18]. Это обуслов-
окси-формы повышается, что должно усиливать
лено тем, что в дезокс-форме гемоглобина ферро-
ион находится в высокоспиновом состоянии
процессы автоокисления гемоглобина. При этом
в венозной крови достаточно свободного кисло-
(4 неспаренных электрона). Присоединение кис-
лорода переводит железо в низкоспиновое состо-
рода, способного принять электроны от Fe2+, так
яние, в котором все электроны спарены. Отсюда
как диффузия его в ткани ограничивается ввиду
(а)
(б)
Живые - 88.59%
Мертвые - 0.11%
Живые - 75.39%
Мертвые - 0.27%
«Trash» - 11.28%
«Trash» - 0.03
%
«Trash» - 19 .5 8%
«Trash» - 0.1 8%
Флуоресценция йодида пропидия
Флуоресценция йодида пропидия
Рис. 6. Пример анализа на соотношение живых и мертвых клеток в суспензиях эритроцитов: (а) - в условиях
нормоксии (7.22 мг О2 ⋅ л-1), (б) - в условиях гипоксии (0.43 мг О2 ⋅ л-1).
БИОФИЗИКА том 65
№ 3
2020
540
СОЛДАТОВ и др.
низких концентрационных градиентов в системе
встраивается на уровне имидазольной группы ги-
«кровь → ткани».
стидина, вызывая окисление как окси-, так и дез-
Не следует исключать из внимания и тот факт,
окси-форм пигмента, что должно сопровождать-
что в условиях нормоксии в ядерных эритроцитах
ся освобождением ∙О2-. Учитывая масштабность
рыб активно протекают аэробные процессы. Об
данного процесса, можно допустить, что он явля-
этом свидетельствует наличие в них митохондрий
-
ется основным в образовании мет-формы и ∙О2
[26, 27]. При дефиците же кислорода в клетках
при экстремальных формах гипоксии.
красной крови должна повышаться роль реакций
гликолиза, которые могут иметь два следствия:
Вместе с тем необходимо отметить, что не во
снижение величины внутриклеточной рН и воз-
всех работах отмечается рост содержания метге-
никновение дефицита NADH. Это должно со-
моглобина в крови при гипоксии [40, 41]. Это, ве-
провождаться снижением активности NADH-
роятно, связано с тем, что в них исследуются уме-
диафоразы, которая выполняет роль специфиче-
ренные формы гипоксии (более 2,5 мг×л-1). В
ского переносчика электрона с NADH на цито-
нашем случае эти концентрации кислорода также
хром b5, а затем на MtHb [4]. Действительно, при
не оказывали заметного влияния на функцио-
гипоксии наблюдается существенное закисление
нальное состояние гемоглобина.
внутриклеточной среды эритроцита [28]. Это
Антиоксидантный ферментный комплекс. В ра-
должно ограничивать активность NADH-диафо-
боте исследуются SOD и CAT в эритроцитах.
разы и способствовать переходу гемоглобина в
Соотношение их активности зависит от характера
окисленное состояние. Показано также, что зна-
окислительной нагрузки. Возможны три вари-
чительное снижение рН ускоряет процесс авто-
анта:
окисления гемоглобина [29, 30].
- увеличение активности CAT без роста актив-
Следует также рассмотреть вероятность утечки
ности SOD. Такое состояние отражает суще-
электронов с дыхательных комплексов митохон-
ственный рост содержания в клетке гидропереки-
дрий эритроцитов в условиях гипоксии. Это мо-
сей;
жет объясняться относительно невысоким срод-
- рост активности SOD без увеличения актив-
ством цитохромоксидазы (комплекс IV) к кисло-
ности CAT. В этом случае можно говорить о про-
роду. При этом на предыдущих звеньях
оксидантном эффекте, связанным с продукцией
дыхательной цепи электроны замедляют свой бег,
и их «утечка» на кислород усиливается, что долж-
∙О2-;
но сопровождаться ростом содержания ∙О2- в
- одновременный рост активности CAT и SOD
клетке. Однако данный процесс не сопровожда-
отражает процесс дисмутации ∙О2-.
ется переходом гемоглобина в мет-форму.
В нашем случае следует рассматривать третий
Переходу гемоглобина в окисленное состоя-
вариант. Активность обоих ферментов повыша-
ние может способствовать также еще один доста-
лась и достигала максимальных значений при
точно масштабный процесс, который развивает-
концентрациях кислорода в инкубационной сре-
ся в эритроцитах при адаптации рыб к условиям
де менее 1 мг ⋅ л-1. Величина R2 для системы
гипоксии - свеллинг клеток красной крови. Он
«SOD ↔ CAT» превышала 0.8. Одновременно об-
описан во многих работах [2, 31-33]. Считается,
наружена значимая связь между активностью
что данная реакция направлена на коррекцию
SOD и CAT, с одной стороны, и содержанием
внутриклеточного рН и определяется работой
мет-формы гемоглобина, с другой стороны (R2
Na+/H+-антипорта [34]. Она контролируется ад-
более 0.7). Это означает, что в эритроцитах мор-
реналином и норадреналином и реализуется че-
ского ерша в условиях гипоксии реализуется ре-
рез β-адренорецепторы клеток и cAMP [35-37].
акция дисмутации супероксида, продукция кото-
Следует отметить, что свеллинг эритроцитов рыб
рого с высокой долей вероятности определяется
наблюдался и в изолированных взвесях клеток
переходом гемоглобина в ферри-форму.
[38]. Допускается, что данная реакция связана со
значительным снижением рН цитоплазмы и, как
Об эффективности перехвата супероксида в
следствие, ростом сродства внутренней стороны
реакциях дисмутации можно судить по состоя-
нию эритроцитов. В условиях гипоксии уровень
мембраны клеток к Н+, что активирует Na+/H+-
активных форм кислорода (гидроперекисей) в
антипорт.
клетках красной крови не повышался. Интенсив-
Работа Na+/H+-антипорта в условиях гипо-
ность флуоресценции дихлорофлуоресцеина, на-
ксии предполагает вход в клетку Na+. Это должно
против, была ниже контрольных значений. Дан-
обеспечить оводнение цитоплазмы и рост ее ди-
ные по флуоресценции SYBR Green I и йодида
электрической проницаемости. Последнее облег-
пропидия не позволяют говорить о росте фрак-
чает проникновение воды в гидрофобную по-
ции мертвых клеток в суспензии эритроцитов.
лость белков и гемоглобина в частности [39]. Вода
Это означает, что SOD и CAT полностью нейтра-
БИОФИЗИКА том 65
№ 3
2020
МЕТГЕМОГЛОБИН, АКТИВНОСТЬ КАТАЛАЗЫ И СУПЕРОКСИДДИСМУТАЗЫ
541
4.
M. J. Percy and T. R. Lappin, Br. J. Haematol. 141, 298
лизовали образующийся •O2-, то есть контроли-
(2008).
руемая нами реакция находилась в пределах фи-
зиологической нормы.
5.
E. Mather-Mihaich, R. T. Di-Giulio, Arch. Environ.
Contam. Toxicol. 20 (3), 391 (1991).
Следует отметить, что рассмотренный выше
6.
R. V. Zikic, A. Stajn, and V. M. Petrovic, Acta Biol. Ju-
порядок процессов имеет определенные функци-
ональные следствия. Он позволяет проводить
gosl. C 27 (1), 45 (1991).
процесс деоксигенации венозной крови, которая
7.
C. S. Tucker and J. R. MacMillan, J. Appl. Aquacult. 1
содержит 40-60% связанного кислорода. Про-
(4), 21 (1992).
цесс не требует снижения тканевого РО
, что осо-
2
8.
E. J. Schoore, B. A. Simco, and K. B. Davis, J. Aquat.
бенно актуально в условиях гипоксии. В наших
Anim. Health. 7 (4), 304 (1995).
экспериментах рост содержания метгемоглобина
9.
J. Wdzieczak, et al., Comp. Biochem. Physiol. B 73 (2),
наблюдался при концентрации кислорода в инку-
361 (1982).
бационной среде менее 2 мг ⋅ л-1. Этот процесс
10.
A. L. Dafre and E. Reischl, Comp. Biochem. Physiol.
становился еще более выраженным в концентра-
B 116 (3), 323 (1997).
ционном диапазоне О2 0-1 мг ⋅ л-1, что соответ-
11.
J. Hardig and L. B. Hoglund, Comp. Biochem. and
ствовало венозному насыщению кислорода. От-
Physiol. A 76 (1), 27 (1983).
сюда следует, что переход гемоглобина в ферри-
12.
J. Sajiki and K. Takahashi, Eisei-Kagaku 37 (6), 467
форму должен способствовать процессу деокси-
(1991).
генации пигмента при низком напряжении кис-
лорода, что позволяет поддерживать окислитель-
13.
R. R. Wilson Jr. and F. C. Knowles, Arch. Biochem.
ные процессы в тканях.
Biophys. 255, 210 (1987).
14.
E. G. Affonso, et al., Comp. Biochem. Physiol. C. Tox-
icol. Pharmacol. 133 (3), 375 (2002).
ЗАКЛЮЧЕНИЕ
15.
N. Chen, et al., Frontiers Physiol. 8 (1), 1 (2017).
Таким образом, при концентрациях кислорода
16.
C. P. Olander and C. E. Parr, Experientia 33 (12), 1656
в среде менее 1 мг О2 ⋅ л-1 часть гемоглобина пе-
(1978).
реходит ферри-форму. Максимальный прирост
17.
J. Arnaud, et al., Ann. Human Biol. 6 (6), 585 (1979).
составляет 32%. Этот процесс не приводит к уве-
18.
A. Mansouri, Experientia 37, 95 (1981).
личению активных форм кислорода в клетке и
происходит на фоне роста активности SOD и
19.
W. G. Willmore and K. B. Storey, Mol. Cell. Biochem.
CAT. Увеличение содержания метгемоглобина в
170, 177 (1997).
эритроцитах не влияет на целостность цитоплаз-
20.
V. I. Lushchak and T. V. Bagnyukova, Comp. Biochem.
матических мембран клеток. Случаи лизиса кле-
Physiol. B 144, 283 (2006).
ток красной крови в инкубационной среде при
21.
A. Stara, J. Machova, and J. Velisek, Neuro. Endocri-
гипоксии (менее 1 мг О2 ⋅ л-1) количественно
nol. Lett. 33 (3), 130 (2012).
совпадают с контрольными величинами (нор-
22.
A. A. Soldatov, Hydrobiol. J. 41 (1), 113 (2005).
моксия - 7-8 мг О2 ⋅ л-1).
23.
K. Tiihonen, M. Nikinmaa, J. Exp. Biol. 161, 509
(1991).
24.
R. E. Benesch, R. Benesch, and S. Yung, Anal. Bio-
ФИНАНСИРОВАНИЕ РАБОТЫ
chem. 55 (1), 245 (1973).
Работа выполнена в рамках Госзадания
25. A. A. Soldatov, O. L. Gostyukhina, and I. V. Golovina,
(№ гос. регистрации АААА-А18-118021490093-4)
J. Evol. Biochem. Physiol. 44, 175 (2008).
и при частичной финансовой поддержке Россий-
ского фонда фундаментальных исследований
26. R. G. Boutilier and R. A. Ferguson, Can. J. Zool. 67
(проект № 16-04-00135).
(12), 2986 (1989).
27. M. C. L. Phillips, C. D. Moyes, and B. L. Tufts, J. Exp.
Biol. 203 (6), 1039 (2000).
СПИСОК ЛИТЕРАТУРЫ
28. N. C. Adragna, M. Di Fulvio, and P. K. Lauf, J. Mem-
1. A. N. Schechter, Blood 112 (10), 3927 (2008).
brane Biol. 201 (3), 109. (2004).
2. F. B. Jensen, A. Fago, and R. E. Weber, in Fish Physiol-
29. W. J. Wallace, et al., J. Biol. Chem. Vol. 257, 4966
ogy, ed. by S. F. Perry and B. L. Tufts (Acad. Press, San
(1982).
Diego, 1998), v. 17, pp. 1-40.
30. M. F. Perutz, Annu. Rev. Physiol. 52, 1 (1990).
3. M. S. Krishna and G. Venkataramana, Ind. J. Physiol.
31. A. Soivio, K. Nyholm, and K. Westman, J. Fish Biol. 6
Pharmacol. 51 (3), 284 (2007).
(6), 763 (1974).
БИОФИЗИКА том 65
№ 3
2020
542
СОЛДАТОВ и др.
32. M. Nikinmaa, et al., J. Exp. Biol. 47 (1), 53 (1987).
38. A. Y. Andreyeva, A. A. Soldatov, and V. S. Mukhanov,
In Vitro Cell. Developm. Biology - Animal. 53 (4),
33. K. Holk, Fish Physiol. Biochem. 15 (5), 371 (1996).
312 (2017).
34. B. Tufts, Can. J. Zool. 70 (3), 411 (1992).
35. R. A. Ferguson and R. G. Boutilier, Respir. Physiol. 74
39. A. White, et al., Principles of biochemistry (McGRAW-
(6), 65 (1988).
Hill, 1978), v. 3.
36. A. Salama and M. Nikinmaa, Raporttisar. Mat. -
40. J. N. Cameron, Comp. Biochem. Physiol. A 40 (3), 743
Luonnontieteenllis. Tiedekunnan / Joensuun Gliopis-
(1971).
to. 30, 13 (1991).
37. A. L. Val, G. C. De Menezes, and C. M. Wood, J. Fish
41. A. A. Soldatov and I. A. Parfenova, J. Evol. Biochem.
Biol. 52 (1), 83 (1997).
Physiol. 37 (6), 622 (2001).
Methemoglobin, Catalase-Like and Superoxide Dismutase-Like Activity in Erythrocytes
of Scorpaena porcus (Linnaeus, 1758) under Experimental Hypoxia Conditions (in vitro)
A.A. Soldatov*, **, A.Y. Andreeva*, ***, T.A. Kukhareva*, and T.I. Andreyenko*, **
*Kovalevsky Institute of Biology of the Southern Seas, Russian Academy of Sciences,
prosp. Nakhimova 2, Sevastopol, 299011 Russia
**Sevastopol State University, Universitetskaya ul. 33, Sevastopol, 299053 Russia
***Sechenov Institute of Evolutionary Physiology and Biochemistry, Russian Academy of Sciences,
prosp. Toreza 44, St. Petersburg, 194223 Russia
The influence of hypoxia on black scorpionfish (Scorpaena porcus) red blood cells has been studied. In deep
hypoxia (oxygen concentration less than 1 mg O2 L-1, oxygen level in normal range is 7-8 mg O2 L-1) oxygen
transport is impaired and the iron moiety of unoxygenated hemoglobin is in the ferric state (methemoglo-
bin). Maximum methhemoglobin level is 32%. The accumulation of methemoglobin in red blood cells is ac-
companied with an increase in catalase-like and superoxide dismutase-like activity and the reduction of re-
active oxygen species in the cytoplasm. It has been shown that the formation of methemoglobin within red
cells is not associated with damage to the cytoplasmic membrane of red blood cells. The percentage of lysis
of red blood cells in deoxygenated suspensions (less than 1.0 mg O2 L-1) quantitatively coincides with control
values.
Keywords: hypoxia, in vitro experiments, red blood cells, methemoglobin, catalase, superoxide dismutase
БИОФИЗИКА том 65
№ 3
2020