БИОФИЗИКА, 2020, том 65, № 3, с. 543-551
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ПОВРЕЖДЕНИЕ ДНК И БЕЛКА р53 ОГРАНИЧИВАЮТ ПРОЛИФЕРАЦИЮ
КЛЕТОК МЮЛЛЕРА В СЕТЧАТКЕ МЫШЕЙ В ОТВЕТ НА ДЕЙСТВИЕ
МЕТИЛНИТРОЗОМОЧЕВИНЫ
© 2020 г. В.А. Тронов*, Е.И. Некрасова**
*Институт химической физики им. Н.Н. Семенова РАН, 119334, Москва, ул. Косыгина, 4
**Институт биохимической физики им. Н.М. Эмануэля РАН, Москва119334, Москва, ул. Косыгина, 4
E-mail: vtronov@yandex.ru
Поступила в редакцию 17.11.2019 г.
После доработки 17.11.2019 г.
Принята к публикации 28.02.2020 г.
Известно, что системная инъекция крысам метилнитрозомочевины вызывала гибель фоторецепто-
ров в сетчатке и последующую дифференцировку клеток глии Мюллера в фоторецептор-подобные
клетки. Однако пролиферативная способность клеток глии Мюллера у крыс очень ограничена и со-
провождается экспрессией гистона γН2АХ и белка р21, которые, как известно, являются компонен-
тами клеточного ответа на повреждение ДНК («DNA damage response»). Это ограничение препят-
ствует заместительной терапии сетчатки с помощью клеточной трансплантации. С другой стороны,
механизм наблюдаемого ограничения пролиферации клеток глии Мюллера в сетчатке млекопита-
ющих пока не известен. Мы исследовали пролиферативный ответ клеток Мюллера, поврежден-
ность ДНК в них в пострепликативный период, а также экспрессию белка р53 в ответ на ретиноток-
сическое воздействие метилнитрозомочевины. Показали, что метилнитрозомочевина вызывала де-
генерацию сетчатки у мышей, которая выражалась в апоптотической гибели фоторецепторов. При
этом остальные клеточные слои сетчатки сохраняли интактную морфологию. Тем не менее во всех
клетках сетчатки через 5 ч после инъекции метилнитрозомочевины наблюдалось формирование
разрывов и щелочелабильных сайтов в ДНК, которые практически полностью удалялись спустя 15 ч
после инъекции метилнитрозомочевины. Однако к 72 ч в клетках глии Мюллера наблюдали досто-
верное увеличение разрывов ДНК. Отсутствие в последующее время включения бромдезоксиури-
дина в клетки сетчатки говорит об отсутствии пролиферации клеток глии Мюллера и репаративного
синтеза ДНК. Вместе с тем в сетчатке наблюдалось увеличение экспрессии белка р53 - универсаль-
ного маркера повреждений в ДНК. Полученные результаты подтверждают концепцию «DNA dam-
age response» в отношении клеток глии Мюллера, которая связывает повреждения ДНК в клетках
глии Мюллера с ограниченной пролиферацией этих клеток у мышей. Пострепликативная репара-
ция рассматривается как вероятный механизм формирования разрывов ДНК в пострепликативных
клетках глии Мюллера.
Ключевые слова: сетчатка, клетки Мюллера, фоторецепторы, апоптоз, разрывы ДНК, репарация
ДНК, р53, метилнитрозомочевина.
DOI: 10.31857/S000630292003014X
Мюллера (ГКМ), которые в ответ на поврежде-
К нейродегенеративным заболеваниям сетчат-
ки относятся пигментный ретинит, возрастная
ние сетчатки подвергаются глиозу, включающему
в себя дедифференцировку, пролиферацию и в
макулярная дегенерация сетчатки, глаукома и
конечном счете дифференцировку ГКМ в рети-
диабетическая ретинопатия.В основе этих забо-
нальные фоторецепторы и нейроны [2]. Процесс
леваний лежит необратимая утрата ретинальных
регенерации сетчатки присутствует в некоторых
клеток. Одна из стратегий терапии этих заболева-
ний базируется на стимуляции эндогенных ство-
видах позвоночных (рыбы, амфибии, птицы).
ловых клеток в глии, способных восполнять пато-
Важнейшими источниками повреждения сет-
логическую утрату клеток сетчатки [1]. Глия в
чатки являются наследственная предрасполо-
сетчатке состоит на 90% из глиальных клеток
женность к дегенерации из-за мутаций в специ-
фических генах, естественная агрессивность
Сокращения: ГКМ - глиальные клетки Мюллера, BrdU -
бромдезоксиуридин, МНМ
- метилнитрозомочевина,
окружающей среды (оксигенация, световое и ра-
PBS - натрий-фосфатный буфер.
диационное воздействия, химическая токсич-
543
544
ТРОНОВ, НЕКРАСОВА
ность), радиационная и химиотерапия при онко-
трий-фосфатном буфере (PBS) непосредственно
логических заболеваниях. В последнее время
перед опытом в концентрации ~0.1 M и вводили
обращается внимание на окуло- и ретинотоксич-
мышам однократно внутрибрюшинно в объеме,
ность химиотерапии опухолей, поскольку боль-
не превышающем 0.4 мл. Контрольным живот-
шинство применяемых при этом препаратов
ным вводили равный объем PBS. Спустя сутки
обнаруживают ретинотоксичность in vitro, a ис-
после инъекции МНМ животным три-шесть раз
пользуемые в химиотерапии интерферон и алки-
внутрибрюшинно вводили BrdU в виде раствора в
лирующие соединения проявляют ретинотокси-
стерильном PBS (10 мг/мл), доза 60-70 мг/кг на
ческое действие в экспериментах на животных [3,
инъекцию. Ретинотоксический эффект оценива-
4]. В частности, метилнитрозомочевина широко
ли спустя 72-110 ч после инъекции препаратов.
используется в животных моделях для исследова-
Получение суспензии клеток сетчатки. Спустя
ния дегенерации и восстановления сетчатки [5].
5 ч после последней BrdU-инъекции животных
Хотя во многих работах наблюдали глиоз кле-
усыпляли в парах хлороформа и извлекали глаза и
ток Мюллера в сетчатке грызунов, существует
сетчатку. Сетчатку диспергировали в объеме 0.2-
устойчивое представление о том, что у млекопи-
0.4 мл PBS, дважды центрифугировали по 5 мин
тающих регенеративная способность сетчатки
при 400 g. Конечный осадок суспендировали в
крайне ограничена: только небольшая часть
фетальной сыворотке быка, содержащей 10% ди-
потомства делящихся ГКМ у млекопитающих
метилсульфоксида. Аликвоты суспензии хранили
выживает, сохраняет способность к делению и
при -70°С.
дифференцировке [6]; основная же часть ГКМ
Метод ДНК-комет: иммобилизация клеток в
дифференцируется в фибробласты и формирует
агарозе, лизис, электрофорез и визуализация кле-
глиальный шрам [7, 8]. С одной стороны, это
ток. Размороженную суспензию клеток центри-
ограничение препятствует заместительной тера-
фугировали (400 g, 5 мин). Осадок суспендирова-
пии сетчатки с помощью клеточной транспланта-
ли в растворе легкоплавкой агарозы (тип IV, Sig-
ции. С другой стороны, механизм наблюдаемого
ma, США) в PBS. Из суспензии готовили слайд на
ограничения пролиферации ГКМ в сетчатке пока
предметном стекле по стандартной процедуре ме-
не известен. Таким образом, понимание молеку-
тода комет [9]. Лизис в щелочи, электрофорез,
лярных событий в ГКМ после повреждения сет-
последующие нейтрализацию и фиксацию про-
чатки может наметить путь к усилению регенера-
водили согласно процедуре, детально описанной
тивной способности сетчатки у млекопитающих.
нами ранее [10]. Пролиферирующие ГКМ прояв-
В данной работе предпринята попытка опреде-
ляли с помощью первичных анти-BrdU антител
лить повреждение ДНК в ГКМ сетчатки у мышей
(10 мкг в 60 мкл PBS/слайд; Abcam, США) и вто-
в связи с возможной причастностью этих повре-
ричных антител (1 мкг/100 мкл/слайд), ассоции-
ждений к ограничению пролиферации ГКМ и ре-
рованных с Alexa 594 (Abcam, США). Фоновое
генерации сетчатки.
окрашивание, проявляющее все ДНК-содержа-
щие клетки в слайде проводили красителем
SYBR-Green I. ГКМ визуализировали в режиме
МАТЕРИАЛЫ И МЕТОДЫ
красной флуроесценции Alexa 594. Клетки/ коме-
Животные и инъекции метилнитрозомочевины и
ты визуализировали в режиме зеленой флуорес-
бромдезоксиуридина. Исследования проводили на
ценции красителяSYBR-Green I. Сканирование
половозрелых мышах-гибридах F1CBAxC57Bl6
слайда проводили на микроскопе AxioImager Z2m
(♀), в возрасте 2.5 мес. Животные содержались в
(Carl Zeiss, Германия), снабженном камерой Ax-
стандартных лабораторных условиях (22 ± 2°С,
ioCam MRc5 (Carl Zeiss, Германия). Сканировали
относительная влажность воздуха 60 ± 10 % и 12-
весь слайд (18×18 мм) или его репрезентативную
часовой световой период), имели неограничен-
часть с шагом 350 мкм, соответствующим размеру
ный доступ к воде и коммерческому питанию.
прямоугольника, вписанного в круглое поле об-
Методический подход для исследования глиаль-
зора микроскопа при увеличении 400×. Сканиро-
ных клеток Мюллера у мышей базировался на мо-
вание осуществляли попеременно в синей и в зе-
дели, в которой острая дегенерация сетчатки у
леной области возбуждения флуоресценции.
мышей индуцируется системной (однократной,
Первое сканирование давало изображение клеток
внутрибрюшинной) инъекцией ретинотоксиче-
(комет), флуоресцирующих в области зеленой
ского агента [6]. В ответ на дегенерацию сетчатки
флуоресценции SYBRGreen I (все клетки сетчат-
активируется пролиферация ГКМ, которую фик-
ки, содержащие ДНК). Второе сканирование да-
сировали по включению в ядра ГКМ пролифера-
вало изображение только BrdU-позитивных
тивного маркера бромдезоксиуридина (BrdU, Sig-
красных клеток/комет. Изображения накаплива-
ma, США). В качестве ретинотоксического агента
ли в памяти компьютера. Подсчет числа клеток
использовали метилнитрозомочевину (МНМ,
проводили с помощью программы ImageJ 1.48v.
Sigma), которую хранили в кристаллическом виде
Повреждение ДНК определяли из анализа ДНК-
при -60°C. МНМ растворяли в стерильном на-
комет с помощью программы CASP 1.2.2 и оцени-
БИОФИЗИКА том 65
№ 3
2020
ПОВРЕЖДЕНИЕ ДНК И БЕЛКА р53 ОГРАНИЧИВАЮТ ПРОЛИФЕРАЦИЮ
545
С0
С1
С2
С3
С4
0 < mt < 3
3 < mt < 10
10 < mt < 20
20 < mt < 40
mt > 40
Рис. 1. Классы ДНК-комет, получаемых из клеток сетчатки мышей, и соответствующие им диапазоны поврежденно-
сти: С0 - отсутствие повреждений, С1 - низкий уровень повреждений, С2 - средний уровень повреждений, С3 - вы-
сокий уровень повреждений, С4 - апоптотическая клетка.
вали по моменту хвоста комет (mt) [11]. Получен-
ноклональные антитела к белку р53 (Abcam,
ные данные представляли в виде распределения
США) и к BrdU (Abcam, США). Все вторичные
комет по 5 классам, каждому из которых соответ-
антитела были конъюгированы с флуоресцент-
ствовал свой интервал значений mt (рис. 1). Срав-
ными красителями Alexa594 или FITC. Слайды
нение экспериментальных распределений прово-
подвергали флуоресцентной микроскопии. Ко-
дили, используя непараметрическую статистику
личественно оценивали либо число флуоресци-
Колмогорова-Смирнова, считая различия досто-
рующих клеток на единичную площадь среза, ли-
верными при Р < 0.05.
бо суммарную интенсивность флуоресценции
единичной площади среза, которую сравнивали с
Приготовление тканевых срезов. Тканевые сре-
контролем.
зы сетчатки толщиной 8-12 мкм готовили из глаз,
фиксированных в параформальдегиде (4%-й рас-
Статистическая обработка результатов исследо-
твор в PBS, 8°C, 24 ч), сразу после извлечения.
вания. Все эксперименты проводили в трех неза-
Последующие процедуры спиртовой отмывки,
висимых повторах; представлены средние значе-
впаивание в парафиновые блоки и приготовле-
ния из них ± sd; сравнение экспериментальных
ние срезов были стандартные и описаны нами ра-
распределений параметров осуществляли с помо-
нее [12]. Срезы на предметном стекле окрашива-
щью непараметрической статистики Колмогоро-
ли красителем SYBR Green I и анализировали
ва-Смирнова, считая различия достоверными
микроскопически во флуоресцентном режиме.
при Р < 0.05. Все статистические расчеты прове-
Для морфометрического измерения слоев сетчат-
дены с помощью программного обеспечения
ки использовали окулярную линейку.
OriginPro 8.1. (OriginLab Corp., США).
Оценка апоптоза в ткани методом TUNEL. Для
регистрации гибели клеток в микроскопических
РЕЗУЛЬТАТЫ
срезах сетчатки на предметном стекле использо-
Метилнитрозомочевина индуцирует апоптоз фо-
вали набор The TACS® 2 TdT Fluorescein kit (Ser.
торецепторов в сетчатке у мышей. МНМ-индуци-
Nu. 4812-30-K, Trevigen, США) [13] и рекомендо-
рованная дегенерация сетчатки затрагивает в ос-
ванную методику к нему. Визуализацию прово-
новном слой фоторецепторов, в то время как
дили на микроскопе ЛОМО МИКМЕД-2 (АО
остальные слои сетчатки остаются интактными.
«ЛОМО», Россия) в флуоресцентном режиме, с
Это видно из рис. 2а. Гибель фоторецепторов со-
набором фильтров для регистрации флуоресцен-
провождается межнуклеосомной деградацией
ции красителя FITC.
хроматина (рис. 2в), что характерно для апопто-
Детекция апоптотической фрагментации ДНК.
тической гибели. Как следует из рис. 2б, макси-
Для детекции апоптотической фрагментации
мум гибели приходится на 72 ч после воздей-
ДНК использовали суспензию клеток после стан-
ствия. Последующее снижение частоты апоптоза
дартной процедуры экстракции из них ДНК и ее
связано с фагоцитозом поврежденных клеток в
электрофоретического разделения в агарозном
ткани.
геле [14]. Электрофорез в 1,5%-м агарозном геле
Повреждения, индуцированные метилнитрозо-
проводили при напряжении 2В/см под визуаль-
мочевиной, и репарация ДНК в клетках сетчатки у
ным контролем формирования лесенки нукле-
мышей. Известно, что МНМ является ДНК-троп-
осом в геле.
ным агентом, вызывающим повреждение ДНК в
Иммуногистохимия. Иммуногистохимическое
виде метилирования оснований, вслед за кото-
исследование тканевых срезов после их депара-
рым в клетке активируется механизм репара-
финизации, фиксации и пермеабилизации про-
ции.Хотя МНМ сама по себе не вызывает разры-
водили в соответствии со стандартным протоко-
вов, образование многих метильных аддуктов и
лом к набору The TACS® 2 TdT Fluorescein kit
процесс их репарации протекает с образованием
(Trevigen, США) [13]. Для этого использовали мо-
временных апурин-апиримидиновых сайтов и
БИОФИЗИКА том 65
№ 3
2020
546
ТРОНОВ, НЕКРАСОВА
(а)
(б)
(в)
16
*
1
14
*
2
12
10
8
6
3
4
2
0
0 10 20 30
70
80
90
100
Контроль
МНМ
Время после МНМ-инъекции, ч
Рис. 2. Апоптоз в сетчатке у мышей, вызванный действием МНМ в дозе 60 мг/кг. (а) - TUNEL-детекция апоптоза
фоторецепторов в срезах сетчатки спустя 72 ч после инъекции; 1 - слой сегментов фоторецепторов, 2 - ядерный слой
фоторецепторов, 3 - внутренний ядерный слой сетчатки; стрелки на микрофотографии указывают на FITC-
позитивные апоптотические клетки. (б) - Динамика числа апоптотических FITC-фокусов в фоторецепторном слое
сетчатки у мышей после инъекции МНМ; * - р < 0.01 по сравнению с контролем (0 ч). (в) - МНМ-индуцированная
межнуклеосомная деградация хроматина в фоторецепторах сетчатки через трое и четверо суток спустя после
инъекции.
разрывов цепей ДНК, которые детектируются
де средних значений mt из этих гистограмм
методом щелочных комет. Рис. 3 отражает дина-
(рис. 3б). Из рисунков видно, что повреждения
мику этих процессов в виде гистограмм распреде-
охватывают практически всю популяцию клеток
ления клеток по поврежденности (рис. 3а) и в ви-
в сетчатке (гисторамма на 5 ч), но к 15 ч значи-
(а)
(б)
24
1.0
*
20
0.8
16
0.6
**
12
0.4
0.2
8
0.0
С0
75
4
С1
15
С2
0
5
0
5
10
15
75
С3
Время после МНМ-инъекции, ч
С4
С
Рис. 3. Повреждение ДНК в клетках сетчатки у мышей после инъекции МНМ в дозе 70 мг/кг и последующей
инкубации in vivo: (а) - гистограммы распределения клеток по повреждению ДНК в процессе инкубации; (б) -
средние значения поврежденности ДНК ± sd в разное время инкубации; разница с контролем (0 ч): * - р < 0.01, ** -
р < 0.05.
БИОФИЗИКА том 65
№ 3
2020
ПОВРЕЖДЕНИЕ ДНК И БЕЛКА р53 ОГРАНИЧИВАЮТ ПРОЛИФЕРАЦИЮ
547
(а)
(б)
**
**
0.8
0.7
0.6
0.5
0.4
0.3
0.2
*
0.1
0.0
0
20
35
50
70
70
МНМ, мг/кг
72 ч
108 ч
Рис.
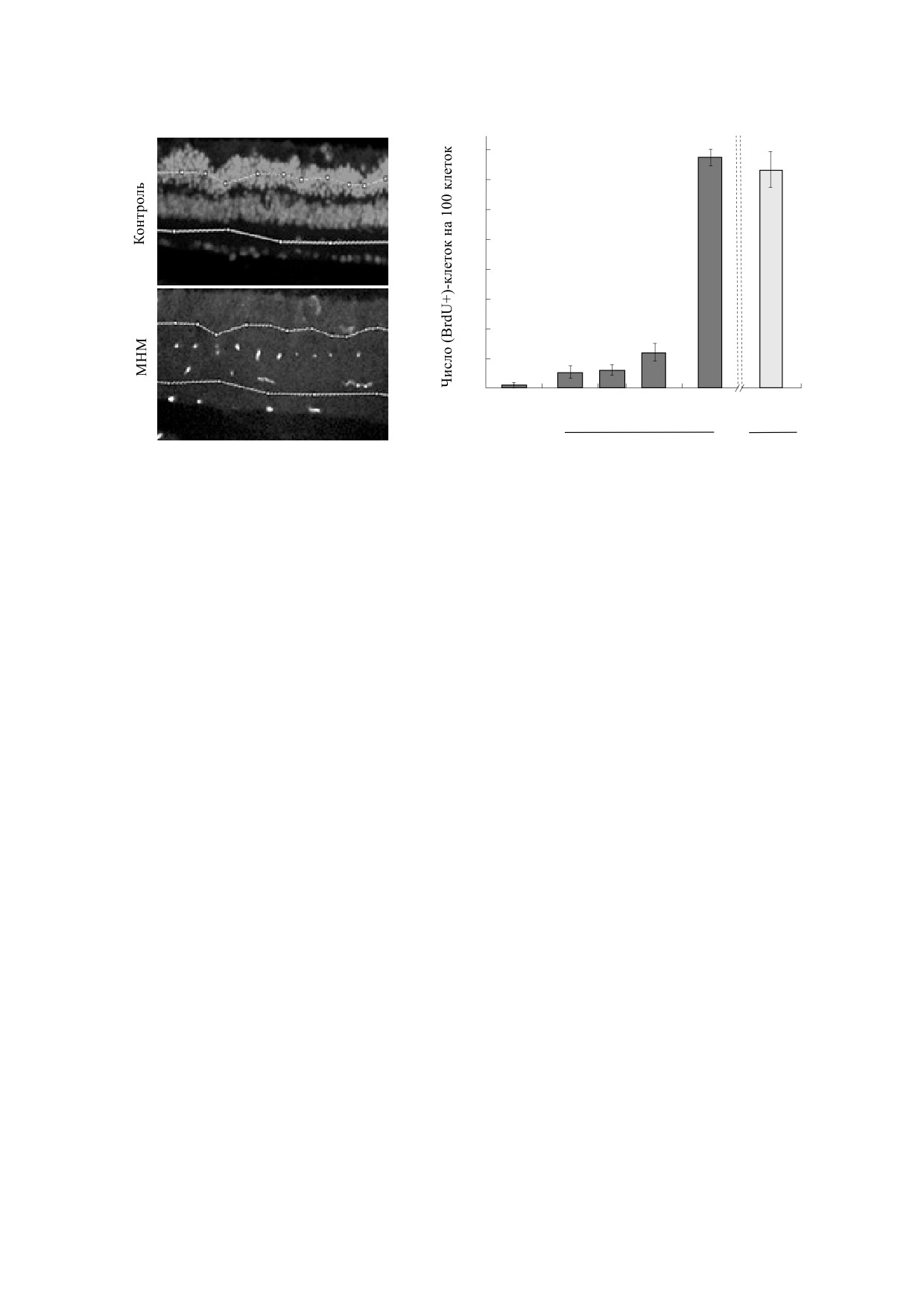
4. Пролиферация ГКМ в ответ на однократное введение мышам МНМ в различных дозах: (а)
-
микрофотографии срезов интактной сетчатки и спустя 72 ч после инъекции МНМ в дозе 70 мг/кг; (б) - число BrdU-
позитивных клеток в срезах на 100 клеток в сетчатке спустя 72 ч (темные столбики) и 108 ч (светлый столбик) после
инъекции МНМ. Достоверность различий с контролем: * - р = 0.05, ** - р < 0.01.
тельная часть их репарирует. Однако спустя 72 ч
клетках глии Мюллера оценивали спустя 72 ч по-
наблюдается вторая волна деградации ДНК, ско-
сле системной инъекции МНМ в дозе 70 мг/кг. К
рее всего связанная с гибелью фоторецепторов.
этому времени завершается один цикл пролифе-
рации ГКМ. Как видно из рис. 5, профили гисто-
Пролиферация клеток Мюллера в сетчатке в от-
грамм и средние значения mt для них различаются
вет на действие метилнитрозомочевины. Радиаль-
(достоверность различия между ними р < 0.05).
ное расположение глии Мюллера в сетчатке обес-
Это различие проиллюстрировано микрофото-
печивает контакт ГКМ со всеми слоями сетчатки,
графиями комет, соответствующих средним зна-
что позволяет им реагировать на любой вид и ло-
чениям mt этих распределений. Хотя ~45% всех
кализацию повреждений. В ответ на инъекцию
клеток интактной сетчатки к этому времени со-
МНМ наблюдается активация пролиферации
держат в разной степени поврежденную ДНК (ле-
ГКМ в сетчатке, которую мы регистрировали по
вая гистограмма), доля аналогично поврежден-
включению в ДНК пролиферативного маркера
ных ГКМ после инъекции МНМ составляет 85%
BrdU. На микрофотографиях срезов сетчатки
(правая гистограмма). С учетом щелочных усло-
(рис. 4а) представлены BrdU-позитивные ядра
вий определения повреждений ДНК в клетках
клеток глии Мюллера, которые располагаются в
этими повреждениями оказываются одно- и
основном в наружном и внутреннем ядерном сло-
двухнитевые разрывы, а также апурин-апирими-
ях сетчатки. МНМ активирует не только проли-
диновые сайты.
ферацию, но и миграцию ядер клеток в направле-
Экспрессия р53 в сетчатке после воздействия
нии к фоторецепторам. Поэтому основная масса
метилнитрозомочевины. Известно, что универ-
BrdU-фокусов располагается в коридоре, ограни-
сальным маркером клеточного ответа на повре-
ченном двумя линиями на рис. 4а. Результат
ждение ДНК является белок р53. Также он при-
оценки их количества в зависимости от дозы
нимает участие в регуляции клеточного цикла.
МНМ показан на рис. 4б. Оценку проводили спу-
Поэтому мы оценили его экспрессию в тканевых
стя 72 и 108 ч после инъекции агента. Максималь-
срезах сетчатки мышей до и после инъекции
ная стимуляция пролиферации наблюдается на
МНМ. На микросрезах сетчатки р53 проявляли с
72 ч и далее остается постоянной до 108 ч. Коли-
помощью моноклональных антител, конъюгиро-
чество пролиферирующих клеток в сетчатке у
ванных с FITC. Измерения FITC-флуоресцен-
мышей составляет в среднем 1% и не превышает
ции, приведенной к единичной площади микро-
2% от общей клеточности сетчатки.
среза, проводили с помощью программы ImageJ
Повреждение ДНК в клетках Мюллера в сетчат-
1.48v. Результат представлен в виде микрофото-
ке. Поврежденность ДНК в BrdU-позитивных графий типичных срезов сетчатки и рассчитан-
БИОФИЗИКА том 65
№ 3
2020
548
ТРОНОВ, НЕКРАСОВА
(а)
(б)
0.5
0.5
0.4
0.4
0.3
0.3
0.2
0.2
0.1
0.1
0.0
0.0
С0
С1
С2
С3
С4
С0
С1
С2
С3
С4
Класс комет
Класс комет
Рис. 5. Поврежденность ДНК в клетках сетчатки (а) и в клетках Мюллера (б), обработанных МНМ и после цикла
пролиферации; микрофотографии представляют кометы клеток с поврежденностью, соответствующей средним
показателям гистограмм для сетчатки (mt ± sd = 9 ± 14, окраска Sybr Green I) и для ГКМ (mt ± sd = 23 ± 15, окраска
Alexa594). Различия гистограмм и средних значений mt достоверны, р < 0.05.
ной из них гистограммы на рис. 6. В интактной
ОБСУЖДЕНИЕ
сетчатке обнаруживается фоновый уровень р53 в
Ретинотоксичность
метилнитрозомочевины.
фоторецепторах и в нейронах, который резко воз-
растает после повреждающего воздействия МНМ
Для исследования глиальных клеток Мюллера у
в дозе 60 мг/кг, что отражает гистограмма на
мышей мы использовали экспериментальную
рис. 7.
модель, в которой острая дегенерация сетчатки у
40
35
30
25
20
15
10
5
0
Контроль МНМ, 60 мг/кг
Рис. 6. Экспрессия р53 в ядерных слоях сетчатки у мышей в ответ на воздействие МНМ, 60 мг/кг, 24 ч после инъекции.
На микрофотографии видны белые одиночные и скопления р53-позитивных клеток. Достоверность различия средних
± sd: p < 0.05.
БИОФИЗИКА том 65
№ 3
2020
ПОВРЕЖДЕНИЕ ДНК И БЕЛКА р53 ОГРАНИЧИВАЮТ ПРОЛИФЕРАЦИЮ
549
Метил-
Эксцизионная репарация
Дисбаланс этапов
Метилирование
нитрозо-
оснований
эксцизионной репарации
оснований ДНК
мочевина
(алкиладенин-ДНК-гликозилаза,
оснований
поли(АДФ-рибозо)-полимераза 1)
Цитотоксические
повреждения ДНК
(апурин-апиримидиновые сайты,
одно- и двухнитевые разрывы ДНК)
Гибель
фоторецепторов сетчатки
Глиальные клетки
Мюллера
р53
х1
Пострепликативная
репарация ДНК
Разрывы ДНК
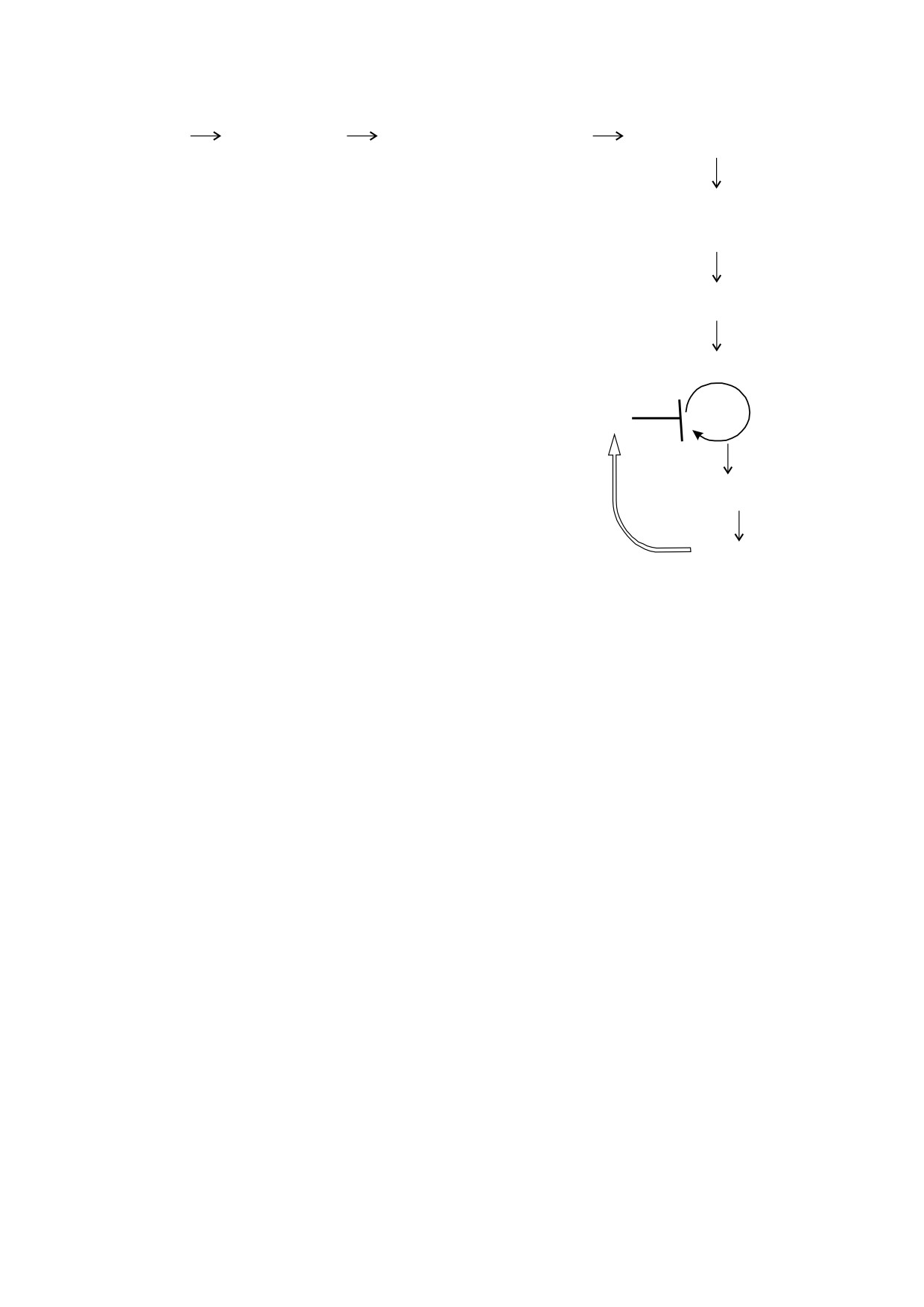
Рис. 7. Предполагаемая цепь событий при действии МНМ на сетчатку.
животных индуцируется системной инъекцией
МНМ. Дисбалансу способствует также то, что са-
ретинотоксического агента [6]. В качестве тако-
мая многочисленная модификация N7meG тор-
вого была выбрана метилнитрозомочевина.
мозит работу полимеразы β [18]. Как следует из
МНМ индуцирует в ДНК три типа модификаций
наших результатов, критический уровень повре-
оснований - N3meA, N7meG и O6meG[15], но
ждений в сетчатке у мышей достигается при дозе
пока неизвестно обладают ли они ретинотоксиче-
МНМ ≥ 60 мг/кг. При этих дозах МНМ резко воз-
ским действием сами по себе. В последнее время
растает накопление разрывов ДНК в клетках сет-
обсуждается роль репаративных механизмов в
чатки. При дозе МНМ 70 мг/кг достигается мак-
цитотоксическом эффекте МНМ [16]. Первые
симум апоптоза фоторецепторов (рис. 2) и проли-
ферации ГКМ (рис. 4). Все это указывают на
две модификации составляют в сумме 90% и яв-
причастность к ретинотоксичности МНМ фер-
ляются субстратом для алкиладенин-ДНК-гли-
ментов репарации [14].
козилазы, фермента, инициирующего эксцизи-
онную репарацию оснований [17]. Алкиладенин-
Последняя МНМ-модификация оснований
ДНК-гликозилаза гидролизует N-гликозидную
O6meG составляет 10% и репарируется деметили-
связь между алкилированым основанием и рибо-
рующим ферментом MGMT, но, будучи нерепа-
зофосфатным остовом ДНК, оставляя апурин-
рированной, образует неканоническую пару с ти-
апиримидиновый сайт. Сайт является субстратом
мином, которая в результате активности коррек-
для апурин-апиримидиновой эндонуклеазы 1,
ционной (пострепликативной) репарации
которая формирует разрыв одной цепи ДНК с 3'-
переходит в летальный двунитевой разрыв ДНК
OH- и 5'-dRP-концами. ДНК-полимераза β уда-
[19]. Важным посредником ретинотоксического
ляет 5'-dRP-конец и на его место присоединяет
действия МНМ может быть поли(АДФ-рибоза)-
один нуклеотид. Завершает процесс ДНК-лигаза I
полимераза 1 [20]. Будучи участником репарации,
или III. Интермедиатами процесса, как видно,
эта полимераза связывается с разрывом со сторо-
являются цитотоксичные апурин-апиримидино-
ны 5'-dRP-конца и присоединяет к ближайшему
вые сайты и однонитевые разрывы, которые в
гистону разветвленный полимер поли(АДФ-ри-
случае несбалансированности этапов эксцизион-
бозу), синтезируемый из ATP и NAD+. Это ослаб-
ной репарации оснований накапливаются в клет-
ляет связь гистонов с ДНК и вызывает диссоциа-
ке и приводят ее к гибели. Дисбаланс этапов та-
цию или миграцию нуклеосом по ДНК, открывая
кой репарации неизбежен при нарастании дозы
доступ к повреждению для репаративного ком-
БИОФИЗИКА том 65
№ 3
2020
550
ТРОНОВ, НЕКРАСОВА
плекса [21]. Поли(АДФ-рибозной) модификации
рилированием гистона Н2АХ и экспрессией
подвергаются многие ферменты и структурные
белка р21. Р53 - универсальный маркер повре-
белки, что делает функционирование поли(АДФ-
ждений ДНК, ответственный за G1-блок цикла
рибозо)-полимеразы 1 в клетке в высокой степе-
клетки с поврежденной ДНК; фосфорилирован-
ни энергозатратным, приводящим клетку к гибе-
ный гистон Н2АХ (γ-Н2АХ ) - маркер двуните-
ли [22]. Это справедливо как для пролиферирую-
вых разрывов ДНК, связанных с апоптотической
щих, так и для покоящихся клеток, в особенности
компактизацией хроматина, а p21 - ингибитор
для фоторецепторов сетчатки, поскольку из-за
циклинкиназ, осуществляющих переход G1→S в
высокой оксигенации и метаболической актив-
клеточном цикле. Как видно, эти три белка явля-
ности эти клетки имеют крайне низкий энергети-
ются компонентами клеточного ответа на повре-
ческий резерв и, как видно из рис. 2, первыми
ждение ДНК (DNA damage response), который
подвергаются гибели при стрессе сетчатки [23,14].
блокирует пролиферацию. С концепцией «DNA
damage response» [27] в ГКМ согласуется обнару-
Разрывы ДНК в глиальных клетках Мюллера и
женный нами факт наличия повреждений ДНК в
р53 ограничивают пролиферацию глиальных клеток
пострепликативных клетках Мюллера и увели-
Мюллера в сетчатке. Отсутствие увеличения чис-
лаBrdU-позитивных клеток в сетчатке после 72 ч
ченная экспрессия р53 в сетчатке.
(рис. 4) подтверждает вывод о блоке дальнейшей
Таким образом, подытоживая результаты ра-
пролиферации ГКМ в сетчатке у мышей, вызван-
боты, на рис. 7 мы представляем предполагаемую
ном имеющимися в ДНК разрывами. Но по-
последовательность событий в сетчатке мышей
скольку до этого времени клетки пролифериро-
после ретинотоксического воздействия МНМ,
вали, то мы полагаем, что эти разрывы прояви-
которая завершается блоком пролиферации гли-
лись в пострепликативный период. Их появление
альных клеток Мюллера.
можно связать с механизмом пострепликативной
репарации. Субстратом для нее служат некор-
ФИНАНСИРОВАНИЕ РАБОТЫ
ректные пары оснований, возникшие либо как
случайные ошибки ДНК-полимеразы при синте-
Работа выполнена при финансовой поддержке
зе на интактной матрице, либо при репликации
Российского фонда фундаментальных исследова-
матрицы, содержащей модифицированные осно-
ний (грант № 16-04-00133).
вания. Принимая во внимание высокий уровень
оксигенации сетчатки, можно ожидать и высокий
КОНФЛИКТ ИНТЕРЕСОВ
уровень окси-модифицированных оснований в
материнской цепи реплицирующейся ДНК гли-
Авторы заявляют об отсутствии конфликта
альных клеток, что мы наблюдали ранее [24].
интересов.
Особенностью пострепликативной репарации
является то, что она оперирует только с дочерней,
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
вновь-синтезированной цепочкой ДНК (поэтому
такую репарацию часто называют постреплика-
Все процедуры с животными осуществляли в
тивной коррекцией). Итак, возникшие в матрице
соответствии с Положением Комитета по этике
и прошедшие через цикл репликации поврежде-
ИБХФ РАН.
ния сохраняются в клетке в пострепликативный
период. Но поскольку этим аддуктам в клетке от-
СПИСОК ЛИТЕРАТУРЫ
сутствуют комплементарные основания, то экс-
цизионная активность пострепликативной репа-
1. S. A. Jayakody, R. R. Gonzalez-Cordero Ali, and
рации на дочерней цепи ДНК становится абор-
R. A. Pearson, Prog. Retin. Eye Res. 46, 66 (2015).
тивной и формирует долгоживущий или
2. D. Lamba, M. Karl, and T. Reh, Cell Stem Cell 2, 538
двунитевой разрыв, которые блокируют репли-
(2008).
кацию.
3. J. G. Monzon, N. Hammad, S. D. Stevens, and
В ответ на возникшие повреждения ДНК в
J. Dancey, Oncologist 17, 384 (2012).
клетках глии возрастает экспрессия белка р53,
4. В. А. Тронов и Е. И. Некрасова, Вопросы
который сигнализирует о снижении пролифера-
онкологии 64, 555 (2019).
ции. Например, глия Мюллера в сетчатке у мы-
5. A. Tsubura, K. Yoshizawa, M. Kuwata, and N. Uehara,
шей с фенотипом (trp53+/+) обнаруживала мень-
Histol. Histopathol. 25, 933 (2010).
шую пролиферативную активность в модели
6. M. O. Karl, S. Hayes, B. R. Nelson, et al., Proc Natl.
NMDA-индуцированной дегенерации сетчатки, чем
Acad. Sci. USA 105, 19508 (2008).
глия у нокаутных мышей с фенотипом trp53-/- [25].
В работе на модели МНМ-индуцированной деге-
7. G. P. Lewis, E. A. Chapin, G. Luna, et al., Mol. Vis.
нерации сетчатки у крыс также наблюдали экс-
16, 1361 (2010).
прессию р53 в сетчатке. Кроме того, регистрируе-
8. K. Yoshizawa, T. Sasaki, N. Uehara, et al., J. Toxicol.
мая пролиферация ГКМ сопровождалась фосфо-
Pathol. 25, 27 (2012).
БИОФИЗИКА том 65
№ 3
2020
ПОВРЕЖДЕНИЕ ДНК И БЕЛКА р53 ОГРАНИЧИВАЮТ ПРОЛИФЕРАЦИЮ
551
9. Л. А. Островская, В. А. Филов, Б. А. Ивин и др.,
19. В. А. Тронов, Е. М. Константинов и И. И. Крама-
Рос. биотерапевт. журн. 3, 24 (2004).
ренко, Биохимия 67, 882 (2002).
10. В. А. Тронов, Е. И. Некрасова и М. А. Островский,
20. M. Allocca, J. J. Corrigan, K. R. Fake, et al., Oncotar-
Цитология 60, 440 (2018).
get 8, 68707 (2017).
11. K. Koñca, A. Lankoff, A. Banasik, et al., Mutat. Res.
21. D. Ahel, Z. Horejsí, N. Wiechens, et al., Science 325,
534, 15 (2003).
1240 (2009).
12. М. Ю. Логинова, В. А. Тронов, Т. А. Белецкая
22. W. Ying, M. B. Sevigny, Y. Chen, and R. A. Swanson,
и др., Радиац. биология. Радиоэкология 48, 698
Proc. Natl. Acad. Sci. USA 98, 12227 (2001).
(2008).
23. W. Cao, J. Tombran-Tink, R. Elias, et al.,Invest. Oph-
thalmol. Vis. Sci. 42, 1646 (2001).
gen.com/docs/protocol/protocol_4812-30-K.pdf.
24. В. А. Тронов, Ю. В. Виноградова, М. Ю. Логинова
14. В. А. Тронов и Е. М. Константинов, Биохимия 65,
и др., Цитология 54, 261 (2012).
1516, (2000).
15. D. T. Beranek, Mutat. Res. 231, 11 (1990).
25. Y. Ueki, M. O. Karl, S. Sudar, et al., Glia 60, 1579
(2012).
16. D. Fu, J. A. Calvo, and L. D. Samson, Nat. Rev. Can-
cer 12, 104 (2012).
26. J. Wan, H. Zheng, Z-L. Chen, et al., Vis. Res. 48, 223
17. L. B. Meira, C. A. Moroski-Erkul, S. L. Green, et al.,
(2008)
Proc. Natl. Acad. Sci. USA 106, 888 (2009).
27. K. Nomura-Komoike, F. Saitoh, Y. Komoike, and
18. M.-C. Koag, Y. Kou, H. Ouzon-Shubeita, and S. Lee,
H. Fujieda, Invest. Ophthalmol. Vis. Sci. 57,
1169
Nucl. Acids Res. 42, 8755 (2014).
(2016).
DNA Damage and p53 Restrict Proliferation of Muller Cells in Mouse Retina
in Response to the Influence of N-Methyl-N-Nitrosourea
V.A. Tronov* and E.I. Nekrasova**
*Semenov Institute of Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
A systemic administration of N-methyl-N-nitrosourea in rats resulted in the death of the retinal photorecep-
tors followed by differentiation of retinal Müller glia cells into the photoreceptor-like cells [27]. However, the
mammalian Müller glia cells display an extremely limited proliferative capacity which correlates with expres-
sion of histone H2AX and p21 protein. These proteins are known to be the components of cellular response
to DNA damage [26]. The restriction of the human Muller glia cells proliferation prevents the retinal replace-
ment therapy by cell transplantation. On the other hand, the mechanism that limits the proliferation of
Müller glia in the mammalian retina is yet to be elucidated. We examined the Müller glial proliferative re-
sponse, DNA damage response in Müller glia in a postreplicative stage as well as expression of p21 protein in
response to the influence of retinotoxic N-methyl-N-nitrosourea. It was shown that N-methyl-N-nitrosourea
induced retinal degeneration in mice via apoptotic death of photoreceptors while the other retinal layers re-
mained intact. At the same time, the formation of DNA breaks and alkali-labile sites was observed in all ret-
inal cells 5 h after N-methyl-N-nitrosourea injection; complete disappearance of these formations occured
15 h after N-methyl-N-nitrosourea injection. By 72 hour, there was a significant rise in DNA breaks in Müller
glia. The absence of bromodeoxyuridine incorporation during subsequent time in the retinal cells indicates
that there is no Müller glia cell proliferation and reparative synthesis of DNA. At the same time, an increase
in the expression of p53 protein, a universal marker to determine DNA damage response was observed. Thus,
our findings support the concept of “DNA damage response” with regards to Müller glia that there is a link
between DNA damage in Müller glia cell and limited proliferation of these cells in mice. Postreplicative re-
pair is considered a probable mechanism of the formation of DNA breaks in postreplicative Müller glia cells.
Keywords: retina, Muller cells, photoreceptors, apoptosis, DNA strand breaks, DNA repair, p53, methylnitro-
sourea
БИОФИЗИКА том 65
№ 3
2020