БИОФИЗИКА, 2020, том 65, № 4, с. 646-655
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.32; 57.03
ЦЕПНАЯ РЕАКЦИЯ АВТООКИСЛЕНИЯ АДРЕНАЛИНА - МОДЕЛЬ
ХИНОИДНОГО ОКИСЛЕНИЯ КАТЕХОЛАМИНОВ
© 2020 г. Т.В. Сирота
Институт теоретической и экспериментальной биофизики РАН,
142290, Пущино Московской области, ул. Институтская, 3
E-mail: sirotatv@rambler.ru
Поступила в редакцию 18.11.2019 г.
После доработки 07.04.2020 г.
Принята к публикации 07.04.2020 г.
Обзор посвящен литературным данным и собственным исследованиям нетривиального
хиноидного пути окисления адреналина. Подобным образом могут окисляться все катехоламины с
образованием соответствующих аминохромов. Этот процесс моделируется in vitro в щелочной среде
и известен как цепная реакция автоокисления адреналина, продуктами которой являются
адренохром и соединения радикальной природы - супероксид-анионы (О−●) и другие. Как
супероксидгенерирующая модель эта реакция была ранее использована для определения
активности супероксиддисмутазы. Нами были предложены различные новые методические
подходы, которые позволяют определять активность фермента и выявлять анти/прооксидантные
свойства различных соединений и материалов. Этот путь превращения одного из катехоламинов
(дофамина) в настоящее время описан как «доклиническая модель болезни Паркинсона». В связи с
этим реакция автоокисления адреналина предложена нами для поиска веществ, способных
ингибировать процесс хиноидного окисления, т.е. выявлять потенциальные нейропротекторы.
Экспериментальные и теоретические исследования этой реакции расширяют представления о
механизмах свободно-радикальных процессов, происходящих в организме
Ключевые слова: катехоламины, аминохромы. адреналин, адренохром, супероксид, хиноидное окисление.
DOI: 10.31857/S0006302920040031
ХИНОИДНЫЙ ПУТЬ ОКИСЛЕНИЯ
хромов происходит с участием ферментов глута-
АДРЕНАЛИНА
тион-S-трансферазы [2, 3] и хинонредуктазы [4].
Адренохром может быть также субстратом гидро-
Гормон-медиатор адреналин, участвующий в
лазы, липазы, эстеразы [5] и ксантиноксидазы
регуляции функционального состояния симпато-
[6]. Подобным образом способны окисляться до
адреналовой системы, вырабатываемый в основ-
соответствующих аминохромов все известные
ном хромаффинной тканью мозгового слоя над-
природные катехоламины (биогенные амины)
почечников, метаболизируется в организме, как
[7-10].
и другие катехоламины, несколькими путями.
Основные пути его превращения - оксиметили-
Процесс хиноидного окисления адреналина
рование с образованием метанефрина (~70%) и
in vitro происходит при внесении его в щелочной
окислительное дезаминирование с участием мо-
карбонатный буфер. Этапы процесса превраще-
ноаминооксидазы (~20%). Кроме того, при опре-
ния адреналина представлены на рис.
1.
деленных условиях может происходить и так на-
Кроме конечного продукта реакции адренохрома
зываемое хиноидное окисление адреналина с об-
в процессе автоокисления происходит и образо-
разованием хинонов - до адренохрома и далее,
вание О−●. При попадании адреналина в буфер
возможно, до адренолютина и индола [1, 2]. Спе-
происходит внутримолекулярная перестройка его
цифические ферменты этого пути окисления ад-
молекулы, депротонизация с последующей цик-
реналина не выявлены, но образующиеся про-
лизацией и образование промежуточных продук-
дукты существуют и известны ферменты, их
тов, таких как радикал семихинон (II), адрена-
утилизирующие [2-6]. Удаление продуктов хино-
линхинон и другие, до соединения хиноидной
идного окисления адреналина и других амино-
природы - адренохрома (VI) (рис. 1а). Этот про-
Сокращения: АФК - активные формы кислорода; БП -
цесс сопровождается высвобождением электро-
болезнь Паркинсона, СОД - супероксиддисмутаза.
нов и последующим одноэлектронным восста-
646
ЦЕПНАЯ РЕАКЦИЯ АВТООКИСЛЕНИЯ АДРЕНАЛИНА
647
(а)
(б)
OH
HO
e
O2
O2
Адреналин
HO
N
H CH
3
I
1e , 1H+
OH
O
Адреналинсемихинон
HO
N
H CH3 CH3
II
1e , 1H+
OH
OH
O
HO
Лейкоадренохром
O
N
HO
N
H
CH3
III
IV
CH3
Адреналинхинон
1e , 1H+
OH
O
Адренохромсемихинон
HO
N
V CH3
1e , 1H+
OH
OH
OH
O
O
O
HO
HO
+
O
N
O
N
HO
N
HO
N
CH3
CH3
CH3
CH3
VII
VI
VIII
IX
Адренохром
Адренохром
Адренолютин
Адренолютин
(цвиттер-ион)
(кето-форма)
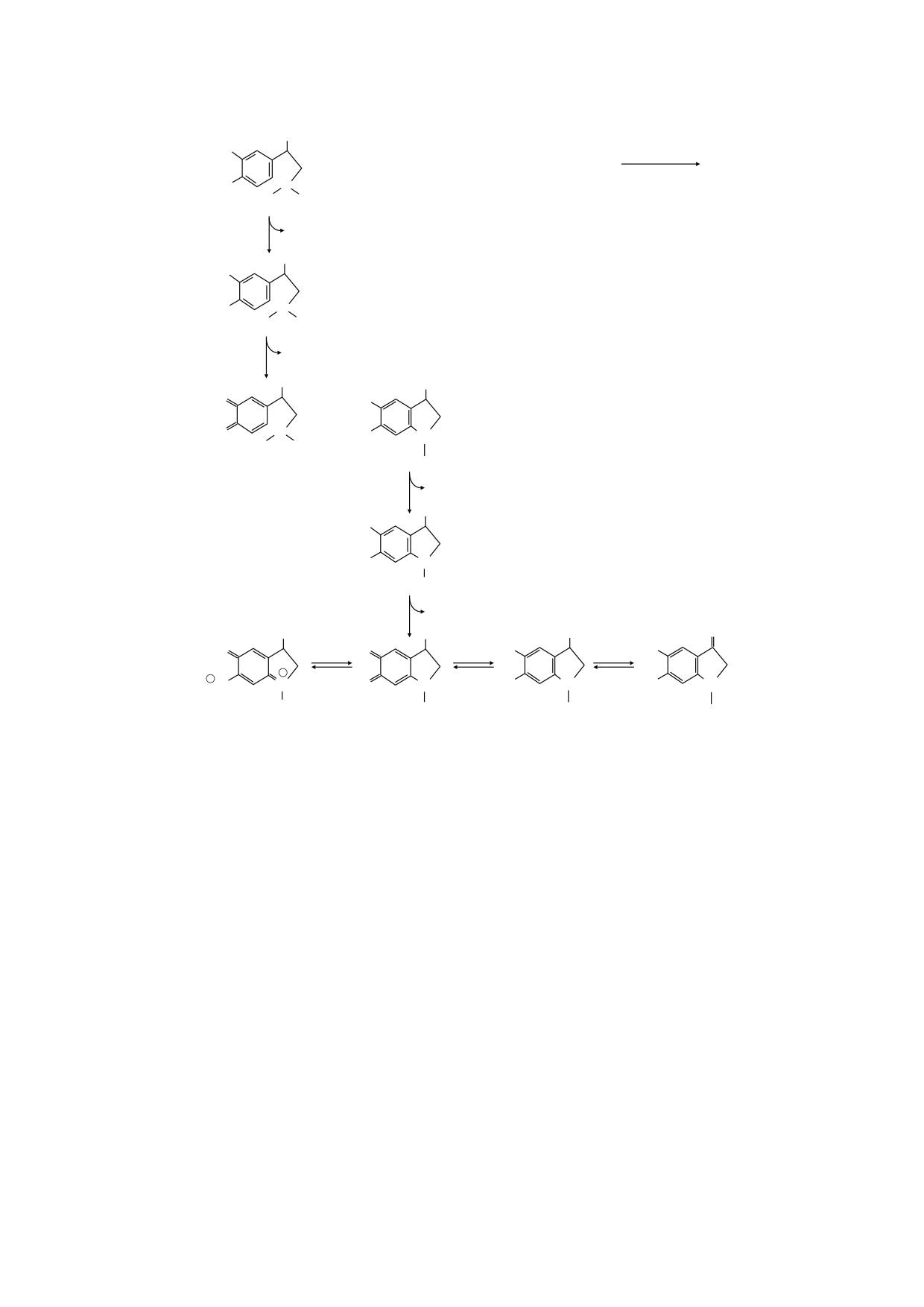
Рис. 1. (а) - Химические превращения адреналина в процессе его хиноидного окисления до адренохрома (VI).
Промежуточные продукты реакции - II-V; возможные взаимные переходы конечных продуктов от адренохрома (VI)
до VII, VIII и IX. (б) - схема сопряженного процесса образования супероксид-анионов. Составлено согласно работам
[7, 8] с некоторыми изменениями и добавлениями [9, 11].
новлением растворенного в среде кислорода и та-
предполагается, обусловлена не только накопле-
ким образом происходит образование супер-
нием продуктов окисления катехоламинов ами-
оксидных радикалов (рис. 1б), т.е. химическое
нохромов, но и образующимися в этом процессе
превращение адреналина сопряжено с образова-
активными формами кислорода (АФК), а именно
нием О−●. На рис. 2 представлена результирую-
О2-●
[13-17]. При недостаточности антиокси-
щая схема этого процесса. Эта модельная система
дантной защиты АФК могут вызывать окисли-
известна как супероксидгенерирующая и су-
тельный стресс и воспаление. Нейротоксическое
пероксиддетектирующая цепная реакция авто-
действие адренохрома и последующего продукта
окисления адреналина [7-11].
окисления адренохрома - адренолютина - свя-
зывают с так называемой «адренохромной» гипо-
Нетривиальный путь окисления относят к
аномальному метаболизму катехоламинов, с ко-
тезой этиологии шизофрении [12, 14-17]. Они из-
торым связывают его нейро- и кардиотоксич-
вестны также как адреномиметики, обладающие
ность [7, 9, 10, 12-23]. Причина токсичности, как
галлюциногенными свойствами [12].
БИОФИЗИКА том 65
№ 4
2020
648
СИРОТА
OH
OH
4e
HO
O
+
e
O2
O2
HO
N
O
N
Супероксид-анион
H
CH3
На каждом этапе окисления
CH3
Адреналин
Адренохром
Четыре последовательных промежуточных этапа
Рис. 2. Краткая схема-резюме хиноидного окисления адреналина.
Описанный много лет назад хиноидный путь
зован в работе [26] для определения активности
окисления адреналина в настоящее время актив-
фермента супероксиддисмутазы (СОД). СОД, пе-
но обсуждается в литературе в связи с его способ-
рехватывая О−●, тормозит накопление адрено-
ностью генерировать АФК. Интерес к этой теме
обусловлен также и тем, что продукты окисления
хрома, регистрацию которого проводили спек-
адреналина, белки-хиноны, глутатионовые конъ-
трофотометрически при длине волны 480 нм [26].
юганты адреналина и адренохрома, влияют на ре-
Таким способом определяют активность фермен-
докс-состояние клеток и тканей [15-18]. Их дей-
та, а именно по его способности ингибировать
ствие обусловлено участием в митохондриальных
скорость образования адренохрома. Нами было
процессах [19, 20], в регуляции NO-зависимой гу-
установлено, что образование адренохрома в ре-
анилатциклазы [21] и функционировании тирео-
идных гормонов [22]. Следует отметить, что АФК
акции автоокисления адреналина можно реги-
важны при выполнении нормальных физиологи-
стрировать и в другой области спектра - в диапа-
ческих функций как вторичные мессенджеры
зоне 330-365 нм [27-29]; используемая длина
внутриклеточной сигнализации, однако избы-
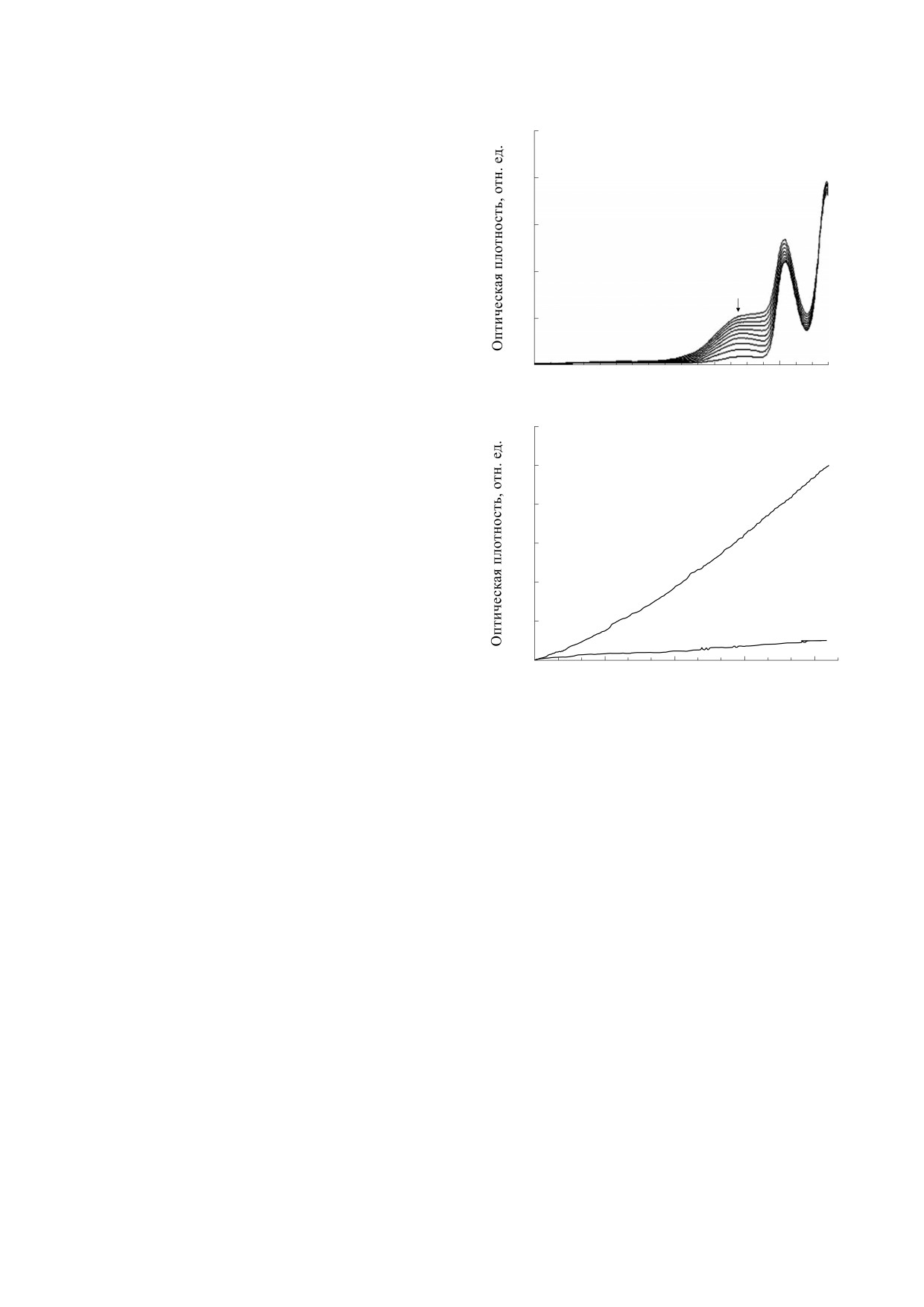
волны - 347 нм (рис. 3а). Величина оптической
точное их накопление, нарушение баланса между
плотности в выявленном диапазоне существенно
образованием и их утилизацией приводит к раз-
выше (почти на порядок), чем при 480 нм [26].
витию патологического процесса [23].
Рис. 3б иллюстрирует преимущество использова-
Особо следует отметить участие аминохрома,
ния длины волны 347 нм в сравнении с длиной
производного от катехоламина дофамина, в этио-
волны 480 нм для регистрации адренохрома. СОД
логии болезни Паркинсона (БП) [16, 18] (см. ни-
же в отдельном разделе).
и анти/прооксидантые соединения ингибирова-
ли или активировали процесс автоокисления ад-
реналина при регистрации кинетики реакции на
МЕТОДИЧЕСКИЕ АВТОРСКИЕ ПРИЕМЫ
этой длине волны [27-29, 31-37, 39].
РЕГИСТРАЦИИ ПРОЦЕССА
АВТООКИСЛЕНИЯ АДРЕНАЛИНА
Последующие исследования этой реакции,
Как описано выше, в условиях in vitro хиноид-
связанные с использованием полярографическо-
ное превращение адреналина с образованием ад-
го метода [11] и применением красителя нитроси-
ренохрома происходит в щелочной среде. Мето-
него тетразолия [38], напрямую показали генера-
дически специально создается высокое значение
цию О2-● в этом процессе и затем, в результате
рН среды, необходимое для более продолжитель-
ного существования супероксид-аниона, чтобы
диспропорционирования, образование перокси-
была возможность его детектировать. Известные
да [11]. На основании этих исследований нами
супероксидгенерирующие модели, такие как
были разработаны новые методические приемы,
ферментативная ксантин-ксантиноксидаза [24],
позволяющие оценивать активность СОД и выяв-
химическая ФМС/НАДН [25], адреналиновая по
лять анти/прооксидантные свойства различных
Misra & Fridovich [26] и наши новые разработки
биологических материалов и химических ве-
«адреналинового» метода [27-29], функциониру-
ют при щелочных условиях, что позволяет реги-
ществ, используя полярографическую установку
или применяя краситель нитросиний тетразолий
стрировать О−●. Процесс автоокисления проис-
[29, 31-37]. Обобщенные данные и выработанные
ходит по механизму цепной реакции и начинает-
ся после внесении адреналина в щелочной
критерии оценки антиоксидантной активности и
раствор (рис. 1 и 2).
активности СОД, включая стандартизацию усло-
Впервые этот процесс окисления адреналина
вий, описаны в работе [39] и представлены на
был описан в работе [30] и впоследствии исполь-
рис. 4.
БИОФИЗИКА том 65
№ 4
2020
ЦЕПНАЯ РЕАКЦИЯ АВТООКИСЛЕНИЯ АДРЕНАЛИНА
649
УЧАСТИЕ КАРБОНАТ/БИКАРБОНАТНЫХ
(а)
2.5
ИОНОВ В ПРОЦЕССЕ АВТООКИСЛЕНИЯ
АДРЕНАЛИНА
2.0
Обнаружено, что скорость накопления адре-
нохрома и скорость образования О−● (опыты с
1.5
нитросиним тетразолием) существенно зависят
от концентрации карбонат/бикарбонатных
ионов в используемом буфере и что эти ионы су-
1.0
щественно ускоряют автоокисление адреналина,
347 нм
проявляя прооксидантные свойства [40]. Кроме
того, графики исследования зависимости степе-
0.5
ни ингибирования процесса образования адрено-
хрома и О−● от концентрации СОД показали,
0.0
что в реакции автоокисления адреналина образу-
600
500
400
300
Длина волны, нм
ются не только супероксид-анионы, но и другие
радикальные соединения, т.е. происходит не
(б)
только одноэлектронное восстановление кисло-
0.3
рода, растворенного в буфере, с образованием
2
О−●, но и одноэлектронное восстановление
компонентов буфера с образованием продуктов
радикальной природы [40]. Вероятными претен-
0.2
дентами могут быть растворенный в буфере диок-
сид углерода (СО2) и собственно карбонат/би-
карбонатные ионы. В рабочем 0.2 М карбонат-
бикарбонатном буфере, рН 10.5 диффузно рас-
0.1
творены как атмосферный кислород, так и СО2,
причем растворимость последнего, как известно,
1
в 70 раз выше, чем растворимость О2 [41-43]. Ве-
роятно, СО2, подобно кислороду, может прини-
0.0
0
1
2
3
4
мать электроны, высвобождающиеся в процессе
Время, мин
автоокисления адреналина, что приводит к обра-
зованию радикалов диоксида углерода. Анализ
литературных данных позволил сделать такое
Рис. 3. (а) - Кинетика автоокисления адреналина в
0.2 М карбонатном буфере, рН 10.5; (б) - измерение
предположение [44-49]. На представленной схе-
величины оптической плотности при длине волны
ме (рис. 5), позиции (1), (2) и (3а) иллюстрируют
480 нм (кривая 1) и 347 нм (кривая 2). Пояснения в
это положение.
тексте.
Образование карбонатных анион-радикалов в
данной модели также возможно, поскольку все
карбонат (НООСО2-) (рис. 5, позиция 3б), фор-
необходимые для этого компоненты присутству-
мирующий впоследствии карбонатный анион-
ют в среде: буфер Na2CO3/NaHCO3, растворен-
радикал (СО−●) [44-49]. Такая логика событий
ные в буфере атмосферный О2 и СО2 и вносимый
позволяет предположить возможность образова-
в систему адреналин, в процессе окисления кото-
ния карбонатных радикалов в реакции автоокис-
рого высвобождаются электроны. Эти электроны
ления адреналина, что и было показано нами ра-
поступают на кислород, образуя супероксидные
нее [40]. В пользу этих представлений указывают
анион-радикалы. Супероксид-радикалы могут
и работа [50], где описаны интересные «взаимо-
спонтанно диспропорционировать с образовани-
ем пероксида водорода, присутствие которого на-
отношения» в карбонат/бикарбонатных водных
ми было установлено в полярографических экс-
системах и цитируются работы относительно воз-
периментах с использованием каталазы [11]. Та-
можности одноэлектронного восстановления ди-
ким образом, в реакционной среде, где
оксида углерода с образованием анион радикала
происходит автоокисление адреналина, присут-
СО−●. Кроме того, в работе [50] также показано,
ствует и образовавшийся пероксид водорода. Со-
что в обычных условиях в водных растворах кар-
гласно литературным данным, бикарбонатный
бонат/бикарбонатных ионов постоянно проду-
ион НСО3-, взаимодействуя с пероксидом, обра-
цируются супероксид-радикалы и другие АФК и
зует промежуточный интермедиат пероксимоно-
особую роль играют именно эти ионы. Сигнал
БИОФИЗИКА том 65
№ 4
2020
650
СИРОТА
ППОА
Адренохром
Спектрофотометрия
347 нм [27, 28]
Адреналин
e
e
+O2
O2 + НСТ
Спектрофотометрия
560 нм [38]
Кислород,
растворенный в буфере
Полярография
(потребление кислорода)
[11]
Рис. 4. Различные авторские методические приемы регистрации продуктов реакции автоокисления адреналина (схе-
ма). Обозначения: ППОА - промежуточные продукты окисления адреналина, НСТ - нитросиний тетразолий. Стрел-
ками показано нарастание оптической плотности при соответствующей длине волны или убыль (потребление) кисло-
рода из кюветы.
тайрона, специфического ЭПР-зонда суперок-
радикалы (этап 3б, согласно работе [48]). Карбо-
сидных анион-радикалов, не обнаруживается, ес-
натные анион-радикалы также могут образовы-
ли в исследуемой системе рН доведен с помощью
ваться из бикарбонатных ионов при участии гид-
NaOH и отсутствуют бикарбонатные ионы. По-
роксил-радикала (НО●), продукта одноэлектрон-
казано также, что амплитуда сигнала ЭПР тайро-
ного окисления воды (этап 3в, согласно работе
на возрастает с ростом концентрации
[50]).
НСО3-/СО32- (рис. 5, позиция 3в) [50].
Поскольку в организме карбонат/бикарбонат-
ные ионы присутствуют повсеместно, нельзя ис-
В исследуемой нами реакции в результате пре-
ключить их участие как акцепторов, а затем доно-
образования адреналина происходит активная
ров электронов. Эти буферы - не инертные си-
«доставка» в буфер электронов, которые, очевид-
стемы, а биологически активные участники в
но, «потребляются» как кислородом и СО2, так и
окислительно-восстановительных реакциях и
другими компонентами буфера. Полученные ре-
могут быть мощными прооксидантами. Необхо-
зультаты и анализ литературных данных впервые
димо это учитывать при использовании подоб-
позволили предположить, что в данной модель-
ных буферов в ситуациях, где происходят свобод-
ной системе реакции автоокисления адреналина,
но-радикальные реакции. А это, как известно,
а это возможно и в организме, образуются не
постоянно протекающие в организме нормаль-
только супероксид-анионы, но и карбонатные
ные окислительно-восстановительные процессы,
радикалы и радикалы диоксида углерода. Уни-
определяющие редокс-статус и возникающие па-
кальная биологическая активность карбонат/би-
тологические случаи, связанные с окислитель-
карбонатных ионов, несомненно, связана и с
ным стрессом.
этой их способностью.
Представленная на рис. 5 схема обобщает на-
ши и литературные данные, показывая, как воз-
ИСПОЛЬЗОВАНИЕ РЕАКЦИИ
можно образование АФК в процессе автоокисле-
АВТООКИСЛЕНИЯ АДРЕНАЛИНА
ния адреналина.
ДЛЯ ПОИСКА НЕЙРОПРОТЕКТОРОВ
Окисляющийся до адренохрома адреналин и
Как было отмечено выше, один из механизмов
его промежуточные продукты - доноры электро-
этиопатогенеза болезни Паркинсона (БП) связы-
нов (этап 1). Высвобождающиеся электроны мо-
вают с процессом хиноидного окисления катехо-
гут поступать не только на растворенный в буфе-
ламина дофамина, прогрессирующего нейродеге-
ре кислород, образуя супероксидные анион-ра-
неративного заболевания, приводящего к гибели
дикалы (этап 2), но и на другие компоненты
(аутофагии) дофаминергических нейронов [15-
используемого буфера, а именно - на растворен-
19, 51-54]. Этот путь превращения катехолами-
ный в буфере атмосферный диоксид углерода, что
нов описывается как «доклиническая модель БП
приводит к образованию радикала диоксида угле-
для поиска нового фармакологического лечения,
рода (этап 3а). При взаимодействии бикарбонат-
которое остановило бы развитие этого заболева-
ных ионов буфера и пероксида водорода, продук-
ния» [18, 52, 53]. Катехоламин дофамин - это
та спонтанного диспропорционирования су-
нейротрансмиттер, который играет важную роль
пероксида, могут образовываться карбонатные
в осуществлении движений. При БП происходит
БИОФИЗИКА том 65
№ 4
2020
ЦЕПНАЯ РЕАКЦИЯ АВТООКИСЛЕНИЯ АДРЕНАЛИНА
651
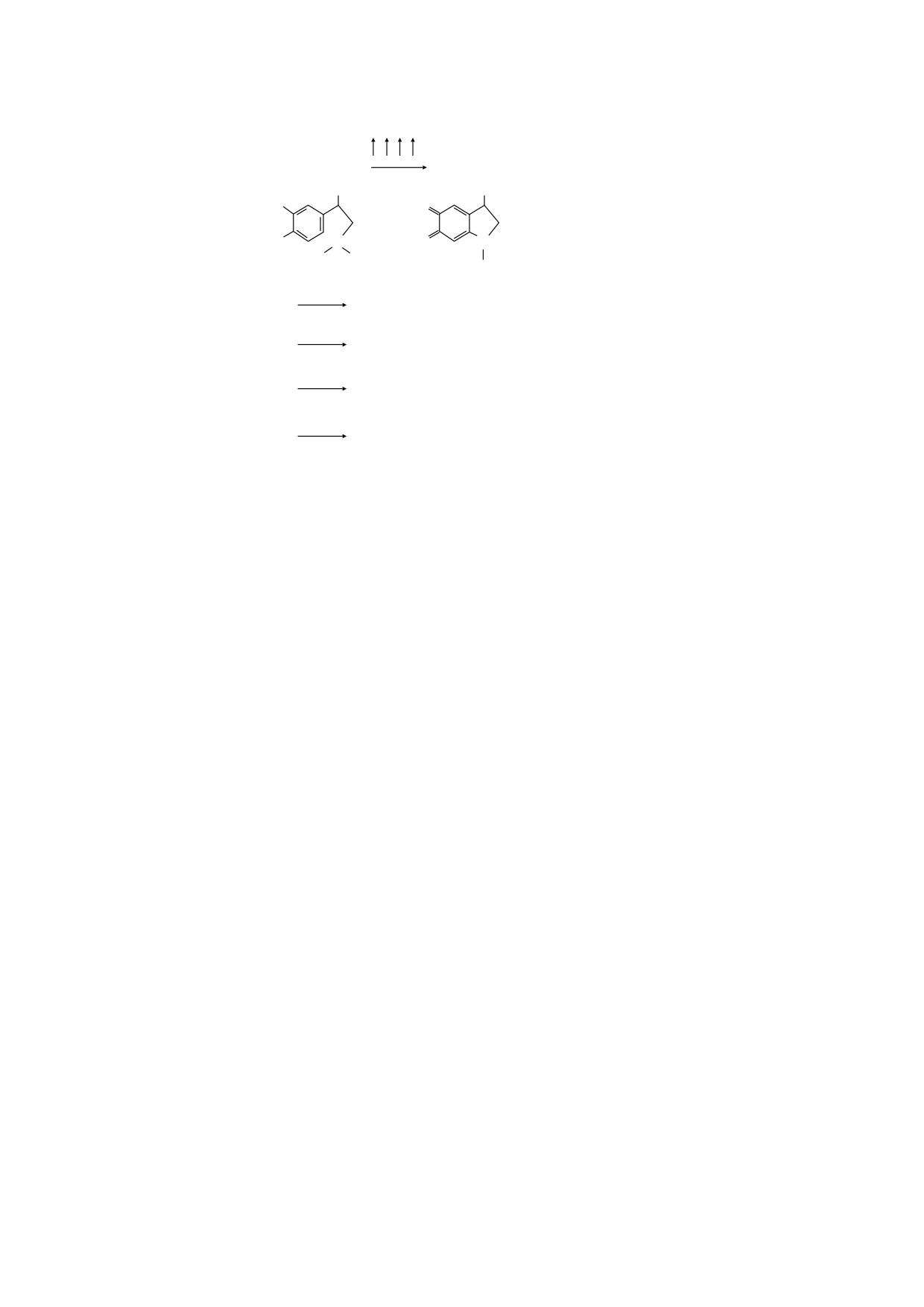
4e , 4 H+
Адреналин
Адренохром
OH
OH
HO
O
( )
1
HO
N
O
N
H
CH3
CH3
+
e
O2
O2
Супероксид
( )
2
+
e
СO2
СO2
Радикал диоксида углерода
(3a)
+H O22
HСO3
СO3
Радикал карбонат-аниона
(3б)
+HO
HСO3
СO3
Радикал карбонат-аниона
(3в)
Рис. 5. Схема, иллюстрирующая окисление адреналина в щелочной среде и связанные с ним процессы образования
различных радикалов. Объяснения в тексте. Этап 3б - цитировано по работе [48], этап 3в - цитировано по работе [50].
неконтролируемое цитоплазматическое накопле-
В своей работе мы использовали модельную
ние продукта хиноидного окисления дофамина
реакцию автоокисления катехоламина адренали-
вещества меланина (он же нейромеланин) в ка-
на как модель хиноидного окисления катехола-
техоламиноергических нейронах, происходит от-
мина для поиска соединений, способных тормо-
ложение белка альфа-синуклеина, Parkin-белков,
зить этот процесс [57]. В проведенном исследова-
нии была сделана переоценка применения
образование телец Леви, ингибирование протеа-
реакции автоокисления адреналина, и она ис-
сом, дисфункция митохондрий, а на ранних эта-
пользована не только как супероксидгенерирую-
пах заболевания - окислительный стресс и ней-
щая модель, но и как модель хиноидного окисле-
ровоспаление. Нейромеланину приписывают
ния катехоламина с целью поиска веществ нейро-
роль нейротоксина, его избыточное образование
протекторов.
и вызывает вышеназванные процессы. В работе
[18] детально представлена биохимия БП и хи-
Было показано, что вещества, содержащие
сульфгидрильную и, что особенно интересно и
мизм процесса хиноидного окисления дофамина,
важно и впервые показано в нашей работе, ди-
объясняющий один из возможных молекулярных
сульфидную группу, могут быть ингибиторами
механизмов развития этой болезни. В биохимию
хиноидного окисления. Установлено, что серосо-
БП вовлечены различные ферментативные си-
держащие соединения цистеин и восстановлен-
стемы - моноаминооксидаза, катехол-орто-ме-
ный глутатион, а также окисленный глутатион
тилтрансфераза, DT-диафораза и другие [18, 54-
ингибируют этот процесс. Они рассматриваются,
56]. И особое место принадлежит нефермента-
таким образом, как ингибиторы хиноидного
тивному хиноидному окислению дофамина, при
окисления и оцениваются как антиоксиданты.
нарушении метаболизма которого происходит
IC50 цистеина и восстановленного глутатиона
избыточное образование нейротоксина нейроме-
близки и составляют 7.5 мкМ. Ингибирование
ланина [18, 51-56]. Из аминохрома дофамина в
окисленным глутатионом слабее и составляет
результате его последующих химических превра-
приблизительно 50-70% относительно цистеина
щений возникает нейромеланин: аминохром →
и восстановленного глутатиона. Другие серосо-
5,6-дигидроксииндол → 5,6-индолхинон → после-
держащие соединения, отличающиеся химиче-
дующая полимеризация с образованием нейро-
ским строением,
- аминокислоты таурин и
меланина [18]. Процесс происходит в дофаминер-
метионин - были неэффективны. Сделано за-
гических нейронах, а также астроцитах и микро-
ключение, что биологически активные серосо-
глии в конкретных структурах мозга: s. nigra, locus
держащие соединения цистеин, а также восста-
ceruleus, nucleus dorsalis п. vagi. В норме этот про-
новленный и окисленный глутатион являются
цесс происходит в этих структурах мозга, однако
специфическими ингибиторами хиноидного
при БП характерно чрезмерное накопление ней-
окисления катехоламина и смогут, вероятно, вы-
ромеланина.
полнять роль нейропротекторов. Предлагается
БИОФИЗИКА том 65
№ 4
2020
652
СИРОТА
использовать эти вещества в лечении и профи-
катехоламина адреналина, который исследован в
лактике БП путем направленного воздействия на
нашей работе [58]. Условия проведения экспери-
систему синтеза этих соединений в организме.
ментов в каждом их этих исследований [58, 59] су-
Такой подход может быть одним из способов за-
щественно различаются, и тем ценнее получен-
щиты клетки от токсического действия продук-
ный результат: биологически важные ионы ме-
тов хиноидного окисления катехоламина и окис-
таллов постоянной валентности Са2+ и Mg2+
лительного стресса [57].
активируют процесс хиноидного окисления ис-
следованных катехоламинов - адреналина [58],
дофамина и пирокатехина [59].
ДЕЙСТВИЕ ИОНОВ МЕТАЛЛОВ Са2+ и Mg2+
Обнаруженное действие вышеназванных ка-
НА РЕАКЦИЮ АВТООКИСЛЕНИЯ
тионов может указывать на их участие в свобод-
АДРЕНАЛИНА
но-радикальных процессах, связанных с окисли-
Известно, что ионы металлов переменной ва-
тельно-восстановительными реакциями в клетке.
лентности (Fe, Mn, Cu, Mo и др.) являются непо-
Наше исследование на модельной реакции ав-
средственными участниками цепных и окисли-
тоокисления адреналина [58] и работа [59] с ис-
тельно-восстановительных каталитических реак-
пользованием непосредственно дофамина пока-
ций. Информация об участии в таких процессах
зали, что ионы металлов с постоянной валентно-
ионов металлов постоянной валентности, биоло-
стью активируют процесс хиноидного окисления
гически активных ионов Са2+ и Mg2+, не найде-
катехоламинов. Возвращаясь к теме БП: извест-
на. В нашей работе [58] было изучено действие
но, что ионы металлов переменной валентности
(марганец, железо) участвуют в патогенезе БП
ионов Са2+ и Mg2+ на свободно-радикальный
[18, 23, 51]. Вероятно, и ионы металлов постоян-
процесс автоокисления адреналина. Показано,
ной валентности Са2+ и Mg2+, которые, как пока-
что Са2+ и Mg2 ускоряли реакцию, причем более
зано, активируют процесс хиноидного окисления
эффективными были ионы кальция по сравне-
катехоламинов, также могут принимать участие в
нию с ионами магния. Активация процесса авто-
этих событиях, и скорее, именно ионы кальция,
окисления адреналина, наблюдаемая при 25-100
поскольку они непосредственно задействованы в
мкМ Са2+ или 100-200 мкМ Mg2+, проявлялась в
синаптической передаче. Свободно-радикальные
сокращении времени инициации цепной реак-
процессы, происходящие при окислении катехо-
ции (лаг-период реакции) и увеличении как ско-
ламинов и восстановлении аминохромов и со-
рости потребления кислорода, так и образования
провождающиеся образованием АФК, имеют ме-
продукта реакции окисления адреналина адрено-
сто при патогенезе многих заболеваний: как от-
хрома [58]. Хотя феномен действия ионов метал-
мечено выше - в случае БП, при различных
лов был обнаружен значительно раньше [29], объ-
формах шизофрении, кардиологических и онко-
яснить механизм их действия нам помогла работа
логических заболеваниях [7, 12, 16, 18, 23, 60, 61].
[59]. Используя методы спектроскопии, поляро-
Биологически активные ионы Са2+ и Mg2 могут,
графии и ЭПР, авторы установили механизм ак-
таким образом, модулировать действие катехола-
тивирующего действия «редокс-инертного каль-
мина в организме.
ция и других металлов II группы с постоянной ва-
лентностью на процесс хиноидного окисления
катехоламина дофамина и пирокатехина». Авто-
ИСПОЛЬЗОВАНИЕ РЕАКЦИИ
ры заключили, что ионы Са2+ активируют про-
АВТООКИСЛЕНИЯ АДРЕНАЛИНА
цесс автоокисления пирокатехина и дофамина за
КАК СУПЕРОКСИДГЕНЕРИРУЮЩЕЙ
счет дополнительного депротонирования при об-
И СУПЕРОКСИДДЕТЕКТИРУЮЩЕЙ
разовании комплексов с Са2+, что и ускоряет пе-
СИСТЕМЫ И КАК МОДЕЛИ ХИНОИДНОГО
ренос электронов на кислород, а также за счет об-
ОКИСЛЕНИЯ КАТЕХОЛАМИНОВ
разования комплексов Са2+ с семихиноном, про-
Наши предыдущие работы и материал
межуточным
продуктом
автоокисления
настоящего обзора, где описаны методические
катехоламина, продолжая таким образом процесс
возможности данной модельной системы, поды-
окисления [59]. Следовательно, причина иссле-
тоживают и определяют область практического ее
дуемого феномена - комплексообразование с
применения. Можно определять активность фер-
кальцием, приводящее к изменению кислотно-
мента СОД и антиоксидантную активность био-
основных свойств с ускорением переноса элек-
логических материалов - цитоплазматических
тронов на кислород и ростом концентрации
фракций гомогенатов тканей и биологических
орто-семихиноната кальция в реакции окисле-
жидкостей, в том числе гемолизата цельной кро-
ния [59]. Адреналин авторы этой работы не ис-
ви и гемолизата отмытых эритроцитов; также ан-
следовали. Очевидно, что такой механизм дей-
тиоксидантную/прооксидантную
активность
ствия имеет место и в процессе автоокисления
фармацевтических форм (настойки, экстракты и
БИОФИЗИКА том 65
№ 4
2020
ЦЕПНАЯ РЕАКЦИЯ АВТООКИСЛЕНИЯ АДРЕНАЛИНА
653
т. д.), растворов различных субстанций и веществ
вращений катехоламинов в этой реакции, сопря-
[27-29, 31-39, 62-64]. Особо необходимо отме-
женных также с образованием различных радика-
тить, что данная методика позволяет определять
лов, позволяет устанавливать механизм действия
антиоксидантную/прооксидантную активность
тестируемых материалов, а не только выявлять
гидрофобных соединений [34, 35], а именно жид-
феноменологию. Для уточнения механизма дей-
ких масел. Обнаруженное проксидантное свой-
ствия исследуемых субстанций также следует
ство амарантового масла проявилось, по нашим
привлекать и другие модельные системы.
данным, в его биологическом действии [34, 35].
Список изучаемых нами веществ из биохими-
Следует отметить, что данная модель, ранее
ческого/химического и фармацевтического арсе-
обозначенная только как супероксидгенериру-
нала как известных, так и новых, достаточно ин-
щая система, «раскрыла» и иные свои возможно-
тересен. Антиоксидантные свойства некоторых
сти: использована нами и как модель хиноидного
веществ подтверждаются [37], а некоторых, на-
окисления катехоламина, открывая большие пер-
пример таурина [57], ставятся под сомнение. Сле-
спективы ее применения для поиска нейропро-
дует отметить, что достаточно большое количе-
текторов (см. выше соответствующую главу и ра-
ство нами исследованных веществ были не эф-
боту [57]). Выявлена специфическая ингибирую-
фективны. Те же соединения, которые имеют
щая активность серосодержащих соединений
отношение к окислительно-восстановительным
(цистеина, восстановленного и окисленного глу-
процессам, были сильнейшими анти- или проок-
татиона): эти вещества тормозили именно хино-
сидантами, т.е. ингибировали или активировали
идный процесс окисления катехоламина и не
автоокисление адреналина (данные не опублико-
проявили своих антиоксидантных свойств в дру-
ваны). В настоящее время нами проводится скри-
гой супероксидгенерирующей системе in vitro -
нинг различных биологически активных соеди-
ксантин-ксантиноксидазе [57]. Известны важ-
нений. Подобные исследования in vitro не только
ность и значимость гомеостаза тиолов при болез-
выявляют
наличие
анти/прооксидантных
ни Паркинсона [51, 65-67], поэтому нами и были
свойств изучаемого препарата, но и определяют в
выбраны именно эти вещества для исследования
дальнейшем стратегию исследований in vivo.
в используемой модели. Лекарственные формы
Таким образом, полученные эксперименталь-
цистеина и глутатиона имеются на фармацевти-
ные данные и теоретические исследования этой
ческом рынке («Цистеин», «N-ацетил-L-цисте-
реакции расширяют представления о механизмах
ин» и «Цистин», а также «Глутатион» и «N-аце-
свободно-радикальных процессов, происходя-
тил-глутатион»), однако применение их неодно-
щих в организме. Разработанные нами подходы
значно: существует проблема их биодоступности
имеют и важное практическое значение, по-
и дороговизна, а прием перорально этих препара-
скольку дают возможность использовать реак-
тов - исключительно для микрофлоры желудоч-
цию автоокисления адреналина как супероксид-
но-кишечного тракта [68-72]. Перспективно, на
генерирующую и супероксиддетектирующую си-
наш взгляд, активировать внутриклеточный син-
стему и также как модель хиноидного окисления
тез этих соединений, которые могут предотвра-
катехоламинов, что позволяет выявлять потенци-
щать хиноидное окисление, и вести поиск путей
альные нейропротекторы.
воздействия на систему антиоксидантной защи-
Автор благодарит главного специалиста
ты в нейронах. Подобный подход (активации
Н.Е. Лямину за техническую помощь в проведе-
синтеза тиоловых соединений) был предложен
нии экспериментов и в подготовке публикаций.
ранее, но не был связан с БП [65]. Современные
знания дают возможность пытаться это делать
Работа в основном проводилась в рамках бюд-
жетного финансирования ИТЭБ РАН по теме 04,
на уровне генетических и молекулярно-клеточ-
ных действий, а именно, через активацию пути
направление 63.
Nrf2-ARE (ARE-редокс-чувствительная сигналь-
ная система), что может быть эффективным сред-
СПИСОК ЛИТЕРАТУРЫ
ством предотвращения гибели нейронов [73-76].
1. В. Меньшиков и T. Д. Большакова, в сб. Адреналин
Необходимо также отметить следующее: по-
и норадреналин (Наука, М., 1964), с. 284.
скольку установлено, что ионы кальция активи-
руют эту реакцию и механизм их действия выяс-
2. S. Baez, J. Segura-Aguilar, M. Widersten, et al., J. Bio-
нен [58, 59], следует учитывать возможность при-
chem. 324, 25 (1997).
сутствия Са2+ в тестируемых препаратах,
3. M. P. Rigobello, G. Scutari, R. Boscolo, and A. Bindo-
особенно растительных и других биологических
li, Nitric Oxide 5, 39 (2001).
образцах, что может приводить к сокрытию анти-
4. Y. Fu, L. Buryanovskyy, and Z. Zhang, J. Biol. Chem.
оксидантного эффекта собственно субстанции.
283, 23829 (2008).
Уникальность данной модели и в том, на наш
5. V. S. Fluxá, D. Wahler, and J. L Reymond, Nat. Protoc.
взгляд, что многостадийность химических пре-
3, 1270 (2008).
БИОФИЗИКА том 65
№ 4
2020
654
СИРОТА
6. C. Foppoli, R. Coccia., C. Cini, and M. A. Rosei, Bio-
35. O. P. Yelisyeyeva, K. O. Semen, G. V. Ostrovska, et al.,
chim. Biophys. Acta 1334, 200 (1997).
Food Chem. 147, 152 (2014).
7. A. Bindoli, M. P.Rigobello, and L. Galzigna, Toxicol.
36. Т. В. Сирота, Бюлл. эксперим. биол. мед. 149 (4),
Lett. 48, 3 (1989).
396 (2010).
8. F. Marques, R. O. Duarte, J. J. Moura, and M. P. Bi-
37. Т. В. Сирота, Н. Е. Лямина и Л. И. Вайсфельд,
cho, Biopl. Signals 5 (5), 275 (1996).
Биофизика 62 (5), 846 (2017).
9. A. Bindoli, M. P. Rigobello, and D. J. Deeble, Free
38. Т. В. Сирота, Биомед. химия 59 (4), 254 (2013).
Radic. Biol. Med. 13, 391 (1992).
39. Т. В. Сирота, Биомед. химия 62 (6), 650 (2016).
10. K. Polewski, Biochim. Biophys. Acta 1523, 56 (2000).
40. Т. В. Сирота, Биомед. химия 61 (1), 115 (2015).
11. Т. В. Сирота, Биомед. химия 58 (1), 77 (2012).
12. В. Г. Колпаков, Журн. невропатологии и
ty/SolvabilityOfSomeGases.
психиатрии им. С. С. Корсакова 74, 1254 (1974).
13. S. Baez, and J. Segura-Aguilar, Biochem. Mol. Med.,
56, 37 (1995).
ha_gazov.htm.
14. A. F. Rump, J. Schierholz, R. Rösen, et al., Arzneimit-
44. C. Karunakaran, H. Zhang, J. Joseph, et al., Chem.
telforschung 51, 964 (2001).
Res. Toxicol. 18 (3), 494 (2005).
15. V. M. Costa, R. Silva, L. M. Ferreira, et al., Chem. Res.
45. D. C. Ramirez, S. E. Gomez Mejiba, and R. P. Mason,
Toxicol. 20, 1183 (2007).
Free Radic Biol Med. 38, 201 (2005).
16. J. Smythies, A. De Iuliis, L. Zanatta, and L. Galzigna,
46. S. P. Goss, R. J. Singh, and B. Kalyanaraman, Biol.
Neurotox. Res. 4 (1), 77 (2002).
Chem. 274, 28233 (1999).
17. J. Smythies, Antioxid. Redox. Signal, 2 (3), 575 (2000).
47. D. B. Medinas, G. Cerchiaro, D. F. Trindade, and
18. P. Muñoz, S. Huenchuguala, I. Paris, and J. Segura-
O. Augusto, IUBMB Life 59, 255 (2007).
Aguilar, Parkinsons Dis. 2012, 920953 (2012). DOI:
48. M. G. Bonini, S. A. Gabel, K. Ranguelova, et al., J.
10.1155/2012/920953.
Biol. Chem. 284, 14618 (2009).
19. M. L. Genova, N. M. Abd-Elsalam, S. M. el-Mahdy,
et al., Arch. Biochem. Biophys. 447 (2), 167 (2006).
49. D. B. Medinas, J. C. Toledo, Jr., G. Cerchiaro, et al.,
Chem. Res. Toxicol. 22 (4), 639 (2009).
20. С. О. Тапбергенов, Вопр. мед. химии 28, 52 (1982).
50. В. Л. Воейков, Н. Д. Виленская, До Минь Ха и др.,
21. И. С. Северина, Н. В. Пятакова, А. Ю. Щеголев и
Журн. физ. химии 86, 1 (2012).
Т. А. Сидорова, Биомед. химия 54, 679 (2008).
51. Е. Е. Дубинина, в сб. Продукты метаболизма
22. А. М. Утевский и С. О. Тапбергенов, Укр. биохим.
кислорода в функциональной активности клеток
журн. 54, 307 (1982
(Санкт-Петербург, 2006), с. 111.
23. K. Jomova and M. Valko, Toxicology 283 (2-3), 65
52. C.C. Santos, F. M. Araújo, R. S. Ferreira, et al., Toxi-
(2011).
col. in Vitro
42,
54
(2017). DOI:
10.1016/
24. C. Beauchamp and I. Fridovich, Anal. Biochem. 44
j.tiv.2017.04.004
(1), 276 (1971).
53. J. Segura-Aguilarand, and S. Huenchuguala, Front
25. M. Nishikimi, N. A. Rao, and K. Yagi, Biochem. Bio-
Neurosci.
12,
106
(2018).
DOI:
10.3389/
phys. Res. Commun. 46 (2), 849 (1972).
fnins.2018.00106
26. H. P. Misra and I. Fridovich, J. Biol. Chem., 247, 3170
54. J. Segura-Aguilar, I. Paris, З. Muñoz, et al., Neuro-
(1972).
chem, 129 (6), 898 (2014). DOI: 10.1111/jnc.12686
27. Т. В. Сирота, Вопр. мед. химии 45, 263 (1999).
55. A. Herrera-Soto, G. Díaz-Veliz, S. Mora, et al., Neu-
28. Т. В. Сирота, Патент РФ на изобретение
rotox. Res. 32 (1), 134 (2017). DOI: 10.1007/s12640-
№ 2144674, Б.И. № 2 (2000).
017-9719-8
29. T. V. Sirota, N. V. Lange, N. I. Kosjakova, et al., Curr.
56. S. Huenchuguala, P. Muñoz, R. Graumann, et al.,
Topics Biophys. 24, 185 (2000).
Neurotoxicology 55, 10 (2016). DOI: 10.1016/j.neu-
30. S. Green, A. Mazur, and E. Shorr, J. Biol. Chem., 220,
ro.2016.04.014
237 (1956).
57. Т. В. Сирота, Биомед. химия 65 (4), 316 (2019).
31. Т. В. Сирота, А. И. Мирошников и К. Н. Новиков,
58. Т. В. Сирота, Биофизика 61 (1), 22, (2016).
Биофизика 55 (6), 990 (2010).
59. А. В. Лебедев, М. В. Иванова, А.А. Тимошин и
32. А. Б. Щербаков, В. К. Иванов, Т. В. Сирота и
Э. К. Рууге, Биомед. химия 54 (6), 687 (2008).
Ю. Д. Третьяков, Докл. РАН 437 (2), 197 (2011).
60. J. Smythies, Neurotox. Res. 4 (2), 147 (2002).
33. Т. В. Сирота, М. В. Захарченко и М. Н. Кондра-
шова, Биомед. химия 60 (1), 63 (2014).
61. G. S. Behonick, M. J. Novak, E. W. Nealley, and
S. L. Baskin, J. Appl. Toxicol. 21 (1) 15 (2001).
34. K. O. Semen, G. J. M. den Hartog, D. V. Kaminsky,
et al., Nat. Products Chem. Res. 2, 122 (2013). DOI:
62. T. V. Sirota, V. I. Novoselov, V. G. Safronova, et al.,
10.4172/2329-6836.1000122
IEEE Trans. Plasma Sci. 34 (4), 1351 (2006).
БИОФИЗИКА том 65
№ 4
2020
ЦЕПНАЯ РЕАКЦИЯ АВТООКИСЛЕНИЯ АДРЕНАЛИНА
655
63. А. И. Грицук, Т. В. Сирота, Л. В. Дравица и
70. D. S. Goldstein, Y. Jinsmaa, P. Sullivan, and Y Sharabi,
Е. А. Крэддок, Биомед. химия 52 (6), 601 (2006).
Neurochem. Res.
42
(11),
3289
(2017). DOI:
64. Т. В. Сирота, В. Г. Сафронова, А. Г. Амелина и др.,
10.1007/s11064-017-2371-0
Биофизика 53 (5), 886 (2008).
71. L. D. Coles, P. J. Tuite, G. Öz, and U. R. Mishra, J.
65. В. И. Кулинский и Л. С. Колесниченко, Успехи
Clin. Pharmacol.
58
(2),
158
(2018). DOI:
биол. химии 31, 157 (1990).
10.1002/jcph.1008
66. Н. К. Зенков, В. З. Ланкин и Е. Б. Меньщикова, в
сб. Окислительный стресс (Наука/Интерпе-
риодика, М., 2001), с. 154.
73. Y. Izumi, Yakugaku Zasshi 133 (9), 983 (2013).
67. Е. Б. Меньщикова, В. З. Ланкин, Н. К. Зенков
74. Н. К. Зенков, Е. Б. Меньщикова и В. О. Ткачев,
и др., в сб. Окислительный стресс. Прооксиданты и
Биохимия 78 (1), 27 (2013).
антиоксиданты («Слово», М., 2006), с. 394.
75. J. A. Lee, H. J. Son, J. W. Choi, et al., Neurochem. Int.
68. G. F. Rushworth and I. L. Megson, Pharmacol. Ther.
112, 96 (2018). DOI: 10.1016/j.neuint.2017.11.006.
141
(2),
150
(2014). DOI: 10.1016/ j.pharmthera.
2013.09.006
76. F. I. Tarazi, Z. T. Sahli, M. Wolny, and S. A. Mousa,
69. M. A. Martínez-Banaclocha, Med. Hypotheses 79 (1),
Pharmacol. Ther.
144
(2),
123
(2014). DOI:
8 (2012).
10.1016/j.pharmthera.2014.05.010.
A Chain Reaction of Adrenaline Autoxidation Is a Model
of Quinoid Oxidation of Catecholamines
T.V. Sirota
Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
ul. Institutskaya 3, Pushchino, Moscow Region, 142290 Russia
The focus of this review is on published data and our own studies of the non-trivial quinoid pathway for the
oxidation of adrenaline. Similarly, all catecholamines can be oxidized with the formation of the correspond-
ing aminochromes. This process is simulated in vitro in alkaline medium and is known as a chain reaction of
adrenaline autoxidation, the reaction products of which are adrenochrome and compounds in the radical
form such as superoxide anions (О− ●) and others. As a superoxide-generating model, this reaction was used
to determine the activity of superoxide dismutase. In our studies, some new approaches have been proposed
to determine the activity of the enzyme and reveal the anti/prooxidant properties of various compounds and
materials. This pathway of the conversion of one of catecholamines (dopamine) currently is described as “a
preclinical model of Parkinson's disease”. In this regard, we offered that the reaction of adrenaline autoxida-
tion can be used for a search for substances that are able to inhibit the process of quinoid oxidation, in other
words, to detect potential neuroprotectors. Experimental and theoretical studies of this reaction provide new
insights into understanding the mechanisms of free radical processes that occur in the body.
Keywords: catecholamines, aminochromes, аdrenaline, adrenochrome, superoxide, quinoid oxidation
БИОФИЗИКА том 65
№ 4
2020