БИОФИЗИКА, 2020, том 65, № 4, с. 664-669
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ОКИСЛИТЕЛЬНЫЕ ПОВРЕЖДЕНИЯ ДНК ПРИ ДЕЙСТВИИ
ПЕРЕМЕННОГО МАГНИТНОГО ПОЛЯ
© 2020 г. Е.Е. Текуцкая*, М.Г. Барышев*, Л.Р. Гусарук**, Г.П. Ильченко*
*Кубанский государственный университет, 350040, Краснодар, ул. Ставропольская, 149
**Кубанский государственный медицинский университет, 350000, Краснодар, ул. Седина, 4
Е-mail: tekytska@mail.ru
Поступила в редакцию 28.10.2019 г.
После доработки 06.04.2020 г.
Принята к публикации 06.04.2020 г.
С помощью иммуноферментного анализа определено содержание повреждений азотистых основа-
ний 8-гидрокси-2-деоксигуанозина в ДНК крови здоровых доноров и больных буллезным эпидер-
молизом после воздействия переменным магнитным полем напряженностью 550 ± 30 А/м в диапа-
зоне частот от 3 до 60 Гц in vitro. Степень окислительного повреждения ДНК при буллезном эпидер-
молизе почти в два раза выше по сравнению со здоровыми донорами. Показано, что после
обработки магнитным полем наблюдается достоверное повышение уровней содержания 8-оксогу-
анина в ДНК для обеих групп, сложным образом зависящее от частоты. Полученный эффект объ-
ясняется генерацией активных форм кислорода при воздействии магнитного поля и нарушением
процессов репарации ДНК.
Ключевые слова: окислительное повреждение ДНК, 8-оксогуанин, низкочастотное электромагнитное
поле, активные формы кислорода, флуоресцентная спектроскопия.
DOI: 10.31857/S0006302920040055
напрямую, эти поля могут воздействовать опо-
Переменные магнитные поля (МП) низкой
средованно, изменяя концентрацию или актив-
частоты занимают особое место в медицинских
ность некоторых кинетически значимых молекул
исследованиях особенно в области лечения рака и
в водном растворе, в частности перекиси водоро-
обезболивании [1-4]. Сообщается, что сочетание
да, как это теоретически было показано в работе
МП с химиотерапевтическими препаратами дает
[9].
многообещающие результаты [4]. Предполагает-
ся, что под действием электромагнитного поля
Наиболее часто образующимся продуктом мо-
может изменяться скорость диффузии через био-
дификации азотистых оснований и одним из
логические мембраны, ориентация и конформа-
ключевых биомаркеров окислительных повре-
ция биологических макромолекул, а также состо-
ждений нуклеиновых кислот, опосредованных с
яние свободных радикалов [1, 5].
генерацией активных форм кислорода, является
Известными проявлениями стресс-реакции в
образование
8-гидрокси-2-деоксигуанозина
клетках являются повреждения биологически
(8-ОНdG) в ДНК [10, 11]. Появление в генетиче-
значимых молекул и, прежде всего, ДНК. Опре-
ском материале клетки 8-оксогуанина (8-oxoG)
деленные клеточные процессы, и среди них гене-
приводит к дестабилизации генома, повышение
рация активных форм кислорода (АФК), многи-
уровней содержания 8-ОНdG и его аналогов
ми авторами считаются ответственными за влия-
8-гидроксигуанозина и 8-гидроксигуанина свя-
ние на структуру ДНК [5-8]. Образование АФК
зывают с мутагенезом, старением и воспалением
приводит к повреждению первичной структуры
[12].
ДНК и накоплению однонитевых разрывов при
Буллезный эпидермолиз (БЭ) - это клиниче-
воздействии на лимфоциты периферической
ски и генетически гетерогенная группа орфанных
крови человека электромагнитного поля [7]. МП
заболеваний, характеризующихся врожденной
низкой частоты не вызывают тепловые эффекты
склонностью к образованию булл (пузырей) на
коже и слизистых оболочках пищевода, кишеч-
Сокращения: МП - магнитные поля, АФК - активные
ника, дыхательной системы. Эрозивно-язвенные
формы кислорода, 8-ОНdG - 8-гидрокси-2-деоксигуано-
зин, 8-oxoG - 8-оксогуанин, БЭ - буллезный эпидер-
дефекты могут сохраняться на коже от одного ме-
молиз.
сяца до нескольких лет, являясь предрасполагаю-
664
ОКИСЛИТЕЛЬНЫЕ ПОВРЕЖДЕНИЯ ДНК
665
щим фактором к образованию плоскоклеточного
туру контролировали с помощью датчика темпе-
рака кожи - основной причины преждевремен-
ратуры с точностью до 0.2°С, она составляла
ной смерти больных [13]. Заболевание обусловле-
22°С. Задавали начальную частоту МП и соответ-
но 1500 мутациями более чем в восемнадцати раз-
ствующую напряженность и проводили обработ-
личных генах структурных белков дермо-эпидер-
ку образца в течение 30 мин. Затем регистрирова-
мального соединения (KRT5 и KRT14, LAMB3,
ли интенсивность флуоресценции раствора ДНК
LAMA3, LAMC2, COL17A1 и др.).
при соответствующей длине волны возбуждения,
а для образцов крови измеряли содержание
Вопросы, связанные с возможностью инициа-
8-ОНdG. Далее микроконтроллер изменял часто-
ции окислительного стресса низкоинтенсивны-
ту МП с шагом в 0.2 Гц.
ми факторами, такими как низкочастотное МП, а
также с вкладом МП в поддержание уже развив-
Степень окислительных повреждений ДНК.
шегося окислительного стресса, остаются мало-
Степень повреждений ДНК оценивали по уров-
изученными.
ням концентрации 8-оксогуанина (8-oxoG) в сы-
Цель работы заключалась в оценке степени
воротке крови, полученным в выборке из шести
окислительных повреждений ДНК перифериче-
больных БЭ и такого же количества здоровых до-
ской крови здоровых доноров и больных буллез-
норов (мужчины 20-25 лет, некурящие). Сведе-
ным эпидермолизом после воздействия перемен-
ния о больных БЭ в регионах Краснодарского
ным МП в диапазоне частот от 3 до 60 Гц in vitro
края, их возрасте и типе заболевания были полу-
путем определения уровня содержания 8-ОНdG в
чены по данным информационного центра Де-
ДНК с использованием иммуноферментного
партамента здравоохранения Краснодарского
анализа.
края.
Взятие крови проводили в пластиковые про-
бирки объемом 2.5 мл с добавлением в качестве
МАТЕРИАЛЫ И МЕТОДЫ
антикоагулянта динатриевой соли этиленди-
Объектами исследований были образцы пери-
аминтетрацетата в конечной концентрации
ферической крови, собранные у добровольцев и
2.0 мг/мл. Определение проводили методом им-
больных БЭ, а также водные растворы ДНК.
муноферментного анализа с использованием мо-
Выделение ДНК из крови человека. Выделение
ноклональных антител к 8-oxoG. Использовали
ДНК проводили с помощью реактивов готовых
готовый набор DNA Damage ELISA Kit, опреде-
ление осуществляли согласно протоколу. После
коммерческих наборов
«ДНК-сорб-В» («Ам-
внесения стоп-растворов измеряли оптическую
плиСенс», ЦНИИ эпидемиологии МЗ РФ,
Москва) сорбционным способом по методике,
плотность образцов при длине волны 450 нм на
подробно описанной в работе [14]. Концентра-
микропланшетном ридере Multiskan (Thermo
цию ДНК в конечном растворе определяли спек-
Fisher Scientific, США). В каждом опыте проводи-
ли измерение не менее трех раз, определяли сред-
трофотометрически, используя коэффициент
нее значение. Количественную оценку содержа-
экстинкции Е260нм = 200.
ния 8-oxoG в ДНК проводили с использованием
Обработка проб магнитным полем. В ходе экс-
предварительно построенной калибровочной
периментов использовали разработанное нами
кривой, которая была линейной в диапазоне кон-
устройство для автоматизированного исследова-
центраций 8-oxoG 0.94-60 нг/мл. Чувствитель-
ния биологических жидкостей в переменном МП
ность метода Stress Xpress DNA Damage ELISA со-
[15]. Обработку растворов ДНК и образцов крови
ставила 0.59 нг/мл.
МП низкой частоты проводили в химически чи-
Флуоресцентные исследования проводили на
стой стерильной пластиковой посуде при толщи-
спектрофлуориметре F-2700 (Hitachi, Япония).
не слоя 2 мм. Образец помещали в центр солено-
ида, где МП с достаточной точностью можно счи-
Результаты обрабатывали статистически (про-
тать однородным, поскольку размеры соленоида
граммное обеспечение StatPlus, AnalystSoft
много больше размеров образца. Эффективное
Inc., США). Достоверность различий между вы-
значение напряженности МП в месте нахожде-
борками оценивали, используя непараметриче-
ния образца составляло 550 ± 30 А/м. Измерение
ский U-критерий Манна-Уитни.
напряженности МП проводили с помощью при-
бора «Экофизика-110А» (ООО «ПКФ Цифровые
РЕЗУЛЬТАТЫ
приборы», Москва) с цифровым измерительным
преобразователем для измерения переменных
Водные растворы ДНК, выделенной из крови
электрических и магнитных полей П3-80-ЕН500
здоровых доноров, обрабатывали магнитным по-
(ГК «Новые технологии», Москва).
лем в диапазоне частот от 3 до 60 Гц при напря-
В модуль для измерения физических характе-
женности 550 ± 30 А/м. На рис. 1 приведены
ристик биологических жидкостей помещали вод-
спектры флуоресценции растворов ДНК с кон-
ный раствор ДНК или образцы крови. Темпера-
центрацией 0.25 мкг/мл и длиной волны возбуж-
БИОФИЗИКА том 65
№ 4
2020
666
ТЕКУЦКАЯ и др.
18
16
11
14
12
10
2
8
1
3
6
7
10
4,8,9
6
4
5
2
0350
450
550
650
750
, нм
Рис. 1. Спектры флуоресценции водного раствора ДНК, выделенной из крови здорового донора, после обработки МП
разной частоты, Гц: 1 - 3 Гц, 2 - 5 Гц, 3 - 10 Гц, 4 - 15 Гц, 5 - 20 Гц, 6 - 25 Гц, 7 - 30 Гц, 8 - 35 Гц, 9 - 40 Гц, 10 -
45 Гц, 11 - 50 Гц. Длина волны возбуждения λвозб = 320 нм, время облучения образцов - 30 мин, СДНК = 0.25 мкг/мл,
t = 22°C.
дения 320 нм, полученные после обработки рас-
ным, приведенным на рис. 2. Уровни концентра-
творов МП. Наблюдаемые на спектрах максиму-
ции 8-oxoG в ДНК сыворотки крови здоровых
мы интенсивности в районе от 350 до 450 нм
лиц (контрольная группа) и больных БЭ до и по-
связаны с флуоресценцией основных хромофо-
сле обработки ЭПМ частотами 3, 30 и 50 Гц пред-
ров нуклеиновых кислот - сопряженных π-свя-
ставлены на рис. 3. В контрольной группе этот па-
зей пуриновых и пиримидиновых оснований
раметр варьируется от 4 до 11 нг/мл, в среднем со-
нуклеотидов. Как видно из рис. 1, интенсивность
ставляя 7.70 ± 1.41 нг/мл. В группе больных БЭ
флуоресценции значительно изменялась в райо-
уровень содержания 8-oxoG в ДНК изменяется от
не второго пика при длине волны 642 ± 2 нм для
10 до 22 нг/мл и в среднем достигает 14.8 ±
всех изучаемых концентраций ДНК в растворе.
2.12 нг/мл. Это свидетельствует о том, что степень
Это, по-видимому, связано с изменением содер-
окислительного повреждения ДНК при БЭ почти
жания АФК в растворе, преимущественно с обра-
в два раза выше по сравнению с контрольной
зованием синглетного кислорода, поскольку, как
группой. После обработки образцов МП наблю-
известно, молекулы синглетного кислорода могут
дается достоверное повышение уровней содержа-
ния 8-oxoG в ДНК сыворотки крови для обеих
образовывать возбужденные эксимеры
(1O2)2,
групп (рис. 3).
которые переходят в основное состояние с испус-
канием фотона в видимом диапазоне в районе
635-645 нм [7, 16].
ОБСУЖДЕНИЕ
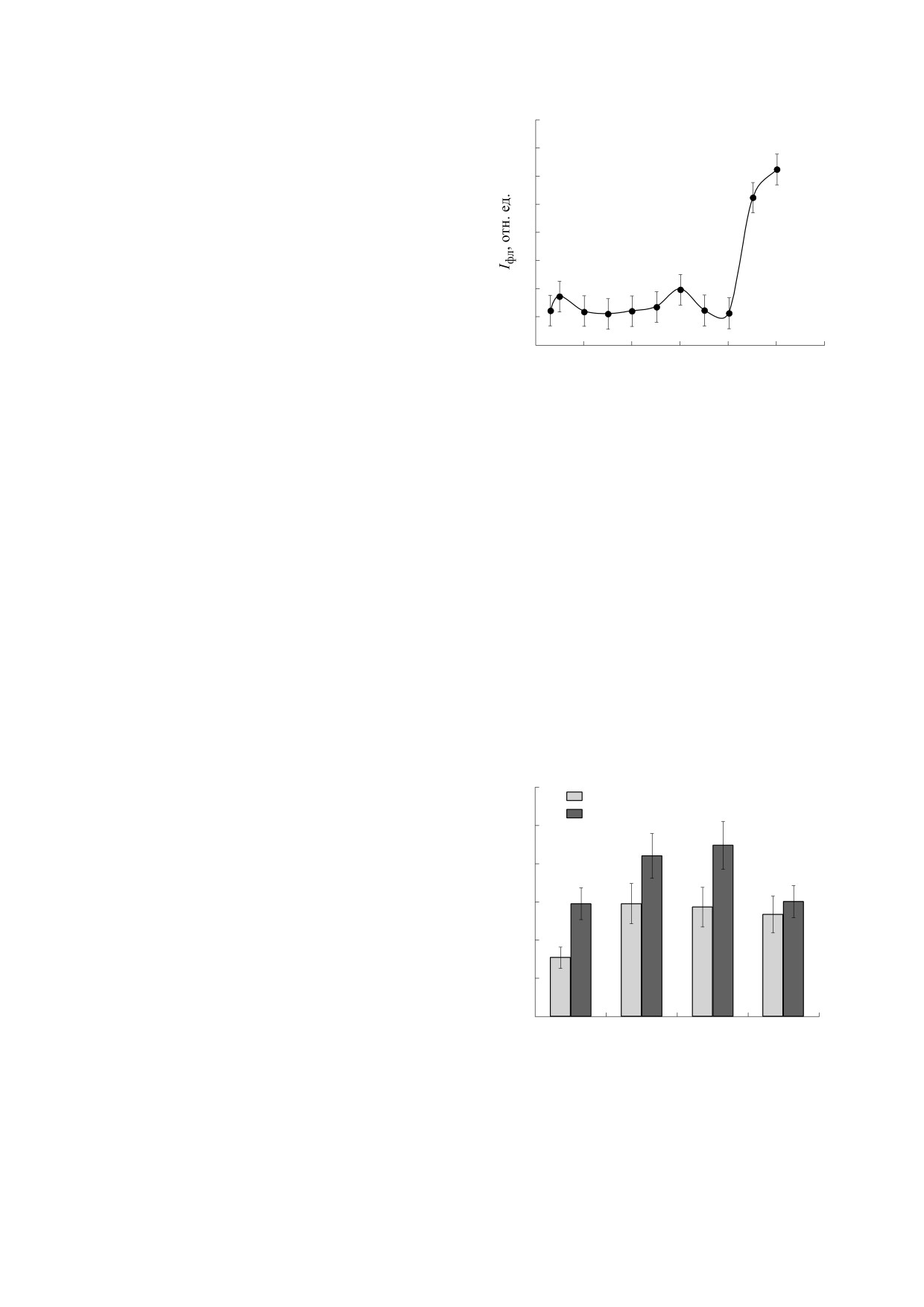
На рис. 2 приведена усредненная зависимость
Обнаруженное двукратное увеличение содер-
интенсивностей флуоресценции в диапазоне вто-
жания 8-oxoG в ДНК сыворотки крови больных
рого пика водных растворов ДНК, выделенных из
БЭ могло привести к структурным изменениям
крови здоровых доноров, от частоты МП. Изме-
спирали ДНК, представляющей из себя практи-
нение концентрации ДНК в растворе в целом не
чески жесткие кольца оснований с несколькими
сказывалось на вид полученной зависимости.
протон-донорными и протон-акцепторными
Интенсивности флуоресценции растворов ДНК
центрами и конформационно лабильный сахаро-
при λmax = 642 нм были максимальны после обра-
фосфатный остов со множеством степеней свобо-
ботки растворов МП с частотами 3, 30 и 50 Гц
ды [17, 18]. При повышении содержания 8-oxoG в
(рис. 2).
ДНК возможно изменение конформации ДНК за
Образцы периферической крови доноров об-
счет изменения торсионных углов сахаро-фос-
рабатывали МП с частотами 3, 30 и 50 Гц.
фатного остова из-за увеличения массы окислен-
При этих частотах наблюдалось наибольшее об-
ных азотистых оснований [19] или нарушения
разование АФК в растворах ДНК, согласно дан-
стэкинга азотистых оснований [20]. Это может
БИОФИЗИКА том 65
№ 4
2020
ОКИСЛИТЕЛЬНЫЕ ПОВРЕЖДЕНИЯ ДНК
667
оказывать определенное влияние на изменение
16
активности соответствующих генов в промотор-
14
ных участках ДНК больных БЭ [13].
12
Изменение количества 8-oxoG в ДНК крови
как здоровых доноров, так и больных БЭ при воз-
10
действии низкочастотного МП не может быть
вызвано депуринизацией модифицированных
8
оснований, поскольку данная модификация при-
6
водит не к ослаблению, а к повышению устойчи-
вости гликозидной связи. Известно, что гуанин в
4
ДНК имеет самый низкий окислительно-восста-
2
новительный потенциал среди природных осно-
ваний [17] и в большей степени подвержен окис-
лению. Как донор электронов, он способен отда-
00
10
20
30
40
50
60
вать свой электрон различным акцепторам,
Частота, Гц
образуя гуанин-радикал-катион, который затем
мигрирует вдоль цепи ДНК по гуанинам прыжко-
Рис. 2. Усредненная зависимость интенсивности
вым способом, пока не происходит его окисление
флуоресценции при λmax = 642 нм растворов ДНК,
выделенной из крови здоровых доноров, после обра-
с образованием 8-oxoG [21]. Возможно, что под
ботки МП от частоты магнитного поля (n = 5, р = 0.95,
действием МП с частотами 3, 30 и 50 Гц происхо-
t0,95 = 2.78), СДНК = 2.5 мкг/мл, t = 22°C.
дит и дальнейшее окисление 8-oxoG до таких
продуктов, как оксазолон, гуанидиногидантоин.
форма которого дисмутирует с образованием
Увеличение уровня окисленных модификаций
наиболее долгоживущей АФК - перекиси водо-
азотистых оснований 8-oxoG в ДНК сыворотки
рода. Процессы образования АФК в водной среде
крови здоровых доноров после обработки МП и
происходят по типу химического осциллятора
еще более существенное увеличение для уже из-
[10, 20] и постепенно затухают, если не поддержи-
мененной ДНК больных БЭ (рис. 3), по-видимо-
ваются внешней энергией низкоинтенсивных
му, связано с генерацией АФК при воздействии
факторов, к которым можно отнести низкоча-
низкочастотного МП [5, 7, 20]. Установлено, что
стотное МП. Процессы такого характера крайне
первичной мишенью при воздействии таких низ-
чувствительны к слабым резонансным воздей-
коинтенсивных физических факторов, как тепло,
ствиям [16].
видимый свет и лазерное излучение (632.8 нм),
является растворенный в водной фазе кислород
Несмотря на то что энергия низкочастотного
[9, 16]. Как отмечают авторы, начальным этапом
МП чересчур мала для какого-нибудь значитель-
для этого процесса является переход кислорода
из триплетного в синглетное состояние. Этот пе-
реход осуществляется под воздейcтвием квантов
С, нг/мл
света с длинами волн, cоответcтвующими по-
30
Здоровые доноры
лоcам поглощения молекуляpного киcлоpода. В
БЭ
работах [22, 23] было показано, что образование
25
синглетного кислорода (1O2) может быть надеж-
но обнаружено при прямом лазерном возбужде-
20
нии кислорода в насыщенных воздухом растворах
с помощью оксигенации ловушек синглетного
15
кислорода. Молярные коэффициенты поглоще-
ния молекулярного кислорода, растворенного
10
при нормальных условиях в воде, составляют при
765 нм 1.2 ⋅ 10-3 М-1 см-1 [23]. По оценке, прове-
5
денной в работе [24], время жизни синглетного
кислорода в биологических системах невелико -
0
от 0.2 для цитоплазмы до 1 мкс для плазмы крови
До
3
30
50
и 0.05 мкс для мембраны эритроцитов, коэффи-
обработки
Частота, Гц
циент диффузии находится в пределах от 4 ⋅ 10-6
до 7 ⋅ 10-7 см2 с-1. Даже этого короткого времени
Рис. 3. Содержание 8-oxoG в сыворотке крови здоро-
вых доноров (контроль) и больных буллезным эпи-
достаточно для запуска дальнейших процессов -
дермолизом (БЭ), после обработки переменным маг-
восстановления синглетного кислорода до су-
нитным полем с частотами 3, 30 и 50 Гц (Uэмп = 1.5,
пероксидного анион-радикала, протонированная
Uкр = 3 при p < 0.01; Uкр = 7 при p < 0.05). .
БИОФИЗИКА том 65
№ 4
2020
668
ТЕКУЦКАЯ и др.
ного повреждения ДНК, ее может быть достаточ-
Таким образом, появление и накопление
но для перехода растворенного кислорода из три-
окислительных повреждений 8-ОНdG в ДНК по-
плетного в синглетное состояние и дальнейшей
сле обработки крови здоровых доноров и больных
генерации каскада АФК. В хромосомах ДНК-свя-
БЭ МП может свидетельствовать, с одной сторо-
зывающие белки защищают ее от окислительных
ны, о генерации АФК при воздействии низкоча-
повреждений, что связано как с компактной упа-
стотного МП, а с другой - об участии АФК в по-
ковкой молекулы ДНК, так и с взаимодействием
вреждении ДНК.
белковых молекул с образующимися АФК. Одна-
ко установлено [21], что долгоживущие белковые
ВЫВОДЫ
радикалы являются источниками продолжитель-
ного образования АФК, посредниками окисли-
Повышение уровня концентрация 8-oxoG в
тельного стресса в биологических системах и спо-
ДНК почти в два раза в выборке больных БЭ сви-
собны к переносу радикальных повреждений на
детельствует о нарушении структуры молекулы
ДНК. Так, гидропероксиды гистона Н1 индуци-
ДНК и о значительных окислительных поврежде-
руют образование 8-оксогуанина в ДНК [21]. Та-
ниях в ней при данной патологии. Генерация ак-
ким образом, все образующиеся при воздействии
тивных форм кислорода при воздействии пере-
на растворы ДНК и образцы крови переменным
менным магнитным полем на образцы
магнитным полем АФК и белковые радикалы мо-
крови in vitro приводит к накоплению содержа-
гут атаковать молекулу ДНК, тем самым приводя
ния 8-oxoG в ДНК и дальнейшему нарушению
к окислительным повреждениям азотистых осно-
процессов репарации ДНК, тем самым оказывая
ваний и накоплению 8-oxoG в ДНК. Это согласу-
существенное влияние на функциональные мета-
ется с результатами, полученными в эксперимен-
болические свойства биосистем в целом. Полу-
тальной работе [25], в которой на суспензии ней-
ченный эффект объясняется генерацией актив-
трофилов мышей была показана зависимость
ных форм кислорода при воздействии МП и на-
величины эффекта МП (изменение внутрикле-
рушением процессов репарации ДНК.
точной продукции АФК) от концентрации моле-
кулярного кислорода.
КОНФЛИКТ ИНТЕРЕСОВ
В работе [26] показано, что воздействие низко-
частотного МП вызывает намагниченность сре-
Авторы заявляют об отсутствии конфликта
ды, в которой протекают химические реакции. В
интересов.
частности, рассмотрена реакция взаимодействия
молекулярного кислорода с произвольным ради-
калом с образованием перекисного радикала. На-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
личие ядерной поляризации снимает вырожде-
Лабораторные диагностические обследования
ние между квартетным и дуплетным состояниями
были выполнены в соответствии с обязательным
реакционного центра. При этом МП увеличивает
соблюдением этических норм, изложенных в
выход перекисного радикала, поскольку продукт
Хельсинкской декларации 1975 г. с дополнения-
реакции образуется из дуплетного состояния.
ми 1983 г.
В организме выработана многоуровневая си-
стема защиты и репарации повреждений, возни-
кающих при действии АФК на ДНК. Повышен-
СПИСОК ЛИТЕРАТУРЫ
ное содержание 8-oxoG в ДНК сыворотки крови
1. F. I. Wolf, A. Torsello, B. Tedesco, et al., Biochim. Bio-
больных БЭ может служить биологическим мар-
phys. Acta 1743, 120 (2005).
кером физиологического неблагополучия орга-
2. C. A. Buckner, A. L. Buckner, S. A. Koren, et al., PLoS
низма. Очевидно, что для восстановления повре-
One 10 (4): e0124136 (2015). DOI: 10.1371/journal.
ждений ДНК, вызванных действием АФК, требу-
pone.0124136
ются не только ферменты антиоксидантной
защиты, но и ферменты эксцизионной репара-
3. T. Wang, Y. Nie, S. Zhao, et al., Bioelectromagnetics
ции. По-видимому, их функционирование при
32 (6), 443 (2011).
БЭ резко снижено, что не позволяет обеспечить
4. F. Sanie-Jahromi and M. Saadat, Mol. Biol. Reports
восстановление структуры ДНК. С другой сторо-
45, 807 (2018). DOI: 10.1007/s11033-018-4223-7
ны, накопление 8-oxoG в ДНК, возникающее при
5. I. Vijayalaxmi and T. J. Prihoda, Int. J. Radiat. Biol. 85,
воздействии низкочастотного МП, может приво-
196 (2009). DOI: 10.1080/09553000902748575
дить к появлению новых мутаций, в том числе и
таких, которые в целом ослабляют процессы ре-
6. R. J. Buldak, R. Polanniak, I. Buldak, et al., Bioelec-
паративной регенерации. Тем самым воздействие
tromagnetics 33, 641 (2012).
низкочастотного МП поддерживает и усиливает
7. Е. Е. Текуцкая, М. Г. Барышев и Г. П. Ильченко,
уже развившийся окислительный стресс у боль-
Авиакосмич. экологич. медицина 52 (1), 56 (2018).
ных БЭ.
DOI: 10.21687/0233-528X-2018-52-1-56-61
БИОФИЗИКА том 65
№ 4
2020
ОКИСЛИТЕЛЬНЫЕ ПОВРЕЖДЕНИЯ ДНК
669
8. A. K. Dharmadhikari, H. Bharambe, J. A. Dharma-
16. С. В. Гудков, О. Э. Карп, С. А. Гармаш и др.,
dhikari, et al., Phys. Rev. Lett. 112, 138105 (2014).
Биофизика 57 (1), 5 (2012).
9. В. О. Пономарев, В. В. Новиков, А. В. Карнаухов и
17. Л. Страйер, Биохимия (Москва: Мир. 1985), т. 3.
О. А. Пономарев, Биофизика 53 (2), 197 (2008).
18. В. И. Полтев, В. М. Анисимов, К. Санчес, и др.,
10. С. В. Смирнова, С. В. Гудков и В. И. Брусков, 8-
Биофизика 61 (2), 259 (2016).
оксогуанин и продукты его окисления. Образование в
19. M. D. Frank-Kamenetskii, A. V. Lukashin, and
ДНК под действием тепла, ионов уранила и гамма-
V. V. Anshelevich, J. Biomol. Struct. Dynam. 2, 1005
излучения (Lambert Acad. Publ., Saarbrucken, 2011).
(1985).
11. М. В. Лукина, А. А. Кузнецова, Н. А. Кузнецов и
20. P. Yakovchuk, E. Protozanova, and M. D. Frank-
О. С. Федорова, Биоорган. химия 43 (1), 4 (2017)
Kamenetskii, Nucl. Acids Res. 34 (2), 564 (2006).
DOI: 10.7868/S0132342317010055
DOI: 10.1093/nar/gkj454
12. X. Ba, L. Aguilera-Aguirre, Q. T. Rashid, et al., Int. J.
21. И. Н. Штаркман, С. В. Гудков, А. В. Черников и
Mol. Sci. 15, 16975 (2014).
В. И. Брусков, Биофизика 73 (4), 576 (2008).
DOI: 10.3390/ijms150916975
22. A. A. Krasnovsky and J. B. Kozlov, J. Biomed. Photon-
13. А. А. Кубанов, А. Э. Карамова, В. И. Альбанова
ics 3 (1), 1 (2017).
и др., Вестн. дерматологии и венерологии 4, 28
23. A. A. Krasnovsky, N. N. Drozdova, A. V. Ivanov, et al.,
(2017). DOI: 10.25208/0042-4609-2017-0-4-22-27
Biochemistry 68, 963 (2003).
14. E. E. Tekutskaya, M. G. Barishev, and G. P. Ilchenko,
24. А. А. Krasnovsky, Membrane Cell Biol. 15, 530 (1998).
Biophysics
60
(6),
913
(2015).
DOI:
10.1134/S000635091506024X
25. В. В. Новиков, Е. В. Яблокова и Е. Е. Фесенко,
Биофизика 63 (2), 277 (2018).
15. G. P. Il’chenko, M. G. Baryshev, E. E. Tekutskaya,
et al., Measur. Techniques 60 (6), 632 (2017). DOI:
26. В. О. Пономарев и В. В. Новиков, Биофизика 54
10.1007/s11018-017-1247-7
(2), 235 (2009).
Oxidative Damage to DNA under the Influence of an Alternating Magnetic Field
E.E. Tekutskaya*, M.G. Baryshev*, L.R. Gusaruk**, and G.P. Ilchenko*
*Kuban State University, ul. Stavropolskaya 149, Krasnodar, 350040 Russia
**Kuban State Medical University, ul. Sedina, 4, Krasnodar, 350000 Russia
An enzyme-linked immunosorbent assay was used to determine the content of nitrogenous bases, 8-hydroxy-
2'-deoxyguanosine, the form of oxidative damage, in DNA from blood of healthy donors and patients with
epidermolysis bullosa after exposure to an alternating magnetic field of strength 550 ± 30 A/m in the frequen-
cy ranging from 3 to 60 Hz in vitro. The degree of oxidative damage to DNA during epidermolysis bullosa is
almost two times higher as compared to that in healthy donors. It was shown that after exposure to a magnetic
field, a significant increase in the level of 8-oxoguanine in DNA was observed in all groups. This increase de-
pended on the frequency in a complex manner. The resulting effect is explained by the generation of reactive
oxygen species under the influence of a magnetic field and DNA repair defects.
Keywords: oxidative damage to DNA, 8-oxoguanine, low-frequency electromagnetic field, reactive oxygen species,
fluorescence spectroscopy
БИОФИЗИКА том 65
№ 4
2020