БИОФИЗИКА, 2020, том 65, № 4, с. 680-690
БИОФИЗИКА КЛЕТКИ
УДК 577.115.08
ИЗОХИНОЛИЗИНОВЫЕ ПРОИЗВОДНЫЕ КУМАРИНА
В КАЧЕСТВЕ АКТИВАТОРОВ ХЕМИЛЮМИНЕСЦЕНЦИИ
В РЕАКЦИЯХ ЛИПИДНОЙ ПЕРОКСИДАЦИИ
© 2020 г. Л.А. Ромодин*, Ю.А. Владимиров**, ***, ****, *****, С.В. Шангин*,
Г.К. Владимиров**, *****, Н.П. Лысенко*, Е.И. Демихов******
*Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина,
109472, Москва, ул. Академика Скрябина, 23
E-mail: rla2904@mail.ru
**Институт регенеративной медицины Первого Московского государственного медицинского университета имени
И.М. Сеченова МЗ РФ, 119991, Москва, ул. Трубецкая, 8/2
***Московский государственный университет имени М.В. Ломоносова, 119991, Москва, Ленинские горы, 1
****Российский национальный исследовательский медицинский университет им. Н.И. Пирогова МЗ РФ,
117997, Москва, ул. Островитянова, 1
*****Институт кристаллографии им. А.В. Шубникова Федерального научно-исследовательского центра
«Кристаллография и фотоника» РАН, 119333, Москва, Ленинский просп., 59
******Физический институт имени П.Н. Лебедева РАН. 119991, Москва, Ленинский просп., 53
Поступила в редакцию 16.03.2020 г.
После доработки 23.03.2020 г.
Принята к публикации 24.03.2020 г.
Изучено участие изохинолизиновых производных кумарина в пероксидазной реакции, катализиру-
емой комплексом цитохрома c с кардиолипином. Исследованы производные кумарина, известные
как C-314 (coumarin-314), C-334 (coumarin-334) и C-525 (coumarin-525) и считающиеся специфиче-
скими физическими активаторами хемилюминесценции, сопровождающей реакции липидной пе-
роксидации. Спектрофотометрически исследовано действие метанола на структуру цитохрома c,
изучены оптические свойства указанных веществ в среде фосфатного буфера. Также проведено
спектрофотометрическое исследование с параллельной регистрацией хемилюминесценции смеси,
в которой протекает липопероксидазная реакция, катализируемая комплексом цитохрома c с кар-
диолипином в присутствии изохинолизиновых производных кумарина. Установлена обратимость
действия метанола на структуру цитохрома c, что доказывает возможность использования данного
спирта при исследовании этого белка, определены положения максимумов поглощения и соответ-
ствующие им значения коэффициентов молярного поглощения в среде 20 мМ фосфатного буфера
(pH 7.4) для C-314 (λmax = 447.5 нм; ε = 32360.4 л/моль∙см), C-334 (λmax = 460 нм; ε = 44012 л/моль∙см)
и C-525 (λmax = 460 нм; ε = 32703.6 л/моль∙см). Показано, что изохинолизиновые производные ку-
марина являются субстратами пероксидазной реакции, катализируемой комплексом цитохрома c с
кардиолипином, расход этих веществ за время среднестатистического опыта по измерению хеми-
люминесценции (322 с) для C-314, C-334 и C-525 составляет 32, 38 и 26% соответственно.
Ключевые слова: апоптоз, хемилюминесценция, комплекс цитохрома c с кардиолипином, пероксидаза,
изохинолизиновые кумарины, спектрофотометрия.
DOI: 10.31857/S0006302920040080
плекс цитохрома c с кардиолипином (ЦитC-КЛ),
Апоптоз, или запрограммированная гибель
обладающий липопероксидазной активностью,
клеток организма, является причиной многих па-
тологий [1-6]. Ключевую роль при запуске апо-
обуславливающей разрушение мембран митохон-
птоза по митохондриальному пути играет ком-
дрий [7-23], что приводит к выходу различных
проапоптотических факторов в цитозоль [24-28].
Сокращения: ЦитC-КЛ
- комплекс цитохрома c с
кардиолипином, ТОКЛ -тетраолеилкардиолипин, C-314 -
Собственная и активированная хемилюминес-
изохинолизиновое производное кумарина, coumarin-314, ценция. Хемилюминесценция - это свечение, ко-
C-334 - изохинолизиновое производное кумарина, cou-
торое является результатом перехода различных
marin-334, C-525
- изохинолизиновое производное
кумарина, coumarin-525.
метаболитов из электронно-возбужденного со-
680
ИЗОХИНОЛИЗИНОВЫЕ ПРОИЗВОДНЫЕ КУМАРИНА
681
(а)
(б)
O
O
CH3
N
O O
O O
(в)
(г)
N
O
N
CH3
H
N
O
O
N
O
O
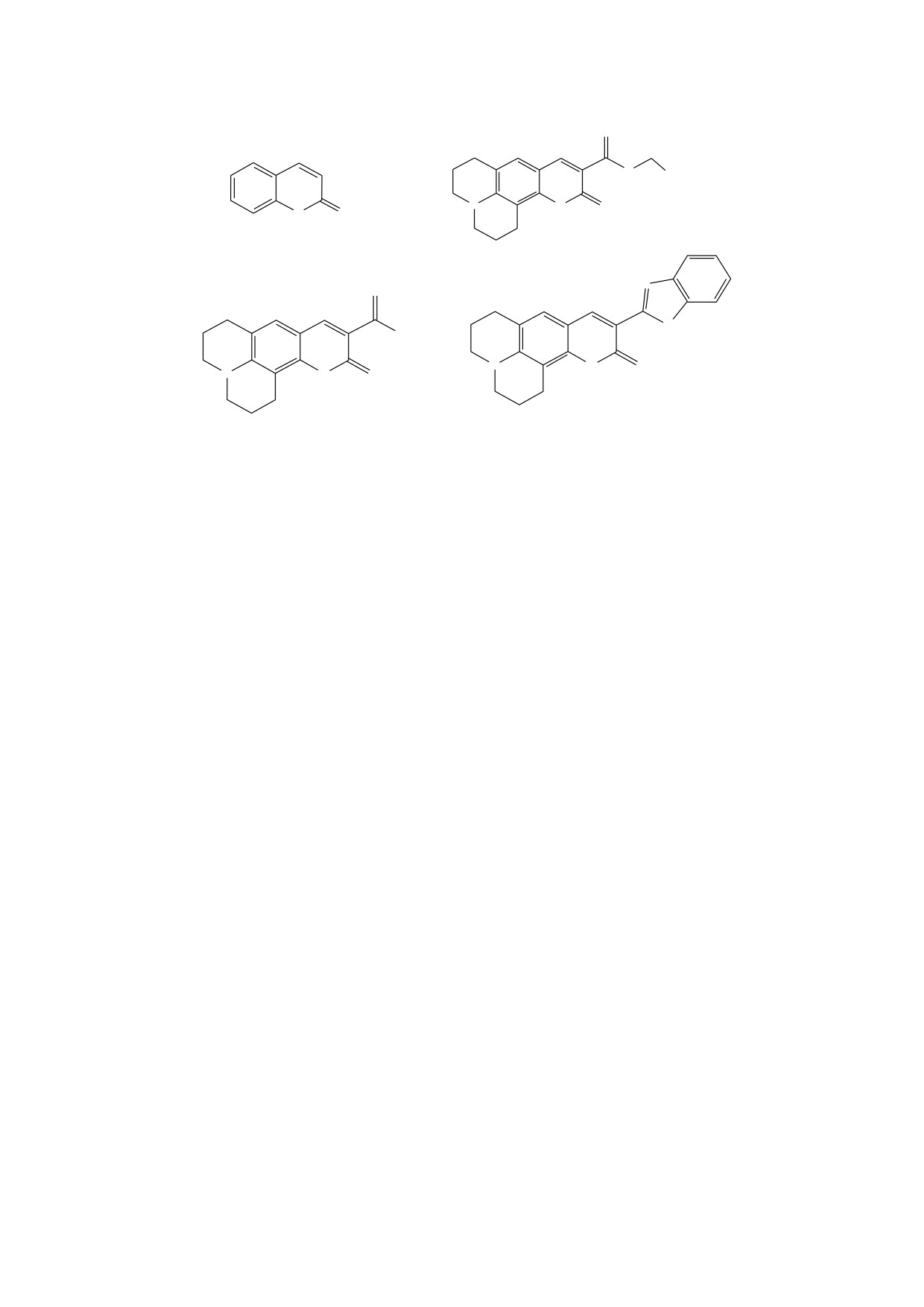
Рис. 1. Формулы кумарина и изучаемых изохинолизиновых его производных [47]: (а) - кумарин, базовое вещество
группы кумаринов, к которому присоединяются различные заместители и/или циклические группы; (б) - Coumarin-
314; (в) - Coumarin-334; (г) - Coumarin-525.
стояния в основное, причем далеко не каждый
В силу этого приходится применять так назы-
акт подобного перехода сопровождается высве-
ваемые активаторы, обуславливающие гораздо
чиванием фотона [29, 30].
более высокий квантовый выход, нежели при
собственной хемилюминесценции. Их можно
Впервые испускание биообъектами светового
разделить на две группы: 1) хемилюминесцент-
излучения очень слабой интенсивности было об-
ные зонды, или химические активаторы, - веще-
наружено в конце первой трети прошлого века
ства, химически реагирующие с участниками или
В.В. Лепешкиным [31, 32] и А.Г. Гурвичем [33].
продуктами свободнорадикальной реакции и пе-
Впоследствии было показано, что хемилюминес-
реходящие при этом в электронно-возбужденное
ценция обусловлена протеканием свободноради-
состояние [30]; 2) физические активаторы -
кальных реакций, главным образом - взаимодей-
вещества, которые усиливают свечение за счет
ствием жирнокислотных пероксил-радикалов
физического процесса миграции (перехвата)
[34, 35].
электронно-возбужденного состояния от участ-
Благодаря образованию большого количества
ников и/или продуктов свободнорадикальной ре-
энергии в элементарном акте радикальной реак-
акции без непосредственного химического взаи-
ции, часть которой выделяется в виде фотонов,
модействия с ними [30, 35, 36, 41, 43].
хемилюминесцентная методика изучения сво-
Изохинолизиновые производные кумарина. В
боднорадикальных процессов дает адекватное
настоящей работе мы исследовали изохинолизи-
представление об их протекании в исследуемой
новые производные кумарина, известные в ан-
системе [30, 37], позволяя оценить скорость реак-
глоязычных источниках как coumarin-314, cou-
ции образования свободных радикалов [29, 36],
marin-334 и coumarin-525 (сокращенно С-314,
на что не способен метод электронного парамаг-
С-334 и С-525 соответственно, структурные фор-
нитного резонанса [30, 36].
мулы приведены на рис. 1), которые до настояще-
го исследования практически общепринято счи-
С тех пор, как собственная хемилюминесцен-
тались специфичными для липидных радикалов
ция была показана на объектах растительного [38]
физическими активаторами хемилюминесцен-
и животного [39] происхождения, при помощи ее
ции, не реагирующими с участниками реакции
регистрации исследуют различные биологиче-
[12, 41, 44-46].
ские системы [30, 35, 40-42]. Однако интенсив-
ность собственной хемилюминесценции крайне
Кумарины - группа ненасыщенных аромати-
ческих лактонов, в основе которых лежит лактон
мала, к тому же зачастую перед исследователями
цис-орто-оксикоричной кислоты - 5,6-бензо-α-
стоит задача изучить не свободнорадикальные
процессы в исследуемом образце в общем и це-
пирон (кумарин) [50]; многие из этих веществ ис-
лом, а исследовать вполне конкретные радикалы,
пользуются в качестве лазерных красителей [51].
к примеру, оценить наличие в исследуемой систе-
Из трех изучаемых нами производных кумари-
ме радикалов липидов, но данный метод реги-
на в литературе уделяется наибольшее внимание
страции абсолютно неспецифичен [30].
кумарину С-525, показанному в качестве актива-
БИОФИЗИКА том 65
№ 4
2020
682
РОМОДИН и др.
тора хемилюминесценции в 1995 г. [46]. Он ис-
МАТЕРИАЛЫ И МЕТОДЫ
пользовался как физический активатор хемилю-
В работе были использованы следующие реак-
минесценции во многих работах с целью опреде-
тивы: КH2PO4, 20 мМ буферный раствор (рН 7.4);
ления гидропероксидов липидов в системе
пероксид водорода, 8.6 М водный раствор (Sigma-
«липидный субстрат - Fe2+» [41, 44-46, 49, 53]. В
Aldrich, США); кумарин С-314, 500 мкМ мета-
данной системе механизм этого усиления хеми-
нольный раствор, приготовленный из навески
люминесценции - это, по-видимому, перенос
необходимой массы (Sigma-Aldrich, США); кума-
энергии от молекулы кетона в электронно-воз-
рин С-334, 1 мМ метанольный раствор, приготов-
бужденном состоянии (первичного продукта ре-
ленный из навески необходимой массы (Sigma-
комбинации пероксил-радикалов) на флуорес-
Aldrich, США); кумарин С-525, 250 мкМ мета-
центный уровень С-525 [44]. Однако стоит заме-
нольный раствор, приготовленный из навески
тить, что С-525 за счет наличия в своей структуре
необходимой массы (Sigma-Aldrich, США); цито-
пуриновой группировки в определенных услови-
хром с, 1 мМ раствор, приготовленный из навес-
ях проявляет антиоксидантные свойства, т.е. вза-
ки необходимой массы (Sigma-Aldrich, США);
имодействует со свободными радикалами [48]. В
1,1’,2,2’-тетраолеилкардиолипин (ТОКЛ), 6 мМ
работе [12] методом индуцированной C-525 хеми-
метанольный раствор, приготовленный из навес-
люминесценции изучалось радикальное окисле-
ки необходимой массы (Avanti Polar Lipids,
ние кардиолипина, находящегося в комплексе с
США).
цитохромом c, т.е., по сути, эту работу можно в
Растворы вышеуказанных веществ в более
определенной степени считать предтечей нашего
низких концентрациях приготовляли методом
исследования. Авторами работы [51] в качестве
последовательных разведений, кратность разбав-
механизма действия C-525 был назван перенос
лений не превышала десяти.
энергии из триплетных состояний карбонилов,
образующихся в самореакции перекисного ради-
Спектрофотометрический анализ изменения
кала через механизм Рассела или разложением
конформации (развертывания) цитохрома c в мета-
ноле и в комплексе с кардиолипином. Измерения
1,2-диоксетана. Исходя из вывода авторов [51],
проводили на спектрофотометре Specord
200
что C-525 не подходит для изучения перекисного
(Analytik Jena, Германия) с использованием кю-
окисления липидов, катализируемого пероксида-
зой хрена, в силу его нестабильности в этой си-
вет из кварцевого стекла с длиной оптического
стеме, можно предположить, что в системе, где в
пути 1 см. Спектры регистрировали в пробе объе-
роли пероксидазы выступает цитохром c в ком-
мом 3 мл в диапазоне 650-750 нм, в качестве рас-
творителя использовали 100 мМ фосфатный бу-
плексе с кардиолипином [7, 12, 14, 18, 19, 48, 54-
фер с pH 7.4. Опытная проба, содержащая 50 мкМ
57], C-525 может быть сам субстратом этой реак-
ции.
раствор цитохрома c и 50% (по объему) метанола,
для установления факта обратимости или необра-
Настоящее исследование проводилось нами с
тимости действия метанола на структуру цито-
целью выяснения того, справедливо ли считать
хрома c была разбавлена в пять раз растворите-
изохинолизиновые производные кумарина
лем. В качестве контролей выступали растворы
C-314, C-334 и C-525 физическими активаторами
цитохрома c с концентрацией 50 и 10 мкМ.
хемилюминесценции, не реагирующими с ком-
Спектрофотометрические измерения для выве-
понентами изучаемой системы. Достижение ука-
занной цели предполагает выполнение задач:
дения концентрационной зависимости оптической
плотности кумаринов C-314, C-334 и C-525. Из ме-
1). Отработка процедуры исследования: вы-
танольного
1 мМ раствора кумарина C-334,
числение коэффициентов молярного поглоще-
500 мкМ раствора кумарина C-314 или 250 мкМ
ния изучаемых изохинолизиновых производных
раствора кумарина C-525 нами был приготовлен
кумарина, подтверждение допустимости наличия
25 мкМ раствор, который использовали в спек-
метанола в экспериментальных пробах.
трофотометрических измерениях, проводимых
2). Спектрофотометрический анализ течения
по следующей схеме: после измерения раствора
пероксидазной реакции, катализируемой ЦитC-
изначальной концентрации методом последова-
КЛ в присутствии изохинолизинового производ-
тельных разведений готовили растворы меньших
ного кумарина.
концентраций.
3). Изучение хемилюминесценции, сопровож-
Регистрация серии спектров поглощения смеси,
дающей катализируемую ЦитC-КЛ пероксидаз-
в которой протекает липопероксидазная реакция. В
ную реакцию, без активатора и в присутствии
кювету спектрофотометра добавляли 300 мкл
изохинолизинового производного кумарина.
100 мкМ раствора цитохрома c, 150 мкл 6 мМ рас-
4). Выдвижение гипотезы относительно того,
твора ТОКЛ, 75 мкл 1 мМ раствора С-334, или
как именно изохинолизиновые производные ку-
150 мкл 500 мкМ раствора С-314, или 300 мкл
марина участвуют в катализируемой ЦитC-КЛ
250 мкМ раствора С-525, а также - 300 мкл
реакции.
2150 мкМ раствора перекиси водорода (в кон-
БИОФИЗИКА том 65
№ 4
2020
ИЗОХИНОЛИЗИНОВЫЕ ПРОИЗВОДНЫЕ КУМАРИНА
683
трольных измерениях H2O2 заменяли фосфатным
C
ε
A
1
P 1,P
C
=
−
буфером), общий объем пробы составлял 3 мл,
C
ε
1,C
l
ε
1,C
данный объем доводили добавлением необходи-
A
2
A
1
мого количестваа 20 мМ фосфатного буфера. Пе-
−
,
рекись водорода добавляли в последнюю очередь.
ε
2,C
l
ε
1,C
l
C
P
=
Далее в течение двух часов регистрировали спек-
ε
ε
2,P
1,P
−
тры поглощения при следующих параметрах:
ε
2,C
ε
1,C
диапазон измерения 300-600 нм, скорость изме-
рения 5 нм/с, шаг (дискретность) 0.5 нм, ширина
где CC - концентрация производного кумарина,
щели 5 нм, время регистрации спектра - пример-
моль/л; A1 - значение оптической плотности (по-
но одна минута.
глощения) на длине волны, равной 409 нм (поло-
са Соре - пик поглощения порфириновой груп-
Объемы растворов и данные концентрации ре-
пы цитохрома c); A2 - значение оптической плот-
активов были подобраны нами по результатам
ности (поглощения) на длине волны,
подготовительных экспериментов, а концентра-
соответствующей максимуму поглощения произ-
ции цитохрома c и ТОКЛ взяты с расчетом на оп-
водных кумарина (447,5 нм для C-314 и 460 нм для
тимальное их соотношение, равное 1:30, как было
C-334 и C-525); ε1,P - коэффициент молярного
показано в работе [15].
поглощения цитохрома c на длине волны 409 нм;
Регистрация хемилюминесценции во время ли-
ε
2,P - коэффициент молярного поглощения ци-
попероксидазной реакции. Исследования по изме-
тохрома c на длине волны, соответствующей мак-
рению хемилюминесценции проводили на хе-
симуму поглощения производных кумарина;
милюминометре «Lum-5773» (ООО «ДИСофт»,
ε
1,C - коэффициент молярного поглощения ис-
Россия), подключенном к компьютеру с про-
следуемого производного кумарина на длине вол-
граммным обеспечением «PowerGraph». Перед
ны 409 нм; ε2,C - коэффициент молярного погло-
началом каждой серии измерений хемилюмино-
щения производного кумарина на длине волны,
метр калибровали по ураниловому стеклу.
соответствующей максимуму поглощения произ-
водных кумарина; l - толщина кюветы (длина оп-
Кювету, содержащую: 300 мкл 100 мкМ цито-
тического пути), см, в нашем случае она равня-
хрома c, 150 мкл 6 мМ метанольного раствора
лась 1 см; CP - концентрация цитохрома c,
ТОКЛ, 75 мкл 1 мМ метанольного раствора
C-334, или 300 мкл 250 мкМ метанольного рас-
моль/л.
твора C-525, или 150 мкл 500 мкМ раствора C-314,
растворенных в 20 мМ фосфатном буфере объе-
РЕЗУЛЬТАТЫ
мом 2175 мкл и 2100 мкл соответственно, помеща-
ли в кюветное отделение хемилюминометра и за-
Отработка процедуры исследования. Спектро-
пускали регистрацию, через 550 с извлекали кю-
фотометрический анализ изменения конформации
вету и добавляли в нее 300 мкл 2150 мкМ перекиси
(развертывания) цитохрома c в метаноле и в ком-
водорода с дальнейшей регистрацией свечения до
плексе с кардиолипином. При изучении ЦитC-КЛ
выхода его к фоновым значениям.
зачастую используются растворы, растворителем
в которых является метанол: это и стоковый рас-
В итоге система имела следующий количе-
твор кардиолипина, и стоковые растворы иссле-
ственный состав на момент начала липоперокси-
дуемых в настоящей работе активаторы хемилю-
дазной реакции: 10 мкМ цитохрома c, 300 мкл
минесценции - производных кумарина. При
ТОКЛ, 215 мкМ H2O2.
этом на определенных этапах эксперимента кон-
центрация спирта в образце может быть весьма
Вычисление концентраций на основании серий
существенной. Однако низкомолекулярные
спектров поглощения. Концентрации цитохрома c
спирты вызывают изменение структуры белков,
и кумариновых производных, изменяющиеся в
заключающееся в частичном развертывании гло-
процессе течения липопероксидазной реакции,
бул вследствие дегидратации белков [58], очевид-
катализируемой ЦитC-КЛ, вычисляли для каж-
но, что цитохром c в вышеупомянутых случаях
дого зарегистрированного спектра. Вычисление
меняет свою конформацию, что может повлиять
проводили на основании закона Бугера-Ламбер-
на адекватность полученных экспериментальных
та-Бера для смеси веществ посредством решения
данных. Поэтому нами была поставлена задача
системы уравнений, характеризующих значение
проверить, обратимо ли действие метанола на
оптической плотности смеси на длинах волн, со-
структуру цитохрома c. Для этого в среде 100 мМ
ответствующих пикам поглощения цитохрома c и
фосфатного буфера при pH 7.4 было зарегистри-
производного кумарина [52], по следующей фор-
ровано значение оптической плотности в пике
муле:
поглощения в области 700 нм, соответствующем
БИОФИЗИКА том 65
№ 4
2020
684
РОМОДИН и др.
0.020
20 мМ фосфатного буфера (pH 7.4). Пик погло-
0.018
щения C-314 приходится на длину волны 447.5 нм
2
(ε = 32360.4 л/моль∙см), C-334 - на 460 нм
0.016
(ε = 44012.0 л/моль∙см), C-525
- на
460 нм
0.014
(ε = 32703.56 л/моль∙см). Значение ε C-314, C-334
0.012
и C-525 на длине волны 409 нм составляет
0.010
12562.4, 9240.0 и 14987.26 л/моль∙см соответствен-
0.008
но. Значение ε для цитохрома c на длинах волн
409, 447,5 и 460 нм составляет 90740, 13890 и
0.006
4
8620 л/моль∙см соответственно.
0.004
3
0.002
Также необходимо сказать несколько слов о
1
растворимости изучаемых производных кумари-
0.000
650
670
690
710
730
750
на. C-334 в сравнении с двумя другими кумарино-
Длина волны, нм
выми красителями показал более высокую рас-
творимость и в метаноле (получалось пригото-
Рис. 2. Обратимость действия метанола на состояние
вить даже 4 мМ растворы), и в среде фосфатного
связей Fe-S в молекуле цитохрома c. Кривая 1 -
буфера (видимых признаков коллоидного раство-
50 мкМ цитохром c в 50%-м метаноле, кривая 2 -
ра не наблюдалось вплоть до концентраций
50 мкМ цитохром c, кривая 3 - 10 мкМ цитохром c в
40 мкМ).
10%-м метаноле (разбавленная в 5 раз предыдущая
проба 1), кривая 4 - 10 мкМ цитохром c.
Спектрофотометрический анализ течения пе-
роксидазной реакции, катализируемой ЦитC-КЛ, в
присутствии изохинолизинового производного ку-
железосерным связям в молекуле цитохрома c. В
марина. Для оценки участия или неучастия изохи-
качестве опытной пробы мы использовали
нолизиновых производных кумарина в липопе-
50 мкМ раствор цитохрома c в 50% метаноле, да-
роксидазной реакции нами при параллельной ре-
лее разбавленный в пять раз, в качестве контро-
гистрации хемилюминесцентного сигнала была
лей использовали 50 мкМ и 10 мкМ растворы ци-
зарегистрирована серия спектров поглощения
тохрома c; результаты эксперимента представле-
смеси, в которой протекала липопероксидазная
ны на рис. 2.
реакция, катализируемая комплексом цитохрома
По данным из спектров на рис. 2 50% метанол
c с тетраолеилкардиолипином.
вызывает полное разрушение железо-серных свя-
зей в молекуле цитохрома c (кривая 1, контроль
Результаты экспериментов по регистрации се-
без метанола - кривая 2), однако разбавление
рии спектров поглощения и общего хемилюми-
этого раствора в пять раз фосфатным буфером
несцентного сигнала показаны на рис. 3-5. На
приводит к их восстановлению (кривая 3, кон-
основании значения оптической плотности в пи-
троль без метанола - кривая 4).
ке поглощения изохинолизинового производно-
По данным проведенной нами с помощью па-
го кумарина нами была вычислена его концен-
кета «MS Excel 2016» обработки, при разбавлении
трация, также мы вычисляли концентрацию ци-
в пять раз раствора цитохрома c с объемной долей
тохрома c, вычисление концентраций проводили
метанола 50% восстановилось, судя по значению
на основании закона Бугера-Ламберта-Бера [52]
поглощения, (93.69 ± 1.04)%n=5;p=0,95 железо-
с упрощением, заключающемся в том, что изуча-
емая реакционная смесь в математической моде-
серных связей в растворе цитохрома c, причем не-
ли представлена как смесь не реагирующих друг с
обходимо указать, что за 100% нами было взято
другом двух веществ - цитохрома c и изохиноли-
значение поглощения 10 мкМ раствора цитохро-
зинового производного кумарина (C-314, C-334
ма c, в котором полностью отсутствует метанол, а
или C-525), так как на рассматриваемых длинах
в опытной пробе его объемная концентрация со-
волн кардиолипин и перекись водорода
ставляет 10%. Вышесказанное указывает на допу-
имеют низкие значения оптической плотности и
стимость использования метанольных растворов
практически весь вклад в общее поглощение сме-
без риска искажения результатов вследствие на-
си в диапазоне длин волн 405-465 нм вносят ци-
рушения метанолом молекулярной структуры
тохром c и изохинолизиновое производное кума-
цитохрома c.
рина.
Спектрофотометрические свойства кумаринов
C-314, C-334 и C-525 в среде с 20 мМ фосфатного
На рис. 3 представлены результаты этого экс-
буфера. При использовании математического вы-
перимента с присутствием в реакционной смеси
ражения закона Бугера-Ламберта-Бера нами
кумарина C-314. Как видно из графиков, в первые
были показаны следующие значения коэффици-
30 мин липопероксидазной реакции происходит
ентов молярного поглощения (ε) исследуемых
резкое уменьшение концентрации изохинолизи-
производных кумарина и цитохрома c в среде
нового производного кумарина, C-314.
БИОФИЗИКА том 65
№ 4
2020
ИЗОХИНОЛИЗИНОВЫЕ ПРОИЗВОДНЫЕ КУМАРИНА
685
(а)
(б)
1.6
25
25
1.4
20
20
15
1.2
10
1.0
15
1
5
0.8
3
2
0.6
4
10
00
100
200
300
1
Время, с
5
0.4
2
5
0.2
0.0
300
400
500
600
00
50
100
Длина волны, нм
Время, мин
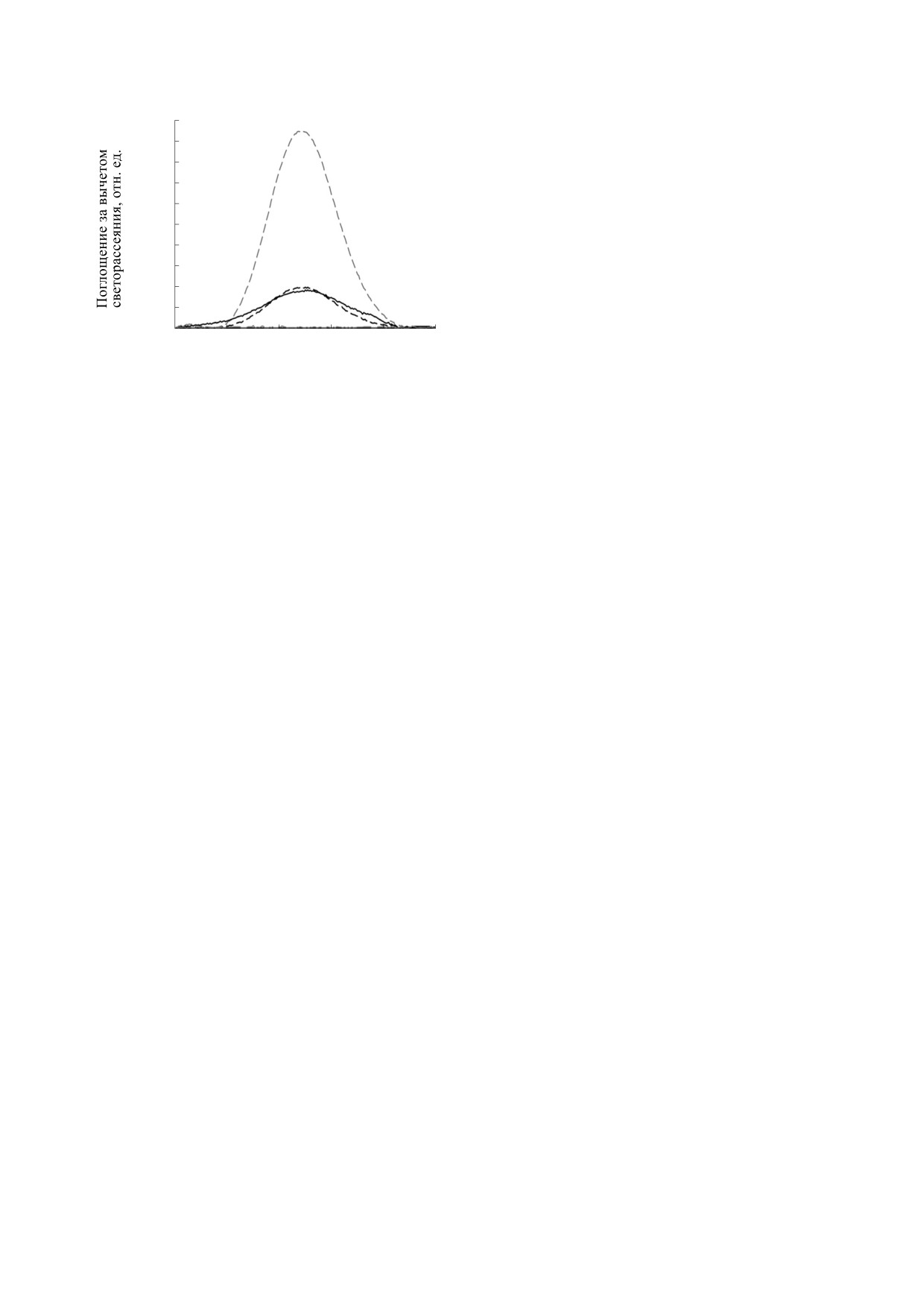
Рис. 3. Пероксидазная реакция в системе начального состава: 10 мкМ цитохрома c, 300 мкМ ТОКЛ, 25 мкМ C-314,
215 мкМ H2O2. (а) - Серия спектров поглощения смеси: 1 - спектр поглощения смеси без H2O2, 2 - спектр
поглощения через 15 с после начала реакции, 3 - через 5 мин, 4 - через 59 мин, 5 - через 120 мин. (б) - Уменьшение
концентрации цитохрома c (кривая 1) и C-314 (кривая 2) в процессе реакции, на врезке - уменьшение концентрации
C-314 в первые минуты реакции.
На рис. 4 представлены результаты аналогич-
бавлении каждого из изучаемых производных
ного эксперимента с присутствием в реакцион-
кумарина, а также - без их добавления. В силу то-
ной смеси C-334, он также расходуется в процессе
го, что хемилюминесценция системы в присут-
реакции.
ствии различных производных кумарина была
Рис. 5 представляет эксперимент с C-525, кон-
примерно одинакова как по кинетике, так и по
центрация которого тоже резко снижается в тече-
амплитуде вспышек, но отличалась от таковой
ние первых 10 мин реакции.
для системы без добавления кумариновых краси-
телей, на график мы решили вывести результат
Хемилюминесценция, сопровождающая катали-
измерения только с одним производным кумари-
зируемую ЦитC-КЛ реакцию. Была проведена ре-
гистрация хемилюминесценции, сопровождаю-
на, сравнив его с хемилюминесценцией системы
щей катализируемую ЦитC-КЛ реакцию при до-
без красителя.
(а)
(б)
25
20
1.4
25
1
15
1.2
20
2
10
1.0
5
15
0.8
3
0.6
00
100
200
300
4
10
1
Время, с
5
0.4
2
5
0.2
0.0
0
0
50
100
300
400
500
600
Время, мин
Длина волны, нм
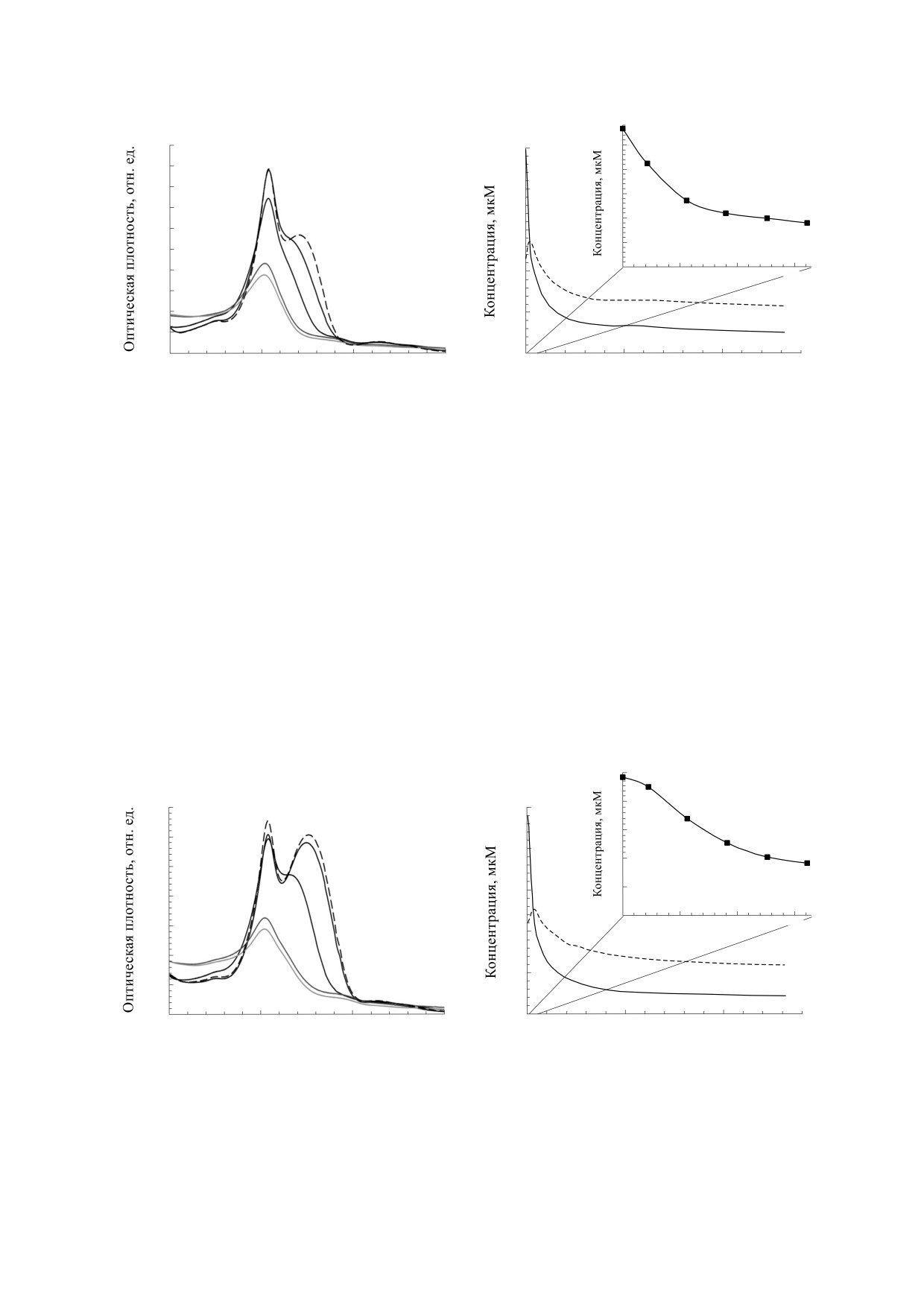
Рис. 4. Пероксидазная реакция в системе начального состава: 10 мкМ цитохрома c, 300 мкМ ТОКЛ, 25 мкМ C-334,
215 мкМ H2O2. (а) - Серия спектров поглощения смеси: 1 - спектр поглощения смеси без H2O2, 2 - спектр
поглощения через 15 с после начала реакции, 3 - через 5 мин, 4 - через 59 мин, 5 - через 120 мин. (б) - Уменьшение
концентрации цитохрома c (кривая 1) и C-334 (кривая 2) в процессе реакции, на врезке - уменьшение концентрации
C-334 в первые минуты реакции.
БИОФИЗИКА том 65
№ 4
2020
686
РОМОДИН и др.
(а)
(б)
25
1.6
25
20
1.4
15
20
1.2
10
1.0
1
15
5
0.8
4
3
2
10
00
100
200
300
0.6
1
5
Время, с
0.4
2
5
0.2
0.0
300
400
500
600
00
50
100
Длина волны, нм
Время, мин
Рис. 5. Пероксидазная реакция в системе начального состава: 10 мкМ цитохрома c, 300 мкМ ТОКЛ, 25 мкМ C-525,
215 мкМ H2O2. (а) - Серия спектров поглощения смеси: 1 - спектр поглощения смеси без H2O2, 2 - спектр
поглощения через 15 с после начала реакции, 3 - через 5 мин, 4 - через 59 мин, 5 - через 120 мин. (б) - Уменьшение
концентрации цитохрома c (кривая 1) и C-525 (кривая 2) в процессе реакции, на врезке - уменьшение концентрации
C-525 в первые минуты реакции.
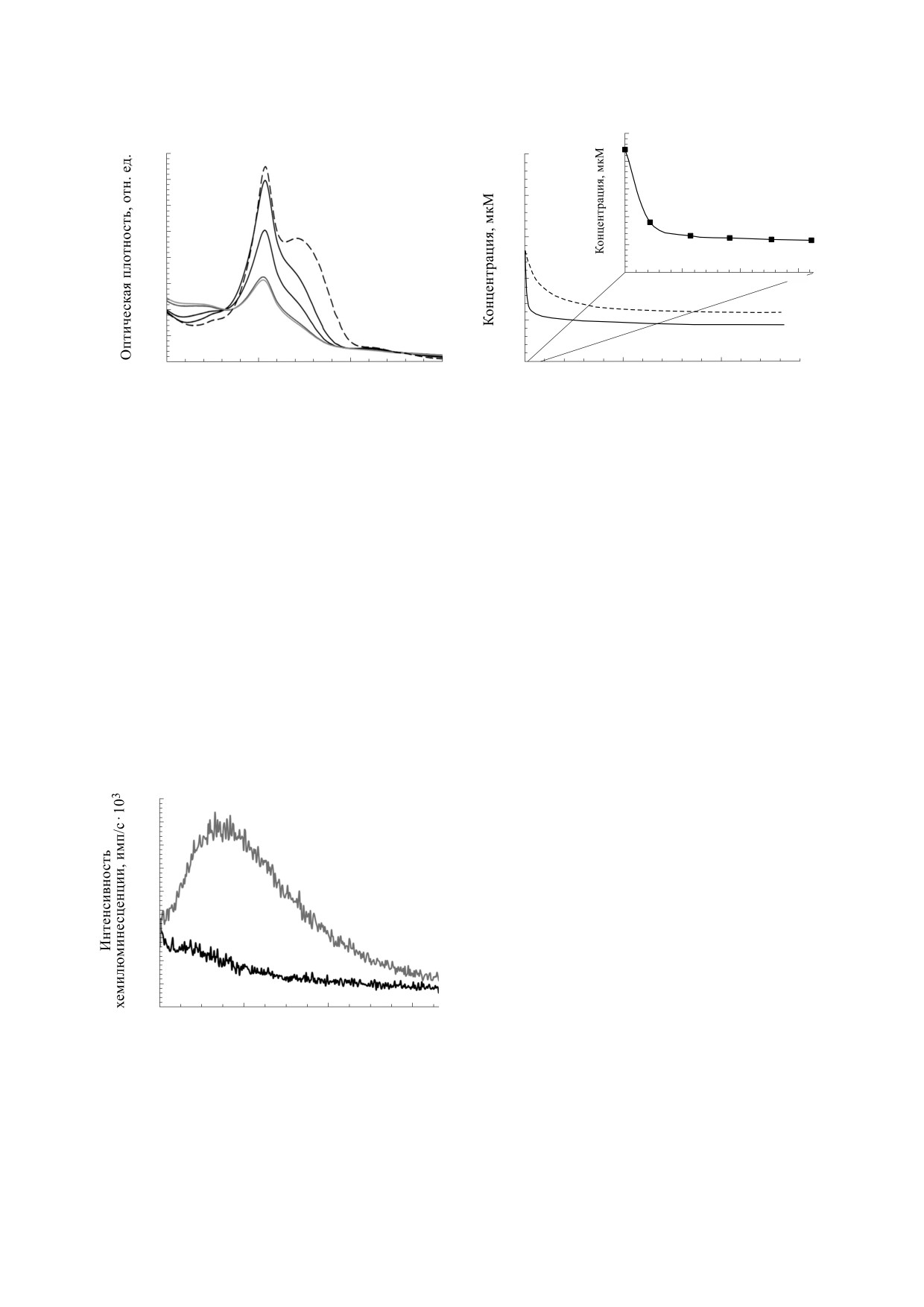
Как видно из приведенных на рис. 6 хемилю-
ции, катализируемой ЦитC-КЛ. График на
минесцентных кривых, свечение, сопровождаю-
врезках на рис. 3-5 характеризует снижение кон-
щее пероксидазную реакцию, катализируемую
центрации изохинолизиновых производных ку-
ЦитC-КЛ, в присутствии изохинолизинового
марина в течение первых ≈5.4 мин пероксидазной
производного кумарина ниже, чем наблюдаемое
реакции. В подавляющем количестве работ по из-
в его отсутствие. Этот, на первый взгляд, стран-
мерению хемилюминесценции продолжитель-
ный результат объяснен ниже при обсуждении.
ность этого измерения не превышает 5 мин. По-
этому для использования изохинолизиновых
производных кумарина в качестве активаторов
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
хемилюминесценции при изучении пероксидаз-
ной реакции, катализируемой ЦитC-КЛ, целесо-
Из рис. 3-5 следует, что изохинолизиновые
образно определить степень расхода активаторов
производные кумарина, C-314, C-334 и C-525, яв-
за это время. Таким образом, в первые 322 с рас-
ляются субстратами липопероксидазной реак-
ходуется 32% C-314, 38% C-334 и 26% C-525. Ука-
занные данные позволяют в будущих работах вы-
числять поправочные коэффициенты для их ис-
0.9
пользования в интерпретировании данных
0.8
кумарин-активированной хемилюминесценции,
0.7
сопровождающей катализируемую ЦитC-КЛ пе-
1
роксидазную реакцию.
0.6
0.5
Появляется весьма логичный и закономерный
вопрос: как же быть с результатами авторов работ
0.4
[44-46, 51], показавших изохинолизиновые про-
0.3
2
изводные кумарина как физические активаторы
0.2
хемилюминесценции, не расходующиеся в ходе
пероксидазной реакции. Ответ на этот вопрос до-
0.1
статочно прост: в перечисленных исследованиях
0.0
происходила пероксидазная реакция, катализи-
0
100
200
300
Время, c
руемая свободными ионами Fe2+ в водной фазе, в
случае же пероксидазной реакции, катализируе-
Рис. 6. Суммарная интенсивность хемилюминесцен-
мой ЦитC-КЛ, взаимодействие с субстратом про-
ции в диапазоне длин волн 300-650 нм смеси началь-
текает скорее в липидной фазе, каковой является
ного состава: 10 мкМ цитохрома c, 300 мкМ ТОКЛ,
кардиолипиновая оболочка, образующаяся во-
215 мкМ H2O2 без добавления производного кумари-
на (кривая
1) и в присутствии
25 мкМ C-334
круг молекулы цитохрома c [15, 17]. В липидной
(кривая 2).
фазе производные кумарина, в отличие от водной
БИОФИЗИКА том 65
№ 4
2020
ИЗОХИНОЛИЗИНОВЫЕ ПРОИЗВОДНЫЕ КУМАРИНА
687
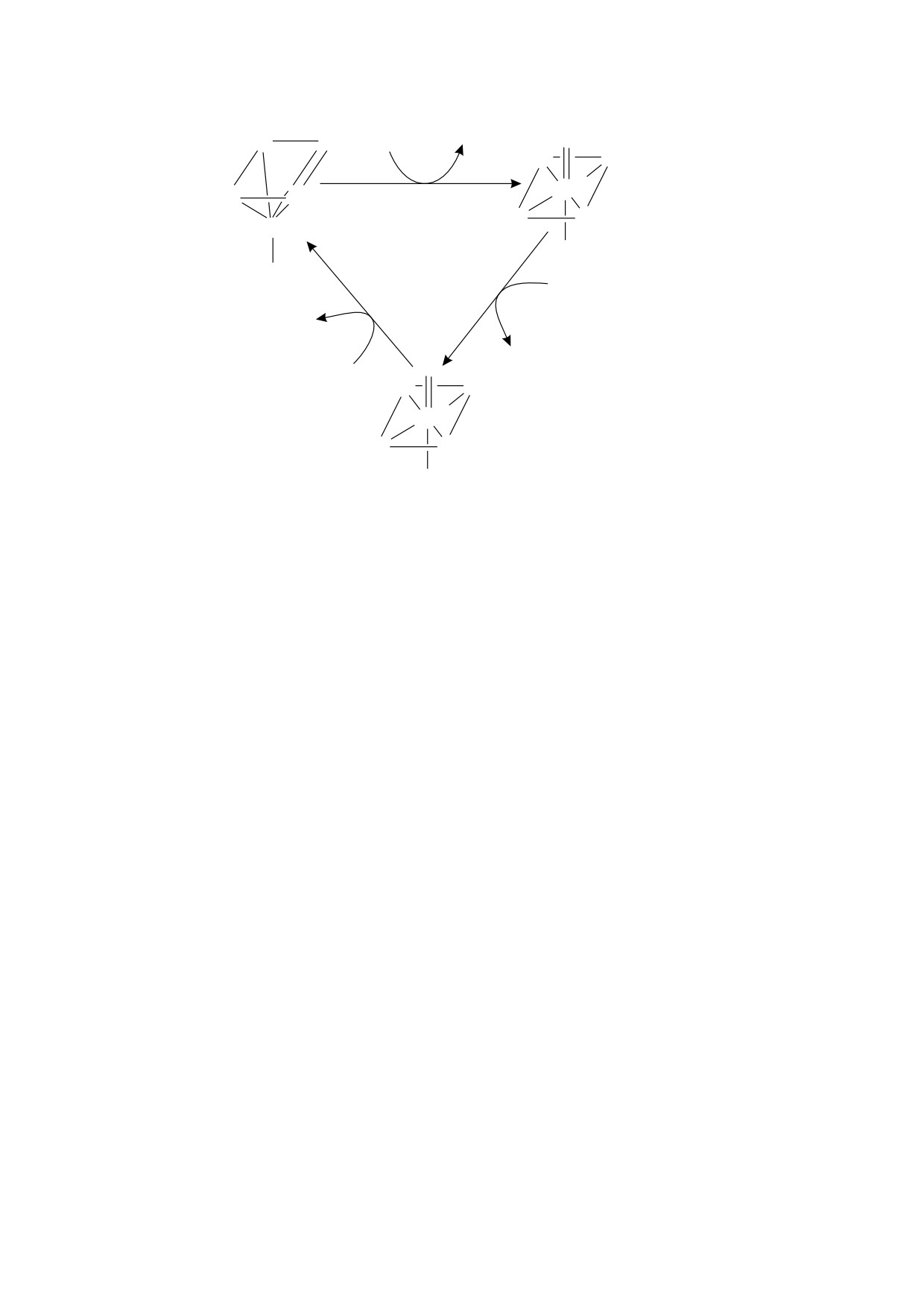
Enz
H O22
H
O
2
O
N
N
N
N
Компаунд 1
FeIV
•+
N
N
N
N
FeIII
NHis
NHis
CoumarinH
Coumarin•
Coumarin•
CoumarinH
O
N
N
FeIV
Компаунд 2
N
N
NHis
Рис. 7. Предполагаемое участие изохинолизиновых производных кумарина в липопероксидазной реакции. Условные
обозначения: Enz - пероксидаза, содержащая трехвалентное железо, компаунд 1 - окисленная пероксидаза, содержа-
щая четырехвалентное железо и радикал), компаунд 2 - пероксидаза, содержащая четырехвалентное железо или ра-
дикал), CoumarinH - исходное изохинолизиновое производное кумарина, Coumarin* - радикал изохинолизинового
производного кумарина.
фазы, по нашим соображениям, являются непо-
которым является липид, восстанавливаясь до
средственными субстратами липопероксидазной
компаунда 2, который может вернуться к состоя-
реакции, занимая место липидного субстрата в
нию исходного фермента путем окисления еще
пероксидазном цикле, подробно описанном в ра-
одной молекулы липида [60], а образовавшиеся
ботах [59, 60]. Также необходимо упомянуть, что
липидные радикалы запускают каскад реакций
авторами работы [51] была замечена нестабиль-
перекисного окисления липидов [61]. Необходи-
ность концентрации C-525 в системе, в которой
мо также заметить, что авторы работы [60] приво-
протекала ферментативная липопероксидазная
дят на схеме пероксидазного цикла способ вос-
реакция, катализируемая пероксидазой хрена.
становления компаунда 1, альтернативный ради-
кальному окислению липида: окисление
Место изохинолизиновых производных кумари-
перекиси водорода с образованием супероксид-
на в пероксидазном цикле. Напомним о процессах,
ного радикала ·O2- и его восстановление до моле-
являющихся составляющими пероксидазного
ферментативного цикла - замкнутой последова-
кулярного кислорода компаундом 2.
тельности превращений, происходящих с фер-
На основании полученных выводов нами была
ментом-пероксидазой, которым является и цито-
составлена схема участия изохинолизиновых
хром c в комплексе с кардиолипином [15]. Так на-
производных кумарина в пероксидазном цикле,
зываемый
«исходный фермент-пероксидаза»
представленная на рис. 7.
содержит гем с трехвалентным железом. После
В предполагаемом нами механизме изохино-
взаимодействия исходного фермента с Н2О2 в ре-
лизиновое производное кумарина претерпевает
зультате его двуэлектронного окисления образу-
радикальное окисление компаундом 1 при его
ется так называемый компаунд 1 - это соедине-
превращении в компаунд 2 и компаундом 2 при
ние со степенью окисления на 2 большей, чем та,
его восстановлении до исходного фермента.
что была у исходного фермента (т.е. исходный
фермент с двумя окисленными эквивалентами):
Далее нам необходимо ответить на вопрос, яв-
соединение, в котором есть два «дополнитель-
ляются ли кумариновые красители химическими
ных» неспаренных электрона [60], представлен-
активаторами хемилюминесценции, индуциро-
ное двумя переходящими друг в друга формами,
ванной пероксидазной реакций. В работе [62]
подробно описанными в работе [59] для перокси-
предложен утвердительный ответ на этот вопрос
дазы хрена. В большинстве случаев компаунд 1
на основании предположения об уменьшении их
берет себе один электрон от субстрата окисления,
концентрации на основании снижения оптиче-
БИОФИЗИКА том 65
№ 4
2020
688
РОМОДИН и др.
ской плотности реакционной смеси (непосред-
слабее, чем в его отсутствии. Это объясняется
ственные значения концентраций в той работе не
различиями в механизме течения реакции.
вычислялись). Однако тот факт, что C-314, C-334
Нами была выдвинута гипотеза, согласно кото-
и C-525 - субстраты реакции, еще не говорит о
рой изохинолизиновые производные кумарина -
том, что они подобно люминолу являются хими-
субстрат катализируемой комплексом цитохрома c с
ческими активаторами хемилюминесценции
кардиолипином пероксидазной реакции, окисляю-
[63], так как, в отличие от последнего, продукты
щийся при восстановлении окисленных форм пе-
окисления кумариновых красителей комплексом
роксидазы.
ЦитC-КЛ не испускают фотонов. Доказатель-
ством этого служат хемилюминесцентные кривые
на рис. 6. Так как мы использовали ТОКЛ, прак-
ФИНАНСИРОВАНИЕ РАБОТЫ
тически не подвергаемый окислению в ходе пе-
Работа была выполнена при финансовой под-
роксидазной реакции, липидные радикалы почти
держке Российского фонда фундаментальных ис-
не образовывались, поэтому кумарины не акти-
следований (грант № 18-015-00491 «Изучение ме-
вировали хемилюминесценцию. Однако при
ханизма реакций образования свободных радика-
этом сами кумариновые красители активно всту-
лов в мембранах клеток и митохондрий,
пали в реакцию (графики снижения концентра-
катализируемых комплексом цитохрома c с ани-
ций - на рис. 3-5). Следовательно, активно обра-
онными липидами (Cyt-AL)».
зовывались и их окисленные продукты, но ника-
кого сильного свечения они не давали. Кривая 1
на рис. 6 характеризует хемилюминесценцию от
КОНФЛИКТ ИНТЕРЕСОВ
изучаемой системы без кумаринов, собственную
Все авторы настоящей работы заявляют, что не
хемилюминесценцию, индуцированную данной
имеют конфликта интересов касательно материа-
реакцией.
лов, представленных в работе.
ВЫВОДЫ
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ НОРМ
В работе показана допустимость применения
Настоящая статья не содержит описания вы-
метанольных растворов в исследованиях функ-
полненных авторами исследований с участием
ций цитохрома c при условии, что в момент непо-
людей или использованием животных в качестве
средственного исследования объемная доля мета-
объектов.
нола не превышает 10% и что на предварительных
стадиях выполнения метода приготовления экс-
периментальной пробы она не превышает 50%.
СПИСОК ЛИТЕРАТУРЫ
Определены длины волн положения максиму-
1. T. Nishikido, J. Oyama, A. Shiraki, et al., J. Am. Heart
мов поглощения изохинолизиновых производных
Assoc. 5 (4), e002863 (2016). DOI: 10.1161/JAHA.
кумарина и соответствующие им значения коэффи-
115.002863
циентов молярного поглощения в среде 20 мМ фос-
2. G. L. Caldeira, I. L. Ferreira, and A. C. Rego, J. Alz-
фатного буфера (pH 7.4): 32360.4 л/моль∙см на
heimers Dis. 34,
115
(2013). DOI: 10.3233/JAD-
121444
447.5 нм для C-314, 44012.0 л/моль∙см на 460 нм для
C-334 и 32703.6 л/моль∙см на 460 нм для C-525. Кон-
3. H. H. Gaballah, S. S. Zakaria, M. M. Elbatsh, and
N. M. Tahoon, Chem. Biol. Interact. 251, 10 (2016).
центрация изохинолизиновых производных кума-
DOI: 10.1016/j.cbi.2016.03.023
рина, равная 25 мкМ, признана нами оптимальной
для исследования ферментативных реакций липид-
4. L. Fan, L. Jiang, and Z. Du, Metab. Brain Dis. 30, 1269
(2015). DOI: 10.1007/s11011-015-9703-z
ной пероксидации в среде фосфатного буфера.
5. N. Yalcinkaya, H. Haytural, B. Bilgic, et al., Neurosci.
Показано, что изохинолизиновые производ-
Lett. 615, 72 (2016). DOI: 10.1016/j.neulet.2016.01.029
ные кумарина расходуются в процессе катализи-
6. Е. В. Проскурнина, Ю. А. Владимиров и А. М. По-
руемой комплексом цитохрома c с кардиолипи-
лимова, в сб. Материалы 11 Междунар. междисци-
ном пероксидазной реакции. Методом спектро-
плин. конгр. «Нейронаука для медицины и психоло-
фотометрии определено, что в первые 322 с этой
гии» (Судак, 2015), с. 309.
реакции расходуется примерно: 32% C-314, 38%
7. Ю. А. Владимиров, Е. В. Проскурнина, Е. М. Дё-
C-334, 26% C-525. Это время равно продолжи-
мин и др., Биохимия 74, 372 (2009).
тельности среднестатистического опыта по изме-
8. Ю. А. Владимиров, Е. В. Проскурнина, Д. Ю. Из-
рению хемилюминесценции.
майлов и др., Биохимия 71, 1225 (2006).
Показано, что хемилюминесценция, индуци-
9. Ю. А. Владимиров, Е. В. Проскурнина, Д. Ю. Из-
рованная катализируемой комплексом цитохро-
майлов и др., Биохимия 91, 1215 (2006).
ма c с кардиолипином пероксидазной реакцией,
10. А. Н. Осипов, Г. О. Степанов, Ю. А. Владимиров
при наличии в смеси кумаринового активатора
и др., Биохимия 71, 1392 (2006).
БИОФИЗИКА том 65
№ 4
2020
ИЗОХИНОЛИЗИНОВЫЕ ПРОИЗВОДНЫЕ КУМАРИНА
689
11. Е. М. Дёмин, Е. В. Проскурнина и Ю. А. Владими-
34. Ю. А. Владимиров, О. А. Азизова, А. И. Деев и др.
ров, Вестн. МГУ. Сер. 2: Химия 49, 354 (2008).
Свободные радикалы в главных системах. (Итоги на-
12. Ю. А. Владимиров, Е. М. Дёмин, Е. В. Проскурни-
уки и техники. Биофизика. Т. 29) (ВИНИТИ АН
на и А. Н. Осипов, Биол. мембраны 26, 493 (2009).
СССР, М., 1991).
13. Е. М. Дёмин, Д. Ю. Измайлов, Е. В. Проскурнина
35. Ю. А. Владимиров, Е. В. Проскурнина и Д. Ю. Из-
и Ю. А. Владимиров, Регуляция радикал-зависимой
майлов, Бюл. эксперим. биологии и медицины
стадии апоптоза с помощью антиоксидантов (ООО
144, 390 (2007).
«МАКС Пресс», М., 2012).
36. А. И. Журавлёв и С. М. Зубкова, Антиоксиданты.
14. Ю. А. Владимиров, в сб. Материалы XXXX Между-
народной научно-практической конференции «При-
Свободнорадикальная патология, старение. Второе
менение лазеров в медицине и биологии» (Ялта, 2013),
издание, исправленное и дополненное (Белые альвы,
с. 174.
М., 2014).
15. Ю. А. Владимиров, Е. В. Проскурнина и
37. А. М. Полимова, М. М. Созарукова, Е. В. Прос-
А. В. Алексеев, Биохимия 78, 1391 (2013).
курнина и Ю.А. Владимиров, в сб. Материалы II
16. Е. М. Демин, Е. В. Проскурнина и Ю. А. Владими-
съезда аналитиков России (Москва, 2013), с. 276.
ров, в сб. Материалы II съезда аналитиков России
38. Ю. А. Владимиров и Ф. Ф. Литвин, Биофизика 4,
(Москва, 2013), с. 275.
601 (1959).
17. А. С. Викулина, А. В. Алексеев, Е. В. Проскурнина
39. Б. Н. Тарусов, А. И. Поливода и А. И. Журавлёв,
и Ю. А. Владимиров, Биохимия 80, 1573 (2015).
Биофизика 6, 490 (1961).
18. V. E. Kagan, V. A. Tyurin, J. Jiang, et al., Nature Chem.
40. Л. А. Ромодин, Ю. А. Владимиров, Н. П. Лысенко
Biol. 1, 223 (2005).
и Е. Н. Зарудная, Изв. междунар. акад. аграрного
19. N. A. Belikova, Y. A. Vladimirov, A. N. Osipov, et al.,
образования, № 42-1, 112 (2018).
Biochemistry 45, 4998 (2006).
41. П. О. Волкова, А. В. Алексеев, А. А. Джатдоева
20. L. Milazzo, L. Tognaccini, B. D. Howes, et al., Bio-
и др., Вестн. МГУ. Сер. Химия 57, 34 (2016).
chemistry 56,
1887
(2017). DOI: 10.1021/acs.bio-
chem.6b01281
42. Г. К. Владимиров, М. М. Созарукова и Д. Ю. Из-
майлов, в сб. Proc. of the int. conf. «Science and prac-
21. Y. A. Vladimirov, C. Sarisozen, G. K. Vladimirov, et al.,
tice: new discoveries», под ред. И. М. Швеца,
Pharm. Res. 34, 1264 (2017). DOI: 10.1007/s11095-
Л. А. Исмагиловой, В. А. Гурьевой и В. И. Седенко
017-2143-1
(Международный центр научно-исследователь-
22. D. A. Capdevila, S. Oviedo Rouco, F. Tomasina, et al.,
ских проектов, Киров, 2015), сс. 717-726.
Biochemistry 54, 7491 (2015). DOI: 10.1021/acs.bio-
chem.5b00922
43. Ю. А. Владимиров и А. Я. Потапенко, Физико-хи-
мические основы фотобиологических процессов:
23. H. Kobayashi, S. Nagao, and S. Hirota, Angew Chem.
учебное пособие для медицинских и биологических
Int.
Ed. Engl.
55,
14019
(2016).
DOI:
спец. вузов (Высш. шк., М., 1989).
10.1002/anie.201607419
44. V. S. Sharov, E. S. Dremina, and Yu. A. Vladimirov,
24. A. Bhujade, G. Gupta, S. Talmale, et al., Food Funct.
Biofizika 40, 428 (1995).
4, 338 (2013). DOI: 10.1039/c2fo30167a
25. D. A. Vasina, D. D. Zhdanov, E. V. Orlova, et al., Bio-
45. Yu. A. Vladimirov, M. P. Sherstnev, and T. K. Azim-
chemistry (Moscow)
82,
24
(2017).
DOI:
baev, Biofizika 40, 323 (1995).
10.1134/S0006297917010035
46. Y. A. Vladimirov, V. S. Sharov, E. S. Driomina, et al.,
26. S. Li, T. Wang, L. Zhai, et al., J. Mol. Neurosci. 64, 144
Free Radic Biol Med. 18, 739 (1995).
(2018). DOI: 10.1007/s12031-017-1012-z
47. База низкомолекулярных веществ PubChem:
27. P. Bemani, M. Mohammadi, and A. Hakakian, Asian
https://pubchem.ncbi.nlm.nih.gov.
Pac. J. Cancer Prev. 19, 97 (2018). DOI: 10.22034/AP-
48. J. Jiang, A. Bakan, A. A. Kapralov, et al., Free Radic.
JCP.2018.19.1.97
Biol. Med. 71, 221 (2014). DOI: 10.1016/j.freerad-
28. S. A. Susin, E. Daugas, L. Ravagnan, et al., J. Exp.
biomed.2014.02.029
Med. 192, 571 (2000).
49. А. С. Викулина, А. А. Джатдоева, Е. Н. Лобиченко
29. Ю. А. Владимиров и А. И. Арчаков, Перекисное
и др., Журн. аналит. химии 72, 639 (1987).
окисление липидов в биологических мембранах (Нау-
50. Выделение и анализ природных биологически актив-
ка, М., 1972).
ных веществ (Изд-во Томского университета,
30. Ю. А. Владимиров и Е. В. Проскурнина, Успехи
Томск, 2017).
биол. химии 49, 341 (2009).
51. V. S. Sharov, K. Briviba, and H. Sies, Free Radic. Biol.
31. W. Lepeschkin, Science
76,
409
(1932). DOI:
Med. 21, 833 (1996).
10.1126/science.76.1975.409
52. Ю. A. Владимиров и Е. В. Проскурнина, Лекции
32. W. W. Lepeschkin, Science 76, 168 (1932). DOI:
медицинской биофизике: Учебное пособие (Изд-во
10.1126/science.76.1964.168
МГУ; ИКЦ «Академкнига», М., 2007).
33. А. Г. Гурвич, Митогенетическое излучение (Госме-
53. O. V. Vasiljeva, O. B. Lyubitsky, G. I. Klebanov, and
диздат, М., 1934).
Yu. A. Vladimirov, Membr. Cell Biol. 12, 223 (1998).
БИОФИЗИКА том 65
№ 4
2020
690
РОМОДИН и др.
54. A. Mandal, C. L. Hoop, M. DeLucia, et al., Biophys. J.
59. J. N. Rodriguez-Lopez, D. J. Lowe, J. Hernandez-
109, 1873 (2015). DOI: 10.1016/j.bpj.2015.09.016
Ruiz, et al., J. Am. Chem. Soc. 123, 11838 (2001).
55. V. E. Kagan, A. Bayir, H. Bayir, et al., Mol. Nutr. Food
60. P. G. Furtmuller, W. Jantschko, M. Zederbauer, et al.,
Res. 53, 104 (2009). DOI: 10.1002/mnfr.200700402
Jpn. J. Infect. Dis. 57, S30 (2004).
56. V. E. Kagan, G. G. Borisenko, Y. Y. Tyurina, et al., Free
Radic. Biol. Med. 37, 1963 (2004). DOI: 10.1016/j.fre-
61. F. Ito, Y. Sono, and T. Ito, Antioxidants (Basel) 8 (3),
eradbiomed.2004.08.016
72 (2019). DOI: 10.3390/antiox8030072
57. Л. А. Ромодин, Е. Н. Зарудная и Ю. А. Владими-
ров, Комплекс цитохрома c с кардиолипином: биоло-
62. Л. А. Ромодин, С. В. Шангин, Ю. А. Владимиров и
гическая роль и ингибирование антиоксидантами
др., Изв. междунар. акад. аграрного образования,
(Изд-во «Перо», М., 2017).
№ 42-1, 118 (2018).
58. A. Deshpande, S. Nimsadkar, and S. C. Mande, Acta
Crystallogr. D. Biol. Crystallogr. 61, 1005 (2005). DOI:
63. M. J. Cormier and P. M. Prichard, J. Biol. Chem. 243,
10.1107/S0907444905009364
4706 (1968).
Isoquinoline Coumarin Derivatives as Chemiluminescence Activators
in Reactions of Lipid Peroxidation
L.A. Romodin*, Yu.A. Vladimirov**, ***, ****, *****, S.V. Shangin*, G.K. Vladimirov**, *****,
N.P. Lysenko*, and E.I. Demikhov******
*Skryabin Moscow State Academy of Veterinary Medicine and Biotechnology,
ul. Akademika Skryabina 23, Moscow, 109472 Russia
**Institute of Regenerative Medicine of Sechenov First Moscow State Medical University, Ministry of Health of the Russian
Federation, Trubetskaya ul. 8/2, Moscow, 119991 Russia
***Lomonosov Moscow State University, Leninskiye Gory 1, Moscow, 119991 Russia
****Pirogov Russian National Research Medical University, Ministry of Health of the Russian Federation,
ul. Ostrovityanova 1, Moscow, 117997 Russia
*****Shubnikov Institute of Crystallography, Federal Research Center “Crystallography and Photonics” of the Russian
Academy of Sciences, Leninskii prosp. 59, Moscow, 119333 Russia
******Lebedev Physical Institute, Russian Academy of Sciences, Leninskii prosp. 53, Moscow, 119991 Russia
The objective of this study was to focus on participation of isoquinoline derivatives of coumarin in peroxidase
reaction catalyzed by the cytochrome c-cardiolipin complex. We have studied coumarin derivatives called
coumarin-314 (C-314), coumarin-334 (C-334) and coumarin-525 (C-525). These substances are known as
specific physical activators of the chemiluminescence accompanying lipid peroxidation reaction. The effect
of methanol on the structure of cytochrome c has been investigated employing spectrophotometry, phosphate
buffer has been used to explore the optical properties of these substances. A spectrophotometric study and the
measurements of the chemiluminescence intensity of a mixture in which lipoperoxidase reaction is catalyzed
by the complex of cytochrome c with cardiolipin in the presence of isoquinoline derivatives of coumarin have
been conducted simultaneously. Our findings show that the effect of methanol on the structure of cyto-
chrome c is reversible indicating possible use of this alcohol in the study of this protein. Positions of absorp-
tion maxima and corresponding values of molar absorption coefficients in 20 mM phosphate buffer
(pH 7.4) are determined for C-314 (λmax = 447.5 nm, ε = 32360.4 l/mol∙cm), C-334 (λmax = 460 nm,
ε = 44012 l/mol∙cm), and C-525 (λmax = 460 nm, ε = 32703.56 l/mol∙cm). We also demonstrated that iso-
quinoline derivatives of coumarin are substrates of peroxidase reaction catalyzed by the complex of cyto-
chrome c with cardiolipin. Mass flow of these substances during an average statistical experiment in measure-
ment of chemiluminescence (322 s) for C-314, C-334 and C-525 amounted to 32, 38 and 26%, respectively.
Keywords: apoptosis, chemiluminescence, cytochrome c/cardiolipin complex, peroxidase, isoquinoline coumarin,
spectrophotometry
БИОФИЗИКА том 65
№ 4
2020