БИОФИЗИКА, 2020, том 65, № 4, с. 691-704
БИОФИЗИКА КЛЕТКИ
УДК 577.1
РАДИКАЛЫ В СТРУКТУРАХ КЛЕТКИ
© 2020 г. Ю.А. Шаповалов*, П.П. Гладышев**, С.Т. Тулеуханов*,
Е.В. Швецова*, Ж.Т. Абдрасулова*
*Казахский национальный университет им. аль-Фараби,
050040, Алматы, просп. аль-Фараби, 71, Республика Казахстан
**Государственный университет «Дубна», 141982, Дубна Московской области, ул. Университетская, 19
E-mail: yu.shapovalov@mail.ru
Поступила в редакцию 05.12.2019 г.
После доработки 18.02.2020 г.
Принята к публикации 25.05.2020 г.
Рассмотрено участие природных радикалов в одноэлектронных процессах жизнедеятельности кле-
ток. Показано, что коферменты, имея промежуточные свободно-радикальные хиноидные и семи-
хиноидные формы, могут взаимодействовать с каротиноидами, образуя комплексы с переносом за-
ряда с полосой поглощения 1030 нм. При этом комплекс может выполнять активную светособира-
ющую функцию при фотосинтезе вплоть до 1100 нм с передачей энергии от хлорофиллов a и b на
комплекс. Исследования сорбции фермент-кофакторной системы «алкогольдегидрогеназа-нико-
тинамидадениндинуклеотид» на гидрофобном электропроводном носителе показали, что макси-
мальная активность фермент-кофакторной системы проявляется при последовательной сорбции
кофермента, а затем апофермента. Важную роль играет ориентация биокаталитической системы на
матрице иммобилизации.
Ключевые слова: радикалы, коферменты, каротиноиды, комплекс с переносом заряда, сорбция,
иммобилизация.
DOI: 10.31857/S0006302920040092
нения антиоксидантной защиты для нейтрализа-
Известно, что к радикалам относят атомы или
ции радикалов. Роль антиоксидантной защиты
молекулы, имеющие неспаренный электрон, ко-
выполняют биокатализаторы: супероксиддисму-
торый определяет их высокую нестабильность и
таза, каталаза, глутатионзависимая пероксидаза,
активность, связанную со стремлением радика-
трансфераза, которые понижают негативное воз-
лов захватить или отдать лишний электрон. В
действие радикалов путем удаления перекисных
биологических объектах различают природные и
соединений. В настоящее время выделено боль-
чужеродные радикалы. Известно, что чужерод-
шое число фенольных соединений, которые об-
ные радикалы на основе кислорода образуются в
ладают антиоксидантными свойствами, напри-
результате физического или химического воздей-
мер, витамины Е (α-токоферол), К1 (филлохи-
ствия на клетки живых организмов. Радикалы по-
вреждают аминокислоты и белки, дезорганизуют
нон) и К2 (менахинон), убихиноны, триптофан,
клеточные структуры и биологические мембра-
фенилаланин, а также значительное количество
ны. Доказана роль чужеродных свободных ради-
растительных и животных пигментов: каротино-
калов в развитии таких болезней, как рак, атеро-
иды, флавоноиды, фенолкарбоксильные кислоты
склероз, инфаркт миокарда, инсульт, ишемия;
[3]. Механизм антиоксидантной защиты сводит-
заболеваний нервной и иммунной систем, лег-
ся к их взаимодействию со свободными радика-
ких, печени, почек, крови, кожи; также они вы-
лами и превращению последних в неактивные
зывают преждевременное старение [1, 2].
молекулы, обеспечивая таким образом обрыв це-
пи свободнорадикального окисления.
Для снижения агрессивного влияния радика-
В отличие от чужеродных радикалов, в живых
лов на организм человека и животных в биологи-
системах преобладают природные радикалы [4],
ческих объектах имеются специализированные
которые образуются в результате ферментатив-
ферментные системы, а также природные биоор-
ных реакций и выполняют ключевую роль в про-
ганические соединения и синтетические соеди-
цессах жизнедеятельности клеток: в реакциях
Сокращения: ADH
- алкогольдегидрогеназа, LDH
-
биосинтеза, окислительного фосфорилирования,
лактатдегидрогеназа.
регуляции липидного обмена, процессах митоза,
691
692
ШАПОВАЛОВ и др.
метаболизма и др. Ежесуточно каждая клетка ге-
Важнейшая роль в транспорте окислительно-
нерирует миллионы соединений, обладающих
восстановительных эквивалентов в мембранах
естественной радикальной природой, которые
митохондрии и хлоропластах отводится мобиль-
участвуют в жизненно важных одноэлектронных
ному небелковому переносчику - убихинону (ко-
биохимических процессах, связанных с отдачей
ферменту Q6 и Q10). Убихинон (CoQ) имеет
или приобретением электронов. Существенную
структуру хинона, он широко распространен в
роль в радикальных окислительно-восстанови-
митохондриальной мембране. Известно, что же-
тельных реакциях клетки выполняют кофермен-
лезо-серные центры биокатализаторов передают
ты NAD, NADP, FAD, FMN, CoQ и др., которые
электроны коферменту Q. В процессе восстанов-
являются акцепторами электронов для одной
ления кофермент Q изменяет свою химическую
группы ферментов в полиферментном комплексе
структуру через форму свободного радикала - се-
и донорами для другой. Коферменты способны
михинона [6]. Принимая при этом один элек-
образовывать промежуточные радикальные
трон, убихинон приобретает радикальную форму
структуры и комплексы с переносом заряда в био-
коэнзима Q, образуя полувосстановленную фор-
логических мембранах, обеспечивая перенос
му - убисемихинон-радикал. Второй электрон
энергии и транспорт электронов. При этом вос-
переводит этот радикал в полностью восстанов-
становление и окисление метаболитов сопровож-
ленный гидрохинон.
дается циклической ферментативной регенера-
На основании вышеизложенного можно за-
цией коферментов. Основными из ряда перенос-
ключить, что коферменты в клетках образуют вы-
чиков redox-эквивалентов
(протонов
и
сокоактивные промежуточные свободные ради-
электронов) в клетках являются коферменты
калы в виде хиноидов и семихинонов, которые
NAD, NADP, FAD, FMN, CoQ. Установлено, что
участвуют в ферментативных окислительно-вос-
в молекулах NAD и NADP в каталитическом акте
становительных реакциях. Приобретая электрон
участвует никотинамидный нуклеотид. Во мно-
и протон от субстрата, кофермент восстановлива-
гих биохимических redox-реакциях никотина-
ется и, обратно, при отдаче электрона и протона
мидный нуклеотид NAD и NADP восстанавлива-
наблюдается его окисление. Перенос энергии и
ется либо окисляется с присоединением или от-
электронов в фермент-кофакторный комплекс
дачей электронов и протонов. Реакция протекает
возможен через систему образования комплексов
через две одноэлектронные стадии, образуя про-
с переносом заряда.
межуточный свободный радикал NAD·.
В работе рассматриваются вопросы о роли при-
Коферменты FAD, FMN, а также их предше-
родных радикалов коферментов в окислительно-
восстановительных биокаталитических реакциях и
ственник рибофлавин (витамин В2) имеют
в процессах, связанных с переносом энергии и
изоаллоксазиновую гетероциклическию систему,
электронов в активный центр окисидоредуктаз с
участвующую в окислительно-восстановитель-
участием липидо-каротиноидной структуры клет-
ных ферментативных процессах. Восстановление
ки. Приводятся данные по ориентации оксидоре-
изоаллоксазинового кольца протекает в две ста-
дуктаз: алкогольдегидрогеназы (ADH) и лактатде-
дии. На первой в результате переноса электрона
гидрогеназы (LDH) на электропроводном обрат-
образуется свободный радикал семихинон, кото-
нофазовом сорбенте, моделирующим гидро-
рый затем присоединяет второй электрон, пере-
фобный монослой биологической мембраны.
ходя в восстановленную форму кофермента.
Отличительным признаком FAD по отноше-
МАТЕРИАЛЫ И МЕТОДЫ
нию к FMN является наличие дополнительной
В экспериментальной работе использовали
гетероциклической системы - аденина, присо-
фермент алкогольдегидрогеназу (КФ 1.1.1.1) из
единенного к изоаллоксазиновому нуклеотиду
печени лошади, коферменты - динатриевую соль
гибкой пирофосфатной цепью. Исследования
восстановленного никотинамидадениндинук-
флюоресценции FAD показали, что в водных рас-
леотида (NADН-Na2) 80%-й чистоты с молеку-
творах изоаллоксазиновый и адениновый нук-
леотиды кофермента располагаются параллельно
лярной массой 709,43 и окисленный никотина-
друг другу, вследствие чего наблюдается сильное
мидадениндинуклеотид (NAD+) 85%-й чистоты с
тушение флюоресценции кофермента. Это стало
молекулярной массой 663,45 (Merck, США). До-
основанием для предположения об образовании
полнительную очистку ADH и кофермента NAD
комплексов с переносом заряда между аденино-
осуществляли, используя карбоксиметил- и
вым и изоаллоксазиновым нуклеотидами [5]. Су-
ДЭАЭ-целлюлозу, а также сефадексы G-10 и
ществование комплексов с переносом заряда в
G-200 (Pharmacia, Швеция). Также в работе ис-
FAD объясняют гидрофобным взаимодействием
пользовали β-каротин; кардиолипин и ликопин
нуклеотидов и их параллельным расположением
(Sigma, США). Для получения обратнофазового
в молекуле.
сорбента применяли линолевую, линоленовую и
БИОФИЗИКА том 65
№ 4
2020
РАДИКАЛЫ В СТРУКТУРАХ КЛЕТКИ
693
олеиновую кислоты, глицерин, трех- и пятихлор-
тельно отмывали водой и высушивали. Окислен-
истый фосфор, хлористый тионил, N,N-диме-
ный уголь активировали треххлористым фосфо-
тилформамид, пиридин, одно- и двухзамещен-
ром при 20°С в течение 5-6 ч при периодическом
ный фосфат натрия, хлорид натрия, этанол, лак-
перемешивании, а затем отмывали обезвожен-
тальдегид,
хлороформ,
четыреххлористый
ным четыреххлористым углеродом или хлоро-
углерод, бикарбонат натрия, азотную и серную
формом.
кислоты, гидрат окиси натрия. Все реактивы -
Связывание глицерина осуществляли по следу-
производства компании «Химмед» (Россия), име-
ющей методике. К 10 г активированного сорбента
ли квалификацию «х.ч.».
приливали смесь обезвоженного глицерина
Количество фермента и кофермента определя-
(1 мл), N,N-диметилформамида (2 мл), хлорофо-
ли на спектрофотометре СФ-56 («ЛОМО», Рос-
ма (15 мл) и пиридина (5 мл). Смесь перемешива-
сия). При препаративной очистке использовали
ли при 20°С в течение 2 ч. Раствор сливали, а но-
жидкостной хроматограф Agilent 1260 Infinity Pre-
ситель последовательно промывали на фильтре
parative Scale (Agilent, США). Удельную поверх-
Шотта хлороформом, серным эфиром, 0.5 н сер-
ность сорбентов определяли, используя Surfer
ной кислотой, 5%-м раствором бикарбоната на-
Gas Adsorption Porosimeter (Thermo Scientific,
трия и дистиллированной водой, затем высуши-
Италия). Экспериментальные исследования об-
вали.
разования комплекса с переносом заряда между
Получение хлорангидридов жирных кислот. В
β-каротином и кардиолипином или лецитином
трехгорлую колбу емкостью 100 мл с обратным
осуществляли спектрофотометрическим методом
холодильником приливали 10 мл охлажденной
на спектрофотометре Specord 200 Plus (Analytik
смеси олеиновой и линолевой кислот (1 : 1.25). В
Jena, Germany), формирование мицелл или липо-
эту смесь по каплям в течение 3 ч при перемеши-
сом проводили с помощью ультразвукового гомо-
вании добавляли 22 мл свежеперегнанного тио-
генизатора Sonopuls HD 2070 (Bandelin, Герма-
нилхлорида, охлаждая реакционную смесь холод-
ния). В электрохимических исследованиях ис-
ной проточной водой. По завершении реакции
пользовали потенциостат-гальваностат Р-20Х
избыток тионилхлорида отгоняли при 75-80°С, а
(«Electrochemical Instruments», Черноголовка
продукт очищали перегонкой при 136°С и давле-
Московской области). Буферные растворы и сме-
нии 1.5-2.0 мм рт. ст.
си прокачивали через проточные спектрофото-
Связывание хлорангидридов жирных кислот с
метрические и электрохмические ячейки пери-
модифицированными носителями. В круглодонную
стальтическими насосами Zalimp-305 и Unipan-
колбу помещали 5 мл хлорангидридов жирных
304 (Польша). Очистку и выделение ферментов и
кислот и 45 мл хлороформа, не содержащего во-
кофементов проводили на центрифуге К-24
ды, затем добавляли 20 г углеродного сорбента с
(MLW, Германия).
«пришитым» глицерином, после чего раствор с
Получение обратнофазового сорбента. Размель-
сорбентом перемешивали в течение 2 ч при ком-
ченный спектральный уголь фракционировали,
натной температуре. Выделяющийся в процессе
используя лабораторные сита. Фракцию с разме-
реакции газообразный хлористый водород удаля-
рами частиц 0.2-0.3 мм обрабатывали концен-
ли, используя водоструйный насос; растворитель
трированной азотной кислотой в колбе с обрат-
отделяли на фильтре Шотта, а сорбент промыва-
ным холодильником. Окисление проводили при
ли хлороформом в аппарате Сокслета. Контроль
температуре кипения кислоты в течение 6 ч с по-
за степенью отмывки обратнофазового сорбента
стоянным перемешиванием. Затем сорбент отде-
осуществляли спектрофотометрически в интер-
ляли от раствора и многократно промывали ди-
вале длин волн 200-350 нм. Носитель отмывали
стиллированной водой до отсутствия кислой ре-
дистиллированной водой, высушивали и исполь-
акции. Отмытый носитель высушивали при
зовали для исследований сорбции кофермента
120°С. Полученный карбоксилированный уголь
НАД и фермента ADH.
включал поликарбоновые кислоты, в частности
Сорбция кофермента NAD и апофермента алко-
меллитовую кислоту, прочно удерживаемую сор-
гольдегидрогеназы. Сорбцию очищенных апофер-
бентом в водных растворах при рН 1.0-8.0. Для
мента и кофермента изучали в термостатируемых
получения углеродного носителя, не содержаще-
ячейках при 25.0 ± 0.2°С при постоянном переме-
го сорбированных поликарбоновых кислот, обра-
шивании магнитной мешалкой со скоростью
ботанный уголь экстрагировали 96%-м этиловым
600 об/мин. Величина навески носителя (на абсо-
спиртом в аппарате Сокслета. Контроль за степе-
лютно сухой вес) была равна 0.1000 г, пределы ис-
нью отмывки носителя осуществляли спектрофо-
ходных концентраций белка и кофермента соста-
тометрически в интервале длин волн 200-350 нм.
Сорбент фильтровали и промывали дистиллиро-
вили 2.4 · 10-6-7.3 · 10-6 М и 4.5·10-5-5.6 · 10-4 М
ванной водой с последующей обработкой 0.1 н
соответственно. Для каждого опыта брали по 5 мл
раствора гидроокиси натрия при температуре
исследуемых растворов, пробы на анализ отбира-
96°С в течение 1 ч. Полученный носитель тща-
ли в течение 1-2 с, а их объем как правило не пре-
БИОФИЗИКА том 65
№ 4
2020
694
ШАПОВАЛОВ и др.
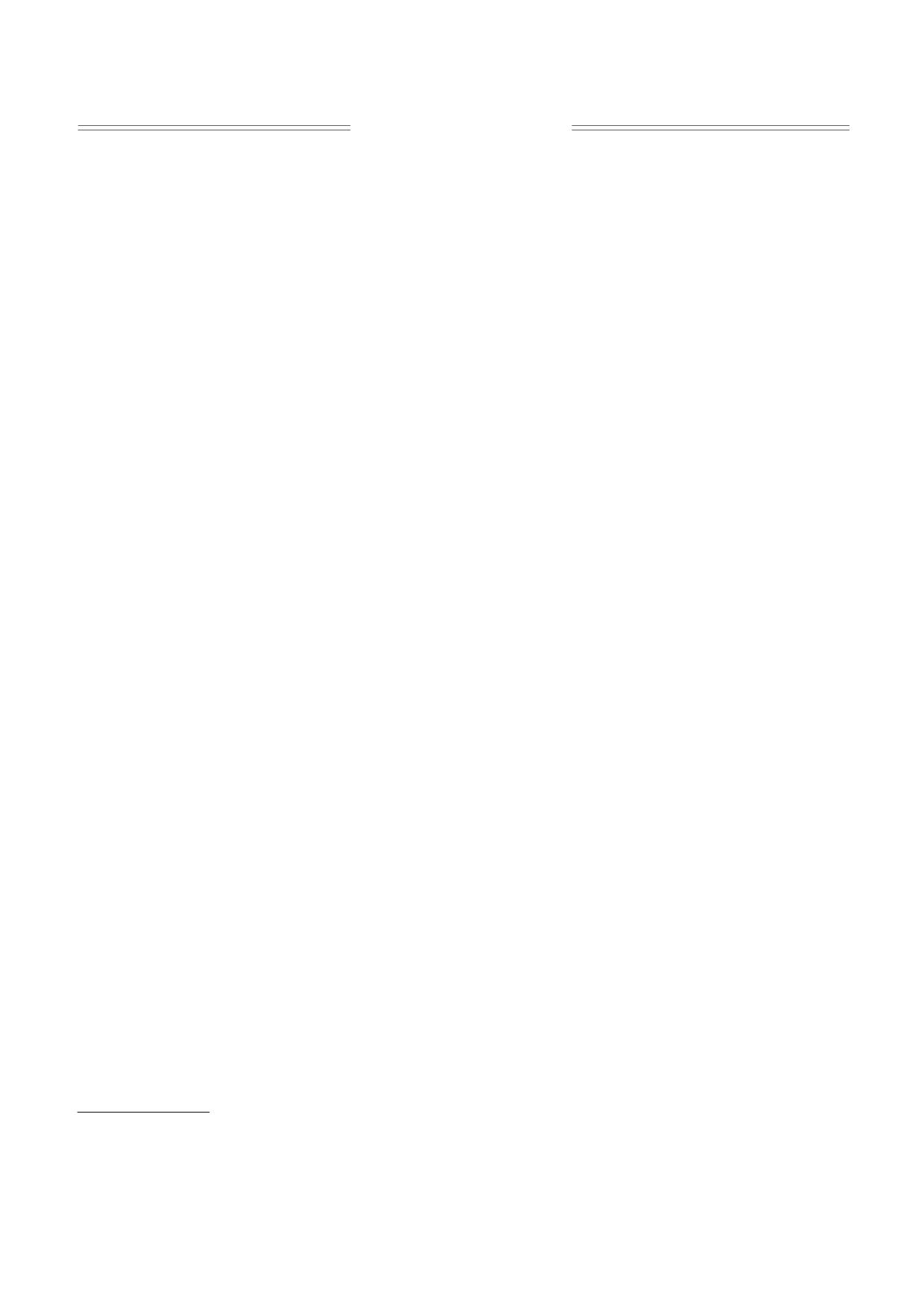
3.0
мобилизации NAD необходимо было экспери-
ментально изучить кинетику сорбции, обрати-
мость сорбционных процессов и, наконец, опре-
2
делить оптимальные условия осуществления
иммобилизации.
2.0
1
Сорбция кофермента NAD на обратнофазовом
углеродном сорбенте. Результаты кинетических
исследований сорбции окисленной формы
NAD+ на гидрофобонизированном угле при ин-
1.0
тенсивном перемешивании показали, что сорб-
ция завершается практически в течение 60 мин.
Полученные изохроны сорбции свидетельствова-
ли о необратимом характере сорбции NAD+ на
0.0
гидрофобонизированном угле. Обратные ветви
0.0
0.5
1.0
1.5
2.0
изохрон указывали на прочную иммобилизацию
С, мг/мл
кофермента и невозможность снятия его с сор-
бента раствором, в котором осуществляли сорб-
Рис. 1. Изохрона сорбции ADH на гидрофобонизиро-
ванном угле: 1 - сорбционная ветвь, 2 - десорбцион-
цию кофермента. Попытки десорбировать иммо-
ная ветвь. Условия эксперимента: навеска 0.1 г, кон-
билизованный NAD даже 4 М раствором хлори-
центрация буферного раствора 0.015 М, объем 5.1 мл,
стого натрия, а также при изменении рН раствора
скорость перемешивания 600 об/мин, температура
в диапазоне 5.0-9.0 не приводили к заметной де-
25°С.
сорбции кофермента, что указывало на гидро-
фобное взаимодействие кофермента на поверх-
ности углеродного модифицированного носите-
вышал 10% от начального объема раствора. Кон-
центрацию ADH определяли флуоресцентным
ля. Результаты проведенных исследований
методом при λ = 310 нм, затем пробы возвращали
показали необратимый характер сорбции NAD на
гидрофобном носителе, которую нельзя рассмат-
обратно в ячейку. Концентрации окисленной и
ривать с позиции равновесных представлений.
восстановленной форм NAD определяли при
λ = 260 и 340 нм соответственно. Анализ осу-
Сорбция апофермента ADH на обратнофазовом
ществляли в кварцевой кювете объемом 0.5 мл.
сорбенте. Аналогичные исследования сорбции
До проведения анализа проверяли соблюдение
были проведены для зависимого от кофермента
линейной зависимости флуоресценции, а также
NAD апофермента ADH. Сорбционная иммоби-
оптической плотности растворов NAD от кон-
лизация ADH на гидрофобной матрице осу-
центрации в области рабочих концентраций. Ко-
ществлялась за счет водородного, гидрофобного
личество сорбированного белка и кофермента
и электростатического взаимодействия. При этом
определяли по разности исходного и оставшегося
не исключалась возможность многоточечного
к моменту отбора пробы количества сорбата в
ориентированного контакта белковой глобулы с
растворе. Каждая точка на кривой являлась сред-
поверхностью матрицы сорбента. Для определе-
ним результатом трех-четырех экспериментов.
ния параметров иммобилизации ADH изучали
кинетику сорбции фермента. Результаты сорбции
фермента на гидрофобонизированном угле пока-
РЕЗУЛЬТАТЫ
зали, что процесс сорбции протекает от одного до
Иммобилизация фермент-кофакторного ком-
двух часов, не достигая равновесия. На неравно-
плекса ADH-NAD на модифицированных электро-
весный характер сорбции белка ADH на гидрофо-
проводных углеродных носителях. Для иммобили-
бонизированном угле указывало также несовпа-
зации фермент-кофакторной системы ADH-
дение сорбционных и десорбционных ветвей изо-
NAD был применен метод сорбционного связы-
хроны (рис. 1). Сорбция белков на сорбентах
вания на угле с привитыми углеводородными це-
зависит от рН раствора, свойств ионогенных
пями, моделирующими липидный монослой.
групп ионита, ионной силы используемого фоно-
Принимая во внимание предложенный метод им-
вого раствора. В качестве буферных растворов
мобилизации, который заключался в последова-
при изучении влияния рН среды на сорбцию
тельной сорбции кофермента и апофермента,
ADH мы использовали 0.015 М фосфатный бу-
проводили исследования сорбции каждого ком-
ферный раствор с рН 6.0-8.4 и 0.015 М карбонат-
понента ферментативной системы в отдельности.
ный буфер с рН 8.0-10.0. Выбор диапазона рН
Образование фермент-кофакторного комплекса
фонового раствора при исследовании сорбции
осуществляли по принципу «самосборки» из от-
АА-изоформы ADH определялся устойчивостью
дельных компонентов ферментативной системы.
фермента в этой области рН и проявляемой им
Для проведения исследований сорбционной им-
максимальной ферментативной активности. Из-
БИОФИЗИКА том 65
№ 4
2020
РАДИКАЛЫ В СТРУКТУРАХ КЛЕТКИ
695
вестно [7], что ниже рН 5.9 фермент инактивиру-
K, мг/г
ется, а наибольшую активность АА-изоформа
ADH проявляет при рН 10.0 [8]. Для гидрофобо-
2.0
низированного угля в этом диапазоне рН не отме-
чалось какого-либо изменения сорбции, что
можно объяснить гидрофобной природой связы-
вания фермента с носителем (рис. 2). Другим
фактором, подтверждающим наличие многото-
1.0
чечных гидрофобных связей, является то, что при
попытке десорбировать иммобилизованную
ADH водными растворами сорбированный
белок не удалось обнаружить в растворе, тогда
0.0
как 50%-й раствор этанола легко и практически
6
8
10
pH
полностью десорбировал фермент. Сорбцию
ADH проводили из 0.015 М фосфатного буферно-
Рис. 2. Зависимость коэффициентов распределения
го раствора с рН 7.8 при перемешивании в тече-
ADH между гидрофобным углем и буферным
ние 2 ч при концентрации ADH от 1.35 · 10-7 до
раствором от рН.
1.08 · 10-6 М растворов. Количество сорбирован-
ного апофермента находилось в пределах 1.0-
личество сорбированного кофермента и фермен-
3.0 мг/г. Каталитическая активность фермента-
та составляло 1.1 мг/г и 6.42 мг/г (массовое соот-
тивной системы оставалась практически неиз-
ношение 1 : 6) соответственно, а удельная актив-
менной при комнатной температуре в течение
ность полученной системы - 0.012 Е/г. Для
180 ч.
полученного массового соотношения возникает
Следует отметить, что при сорбции ADH на уг-
вопрос о структуре молекулярного комплекса
леродных сорбентах, как и в случае кофермента
ADH-NAD. Известно, что в комплексе на одну
существенную роль играют гидрофобные взаимо-
молекулу ADH, содержащую два активных цен-
действия. Об этом свидетельствует прочное удер-
тра, приходится две молекулы кофермента NAD.
живание фермента при высоких концентрациях
Из полученных экспериментальных данных мож-
хлористого натрия (вплоть до 2 М) в фосфатном
но рассчитать, что количество сорбированного
буферном растворе, а также результаты десорб-
кофермента на порядок больше его количества,
ции фермента спиртом. С увеличением концен-
необходимого для образования комплекса. При
трации спирта до 50% десорбция фермента в ре-
последовательной сорбции NAD, а затем ADH
зультате разрушения гидрофобных связей растет.
происходит перераспределение кофермента меж-
Дальнейшее увеличение концентрации спирта
ду сорбентом и активными центрами биокатали-
ведет к уменьшению десорбции, что, по-видимо-
затора. В связи с последним часть молекул кофер-
му, связано с противодействующим влиянием
мента NAD оказывается в активном центре фер-
высаливающего эффекта. Значительная денату-
мента, тогда как другая была сорбирована
рация иммобилизованной ADH наблюдается при
носителем. Таким образом, массовое соотноше-
концентрации спирта выше 70%.
ние не имеет прямого отношения к составу ком-
плекса.
Формирование биокаталитического комплекса
ADH-NAD на углеродном электропроводном носи-
При сорбции фермент-кофакторной системы
теле. Ввиду необратимости сорбционных процес-
в последовательности ADH-NAD количество
сов, следует ожидать влияния последовательно-
сорбированных кофермента и фермента соответ-
сти проведения сорбции компонентов на конеч-
ствовало 0.50 и 3.56 мг/г, удельная активность со-
ное состояние сорбционного комплекса системы
ставляла 0.0083 Е/г. Как видно из приведенных
и проявляемую им каталитическую активность.
данных, активность системы, полученной по пер-
Экспериментально было изучено влияние после-
вому способу, примерно в полтора раза выше, чем
довательности сорбции на гидрофобонизирован-
по второму.
ном угле ADH и NAD на активность иммобили-
зованной фермент-кофакторной системы. Сорб-
Повышенную активность систем, полученных
ция фермента и кофермента осуществлялась в
при сорбции в последовательности NAD-ADH,
идентичных условиях при рН 7.8 из 0.015 М фос-
нельзя однозначно объяснить стерическими осо-
фатного буфера. Фермент сорбировали из раство-
бенностями иммобилизованного фермент-ко-
ра с концентрацией 3 мг/мл, а кофермент NADН -
факторного комплекса, так как повышение ак-
0.79 мг/мл при соотношении сорбент : раствор,
тивности может быть связано с повышением кон-
равном 1 : 10. Было установлено, что при «сбор-
центрации кофермента и фермента на
ке» иммобилизованной фермент-кофакторной
поверхности носителя. Тем не менее из сообра-
системы в последовательности NADН-ADH ко-
жений стерического блокирования NAD в ката-
БИОФИЗИКА том 65
№ 4
2020
696
ШАПОВАЛОВ и др.
COOH
COCl
PCl3
COCl
COO CH CHOH CH OH22
+ HOCH2
CHOH CH OH2
HCl
COO CH CHOH CH OH22
COO CH2 CH CH2OCO (CH2)n CH3
+ 2Cl CO (CH )n CH23
2HCl
OCO (CH )n CH23
Рис. 3. Схема синтеза обратнофазового сорбента.
литической щели апофермента целесообразно
ние такого электропроводного гидрофобного
осуществлять сначала сорбцию кофермента, а за-
сорбента, моделирующего монослой биологиче-
тем фермента. Различия в количествах сорбиро-
ских мембран на углеродной матрице, приводит-
ваных фермента и кофермента при изменении
ся на рис. 3. Оптимальной считается ориентация
последовательности сорбции объясняются тем,
фермента на гидрофобном сорбенте, когда ко-
что при предварительной сорбции NAD происхо-
фермент блокирован носителем в каталитиче-
дит существенное изменение свойств поверхно-
ской щели апофермента, обеспечивая тем самым
сти сорбента, в частности, увеличивается ее отри-
эффективную регенерацию кофермента и высо-
цательный заряд, что при рН 7.8 < рI 8.7 означает
кую биокаталитическую активность иммобили-
усиление электростатического взаимодействия
зованной фермент-кофакторной системы.
положительно заряженного белка с сорбентом.
На примере ADH нами была рассмотрена по-
Подобная модификация сорбента низкомолеку-
луэмпирическая модель взаимодействия белко-
лярными органическими соединениями (хотя и
вой глобулы с электронейтральной гидрофобной
не ионного характера) широко используется на
поверхностью [9]. Ввиду того, что глобула фер-
практике для ориентированной иммобилизации
мента представляет собой сложную систему, рас-
ферментов, управляемой гидрофобными взаимо-
чет ее сорбционных характеристик с помощью
действиями. Уменьшение сорбции NADН после
метода атом-aтомных потенциалов представляет-
сорбции ADH, по-видимому, связано с блокиро-
ся нецелесообразным. Поэтому энергию взаимо-
ванием белком гидрофобной поверхности сор-
действия (Fsorb) ADH с обратнофазовым сорбен-
бента.
том рассчитывали по аддитивной схеме, исходя
Полученные результаты сорбции ADH и NAD
из экспериментальных данных по взаимодей-
на обратнофазовом углеродном носителе указы-
ствию аминокислот и пептидов с гидрофобным
вают на прочную необратимую сорбцию фер-
сорбентом [10], в соответствии с уравнениями 1
мент-кофакторного комплекса на матрице сор-
и 2:
бента за счет гидрофобного связывания. Катали-
i
тическая активность комплекса существенно
F
F
,
(1)
зависит от последовательности формирования
sorb
=
solv,
i
i=1
ферментативной системы. Наибольшую актив-
ность биокаталитический комплекс проявляет
Fsolv = FiΔLi/Li,
(2)
при последовательной сорбции сначала кофер-
где Fsolv,i - энергия гидрофобного взаимодействия
мента, а затем апофермента.
i-го радикала; n - число радикалов; Fi - энергия
взаимодействия i-го аминокислотного радикала
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
при его полном погружении в гидрофобный слой
сорбента; ΔLi -длина участка радикала, погру-
Исследование ориентации алкогольдегидрогена-
женного в гидрофобный слой при данной ориен-
зы и лактатдегидрогеназы на обратнофазовых сор-
тации глобулы белка; Li - длина радикала.
бентах. Практический интерес представляет ори-
ентация глобулярных белков на обратнофазовых
При расчете энергии гидрофобного взаимо-
матрицах за счет сил гидрофобного взаимодей-
действия использовали значения относительных
ствия. В качестве носителей могут быть использо-
свободных энергий F/RT взаимодействия амино-
ваны электропроводные углеводородные сорбен-
кислотных радикалов с обратнофазовыми сор-
ты или их модифицированные формы. Получе-
бентами (таблица).
БИОФИЗИКА том 65
№ 4
2020
РАДИКАЛЫ В СТРУКТУРАХ КЛЕТКИ
697
Значения F/RT для аминокислотных радикалов [10]
Asp
Glu
Tyr
Ser
Met
Trp
Phe
0,173
0,173
-0,694
0,106
-0,449
-1,758
-1,085
Val
Leu
Ile
Gly
Ala
Pro
His
0,288
-0,485
-0,485
0,040
-0,097
-0,197
-0,149
Lys
Arg
Gln
Asn
Cys
-0,554
-0,197
-0,108
-0,108
0,090
Полученные в результате расчета данные
вием сохранения физиологической активности
представлены в виде перспективной азимуталь-
иммобилизованных биокаталитических систем,
ной ортографической проекции уровней взаимо-
включающих кофактор, является его нативное
действия белковой глобулы при различных на-
расположение в активном центре апоферментов.
правлениях касания с гидрофобной плоскостью
Представлялось интересным рассмотреть, как
(рис. 4).
другие NAD-зависимые дегидрогеназы, обладаю-
Из приведенных данных видно, что глобула
щие трехмерной гомологией с ADH, будут ориен-
ADH имеет четыре области наиболее вероятной
тироваться в липофильном слое биологической
гидрофобной атаки сорбционной плоскости. При
мембраны. Для решения поставленной задачи ис-
этом две из них находятся близко друг от друга на
пользовали лактатдегидрогеназу акулы, для кото-
экваторе глобулы (Δφ = 18) и лежат между двумя
рой известна пространственная структура [11, 12].
коферментными щелями фермента. Если гидро-
Молекула LDH состоит из четырех симметрич-
фобная поверхность представляет собой не плос-
ных субъединиц, каждая из которых имеет 331
кость, а цилиндрическую или сферическую пору
аминокислоту. В работе [12] координаты α-С-
с R ≈ 28.0 нм, то осуществляется одновременная
атомов аминокислот приводятся для стандартной
гидрофобная атака по этим двум основным на-
«красной» субъединицы. Координаты других
правлениям и их равнодействующая по направле-
субъединиц рассчитываются путем вращения
нию совпадает с осью «у». При этом в силу сим-
«красной» субъединицы вокруг осей P, Q, R. Ко-
метрии молекулы фермента обе коферментные
ординаты «голубой» субъединицы получали вра-
щели расположены строго симметрично отно-
щением «красной» субъединицы вокруг оси Р,
сительно направления наиболее вероятной гид-
«желтой» - вокруг оси Q и «зеленой» - вокруг
рофобной атаки. Доступность же субстратных
оси R. В связи с этим программа расчета энергии
щелей для этанола максимальна. Важным усло-
взаимодействия белковой глобулы с гидрофоб-
1
2
3
4
Рис. 4. Перспективная азимутальная ортографическая проекция уровней гидрофобности ADH: 1 - 5 < F/RT < 10, 2 -
10<F/RT < 20, 3 - 20 < F / RT < 30, 4 - F/RT > 30; «меридианы» и «параллели» проведены через 9° [9].
БИОФИЗИКА том 65
№ 4
2020
698
ШАПОВАЛОВ и др.
1
2
3
4
Рис. 5. Перспективная азимутальная ортографическая проекция уровней гидродрофобности поверхности LDH: 1 -
0 < F/RT < 1; 2 - 1 < F/RT < 2; 3 - F/RT > 2;, 4 - гидрофильная область.
ной поверхностью включала преобразование ко-
ление уровней энергии гидрофобного связыва-
ординат с установлением пространственного рас-
ния глобулы LDH на поверхности полусферы,
приведенной со стороны одного из полюсов мо-
положения 1324 α-С-атомов четырех субъединиц
лекулы белка. Из рисунка видно, что LDH на эк-
LDH. Результаты расчета ориентации LDH на
ваторе имеет два участка (полосы), где белковая
гидрофобной поверхности в виде перспективной
глобула проявляет гидрофильные свойства при
азимутальной ортографической проекции приве-
различных направлениях касания с гидрофобной
дены на рис. 5. На рис. 6 представлено распреде-
поверхностью. Четыре активных центра биоката-
лизатора находятся на двух противоположных
полюсах (по два на каждом) в области максималь-
ной энергии гидрофобного связывания, которые
на рис. 5 и 6 обозначены черным цветом. При
сорбции LDH на гидрофильных сорбентах моле-
кула апофермента будет сориентирована эквато-
ром к поверхности, обеспечивая свободный до-
ступ субстратов и коферментов к четырем актив-
ным центрам биокатализатора, расположенным
на полюсах молекулы фермента.
При сорбции LDH на гидрофобной поверхно-
сти будет наблюдаться связывание, при котором
один из полюсов с двумя активными центрами
будет сориентирован к гидрофобной поверхно-
сти, тогда как другой направлен в противополож-
ную от носителя сторону. Такой тип ориентиро-
ванной посадки молекулы белка в гидрофобном
слое мембраны обеспечивает блокирование NAD
в активном центре апофермента, сохраняя при
этом активность фермент-кофакторной системы.
Этот тип ориентации белков на гидрофобных
сорбентах в дальнейшем будет использован при
Рис. 6. Распределение уровней энергии гидрофобно-
иммобилизации фермент-кофакторных систем
го связывания LDH на поверхности полусферы.
на гидрофобных электропроводных носителях.
БИОФИЗИКА том 65
№ 4
2020
РАДИКАЛЫ В СТРУКТУРАХ КЛЕТКИ
699
Транспорт электронов и протонов в биологиче-
Представленные на этой схеме ферментативные
ских структурах с участием радикалов. Функцио-
реакции, протекающие в биологических мембра-
нирование коферментов в настоящее время еще
нах, возможны благодаря аналогии каталитиче-
полностью не изучено. Восстановление и окисле-
ских щелей апоферментов, а также подобию в
ние метаболитов сопровождается циклической
фиксации коферментов в активном центре и
ферментативной регенерацией. Общий ради-
строгой ориентации фермент-кофакторных ком-
кальный механизм биокаталитических процес-
плексов. Наибольшее сходство было обнаружено
сов, происходящих в полиферментном комплек-
се биологических мембран клетки и сопровожда-
для NAD-связывающих областей, что подтвер-
ющихся переносом redox-эквивалентов, можно
ждает аналогичность способов фиксации кофак-
представить в виде следующей схемы (схема 1).
тора в коферментсвязывающей щели.
Схема 1. Общий радикальный механизм биокаталитических процессов, происходящих в полиферментном комплексе
биологических мембран клетки. Е1, Е2…Еn и É1, É2…Én - ферменты, участвующие в восстановлении и окислении суб-
стратов S1,S2…Sn и Ś1Н, Ś2Н…ŚnН соответственно; ·СoQ- и ·СoQ·Н- - анион-радикал и убисемихинон радикала ко-
фермента Q, соответственно; РН1, РН2…РНn и Ṕ
1, Ṕ2…Ṕn - продукты ферментативных реакций.
Исследования аминокислотной последова-
тельности и пространственной структуры фер-
ментов: ADH печени человека и лошади, LDH
собаки и акулы, глицеральдегид-3-фосфатдегид-
рогеназы кальмара, свиньи и дрожжей привели к
выводу о существовании трехмерной гомологии
Схема 2. Последовательные радикальные реакции
NAD-зависимых дегидрогеназ [13, 14]. Представ-
при трансмембранном переносе протонов.
ленная схема 1 показывает, каким образом в клет-
Как видно из схемы 2, коэнзим Q восстанавли-
ке возможен радикальный механизм реализации
вается по одноэлектронному механизму, образуя
переноса протонов и электронов через биологи-
полувосстановленную форму - убисемихинон-
радикал.
ческие мембраны.
К группе переносчиков энергии и электронов,
Анион-радикал кофермента Q (·CоQ-), лока-
широко распространенных в растительном и жи-
лизованного в жидкокристаллической структуре
вом мире, можно отнести природные
биомембраны, восстанавливается в результате
органические пигменты - каротиноиды, имею-
ферментативной реакции É1 до убисемихинон-
щие сопряженную систему связей. В настоящее
время известно более 800 видов структурно раз-
радикала (·СoQ·Н-), присоединяя протон. Суб-
личающихся каротиноидов [15, 16]. По химиче-
страт S1′H в матриксе митохондрии окисляется
скому строению каротиноиды делят на две груп-
при этом до Р1′. Ферментативная регенерация ко-
пы: каротины (углеводороды) и ксантофиллы
(каротиноиды, содержащие кислород). Боль-
фермента ·CоQ- происходит при миграции его к
шинство каротиноидов содержат 40 углеродных
другой биокаталитической системе E1. При этом
атомов, имеют сопряженные двойные связи. Бла-
субстрат S1, находящийся в межмембранном про-
годаря наличию ненасыщенных сопряженных
странстве, например, митохондрии, восстанавли-
(конъюгированных) связей каротиноиды имеют
вается до PН1.
вытянутую светочувствительную «проволочную»
структуру, благодаря которой способны выпол-
Трансмембранный перенос протонов, сопро-
нять функцию переносчиков энергии и электро-
вождающийся ферментативной регенерацией ко-
нов. Каротиноиды встречаются как в свободном
фермента, может быть описан рядом последова-
состоянии, так и в виде гликозидов; они способ-
тельных радикальных реакций (схема 2):
ны нековалентно связываться с белками, кофак-
БИОФИЗИКА том 65
№ 4
2020
700
ШАПОВАЛОВ и др.
(а)
(б)
Рис. 7. Химические структуры β-каротина (a) и ликопина (б).
торами и мембранными липидами. Электроны
каротиноидов легко переходят в возбужденное
состояние при попадании даже небольшого коли-
чества квантов света. Ряд каротиноидов способен
Схема 3. Физический механизм антиоксидантного
образовывать комплексные соединения с такими
действия каротиноидов.
металлами, как Ca2+, Cu2+, Pb2+, Zn2+, Cd2+ и
Химический механизм «тушения» предполага-
Hg2+ [17]. Образование металл-хелатного ком-
ет окисление каротиноидов синглетным кисло-
плекса не только изменяет спектр поглощения
родом с образованием различных альдегидов и
эндопероксидов [18, 19]. Образующиеся при этом
каротиноидов, но и повышает его способность к
продукты окисления каротиноидов могут играть
перехвату свободных радикалов.
важную роль в регуляции развития растений [20].
Каротиноиды в основном локализуются в ли-
Взаимодействие каротиноидов со свободными
пофильной области биологических мембран, об-
радикалами зависит главным образом от характе-
разуя стабильные каротинобелковые комплексы,
ра свободных радикалов, а не от типа каротинои-
они модулируют физические свойства мембран,
да [18]. Каротиноиды могут взаимодействовать со
расширяя диапазон фазового перехода из состоя-
свободными радикалами (·R) тремя способами,
ния геля в жидкокристаллическую структуру.
причем во всех трех случаях образуются радикалы
Длинные сопряженные углеводородные цепи ка-
каротиноидов [18]:
ротиноидов заканчиваются кольцевой иононо-
1. Взаимодействие с полиеновой структурой
вой структурой (рис. 7а), хотя возможно и отсут-
каротиноидов - ·R + Car → ·Car-R.
ствие гетероциклического кольца, как это можно
видеть у ликопина (рис. 7б). В связи с тем, что ка-
2. Реакция с отделением атома водорода -
ротиноиды содержат большое количество двой-
·RН + Car → ·Car-H + R.
ных связей, в клетках животных и человека они
3. Реакции, сопровождающиеся переносом
выполняют различные защитные функции: свя-
электронов -
зывают синглетный кислород, предупреждая об-
разование чужеродных свободных радикалов;
·R + Car → R- + ·Car+,
обеспечивают защиту от жесткого электромаг-
·R + Car → R+ + ·Car-.
нитного излучения. Понижая уровень свободных
Имея светочувствительную, электронопрово-
радикалов, каротиноиды выступают в роли анти-
дящую сопряженную структуру связей, кароти-
оксидантов. Способность к перехвату свободных
ноиды выполняют функцию переносчиков энер-
радикалов в молекуле каротиноидов возрастает с
гии и электронов. При этом они могут образовы-
увеличением числа компланарных (т.е. лежащих
вать комплексы с переносом заряда с
в одной плоскости) конъюгированных двойных
биоорганическими соединениями, имеющими
связей. Различают физический и химический ме-
свободно-радикальную форму хинона, напри-
ханизмы антиоксидантного действия каротинои-
мер, с коферментами FAD, FMN, имеющих в
дов. Физический механизм антиоксидантного
своем составе изоаллоксазиновое кольцо, кото-
действия предполагает «тушение» триплетного
рое при восстановлении образует радикал семи-
хлорофилла (3Chl*) или синглетного кислорода
хинона. Так, комплекс кофермента с иононовым
(1О2) за счет перехода каротиноидов (Car) в три-
кольцом каротиноида образуется при его контак-
плетное возбужденное состояние (3Car*) и даль-
те с изоаллоксазиновым нуклеотидом кофактора.
нейшего рассеивания энергии в виде тепла
Важную роль в транспорте окислительно-восста-
(схема 3) [18]:
новительных эквивалентов в биологической мем-
БИОФИЗИКА том 65
№ 4
2020
РАДИКАЛЫ В СТРУКТУРАХ КЛЕТКИ
701
бране отводится небелковому переносчику элек-
Эффективность электронного переноса через
тронов и протонов - коферменту Q, который так-
липидо-каротиноидную структуру существенно
же способен приобретать форму свободного
возрастет при воздействии на нее квантов света,
анион-радикала - семихинона (·CoQH-). Фер-
что можно наблюдать в процессах фотосинтеза,
ментативная реакция с участием коферментов
протекающих в тилакоидах хлоропластов. Каро-
NAD, NADP протекает через две одноэлектрон-
тиноиды тилакоидных мембран участвуют в све-
ные стадии, в результате первой из них образуют-
товых реакциях фотосинтеза и обеспечивают
ся промежуточные свободные радикалы кофер-
структурную стабильность пигмент-белковых
ментов ·NAD или ·NADP, имеющие хиноидную
комплексов. Как известно, мембраны тилакои-
структуру в никотинамидном нуклеотиде.
дов содержат молекулы хлорофилла и каротинои-
дов, которые выполняют светособирающую
Одноэлектронный характер взаимодействия ка-
функцию, при этом каждая из этих молекул улав-
ротиноидов и их комплексов с хинонами в поляр-
ливает из солнечного спектра электромагнитные
ных средах описан в работах [21, 22]. Образование
волны определенной длины волн. Имеющаяся
катион-радикалов каротиноидов в реакции с хино-
система двойных связей выполняет функцию
нами показало, что на первой стадии образуется
хромофора и характеризует спектральные свой-
комплекс с переносом заряда, а затем ион-ради-
ства конкретных каротиноидов, которые имеют
кальная пара [·Car+ + ·Q-]. Конечными продуктами
три или два пика (максимума) поглощения света
являются аддукты каротиноида с хиноном (Car-Q)
в диапазоне длин волн от 280 до 550 нм.
и цис-изомеры каротиноида. Образование ком-
плексов с переносом заряда в реакциях β-каротина,
Сложилось представление, что передача энер-
кантаксантина и 8΄-апо-β-каротин-8΄-аля с хино-
гии возможна только от каротиноидов на хлоро-
нами были зарегистрированы методом оптической
фил, которая происходит резонансным путем по
спектроскопии и ЭПР [21, 22].
механизму Фёрстера и протекает для одной пары
Было изучено образование комплексов с пере-
молекул на расстояние 1 нм в течение 10-10 - 10-12 с.
носом заряда между β-каротином и липидом кар-
Передача энергии сопровождается ее потерей:
диолипином. Для кардиолипина в видимой обла-
10% при передаче от хлорофилла a к хлорофиллу b и
сти спектра не были обнаружены полосы погло-
60% - от каротиноидов к хлорофиллу [22-25]. При
щения, тогда как β-каротин имеет характерные
этом передача энергии возможна только от пиг-
полосы при 340, 450 и 475 нм. Существенное рас-
мента с максимумом поглощения с меньшей дли-
ширение (до 100 нм) полосы поглощения β-каро-
ной волны к пигменту с большей, причем обрат-
тина в длинноволновую область наблюдается при
ный процесс невозможен. Такое упрощенное по-
образовании комплекса кардиолипина с β-каро-
нимание процесса передачи энергии и
тином. Незначительное смещение полос погло-
электронов при фотосинтезе не совсем правиль-
щения в длинноволновую область до 480 нм было
ное, так как оно не дает ответа на вопрос: каким
получено для комплекса «β-каротин-лецитин»
образом хлорофилл реализует механизм передачи
относительно исходной длины волны 450 нм.
энергии на другие биомолекулы тилакоидов, на-
Проведенные экспериментальные исследования
пример, каротиноиды, липиды, кофакторы, фер-
показали, что система «каротин-липид» способ-
менты?
на образовывать комплекс с переносом заряда,
В связи с этим следует отметить, что каротино-
посредством которого возможен электронный
перенос через липидо-каротиноидную структуру
иды в структурах клетки находятся в динамиче-
биологических мембран.
ском контакте с другими биомолекулами, образуя
при этом комплексы с переносом энергии и заря-
Радикальный перенос электронов в биологи-
да, следствием чего является существенное рас-
ческих мембранах с участием радикалов кофер-
ментов (С, СоQ), каротиноидов (Car) и липидов L
ширение полосы поглощения каротиноидов.
можно представить в виде цепи последователь-
Комплексы каротиноидов в составе биологиче-
ных реакций (схема 4).
ских мембран проявляют высокую стабильность.
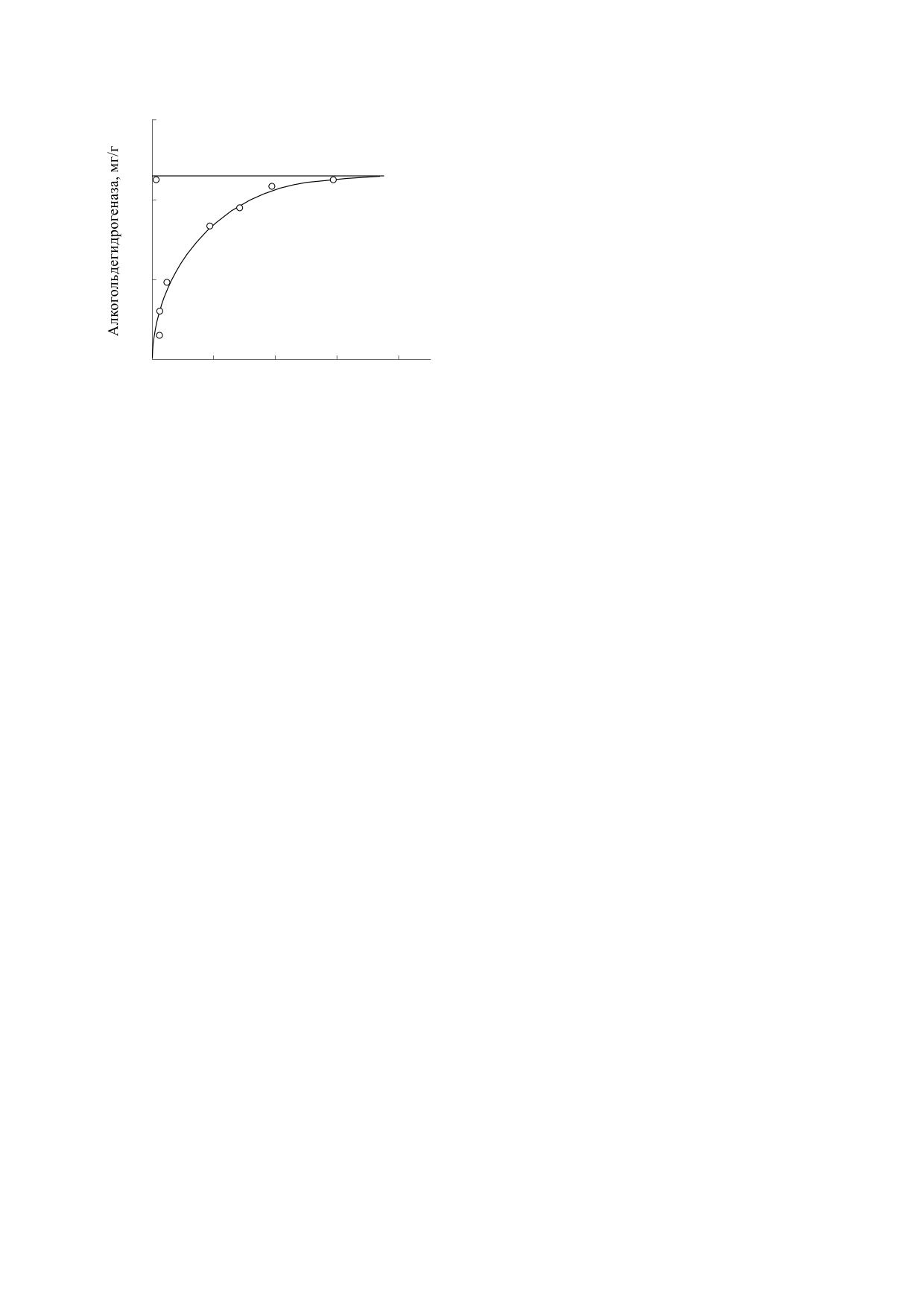
Проведенные спектрофотометрические исследо-
вания [21, 22] показали возможность образования
комплексов с переносом заряда для смеси β-ка-
ротина с хиноном (2,3-дихлор-5,6-дициано-1,4-
бензохиноном) и появление интенсивной полосы
поглощения β-каротина в области 1030 нм. Таким
образом, передача энергии при фотосинтезе мо-
жет осуществляться от хлорофила к каротинои-
дам, что совсем не нарушает правила передачи
Схема 4. Цепь последовательных реакций
энергии от пигмента с меньшей длиной волны к
при радикальном переносе электронов в биологиче-
ских мембранах.
пигменту с большей длиной волны. Совпадение
БИОФИЗИКА том 65
№ 4
2020
702
ШАПОВАЛОВ и др.
1.2
ных жирных кислот в липидных мембранах и со-
1
2
держания в них каротиноидов.
1.0
В ряде работ рассматривается возможность
проводимости углеводородных цепей с диеновой
0.8
конъюгацией [27], когда углеродные атомы разде-
0.6
лены этиленовыми группировками или «метиле-
новыми мостиками» -СН2-. В частности, приво-
0.4
дятся данные об электронной проводимости ли-
пида - далихола, углеводородная цепь которого
0.2
имеет спиральное диеновое сопряжение. Умест-
но отметить, что диеновую конъюгацию имеет
0.0
кофермент Q, выполняющий функцию перенос-
300
400
500 600 700
800
900 100
0
110 0
чика протонов и электронов.
, нм
Установлено, что при фотоактивации фермен-
тативной системы EС2 происходит окисление β-
каротина, сопровождающееся переносом элек-
Рис.
8. Спектры поглощения β-каротина
(1) и
трона от молекулы каротина (Car) к первичному
комплекса с переносом заряда (2), образованного при
донору Р680+ и образованием катион-радикала
его смешении с хиноном (2,3-дихлор-5,6-дициано-
1,4-бензохиноном) [21].
·Car+ [28]. Методом ЭПР было обнаружено обра-
зование анион-радикалов хинонов в EС1 и EС2
[29]. Молекулы каротиноидов легко подвергают-
полос поглощения хлорофилла и каротиноидов в
ся окислению и восстановлению, обладают хоро-
диапазоне длин волн 440-460 нм говорит о том,
шими электронными донорно-акцепторными
что передача энергии от хлорофилла на молекулу
свойствами по отношению к хлорофиллу, липи-
β-каротина может быть реализована без энерге-
дам и коферментам. Спектры поглощения каро-
тических затруднений.
тиноидов изменяются при различных структур-
Анализ спектра поглощения (рис. 8) указывает
ных перестройках молекулы пигмента. Образова-
на то, что пигменты-каротиноиды могут выпол-
ние ·Car+ в реакции с хинонами зарегистрировано
нять активную светособирающую функцию от
как в условиях фотолиза, так и в условиях темно-
ультрафиолетовой до видимой области в диапазо-
вой реакции.
не от 350 до 500 нм, а также 770-1100 нм. В диапа-
зоне спектра
440-770 нм светособирающую
функцию выполняют хлорофилл a и хлорофилл b.
ВЫВОДЫ
В связи с этим можно отметить, что каротино-
В работе рассмотрено участие природных ра-
иды являются обязательными структурными
дикалов в одноэлектронных процессах жизнедея-
компонентами любых фотосинтетических мем-
тельности клеток. Показано, что коферменты
бран, в виде комплексов они входят в состав хло-
имеют промежуточные свободно-радикальные
рофилл-белковых комплексов, пронизывают
хиноидные и семихиноидные формы, которые
мембранный бислой, образуя межмолекулярную
участвуют в жизненно важных одноэлектронных
связь с молекулами липидов [26]. Имея протя-
биохимических процессах, связанных с отдачей
женную сопряженную систему связей с метиль-
или приобретением электронов. Описывается
ными ответвленными группировками, каротино-
способ получения гидрофобного электропровод-
иды встраиваются в липидную мембрану и стяги-
ного сорбента, моделирующего монослой биоло-
вают два монослоя за счет сил гидрофобного
гической мембраны. Разработаны гетерогенные
связывания, формируя высокоорганизованную
биокаталитические системы в результате сорбции
структуру упакованных молекул пигмента и ли-
ADH и NAD на обратнофазовом электропровод-
пидов. При этом углеводородные цепи липидов
ном углеродном сорбенте. Результаты сорбции
могут содержать от одной до шести двойных свя-
ADH и NAD на электропроводном углеродном
зей. Липиды ряда растений, так же как и кароти-
носителе указывают на прочную необратимую
ны, могут иметь конъюгированную систему
сорбцию фермент-кофакторного комплекса на
связей. Это дает основание предполагать, что
матрице сорбента за счет гидрофобного связыва-
энергетическая и электронная проводимость
ния. Показано, что каталитическая активность
биологических мембран существенно зависит от
комплекса существенно зависит от последова-
количественного содержания полиненасыщен-
тельности формирования фермент-кофакторной
БИОФИЗИКА том 65
№ 4
2020
РАДИКАЛЫ В СТРУКТУРАХ КЛЕТКИ
703
системы; наибольшую активность биокаталити-
5.
ческий комплекс проявляет при последователь-
6.
Е. В. Петрова, Дис
канд. хим. наук (Томский
ной сорбции сначала кофермента, а затем апо-
гос. университет, 2015).
фермента. Осуществлены численные модельные
7.
J. T. McFarland and Yu-H. Chu, Biochemistry 14 (6),
исследования ориентированной сорбции ADH и
1140 (1975).
лактатдегидрогеназы на гидрофобных матрицах с
8.
U. M. Lutstarf, P. M. Shürch, and J. P. Wartburg, Eur.
целью управления биокаталитическими свой-
J. Biochem. 17 (3), 497 (1970).
ствами иммобилизованной фермент-кофактор-
ной системы.
9.
П. П. Гладышев, М. И. Горяев и И. Г. Шпильберг,
Молекул. биология 16 (5), 943 (1982).
Рассматриваются вопросы радикального
трансмембранного переноса протонов и электро-
10.
E. Lundanes and T. Greibrokk, J. Chromatogr. 149,
нов, сопровождающегося ферментативной реге-
241 (1978).
нерацией кофермента. Отмечается важная роль
11.
The Enzymes (Acad. Press, New York, San Francisco,
радикалов природных пигментов каротиноидов в
London, 1975), Vol. 11, p. 191.
процессах переноса энергии и электронов в ак-
тивный центр биокатализаторов, которые могут
12.
M. J. Adams, G. C. Ford, A. Liljas, and M. G. Ross-
образовывать комплексы с переносом заряда с
man, Biochem. Biophys. Res. Commun. 53 (1), 46
липидами и коферментами. Анализ спектра по-
(1973).
глощения комплекса β-каротина с хиноном (2,3-
13.
M. G. Rossmann, D. Moras, and K. W. Olsen, Nature
дихлор-5,6-дициано-1,4-бензохиноном) показал
250 (5463), 194 (1974).
появление интенсивной полосы поглощения в
14.
I. Ohlsson, B. Nordström, and C.-I. Bränden, J. Mol.
области 1030 нм [23]. Это указывает на то, что
Biol. 89 (2), 339 (1974).
комплекс каротина с коферментами, имеющими
фрагменты хиноидной и семихиноидной струк-
15.
H. Klaui, in Chemistry and Biochemistry (Pergamon
тур, могут выполнять активную светособираю-
Press, Oxford, (1982), pp. 309-317.
щую функцию при фотосинтезе в области длин
16.
J. A. Olson and N. I. Krinsky, FASEB J. 9 (15), 1547
волн в диапазоне от 350 до 500 нм, а также 770-
(1995).
1100 нм. При этом перенос энергии от хлорофил-
17.
E. Hernández-Marin, A. Barbosa, and A. Martínez,
лов a и b на комплекс каротиноида c кофермен-
Molecules 17, 1039 (2012).
том не нарушает правило передачи энергии от
18.
R. Edge and G. Truscott, in Carotenoids: Physical,
пигмента с меньшей длиной волны к пигменту с
Chemical, and Biological Functions and Properties (Klu-
большей длиной волны. В диапазоне спектра
wer Acad. Publ., 2010), pp. 283-307.
440-770 нм светособирающую функцию выпол-
няют хлорофилл a и хлорофилл b.
19.
F. Ramel, S. Birtic, and S. Cuine, Plant Physiol. 158,
1267 (2012).
20.
F. Bouvier, J.-C. Isner, O. Dogbo, and B. Camara,
КОНФЛИКТ ИНТЕРЕСОВ
Trends Plant Sci. 10 (4), 187 (2005).
Авторы заявляют об отсутствии конфликта
21. Н. Э. Поляков и Т. В. Лёшина, Успехи химии 75,
интересов.
1175 (2006).
22. N. E. Polyakov, A. L. Focsan, K. Michael, et al., J.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Phys. Chem. B 23, 16968 (2010).
Настоящая работа не содержит описания ка-
23. H.Volkhard, Fluorescence Resonance Energy Transfer.
ких-либо исследований с использованием людей
Principles of Computational Cell Biology (Wiley-VCH,
и животных в качестве объектов.
Weinheim, 2008).
24. Н. Д. Алехина, Ю. В. Балнокин, В. Ф. Гавриленко
СПИСОК ЛИТЕРАТУРЫ
и др., Физиология растений (Academia, М., 2005).
1. Н. П. Чеснокова, Е. В. Понукалина и М. Н. Бизен-
25. D. C. Harris, in Applications of Spectrophotometry.
кова, Успехи соврем. естествознания, № 7, 29
Quantitative Chemical Analysis (W. H. Freeman and
(2006).
Co., New York, 2010).
2. Ю. А. Владимиров, Сорос. образоват. журн.
26. Г. Н. Смоликова и С. С. Медведев, Физиология
Биология 6 (12), 14 (2000).
растений 62 (1), 3-16 (2015).
3. Н. Т. Берберова, Сорос. образоват. журн. Химия 6
(5), 39 (2000).
28. D. Kuciauskas, P. A. Liddell, A. L. Moore, et al., J. Am.
4. А. Соловьев, Фармацевт практик, № 12 (2016).
Chem. Soc. 120, 10880 (1998).
29. A. Sieckmann, W. Lubitz, and D. Stehlic, Chem. Phys.
rushiteli-ili-zashhitniki-organizma.
194, 349 (1995).
БИОФИЗИКА том 65
№ 4
2020
704
ШАПОВАЛОВ и др.
Radicals in the Structures of a Cell
Yu.А. Shapovalov*, P.P. Gladyshev**, S.T. Tuleukhanov*, E.V. Schvetsova*, and Zh.T. Abdrasulova*
*Al-Farabi Kazakh National University, prosp. Al-Farabi 71, Almaty, 050040 Republic of Kazakhstan
**Dubna State University, ul. Universitetskaya 19, Dubna, Moscow Region, 141982 Russia
The participation of natural radicals in single-electron processes of cell activity is considered. It was shown
that coenzymes, having intermediate free radical quinoid and semichinoid forms, can interact with carot-
enoids, forming complexes with charge transfer with an absorption band of 1030 nm. Moreover, the complex
can perform an active light-harvesting function during photosynthesis up to 1100 nm, with the energy transfer
from chlorophyll a and chlorophyll b to the complex. Studies of the sorption of the alcoholdehydrogenase-
nicotinamide adenine dinucleotide enzyme-cofactor system on a hydrophobic electrically conductive carrier
showed that the maximum activity of the enzyme-cofactor system is reached during sequential sorption of the
coenzyme, and then the apoenzyme. The orientation of the biocatalytic system on the immobilization matrix
is of great importance.
Keywords: radicals, coenzymes, carotenoids, charge-transfer complexes, sorption, immobilization
БИОФИЗИКА том 65
№ 4
2020