БИОФИЗИКА, 2020, том 65, № 4, с. 713-721
БИОФИЗИКА КЛЕТКИ
УДК 577.352.2
СВОЙСТВА ИОННЫХ КАНАЛОВ В ЛИПИДНЫХ МЕМБРАНАХ,
МОДИФИЦИРОВАННЫХ АРОМАТИЧЕСКИМ
АНТИБИОТИКОМ ЛЕВОРИНОМ А2
© 2020 г. Т.П. Таги-заде, Х.М. Касумов
Отдел медико-биологических наук Азербайджанской государственной академии физической культуры и спорта,
AZ107272, Баку, просп. Фатали Хана Хойского, 98, Азербайджан
E-mail: khalil.gasimov@gmail.com
Поступила в редакцию 10.12.2019 г.
После доработки 08.04.2020 г.
Принята к публикации 17.04.2020 г.
Показано, что основные компоненты леворина А с ароматической группировкой - А0, А1, А2, А3
увеличивают проводимость мембран в ряду: А3 > А2 > А1 > А0, когда находятся с одной стороны
мембраны. Все компоненты леворина обладают катионной селективностью. Наиболее изученный в
работе леворин А2 создает в мембранах практически идеальную проницаемость для ионов калия.
Потенциал на десятикратный градиент изменения концентрации KCl составляет 56 ± 2 мВ.
Модификация мембран при одной и той же концентрации леворина А2 сначала с одной стороны
мембраны, а затем, после установления стационарной проводимости, с другой стороны мембраны
показывает, что суммарная проводимость мембран при этом удваивается. Это означает, что с
каждой стороны мембраны формируются независимые левориновые проводящие полупоры.
Установлено, что при одностороннем введении леворина А2 к мембранам увеличивается
проницаемость мембран для моносахаров и других нейтральных молекул. В присутствии леворина
А2 на мембранах из фосфолипидов с холестерином, эргостерином и стигмастерином обнаружены
одиночные ионные каналы с проводимостью 0.2-0.5 пСм и изучены их свойства. Левориновые
каналы имеют два основных состояния - открытое и закрытое. В растворе KBr-канал большую
долю времени находится в открытом состоянии. В растворах разных солей, но одинаковой
молярности, величина проводимости левориновых каналов примерно одинакова 0.4-0.5 пСм.
Увеличение концентрации диметилсульфоксида в водном растворе способствует переходу молекул
полиеновых антибиотиков из дисперсной в мономолекулярную форму. Молекулы полиеновых
антибиотиков, находясь в ассоциированной форме, обладают высокой мембранной активностью.
Ключевые слова: макролидные полиеновые антибиотики, леворин А2, липидные мембраны, проницае-
мость мембран, ионные каналы, диметилсульфоксид.
DOI: 10.31857/S0006302920040110
биологическую активность молекул, с широким
Исследование молекулярного механизма из-
варьированием внешних и внутренних парамет-
бирательной проницаемости клеточных мембран
ров. В связи с этим большое внимание уделяется
для ионов и органических соединений является
изучению структуры и мембранной активности
одной из ключевых проблем биофизики мем-
каналообразующих соединений. В отличие от ка-
бранного транспорта. Прогресс, достигнутый в
налообразующих соединений грамицидина А и
изучении механизма транспорта ионов через ли-
аламетицина, полиеновые антибиотики (ПА) яв-
пидные мембраны, связан с веществами антибио-
ляются классическими структурными канало-
тической природы. Чтобы подойти к решению
формерами с известной структурой молекул [1].
молекулярного механизма переноса ионов через
ПА представляют собой большую группу природ-
мембраны, необходимо знать структуру молекул,
ных соединений, продуцируемых микроорганиз-
образующих независимые системы проницаемо-
мами Streptomyces (Actinomyces) [2]. Большинство
сти, а также иметь возможность изучить отдель-
ПА продуцируются грамположительными мик-
ные функциональные группы, определяющие
роорганизмами [2]. ПА обладают высокой проти-
вогрибковой активностью [3, 4]. В основе биоло-
Сокращения: ПА - полиеновые антибиотики БЛМ - бис-
гического действия ПА лежит формирование ими
лойные липидные мембраны, ДМСО - диметилсульфок-
сид.
в липидных и клеточных мембранах в комплексе
713
714
ТАГИ-ЗАДЕ, КАСУМОВ
со стеринами структурных ионных каналов моле-
этой целью изучен механизм одностороннего
кулярных размеров с определенной проводимо-
действия компонентов леворина А, изучены
стью [1, 5]. Из всех изученных ПА наибольшей
свойства ионных каналов при введении леворина
биологической активностью обладают гептаено-
А2 как идеального катионного каналоформера в со-
вые антибиотики амфотерицин В и леворин [1].
став БЛМ с одной стороны мембраны, представле-
Леворин - основной представитель антибиоти-
ны данные экспериментальных исследований об
ков с ароматической группировкой. Леворин
избирательности при формировании односторон-
продуцируется микроорганизмами Actinomyces
них проводящих каналов и величине проводимости
levoris [6]. В отличие от неароматических анти-
каналов, образуемых леворином А2.
биотиков амфотерицина В, нистатина и микогеп-
тина, антибиотик леворин эффективно действует
с одной стороны бислойных липидных мембран
МАТЕРИАЛЫ И МЕТОДЫ
(БЛМ) [1]. Несмотря на большое количество пуб-
ликаций, касающихся механизма взаимодей-
Бислойные мембраны получали из общих фос-
ствия ПА с БЛМ, до сих пор остается неясной
фолипидов, выделенных из белого вещества бы-
связь между структурой молекул антибиотиков и
чьего мозга. Общие фосфолипиды очищали от
свойствами образованных ими каналов. В хими-
нейтральных липидов ацетоновой промывкой и
ческой структуре всех ПА имеется макролидное
хранили при 0°С в хлороформо-метанольном
кольцо, содержащее то или иное число сопря-
растворе (2 : 1) в концентрации 20 мг/мл. Затем к
женных двойных связей, которые определяют
этим липидам добавляли необходимое количе-
хромофорные свойства данного вещества [6].
ство перекристаллизованного холестерина в со-
Биологическая активность ПА зависит от числа
ответствующих концентрациях. Мембраны фор-
двойных связей в гидрофобной части молекул.
мировали на отверстии в тефлоновой ячейке диа-
Ароматический гептаеновый антибиотик лево-
метром 0.3 мм. В работе были использованы ПА,
рин, в отличие от неароматического гептаенового
любезно предоставленные нам проф. В.А. Вайн-
антибиотика амфотерицина B, содержит в своей
штейном (Санкт-Петербургский государствен-
структуре два атома азота (один входит в состав
ный химико-фармацевтический университет,
аминосахара, второй - в состав N-метил-n-ами-
Санкт-Петербург, Россия). Известно, что ПА в
ноацетофенона [6]. Наибольший интерес пред-
воде нерастворимы, лучшим растворителем для
ставляет изучение мембранных свойств леворина
них является диметилсульфоксид (ДМСО).
как катионного каналоформера. Леворин неод-
ДМСО получают путем окисления диметилсуль-
нороден по составу и включает два близких, но не
фида [13], в состав его молекулы входят две ме-
идентичных по своим свойствам ароматических
тильные группы, соединенные через серу двой-
гептаена - леворин А и леворин В [7, 8]. Леворин
ной связью с кислородом. Молекуле ДМСО при-
А более активен, чем леворин В [8]. Наиболее
сущи такие свойства как амфифильность,
изученный из них - леворин А - оказался ком-
полярность, высокая резорбция и быстрое про-
плексным, как и многие из известных ПА гептае-
никновение в органы и ткани [13]. Мы использо-
нового ряда: кандицидин, трихомицин, гамицин
вали в работе ДМСО фирмы Sigma-Aldrich
и другие [8, 9]. Исходный леворин А представляет
(США). Леворин растворяли в ДМСО в концен-
собой смесь нескольких компонентов - А0, А1, А2,
трации 1-10 мг/мл, полученный раствор затем
А3 [8, 9]. Установлена структура основного ком-
использовали в качестве маточного и хранили его
понента антибиотического комплекса - левори-
в течение недели. Из маточного раствора микро-
на А2 [10] и частичная структура других компо-
шприцом антибиотики вводили в водный рас-
нентов [11]. Структурные отличия между компо-
твор, окружающий мембрану. Электрические ха-
нентами леворина А показаны на рис. 1. Как
рактеристики БЛМ измеряли с помощью метода
видно из рис. 1, компоненты леворина отличают-
фиксации мембранного потенциала и тока, ис-
ся друг от друга расположением и числом карбо-
пользуя электрометрический усилитель постоян-
нильных и гидроксильных групп в структуре их
ного тока Keithley-301 (США) и двухкоординат-
молекул. В отличие от амфотерицина В аромати-
ный самописец Endim (Германия). Число лево-
ческий антибиотик леворин А увеличивает про-
риновых каналов зависит от концентрации
ницаемость липидных и клеточных мембран для
леворина. При образовании БЛМ мембранофор-
катионов щелочных металлов, когда находится с
мирующие растворы готовили из фосфолипидов
одной стороны мембраны [1, 12]. Наличие ком-
с холестерином. В работе были использованы пе-
плексной природы леворина А и известная струк-
рекристаллизованный холестерин, фосфатидил-
тура составляющих его компонентов предопреде-
серин, эргостерин, стигмастерин, мочевина, аце-
лили необходимость их более глубокого сравни-
тамид, глицерин, рибоза, арабиноза, глюкоза, са-
тельного изучения. К настоящему времени в
хароза - все от компании Sigma (США). Для
литературе отсутствуют данные о механизме од-
стабилизации рН водных растворов использова-
ностороннего действия леворина А на БЛМ. С
ли буферные системы в концентрации 5 · 10-3 М.
БИОФИЗИКА том 65
№ 4
2020
СВОЙСТВА ИОННЫХ КАНАЛОВ В ЛИПИДНЫХ МЕМБРАНАХ
715
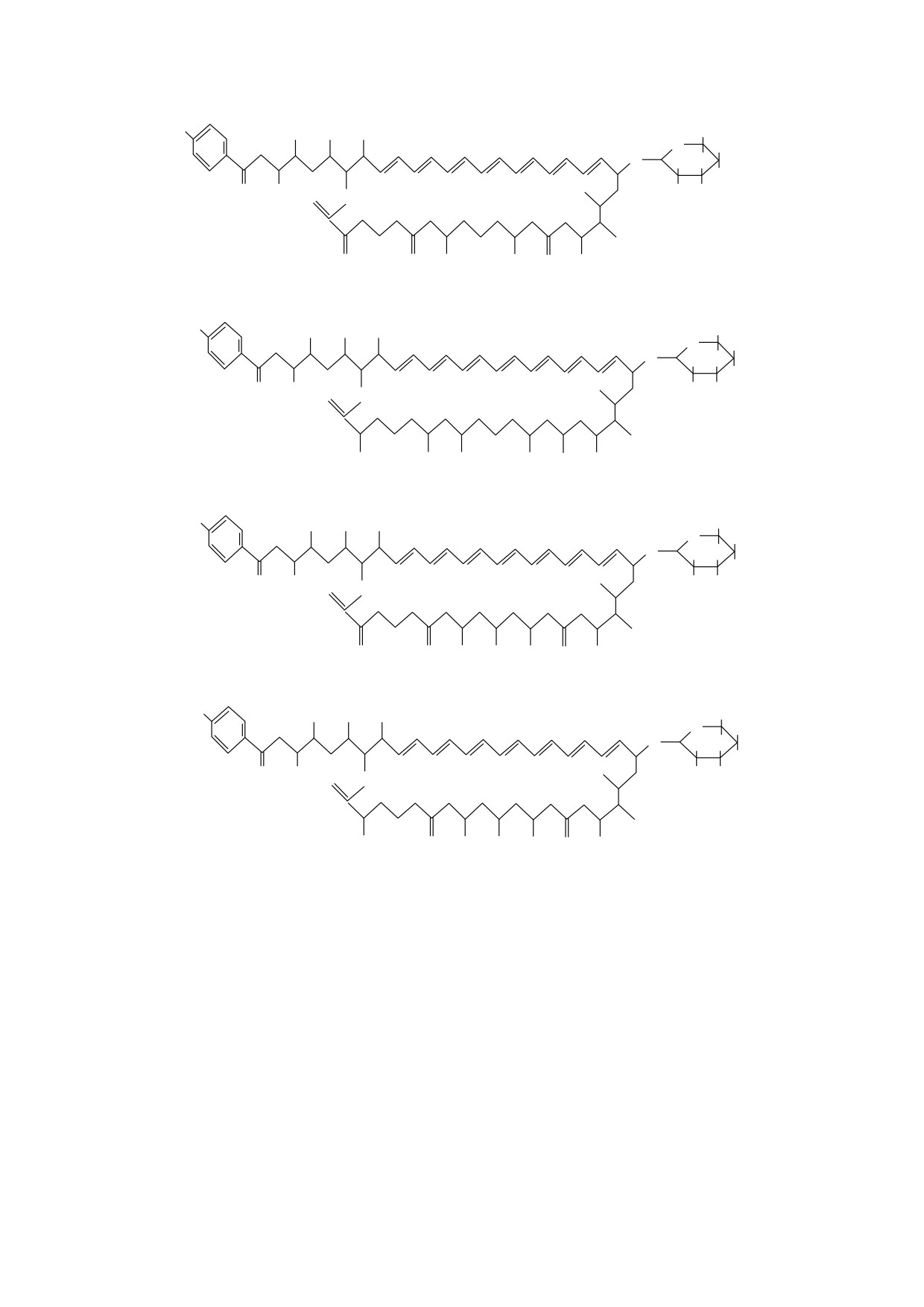
H N2
CH3 CH
CH3
3 CH3
O
O
O
O
OH
HO
OH
NH2
O
O
COOH
O
O OH
OH O OH
Леворин А0
H N2
CH3
CH3 CH3
CH3
O
O
OН
O
OH
HO
OH
NH2
O
O
COOH
OH
OH
OH
OH
OH
OH
Леворин А1
H N2
CH3
CH3 CH3
CH3
O
O
O
O
OH
HO
OH
NH2
O
O
COOH
O
O OH
OH
OH
O OH
Леворин А2
H N2
CH3
CH3 CH3
CH3
O
O
O
OН
O
OH
OH
NH2
O
O
COOH
OH
O OH
OH
OH
O OH
Леворин А3
Рис. 1. Химическая структура индивидуальных компонентов леворина А (согласно работе [11]).
Проводимость немодифицированной мембраны
обе стороны мембраны будет выравниваться. Во-
составляла 2-3 пС в растворах 0.1 М и 2 М КСl.
да начнет входить во внутренний отсек, выравни-
Транспорт неэлектролитов определяли осмо-
вая химические потенциалы воды в разных отде-
тическим методом [14]. С наружной стороны
лениях системы. По скорости выравнивая хими-
мембраны вводили неэлектролит в сравнительно
ческих потенциалов воды в разных отделениях
высокой концентрации так, чтобы осмотическое
системы можно судить о скорости поступления
давление (тоничность) раствора возросло по
исследуемого неэлектролита во внутренний отсек
сравнению с осмотическим давлением с противо-
мембраны. Коэффициент проницаемости для
положной стороны мембраны. Если исследуемый
данного вещества определялся из уравнения
неэлектролит проникает во внутренний отсек, то
по мере его перехода осмотическое давление по
Pd = D/d, где D - коэффициент диффузии прони-
БИОФИЗИКА том 65
№ 4
2020
716
ТАГИ-ЗАДЕ, КАСУМОВ
103
на тот факт, что обнаружены два типа сборки
А3
проводящих структур при введении антибиоти-
ков с одной стороны мембраны: потенциалзави-
А2
А1
симый и концентрационный. Первый тип сборки
105
наблюдается при концентрациях компонентов
А0
леворина А от 10-8 до 5 · 10-7 М и зависит от вели-
чины приложенного к мембране электрического
поля. При концентрациях антибиотиков больше
107
5 · 10-7 М проявляется второй тип сборки при по-
стоянной величине мембранного потенциала.
Этот процесс необратим. Величина мембранного
потенциала на десятикратный градиент проника-
109
109
108
107
106
105
104
ющего иона варьирует в зависимости от числа
гидроксильных групп в гидрофильной части мо-
С, М
лекулы антибиотика. Молекула леворина в отли-
чие от неароматических антибиотиков содержит
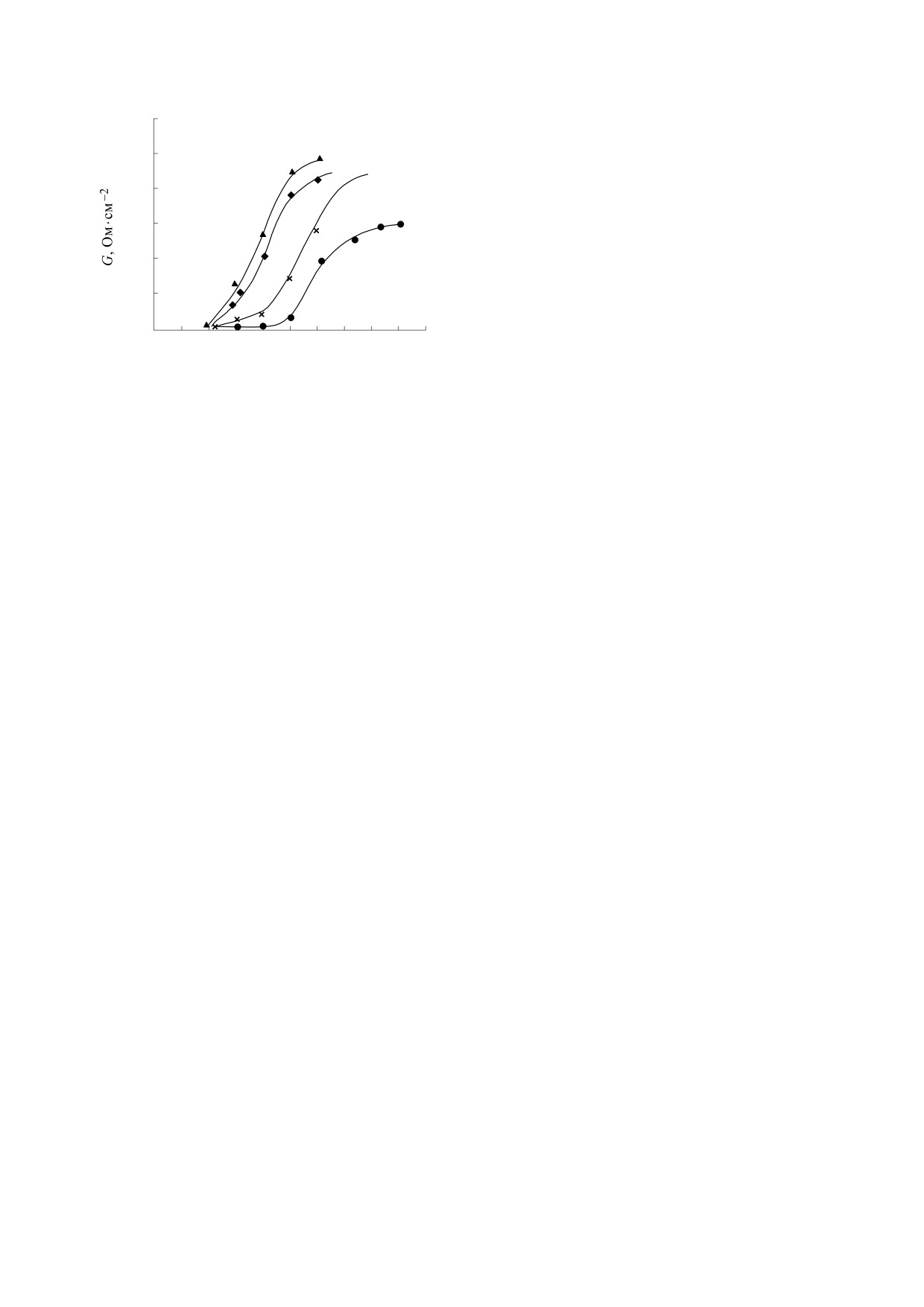
Рис. 2. Зависимости проводимости бимолекулярных
в своем составе ароматическую группировку, бла-
мембран от концентрации индивидуальных компо-
нентов леворина А (А0, А1, А2, А3) с одной стороны
годаря которой молекула приобретает дополни-
мембраны в растворе 2 М КСl, рН 6.5 при t = 25°С.
тельный положительный заряд: один расположен
Потенциал на мембране +100 мВ («+» со стороны ан-
у входа в канал, другой - с гидрофобного конца
тибиотиков). Мембраны получали из раствора фос-
молекулы. Следовало ожидать, что компоненты
фолипидов бычьего мозга с холестерином в соотно-
шении 2 : 1.
леворина будут создавать в мембранах анионную
избирательность. Однако в экспериментах на-
блюдается катионная селективность. Этот эф-
кающего вещества, d
- толщина мембраны
фект подтверждает предположение о том, что си-
(~50 Å).
стема селективности локализована на гидро-
фильной части лактонного кольца молекулы
леворина. Отсюда следует, что ионная избира-
РЕЗУЛЬТАТЫ
тельность мембран в присутствии леворина свя-
зана со структурой молекулярных групп, высти-
Все индивидуальные компоненты леворина А
лающих внутреннюю полость канала. Изучение
увеличивают ионную проницаемость мембран,
механизма избирательной проницаемости мем-
содержащих холестерин, для моновалентных ка-
бран для ионов и органических молекул в присут-
тионов. В отличие от неароматических гептаено-
ствии леворина является важным аспектом про-
вых антибиотиков амфотерицина В, нистатина и
водимых исследований. Из рис. 1 видно, что ин-
микогептина компоненты леворина увеличивают
дивидуальные компоненты леворина А по
проводимость мембран при введении их с одной
структуре одинаковы, но отличаются только чис-
стороны мембраны. На рис. 2 представлена зави-
лом гидроксильных и карбонильных групп в гид-
симость проводимости мембран от их концентра-
рофильной части молекул.
ции с одной стороны мембраны. Видно, что наи-
Исследования проводимости мембран при од-
большей эффективностью обладает леворин А3, а
ностороннем действии левориновых компонен-
наименьшей - А0. По степени изменения прово-
тов в растворах различных проникающих катио-
димости мембран левориновые компоненты рас-
нов показали, что проводимость мембран зависит
полагаются в следующий ряд с возрастающей эф-
от степени гидратации проникающих ионов, как
фективностью: А0 < А1 < А2 < А3. В аналогичный
и в случае симметричной модификации мембран
ряд располагаются антибиотики по мере увеличе-
левориновыми компонентами. Ионы лития, об-
ния их биологический активности [8].
ладая меньшим размером кристаллического ра-
диуса в ряду катионов щелочных металлов, гидра-
Компоненты леворина А обладают важными
тируются в значительно большей степени, чем,
свойствами. Влияние антибиотиков на проводи-
например, ионы цезия. Вследствие этого резко
мость мембраны зависит не только от их концен-
трации, но и от величины и направления прило-
уменьшается скорость перемещения ионов Li+ в
женного к мембране потенциала. Изменение по-
канале, и это, в свою очередь, обуславливает
тенциала вдвое (от 100 до 200 мВ) при постоянной
меньшую проводимость канала в растворах хло-
концентрации антибиотика приводит к росту
ристого лития по сравнению с проводимостью
леворинового канала в растворах хлористого це-
проводимости в 24 раза. Удвоение же концентра-
зия. Полученные данные при исследовании од-
ции антибиотика при постоянной величине мем-
ностороннего действия левориновых компонен-
бранного потенциала приводит к росту проводи-
мости в четыре раза. Следует обратить внимание
тов показывают, что прохождение ионов Li+ че-
БИОФИЗИКА том 65
№ 4
2020
СВОЙСТВА ИОННЫХ КАНАЛОВ В ЛИПИДНЫХ МЕМБРАНАХ
717
рез левориновые каналы более затруднено, чем
1 пСм
ионов Cs+. Это позволяет предположить, что од-
носторонний левориновый канал представляет
10 с
собой канал, заполненный водой. Исходя из это-
го предположения, следовало ожидать, что при
I0
одинаковой молярной концентрации проводи-
мость мембран с леворином в растворе NaCl будет
примерно равной проводимости мембран в рас-
Рис. 3. Дискретные изменения проводимости мем-
бран в присутствии леворина А2 при потенциале
творе LiCl. Однако проводимость мембран с ле-
100 мВ («+» со стороны антибиотика). Концентрация
ворином в растворах NaCl оказалась на порядок
антибиотика с одной стороны мембраны составляла
выше проводимости мембран в растворе CsCl.
5 · 10-8 М. Водные растворы с обеих сторон мембра-
По-видимому, здесь имеет место более сложный
ны содержали 2 М KCl, рН 6.5, t = 22°С. Мембраны
получали в смеси фосфолипида с эргостерином в со-
характер переноса ионов через левориновые ка-
отношении 20 : 1. Стрелкой обозначен уровень про-
налы.
водимости немодифицированной мембраны.
Из всех компонентов леворина А только лево-
рин А2 обладает практически идеальной катион-
см ⋅ с-1 ⋅ 10-4) для нейтральных молекул в поряд-
ной селективностью. Исходя из этого, наиболь-
ке возрастания гидродинамического радиуса мо-
ший интерес представляет исследование свойств
лекул. По степени уменьшения проницаемости
леворина А2 при взаимодействии с мембранами.
молекул они располагаются в следующем ряду:
Модификация мембран при одной и той же кон-
вода (ri = 1.4, Pd = 16.7 ± 2.2) > мочевина (ri = 1.8,
центрации леворина А2 сначала с одной стороны
Pd = 11.2 ± 0.7) > ацетамид (ri = 2.5, Pd = 6.64 ± 1.34) >
мембраны, а затем, после установления стацио-
> глицерин (ri = 3.1, Pd = 4.36 ± 1.03) > рибоза
нарной проводимости, с другой стороны мембра-
(ri = 3.6, Pd = 1.42 ± 0.12) > арабиноза (ri = 3.8, Pd =
ны показывает, что суммарная проводимость
мембран при этом удваивается. Эти данные
1.38 ± 0.11) > глюкоза (ri = 4.2, Pd = 1.23 ± 0.04) >
показывают, что с каждой стороны мембраны
> сахароза (ri = 5.2, Pd = 0.08 ± 0.02). Через лево-
формируются независимые левориновые прово-
риновые каналы способны проникать нейтраль-
дящие каналы. С другой стороны, известно, что
ные молекулы вплоть до молекул глюкозы. Эти
амфотерицин В не действует с одной стороны
данные говорят о том, что эффективный диаметр
мембраны даже при очень высоких концентраци-
леворинового канала составляет величину ~ 8 Å.
ях (1 · 10-4 М). Добавление амфотерицина В с
Введение леворина А2 к липидным мембранам
другой стороны мембраны в той же концентра-
вызывает увеличение проводимости мембран по
ции резко усиливает проводимость мембран. В
канальному механизму. Работа одиночных кана-
этом случае происходит взаимодействие амфоте-
лов, формируемых леворином А2, показана на
рицина В, находящигося по разные стороны мем-
браны, при котором проводимость мембран уве-
рис. 3, из которого видно, что проводимость ка-
нала составляет величину ~ 0.4-0.5 пСм. Мем-
личивается в 24 раза [1]. Это доказывает взаимо-
браны, модифицированные леворином А2, обла-
действие двух амфотерициновых полупор с
образованием проводящего канала. При односто-
дают катионной селективностью. Потенцил на
ронней модификации бислойных мембран лево-
десятикратный градиент проникающего иона
100 мМ : 10 мМ (100 мМ - со стороны антибиоти-
рином А2 при концентрации 1 · 10-5 М и при мем-
ка) составляет величину +56 ± 2 мВ (знак + нахо-
бранном потенциале +100 мВ (плюс - со стороны
дится в свободном от антибиотика растворе). Это
антибиотика) наблюдается резкий рост проводи-
означает, что мембраны практически идеально
мости с выходом спустя 15 мин на стационарный
проницаемы для катионов.
уровень. После достижения стационарной прово-
димости мембран была исследована проницае-
Проводимость каналов, образуемых левори-
мость левориновых каналов для моносахаров и
ном А2, примерно на порядок меньше проводи-
других нейтральных молекул. Объем раствора во
мости амфотерициновых каналов и в 100 раз
внутренней ячейке составлял 0.3 мл, а объем на-
меньше проводимости грамицидиновых каналов
ружного раствора - 1 мл. В результате проведен-
при той же концентрации электролита. Обнару-
ных экспериментов было обнаружено, что при
жение одиночных каналов в присутствии левори-
модификации мембран леворином А2 наблюдает-
на А2 подтвердило предположение о наличии в
ся увеличение проводимости липидных мембран
мембранах комплексов, инициирующих катион-
для моносахаров и других нейтральных молекул.
ную проницаемость. Левориновые каналы совер-
Ниже в скобках указаны значения радиуса моле-
шают переходы между двумя состояниями: от-
кул (ri,_ Å) и коэффициент проницаемости (Pd,
крытым и закрытым. В таблице представлены ве-
БИОФИЗИКА том 65
№ 4
2020
718
ТАГИ-ЗАДЕ, КАСУМОВ
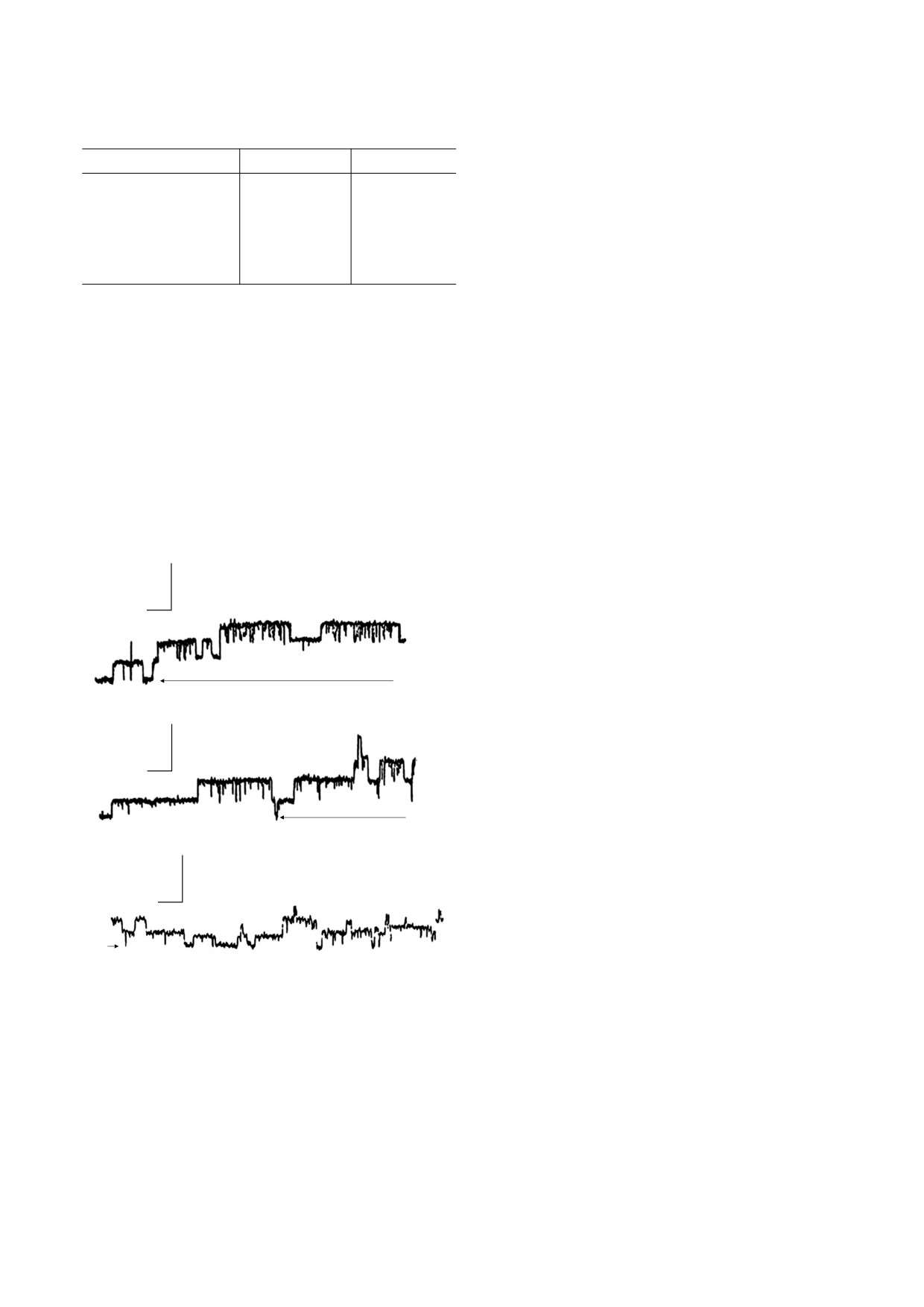
Параметры ионного канала в присутствии леворина А2
висит от концентрации антибиотика. В разных
в растворах КСl и КВr
солях времена жизни канала в открытом и закры-
2 M KCl
2 M KBr
том состояниях отличаются. В растворе КСl лево-
риновый канал большую долю времени проводит
gM, Ом-1 ⋅ 1012
0.4 ± 0.1
0.5 ± 0,l
в закрытом состоянии, однако в растворе KBr ка-
нал большую долю времени находится в откры-
Леворин A2, M ⋅ 10-9
5.0
10.0
том состоянии. Отсюда можно сделать вывод, что
Tо, c
2.5 ± 0.3
5.2 ± 0.4
анионы оказывают влияние на переключающую
Tз, c
3.5 ± 0.2
0.86 ± 0.05
систему молекулярного канала.
Примечание. gм - Проводимость одиночного канала при
На рис. 4 показана работа одиночных каналов
мембранном потенциале 200 мВ; леворин А2 - концентра-
леворина А2 на мембранах из фосфатидилсерина
ция, необходимая для получения одиночных каналов (в те-
с холестерином, эргостерином и стигмастерином.
чение 15 мин); То - время жизни канала в открытом состоя-
нии; Тз - время жизни канала в закрытом состоянии. Мем-
При низких концентрациях антибиотика можно
браны формировали из смеси фосфатидилсерина с
наблюдать работу одиночных ионных каналов.
эргостерином в весовом соотношении 20 : 1.
Введение леворина А2 в концентрации 5 · 10-9 М
с обеих сторон мембран, приготовленных из фос-
фатидилсерина с холестерином, приводит к дис-
личина проводимости канала и времена жизни
кретному нарастанию мембранного тока, флукту-
каналов в открытом и закрытом состояниях.
ирующего относительно среднего значения
Как видно из таблицы, в растворах разных со-
(см. рис. 4а). Флуктуация тока связана с дискрет-
лей, но одинаковой молярности, величина про-
ной работой отдельных проводящих единиц - ка-
водимости каналов примерно одинакова и не за-
налов. Анализ флуктуаций тока показывает, что
проводимость каналов лежит в интервале 0.2-
0.5 пСм в растворах 2 М КСl при мембранном по-
(а)
тенциале 200 мВ. В присутствии леворина А2 в
1 пСм
концентрации 5 · 10-8 М с обеих сторон мембран,
образованных из раствора фосфатидилсерина с
10 с
эргостерином, впервые наблюдали дискретные
скачки проводимости (рис. 4б). Дискретные из-
менения проводимости мембран с леворином на-
I0
блюдаются также на мембранах со стигмастери-
ном (рис. 4в). Как видно на рис. 4, проводимости
(б)
каналов примерно одинаковы и не зависят от со-
става электролита. В асимметричных условиях
1 пСм
концентрации электролита (2М КСl : 0.2 М КСl)
потенциал нулевого тока равен +54 ± 4 мВ на
10 с
мембранах с большим числом каналов. Знак по-
тенциала говорит об избирательной проницаемо-
I
0
сти мембран для ионов К+. Ионная селектив-
(в)
ность канала не зависит от полиеновой цепи. По
всей видимости система, ответственная за селек-
1 пСм
тивность ионного канала, локализована на гид-
рофильной стороне молекулы полиена. Изучая
10 с
селективные свойства мембраны с большим чис-
I0
лом полиеновых каналов, можно однозначно
определить избирательность одиночного канала.
Такой экспериментальный подход обусловлен
Рис. 4. Дискретные изменения проводимости мем-
бран в присутствии леворина А2 при потенциале
тем, что систематическое изучение селективности
200 мВ, рН 6.5; t = 22°С. (а) - Концентрация антибио-
непосредственно одиночного канала методиче-
М; мембраны полу-
тика в растворе 2 М КСl - 5 ·10-9
ски достаточно сложно ввиду ее малой проводи-
чали из смеси фосфатидилсерина с холестерином в
мости. В растворах КСl частота переходов канала
соотношении 2 : 1. (б) - Концентрация антибиотика
в растворе 2 М КВr - 5·10-8 М; мембраны получали из
из открытого в закрытое состояние несколько
смеси фосфатидилсерина с эргостерином в соотно-
больше, и это связано, по-видимому, со сложным
шении 20 : 1. (в) - Концентрация антибиотика в рас-
характером взаимодействия иона с полярными
творе 2М КВr - 5 · 10-9 М; мембраны получали из
группами, выстилающими внутреннюю пору в
смеси фосфатидилсерина со стигмастерином в соот-
ношении 2 : 1.
канале.
БИОФИЗИКА том 65
№ 4
2020
СВОЙСТВА ИОННЫХ КАНАЛОВ В ЛИПИДНЫХ МЕМБРАНАХ
719
Чувствительность мембран к ПА зависит от
нов только при наличии их с обеих сторон мем-
концентрации ДМСО в водном растворе, окру-
браны [1]. Было показано, что указанные выше
жающем мембрану [15, 16]. При соотношении во-
антибиотики эффективно увеличивают проница-
да : ДМСО = 20 : 1 проводимость мембран с анти-
емость мембран эритроцитов, лимфоцитов, ти-
биотиками была высокой и становилась сравни-
моцитов и мышечных клеток при наличии их с
мой с проводимостью самих электродов. При
одной стороны мембраны, при этом на мембра-
соотношении вода : ДМСО = 10 : 1 проводимость
нах наблюдается усиление потока не для анио-
мембран с антибиотиками была также высока.
нов, а для катионов щелочных металлов [17-20].
Постепенное увеличение концентрации ДМСО в
Антибиотики с ароматической группировкой, в
водном растворе уменьшало чувствительность
частности левориновые компоненты, оказались
ПА к мембранам. Проводимость мембран в соле-
эффективны с одной стороны клеточных мем-
вом растворе, содержащем 50% ДМСО и ПА, ока-
бран и БЛМ. Леворин действует на липидные и
залась очень низкой. Та же картина наблюдалась
клеточные мембраны, создавая избирательную
в растворе с соотношением вода : ДМСО, равным
проницаемость для катионов щелочных металлов
1 : 10. Приведенные данные показывают, что по-
[12, 21]. В молекуле микогептина на одну карбо-
степенное увеличение концентрации ДМСО в
нильную группу больше, чем в молекулах амфо-
водном растворе способствует переходу молекул
терицина В и нистатина. Через микогептиновые
ПА из дисперсной, т.е. ассоциированной формы,
каналы анионы и катионы проникают примерно
в мономолекулярную форму, и в этой форме мо-
одинаково [21]. В молекуле леворина на две кар-
лекулы ПА оказываются биологически неактив-
бонильные группы больше, чем в молекулах ам-
ными. Отсюда следует, что молекулы ПА, нахо-
фотерицина В и нистатина, и в присутствии лево-
дясь в ассоциированной форме, обладают очень
рина уже наблюдается избирательная проницае-
высокой мембранной активностью, а распад про-
мость мембран для катионов
[21]. Наши
водящего комплекса в мембране означает переход
исследования показали, что мембраны, модифи-
канала из олигомерной структуры в мономерно-
цированные леворином с одной стороны мембра-
ны, обладают такой же селективностью, как и при
димерную и потере им проводимости. Чувстви-
двухстороннем введении антибиотика. Проводи-
тельность ПА к мембранам означает, что увели-
чивается число проводящих каналов, а проводи-
мость одиночных полупор примерно такая же,
мость индивидуальных одиночных каналов не из-
как и проводимость канала, возникающая при
меняется. Под чувствительностью ПА к
двухстороннем введении антибиотика. Для рас-
мембранам понимается минимальная концентра-
шифровки молекулярной природы катионной се-
ция антибиотика, под действием которого обра-
лективности левориновых каналов требуется
зуются одиночные каналы в единицу времени. По
синтез новых молекул с измененной химической
мере увеличения концентрации ДМСО чувстви-
структурой молекул. Биологический синтез и хи-
тельность мембран к антибиотикам уменьшается,
мическая трансформация молекул ПА - вот ре-
хотя угол наклона зависимости проводимости
альный путь получения новых производных ПА с
мембран от концентрации антибиотиков при
новыми физико-химическими свойствами [22-
этом не меняется.
24]. Наибольший интерес представляет модифи-
кация полиеновой молекулы по гидрофильной
цепи, изменяющая внутреннюю полость канала,
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
и, как показывают исследования, только эта си-
Наибольший интерес представляют сравни-
стема в молекулах полиенов отвечает за избира-
тельные исследования, связанные с особенностя-
тельную проницаемость мембран для ионов и
ми взаимодействия ПА с БЛМ и клеточными
органических соединений. Эксперименты, про-
мембранами. На изолированном мышечном во-
веденные с алкильными производными левори-
локне травяной лягушки Rana temporaria был изу-
на, модифицированными по полярным карбок-
чен индуцированный полиенами ионный транс-
сильным и аминным группам, показали, что
порт. Было показано, что амфотерицин В, мети-
подобная модификация не влияет на избиратель-
ловый эфир амфотерицина В, нистатин,
ную проницаемость мембран, а только определя-
микогептин и леворин усиливают проводимость
ет время пребывания антибиотика в мембране.
мышечного волокна для катионов щелочных ме-
Модифицируя мембраны алкильными производ-
ными с разной длиной углеводородной цепи
таллов [12, 17-19]. Как было показано в нашей ра-
(R-CH3 - метил, R-C2H5 - этил, R-C3H7 - про-
боте, леворин также усиливает проводимость
бислойных мембран для катионов щелочных ме-
пил, R-C4H9 - бутил; R-C5H11 - амил), можно
таллов. Избирательная проницаемость липидных
точно контролировать время нахождения анти-
мембран зависит от структуры гидрофильной це-
биотика в мембране [1]. Проведенные экспери-
пи полиеновой молекулы. Так, амфотерицин В,
менты на липидных мембранах показали, что с
нистатин и микогептин эффективно увеличива-
увеличением длины алкильной цепи производ-
ют проводимость БЛМ для одновалентных анио-
ных леворина время нахождения их в мембране
БИОФИЗИКА том 65
№ 4
2020
720
ТАГИ-ЗАДЕ, КАСУМОВ
по сравнению с исходным леворином уменьшает-
ФИНАНСИРОВАНИЕ РАБОТЫ
ся [1]. Время пребывания антибиотика в мембра-
Работа выполнена при финансовой поддержке
не определялось по постоянной времени релакса-
Фонда развития науки при Президенте Азербай-
ции проводимости мембран после отмывки анти-
джанской Республики (грант № EIF-BGM-3-
биотика из окружающего мембрану раствора.
BRFTF-2+/2017-15/12).
Биологическая активность ПА зависит не
только от структуры молекул полиенов, но и от
КОНФЛИКТ ИНТЕРЕСОВ
выбора растворителя. Водорастворимые формы
Авторы заявляют об отсутствии конфликта
ПА примерно в десять раз менее эффективны,
интересов.
чем при введении в водную фазу антибиотиков в
растворах ДМСО
[21]. При введении смеси
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ДМСО с ПА в водную среду происходит форми-
рование самоагрегированных ассоциатов ПА в
Настоящая работа не содержит описания соб-
водных растворах [25-27]. Полиены в комплексе
ственных исследований с использованием людей
и животных в качестве объектов.
с ДМСО формируют в водных растворах ассоци-
аты, состоящие из нескольких молекул антибио-
тиков, и только в такой форме они обладают вы-
СПИСОК ЛИТЕРАТУРЫ
сокой мембранной активностью [28]. Частота об-
1. Х. М. Касумов, Структура и мембранная функция
разования и размер агрегированных ассоциатов
полиеновых макролидных антибиотиков (Наука, М.,
возрастает с увеличением концентрации ПА [29].
2009).
Диаметр левориновой полупоры составляет 8 Å,
2. S. B. Zotchev, Curr. Med. Chem. 10, 211 (2003).
что согласуется с данными работы [30]. Исполь-
3. K. C. Gray, D. S. Palacios, I. Dailey, et al., Proc. Natl.
зование ПА в комплексе с ДМСО усиливает эф-
Acad. Sci. USA 109, 2234 (2012).
фективность биологического действия ПА на ли-
4. E. Grela, A. Zdybicka-Barabas, B. Pawlikowska-Paw-
пидные мембраны [15, 16]. Здесь с большой веро-
lega, et al., Sci. Rep. 9 (1), 17029 (2019).
ятностью можно говорить о том, что увеличение
5. Y. Nakagawa, Y. Umegawa, T. Takano, et al., Bio-
числа молекул антибиотика, встроенного в мем-
chemistry 53 (19), 3088 (2014).
брану, связано с совершением работы силами по-
6. E. Borowski, Farmaco 55, 206 (2000).
верхностного натяжения. Благодаря тому, что
7. E. Borowski, M. Malyshkina, S. Soloviev, and
значение диэлектрической проницаемости
T. Ziminski, Chemotherapia 10, 178 (1966).
ДМСО (ε = 48.9) находится между величинами
8. A. И. Филипова и Ю. Д. Шенин, Антибиотики 19
для воды и жиров, происходит уменьшение коэф-
(1), 32 (1974).
фициента распределения ПА между мембраной и
9. P. Szczeblewski, T. Laskowski, B. Kubacki, et al., Sci.
водой. Исходя из изложенных данных, можно
Rep. 7, 40158 (2017).
высказать предположение о том, что леворин,
10. J. Zielinski, J. Gumieniak, J. Golik, et al., In Proc. Int.
являясь каналообразующим соединением, может
Symp. on Antibiotics (Weimar, GDR, 1979), B16.
индуцировать в мембранах формирование до-
11. J. Zielinski, H. Borowy-Borowski, J. Golik, et al., Tet-
полнительных каналов проницаемости и при ин-
rahedron Lett. 20 (20), 1791 (1979).
тенсивной мышечной активности усилить пере-
12. N. Shvinka, Proc. Latv. Acad. Sci. 56, 57 (2001).
нос катионов и энергозависимых субстратов в
13. Zh.-W. Yu and P. J. Quinn, Biosci. Rep. 14, 259 (1994).
клетки.
14. В. В. Зенин, Автореф. дис. … канд. биол. наук
(РАН, Л., 1979).
15. В. Х. Ибрагимова, Д. И. Алиев и И. Н. Алиева,
ВЫВОДЫ
Биофизика 47 (5), 833 (2002).
Изложенные выше результаты проведенных
16. V. Ibragimova, I. Alieva, Kh. Kasumov, et al., Biochim.
Biophys. Acta 1758, 29 (2006).
экспериментов позволяют высказать предполо-
жение о том, что путем встраивания в мембраны
17. N. Shvinka and G. Caffner, Biophys. J. 67, 143 (1994).
гептаенового антибиотика леворина А2 с установ-
18. N. Shvinka and G. Caffner, Eur. Biophys. J. 24, 23
ленной химической структурой молекул можно
(1995).
моделировать процесс формирования каналов в
19. Н. Э. Швинка и Г. Кафнер, Биол. мембраны 6, 1216
клеточных мембранах и экспериментально осу-
(1989).
ществить трансмембранный перенос ионов и уг-
20. S. C. Hartsel, S. K. Benz, W. Ayenew and J. Bolard,
леводов в клетки.
Eur. Biophys. J. 23, 125 (1994).
БИОФИЗИКА том 65
№ 4
2020
СВОЙСТВА ИОННЫХ КАНАЛОВ В ЛИПИДНЫХ МЕМБРАНАХ
721
21. A. A. Samedova, T. P. Tagi-zade, and Kh. M. Kasu-
26. J. Starzyk, M. Gruszecki, K. Tutaj, et al., J. Phys.
mov, Rus. J. Bioorg. Chem. 44 (3), 337 (2018
Chem. 118 (48), 13821 (2014).
27. W. Grudzinski, J. Sagan, R. Welc, et al., Sci. Rep. 13
22. J. F. Aparicio, P. Caffrey, J. A. Gil, and S. B. Zotchev,
(6), 32780 (2016).
Appl. Microbiol. Biotechnol. 61, 179 (2003).
28. E. Grela, M. Wieczór, R. Luchowski, et al., Mol.
23. M. N. Preobrazhenskaya, E. N. Olsufyeva, S. E. Solo-
Pharm. 15 (9), 4202 (2018) .
vieva, et al., J. Med. Chem. 52, 189 (2009).
29. J. Mazerski and E. Borowski, Biophys. Chem. 57, 205
24. D. S. Palacios, L. Dailey, D. M. Siebert, et al., Proc.
(1996).
Natl. Acad. Sci. USA 108 (17), 6733 (2011).
30. С. А. Ф. Ел-Суфи, Автореф. канд. … дис. биол.
25. W. I. Gruszecki, M . Gagoś, and M Hereć, J.
наук (Ташкент, Ин-т биохимии АН Узбекистана,,
Photochem. Photobiol. 69, 49 (2003).
1992).
Properties of Ion Channels in Lipid Membranes Modified by Levorin А2,
an Aromatic Antibıotic
T.P. Taghi-zada and Kh.M. Kasumov
Department of Medical and Biological Sciences, Azerbaijan State Academy of Physical Education and Sport,
prosp. Fatali Khan Khoyski, 98, Baku, AZ 1072 Azerbaijan
It is shown that the main components of levorin A complex consisting of antibiotics of the aromatic group
designated as A0, A1, A2, A3 increase the permeability of membranes for: A3 > A2 > A1 > A0 when added to
one side of the membrane. All components of levorin produce a cation-selective conductance. Levorin А2,
which has been extensively studied in our research, promotes increased permeability of membranes to potas-
sium ions. The membrane potential for a tenfold change in KCI concentration gradient is 56 ± 2 mV. It has
been shown that that injection of the same concentration of levorin А2 to one side and then, after determining
typical membrane permeability, to the other side of the membrane generates a two-fold increase in total
membrane permeability. This means that independent levorin-induced conductive semi-pores are formed on
each side of the membrane. It has been found that injection of levorin А2 only to one-side of the membranes
enhances membrane permeability for monosaccharides and other neutral molecules. In the presence of
levorin А2 on membranes of phospholipids with cholesterol, ergosterol and stigmasterol, the single-channel
conductance of typical ion channels was 0.2-0.5 pS and the properties of these channels were studied.
Levorin channels exist in two states: open and closed. In KBr solution the channel remains most of the
time in the open state. In solutions containing different salts, but with the same molarity, the conductance
value of levorin channels is approximately the same (0.4-0.5 pS). Increasing the concentration of dimethyl
sulfoxide in aqueous solution facilitates the transition of molecules of polyene antibiotics from dispersed to
monomolecular form. The molecules of polyene antibiotics, formed by association, exhibit high membrane
activity.
Keywords: polyene macrolide antibiotics, levorin A2, lipid membrane, membrane permeability, ion channels, di-
methyl sulfoxide
БИОФИЗИКА том 65
№ 4
2020