БИОФИЗИКА, 2020, том 65, № 4, с. 722-727
БИОФИЗИКА КЛЕТКИ
УДК 57.053.2: 612.117.5: 612.117.7
ВЛИЯНИЕ ГАЗОМЕДИАТОРОВ НА Са2+-ЗАВИСИМУЮ КАЛИЕВУЮ
ПРОНИЦАЕМОСТЬ МЕМБРАНЫ КРАСНЫХ КЛЕТОК КРОВИ
© 2020 г. И.В. Петрова*, Ю.Г. Бирулина*, С.Н. Беляева**, О.А. Трубачева*, **,
А.В. Сидехменова***, Л.В. Смаглий*, И.В. Ковалев*, С.В. Гусакова*
*Сибирский государственный медицинский университет Минздрава России, 634050, Томск, Московский тракт, 2
**НИИ кардиологии Томского НИМЦ РАН, 634012, Томск, Киевская ул., 111а
***НИИ фармакологии и регенеративной медицины им. Е.Д. Гольдберга Томского НИМЦ РАН,
634028, Томск, просп. Ленина, 3
E-mail: ivpetrova57@yandex.ru
Поступила в редакцию 02.12.2019 г.
После доработки 31.01.2020 г.
Принята к публикации 27.05.2020 г.
Исследовано влияние газовых посредников H2S и СО на Са2+-зависимые калиевые каналы и ани-
онный обменник, которые участвуют в формировании гиперполяризации мембраны эритроцитов,
а также играют важную роль в регулировании объема и деформируемости эритроцитов. Установле-
но, что в присутствии доноров H2S и СО существенно снижается амплитуда редокс-стимулирован-
ной гиперполяризации мембраны вследствие снижения активности Са2+-зависимых калиевых ка-
налов. Также обнаружено, что H2S и СО устраняют снижение объема эритроцитов, отмечаемое при
активации Са2+-зависимых калиевых каналов или блокировании анионного обменника. Показано,
что H2S достоверно увеличивает деформируемость эритроцитов.
Ключевые слова: эритроциты, монооксид углерода, сероводород, Са2+-зависимые калиевые каналы,
анионный обменник, деформируемость.
DOI: 10.31857/S0006302920040122
КСа-каналов каналов является их участие в регу-
Реологические свойства крови во многом обу-
словлены способностью красных кровяных телец
ляции апоптоза красных клеток крови [5]. Пока-
деформироваться при прохождении через микро-
зано, что при различных заболеваниях, в том чис-
циркуляторное русло и поддерживать свой посто-
ле и при сердечно-сосудистой патологии, сокра-
янный объем. Два тесно взаимосвязанных про-
щается продолжительность жизни эритроцитов,
цесса, которые зависят от структурных свойств
снижается их деформируемость, увеличивается
внутриклеточная концентрация ионов кальция
компонентов цитоскелета, степени взаимодей-
[1, 6].
ствия цитоскелета и интегральных трансмем-
бранных комплексов, которое достигается анки-
В то же время основная функция эритроцитов
рином, белками 4.1, 4.2 и белком полосы 3 (из-
заключается в транспортировке кислорода в свя-
вестным как анионный обменник (AE1)) [1], а
зи с гемоглобином. Сродство кислорода к гемо-
глобину можно регулировать, изменяя, напри-
также от активности ион-транспортных систем
мер, объем клеток (и, следовательно, концентра-
эритроцитарной мембраны [2].
цию гемоглобина) и уровень рН внутри
Установлено, что заметное уменьшение объе-
эритроцитов. Изменения напряжения кислорода,
ма эритроцитов опосредовано так называемым
в свою очередь, могут контролировать активность
Gardos-эффектом, который представляет собой
ионных переносчиков [7, 8], которые участвуют в
поддержании клеточного объема и рН. Помимо
индуцированную ионами Са2+ потерю катионов
молекулярного кислорода как такового, актив-
калия через Са2+-зависимые К+-каналы (КСа-ка-
ные формы кислорода, оксид азота (NO), моно-
налы, Gardos-каналы) [3, 4]. Одной из функций оксид углерода (CO), сероводород (H2S) могут иг-
рать роль в регуляции ион-транспортных систем
Сокращения: КСа-каналы - Са2+-зависимые калиевые ка-
эритроцитов при условии, что они подвержены
налы, ФМС - феназинметасульфат, CORM-2 - бис(ди-
хлорид трикарбонилрутения), ГО - гиперполяризацион-
влиянию напряжения кислорода. Имеющиеся
ный ответ.
данные о вовлечении эндогенно синтезируемых
722
ВЛИЯНИЕ ГАЗОМЕДИАТОРОВ
723
газовых молекул - H2S и CO в механизмы внут-
бис(дихлорид трикарбонилрутения) (CORM-2) -
ри- и межклеточной коммуникации дополни-
добавляли за 5 мин до внесения в суспензию
тельно указывает на значимость данных агентов в
эритроцитов агентов, вызывающих гиперполяри-
регуляции жизнедеятельности клеток, тканей и
зацию мембраны.
организма в целом [9-11]. Существенный про-
Регистрацию изменений объема эритроцитов
гресс в исследованиях реакций, опосредованных
выполняли спектрофотометрическим методом,
газотрансмиттерами, достигнут в связи с откры-
согласно которому при изменении объема клеток
тием способности некоторых химических соеди-
изменяется светопропускание, значит, и оптиче-
нений воспроизводить эффекты данных сигналь-
ская плотность суспензии эритроцитов [13]. Оп-
ных молекул, действуя в качестве их доноров.
тическая плотность вычисляется как десятичный
Однако сведения о действии H2S и СО на клетки
логарифм отношения потока излучения, падаю-
крови весьма немногочисленны и носят скорее
щего на объект, к потоку излучения прошедшего
констатирующий характер, что оставляет ряд
через него (отразившегося от него): D = lgI0/I, где
нерешенных вопросов о механизмах воздействия
D - оптическая плотность (I0 и I - интенсивно-
сигнальных молекул на системы ионного пере-
сти падающего и ослабленного пучков света). Оп-
носа.
тическую плотность определяли при λ = 800 нм
В связи с вышесказанным целью исследова-
(спектрофотометр UNICO-2800, United Products
ния явилось изучение механизмов регуляции
& Instruments, США). Для спектрофотометриче-
Са2+-зависимой калиевой гиперполяризации
ских измерений упакованные эритроциты разво-
мембраны эритроцитов.
дили в среде их инкубации в соотношении 1:100.
В исследуемой суспензии количество эритроци-
тов варьировало от 4 ⋅ 107 до 5 ⋅ 107 кл./мл, объем
МАТЕРИАЛЫ И МЕТОДЫ
кварцевой кюветы составлял 3.5 мл.
Материалом исследования являлась венозная
Исследование деформируемости эритроцитов
кровь, которую забирали из локтевой вены до-
проведено методом эктацитометрии на анализа-
норов утром натощак в пробирки типа BD
торе RheoScan-AnD 300 (Rheo Meditech. Inc., Ко-
Vacutainer® с гепарином лития (17 МЕ/мл). В ис-
рея) c помощью набора картриджей RSD-К02 в
следование были включены 25 здоровых добро-
диапазоне напряжений сдвига 1-20 Па. Для ха-
вольцев (15 мужчин и 10 женщин) в возрасте от 38
рактеристики деформируемости эритроцитов ис-
до 62 лет, не имеющих в анамнезе сердечно-сосу-
пользовали индекс элонгации [14].
дистых, эндокринных и генетических заболева-
Статистическую обработку полученных резуль-
ний. Из цельной гепаринизированной крови по-
татов проводили при помощи программы SPSS
лучали осадок эритроцитов путем центрифугиро-
Statistics 22. Достоверность различий определяли
вания (5 мин, 1000 g, 4°С), затем удаляли плазму и
непараметрическими критериями: U-критерий
клетки белой крови, а эритроциты дважды отмы-
Манна-Уитни для независимых и Т-критерий
вали 150 мМ NaCl, содержащим фосфатно-соле-
Вилкоксона для зависимых выборок. Данные
вой буфер (5 мМ, рН 7.4), при тех же условиях
представлены в виде медианы (Me) и межквар-
центрифугирования. Полученный осадок эрит-
тильного размаха (Q1; Q3).
роцитов промывали изоосмотической средой
(320 мОсм/л), содержащей 150 мМ NaCl, 10 мM
глюкозы, 1 мМ KCl, 1 мM MgCl2. После этого
РЕЗУЛЬТАТЫ
эритроциты переносили на лед и хранили не бо-
лее 12 ч.
Изучение влияния газотрансмиттеров на меха-
низмы регуляции Gardos-каналов эритроцитов. До-
Изучение Са2+-зависимой калиевой проницае-
бавление искусственной электронно-донорной
мости мембраны эритроцитов выполняли потен-
системы «аскорбат-ФМС» к суспензии эритро-
циометрическим методом путем непрерывной
цитов приводит к развитию гиперполяризации
регистрации мембранного потенциала клеток по
мембраны красных клеток крови, изменение ам-
изменениям рН среды, основанным на том, что в
плитуды которой служит интегральной характе-
присутствии протонофора (СlССP, carbonylcya-
nide-m-chlorophenylhydrazone), 20 мкМ) распре-
ристикой Са2+-управляемой К+-проницаемости
мембраны эритроцитов. Добавление NaHS в кон-
деление Н+ зависит от мембранного потенциала
центрациях 5 и 10 мкМ в среду инкубации эрит-
как Em = (pHi - pH0)RT/F, где pHi и pH0 - значе-
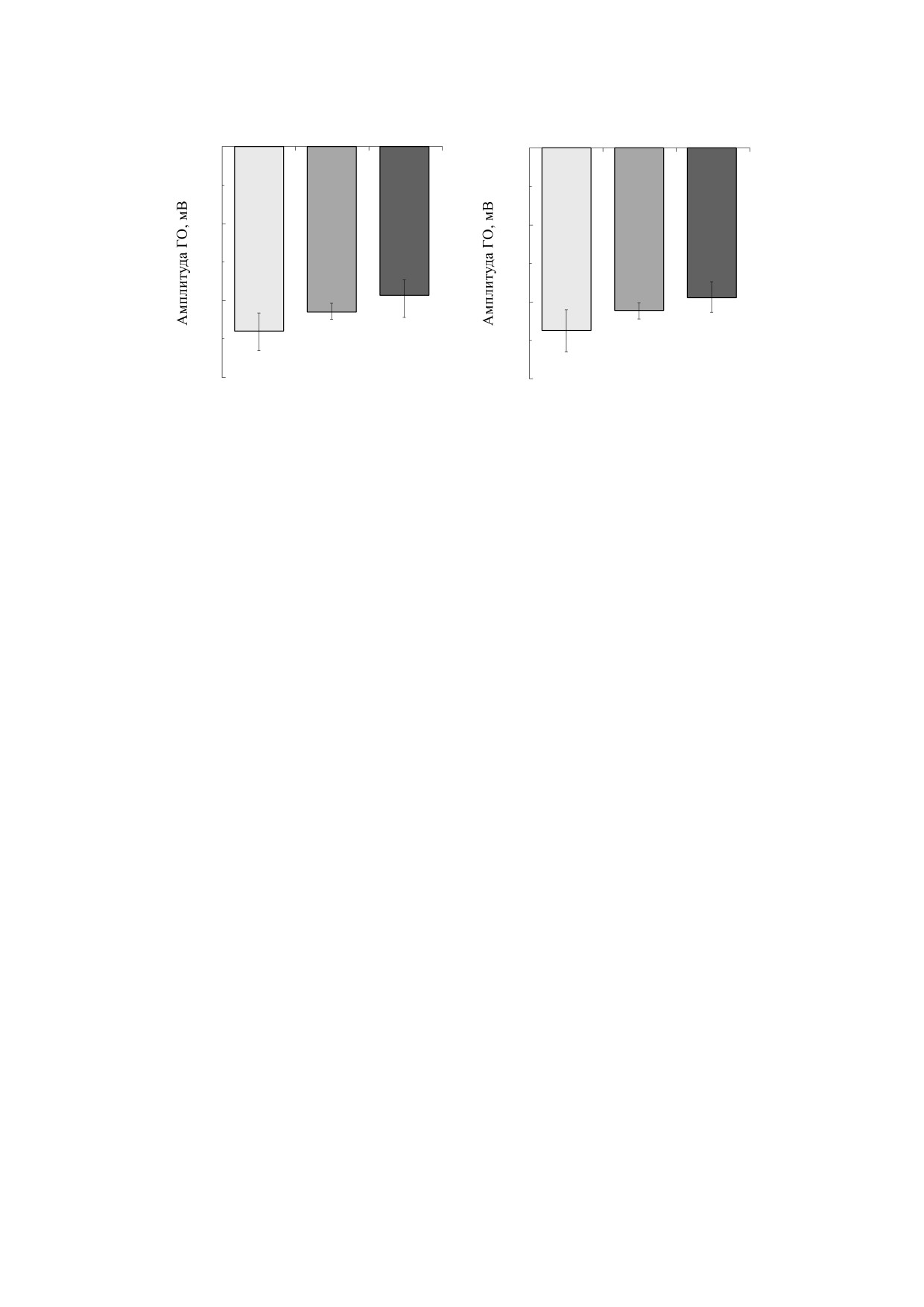
роцитов достоверно снижало амплитуду гиперпо-
ния pH цитоплазмы и среды инкубации соответ-
ляризационного ответа (ГО) на 12% (n = 8,
ственно. Для активации КСа-каналов использо-
p < 0.05) и на 23% (n = 8, p < 0.05) по сравнению с
вали искусственную электронно-донорную си-
контролем соответственно (рис. 1а). В присут-
стему аскорбат (10 мМ) - феназинметасульфат
ствии 5 и 10 мкМ CORM-2 в среде инкубации
(ФМС, 0,1 мМ) [12]. Доноры H2S и CO - NaHS и
эритроцитов редокс-индуцированный ГО сни-
БИОФИЗИКА том 65
№ 4
2020
724
ПЕТРОВА и др.
(а)
(б)
0
0
20
20
40
40
*
*
*
*
Контроль
+ NaHS,
+ NaHS,
Контроль + CORM-2,
+ CORM-2,
60
60
5 мкМ
10 мкМ
5 мкМ
10 мкМ
Рис. 1. Влияние NaHS (а) и СОRM-2 (б) на гиперполяризацию мембраны эритроцитов; * - р < 0.05 по сравнению с
контролем.
зился на 10% (n = 7, p < 0.05) и 20% (n = 7, p < 0.05)
лица). Инкубация эритроцитов с блокатором
по сравнению с контролем соответственно
КСа-каналов клотримазолом (3 мкМ) устраняла
(рис. 1б).
описанный эффект.
Показано, что определенный вклад в развитие
ГО мембраны эритроцитов вносит электроней-
Добавление к суспензии эритроцитов NaHS в
тральный Cl-/HCO-3-обменник [15]. Инкубация
концентрациях 5 и 10 мкМ на фоне активации
Gardos-каналов вызывало уменьшение показате-
эритроцитов в присутствии блокатора анионного
ля оптической плотности (p < 0.05) по сравнению
обмена SITS (100 мкМ) приводила к увеличению
амплитуды редокс-зависимого ГО на 35.2% от
с контролем. Таким образом, донор H2S снижал
контрольного значения (n = 8, p < 0.05). Инкуба-
эффект сжатия эритроцитов, возникающий в ре-
ция эритроцитов в присутствии SITS и NaHS вы-
зультате активации КСа-каналов. Сходное влия-
звала снижение исследуемого параметра по срав-
ние на величину оптической плотности оказывал
нению со значениями, полученными в отсутствие
и донор СО в различных концентрациях, тем са-
NaHS. Так, амплитуда ГО при совместном дей-
ствии SITS и 5 или 10 мкМ NaHS составила отно-
мым приводя к увеличению объема красных кле-
сительно контрольного значения -52.3 (-58.8,
ток (таблица).
-47.1) мВ (n = 6, p < 0.05) и -25.4 (-35.8, -18.6) мВ
(n = 6, p < 0.05) соответственно. Аналогичные
Блокирование Cl-/HCO-3-обменника приво-
данные были получены и при сочетанном дей-
дило к статистически значимому увеличению по-
ствии SITS и CORM-2: в концентрации 5 мкМ
казателя оптической плотности на 15% (n = 10,
CORM-2 снижал величину ГО до -53.5 (-56.2,
p < 0.05) по сравнению с контролем. Присутствие
-44.2) мВ (n = 6, p < 0.05), 10 мкМ CORM-2 - до
доноров H2S или СО в концентрациях 5, 10 мкМ
-24.4 (-35.6, -17.7) мВ (n = 6, p < 0.05) соответ-
ственно.
в суспензии эритроцитов совместно с SITS вызы-
вало снижение показателя оптической плотности
Полученные результаты свидетельствуют, что
доноры H2S и CO снижают амплитуду редокс-
суспензии эритроцитов, что свидетельствовало о
набухании эритроцитов.
стимулированного ГО, развитие которого обес-
печивается Gardos-каналами и транспортом ани-
Изучение деформируемости эритроцитов при
онов хлора.
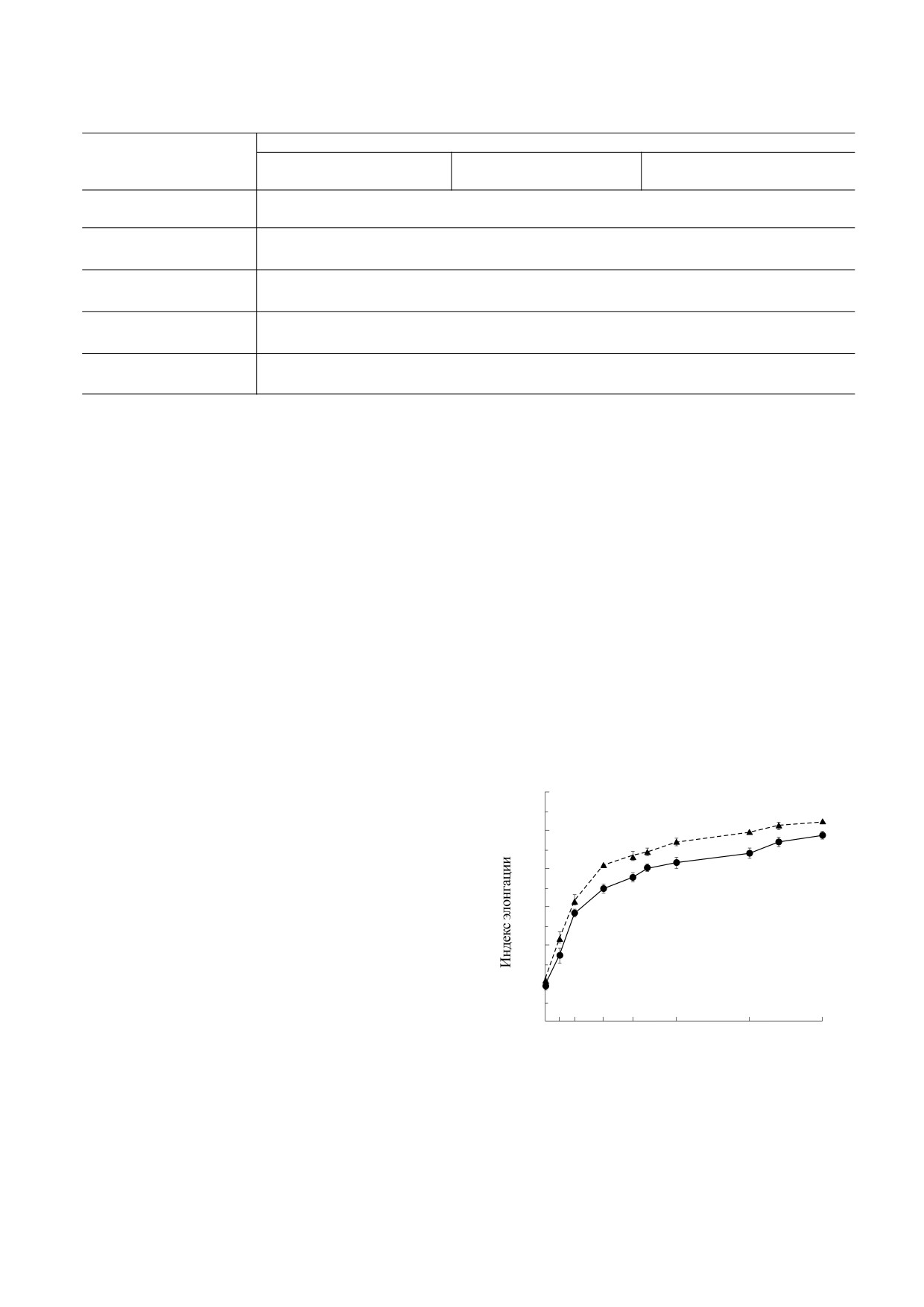
действии сероводорода. Исследование деформи-
Исследование влияния газомедиаторов на изме-
руемости эритроцитов эктацитометрическим ме-
нения объема эритроцитов. С помощью фотомет-
тодом показало, что обработка красных клеток
рического метода было показано, что стимуляция
крови донором H2S в концентрации 10 мкМ вы-
Са2+-зависимой калиевой проницаемости мем-
зывала увеличение индекса элонгации при раз-
браны эритроцитов с помощью редокс-системы
«аскорбат-ФМС» вызывает увеличение оптиче-
личных величинах напряжения сдвига, что свиде-
ской плотности суспензии эритроцитов (p < 0.05),
тельствовало об увеличении деформируемости
что может отражать процесс сжатия клеток (таб-
красных клеток крови (рис. 2).
БИОФИЗИКА том 65
№ 4
2020
ВЛИЯНИЕ ГАЗОМЕДИАТОРОВ
725
Изменение оптической плотности суспензии эритроцитов при действии NaHS и СОRM-2
Оптическая плотность (D)
Группа
+ Аскорбат-ФМС + SITS,
- Аскорбат-ФМС
+ Аскорбат-ФМС
100 мкМ
Контроль
0.793
0.825
0.912
(0.784; 0.802)
(0.818; 0.836)
(0.905;0.918)
NaHS, 5 мкМ
0.766*
0.815*#
0.896*#
(0.757; 0.775)
(0.757; 0.775)
(0.886; 0.905)
NaHS, 10 мкМ
0.761*
0.786*#
0.875*#
(0.756; 0.768)
(0.770; 0.798)
(0.870; 0.883)
CORM-2, 5 мкМ
0.755*
0.820*#
0.882*#
(0.748; 0.760)
(0.815; 0.830)
(0.905; 0.918)
CORM-2, 10 мкМ
0.746*
0.788*#
0.870*#
(0.739; 0.754)
(0.774; 0.795)
(0.864; 0.879)
Примечание. Данные приведены в виде Me (Q1; Q3); * - р < 0.05 по сравнению с контролем в каждой группе; # - р < 0.05 по
сравнению с действием NaHS или CORM-2 в отсутствии редокс-системы «аскорбат-ФМС».
ОБСУЖДЕНИЕ
быть взаимодействие H2S или СО с белками ка-
В течение последних трех десятилетий элек-
нала или его регуляторными белками, в частно-
трофизиологические исследования показали, что
сти протеинкиназами [19]. Отмечено, что для H2S
мембрана эритроцитов наделена большим разно-
основными мишенями для передачи сигналов яв-
образием ион-транспортных систем, которые
ляются окисленное железо, которое в небольшом
участвуют в гомеостазе катионной и, в меньшей
количестве присутствует в эритроцитах, и тиоло-
степени, анионной проводимости клеток [6, 16].
вые группы белков. При этом наиболее вероятно
Известно, что активация KCa-каналов, способ-
образование в клетках производных H2S персуль-
ствуя массивной утечке ионов калия наружу из
фида (R-SSH) и полисульфидов (R-SnH) [20, 21],
клеток, приводит к их обезвоживанию и сжатию
которые оказывают влияние на функциональную
[4, 8].
активность белков, в том числе и ионных кана-
В настоящем исследовании для стимуляции
лов. Также H2S может вызывать модификацию
KCa-каналов эритроцитов была использована ис-
белков за счет реакций сульфгидрирования, в том
кусственная электронно-донорная система «ас-
числе образования сульфгемоглобина [10]. В то
корбат-ФМС». Согласно работе [12], данная си-
же время, несмотря на высвобождение СО из
CORM-2, который связывается с гемоглобином
стема модулирует Са2+-зависимую калиевую
проницаемость мембраны за счет увеличения
сродства KCa-каналов к ионам Са2+. Однако воз-
0.6
можны и другие пути регуляции калиевой прони-
*
цаемости мембраны эритроцитов, не связанные с
*
0.5
ионами кальция. Показано, что добавление ас-
* *
*
корбата и ФМС в среду инкубации эритроцитов
0.4
приводит к образованию редокс-агентов, кото-
рые, возможно, оказывают свое влияние на Са2+-
0.3
зависимую калиевую проницаемость мембраны
эритроцитов опосредованно через SH-группы [4,
0.2
17], которые являются конечным или промежу-
точным акцептором в электронном транспорте на
0.1
мембране эритроцитов [18].
Как было установлено в настоящей работе, в
0.0
присутствии различных концентраций доноров
123
5
7
10
15
20
H2S или СО наблюдается снижение амплитуды
Напряжение сдвига, Па
ГО мембраны эритроцитов, что свидетельствует о
подавлении Са2+-зависимой калиевой проводи-
Рис. 2. Влияние NaHS на деформируемость эритро-
цитов: сплошная линия - изменение индекса элонга-
мости мембраны и, соответственно, уменьшении
ции в отсутствие NaHS, пунктирная линия - в при-
потерь ионов калия клеткой. Наиболее вероятны-
сутствии NaHS (10 мкМ); * - р < 0.05 по сравнению с
ми причинами обнаруженного эффекта может
показателем в отсутствие донора H2S.
БИОФИЗИКА том 65
№ 4
2020
726
ПЕТРОВА и др.
эритроцитов с образованием карбоксигемогло-
щей разработки подходов к управлению газовой
бина (HbCO), отмечается, что содержание HbCO
коммуникацией.
составляет менее 5% [11].
Полученные данные свидетельствуют, что H2S
Важно, что стимуляция KCa-каналов также со-
и СО оказывают существенное влияние на ион-
транспортную функцию мембраны эритроцита.
здает движущую силу для удаления хлора из эрит-
роцитов. В работе [22] было показано, что блока-
Уменьшение амплитуды редокс-вызванной ги-
перполяризации мембраны в присутствии газо-
торы хлорного тока оказывают определенное воз-
трансмиттеров имеет важное значение в механиз-
действие на калиевую проницаемость мембраны
мах регуляции объема и деформируемости эрит-
эритроцитов. В настоящем исследовании блоки-
роцитов.
рование хлорной проводимости мембраны кле-
ток крови с помощью SITS приводило к суще-
ственному росту амплитуды гиперполяризацион-
ФИНАНСИРОВАНИЕ РАБОТЫ
ного ответа. Инкубация эритроцитов с донорами
Исследование выполнено при финансовой
H2S или СО существенно снижала этот эффект.
поддержке Российского фонда фундаментальных
Полученные данные свидетельствуют о влиянии
исследований (в рамках научного проекта №19-
газотрансмиттеров не только на KCa-каналы, но и
415-703015) и Совета по грантам Президента Рос-
на анионный транспорт. Важно отметить, что
сийской Федерации (грант МК-143.2020.4).
анион-транспортную функцию осуществляет бе-
лок полосы 3 мембраны эритроцитов, который
является одним из белков цитоскелета красных
КОНФЛИКТ ИНТЕРЕСОВ
клеток крови [15]. Это позволяет предположить,
Авторы заявляют об отсутствии конфликта
что мишенью для H2S и СО могут быть и белки
интересов.
цитоскелета эритроцитов, участвующие в регуля-
ции трансмембранного транспорта ионов.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Так же как и в других клетках, в эритроцитах
В работе соблюдались этические стандарты,
реализуется Ca2+-зависимая передача сигналов
разработанные в соответствии с Хельсинкской
не только в обеспечении физиологических пара-
декларацией (с поправками 2013 г.) и Правилами
метров, но и для управления биофизическими
надлежащей клинической практики (приказ МЗ
свойствами, такими как объем клеток и деформи-
РФ от 01.04.2016 г.). Все лица, участвующие в ис-
руемость [23-25]. В настоящем исследовании
следовании, дали информированное согласие.
спектрофотометрическим методом было показа-
но, что активация KCa-каналов с помощью искус-
ственной редокс-системы, как и блокирование
СПИСОК ЛИТЕРАТУРЫ
Cl-/HCO-3-обменника, вызывала увеличение
1. R. Huisjes, A. Bogdanova, W. W. van Solinge, et al.,
Front. Physiol. 9, 656 (2018).
показателя оптической плотности суспензии кле-
ток, что может объясняться сжатием эритроци-
2. H. Guizouarn, N. Gabillat, R. Motais, and F. Borgese,
тов. В то же время инкубация эритроцитов с
J. Physiol. 535 (Pt 2), 497 (2001).
NaHS или CORM-2 нивелировала уменьшение
3. A. Bogdanova, A. Makhro, J. Wang, et al., Int. J. Mol.
объема клеток, вызванное системой «аскорбат-
Sci. 14, 9848 (2013).
ФМС» и SITS, что подтверждают данные потен-
4. A. D. Maher and P. W. Kuchel, Int. J. Biochem. Cell
циометрического исследования о роли калиевой
Biol. 35 (8), 1182 (2003).
и хлорной проводимости в развитии ГО. Также
5. F. Lang, E. Lang, and M. Föller, Transfus. Med.
было обнаружено увеличение деформируемости
Hemother. 39 (5), 308 (2012).
красных клеток крови в присутствии донора H2S.
6. S. L. Thomas, G. Bouyer, A. Cueff, et al., Blood Cells,
Учитывая результаты проведенного исследова-
Molecules & Diseases 46 (4), 261 (2011).
ния, можно предположить, что этот эффект свя-
зан с влиянием H2S на ион-транспортные систе-
7. J. S. Gibson, A. R. Cossins, and J. C. Ellory, J. Exp. Bi-
ol. 203 (Pt 9), 1395 (2000).
мы клетки, в первую очередь, на KCa-каналы.
8. A. Bogdanova, M. Berenbrink, and M. Nikinmaa, Acta
Physiol. 195, 305 (2009).
ВЫВОДЫ
9. S. V. Gusakova, I. V. Kovalev, Y. G. Birulina, et al.,
Biophysics 62 (2), 220 (2017).
Выяснение механизмов воздействия газо-
трансмиттеров на клетки крови имеет существен-
10. E. Dongó, G. Beliczai-Marosi, A. S. Dybvig, and
ное значение не только с позиции получения
L. Kiss, Nitric Oxide 81, 75 (2018).
фундаментального знания о принципах внутри- и
11. I. Barbagallo, G. Marrazzo, A. Frigiola, et al., Curr.
межклеточной сигнализации, но и для последую-
Pharm. Biotechnol. 13 (6), 787 (2012).
БИОФИЗИКА том 65
№ 4
2020
ВЛИЯНИЕ ГАЗОМЕДИАТОРОВ
727
12. I. Bernhardt and J. C. Ellory, Red Cell Membrane
19. B. Del Carlo, M. Pellegrini, and M. Pellegrino, Bio-
Transport in Health and Disease (Springer, Berlin,
chim. Biophys. Acta 1612 (1): 107 (2003).
2013).
20. C. L. Bianco, A. Savitsky, M. Feelisch, and M. M. Cor-
13. S. P. Srinivas, J. A. Bonanno, E. Lariviere, et al.,
tese-Krott, Biochem. Pharmacol. 149, 163 (2018).
Pflugers Arch. 447 (1), 97 (2003).
21. M. L. Jennings, Am. J. Physiol. Cell Physiol. 305, C941
14. S. Shin, Y. Ku, M. S. Park, and J. S. Suh, Korea Austra-
(2013).
lia Rheology Journal 16 (2), 85 (2004).
15. A. C. Kalli and R. A. F. Reithmeier, PLOS Comput. Bi-
22. Y. V. Kucherenko, L. Wagner-Britz, I. Bernhardt, and
ol. 14 (7), 1 (2018).
F. Lang, J. Membr. Biol. 246 (4), 315 (2013).
16. А. А. Платонова, С. В. Кольцова, Г. В. Максимов и
23. E. Lang, S. M. Qadri, K. Jilani, et al. Basic Clin. Phar-
др., Биофизика 58 (3), 501 (2013).
macol. Toxicol. 111 (5), 348 (2012).
17. А. В. Ситожевский, И. В. Петрова, С. В. Кремено и
24. С. Н. Орлов, И. В. Петрова, Н. И. Покудин и др.,
др., Рос. физиол. журн. им. И.М. Сеченова 92 (4),
Биол. мембраны 9 (9), 885 (1992).
461 (2006).
18. Y. Yang, X. Jin, and C. Jiang, Antioxid. Redox Signal.
25. A. Dyrda, U. Cytlak, A. Ciuraszkiewicz, et al., PLoS
20 (6), 937 (2014).
One 5 (2), e9447 (2010).
The Effects of Gasomediators on the Са2+-Dependent Potassium Permeability
of the Red Blood Cells Membrane
I.V. Petrova*, Yu.G. Birulina*, S.N. Belyaeva**, O.A. Trubacheva*, **, A.V. Sidekhmenova***,
L.V. Smagliy*, I.V. Kovalev*, and S.V. Gusakova*
*Siberian State Medical University, Moskovsky trakt 2, Tomsk, 634050 Russia
**Cardiology Research Institute, Tomsk National Research Medical Center of the Russian Academy of Sciences,
Kievskaya ul. 111a, Tomsk, 634012 Russia
***Goldberg Research Institute of Pharmacology and Regenerative Medicine, Tomsk National Research Medical Center
of the Russian Academy of Sciences, prosp. Lenina 3, Tomsk, 634028 Russia
We investigated the effects of gasomediators H2S and CO on Ca2+-dependent potassium channels and an an-
ion exchanger, which participate in the induction of a hyperpolarization response of the erythrocyte mem-
brane and also play an important role in regulation. We showed that in the presence of H2S and CO donors,
the amplitude of redox-stimulated membrane hyperpolarization decreases significantly due to a decrease in
the activity of Ca2+-dependent potassium channels. In addition, it was found that gasomediators eliminate
the compression of red blood cells observed during activation of Ca2+-dependent potassium channels or in-
hibition of the anion exchanger. It was shown that the H2S donor significantly increases the deformability of
red blood cells.
Keywords: erythrocytes, carbon monoxide, hydrogen sulfide, Ca2+-dependent potassium channels, anion ex-
changer, deformability
БИОФИЗИКА том 65
№ 4
2020