БИОФИЗИКА, 2020, том 65, № 4, с. 735-740
БИОФИЗИКА КЛЕТКИ
УДК 577.3
СНИЖЕНИЕ ПРОДУКЦИИ СУПЕРОКСИДНОГО АНИОН-РАДИКАЛА
В НЕЙТРОФИЛАХ В РЕЗУЛЬТАТЕ ДЕЙСТВИЯ «НУЛЕВОГО»
МАГНИТНОГО ПОЛЯ
© 2020 г. В.В. Новиков, Е.В. Яблокова, И.А. Шаев, Е.Е. Фесенко
Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, ул. Институтская, 3
E-mail: docmag@mail.ru
Поступила в редакцию 21.04.2020 г.
После доработки 21.04.2020 г.
Принята к публикации 07.05.2020 г.
Предварительная инкубация суспензии нейтрофилов в «нулевом» магнитном поле, создаваемом
системой магнитных экранов (остаточное постоянное магнитное поле не более 20 нТл), приводит к
существенному снижению интенсивности их люцигенин-зависимой хемилюминесценции. Добав-
ка в среду для инкубации ингибитора NADPH-оксидазы, дифенилйодония, приводит к снижению
интенсивности хемилюминесценции, как в опытных, так и в контрольных образцах (геомагнитное
поле). При этом различия между группами, обусловленные действием «нулевого» поля, проявляют-
ся, как при меньших концентрациях дифенилйодония (2.5, 5, 10 мкМ), так и при больших его кон-
центрациях (50, 100 мкМ), приблизительно в одинаковой степени. В отличие от этого добавка 2,4-
динитрофенола, разобщителя окисления и фосфорилирования в митохондриях, начиная с концен-
трации 5 мкМ и далее вплоть до 200 мкМ, практически полностью нивелировала различия между
контрольными и опытными образцами, которые проявлялись при более низких концентрациях
этого ингибитора и в его отсутствие.
Ключевые слова: нейтрофилы, нулевое магнитное поле, супероксидный-анион радикал, хемилюминесцен-
ция, люцигенин, NADPH-оксидаза, митохондрии.
DOI: 10.31857/S0006302920040146
жение интенсивности процессов окисления 2,7-
В литературе сообщается о снижении продук-
ции активных форм кислорода (АФК) в гипомаг-
дихлордигидрофлуоресцеина в неактивирован-
нитных условиях в различных типах клеток [1-4].
ных нейтрофилах в гипомагнитных условиях не
Ранее нами было показано, что экспонирование
зависит от кальций-опосредованных регулятор-
перитонеальных нейтрофилов мышей при маг-
ных механизмов, о чем свидетельствует отсут-
нитном экранировании в гипомагнитных услови-
ствие действия внутриклеточного хелатора ионов
ях вызывает снижение внутриклеточной продук-
кальция (ацетоксиметилового эфира 1,2-бис(2-
ции активных форм кислорода, регистрируемое
аминофенокси)этан-N,N,N',N´-тетрауксусной
по изменению интенсивности флуоресценции
кислоты) на интенсивность этого процесса [6].
продуктов окисления
2,7-дихлордигидрофлуо-
Это снижение вряд ли обусловлено влиянием ги-
ресцеина и дигидрородамина 123 [5-7]. Учитывая
помагнитных условий на фосфорилирование
то, что этот эффект действия гипомагнитного по-
компонентов НАДФН-оксидазы, так как добавка
ля проявлялся в опытах на нейтрофилах без до-
ингибитора протеинкиназы С (Ro 31-6233) прак-
полнительной их стимуляции химическими акти-
тически не отразилась на интенсивности флуо-
ваторами респираторного взрыва и, следователь-
ресценции внутриклеточного дихлордигидро-
но, не был обусловлен нарушением ответа
флуоресцеина [6]. Добавка ингибитора фосфоли-
нейтрофилов на эти стимулы, нами с целью опре-
пазы С (U73122) немного и приблизительно
деления возможных молекулярных механизмов
одинаково снизила продукцию АФК как в кон-
действия «нулевого» поля был проведен ком-
троле, так и в опыте [6]. О возможном участии
плекс специальных исследований на неактивиро-
электронтранспортной цепи митохондрий в ме-
ванных нейтрофилах [6]. Было показано, что сни-
ханизме этого эффекта «нулевого» поля свиде-
тельствует снижение продукции АФК при добав-
Сокращения: АФК - активные формы кислорода, МП -
ке ротенона, значительно более выраженное в
магнитное поле, САР - супероксидный анион-радикал.
735
736
НОВИКОВ и др.
опытных образцах, подвергшихся действию ги-
ной 5.5 см), в которых затем измеряли хемилюми-
помагнитного поля [6].
несценцию. Типичное время инкубации состав-
ляло 40 мин. Заданную температуру поддержива-
Все вышеперечисленные результаты были по-
ли циркуляционным термостатом.
лучены методом флуоресцентной спектроскопии
при использовании интенсивно реагирующих, но
Образцы контрольных групп находились в ло-
неселективных к определенным формам АФК
кальном геомагнитном поле с постоянной со-
флуоресцентных зондов (2,7-дихлордигидрофлу-
ставляющей ∼44 мкТл и уровнем магнитного фо-
оресцеина диацетата и дигидрородамина 123) [8-
на на 50 Гц 15-50 нТл при таком же температур-
10]. В данной работе для оценки радикалпродуци-
ном режиме, как и опытные образцы, и
рующей способности нейтрофилов после дей-
одновременно с ними. Опытные образцы поме-
ствия «нулевого» поля мы применили другой ме-
щали в установку для формирования гипомаг-
тод - метод активированной хемилюминесцен-
нитных условий.
ции с использованием селективного зонда на
супероксид-анион - люцигенина [11, 12]. Также
В опытах была использована специальная ис-
на этой экспериментальной модели с целью опре-
следовательская установка для формирования ги-
деления возможных источников продукции су-
помагнитных условий, которая позволяла полу-
пероксида, реагирующих на действие гипомаг-
чить высокую степень ослабления геомагнитного
нитного поля, мы применили ингибиторный ана-
поля - до 10000 раз (остаточное постоянное поле
лиз с использованием ингибитора NADPH-
не превышало 20 нТл) и существенно ослабляла
оксидазы дифенилйодония [13, 14] и разобщителя
переменные техногенные помехи (до единиц
окисления и фосфорилирования в митохондриях
нТл). Эта установка детально описана нами ранее
2,4 динитрофенола [15, 16].
[7, 17]. Она состоит из трех вставленных соосно
один в другой цилиндрических магнитных экра-
нов из пермаллоя (толщиной 1 мм). Определение
МАТЕРИАЛЫ И МЕТОДЫ
остаточных полей внутри установки проводили
прямым измерением с помощью феррозондового
Получение суспензии нейтрофилов. Работа вы-
магнитометра Mag-03 MS 100 (Bartington, Вели-
полнена на перитонеальных нейтрофилах мы-
кобритания). Для формирования эксперимен-
шей. Для получения нейтрофилов использовали
тального слабого однородного постоянного маг-
лабораторных мышей самцов линии CD-1 массой
нитного поля (МП) внутри этой установки был
24-26 г, полученных из питомника лабораторных
установлен специальный индуктор (соленоид),
животных ФИБХ РАН (Пущино, Московская об-
подключенный к источнику постоянного тока -
ласть). В перитонеальную полость мыши инъеци-
для формирования слабого постоянного МП раз-
ровали 150 мкл суспензии опсонизированного
личной интенсивности (2.5, 7.0, 44 мкТл), ис-
зимозана с концентрацией 5 мг/ мл (Zymozan A из
пользуемого в ряде опытов. Размеры экспери-
Saccharomyces carevisiae, Sigma, США). После это-
ментального участка внутри системы экранов
го через 12 ч животных умерщвляли методом цер-
(диаметр участка 20 см, длина - 40 см) позволяли
викальной дислокации, их брюшную полость
поместить одновременно в зону однородного
промывали четырьмя миллилитрами охлажден-
слабого магнитного поля достаточное для опытов
ного раствора Хенкса без кальция. Экссудат соби-
число экспериментальных образцов (не менее
рали пипеткой и центрифугировали в течение
шести). Опыты повторяли не менее трех раз.
5 мин при 600 g. Супернатант декантировали, а
осадок разводили в 4 мл безкальциевого раствора
До начала инкубации к части образцов добав-
Хенкса и оставляли на 1 ч при 4°C. Количество
ляли по отдельности различные химические до-
выделенных клеток подсчитывали в камере Горя-
бавки: ингибитор NADPH-оксидазы хлорид ди-
ева. Жизнеспособность клеток определяли, ис-
фенилйодония (Sigma, США) в различных кон-
пользуя витальный краситель трипановый синий.
центрациях (2.5, 5.0, 10, 20, 50 и 100 мкМ),
Содержание живых клеток при этом составляло
предварительно растворенный в диметилсуль-
не менее 98%. Для опытов образцы получали, раз-
фоксиде (Sigma, США); а также разобщитель
водя суспензию нейтрофилов стандартной сре-
окислительного фосфорилирования 2,4-динит-
дой Хенкса (138 мM NaCl, 6 мM KCl, 1 мМ Mg-
рофенол (Sigma, США) в различных концентра-
SO4, 1 мM Na2HPO4, 5 мM NaHCO3, 5,5 мM глю-
циях (1.0, 4.0, 5.0, 10, 20, 200 мкМ и 2 мМ), также
козы, 1 мM CaCl2, 10 мМ HEPES, pH 7.4; Sigma,
предварительно растворенный в диметилсуль-
США) до концентрации 1 млн кл/мл.
фоксиде. Отдельно проверяли действие самой до-
бавки диметилсульфоксида в конечной концен-
Экспонирование суспензии нейтрофилов в «ну-
левом» и слабом постоянном магнитном поле. Ней-
трации 1 мМ, соответствующей его присутствию
трофилы инкубировали при 37.0 ± 0.2°С в кон-
в пробе с содержанием 10 мкМ дифенилидония
центрации 1 млн/мл по 0.25 мл в круглодонных
или 20 мкМ 2,4-динитрофенола. В ряде опытов
кюветах из полистирола (диаметром 1.2 см и дли-
эти ингибиторы вносили в пробы не до начала
БИОФИЗИКА том 65
№ 4
2020
СНИЖЕНИЕ ПРОДУКЦИИ СУПЕРОКСИДНОГО АНИОН-РАДИКАЛА
737
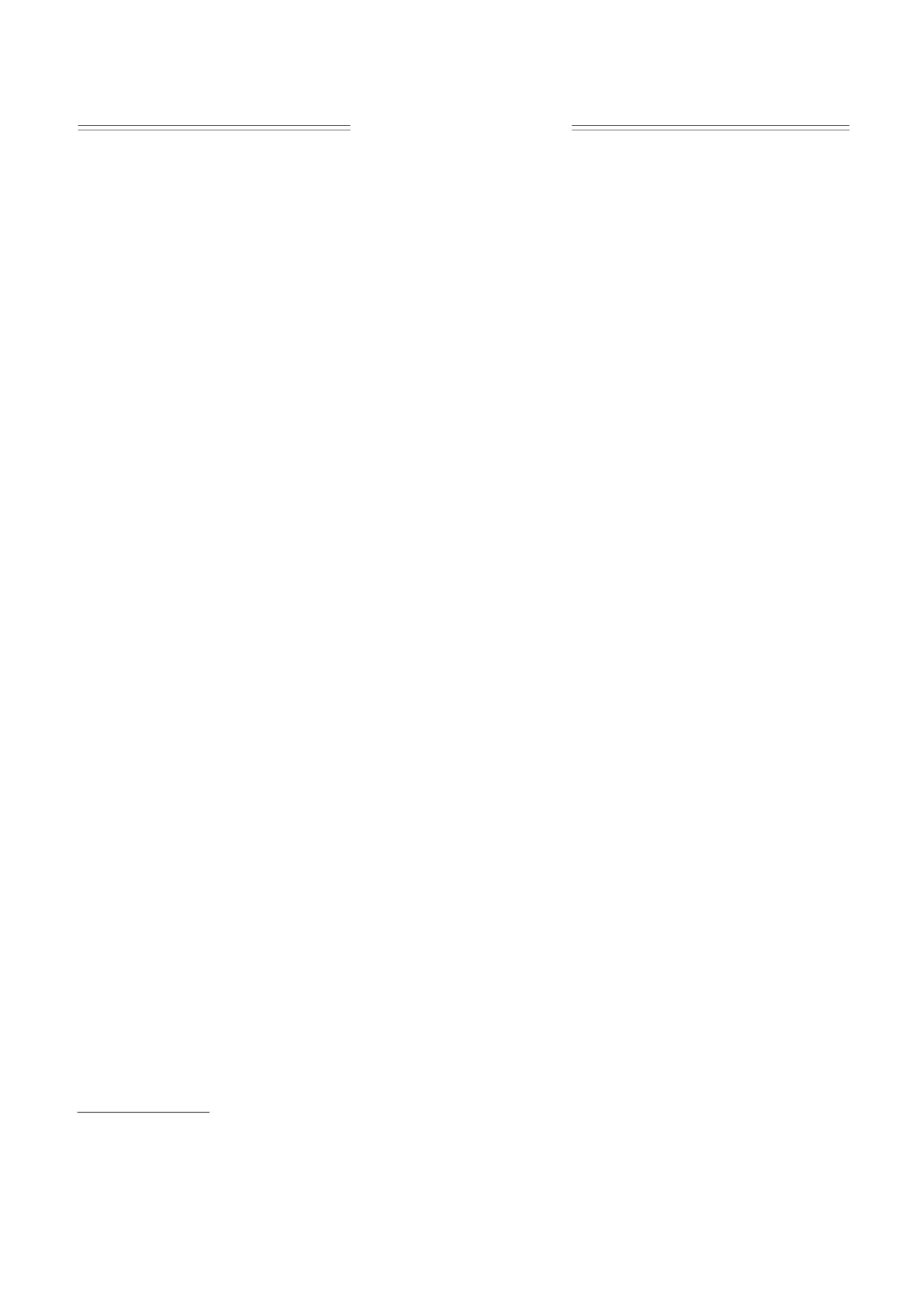
125
конечной концентрации 0.35 мМ. Для измерений
1
использовали хемилюминометр Lum-1200 (ООО
«ДИСофт», Россия). Для анализа данных хеми-
100
2
люминесценции применяли программу Power-
Graph. Часть результатов представлена в процен-
*
*
тах по отношению к амплитудам хемилюминес-
75
центного ответа в контроле, принятым за 100%.
Результаты измерений были статистически обра-
50
ботаны с применением t-критерия Стьюдента.
25
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Предварительная инкубация суспензии ней-
0
трофилов в «нулевом» магнитном поле приводит
ГипоМП
2.5
7.0
44.0
к существенному снижению интенсивности лю-
Магнитное поле, мкТл
цигенин-зависимой хемилюминесценции (при-
близительно на 30%) (рис. 1 и 2). При увеличении
Рис. 1. Влияние постоянного МП на интенсивность
постоянного поля до 2.5 мкТл этот эффект не
люцигенин-зависимой хемилюминесценции суспен-
проявляется, при 7 мкТл снова возникает и исче-
зии нейтрофилов. По оси абсцисс - величина посто-
зает при 44 мкТл (значение соответствует величи-
янного МП в мкТл, по оси ординат - максимальная
не постоянного МП в контроле) (рис. 1). Такой
интенсивность хемилюминесценции в процентах по
отношению к контролю (средние значения и стан-
мультипиковый (полиэкстримальный) характер
дартные отклонения, n = 8). Гипомагнитное поле
зависимости ответа на слабое постоянное МП от-
(ГипоМП) соответствует постоянному МП не более
мечался нами и ранее в опытах на нейтрофилах
0.02 мкТл; 1 - контроль, 2 - опыт. Звездочкой отме-
при регистрации продукции АФК методом флуо-
чены достоверные отличия от контроля (P < 0.05).
ресценции [7], а также на других биологических
объектах [18, 19].
инкубации, а сразу после нее, но до введения лю-
Добавка в среду для инкубации дифенилйодо-
цигенина и регистрации хемилюминесценции.
ния приводит к снижению интенсивности хеми-
люминесценции, как в опытных, так и в кон-
Регистрация хемилюминесценции. После инку-
трольных образцах (рис. 2 и 3). Эффект действия
бации суспензии нейтрофилов измеряли интен-
дифенилйодония приблизительно линейно зави-
сивность хемилюминесценции образцов в кон-
сит от его дозы (растет с увеличением концентра-
трольных и опытных случаях после добавки в них
ции) как в контрольных, так и в опытных случаях
раствора люцигенина (Enzo Life Sciences, США) в
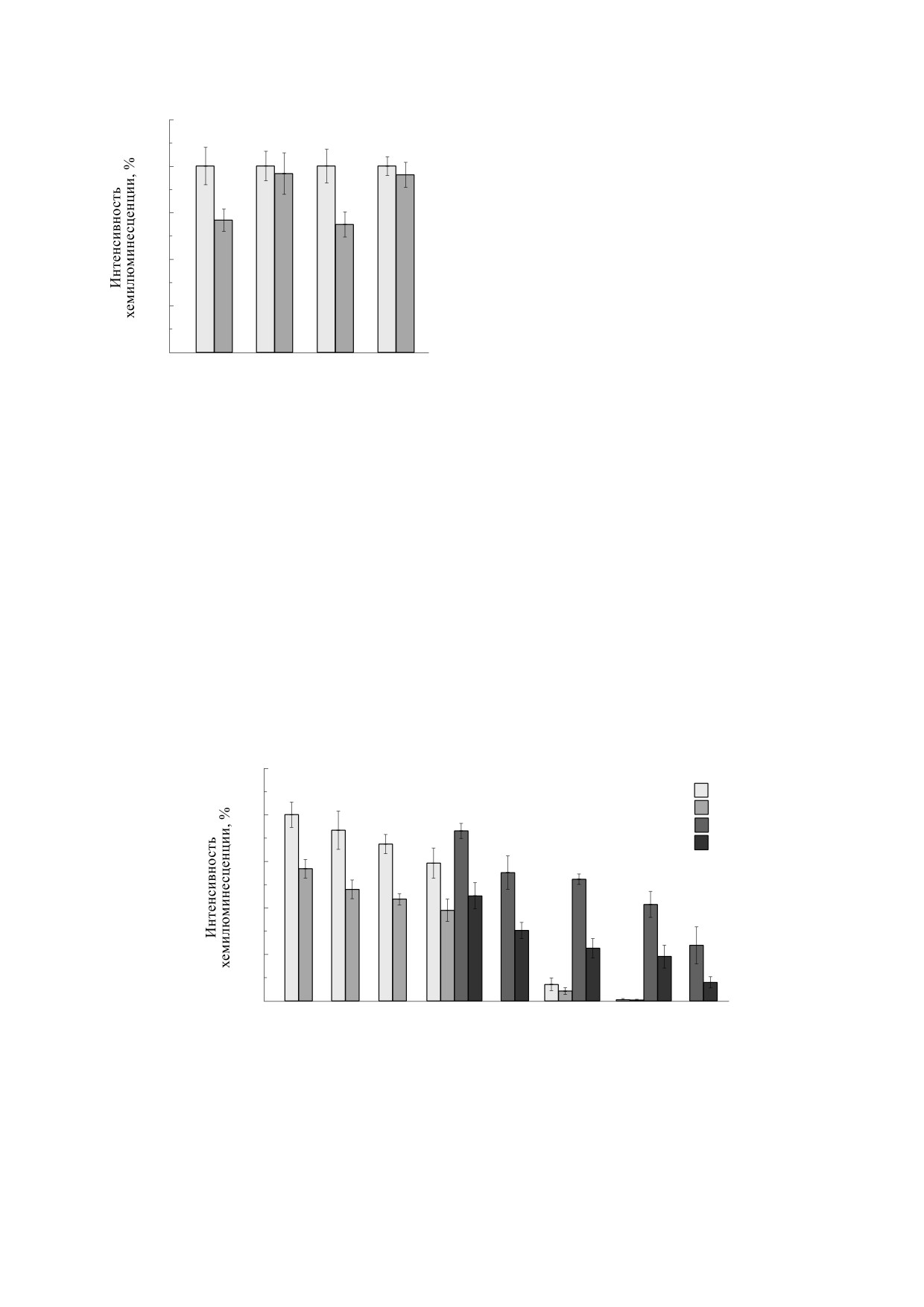
(рис. 2). При этом различия между группами, обу-
125
1
2
100
3
4
*
75
*
*
*
*
50
*
*
*
25
*
*
0
0.0
2.5
5.0
10.0
20.0
50.0
100.0
1000.0
Концентрация дифенилйодония, мкМ
Рис. 2. Влияние дифенилйодония на интенсивность люцигенин-зависимой хемилюминесценции суспензии нейтро-
филов после действия «нулевого» МП. По оси абсцисс - концентрация дифенилйодония в мкМ, по оси ординат -
максимальная интенсивность хемилюминесценции в процентах по отношению к контролю (средние значения и стан-
дартные отклонения, n = 6). 1 - Контроль, добавка дифенилйодония перед инкубацией; 2 - опыт, добавка дифенилй-
одония перед инкубацией; 3 - контроль, добавка дифенилйодония после инкубацией; 4 - опыт, добавка дифенилйо-
дония после инкубацией. Звездочкой отмечены достоверные отличия от контроля (P < 0.05).
БИОФИЗИКА том 65
№ 4
2020
738
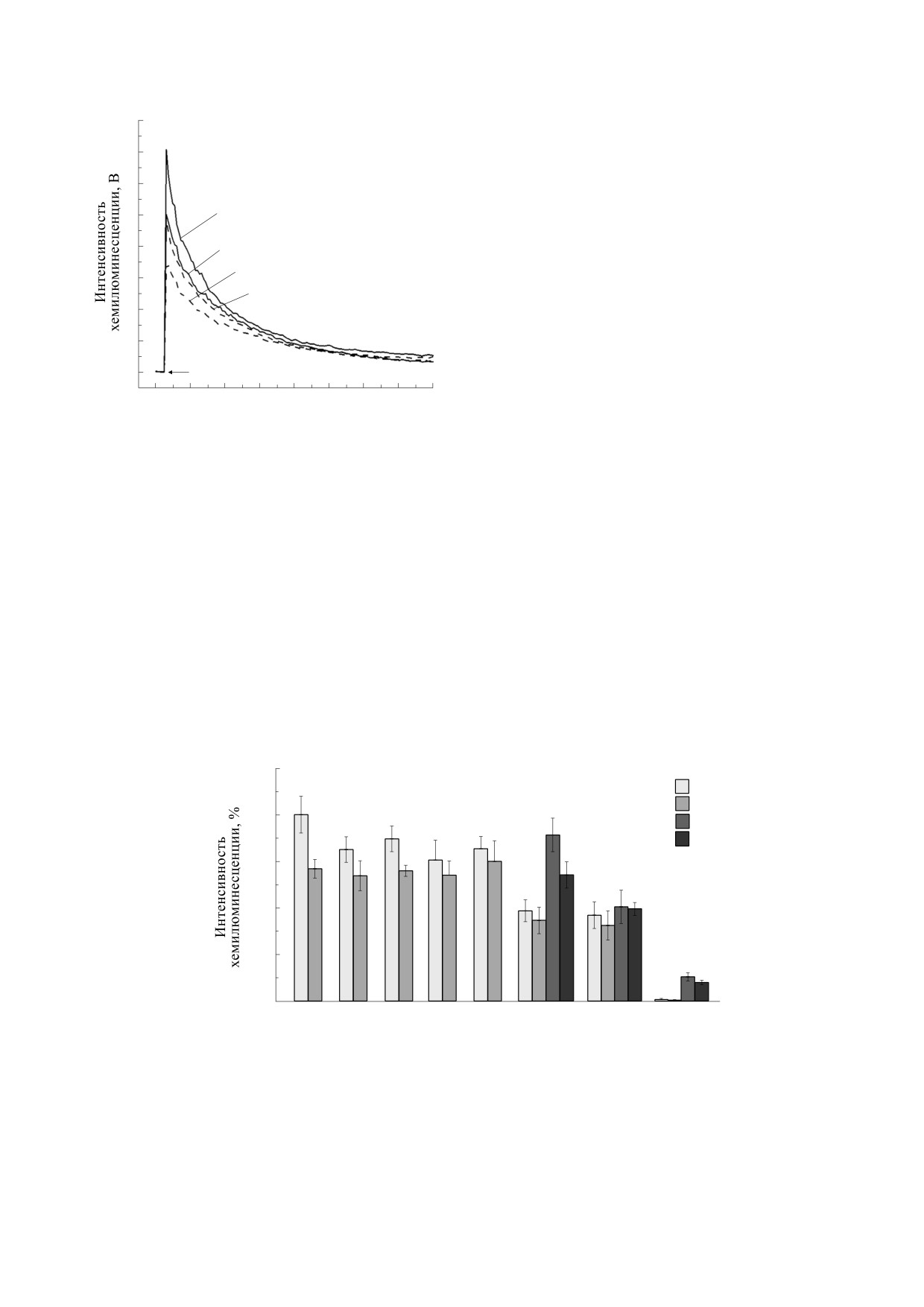
НОВИКОВ и др.
применяемого в качестве растворителя при при-
8
готовлении растворов дифенилйодония, позво-
7
ляет связать обнаруженные эффекты с действием
именно этого ингибитора.
6
При добавке дифенилйодония минуя стадию
5
1
инкубации, непосредственно перед измерением
хемилюминесценции, характер его влияния на
4
3
контрольные и опытные образцы сохраняется, но
4
степень выраженности действия в зависимости от
3
дозы снижается (рис. 2).
2
2
Качественно иной результат получен нами в
опытах с разобщителем окисления и фосфорили-
1
рования - 2,4-динитрофенолом. Так, добавка
этого ингибитора, начиная с концентрации
0
Люцигенин
5 мкМ и далее, вплоть до 200 мкМ, практически
0
100
200
300
400
500
600
700
800
полностью нивелировала различия между кон-
Время, с
трольными и опытными образцами (рис. 4 и 5).
При этом интенсивность люцигенин-зависимой
хемилюминесценции суспензии нейтрофилов в
Рис. 3. Кинетика хемилюминесцентного ответа сус-
пензии нейтрофилов на люцигенин после действия
контроле снижалась пропорционально концен-
«нулевого» МП в отсутствие, а также в присутствии
трации 2,4-динитрофенола. На основании этих
дифенилйодония: 1 - контроль; 2 - опыт; 3 - кон-
данных можно сделать вывод о том, что динитро-
троль, предварительная добавка 10 мкМ дифенилйо-
фенол в определенных концентрациях способен
дония; 4 - опыт, предварительная добавка 10 мкМ
полностью отменить эффект действия «нулевого»
дифенилйодония.
МП. По-видимому, наиболее вероятной причи-
ной этого эффекта динитрофенола может являть-
словленные действием «нулевого» поля, проявля-
ся некоторая «идентичность» механизма его дей-
ствия с эффектом «нулевого» поля. Действитель-
ются как на меньших концентрациях дифенилйо-
но, в этом случае, конкурируя за субстраты,
дония (2.5, 5.0, 10 мкМ), так и на больших (50 и
химический агент мог бы подавить эффект физи-
100 мкМ), приблизительно в одинаковой степе-
ческого фактора. Альтернативной гипотезой для
ни. Отсутствие значительного действия диметил-
объяснения этого действия динитрофенола явля-
сульфоксида (различия между пробами с его до-
ется предположение о том, что для реализации
бавкой в концентрации 1 мМ и соответствующи-
эффекта «нулевого» магнитного поля необходи-
ми контрольными образцами не превышают 5%),
мо сопряжение окисления и фосфорилирования
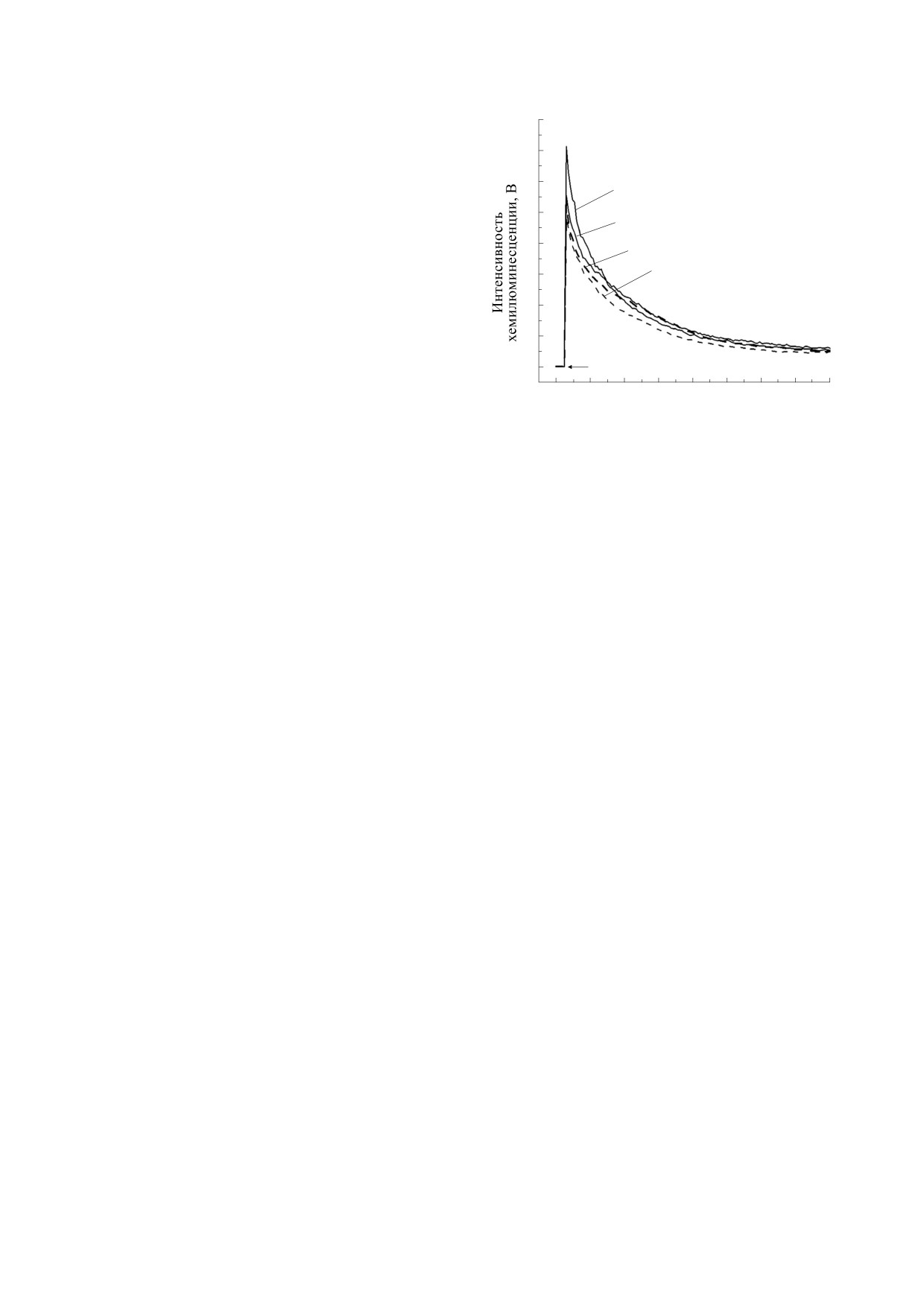
125
1
2
100
3
4
*
*
*
*
75
50
25
0
0
1
4
5
10
20
200
2000
Концентрация дифенилйодония, мкМ
Рис. 4. Влияние динитрофенола на интенсивность люцигенин-зависимой хемилюминесценции суспензии нейтро-
филов после действия «нулевого» МП. По оси абсцисс - концентрация динитрофенола в мкМ; по оси ординат - мак-
симальная интенсивность хемилюминесценции в процентах по отношению к контролю (средние значения и стан-
дартные отклонения, n = 6). 1 - Контроль, добавка динитрофенола перед инкубацией; 2 - опыт, добавка динитрофе-
нола перед инкубацией; 3 - контроль, добавка динитрофенола после инкубацией; 4 - опыт, добавка динитрофенола
после инкубацией. Звездочкой отмечены достоверные отличия от контроля (P < 0.05).
БИОФИЗИКА том 65
№ 4
2020
СНИЖЕНИЕ ПРОДУКЦИИ СУПЕРОКСИДНОГО АНИОН-РАДИКАЛА
739
в митохондриях нейтрофилов, т. е. необходим
8
определенный уровень продукции АТФ. Однако
опыты с добавкой динитрофенола не вначале, а
7
после инкубации в «нулевом» поле, показавшие,
6
что и в этом случае результат его действия также
1
проявляется и качественно не меняется (рис. 4),
5
3
скорее свидетельствуют в пользу первого предпо-
ложения.
4
2
Известно, что механизм действия динитрофе-
4
3
нола, который является хорошо охарактеризо-
ванным разобщителем митохондриального дыха-
2
ния, связан с его способностью рассеивать про-
тонный градиент, возникающий благодаря
1
транспорту электронов [15, 16]. Рассеивание это-
го протонного градиента на внутренней митохон-
0
Люцигенин
дриальной мембране позволяет дыханию продол-
0
100
200
300
400
500
600
700 800
жаться, но при этом прекращается синтез АТФ,
Время, с
который обычно черпает энергию в этом протон-
ном градиенте. Это разобщение нарушает мем-
бранный потенциал внутренней митохондриаль-
Рис. 5. Кинетика хемилюминесцентного ответа сус-
пензии нейтрофилов на люцигенин после действия
ной мембраны [15].
«нулевого» МП в присутствии динитрофенола: 1 -
Ранее было принято считать, что зрелые ней-
контроль; 2 - опыт; 3 - контроль, предварительная
добавка 10 мкМ динитрофенола; 4 - опыт, предвари-
трофилы имеют мало функциональных митохон-
тельная добавка 10 мкМ динитрофенола.
дрий, если таковые вообще имеются [20]. Это
предположение было основано на том факте, что
электронная микроскопия в фиксированных
ром инициировании респираторного взрыва или
клетках обычно не может идентифицировать ин-
фагоцитоза, но интенсивность этих процессов
тактные митохондрии, а те, которые видны, явля-
снижается у нейтрофилов, предварительно обра-
ются небольшими, с плохо выраженными
ботанных ингибиторами митохондрий [25]. Все
кристами и внутренней митохондриальной мем-
эти данные, наряду с полученными нами экспе-
браной [20]. Кроме того, установлено, что ней-
риментальными результатами, указывают на воз-
трофилы для производства энергии используют
можность исследования митохондрий нейтрофи-
главным образом гликолиз [21], а интенсивность
лов в качестве потенциальных мишеней действия
митохондриального дыхания очень низкая. Этот
«нулевого» поля.
O2-независимый механизм производства энергии
В нейтрофилах имеется несколько основных
полезен тем, что позволяет нейтрофилам функ-
систем, в которых свободные радикалы образу-
ционировать в очагах воспаления или в местах
ются в качестве основного или побочного про-
проникновения инфекции, где парциальное дав-
дукта. Прежде всего это NADPH-оксидазы, мем-
ление O2 может быть очень низким [22]. При фа-
бранные ферменты, продуцирующие суперок-
гоцитозе нейтрофилы используют большие коли-
сидный анион-радикал (САР) по реакции
чества молекулярного O2 не для митохондриаль-
одноэлектронного восстановления [26]. Кроме
ного дыхания, а скорее для генерации
того, важной системой продукции САР могут яв-
супероксидного аниона и других АФК посред-
ляться митохондрии. Известно, что на их внут-
ством дыхательного взрыва, катализируемого
ренней мембране утечка САР происходит в один-
NADPH-оксидазой [23]. Из этих морфологиче-
надцати местах, главным образом, в комплексах
ских и биохимических особенностей как бы сле-
I, II, III, причем САР продуцируется как в мат-
довало, что нейтрофилы не имеют функциональ-
рикс, так и в межмембранное пространство [27].
но активных митохондрий и не нуждаются в них.
Люцигенин считается селективным зондом на
Однако в настоящее время появляются доказа-
САР [11], поэтому его активно используют для
тельства того, что функциональные митохондрии
изучения продукции АФК как NADPH-оксида-
могут играть важную роль в контроле апоптоза
зой, так и митохондриями [12]. Характер ингиби-
нейтрофилов [24]. Было показано, с использова-
рующего эффекта дифенилйодония (неспеци-
нием флуоресцентных индикаторов митохондри-
фический ингибитор NADPH-оксидазы), обна-
альной функции в живых клетках, что нейтрофи-
руженный нами в настоящей работе на
лы обладают развитой митохондриальной сетью
нейтрофилах, подвергшихся действию «нулево-
[25]. Мембранный потенциал этих митохондрий
го» поля, делает сомнительным предположение о
может быть нарушен химическими разобщителя-
том, что NADPH-оксидаза является основным
ми транспорта электронов. Было показано, что
источником САР, реагирующим на действие ги-
митохондрии нейтрофилов не участвуют в быст-
помагнитных условий.
БИОФИЗИКА том 65
№ 4
2020
740
НОВИКОВ и др.
Напротив, опыты с динитрофенолом, разоб-
8. J. P. Crow, Nitric Oxide: Biology and Chemistry 1 (2),
щителем окислительного фосфорилирования,
145 (1997).
показавшие практически полную отмену эффек-
9. S. L. Hempel, G. R. Buettner, Y. Q. O’Malley, et al.,
та действия «нулевого» магнитного поля в его
Free Radic. Biol. Med. 27 (1-2), 146 (1999).
присутствии, делают обоснованным предположе-
10. 10. G. Bartosz, Clin. Chim. Acta 368, 53 (2006).
ние о том, что именно митохондрии, как проду-
11. T. B. Aasen, B. Bolann, J. Glette, et al., Scand. J. Clin.
центы САР, являются основной мишенью дей-
Lab. Invest. 47, 673 (1987).
ствия этого физического фактора. Разумеется, эта
12. А. А. Джатдоева, Е. В. Проскурнина, А. М. Нес-
гипотеза требует дальнейшего изучения.
терова и др., Биол. мембраны 34 (6), 116 (2017).
13. A. R. Cross and O. T. Jones, Biochem. J. 237, 111
(1986).
КОНФЛИКТ ИНТЕРЕСОВ
14. Y. Li and M. A. Trush, Biochim. Biophys. Acta 253,
Авторы заявляют об отсутствии конфликта
295 (1998).
интересов.
15. S. Matsuyama, J. L. Lopis, Q. L. Deveraux, et al., Nat.
Cell. Biol. 2, 318 (2000).
16. M. M. El-Guindy, A. C. Neder, and C. B. Gomes, Cell
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Mol Biol. 1981, 27(5):399-402.
Все применимые международные, националь-
17. В. В. Новиков, Е. В. Яблокова и Е. Е. Фесенко,
ные и институциональные принципы ухода и ис-
Биофизика 65 (1), 97 (2020).
пользования животных при выполнении работы
18. В. В. Новиков, И. М. Шейман и Е. Е. Фесенко,
были соблюдены.
Биофизика 52 (5), 912 (2007).
19. V. V. Novikov, I. M. Sheiman, and E. E. Fesenko, Bio-
electromagnetics 29, 387 (2008).
СПИСОК ЛИТЕРАТУРЫ
20. S. W. Edwards, Biochemistry and Physiology of the Neu-
1. H. Zhang, Z. Zhang, W. Mo, et al., Prot. Cell 8 (7), 527
trophil (Cambridge University Press, N.-Y., 1994).
(2017).
21. M. L. Karnovsky, Semin. Hematol. 5, 156 (1968).
2. C. F. Martino and P. R. Castello, PLoS One 6 (8),
22. S. W. Edwards, M. B. Hallett, and A. K. Campbell,
e22753 (2011).
Biochem. J. 217, 851 (1984).
3. P. Politanski, E. Rajkowska, M. Brodecki, et al., Bio-
electromagnetics 34, 333 (2013).
23. A. W. Segal and A. Abo, Trends Biochem. Sci. 18, 43
(1993).
4. V. N. Binhi and F. S. Prato, PLoS One 12 (6), e0179340
(2017).
24. J. G. Pryde, A. Walker, A. G. Rossi, et al., J. Biol.
Chem. 275, 33574 (2000).
5. В. В. Новиков, Е. В. Яблокова и Е. Е. Фесенко,
Биофизика 63 (3), 484 (2018).
25. G. Fossati, D. A. Moulding, D. G. Spiller, et al., J. Im-
munol. 170, 1964 (2003).
6. В. В. Новиков, Е. В. Яблокова, Э. Р. Валеева и
Е. Е. Фесенко, Биофизика 64 (4), 720 (2019).
26. A. Panday, M. K. Sahoo, D. Osorio, and S. Batra, Cell
7. В. В. Новиков, Е. В. Яблокова, И.А. Шаев и
Mol. Immunol., 12, 5 (2015).
Е. Е. Фесенко, Биофизика 65 (3), 524 (2020).
27. V. Kozjak-Pavlovic, Cell Tissue Res. 367 (1), 83 (2017).
Attenuation in Superoxide Anion Radical Production in Neutrophils
after Exposure to Near Null Magnetic Field
V.V. Novikov, E.V. Yablokova, I.A. Shaev, and E.E. Fesenko
Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
Preincubation of neutrophil suspension when exposed to near null magnetic field created by a system of mag-
netic shields (the residual static magnetic field not greater than 20 nT) is associated with a significant decrease
in the intensity of lucigenin-dependent chemiluminescence of neutrophils. Addition of the NADPH-oxidase
inhibitor diphenyliodonium to the incubation medium caused attenuation in the chemiluminescence activity
both in the exposed and control samples (geomagnetic field). Differences induced by near null magnetic field
were observed almost to the same extent between exposed and control samples at both lower (2.5, 5, 10 μM),
and higher (50, 100 μM) concentrations of diphenyliodonium. In contrast, the presence of 2,4-dinitrophe-
nol, the uncoupler of oxidative phosphorylation in mitochondria, at concentrations of 5 μM up to 200 μM
virtually completely blunted differences which were observed between exposed and control samples at lower
concentrations of this inhibitor or in the absence of it.
Keywords: neutrophils, near null magnetic field, superoxide anion radical, chemiluminescence, lucigenin,
NADPH-oxidase, mitochondria
БИОФИЗИКА том 65
№ 4
2020