БИОФИЗИКА, 2020, том 65, № 4, с. 818-823
ДИСКУССИИ
УДК 577.3
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА С ТИОЛСОДЕРЖАЩИМИ
ЛИГАНДАМИ МОГУТ КАК ДОНОРЫ КАТИОНОВ НИТРОЗОНИЯ
ПОДАВЛЯТЬ ВИРУСНЫЕ ИНФЕКЦИИ (ГИПОТЕЗА)
© 2020 г. А.Ф. Ванин
Федеральный исследовательский центр химической физики им. Н.Н. Семёнова РАН, 119334, Москва, ул. Косыгина, 4
Институт регенеративной медицины Первого Московского государственного медицинского университета
имени И.М. Сеченова МЗ РФ, 119991, Москва, ул. Трубецкая, 8/2
Поступила в редакцию 06.04.2020 г.
После доработки 08.05.2020 г.
Принята к публикации 12.05.2020 г.
Аргументируется целесообразность проверки возможного противовирусного действия динитро-
зильных комплексов железа с тиолсодержащими лигандами как донорами катионов нитрозония
(NO+). Есть основание надеяться, что ингаляция дыхательных путей и легких человека при
COVID-19 инфекции распыленными растворами динитрозильных комплексов железа с глутати-
оном или N-ацетил-L-цистеином как донорами NO+ может инициировать S-нитрозирование
клеточных протеаз и тем самым подавить вирусную инфекцию.
Ключевые слова: динитрозильные комплексы железа, нитрозоний, S-нитрозирование, вирусные ин-
фекции.
DOI: 10.31857/S0006302920040250
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
ядерной формах (М-ДНКЖ и Б-ДНКЖ соответ-
С ТИОЛСОДЕРЖАЩИМИ ЛИГАНДАМИ:
ственно) и описываемые соответственно форму-
ФИЗИКО-ХИМИЧЕСКИЕ
лами [(RS-)2Fe(NO)2] и [(RS-)2Fe2(NO)4], возни-
И БИОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ
кают в клетках и тканях животных,
В настоящее время установлено, что у всех
продуцирующих NO и полностью имитируют био-
представителей живого мира - животных и чело-
логическую активность этого агента [5-8]. Говоря
века, растений и микроорганизмов - фермента-
о последнем, представляется целесообразным го-
тивным путем непрерывно продуцируется про-
ворить не только о нейтральных молекулах NO, а о
стейшее соединение монооксид азота (или про-
системе их производных, ответственных за реали-
сто оксид азота, NO), функционирующее в живых
зацию разнообразных метаболических и физиоло-
организмах в качестве одного из универсальных
гических процессов, т.е. говорить о биологической
регуляторов разнообразных метаболических и
системе оксида азота. Есть основание предпола-
физиологических процессов [1-3]. Кроме того,
как правило, при повышенных концентрациях
гать, что М- и Б-ДНКЖ с тиолсодержащими ли-
(до 100 микромолей/кг веса животных) оксид азо-
гандами выступают в живых организмах в качестве
та выступает в качестве одного из основных эф-
важнейшего компонента этой системы. Это пред-
фекторов системы клеточного иммунитета.
положение основывается на трех выборках экспе-
Есть основание предполагать, что функциони-
риментальных данных, касающихся указанных
рование NO как аутокринного и особенно пара-
комплексов. Первая - многочисленная выборка
кринного эффектора в организме животных и че-
данных, о которой уже сказано выше, свидетель-
ловека обеспечивается его включением в динитро-
ствующая о разнообразном биологическом дей-
зильные комплексы железа (ДНКЖ) с
ствии синтезированных химическим путем (экзо-
тиолсодержащими (RS-) лигандами [4-6]. Эти
генных) М- и Б-ДНКЖ, имитирующем биологи-
комплексы, существующие в моноядерной и би-
ческую активность системы эндогенного NO [5-
8]. Вторая выборка - факты, свидетельствующие о
Сокращения: ДНКЖ - динитрозильные комплексы желе- том, что появляющийся в тканях животных оксид
за, М-ДНКЖ - моноядерные динитрозильные комплексы
азота практически полностью включается в Б-ДН-
железа, Б-ДНКЖ - биядерные динитрозильные комплек-
сы железа.
КЖ, обеспечивающих его стабилизацию и, оче-
818
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
819
видно, перенос NO к мишеням его биологическо-
динитрозильных ([Fe(NO)2]) групп ДНКЖ их же-
го действия [9, 10]. Третья выборка данных демон-
лезо-мононитрозильные ([Fe(NO)]) фрагменты с
стрирует способность обеих форм ДНКЖ
образованием ЭПР-регистрируемых мононитро-
инициировать превращение включающихся в эти
зильных комплексов железа с производными ди-
комплексы нейтральных молекул NO в катионы
тиокарбамата [9, 10].
нитрозония (NO+) [11-13]. В результате динитро-
ДНКЖ с тиолсодержащими лигандами и дру-
зильные комплексы железа с тиолсодержащими
гая форма стабилизация NO в живых организмах
лигандами, как доноры этих катионов, способны
- S-нитрозотиолы (общая формула - RS-NO) -
вызывать S-нитрозирование высоко- и низкомо-
взаимосвязаны, т.е. взаимоопределяют существо-
лекулярных тиолсодержащих соединений, т.е.
вание друг друга. Проявляется это в том, что как
имитировать одно из важнейших проявлений био-
ДНКЖ могут возникать из RS-NO, так и послед-
логической активности системы эндогенного
ние могут появляться в живых организмах в ре-
NO - инициирование в живых организмах образо-
зультате высвобождения из динитрозильных ком-
вание S-нитрозотиолов.
плексов катионов нитрозония, взаимодействие
Следует отметить, что в отличие от моноядер-
которых с тиолами приводит к образованию RS-
ной, парамагнитной формы ДНКЖ с тиолсодер-
NO [5, 6].
жащими лигандами, характеризующейся сигна-
В соответствии с развиваемыми нашей груп-
лом электронного парамагнитного резонанса с
пой представлениями о механизмах образования
gср = 2.03 (так называемого сигнала 2.03), Б-
ДНКЖ при участии молекулярного NO или RS-
ДНКЖ с тиолсодержащими лигандами диамаг-
NO, в обоих случаях эти механизмы определяют-
нитны, т.е. ЭПР-неактивны [14]. Тем не менее их
ся реакцией диспропорционирования NO или
наличие в тканях животных можно выявить пу-
RS-NO, т.е. реакцией одноэлектронного взаим-
тем обработки тканей как in vivo, так и in vitro про-
ного окисления-восстановления этих агентов,
изводными дитиокарбамата (диэтилдитиокарба-
реализующейся после связывания NO или RS-
матом или N-метил-D-глюкаминдитиокарбама-
NO с ионами двухвалентного железа (по две мо-
том), способными акцептировать из железо-
лекулы на один ион железа), см. схемы 1 и 2:
-
-
-
-
-
HNO
+1/2 (N O
+
H
O)
2
2
–
-
-
-
-
H+
Схема 1. Предполагаемая схема образования М-ДНКЖ с тиолсодержащими лигандами
в реакции двухвалентного железа, тиолов и газообразного NO [4-6, 15-17].
–
-
–
-
-
+ RS•
-
RS +•SR
-
–
-
–
-
+ RS-
Схема 2. Предполагаемый механизм образования М-ДНКЖ с тиолсодержащими лигандами в реакции Fe2+,
тиолов и RS-NO [15-18].
Приведенные на схемах 1 и 2 механизмы обра-
Что касается биядерной формы ДНКЖ (Б-
зования М-ДНКЖ с тиолсодержащими лиганда-
ДНКЖ) с тиолсодержащими лигандами, показано,
ми подробно рассматриваются в наших предыду-
что она образуется при конденсации двух моноядер-
ных форм этих комплексов [14] вне зависимости от
щих публикациях [15-18]. Здесь же следует отме-
способов синтеза последних при понижении содер-
тить, что в обоих случаях образуются одинаковые
жания в растворе тиолсодержащих лигандов в соот-
по своей электронной и пространственной струк-
ветствии со схемой обратимого взаимопревращения
туре комплексы, характеризующиеся электрон-
М- и Б-ДНКЖ (схема 3) и характеризуется соответ-
ной конфигурацией железа d7 с соответствующей
ственно резонансной структурой, аналогичной
резонансной структурой [(RS-)2Fe+(NO+)2]+.
структуре М-ДНКЖ - [(RS-)2Fe+2(NO+)4]+4:
БИОФИЗИКА том 65
№ 4
2020
820
ВАНИН
- RS-
М-ДНКЖ
Б-ДНКЖ
+ RS-
Схема 3. Обратимое взаимопревращение М- и Б-ДНКЖ с тиолсодержащими лигандами [14].
Исходя из приведенной выше резонансной
компонентами может быть представлено в соот-
структуры М-ДНКЖ, химическое равновесие
ветствии со схемой 4 как
между этими комплексами и составляющими их
–
2+
–
-
[(RS ) Fe+(NO+)
Fe
+ NO + RS + NO++ RS
2
2
RS-NO
Схема 4. Химическое равновесие между М-ДНКЖ с тиолсодержащими лигандами
и составляющими их компонентами [15-18].
Точно такие же компоненты этого набора со-
цибельной NO-синтазы - iNOS или NOS2), ак-
тивных форм кислорода, а также резкое повыше-
ставляющих М-ДНКЖ компонентов - Fe2+, NO,
ние концентрации разнообразных цитокинов
RS-NO и тиолы (RS-) могут высвобождаться из
[22-32]. К настоящему времени установлено, что
этих комплексов в зависимости от механизма их
именно повышение уровня NO подавляет в клет-
распада. Так, при распаде, вызванном удалением
ках хозяина репликацию вирусных РНК и ДНК,
из М-ДНКЖ двухвалентного железа под действи-
приводит к дезактивации важнейших вирусных
ем соответствующих хелаторов железа, в раствор
белков, необходимых для воспроизведения виру-
в свободном состоянии должны, очевидно, пере-
сов, таких как вирусные протеазы, обратные
ходить молекулы NO и катионы нитрозония, гид-
транскриптазы, факторы транскрипции и др.,
ролиз которых предотвращается их включением в
причем эта дезактивация инициируется S-нитро-
RS-NO. Это предположение согласуется с резуль-
зированием в этих белках функционально важ-
татами исследований нашей группы, касающихся
ных тиоловых групп. Аналогичный результат был
взаимодействия ДНКЖ с производными дитио-
получен в опытах с использованием экзогенных
карбамата, перехватывающими на себя из этих
доноров NO - S-нитрозо-N-ацетилпеницилла-
комплексов железо-мононитрозильные фраг-
мина (SNAP), NONO-атов, нитропруссида на-
менты [19]. C другой стороны, при распаде, вы-
трия и даже нитроглицерина.
званном удалением из комплексов молекул NO
Не исключено, что при некоторых вирусных
[20] в результате их включения в более стойкие
инфекциях S-нитрозирование не вирусных бел-
нитрозильные комплексы гемового железа или в
ков, а белков хозяина, например, его протеиназ,
результате связывания молекул NO с анионами
может подавлять начальную стадию инфекции.
супероксида [21], в раствор в свободном состоя-
Последнее может иметь место при вирусных ин-
нии должны, очевидно, переходить ионы Fe2+ и
фекциях, при которых контакт и последующее
катионы нитрозония (точнее, RS-NO).
слияние вирусов и клеток хозяина могут реализо-
ваться при участии соответствующих белков хо-
зяина.
КАКИМ ОБРАЗОМ М- И Б-ДНКЖ С ТИОЛ-
В 2006 г. была опубликована работа [33], в ко-
СОДЕРЖАЩИМИ ЛИГАНДАМИ МОГУТ
торой показано, что М-ДНКЖ с цистеином
ПОДАВЛЯТЬ РЕПЛИКАЦИЮ ВИРУСОВ
сам по себе и в особенности присоединенный
В ТКАНЯХ И КЛЕТКАХ ХОЗЯИНА
к цистеиновому остатку тетрапептида Leu-Ser-
В 80-90-е годы сразу же после установления
Tre-Cis, избирательно связывающегося с проте-
роли NO как одного из основных эффекторов си-
азой 2А Coxsackie-B-вируса, полностью подавля-
стемы клеточного иммунитета началось интен-
ет активность этого фермента. Это ингибирова-
сивное изучение влияния этого агента и его доно-
ние, наблюдавшееся в экспериментах как на изо-
ров на развитие разнообразных инфекционных
лированной протеазе А, так и на включенной в
патологий, в том числе вирусного происхожде-
клеточные культуры, было обусловлено S-нитро-
ния. К настоящему времени опубликованы сотни
зированием одной из тиоловых групп этого фер-
статей и множество обзоров, в которых было по-
мента и было полностью обратимым. При обра-
казано, что для большинства патологий, вызван-
ботке S-нитрозированной протеазы 2А дитиотре-
ных в организме животных и человека вирусной
итолом, перехватывающим на свои тиоловые
инфекцией, характерно резкое повышение в
группы катионы нитрозония, входившие в состав
клетках и тканях хозяина уровня оксида азота (в
белковых S-нитрозотиолов, активность протеазы
основном в результате активации синтеза инду-
А полностью восстанавливалась. Аналогичным
БИОФИЗИКА том 65
№ 4
2020
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
821
образом М-ДНКЖ с цистеином сам по себе ини-
Как уже указывалось в предыдущем разделе,
циировал S-нитрозирование внутриклеточной
S-нитрозирование тиолов, вызванное высвобож-
каспазы 3.
дением из ДНКЖ с тиолсодержащими лигандами
катионов нитрозония, может обеспечиваться рас-
Отмечается, что S-нитрозирование протеазы 2A в
падом этих комплексов либо в результате удале-
тканях миокарда мышей существенно ослабляло
ния железа из этих комплексов под действием со-
вирусную инфекцию [34].
ответствующих хелаторов железа, либо в резуль-
тате связывания с анионом супероксида
Как предполагают авторы работы [33], способ-
половины нитрозильных лигандов, представлен-
ность М-ДНКЖ с цистеином вызывать S-нитрози-
ных в ДНКЖ в форме нейтральных молекул. Та-
рование протеазы 2А была обусловлена существова-
кого рода распад белковых ДНКЖ может проис-
нием обоих нитрозильных лигандов в железо-ди-
ходить естественным путем в клетках, инфициро-
нитрозильных группах этих комплексов в форме
ванных вирусами, без добавления экзогенных
катионов нитрозония, которые и инициировали об-
хелаторов железа или доноров супероксидных ра-
разование S-нитрозотиолов в составе протеазы 2А и
дикалов. Во-первых, в условиях интенсивной ре-
каспазы 3. Такое предположение справедливо лишь
пликации вирусов в клетках хозяина возникает
отчасти. В соответствии с результатами наших ис-
необходимость доставки в эти клетки железа, что
следований ДНКЖ с тиолсодержащими лигандами
может достигаться производством эндогенных
эти комплексы могут выступать не только в качестве
хелаторов железа, способных разрушать белко-
доноров катионов нитрозония, обеспечивающих S-
вые ДНКЖ. Во-вторых, анионы супероксида в
нитрозирование тиолов, но и в качестве доноров
клетках хозяина могут возникать как реакция на
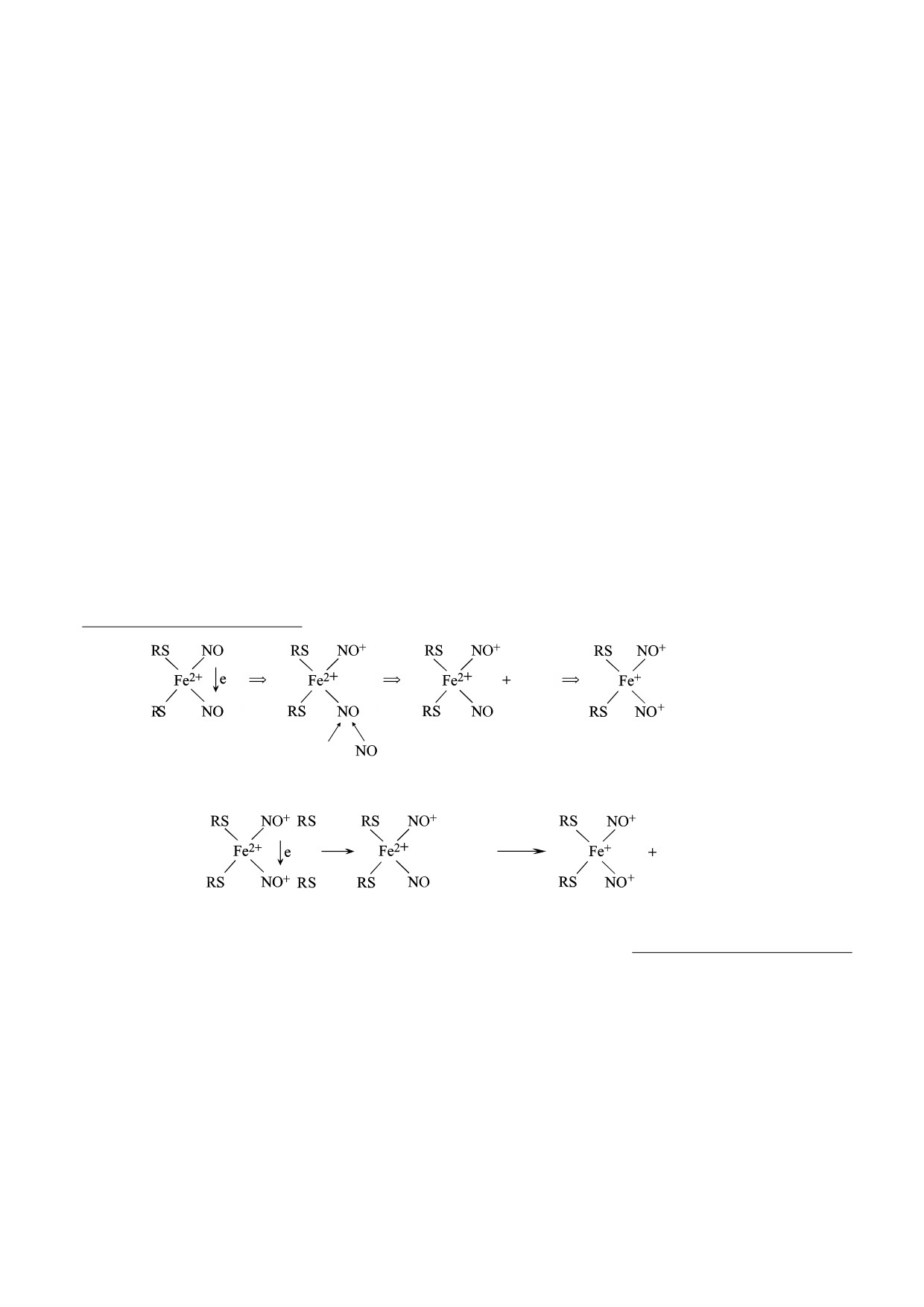
нейтральных молекул NO, причем, как правило, эти
воспалительные процессы, вызванные вирусной
молекулы высвобождаются из ДНКЖ в количестве,
инфекцией. Кроме того, супероксидные радика-
примерно равным количеству высвобождающихся
лы могут возникать в результате окисления кис-
катионов нитрозония [5-8, 15-18]. Этот феномен
лородом ионов двухвалентного железа, высво-
обеспечивается переносом электрона с атома железа
бождающихся из ДНКЖ по механизму положи-
на один из нитрозильных лигандов в резонансной
тельной обратной связи (по
«взрывному»
структуре М-ДНКЖ - [(RS-)2Fe+(NO+)2]+ - и пе-
механизму).
реходом ее в структуру [(RS-)2Fe2+(NO+)(NO)]+.
Есть основание предполагать, что использова-
ние низкомолекулярных ДНКЖ с тиолсодержа-
Каким же образом может осуществляться S-
щими лигандами при лечении коронавирусной
нитрозирование вирусных белков, появляющих-
инфекции может дать наибольший положитель-
ся в клетках хозяина при вирусной инфекции,
ной эффект при ингаляции распыленных (пропу-
при включении в эти клетки низкомолекулярных
щенных через небулайзер) водных растворов
ДНКЖ с тиолсодержащими лигандами, одни из
ДНКЖ. Наибольший эффект, естественно, ожи-
которых - М-ДНКЖ с цистеином - были ис-
дается от такого рода комплексов, наиболее эф-
пользованы авторами работы [33]? Результаты
фективно проникаюших в клетки эпителия тка-
многих исследований поведения низкомолеку-
ней дыхательного пути и легкого. В качестве та-
лярных ДНКЖ с тиолсодержащими лигандами
ких комплексов можно рекомендовать ДНКЖ с
при их введении в белоксодержащие растворы, в
N-ацетил-L-цистеином, сравнительно легко
клеточные культуры или в организм животных
проникающие внутрь клеток [13].
показывают, что в этих системах происходит
В заключение следует отметить, что использо-
быстрый перенос железо-динитрозильных групп
вание газообразного NO, а также агентов, высво-
из этих комплексов на тиоловые группы белков с
бождающих NO - S-нитрозотиолов или NONO-
образованием белковых ДНКЖ. Эти комплексы
атов, - может приводить к образованию в эпите-
могут содержать не только два тиолсодержащих
лиальных клетках и клетках легкого, пораженных
(белковых) лиганда - два цистеиновых остатка, -
корановирусами, образование (в соответствии со
но и включать в себя в качестве тиолсодержащего
схемами 1 и 2 при участии слабосвязанного внут-
лиганда только один из из этих остатков, тогда
риклеточного железа и эндогенных тиолов) сна-
как в качестве второго - азотсодержащего лиган-
чала ДНКЖ с низкомолекулярными тиолсодер-
да - в белковые ДНКЖ могут включаться, напри-
жащими лигандами (в первую очередь, с глутати-
мер, остатки гистидина [35, 36]. Тем не менее и
оном), а затем с белковыми тиолами. После этого
одного остатка цистеина может оказаться доста-
механизм S-нитрозирования вирусных белков
точно для S-нитрозирования этого белка. Каким
может осуществляться по описанному выше ме-
же образом будет осуществляться это превраще-
ханизму.
ние - переход, например, вирусной протеазы -
белка, содержавшего связанный с ним ДНКЖ,
Таким образом ДНКЖ с тиолсодержащими
в белок с S-нитрозированными остатками цисте-
как доноры катионов нитрозония, способных
ина?
инициировать S-нитрозирование вирусных бел-
БИОФИЗИКА том 65
№ 4
2020
822
ВАНИН
ков и белков хозяина, могут подавлять вирусную
7. A. F. Vanin, The Open Conf. Proc. J. 4, 23 (2013).
инфекцию как на ее начальной стадии, так и на
8. A. F. Vanin, Cell Biochem. Biophys. 76, 3 (2018).
стадии внутриклеточной репликации вирусов.
9. А. Ф. Ванин, В. Д. Микоян, Л. Н. Кубрина и др.,
Что касается блокады вирусной инфекции ней-
Биофизика 60, 735 (2015).
тральными молекулами NO, высвобождающими-
10. V. D. Mikoyan, E. N. Burgova, R. R. Borodulin, et al.,
ся из ДНКЖ при действии на них, например, хе-
Nitric Oxide Biol. Chem. 62, 1 (2017).
латоров железа, то в отличие от катионов NO+,
11. A. F. Vanin, Austin J. Analyt. Pharmac. Chem. 5 (4),
слабо влияющих на клетки хозяина [22-32], мо-
1109 (2018).
лекулы NO, превращаясь в реакции с суперокси-
12. A. F. Vanin, Cell Biochem. Biophys. 77, 279 (2019).
дом в весьма токсичный пероксинитрит, могут
оказывать токсическое действие на клетки хозяи-
13. А. Ф. Ванин, Биофизика 65, 421 (2020).
на, причем более эффективно, чем на патогенные
14. A. F. Vanin, A. P. Poltorakov, V. D. Mikoyan, et al., Ni-
вирусы [37-45].
tric Oxide Biol. Chem. 23, 136 (2010).
15. A. F. Vanin, I. V. Malenkova, and V. A. Serezhenkov,
Nitric Oxide Biol. Chem. 1, 191 (1997).
БЛАГОДАРНОСТИ
16. A. F. Vanin, Nitric Oxide Biol. Chem. 21, 1 (2009).
Автор выражает благодарность д-ру С. Яко-
17. A. F. Vanin and D. Sh. Burbaev, Biophys. J. 14, 818
венко за предоставление технической помощи,
(2011).
без которой в условиях карантина по COVID-19
18. A. F. Vanin, A. A. Papina, V. A. Serezhenkov, et al., Ni-
написание этой статьи было бы невозможно.
tric Oxide Biol. Chem. 10, 60 (2004).
19. R. R. Borodulin, L. N. Kubrina, V. D. Mikoyan, et al.,
ФИНАНСИРОВАНИЕ РАБОТЫ
Nitric Oxide Biol. Chem. 29, 4 (2013).
Работа выполнена в рамках Государственного
20. N. A. Sanina, L. A. Syrtsova, N. I. Shkondina, et al.,
Задания Министерства образования и науки для
Nitric Oxide Biol. Chem. 16, 181 (2007).
научных
организаций
(00008202014-0001б
21. K. B. Shumaev, A. A. Gubkin, V. A. Serezhenkov, et al.,
№ АААА-А17-117040610310-б,
0082-2014-0008 и
Nitric Oxide Biol. Chem. 18, 37 (2008).
№ АААА-А17-1170403100008-5), спонсирована
22. J. B. Mannick, K. Asano, and K. Izumi, Cell 79, 1137
Российским академическим проектом «5-100», а
(1994).
также финансирована в рамках гранта Россий-
23. D. G. Karupiah and N. Harris, J. Exp. Med. 181, 2172
ского фонда фундаментальных исследований
(1995).
№ 18-04-00059а.
24. J. MacMicking, A-W. Xie, and C. Nathan, Annu. Rev.
Immunol. 15, 323 (1995).
КОНФЛИКТ ИНТЕРЕСОВ
25. C. S. Reiss and T. Kamatsu, J. Virolog. 72, 4547 (1998).
Автор заявляет об отсутствии конфликта инте-
26. S. P. Sanders, Proc. Soc. Exp. Biol. Med. 220, 123
ресов.
(1999).
27. G. F. Rimmelzwaan, M. M. J. W. Baars, P. deLuster,
et al., J. Virulog. 73, 8880 (1999).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
28. C. Tafalla, A. Figneras, and B. Novos, Veterinar. Im-
Настоящая работа не содержит описания ка-
munol. Immunopathol. 72, 249 (1999).
ких-либо исследований с использованием людей
29. T. Akaike and H. Maeda, Immunol. 101, 300 (2000).
и животных в качестве объектов.
30. M. S. Finkel, Circulation 102, 2162 (2000).
31. E. Keyaerts, L. Vijgen, L. Chen, et al., Int. J. Infect.
СПИСОК ЛИТЕРАТУРЫ
Dis. 8, 223 (2004).
1. L. J. Ignarro, Nitric Oxide: Biology and Pharmacology
32. M. S. Abdul-Cader, A. Amarasingh, M. R. Abdul-Ca-
(Academic Press, San Diego, 2000).
reem, et al., Arch. Virol. 161, 2075 (2016).
2. P. Domingos, A. M. Prado, A.Wong, et al., Mol. Plant
33. C. Badorff, B. Fichtlscherer, A. Muelsch, et al., Nitric
8, 506 (2015).
Oxide Biol. Chem. 6, 305 (2002).
3. A. M. Stem, J. Zhu, Appl. Microbiol. 87, 187 (2014).
34. C. Badorff, B. Fichtlscherer, R. E. Rhoads, et al., Cir-
4. A. F. Vanin, Nitric Oxide Biol. Chem. 54, 15 (2016).
culation 102, 162 (2000).
5. A. F. Vanin, Dinitrosyl Iron Complexes as a “Working
35. A. F. Vanin, V. A. Serezhenkov, V. D. Mikoyan, et al.,
Form”of Nitric Oxide in Living Organisms (Cambridge
Nitric Oxide Biol. Chem. 2, 224 (1998).
Scholars Publishing, Cambridge, UK, 2019).
6. А. Ф. Ванин, Динитрозильные комплексы железа с
36. D. R. Truzzi, S. V. Alves, L. E. S. Netto, and O. Augus-
тиол-содержащими лигандами: физхимия, биология,
to, Antioxidants 9, 276 (2020).
медицина (Институт компьютерных исследований,
37. G. Karupiah, J-H. Chen, S. Mahalingam, et al., J. Exp.
Ижевск, 2015).
Med. 188, 1541 (1999).
БИОФИЗИКА том 65
№ 4
2020
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
823
38. P. Koka, K. He, J.A. Zack, et al., J. Exp. Med. 182, 941
42. C-F. Lin, H-Y. Lei, A-L. Shian, et al., J. Immunol.
(1995).
169, 657 (2002).
39. T. Akaike, Y. Noguchi, S. Ijiri, et al., Proc. Natl. Acad.
43. X. Lim, M. Janas, and S. Dasguptas J. Biol. Chem. 273,
Sci. USA 93, 244 (1996).
39312 (2002).
40. S. Mihm, A. Fayyzi, and G. Ramadori, Hepatology 26,
44. K. Machida, K. T-H. Cheng, V. M-H. Sun, et al., J.
451 (1997).
Virol. 78, 8835 (2004).
41. P. L. Majano, M. J. Borque, and R. Moren-Otero, J.
45. M.-M. Wang, M. Lu, C-L. Zhang, et al., Mol. Med.
Clin. Invest. 101, 1343 (1998).
Rep. 18, 1867 (2018). DOI: 10.3892/mmr.2018.9089
Dinitrosyl Iron Complexes with Thiol-Containing Ligands as Donors of Nitrosonium
Cations Suppress Viral Infections (Hypothesis)
A.F. Vanin
Semenov Federal Research Center of Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
Institute of Regenerative Medicine, Sechenov First Moscow State Medical University of the Ministry of Health of the Russian
Federation, Trubetskaya ul. 8/2, Moscow, 119991 Russia
The importance of exploration of the possible antiviral action of dinitrosyl iron complexes with thiol-contain-
ing ligands as donors of nitrosonium cations (NO+) has been discussed throughout the paper. Evidence sug-
gests that inhalation of nebulized dinitrosyl iron complexes with glutathione or N-acetyl-L-cysteine as NO+
donors in a person infected with a virus such as COVID-19 might initiate S-nitrosation of cellular proteases,
thereby suppressing viral infection.
Keywords: dinitrosyl iron complexes, nitrosonium, S-nitrosation, viral infections
БИОФИЗИКА том 65
№ 4
2020