БИОФИЗИКА, 2020, том 65, № 5, с. 860-864
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ВЛИЯНИЕ ВЯЗКОСТИ СРЕДЫ НА МОЛЕКУЛЯРНУЮ ДИНАМИКУ
ФОРМИРОВАНИЯ ВТОРИЧНОЙ СТРУКТУРЫ ПОЛИПЕПТИДОВ
(AlaGly)25 И (AlaGly)75
© 2020 г. А.А. Эрендженова, Г.А. Армеев, К.В. Шайтан
Московский государственный университет имени М.В. Ломоносова, 119991, Москва, Ленинские горы, 1/12
E-mail: shaytan49@yandex.ru
Поступила в редакцию 20.06.2020 г.
После доработки 20.06.2020 г.
Принята к публикации 29.06.2020 г.
Методами ланжевеновской динамики при различных значениях вязкости виртуальной среды изу-
чен фолдинг модельных полипептидных последовательностей, состоящих из 50 и 150 аминокислот-
ных остатков с чередованием аланина и глицина. Стартовые конформации соответствовали полно-
стью развернутой структуре цепи. Изменение диссипативных свойств среды моделировалось за счет
вариации параметров ланжевеновского термостата. Показано, что имеется достаточно высокая и
пороговая чувствительность результата сворачивания цепи к вязкости среды. Сворачивание рас-
смотренных полипептидных последовательностей при вязкости среды уже порядка вязкости сжи-
женных газов происходит преимущественно в альфа-спиральные конформации. При уменьшении
эффективной вязкости среды ниже критической происходит формирование неупорядоченных
структур. Обращает внимание, что в условиях виртуальной среды энергетические эффекты не явля-
ются однозначным критерием для определения конформации в результате сворачивания полипеп-
тидной цепи. Наблюдаемые эффекты вязкости, приводящие к корреляции конформационных дви-
жений за счет действия диссипативных сил и отбору возможных путей конформационной релакса-
ции цепи, непосредственным образом влияют на результат сворачивания в соответствии с
предсказаниями аналитической теории.
Ключевые слова: молекулярная динамика, полипептиды, фолдинг, вязкость, вторичная структура, по-
верхность потенциальной энергии.
DOI: 10.31857/S0006302920050026
Моделирование конформационной динамики
минимум. Характерное время фолдинга зависит
биополимеров является в настоящее время одним
от строения макромолекулы и условий проведе-
из наиболее часто используемых инструментов
ния эксперимента и может меняться в достаточно
для изучения свойств различных макромолеку-
широком диапазоне от наносекунд до микросе-
лярных объектов. Увеличение вычислительных
кунд и более [4, 5, 7]. В широко известной работе
мощностей и переход к суперкомпьютерным вы-
[1] было обращено внимание на существование
числениям позволил в последние годы суще-
фундаментальной проблемы, известной как «па-
ственно расширить возможности применения
радокс Левинталя». При достаточно большом
молекулярной динамики для проведения числен-
числе звеньев цепи ультрамногомерная поверх-
ных экспериментов с макромолекулярными си-
ность потенциальной энергии макромолекулы
стемами. Одной из актуальных проблем является
имеет очень сложную структуру с экспоненци-
компьютерный фолдинг белковых структур. Про-
ально большим числом локальных минимумов и
блема формирования уникальной простран-
других особенностей рельефа поверхности [8].
ственной структуры белков хорошо известна и
Это делает проблематичным попадание репре-
привлекает внимание уже более полувека [1-6]. С
зентативной точки в глобальный минимум энер-
точки зрения фундаментальной физической тео-
гии за любое разумное время без неких специаль-
рии проблема заключается в нахождении гло-
ных условий, накладываемых на поверхность по-
бального минимума потенциальной (свободной)
тенциальной энергии. Для преодоления этого
энергии макромолекулы и обеспечения попада-
парадокса была выдвинута гипотеза о некотором
ния репрезентативной точки в этот глобальный
специальном устройстве рельефа поверхности
860
ВЛИЯНИЕ ВЯЗКОСТИ СРЕДЫ НА МОЛЕКУЛЯРНУЮ ДИНАМИКУ
861
потенциальной энергии макромолекул (принцип
Шаг интегрирования равен 1 фс, а длины траек-
«минимальной фрустрации энергетической во-
торий - 2 нс. В рассматриваемых условиях такие
ронки»), для которых имеет место фолдинг в уни-
длины траекторий оказались достаточными для
кальные пространственные структуры [2]. Заме-
изучения эффектов вязкости виртуальной среды
тим, что никаких четких физических обоснова-
на фолдинг рассматриваемых полипептидов.
ний для подобного устройства энергетических
Эффективная (виртуальная) вязкость среды
ландшафтов, например, полипептидов в настоя-
(или коэффициент трения) определяется пара-
щее время не существует за исключением пред-
метром ланжевеновского термостата:
ставлений, основанных на топологии конфигура-
2
ционного пространства линейных полимерных
d r
i
dr
i
m
=
-m
ξ
+
F
+
f
,
(1)
i
2
i
i
i
макромолекул [9, 10]. Однако даже наличие опре-
dt
dt
деленных ограничений на строение рельефа мно-
гомерной поверхности потенциальной энергии
где ξ - эффективная вязкость, пс-1; mi - масса
не снимает вопроса о достижении репрезентатив-
i-й частицы, Fi - сумма сил, которая действует на
ной точкой единственного глобального миниму-
i-ю частицу, fi - случайная сила [17].
ма энергии за разумное экспериментальное вре-
Эффективная вязкость среды варьировалась
мя [4-7]. Изучение проблемы релаксационного
от 0.01 до 2. Для численного сравнения этот диа-
спуска репрезентативной точки в энергетической
пазон вязкостей варьировался от значений, кото-
воронке методами многомерной геометрии пока-
рые характерны для плотных газов, до значений,
зывает, что результат сворачивания полимерной
характерных для маловязких жидкостей типа
цепи критически зависит от вязкости и в услови-
сжиженных газов (эти значения примерно на два
ях жидкой среды характеризуется экстремальны-
порядка меньше вязкости воды). Значимые эф-
ми принципами - максимумом скорости умень-
фекты оказываются видны уже при этих вязко-
шения потенциальной энергии при одновремен-
стях.
ном минимуме скорости диссипации энергии
Результат расчета усреднял по выборке из два-
[11]. Последнее приводит к равнораспределению
дцати траекторий, рассчитанных при одинаковых
средних скоростей диссипации энергии по кон-
значениях параметров протокола моделирова-
формационным степеням свободы макромолеку-
ния. Для длинной цепи (AlaGly)75 и больших зна-
лы (в пределе очень большого числа звеньев), что
чениях вязкости (когда процесс сворачивания
демонстрируется как аналитическими [11, 12], так
был более медленным) проводили также допол-
и численными [13] методами. Эти закономерно-
нительные расчеты серий из двадцати траекторий
сти для движения репрезентативной точки на
длиной 4 нс. При относительно большой эффек-
тивной вязкости среды наблюдается фолдинг по-
многомерном энергетическом ландшафте важны
липептидных цепей преимущественно в альфа-
для процесса фолдинга. Силы вязкого трения
спиральную конформацию.
приводят к корреляции конформационных дви-
жений [11-13], что существенно сокращает объем
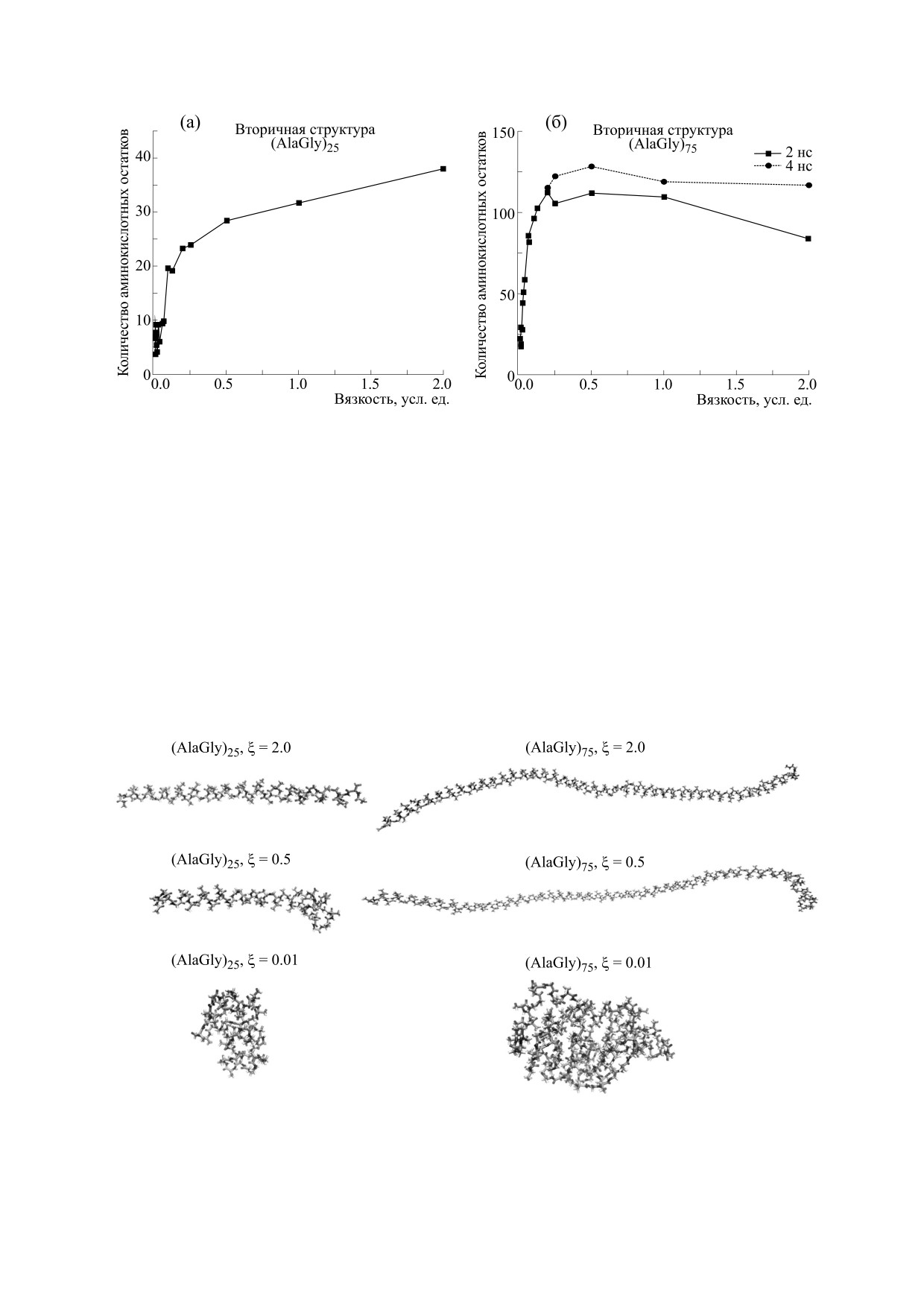
На рис. 1 показана зависимость числа амино-
динамически доступного конфигурационного
кислотных остатков в альфа-спиральной кон-
пространства в процессе фолдинга и определен-
формации при различных значениях параметра
вязкости. Видно, что при увеличении вязкости от
ным образом направляет общий тренд конформа-
очень низких значений до величины порядка 0.2
ционной релаксации в направлении определен-
имеет место резкое увеличение доли участков це-
ных пространственных структур. Было показано,
пи в альфа-спиральной конформации. Для отно-
что уменьшение вязкости среды ниже некоторого
сительно низкомолекулярного пептида эта доля
критического уровня дезорганизует процесс фол-
возрастает при увеличении вязкости. Для более
динга полипептидов [14] и приводит к сворачива-
высокомолекулярного полипептида эта доля вы-
нию в случайные пространственные структуры.
ходит на насыщение уже при значении эффек-
Ниже мы рассматриваем процесс фолдинга поли-
тивной вязкости порядка 0.5 и составляет практи-
пептидной цепи из полностью развернутой кон-
чески те же 75%, что и для более низкомолекуляр-
формации на примере двух полипептидов раз-
ного пептида.
личной длины - (AlaGly)25 и (AlaGly)75 (как и в
На рис. 2 представлены типичные конформа-
работе [14]) - в широком диапазоне вязкости сре-
ции после сворачивания полипептидов (AlaGly)25
ды. Используется тот же протокол ланжевенов-
и (AlaGly)75 при различной вязкости среды. Вид-
ской (стохастической) динамики, программный
но, что при большой вязкости среды сворачива-
пакет GROMACS [15] и полноатомное cиловое
ние рассматриваемых полипептидов происходит
поле AMBER99 [16]. Температура Т = 300 К. Ди-
преимущественно в альфа-спиральные конфор-
электрическая проницаемость среды ε
= 1.
мации.
БИОФИЗИКА том 65
№ 5
2020
862
ЭРЕНДЖЕНОВА и др.
Рис. 1. Зависимость числа аминокислотных остатков в альфа-спиральной конформации при различных значениях
параметра вязкости. Принадлежность аминокислотного остатка к альфа-спирали определялась с использованием
программы DSSP [18]. Некоторое уменьшение доли аминокислотных остатков в альфа-спиральной конформации
для более длинной полипептидной цепи связано с замедлением процесса сворачивания. Увеличение длины траек-
тории до 4 нс нивелирует этот эффект.
На рис. 3 видно, что увеличение вязкости сре-
достаточно вязкой среде и энергетические сооб-
ды делает начальный участок сворачивания более
ражения в условиях рассматриваемой модели
плавным. Обращает на себя внимание тот факт,
виртуальной вязкой среды оказываются далеко
что конечный участок траектории приводит к
не главными. Быстрая компактизация цепи, ко-
близким средним значениям потенциальной
торая происходит при малых вязкостях (это мож-
энергии системы, хотя эти близкие значения по-
но наблюдать на рис. 4 при сравнении изменений
тенциальной энергии соответствуют сильно раз-
радиусов гирации цепи), не ведет к формирова-
ным конформациям. Формирование регулярной
нию регулярной пространственной структуры ти-
альфа-спирали оказывается возможным только в
па альфа-спирали, даже если энергетически эта
Рис. 2. Типичные конформации полипептидов (AlaGly)25 (слева) и (AlaGly)75 (справа) в результате сворачивания
при различной вязкости.
БИОФИЗИКА том 65
№ 5
2020
ВЛИЯНИЕ ВЯЗКОСТИ СРЕДЫ НА МОЛЕКУЛЯРНУЮ ДИНАМИКУ
863
Рис. 3. Зависимость средней потенциальной энергии от времени в процессе сворачивания полипептидов (AlaGly)25 (а) и
(AlaGly)75 (б) при различной вязкости. Усреднение потенциальной энергии проводили по 25 шагам интегрирования.
структура оказывается несколько более выгод-
пептидные цепочки, состоящие из аланина и гли-
ной. Заметим, что из приведенных расчетов нель-
цина в вязкой среде, сворачиваются во вторич-
зя сделать выводы о точном различии в энергии
ную структуру, преимущественно в альфа-спи-
конформаций. Это может являться предметом
ральные конформации. Полипептид, состоящий
отдельных исследований с учетом всех особенно-
из 150 остатков, формирует две альфа-спирали,
стей в энергии взаимодействия атомов полипеп-
соединенные петлей при относительной вязко-
тидов с молекулами реальной среды. Но инте-
сти, равной 2, а при вязкости, равной 0.5, одну бо-
ресно то, что при высокой вязкости репрезента-
лее длинную альфа-спираль. При увеличении
тивную точку затягивает в область, отвечающую
вязкости среды до значений, которые сравнимы с
альфа-спирали, что говорит об определенной ди-
вязкостью жидкостей, доля аминокислотных
намической корреляции между углами основной
остатков в конформации альфа спирали увеличи-
цепи [14] и непротивлении такому сворачиванию
вается и превышает 70%. При низкой вязкости
со стороны топографии энергетической поверх-
результат сворачивания можно рассматривать
ности полипептидов.
как стохастическую глобулу. Скорость сворачи-
вания уменьшается при увеличении вязкости.
В условиях виртуальной вязкой среды потен-
ЗАКЛЮЧЕНИЕ
циальная энергия альфа-спиральных конформа-
Таким образом, вязкость среды имеет важное
ций мало отличается от энергии стохастической
значение для организации процесса фолдинга
глобулы. Однако с увеличением вязкости среды
полипептидных структур. Рассмотренные поли-
происходит увеличение количества аминокис-
Рис. 4. Изменение радиусов гирации полипептидных цепей (AlaGly)25 (а) и (AlaGly)75 (б) при сворачивании при
различной вязкости.
БИОФИЗИКА том 65
№ 5
2020
864
ЭРЕНДЖЕНОВА и др.
лотных остатков, образующих альфа-спирали,
3. E. I. Shakhnovich and A. M. Gutin, Nature (Lond.)
несмотря на то что видимого энергетического вы-
346, 773 (1990).
игрыша при этом не происходит. Это связано с
4. А. В. Финкельштейн, Физика белковых молекул
увеличением корреляции поворотов по торсион-
(М.-Ижевск, 2014).
ных углам полипептидной цепи [14] и, как след-
5. K. A. Dill and J. L. MacCallum, Science 338, 1042
ствие, направлении траекторий сворачивания в
(2012).
сторону спиральных конфигураций.
6. A. Yu. Grosberg and A. R. Khokhlov, Giant Molecules:
Here, There, and Everywhere, 2nd ed. (World Scientific,
Singapore, 2011).
ФИНАНСИРОВАНИЕ РАБОТЫ
7. E. R. Henry, R. B. Best, and W. A. Eaton, Proc. Natl.
Работа выполнена при финансовой поддержке
Acad. Sci. USA 110, 17880 (2013).
Российского фонда фундаментальных исследова-
8. К. В. Шайтан, Биофизика, 63 (4), 629, (2018)
ний (грант № 18-02-40010).
9. К. В. Шайтан, Биофизика 63 (5), 850 (2018).
10. К. В. Шайтан, Биофизика 63 (1), 5 (2018).
11. К. В. Шайтан, Биофизика 62 (1), 5 (2017).
КОНФЛИКТ ИНТЕРЕСОВ
12. К. В. Шайтан, М. А. Ложников и Г. М. Кобельков,
Авторы заявляют об отсутствии конфликта
Биофизика 62, 249 (2017)
интересов.
13. К. В. Шайтан, Ф. Ю. Попеленcкий и Г. А. Аpмеев,
Биофизика 62, 443 (2017)
14. K. V. Shaitan, in Stochastic Dynamics of Reacting Bio-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
molecules, Ed. by W. Ebeling, L. Schimansky-Gefer,
Настоящая работа не содержит описания ка-
and Y. M. Romanovsky (World Scientific, Singapore,
ких-либо исследований с использованием людей
2003), pp. 283-308.
и животных в качестве объектов.
15. S. Pronk, S. Páll, R. Schulz, P. Larsson, et al., Bioin-
formatics 29, 845 (2013).
16. E. J. Sorin and V. S. Pande, Biophys. J. 88, 2472 (2005)
СПИСОК ЛИТЕРАТУРЫ
17. К. Хир, Статистическая механика, кинетическая
1. C. Levinthal, J. Chem. Phys. 65, 44 (1968).
теория и стохастические процессы (М., 1976).
2. J. N. Onuchic and P. G. Wolynes, Curr. Opin. Struct.
18. W. G. Touw, C. Baakman, J. Black, et al., Nucl. Acids
Biol. 14, 70 (2004).
Res. 43, D364 (2015).
Effect of Medium Viscosity on Molecular Dynamics of the Formation of Secondary
Structure of the (AlaGly)25 and (AlaGly)75 Polypeptides
A.A. Erendjenova, G.A. Armeev, and K.V. Shaitan
Lomonosov Moscow State University, Leninskie Gory 1, Moscow, 119991 Russia
Folding of model polypeptide sequences consisting of 50 and 150 amino acid residues with the alanine and
glycine repeat was explored using Langevin dynamics techniques at different values of the viscosity of a virtual
medium. Starting conformations corresponded to a totally extended chain structure. The change in the dis-
sipative properties of the medium was simulated under varying parameters of the Langevin thermostat. It is
shown that there is a sufficiently high and threshold sensitivity of the result of chain folding to the viscosity of
the medium. The folding of the considered polypeptide sequences when the viscosity of the medium is al-
ready on the order of viscosity of liquefied gases occurs mainly in alpha-helical conformations. With a de-
crease in the effective viscosity of the medium below the critical value, disordered structures are formed. It is
noteworthy that in a virtual environment, energy effects are not an unambiguous criterion for determining
conformation as a result of folding of the polypeptide chain. The observed effects of viscosity, leading to the
correlation of conformational motions due to the action of dissipative forces and the selection of possible con-
formational relaxation paths of the chain, directly affect the folding result in accordance with the predictions
of the analytic theory.
Keywords: molecular dynamics, polypeptides, folding, viscosity, secondary structure, potential energy surface
БИОФИЗИКА том 65
№ 5
2020